Method Article
固体および造形癌細胞を標的とするキメラ抗原受容体T細胞のリアルタイム効力アッセイ
要約
液体および固形腫瘍細胞を標的とするキメラ抗原受容体T細胞の効力を評価する定量的なインビトロ細胞質アッセイシステムを説明する。このプロトコルは、他の免疫エフェクター細胞、ならびに組み合わせ治療を評価するために拡張することができる。
要約
癌に対するキメラ抗原受容体(CAR)T細胞療法は、小児急性リンパ球性白血病などの耐性および耐火性肝性悪性腫瘍に対して重要な臨床的利益を達成した。現在、この有望な治療法を他の造形癌に加えて固形腫瘍に拡張する取り組みが進められている。ここでは、固体および液体腫瘍細胞に対するユニークまたは優先的発現を有する抗原を標的とする強力なCAR T細胞の開発と産生について説明する。 これらのCAR T細胞の体外効力は、高感度インピーダンスベースのxCELリジェンスアッセイを用いてリアルタイムで評価される。具体的には、グルココルチコイド誘発腫瘍壊死因子受容体(TNFR)関連タンパク質(GITR)などの異なる共刺激シグナル伝達ドメインの影響が、CAR T細胞のインビトロ効力に対して調べられている。このレポートには、レンチウイルス遺伝子導入を用いた前臨床試験のためのCAR T細胞の生成、CAR T細胞の拡張、CAR発現の検証、xCELLigence効力アッセイの実行と分析などのプロトコルが含まれています。
概要
近年、CAR T細胞療法は、再発および難治性造血性悪性腫瘍に対する癌免疫療法における最も顕著なブレークスルーの一つである。急性リンパ芽球性白血病に対するCD19指示CAR T細胞の最近の米国食品医薬品局(FDA)の承認により、 非ホジキンリンパ腫、およびびまん性大細胞型B細胞リンパ腫、および多発性骨髄腫に対するB細胞成熟抗原(BCMA)指向CAR T細胞の画期的な治療法の指定により、この技術は科学界で大きな興奮を生み出し、世界中の数多くの基礎、応用、臨床研究を促進してきました。 4、5.2019年1月には、700以上の臨床試験が臨床試験データベースに登録されました(clinicaltrials.gov)。これらの試験のうち約450件は、患者を積極的に募集し始めるか、または積極的に募集していた。臨床試験のほとんどは、血行性悪性腫瘍に焦点を当てており、CD19に加えて、CD20、CD22、およびBCMAを標的とするCAR T細胞を利用した臨床試験は、6、7と同様に進行中である。試験のほとんどは自家的なCAR T細胞療法を使用していますが、それらのかなりの数はまた、同種CAR T細胞8、9、10の有用性を探求しています。造形悪性腫瘍の有望な結果にもかかわらず、固形腫瘍を標的とするCAR T細胞の使用は、腫瘍内で排他的に発現される良好な標的の欠如、固形腫瘍および腫瘍「脱出」、およびCAR T細胞が腫瘍微小環境11にアクセスする際に有する困難を含む様々な理由で、クリニックではるかに困難であることが証明された。15.有効性に対するこれらの障壁を克服できる固形腫瘍特異的CAR T細胞の開発と「標的外腫瘍上」毒性の問題に対する重要な必要性がある。CAR T細胞の設計と試験において、多数のインビトロおよびインビボアプローチが保証されているが、堅牢で予測的なインビトロ効力アッセイは16、17が最も重要である。
CAR T細胞の効力を評価するために、様々なインビトロ法が開発されている。一般に、これらの効力アッセイは、標的腫瘍細胞に対するCAR T細胞の細胞溶解活性を直接測定するか、または(ii)標的細胞を殺す際にCAR T細胞によって放出されるサイトカインなどの代理マーカーを測定するかに応じて、2つの大きなカテゴリーに分けることができる。細胞溶解活性を直接測定する技術は、クロム-51放出アッセイ(CRA)18、蛍光プローブ19、20を用いて標的細胞のアポトーシスを測定するイメージングベースのアッセイ、およびアポトーシス標的細胞21を検出するフローサイトメトリーアッセイを含む。これらのアッセイでは、CAR T細胞は通常、放射性または蛍光プローブで事前に標識された標的細胞と共培養され、その後適切な測定が行われる。それは長い間、その感度のためにフィールドの金本位と考えられてきましたが、CRAにはいくつかの欠点があります。まず、エンドポイントアッセイであり、運動情報を提供しません。第二に、標的細胞は、細胞から浸出する傾向があり、バックグラウンドノイズ22を著しく増加させることができるクロム-51で標識する必要がある。最後に、放射性廃棄物の適切な予防措置と処分が必要です。代替アッセイは、効力の指標として標的細胞とのCAR T細胞相互作用の副産物を測定し、フローサイトメトリーベースの方法または酵素結合免疫吸着アッセイのいずれかを用いてCAR T細胞によって放出される種々のサイトカインの定量を含む。ここでも、これらは、所定の時点におけるサイトカインの累積放出を測定するエンドポイントアッセイであり、したがって、CAR T細胞の実際の細胞溶解活性を必ずしも反映していてもよい。
効力アッセイを開発する場合、特にCAR T細胞のような細胞ベースの治療の放出基準を定義するアッセイは、すべての相互作用が考慮する必要があり、アッセイの全体的な堅牢性と一貫性を低下させることができる別の変数であるため、アッセイは最小限の操作と実践的な時間を伴うことが重要です。さらに、CAR T細胞と腫瘍細胞との相互作用は動的プロセスであり、細胞上昇の速度などのこれらの動的相互作用に関する情報を提供することは、効力評価にとって最も重要である。これらの基準を念頭に、xCELLigenceリアルタイム細胞解析(RTCA)プラットフォームを利用したCAR T細胞のラベルフリーキネティック効力アッセイを開発しました。xCELLigenceは、各井戸の底部に埋め込まれた金のバイオセンサーを含む特殊なマイクロチタープレート(Eプレート)を利用しています。特定の抗体を用いてつながれた固形腫瘍細胞、または液体癌細胞のいずれかを用いて、これらのバイオセンサは、標的細胞数、細胞サイズ、細胞基質付着強度、および細胞間相互作用(すなわちバリア機能)17、23、24、25、26、27、28のリアルタイムCART細胞による変化を監視する。ワークフローは単純で、単にターゲットセルをEプレートのウェルにシードし、続いて異なるエフェクタ対ターゲット比でCAR T細胞を追加します(図1)。その後、バイオセンサが標的細胞の生存率を継続的に監視するにつれて、データは自動的にリアルタイムで表示されます。
過去15年間にわたり、xCELLigenceアッセイは、ナチュラルキラー(NK)細胞、T細胞、CAR T細胞、チェックポイント阻害剤、二重特異性抗体、集中性ウイルス、およびいくつかの併用療法17、29、30、31、32、33、34の効力を評価するために検証された。近年、xCELリジェンス効力アッセイを評価し、T細胞受容体(TCR)工学T細胞35を製造した。ここでは、臨床療法において固形腫瘍および液体腫瘍を標的とするように設計されたCAR T細胞の体外効力を評価するためのRTCAシステムを採用することを報告する。
プロトコル
1. CARコードレンチウイルスの生成
注:特定のCAR T細胞プラスミド構造(CD47他)が完了すると、293 FT細胞、レンチウイルス包装ミックス、およびトランスフェクション剤(材料の表を参照)を使用して、標準的な手順によってレンチウイルスCALが生成されます(29記載の材料の表を参照)。続いて、定量的逆転写ポリメラーゼ連鎖反応(RT-PCR)キットとサーマルサイクラー(材料表参照)を使用して、製造業者のプロトコルに従ってレンチウイルスRNA量を測定してウイルス力価を決定します。すべてのレンチウイルス手順は、安全要件に厳密に従って行われることが重要です。
- Dulbeccoの改変イーグル培地(DMEM)の種子15 x 106 HEK293FT細胞を、加湿した5%CO2インキュベーター内の1つの150mm皿で37°Cで一晩インキュベートする。
- トランスフェクションコンプレックスを持つ2本の15mLチューブを用意します。最初のチューブには、レンチウイルスベクタープラスミドDNA(5μg)とレンチウイルス包装ミックス(22.5μg)がトランスフェクション希釈液の2.5mLに含まれています。第2管には、トランスフェクション希釈液の2.5mLに82.5μLのトランスフェクション試薬が含まれています(材料表参照)。
- チューブ1の内容物をチューブ2にピネトし、室温で15分間インキュベートする。
- チューブの内容物をHEK293FT細胞の皿に滴下し、加湿した5%CO2インキュベーターで37°Cで一晩サンプルをインキュベートします。
- 翌日、既存の培地を19mLの新鮮なDMEM培養培地に交換し、加湿した5%CO2インキュベーター内の細胞を37°Cで一晩インキュベートし続ける。
- 皿から50 mL遠心管に媒体を移す。ウイルスを含む媒体を冷蔵庫に入れておいてください。
- 上記の手順を繰り返し、新鮮なDMEMを追加し、1日後に再度収集します。
- メディアの2つのコレクションを1つの遠心管に結合します。チューブを2,000 x gで4°Cで30分間遠心分離します。
- レンチウイルス含有上清の大部分を超透明遠心管に移す。細胞や破片を含む可能性のあるペレットを乱さないように、上清の最小体積約1mLを残します。
- 超遠心分離機は、上記で110,000xgで上清を4°Cで100分間明らかにした。
- 上清を慎重に取り除き、チューブ底部のウイルスペレットにDMEM培地を100μL加えます。チューブを氷の上に15分間放置し、溶液を軽く混ぜ、レンチウイルス溶液をプレチルド滅菌チューブにアリコートします。これらのウイルスストックチューブは-80°Cの冷凍庫に保管してください。
- 定量的RT-PCRキットを使用して、レンチウイルスRNAを抽出して測定するメーカーのプロトコルに従ってレンチウイルスの価タイヤーを決定します。
2. CAR T細胞の生成と拡張
- 以前に凍結したヒトPBMC(約1 x 106~2 x 106細胞)を、同数のCD3/CD28コーティングマイクロビーズを持つCAR T細胞培地の1mLで活性化し(材料表を参照)、加湿した5%CO2インキュベーターで37°Cで細胞を24時間インキュベートします。
- 氷の上にレンチウイルスストックのアリコートを解凍します。
- 1μLの形質転換増強剤を細胞とウェルに加え、混合する。
- 5:1の感染の多重度(MOI)で細胞にレンチウイルスを追加し、穏やかに混合します。翌日、このステップ(第1回導入後24時間)を繰り返します。
- 2~3日ごとにT細胞の増殖を監視します。さらに新鮮な CAR T 細胞培地を追加して、1 x 106 ~ 2 x 106セル/mL の密度でセルを維持します。
- 凍結解を使用して、CAR T セルを標準プロトコルでフリーズします(「材料表」を参照)。
- 標準的な方法を使用してCAR T細胞を解凍し、アッセイに適用する前に、IL-2(300単位/mL)で約〜2〜4時間CAR T細胞培地で事前培養します。
3. フローサイトメトリーによるCAR発現の検出
- 3 x 105 CAR T細胞と非トランスデュースT細胞を2つの別々の1.5 mLマイクロ遠心管に転写します。
- 300 x gでチューブを2分間遠心分離し、1%のヒト血清を含む蛍光活性化細胞選別(FACS)緩衝液の200μLで細胞を再中断する。
- 2つの5 mLポリスチレンFACSチューブにセル溶液の100 μLをパイプし、5分間氷の上にチューブを保ちます。
- ビオチン化ヤギ抗マウスF(ab')2を各細胞タイプの1チューブに1μL加えます。次に、PE標識抗タグ抗体の2μLを各細胞タイプの他のチューブに加える(材料表参照)。よく混ぜ、氷の上で30分間インキュベートします。
- 各チューブに3mLのFACS緩衝液で細胞を洗浄し、300 x gでチューブを5分間遠心分離します。上清と渦を非常に短時間捨てるか、チューブを短時間振って残留液中の細胞を再サスペンドします。
- APCアンチCD3の2°Lと7-AAD抗体溶液の2°L(材料表参照)を各チューブに加えます。抗F(ab')2 Abで染色された細胞のチューブに、PE標識ストレプトアビジンを1μL添加します。短時間混ぜて氷の上のチューブを30分間インキュベートします。
- FACS バッファーを使用して、ステップ 3.5 の説明に従ってセルを再度洗浄し、各チューブにさらに 200 μL の FACS バッファーを追加します。
- フローサイトメトリーを使用して、最初に前方散乱対側散布図のT細胞をゲーティングし、次にCD3対7-AADプロットで生細胞(7-AAD陰性)をゲーティングして細胞を分析します。最後のステップは、アンチタグ、アンチScFvまたは反F(ab')2対CD3を分析することです。
4. リアルタイムサイトリシス効力アッセイ
メモ:製造元の推奨条件に従ってRTCAアッセイを実行します。簡単に言えば、まずEプレートのウェルに標的細胞をプレートし、次の日にCAR T細胞を添加する。標的細胞に対するCAR T細胞の細胞化活性をリアルタイムで監視する。T細胞およびモックトランス誘導T細胞(モックCAR T細胞)は、負のエフェクター細胞制御として使用される。以下のプロトコルは、付着腫瘍細胞株に対するインビトロリアルタイムサイトリシス効力アッセイを記載する。
- xCELLigence Eプレートの各ウェルに100μLの標的細胞培養培地を加え、xCELリジェンス楽器の中にプレートを入れ、バックグラウンド読み取りを行います。次いで、細胞播種用の組織培養フードにEプレートを移す。
- 標準プロトコルを使用して、培養装置から標的癌細胞をトリプシン化します。次いで、細胞を15mL遠心管に移し、15mLまでの新鮮な培養培地を加える。200 x gで 5 分間遠心分離して細胞をペレットします。上清を捨て、5mLの新鮮な培地を加え、血清学的ピペットを使用して細胞ペレットを穏やかに再スペンドします。ヘモサイトメーターと顕微鏡を使用して生細胞の密度をカウントします。
- 細胞密度を適宜調整し、Eプレートの各ウェルに100Lの細胞懸濁液を加えます。標的細胞数は、通常、付着細胞株(BxPC3、Hela-CD19、SKOV3)の場合は約10,000細胞/ウェル、またはラジなどの懸濁細胞については30,000細胞/ウェル(液体癌細胞をテザーするために抗体によるウェルのプレコーティングに関する詳細については、下記参照)。
- 室温でEプレートを30分間平衡化し、細胞が井戸の底に均等に沈降できるようにします(これは重要です。このステップをスキップしないでください)。
- Eプレートを細胞培養インキュベーター内のxCELLigence計器に入れ、セルインデックス対時間として表示されるインピーダンスを15分ごとに自動的に測定します。
- 翌日、エフェクターCAR T細胞を調製する。すべてのセルが同時に準備ができていることを確認するために、適切なコントロール(モックCAR T細胞、非転写制御T細胞、および/または無関係なCAR T細胞)を事前に準備してください。エフェクターセルと対照細胞を適切な密度に調整し、ステップ9でエフェクター細胞懸濁液の100μLが各ウェルに添加されたときに所望のE:T比が達成されるようにシリアル希釈を準備します。
- xCELLigenceデータ取得を一時停止し、インキュベーターから細胞培養フードにEプレートを持って来ます。
- 各ウェルから100μLの培地を取り除く。各ウェルの残留媒体の量は100μLになりました。
- 連続希釈エフェクタCAR T細胞または他の制御セル(モックCAR T細胞)を100μL加えるにして、目的のE:T比を達成します。
- Eプレートを室温で30分間平衡化し、エフェクタセルが沈着できるようにし、EプレートをxCELリジェンス機器に戻します。データ取得を再開します。
- もし望むならば、重要な時点でxCELLigenceデータ取得を一時停止し、直交アッセイによって分析される小さなサンプルを収集するためにプレートを除去することができる(すなわち、ELISAまたはフローサイトメトリーによるサイトカイン産生を測定する)。
- EGFR-GITR-CD3 CAR T細胞実験では、ELISAキットでINFγ収率を測定します(メーカーの指示に従ってください。材料表を参照)。
注意 液体癌の使用に関して:非付着性血腫癌細胞を検査するために、Eプレートのウェルを細胞を添加する前に、まず癌細胞の表面に発現される抗原に特異的な抗体でコーティングされる。ラジB細胞株には、抗CD40に基づくテザリング試薬が用いられる(材料表の液体腫瘍殺傷アッセイキットを参照)。プレートをコーティングする手順は次のとおりです。 - テザリング試薬(抗CD40)をテザリングバッファーで4μg/mLの濃度に希釈します。
- 組織培養フード内で作業し、Eプレートの各ウェルに希釈テザリング試薬の50°Lを追加します。Eプレートは室温または37°Cのインキュベーターに3時間放置します。
- テザリング試薬を取り外し、Eプレートを洗浄バッファーで少なくとも2倍洗浄します。この時点で、EプレートはRaji標的細胞(30,000細胞/ウェル)を播種する準備ができています。
- 手順 4.1 (上記) に進み、残りの手順を実行します。
結果
CARレンチウイルス製剤とCAR T細胞発生および効力評価
CARレンチウイルス製剤の価たうるしは、メーカーのプロトコルに従って定量的RT-PCRキット(材料表参照)を用いて決定した。滴定プロトコルは、まずウイルスRNAを抽出し、次にレンチウイルスRNAコピー数を測定し、感染性ウイルス粒子の量を示した。上記のプロトコルを使用して1つの150ミリメートル皿から生成されるウイルスのタイターは、通常、109-1010ウイルスコピー/mLの間の範囲です。図2Aは、代表的な定量PCR結果からの信号強度とRT-PCRサイクル数を示す。ウイルス品質が満たされると、テキターが1x108 pfu/mLより大きくなったとき、その後のT細胞伝達のために凍結した。CAR T細胞をレンチウイルスで形質転換した後、T細胞をさらに12〜14日間培養し、その密度を1x 106〜2 x 106細胞/mL前後維持した。CAR T細胞を下流の塗布または凍結する前にフローサイトメーターを用いて抗ScFv特異的抗体でチェックした。良好な代表的なバッチ結果を図 2Bに示します。抗ScFv抗体を用いて、CAR T細胞の約50%が陽性に染色され(Q2 50.6%対T細胞1%)、T細胞の約50%におけるCARの発現を示す。続いて、CAR T細胞の各バッチが凍結され、将来の適用の準備が整う前に、細胞分解判定のためにRTCA効力アッセイを行った。CAR T細胞設計、生成、評価手順の1サイクルは約1ヶ月かかりました。
CD22-CAR T細胞によるラジリンパ腫B細胞の死滅
抗CD40液体腫瘍テザリングキット(材料表参照)を4μg/mLの濃度で使用し、37°Cで3時間Eプレートをコーティングした。テザリング緩衝液で井戸を洗浄した後、B細胞リンパ腫細胞を30,000細胞/ウェルの密度でEプレートに添加した。細胞が30分間沈殿することを許可した後、EプレートはxCELLigence器具の内側に戻り、細胞の付着および増殖を捕捉するためにインピーダンスの読み取りがすぐに開始された。翌日、CD22-CAR T細胞、モックCAR T細胞、または非トランスデュースT細胞のいずれかを添加した。図 3では、すべてのセル タイプに対して 10:1 の E:T 比が使用されています。CD22陽性ラジ細胞を、CD22-CAR T細胞で処理し、陰性対照(非転写T細胞およびモックCAR T細胞)と比較して有意な殺傷(緑色の痕跡)を示した。
CD47-CAR T細胞による膵臓癌細胞の効果的な殺傷
CD47は、免疫グロブリンスーパーファミリーの膜貫通表面糖タンパク質である。インテグリン関連タンパク質として、血小癌(白血病、リンパ腫、多発性骨髄腫)および固形癌(卵巣、小細胞肺癌、膵臓、神経膠芽腫など)および他のタイプの癌36、37の両方で高発現している。CD47はまた、マクロファージへの食べない私信号として知られており、一部の癌で潜在的な治療標的となっています。CD47-CAR T細胞を産生し、高レベルのCD4738、39を発現するBxPC3膵臓癌細胞に対して試験した。BxPC3細胞を1日目にEプレートに10,000細胞/ウェルの密度で播種した。リアルタイムモニタリングは、これらの細胞が16時間後に合流性に達したことを示した。この時点で、CAR T細胞をE:T比10:1(図4A)で添加した。非トランスデュースT細胞およびモックCAR T細胞のようなコントロールエフェクター細胞も添加した。結果は、CD47-CAR T細胞が標的BxPC3細胞29を選択的に死滅することを明らかに示している。また、図4Bは、CD47-CAR T細胞が空のウェルに添加された場合のインピーダンス信号が、標的BxPC3細胞によって生成されるインピーダンス信号よりも実質的に低いことを示す。CD47-CAR T細胞のみにあるウェルからのセルインデックス値は、最大0.14に達し、これは培地単独(0.02)からの信号よりもわずかに高いだけです。これは、この異種殺傷アッセイにおいて、インピーダンスシグナルが標的癌細胞からほぼ排他的に誘導されることを示す。
GITRドメインによるCAR T細胞の共刺激
EGFR-GITR-CD3 CARで発現した場合、GITR共刺激ドメインは、EGFR陽性SKOV3癌細胞の殺害を増強することが以前に報告されたが、EGFR陰性MCF-7癌細胞30は報告されなかった。GITRドメインの役割をより明確にするために、全長 GITR ドメインを含むCARコンストラクト、またはドメインのバージョンを削除または再配置し、CAR T細胞を共結合する能力について生成およびテストしました(図5A)。図5B,CのxCELLigenceデータは、GITR共刺激ドメインが、GITRドメインを欠く元のCAR構築物で観察されるものよりも上のEGFR陽性標的細胞のCAR T細胞殺傷を増強することを示している。さらに、GITRドメインから10個のアミノ酸(アミノ酸184-193)を除去し、この刺激活性を廃止した。対照的に、CARコンストラクト内のGITRドメインの相対的な位置を再配置することは、その刺激能力にあまり有害でないことが判明した。終点データを用いて、T細胞活性化のサロゲートとしてのIFNγ産生は、GITRドメインの刺激活性も実証した(図5B)。単なる「スナップショット」である終点データとは対照的に、xCELLigence計測器の連続インピーダンスプロファイルは、異なる治療のキリングキネティクスの微妙な違いを明確に照らします(図5C)。ここで得られた結果は、生体内研究30の結果と一致している。
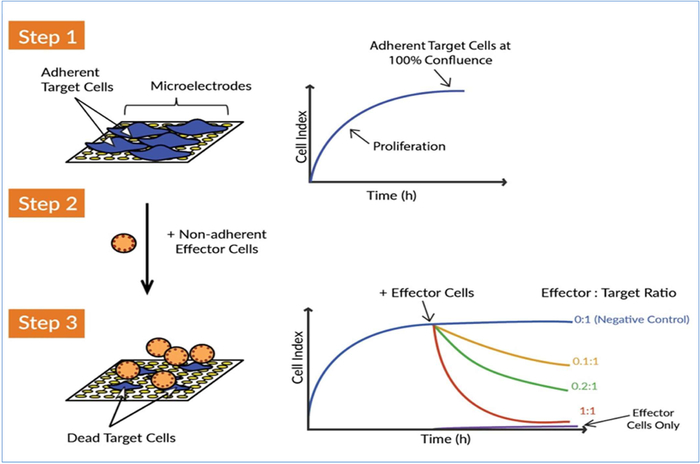
図1:xCELLigenceリアルタイム細胞解析(RTCA)システムは、エフェクター細胞による標的細胞の死滅を検出する。標的癌細胞に対するCAR Tエフェクター細胞の殺傷活性を測定するための3つの主な概念的なステップがあります。ステップ1:標的細胞(すなわち、腫瘍細胞)をEプレートのウェルに播種する。細胞は金バイオセンサマイクロ電極に取り付け、電極間の電流の流れを妨げる。このインピーダンス値は、セルインデックスと呼ばれる単位なしのパラメータとして測定およびプロットされます。セルインデックスの値は、細胞が成長するにつれて増加し、細胞が合流に近づくにつれて高原に達します。ステップ2:エフェクター細胞-非付着免疫細胞-続いて添加される。これらの細胞は金のマイクロ電極に付着しないため、直接インピーダンス変化を引き起こさない。ステップ3:エフェクター細胞が標的癌細胞を攻撃する場合、腫瘍細胞の破壊は、時間の経過とともに細胞指数の減少によって反映される。エフェクター細胞のこの細胞溶解活性、またはエフェクター細胞の効力は、敏感かつ正確に監視することができる。xCELLigenceシステムからのインピーダンスデータの継続的な取得により、複数の条件に対するリアルタイムのキネティック分析が同時に可能になります。この図の大きなバージョンを表示するには、ここをクリックしてください。
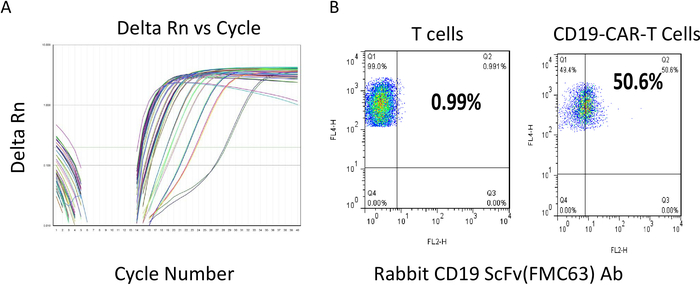
図2:CAR T細胞のレンチウイルスおよびフローサイトメトリー評価のマイター決定。(A)レンチウイルス力測定器決定。異なる色線は、サイクル番号とデルタRnの代表的なサンプルであり、低サイクル数はサンプル中に存在する比較的高い量のウイルスRNAテンプレートを示す。(B)導入後、CAR T細胞を培養し、2x106細胞/mL未満の密度で維持し、次いでフロー分析を行った。y軸はT細胞の染色を反映し、正の値は領域Q1およびQ2に反映されます。どちらのサンプルもT細胞に対して100%陽性です。CAR scFV の式は、scFv 特異的 Ab(x-軸) を使用して決定されます。その結果、T細胞の50%以上がCD22-CAR T細胞においてscFv陽性であることが示された。この図の大きなバージョンを表示するには、ここをクリックしてください。
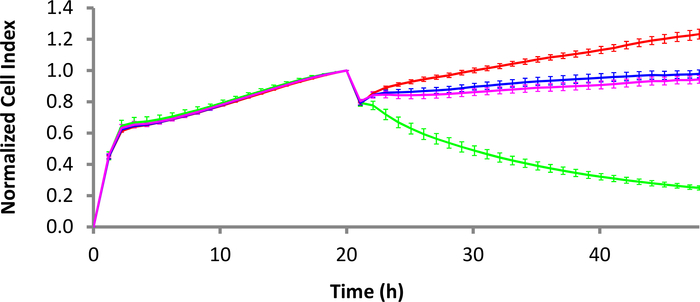
図3:ラジ・バーキットリンパ腫細胞に対するCD22-CAR T細胞の死性動態赤い曲線はラジ細胞単独ですが、緑色の曲線はCD22-CAR T細胞で処理されたラジ細胞です。ピンクとブルーの曲線は、それぞれモックCAR T細胞治療と非トランスデュースT細胞処理です。E:T比は10:1です。誤差範囲は標準偏差です。タイム スケールは 2 時間間隔で設定され、表示しやすいものの、より多くのデータ ポイントを使用できます。この図の大きなバージョンを表示するには、ここをクリックしてください。
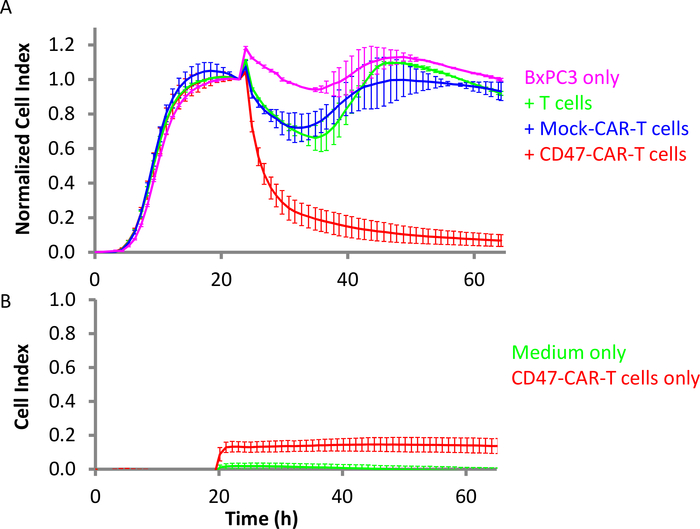
図4:膵固形腫瘍細胞に対するCD47-CAR T細胞の有効性(A) ピンクは標的BxPC3細胞単独で、赤はCD47-CAR T細胞が加えたBxPC3である。緑はBxPC3で、非転写T細胞を添加し、青はモックCAR T細胞を有する。E:T比は10:1です。(B)同じ設定では、赤は空(ターゲットセルが不足)CD47-CAR T細胞のみでウェルをコントロールし、緑色は媒体のみである。誤差範囲は標準偏差です。この図の大きなバージョンを表示するには、ここをクリックしてください。
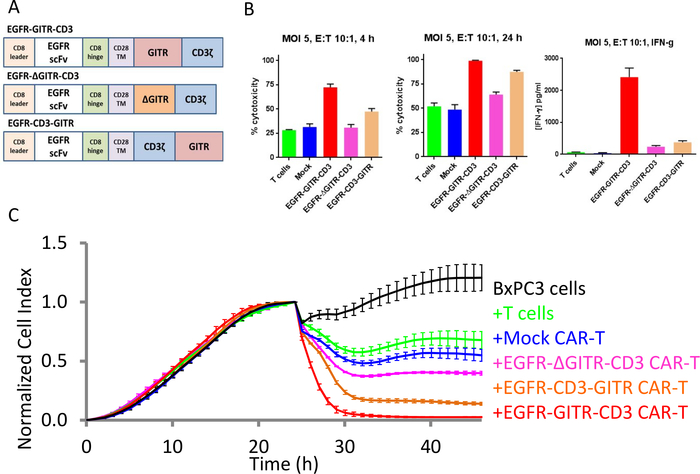
図5:GITRドメインは、EGFR陽性腫瘍細胞株に対するCAR T細胞細胞傷害活性を増加させる。(A) 異なる CAR コンストラクト。(B) 4時間(左)と24時間(中央)の異なるCARコンストラクトに対する細胞溶解率の棒プロット。24時間でのIFNγ産生は右側に示されている。(C) すべてのコンストラクトに対する連続殺傷評価。黒い曲線はBxPC3卵巣癌細胞のみの成長曲線である。緑色の曲線はT細胞のみで処理される標的細胞であり、青色曲線はモックCAR T細胞で処理された標的細胞であり、赤色曲線はEGFR-GITR-CD3-CAR T細胞で処理された標的細胞であり、ピンク曲線はEGFR-ΔGITR-CD3-CAR T細胞で処理された標的細胞であり、褐色曲線はEGFR-CD3-GITR-CAR細胞で処理された標的細胞である。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
キメラ抗原受容体は、細胞外単鎖可変断片(scFv領域)、ヒンジ領域、膜貫通領域、およびCD28およびOX4011、40などの受容体からのTCRシグナル伝達ドメインおよび追加の共刺激ドメインからなる細胞質ドメインから構成される多ドメインタンパク質である。安全で選択的で効果的なCALを設計するには、CAの設計における様々な順列を、インビトロ効力アッセイと、最終的には動物モデルを使用して徹底的にテストすることが不可欠です。本研究では、リアルタイムのインビトロ効力アッセイが有効なCALの設計をどのように知らせるかについて、プロトコルとワークフローを提供した。
任意のタイプの効力アッセイを設計する際には、特に製造目的のために、アッセイが敏感で、堅牢で、一貫しており、可能な限り作用機序に近いことが不可欠である。ここで説明するリアルタイム効力アッセイは、サイトカイン放出などのサロゲートマーカーを使用するのではなく、CAR T細胞の細胞溶解活性を直接測定するように設計されている。重要なことに、アッセイは、アッセイプレート(Eプレート)以外の染料や試薬などの追加成分や、細胞を維持するための推奨媒体を必要としない。さらに、アッセイは絶妙に敏感であり、他のラベルベースのアッセイ42、43、44と比較して非常に再現性の高いデータを提供する。さらに、xCELLigenceアッセイは、特定の細胞化の評価に最適な非常に低いエフェクター対ターゲット比を使用することが可能です。
xCELLigenceシステムの柔軟性と有用性を実証するために、我々は2つの腫瘍タイプ、すなわち造形起源と固形腫瘍の腫瘍に焦点を当てた。CD22指向CAR T細胞の効力を評価するために、ラジ細胞(すなわち、B細胞リンパ腫細胞株)を抗CD40抗体を用いてEプレートにテザリングした。Eプレートの底部にラジ細胞のテザリングは、井戸内のラジ細胞の生存率と数を反映するインピーダンス信号をもたらす。CD22-CAR T細胞の添加後、Raji細胞は時間およびエフェクタ依存的に選択的に死滅し、インピーダンス信号の時間依存的な減少に終わる。インピーダンスの低下は、細胞化またはラジ細胞の生存率の喪失を意味する17.抗体を用いたこの選択的テザリングアプローチは、他の液体腫瘍細胞株に拡張することができる。造馬起源の腫瘍細胞株を使用する代替戦略は、HeLa細胞で発現されるCD19のような腫瘍抗原を安定的に発現するように設計された付着癌細胞を使用することである。このアプローチの利点は、親 HeLa 細胞が容易に入手でき、特異性の負のコントロールとして使用できることです。このようなアプローチは、CHO-CD22対CHO細胞およびCHO-BCMA対CHO細胞29で既に検証されています。このような異なるアプローチを使用して、CAR T細胞の設計および有効性は容易にテストすることができる。xCELLigenceアッセイは本質的に柔軟であり、アッセイ条件は生理学的状態を最大限に近似するために調整することができる。
ここで説明した効力アッセイの大きな利点の1つは、シンプルな機能アッセイであり、遺伝子工学技術と組み合わせて、最適で有効なCALを高スループットで設計できることです。EGFR陽性癌細胞を標的とするように設計されたCAR T細胞についてここに示したように、アッセイは、異なるCAR構築物/変異体の相対活性を評価するために使用することができる。たとえば、GITR ドメインが CD3 ドメインの上流にある場合、CD3 ドメインの下流に位置する場合よりもはるかに堅牢な細胞溶解活性を示すことを示しました。
それは生体内CAR T細胞活性と完全に相関しないが、インビトロサイトカイン放出は、歴史的にCAR T細胞効力の尺度として使用されてきた。ここで説明するxCELLigenceベースの効力アッセイは、製造中または臨床応用のためにリリースされる前に細胞ベースの治療法を評価するために使用することができますが、これらの結果が生体内の有効性とどの程度相関しているかはまだありません確立。生体内の有効性は、インビトロアッセイ内で再現されない可能性のある因子および変数のホストに依存する。このような変数には、腫瘍部位へのCAR T細胞のホーミング、CAR T細胞の刺激および活性化および患者内で持続する能力、および腫瘍微小環境が含まれる。さらなる精製により、xCELLigenceアッセイは、これらの複雑なプロセスの一部をインビトロでモデル化することができるかもしれない。
ここで提供されるプロトコルは、ほとんどの付着癌細胞株および液体腫瘍細胞株の一部に適用される。しかし、原発性癌細胞などの臨床サンプルは、腫瘍の種類と相の複雑さのために、さらに検査され、最適化される必要があります。ここで説明する体外効力アッセイシステムは、CAR T細胞の潜在的な活性を反映するためだけに癌細胞株を使用していることは確かに注目に値する。人体内の実際の腫瘍状況は、特に動的腫瘍環境と発達のために固形腫瘍が標的とされる場合、はるかに複雑です。したがって、効力評価結果は、試験されたCAR T細胞の臨床有効性にあまりうまく変換されない場合がある。
要約すると、提示されたインピーダンスベースのxCELLigenceプラットフォームは、長期間、すなわち最大10日間の細胞殺害のラベルフリーの監視を可能にします。データ収集のためのこのような長い時間スケールのためのこの容量は、現在使用中であり、タイムポイント収集と手間のかかるサンプル操作のために複数の実験的反復を設定する必要がある他のアッセイと技術を区別します。さらに、エフェクター免疫細胞の最小限の信号寄与は、データ分析を簡素化します。ソフトウェアは、自動的にデータを処理し、細胞化、KT50などの有用なパラメータを生成することができます。この技術はすでに高感度(E:T比が1:20以下)と大きなダイナミックレンジ(E:T比は20:1~1:20)で、他のアッセイでは容易に達成できません。全体として、この技術の実装は、CAR T細胞試薬の開発を強化し、はるかに高いペースで分野を進める、より高いスループットスケールでより正確なデータ分析を可能にする必要があります。
開示事項
著者らは、PROMabバイオテクノロジーとACEAバイオサイエンスのビジネス上の利益であるCAR T細胞開発および関連する効力アッセイの研究をそれぞれ行っている。しかし、これは科学的知識の普及を高めるというJoVEの使命に対する著者の固執を変えるものではない。本出版の条項は、研究方針に従い、ProMabバイオテクノロジーおよびACEAバイオサイエンスによって見直され、承認されています。
謝辞
著者らは、本研究で利用された試薬および器具を提供してくれたProMabバイオテクノロジーとACEAバイオサイエンスに感謝する。
資料
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 420404 | |
| Anti-CD40, liquid tumor killing assay kit | ACEA Biosciences | 8100005 | |
| anti-human F(ab')2 | Jackson Immunoresearch laboratories. | 109-116-088 | |
| APC anti-CD3 | Biolegend | 317318 | |
| Assay medium RPMI1640 | life technologies.Corp | 11875-093 | |
| CAR-T cell frozen solution CryostorCS10 | Stemcell technologies | #07930 | |
| CAR-T cell medium from ProMab | AIM-V+300IFU/ml IL-2 | 12055-091 | |
| CD3/CD28 coated microbeads, Dynabeads | Thermofisher | 11131D | |
| DMEM | GElifesciences.com | SH30243.02 | |
| FACS buffer | Promab made | ||
| FBS | Lonza.com | 14-503F | |
| HEK293FT | Thermo Fisher | R70007 | |
| INFg ELISA kit | Thermo Fisher | ||
| Lentiviral Packaging Mix | System Biosciences | VP100 | |
| Lenti-X quantitative RT-PCR titration kit (Clontech) | Takara | 631235 | |
| Promab medium for target cells | Varied with cell lines | ||
| Real time Cellular Analyer | ACEA Biosciences | ||
| Thermal cycler | Thermo Fisher | ||
| Transduction enhance agent, Virus Transduction Enhancer (Alstem) | Transplus, Alstem | V020 | |
| Transfection dilution solution, Opti-MEM | Thermo Fisher | ||
| Transfection reagent, NanoFect reagent | Alstem | NF100 |
参考文献
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell Therapy: A New Era in Cancer Immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- . FDA approval brings first gene therapy to the United States Available from: https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm (2017)
- . FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma Available from: https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm581216.htm (2017)
- Liu, B., Song, Y., Liu, D. Clinical trials of CAR-T cells in China. Journal of Hematology & Oncology. 10 (1), 166 (2017).
- Fry, T. J., et al. CD22-targeted CAR T cells induce remission in B-ALL that is naive or resistant to CD19-targeted CAR immunotherapy. Nature Medicine. 24 (1), 20-28 (2018).
- Yang, Y., Jacoby, E., Fry, T. J. Challenges and opportunities of allogeneic donor-derived CAR T cells. Current Opinion in Hematology. 22 (6), 509-515 (2015).
- . Celyad Announces FDA Acceptance of IND Application for CYAD-101, a First-in-Class Non-Gene Edited Allogeneic CAR-T Candidate Available from: https://www.celyad.com/en/news/celyad-announces-fda-acceptance-of-ind-application-for-cyad-101-a-first-in-class-non-gene-edited-allogeneic-car-t-candidate (2017)
- Sheridan, C. Allogene and Celularity move CAR-T therapy off the shelf. Nature Biotechnology. 36 (5), 375-377 (2018).
- D’Aloia, M. M., Zizzari, I. G., Sacchetti, B., Pierelli, L., Alimandi, M. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease. 9 (3), 282 (2018).
- Xu, J., et al. Combination therapy: A feasibility strategy for CAR-T cell therapy in the treatment of solid tumors. Oncology Letters. 16 (2), 2063-2070 (2018).
- Xia, A. L., Wang, X. C., Lu, Y. J., Lu, X. J., Sun, B. Chimeric-antigen receptor T (CAR-T) cell therapy for solid tumors: challenges and opportunities. Oncotarget. 8 (52), 90521-90531 (2017).
- Yong, C. S. M., et al. CAR T-cell therapy of solid tumors. Immunology and Cell Biology. 95 (4), 356-363 (2017).
- Newick, K., O'Brien, S., Moon, E., Albelda, S. M. CAR T Cell Therapy for Solid Tumors. Annual Review of Medicine. 68, 139-152 (2017).
- de Wolf, C., van de Bovenkamp, M., Hoefnagel, M. Regulatory perspective on in vitro potency assays for human mesenchymal stromal cells used in immunotherapy. Cytotherapy. 19 (7), 784-797 (2017).
- Cerignoli, F., et al. In vitro immunotherapy potency assays using real-time cell analysis. PLOS ONE. , (2018).
- Holden, H. T., Oldham, R. K., Ortaldo, J. R., Herberman, R. B. Standardization of the chromium-51 release, cell-mediated cytotoxicity assay: cryopreservation of mouse effector and target cells. Journal of the National Cancer Institute. 58 (3), 611-622 (1977).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLOS ONE. 10 (10), e0141074 (2015).
- Mukherjee, M., Mace, E. M., Carisey, A. F., Ahmed, N., Orange, J. S. Quantitative Imaging Approaches to Study the CAR Immunological Synapse. Molecular Therapy: The Journal of the American Society of Gene Therapy. 25 (8), 1757-1768 (2017).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Review of Vaccines. 9 (6), 601-616 (2010).
- Nelson, D. L., Kurman, C. C., Serbousek, D. E. Chapter 7, Unit 7: 51Cr release assay of antibody-dependent cell-mediated cytotoxicity (ADCC). Current Protocols in Immunology. , 27 (2001).
- Abassi, Y. A., et al. Label-free, real-time monitoring of IgE-mediated mast cell activation on microelectronic cell sensor arrays. Journal of Immunological Methods. 292 (1-2), 195-205 (2004).
- Glamann, J., Hansen, A. J. Dynamic detection of natural killer cell-mediated cytotoxicity and cell adhesion by electrical impedance measurements. Assay and Drug Development Technologies. 4 (5), 555-563 (2006).
- Solly, K., Wang, X., Xu, X., Strulovici, B., Zheng, W. Application of real-time cell electronic sensing (RT-CES) technology to cell-based assays. Assay and Drug Development Technologies. 2 (4), 363-372 (2004).
- Zhu, J., Wang, X., Xu, X., Abassi, Y. A. Dynamic and label-free monitoring of natural killer cell cytotoxic activity using electronic cell sensor arrays. Journal of Immunological Methods. 309 (1-2), 25-33 (2006).
- Ke, N., Wang, X., Xu, X., Abassi, Y. A. The xCELLigence system for real-time and label-free monitoring of cell viability. Methods in Molecular Biology. 740, 33-43 (2011).
- Lamarche, B. J., Xi, B., Cerignoli, F. Quantifying the Potency of Cancer Immunotherapies: Immune Cell-Mediated Killing Kinetics and Efficacy Analysis in Real-Time without the Use of Labels. Genetic Engineering & Biotechnology News (GEN). 36 (14), 18-19 (2016).
- Golubovskaya, V., et al. CD47-CAR-T Cells Effectively Kill Target Cancer Cells and Block Pancreatic Tumor Growth. Cancers. 9 (10), (2017).
- Golubovskaya, V. M., et al. GITR domain inside CAR co-stimulates activity of CAR-T cells against cancer. Frontiers in Bioscience. 23, 2245-2254 (2018).
- Guedan, S., et al. Enhancing CAR T cell persistence through ICOS and 4-1BB costimulation. JCI Insight. 3 (1), (2018).
- Erskine, C. L., Henle, A. M., Knutson, K. L. Determining optimal cytotoxic activity of human Her2neu specific CD8 T cells by comparing the Cr51 release assay to the xCELLigence system. Journal of Visualized Experiments. (66), e3683 (2012).
- Davenport, A. J., et al. CAR-T Cells Inflict Sequential Killing of Multiple Tumor Target Cells. Cancer Immunology Research. 3 (5), 483-494 (2015).
- Hegde, M., et al. Tandem CAR T cells targeting HER2 and IL13Ralpha2 mitigate tumor antigen escape. The Journal of Clinical Investigation. 126 (8), 3036-3052 (2016).
- Jin, J., et al. Enhanced clinical-scale manufacturing of TCR transduced T-cells using closed culture system modules. Journal of Translational Medicine. 16 (1), 13 (2018).
- Weiskopf, K. Cancer immunotherapy targeting the CD47/SIRPalpha axis. European Journal of Cancer. 76, 100-109 (2017).
- Huang, Y., Ma, Y., Gao, P., Yao, Z. Targeting CD47: the achievements and concerns of current studies on cancer immunotherapy. Journal of Thoracic Disease. 9 (2), E168-E174 (2017).
- Ma, S., Thorpe, P., Vitetta, E., Meyer, J. Combined targeting of exposed phosphatidylserine, CD47 and CD54 on human pancreatic tumor cells in a mouse xenograft model of human pancreatic cancer (P4455). The Journal of Immunology. 190 (1 Supplement), (2013).
- Yamamoto, K., et al. Emergence of CD47- high expression cells confers enhanced tumorigenicity upon KDM6B suppression in pancreatic cancer. Cancer Research. 76 (2 Supplement), (2016).
- Xu, D., et al. The development of CAR design for tumor CAR-T cell therapy. Oncotarget. 9 (17), 13991-14004 (2018).
- FDA. . Guidance for Industry, Potency Tests for Cellular and Gene Therapy Products. , (2017).
- Limame, R., et al. Comparative analysis of dynamic cell viability, migration and invasion assessments by novel real-time technology and classic endpoint assays. PLOS ONE. 7 (10), e46536 (2012).
- Chiu, C. H., et al. Comparison between xCELLigence biosensor technology and conventional cell culture system for real-time monitoring human tenocytes proliferation and drugs cytotoxicity screening. Journal of Orthopaedic Surgery and Research. 12 (1), 149 (2017).
- Hillger, J. M., Lieuw, W. L., Heitman, L. H., IJzerman, A. P. Label-free technology and patient cells: from early drug development to precision medicine. Drug Discovery Today. 22 (12), 1808-1815 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved