需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
改进 x 射线激光时分辨序列飞秒晶体学微晶的高粘度挤出
摘要
时间解析的飞秒晶体学实验的成功取决于有效的样品传递。在这里, 我们描述了从高粘度微挤压喷射器中优化细菌视紫红质微晶挤出的方案。该方法依赖于样品同质化与一种新的三向耦合器和可视化与高速相机。
摘要
在 x 射线自由电子激光器 (xfels) 的连续飞秒晶体学实验 (sfx) 中, 高粘度微挤出喷射器大幅降低了样品消耗。一系列使用光驱动质子泵细菌视灯相的实验进一步确定了这些注射剂作为为时间分辨的串行飞秒晶体学 (tr-sfx) 提供晶体的首选, 以解决结构变化。光激活后的蛋白质。为了获得高质量的多个结构快照, 必须收集大量数据, 并确保每个泵浦激光脉冲之间的晶体间隙。在这里, 我们详细介绍了我们如何优化细菌视紫红素微晶的挤出, 为我们最近在 linac 相干光源 (lcls) 进行的 tr-sfx 实验。该方法的目标是优化挤出, 以实现稳定和连续的流动, 同时保持高密度的晶体, 从而提高 tr-sfx 实验中收集数据的速度。我们通过使用一种新型的三向注射器耦合装置制备具有均匀分布的晶体的脂质立方相来实现这一目标, 然后根据高速对挤出稳定性的测量调整样品组成。摄像机设置。该方法可以调整, 以优化其他微晶的流动。该设置将提供给新的瑞士免费电子激光设施的用户。
引言
串行飞秒晶体学 (sfx) 是一种结构生物学技术, 利用 x 射线自由电子激光器 (xfel) 的独特特性, 从数千颗微米大小的晶体中确定室温结构, 同时超过大多数晶体。辐射损伤由 "衍射在破坏之前" 原则1,2,3。
在 sfx (TR-SFX) 的时间解析扩展中, 来自 xfel 的飞秒脉冲用于研究蛋白质4,5的结构变化。感兴趣的蛋白质是用光学激光 (或另一个活动触发器) 激活的, 就在 xfel 在泵-探针设置中被 xfel 击中之前。通过精确控制泵与探针脉冲之间的延迟, 可以在不同的状态下捕获目标蛋白。分子电影的结构变化超过十一个数量级的时间显示了新的 xfel 源的力量, 研究几个蛋白质靶标 6,7,8, 9, 10、11、12、13。主要是, 该方法将动态光谱和静态结构技术结合在一起, 提供了近原子分辨率下蛋白质动力学的一瞥。
tr-sfx 的简单系统可能包含具有光敏感成分的内源性激活触发器, 如视网膜在细菌视紫红质 (br)9,10, 光系统 ii,13中的色谱,光活性黄色蛋白 (pyp)6,7可逆光敏荧光蛋白11, 或肌红蛋白8中的可光解一氧化碳.该技术的令人兴奋的变化仍在开发中, 它依靠混合和注入方案14,15 来研究酶反应或用于诱发结构变化的电场16。鉴于 xfel 源只提供了几年, 并将过去的成功推断到未来, 该方法显示了我们对蛋白质功能的理解作为真正改变游戏规则的潜力。
由于生物样本被一次暴露在高功率 xfel 脉冲中破坏, 因此有必要采用新的蛋白质晶体学方法。在这些程序中, 需要开发生长大量均匀微晶的能力 17、18、19.为了在 xfel 中进行数据收集, 必须交付、丢弃这些晶体, 然后为每个 xfel 脉冲续订这些晶体。鉴于 xfels 在10-120 赫兹的情况下发射可用脉冲, 样品交付必须快速、稳定和可靠, 同时保持晶体的完整性并限制消耗。其中最成功的解决方案是高粘度微挤出喷射器, 它提供了一个连续流的液晶脂质立方相 (lcp) 跨越脉冲 x 射线光束20的流动柱.嵌入在 lcp 流中的随机取向晶体, 由 xfel 脉冲将 x 射线散射到记录衍射图的探测器上。lcp 是样品输送介质的自然选择, 因为它经常被用作 17、21、22、23等膜蛋白晶体的生长介质, 而其他高粘度载体介质24、25、26、27、28、29、30 和可溶性蛋白质31也被用于注射器中。sfx 与高粘度喷射器已成功地在结构测定膜蛋白 13,32包括 g 蛋白耦合受体 (gpcr)33,34, 35、36、37, 数据质量足以满足本地阶段38、39 的要求, 同时同时具有时间和样本效率。目前, 这些喷油器在同步加速器源 28、30、40、41以及技术上更经常地用于室温测量。在 xfels9、10、13、42上需要tr-sfx 实验。
可比较的 tr-sfx 实验是使用其他喷射器类型进行的, 如液相输送在流量聚焦喷嘴 6,7, 12, 然而, 这种方法需要蛋白质量不能提供给许多生物上有趣的目标。据报告, 在使用粘性挤出的情况下, 每 10, 000个指数化衍射模式平均消耗0.72 毫克蛋白质, 而液体喷射喷嘴的平均消费量为9.35 毫克 (即样品增加约 130倍)效率)20。高粘度喷油器已被证明是 TR-SFX 的一个可行的样品输送装置, 而只是牺牲了其中的一部分样品效率43。例如, 在 nogly 等人 (2018年)10中, 样本消费量约为每 10, 000个指数模式1.5 毫克, 这与使用 pyp 进行的类似 tr-sfx 实验相比是有利的, 该实验的平均样本消费量要高得多, 每 10, 000 人中有74毫克蛋白质索引模式 6。因此, 当可用蛋白质的数量受到限制或晶体直接生长在 lcp 中时, 高粘度喷射器具有明显的优势。
要使 tr-sfx 使用高粘度喷射器产生最可靠的数据, 需要解决几个技术问题: 流速需要保持在最小临界值以上;命中率应保持在不会使数据收集缓慢的水平 (例如, 大于 5%); 必须在没有过度中断的情况下交付样本。理想情况下, 早在计划的 tr-sfx 实验尽可能高效地使用可用 xfel 时间之前, 这些条件就已经得到满足。在合理的情况下, lcp 流的减慢可能会使探测晶体被多个光学激光脉冲激活, 并导致混合活动状态, 或探测泵浦材料时, 泵送材料预计在光束中。注塑预测试的另一个好处是, xfel 数据收集过程中的停机时间降至最低, 因为时间将减少到更换堵塞的喷嘴、更换非挤出样品和其他维护任务。
在这里, 我们提出了一种使用高粘度微挤出喷射器优化 tr-sfx 数据收集样品交付的方法。为了简单起见, 所描述的方法并不依赖于获得 x 射线源, 尽管在同步加速器波束线 29上的工作将提供有关预期命中率和晶体衍射的进一步信息。我们的协议是为了优化实验来捕获质子泵细菌-视紫红质10中的视网膜异构, 并分两个阶段进行, 从准备挤出的晶体样品开始, 然后对挤出进行监测使用高速摄像机设置。在第一阶段, 晶体满载的 lcp 与额外的 lcp、低过渡温度脂质或其他添加剂混合, 以确保最终混合物适合在不堵塞或减速的情况下输送到样品环境中。为了提高混合性能和样品均匀性, 研制了一种新型的三向注射器耦合器。第二阶段由高速摄像机记录的挤压试验组成, 直接测量挤压速度稳定性。在对视频数据进行分析后, 可以对样品制备协议进行调整, 以提高实验结果。这些过程可以调整为 tr-sfx 数据收集准备其他蛋白质, 只需进行最少的修改, 这将有助于有效利用有限的 xfel 波束时间。随着新的 xfel 设施刚刚开始运作44、45 , 并将基于注射器的串行数据收集方法转移到 28、30、40、41的同步加速器, 未来几年一定会继续为越来越广泛的蛋白质靶标的结构动力学提供令人兴奋的新见解。
研究方案
1. 蛋白质晶体样品制备
- 在样品注射前大约 30分钟, 将50μl 的基于晶体的单油蛋白基 lcp 装入100μl 注射器中。
- 用于在大气压力下注射: 将10μl 的液体石蜡装入第二个注射器的背面。垂直按住注射器, 排出注射器中的气泡。
- 用于注入真空环境: 将5μl 的 mag 7.9 和5μl 的液体石蜡加载到第二个注射器的背面。垂直按住注射器, 排出注射器中的气泡。
- 用石蜡与 mag 7.9 连接注射器到标准的注射器耦合器, 轻轻按压柱塞, 将空气从耦合器中清除, 直到在耦合器针头处可见少量 (& lt;1 μl)。
- 将样品注射器连接到注射器耦合器, 注意不要在样品中引入任何空气。通过多次通过耦合器将样品材料传递到脂肪-石蜡中。
- 将20μl 预混 lcp (27% peg, 100 mm sorensen ph 5.6 + mo) 加载到另一个100μl 注射器中。根据需要去除气泡。
- 从耦合器中取出空注射器, 并使用标准注射器耦合器将预混 lcp 连接到含有注射器的晶体上。通过耦合器将样品传递100次。
注: 样品混合可能会使样品稍微加热46。在样品温度可以保持合理稳定的情况下, 应以较慢的速度进行混合。 - 根据光源检查样品的透明度。如果形成了明确的齐次 lcp, 请转到步骤1.9。
- 要将样品放入立方相, 请加入3μl 单烯烃, 并混合 50次 (如上文所述)。重复此过程, 直到形成透明的阶段, 以避免过量的单烯烃。
注: lcp 的形成与温度有关 47 , 在20°c 以上略有达到最佳效果。所需的额外单烯烃的量将取决于从结晶中结转的残留沉淀液的体积。 - 作为样品刚度 (如 lcp 阶段所预期的那样) 和挤出能力的初步测试, 将空注射器从注射器耦合器中分离出来, 并垂直按住注射器, 通过耦合器挤压少量样品 (和 lt;2 μl)。如果挤出样品形成一个直立的圆柱体, 那么样品就可以进行挤出测试了。
- 通过添加更多预混 lcp (如步骤1.5 中所示), 将样品的总体积调整为100μl。
- 将样品注射器和两个空注射器连接到三通注射器耦合器 (像以前一样从耦合器中净化空气)。将一半的样品放入第二个注射器中, 然后同时将样品的两个一半按入第三个注射器, 将样品混合至少 50次 (或直到均匀)。
- 将含有混合样品的注射器置于立体显微镜下, 以验证晶体的均匀分布。
2. 使用高速摄像机设置测试样品挤出
- 确定实验参数。
- 选择测试的喷嘴尺寸。
注: 喷嘴尺寸通常为50或75μm 内径 (id), 但可以考虑从大约 30-100μm id 的任何尺寸。选择基于平均堵塞时间、背景散射、样品消耗和命中率之间的平衡。 - 根据实验激光光斑尺寸 (直径为 2 ) 和将在 xfel 使用的数据收集方案 (例如, 交错光和暗) 计算最佳流速。
- 根据最佳流速 (

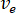 ) 和所选喷嘴直径 (
) 和所选喷嘴直径 (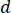 ) 计算样品的所需流速 ():
) 计算样品的所需流速 ():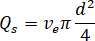
根据喷油器的放大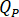 系数 (
系数 (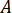 ) 确定应在高效液相色谱泵上输入的流速 ()。
) 确定应在高效液相色谱泵上输入的流速 ()。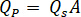
根据喷嘴配件 (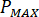
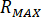 ) 的额定压力和喷油器 (
) 的额定压力和喷油器 (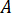 ) 的放大系数计算最大压力 ():
) 的放大系数计算最大压力 ():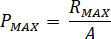
- 选择测试的喷嘴尺寸。
- 设置用于离线使用的高粘度挤出喷射器, 如图 1所示。
注: 喷油器通过高效液相色谱泵驱动的液压挤出功能, 并使用由气体调节器控制的共流氦气体护套。该协议不讨论泵和调节器的设置。详情手册见《詹姆斯》 (2015年)48第四章。- 清除泵和所有水线, 以确保流量准确。清洗喷油器的液压级。
- 将喷油器 (或相机) 安装在三轴舞台上, 以方便高速视频的框架和对焦。为物镜、照明、反光屏幕和小烧杯留出注射点周围的空间, 以捕捉已用样品。
- 构建一个 "虚拟喷嘴" (一个带有喷嘴的空蓄水池), 并将其安装在喷油器上, 以方便定位、聚焦和照明。
- 将高速摄像机安装在目标的焦点附近, 将喷嘴尖端固定在目标的焦距附近。
- 将反射屏幕放置在喷油器后面, 并将照明调整为喷嘴的前灯。
- 打开并使用提供的软件连接到相机。通过现场视频进行视觉反馈, 将喷嘴尖端放置在框架的中心, 并将其与三轴阶段一起聚焦。
- 调整照明, 直到喷嘴清晰可见, 背景均匀照明。
- 配置摄像机以录制高速延时视频。
- 将帧率设置为 1000 fps。将分辨率设置为 512 x 512 像素。
- 现在, 曝光时间由帧速率确定, 调整照明水平, 直到喷嘴可见 (即, 而不是曝光不足或过度曝光)。重新定位喷嘴尖端, 使其从左到右居中, 位于框架的前三分之一。
- 运行任何背景校正或白平衡操作。
- 在延时模式下设置相机。将间隔设置为30秒, 并重复到40次, 将触发模式设置为随机(或随机重置), 并输入要记录为1000秒的帧数。
- 用测试样品的20μl 装入储液库, 并连接毛细管喷嘴。
- 将已填充的水库连接到喷射器。将气线连接到喷嘴上的端口, 然后启动气体流动。
- 通过打开在线阀门并按下注射器, 手动推进活塞。当活塞与储罐中的样品进行实心接触时, 请关闭阀门。
- 使用计算出的流量对泵进行编程, 并将最大压力设置为计算值 (请参阅步骤 2.1.3)。
- 同时启动泵和相机录制。
- 当挤压开始时, 调整气体压力以增加稳定性。如果流体在喷嘴的尖端而不是柱处形成下降, 则增加气体压力。如果挤压因气流的过度剪切而破裂, 或快速振荡 (抽打), 则可降低压力。
- 监控挤出 (10分钟通常足以识别均匀流动条件), 当泵压力在接近预期结束时间的时候急剧上升时, 停止记录, 关闭泵, 并通过打开安全阀来释放系统压力。
- 视频文件分析
注: 明显不足的样品挤出不需要详细分析。但是, 确定故障模式以优化示例仍然很有用。- 使用分析软件 (例如, 斐济49) 打开视频文件并校准测量工具。
- 使用换行工具在视频图像中选择已知长度的线, 以校准测量值。通过 "分析" 打开"设置缩放"窗口设置 "缩放"并输入已知距离和度量单位。
注: 喷嘴的已知直径为这些测量提供了足够的校准长度。 - 在视频中查找一个帧, 其中有一个可跟踪的特征在拉伸中可见 (例如, 晶体)。记录帧号。
- 将视频推进到同一功能可见但已从上一步中的位置移动的帧。记录帧号。
- 使用直线测量工具, 通过 "分析" 测量与要素起点和终点之间的距离测量。
注: 可跟踪距离越长, 测量中的误差越少, 将影响计算 - 根据测量的距离和经过的时间 (通过的帧数除以帧数) 计算喷射速度。
- 重复步骤 2.11.3-对视频的每个片段2.11.6 几次。
- 绘制数据系列, 如图 2所示。
结果
此处描述的过程 (图 3) 的理想起始材料是将微晶高密度集成到喷射器的粘性载体介质中。该程序要求每个制备过程中大约有50μl 的含晶载流子。它们可以直接在 lcp 中生长, 就像这里使用的 br9, 10 一样, 例如 (图 4), 也可以使用传统蒸汽扩散设置中生长的晶体进行制备。在 ishchenko 等人 (...
讨论
tr-sfx 方法与粘性挤出喷射器已被证明是一种可行的技术,结构动力学研究细菌视紫红质 9,10 和光系统 ii13 , 现在似乎准备研究蛋白质驱动其他照片生物过程, 如光驱动离子传输或感官感知5,50。上述协议旨在最大限度地提高 TR-SFX 细菌视紫红质数据收集的成功率, 但我们相信可以作为模板, 优化?...
披露声明
提交人声明没有相互冲突的利益。
致谢
我们感谢 gebhard schertler、rafael abela 和 chris milne 支持在 psi 使用高粘度喷射器。richard neutze 和他的团队被认可讨论时间解析的晶体学和样品交付使用高粘度喷射器。为了提供财政支助, 我们感谢瑞士国家科学基金会提供赠款31003A_141235、31003A_159558 (向 j. s.) 和 PZ00P3_174169 (向 p. n.) 提供的赠款。根据 marie-sklolowska-curie 第706号赠款协议, 该项目得到了欧洲联盟 "地平线 2020" 研究和创新方案的资助。
材料
| Name | Company | Catalog Number | Comments |
| Mosquito LCP Syringe Coupling | TTP labtech store | 3072-01050 | |
| Hamilton Syringe 1710 RNR, 100 µl | Hamilton | HA-81065 | |
| Hamilton Syringe 1750 RNR, 500 µl | Hamilton | HA-81265 | |
| Monoolein | Nu-Chek Prep, Inc. | M-239 | |
| 7.9 MAG | Avanti Polar Lipids Inc. | 850534O | |
| 50% w/v PEG 2000 | Molecular Dimensions | MD2-250-7 | |
| Paraffin (liquid) | Sigma-Aldrich | 1.07162 | |
| High speed camera | Photron | Photron Mini AX | |
| High magnification lens | Navitar | 12X Zoom Lens System | |
| Three axis stage | ThorLabs | PT3/M | |
| Fiber light | Thorlabs | OSL2 | |
| Fused silica fiber | Molex/Polymicro | TSP-505375 | |
| Lite touch ferrule | IDEX | LT-100 | |
| ASU high viscosity injector | Arizona State University | Purchasable from Uwe Weierstall (weier@asu.edu) | |
| HPLC pump | Shimadzu | LC-20AD | |
| Electronic gas regulator | Proportion Air | GP1 |
参考文献
- Neutze, R., Wouts, R., van der Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-77 (2011).
- Barty, A., et al. Self-terminating diffraction gates femtosecond X-ray nanocrystallography measurements. Nature photonics. 6 (December), 35-40 (2012).
- Aquila, A., et al. Time-resolved protein nanocrystallography using an X-ray free-electron laser. Optics express. 20 (3), 2706-2716 (2012).
- Panneels, V., et al. Time-resolved structural studies with serial crystallography: A new light on retinal proteins. Structural Dynamics. 2 (4), 041718 (2015).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Pande, K., et al. Femtosecond structural dynamics drives the trans/cis isomerization in photoactive yellow protein. Science (New York, N.Y.). 352 (6286), 725-729 (2016).
- Barends, T. R. M., et al. Direct observation of ultrafast collective motions in CO myoglobin upon ligand dissociation. Science (New York, N.Y.). 350 (6259), 445-450 (2015).
- Nango, E., et al. A three-dimensional movie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Nogly, P., et al. Retinal isomerization in bacteriorhodopsin captured by a femtosecond x-ray laser. Science. 0094 (June), (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2017).
- Kupitz, C., et al. Serial time-resolved crystallography of photosystem II using a femtosecond X-ray laser. Nature. , (2014).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Stagno, J. R., et al. Structures of riboswitch RNA reaction states by mix-and-inject XFEL serial crystallography. Nature. 541 (7636), 242-246 (2017).
- Wang, D., Weierstall, U., Pollack, L., Spence, J. C. H. Liquid Mixing Jet for XFEL Study of Chemical Kinetics. Journal of synchrotron radiation. , 1364-1366 (2014).
- Hekstra, D. R., White, K. I., Socolich, M. A., Henning, R. W., Šrajer, V., Ranganathan, R. Electric-field-stimulated protein mechanics. Nature. 540 (7633), 400-405 (2016).
- Liu, W., Ishchenko, A., Cherezov, V. Preparation of microcrystals in lipidic cubic phase for serial femtosecond crystallography. Nature. 9 (9), 2123-2134 (2014).
- Kupitz, C., Grotjohann, I., Conrad, C. E., Roy-Chowdhury, S., Fromme, R., Fromme, P. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological sciences. 369 (1647), (2014).
- Falkner, J. C., et al. Generation of Size-Controlled, Submicrometer Protein Crystals. Chemistry of Materials. 17 (10), 2679-2686 (2005).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature communications. 5, 3309 (2014).
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: a novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences of the United States of America. 93 (December), 14532-14535 (1996).
- Caffrey, M. A comprehensive review of the lipid cubic phase or in meso method for crystallizing membrane and soluble proteins and complexes. Acta Crystallographica Section F Structural Biology Communications. 71 (1), 3-18 (2015).
- Cherezov, V. Lipidic cubic phase technologies for membrane protein structural studies. Current Opinion in Structural Biology. 21 (4), 559-566 (2011).
- Conrad, C. E., et al. A novel inert crystal delivery medium for serial femtosecond crystallography. IUCrJ. 2 (4), 421-430 (2015).
- Sugahara, M., et al. Hydroxyethyl cellulose matrix applied to serial crystallography. Scientific Reports. 7 (1), 703 (2017).
- Sugahara, M., et al. Grease matrix as a versatile carrier of proteins for serial crystallography. Nature Methods. 12 (1), 61-63 (2014).
- Sugahara, M., et al. Oil-free hyaluronic acid matrix for serial femtosecond crystallography. Scientific Reports. 6 (1), 24484 (2016).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Kovácsová, G., et al. Viscous hydrophilic injection matrices for serial crystallography. IUCrJ. 4 (4), 400-410 (2017).
- Martin-Garcia, J. M., et al. Serial millisecond crystallography of membrane and soluble protein microcrystals using synchrotron radiation. IUCrJ. 4 (4), 439-454 (2017).
- Fromme, R., et al. Serial femtosecond crystallography of soluble proteins in lipidic cubic phase. IUCrJ. 2, 545-551 (2015).
- Caffrey, M., Li, D., Howe, N., Shah, S. T. A. "Hit and run" serial femtosecond crystallography of a membrane kinase in the lipid cubic phase. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130621 (2014).
- Liu, W., et al. Serial femtosecond crystallography of G protein-coupled receptors. Science (New York, N.Y.). 342 (6165), 1521-1524 (2013).
- Zhang, H., et al. Structure of the Angiotensin Receptor Revealed by Serial Femtosecond Crystallography. Cell. 161 (4), 833-844 (2015).
- Fenalti, G., et al. Structural basis for bifunctional peptide recognition at human δ-opioid receptor. Nature Structural & Molecular Biology. (February), (2015).
- Kang, Y., et al. Crystal structure of rhodopsin bound to arrestin by femtosecond X-ray laser. Nature. 523 (7562), 561-567 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and Delivery of Protein Microcrystals in Lipidic Cubic Phase for Serial Femtosecond Crystallography. Journal of Visualized Experiments. 9 (115), 2123-2134 (2016).
- Batyuk, A., et al. Native phasing of x-ray free-electron laser data for a G protein-coupled receptor. Science Advances. 2 (9), e1600292 (2016).
- Nakane, T., et al. Native sulfur/chlorine SAD phasing for serial femtosecond crystallography. Acta Crystallographica Section D Biological Crystallography. 71 (12), 2519-2525 (2015).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tosha, T., et al. Capturing an initial intermediate during the P450nor enzymatic reaction using time-resolved XFEL crystallography and caged-substrate. Nature Communications. 8 (1), 1585 (2017).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314 (2016).
- Abela, R., et al. Perspective: Opportunities for ultrafast science at SwissFEL. Structural Dynamics. 4 (6), 061602 (2017).
- Marx, V. Structural biology: doors open at the European XFEL. Nature Methods. 14 (9), 843-846 (2017).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chemistry and Physics of Lipids. 95 (1), 11-21 (1998).
- Qiu, H., Caffrey, M. The phase diagram of the monoolein/water system: Metastability and equilibrium aspects. Biomaterials. 21 (3), 223-234 (2000).
- James, D. . Injection Methods and Instrumentation for Serial X-ray Free Electron Laser Experiments. , (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Moffat, K. Femtosecond structural photobiology. Science (New York, N.Y.). 361 (6398), 127-128 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。