JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
X 선 레이저에서 직렬 펨 결정학 시간 해결에 대 한 Microcrystals의 고 점도 압출을 개선
요약
시간이 해결 직렬 펨 결정학 실험의 성공 효율적인 샘플에 따라 달라 집니다. 여기, 우리는 프로토콜 최적화 높은 점도 마이크로 압출 인젝터에서 bacteriorhodopsin microcrystals의 입체 면을 설명 합니다. 방법론은 소설 3 방향 커플러와 샘플 균질 및 고속 카메라와 시각화에 의존합니다.
초록
높은 점도 마이크로 압출 인젝터는 극적으로 x 선 자유 전자 레이저 (XFELs)에서 직렬 펨 결정학 실험 (SFX)에서 샘플 소비를 감소 했습니다. 일련의 실험 빛 구동 양성자 펌프 bacteriorhodopsin를 사용 하 여 추가 설정한이 인젝터의 구조 변화를 해결 하려면 시간 해결 직렬 펨 결정학 (TR-SFX)에 대 한 결정을 제공 하는 기본 옵션으로 photoactivation 후 단백질입니다. 높은 품질의 여러 구조 스냅샷, 많은 양의 데이터를 수집 하 고 모든 펌프 레이저 펄스 사이의 결정의 보장에 필수적 이다. 여기, 우리가 어떻게 우리가 우리의 최근 TR SFX 실험 Linac 일관 된 빛 소스 (LCLS)에서 bacteriorhodopsin microcrystals의 입체 최적화 자세히 설명 합니다. 방법의 목표 속도 증가 하는 결정의 높은 밀도 유지 하면서 안정적이 고 지속적인 흐름에 대 한 압출을 최적화 하는 실험에서 TR SFX에 데이터를 수집할 수 있습니다. 우리 커플링 장치는 고속으로 찍은 압출 안정성의 측정에 따라 샘플 구성 조정 하 여 다음 소설 3-방법으로 주사기를 사용 하 여 결정의 균일 분포 lipidic 입방 단계를 준비 하 여이 목표를 달성 카메라 설정입니다. 방법론은 다른 microcrystals의 흐름을 최적화 하기 위해 적용할 수 있습니다. 설치는 새로운 스위스 자유 전자 레이저 시설 사용자가 가능할 것 이다.
서문
직렬 펨 결정학 (SFX)은 대부분의 잡기 동안 수천 마이크로미터 크기의 결정에서에서 x 선 자유 전자 레이저 (XFEL) 실 온 구조 결정의 독특한 속성을 이용 하는 구조 생물학 기술 "파괴 전에 회절" 원리1,2,3방사선 손상.
시간 해결 SFX (TR-SFX) 확장,는 XFEL에서 펨 펄스는 단백질4,5에 구조적인 변화를 공부 하는 데 사용 됩니다. 관심사의 단백질 XFEL 펌프-프로브 설치 프로그램에 의해 총 직전 광학 레이저 (또는 다른 활동 트리거) 활성화 됩니다. 정확 하 게 제어 함으로써 펌프와 프로브 펄스 사이의 지연, 다른 주에서 대상 단백질을 캡처할 수 있습니다. 시간 11 배나 통해 구조 변경의 분자 영화 보여 여러 단백질 목표6,7,,89의 역학을 공부 하는 새로운 XFEL 소스의 힘 10,11,,1213. 주로, 메서드 원자 해상도 근처에서 단백질 역동성으로 엿볼 제공 동적 광 및 정적 구조 기술을 하나로, 조인.
TR-SFX에 대 한 간단한 시스템 bacteriorhodopsin (bR)9,10에 망막, photosystem II12,13, chromophores 같은 사진에 민감한 구성 요소 활성화의 내 생 트리거 포함 될 수 있습니다. 광 노란색 단백질 (PYP)6,7 역 photoswitchable 형광 단백질11또는 myoglobin8일산화 탄소 photolyzable. 기술 개발에 여전히의 흥미로운 변이 혼합에 의존 하 고 주사 제도14,15 효소 반응 또는16구조적인 변화 유도 하는 데 사용 하는 전기 분야를 공부 하. XFEL 소스 겨우 사용할 수 있는 몇 년 동안 하 고 미래에 과거의 성공 바탕, 메서드를 보여 줍니다 방법에 대 한 우리의 이해에 관하여 진짜 게임 체인저로 잠재적인 단백질 기능.
생물 학적 샘플 단일 노출 고성능 XFEL 펄스에 의해 파괴 때문에 단백질 결정학에 새로운 접근 필요 했다. 이러한 절차 중 많은 양의 유니폼 microcrystals 성장 능력 개발된17,,1819필요가 있었다. XFEL에 데이터 컬렉션을 사용 하려면 이러한 결정 전달, 삭제, 고 각 XFEL 펄스에 대 한 다음 갱신 있습니다. XFELs 10-120 Hz에서 사용 가능한 펄스 발생, 샘플 배달 해야 되지, 안정, 빠르고 안정적 또한 유지 결정 그대로 제한 소비 하면서. 가장 성공적인 솔루션 중 continiously 펄스 x-선 빔20통해 실내 온도 크리스탈-라덴 lipidic 입방 단계 (LCP)의 열을 스트리밍을 제공 하는 높은 점성 마이크로 압출 인젝터가입니다. 무작위로 지향된 결정, XFEL 펄스 분산형 엑스레이 회절 패턴을 기록 하는 감지기에 의해 도청 하는 LCP 스트림에 포함. 그것은 자주 막 단백질 결정17,21,,2223, 아직 다른 점도 캐리어 미디어 성장 매체로 사용 LCP 샘플 전달 매체에 대 한 자연 선택은 24,25,26,,2728,29,30 및 수용 성 단백질31 또한 인젝터에 사용 되었습니다. 높은 점도 인젝터와 SFX 막 단백질13,32 G 단백질 결합 된 수용 체 (GPCRs)33,34, 등의 구조를 결정 하는 동안 성공 했습니다. 35,,3637, 네이티브 위상38,39 시간 및 효율적인 샘플 되는 동안에 대 한 충분 한 데이터 품질. 현재,이 인젝터는 사용 되 고 더 정기적으로 더 동안에 뿐만 아니라 싱크 로트 론 소스28,30,,4041 에서 실내 온도 측정에 대 한 기술적으로 XFELs9,10,,1342에서 TR SFX 실험을 요구.
그러나 유사한 TR SFX 실험 진행 되었습니다 밖으로 액체 단계 흐름에서 배달 집중 노즐6,,712같은 다른 인젝터 종류를 사용 하 여,,이 방법은 많은 단백질 양을 사용할 수 없는 필요 합니다. 생물학적으로 목표를 재미 있는. 액체 제트에 대 한 10000 인덱싱된 회절 패턴 9.35 mg에 비해 당 단백질의 0.072 밀리 그램의 평균 소비 점성 돌출을 사용 하 여 정적 구조체의 결정에 대 한 노즐 (즉, 130 배 더 많은 샘플에 대해 보고 되었습니다. 효율적인)20. 고 점도 인젝터만이 샘플 효율43의 일부 희생 하면서 TR SFX를 위한 실행 가능한 샘플 배달 장치를 보였다. Nogly 외. (2018)에10, 예를 들어 샘플 소비는 약 1.5 m g 10000 인덱싱된 패턴 당 평균 샘플 소비는 74 밀리 그램의 10000 당 단백질의 훨씬 더 높은 PYP를 사용 하 여 비슷한 TR SFX 실험을 호의적으로 비교 하는 인덱싱된 패턴6. 고 점도 인젝터는 따라서 사용 가능한 단백질의 양을 제한 하거나 결정 LCP 직접 재배 명확한 장점이 있다.
TR-SFX 높은 점도 사용 하 여에 대 한 몇 가지 기술적인 문제가 가장 신뢰할 수 있는 데이터를 인젝터 해결 해야: 흐름 속도 최소 임계값; 위에 남아 있어야 히트-속도 느린 데이터 컬렉션을 렌더링 하지 않는 수준에서 유지 되어야 한다 (예를 들어, 보다 큰 5%); 샘플 과도 한 중단 없이 전달 했다. 이상적으로, 이러한 조건을 이미 충족 하는 사용 가능한 XFEL 시간을 가능한 한 효율적으로 사용 하는 예약 된 TR SFX 실험 하기. Pricipally, LCP 스트림의 둔화 이상의 광학 레이저 펄스와 혼합된 활성 상태에 결과 활성화 된 결정 프로 빙 또는 umpumped 물자는 빔에 예상 되는 경우 펌핑된 소재를 프로 빙 수. 있습니다 사출 사전 테스트의 추가 혜택은 강등 압출 비 샘플 변경 막힌된 노즐을 교체 하는 시간으로는 XFEL에서 데이터 수집 하는 동안 가동 중지 시간 최소화 및 기타 유지 관리 작업 감소.
여기, 우리는 높은 점도 마이크로 압출 인젝터와 TR SFX 데이터 컬렉션에 대 한 샘플 배달을 최적화 하는 방법을 제시. 편의상, 설명된 방법 의존 하지 마십시오 X-ray 소스에 액세스할 수 있지만 싱크 로트 론 beamline29 일 것 이다 추가 제공 정보 예상된 적중된 속도 크리스탈 회절에. 우리의 프로토콜 양성자 펌프 bacteriorhodopsin10 에 망막 isomerization 캡처 실험을 최적화 하기 위해 개발 되었다 고 돌출을 모니터링 하 여 다음 돌출 크리스탈 샘플을 준비와 함께 시작 하는 두 단계에서 수행 됩니다. 고속 카메라 설치를 사용 하 여. 1 단계에서 결정-라덴 LCP 최종 혼합물은 막힘 또는 감속 없이 배달 샘플 환경에 적합 하도록 추가 LCP, 낮은 전환 온도 지질 또는 다른 첨가제 혼합입니다. 새로운 3 방향 주사 통 커플러는 혼합 성능 및 샘플 동질성을 개선 하기 위해 개발 되었다. 직접 압출 속도 안정성을 측정 하는 고속 카메라에 의해 기록 된 압출 테스트 두 번째 단계에 의하여 이루어져 있다. 비디오 데이터의 분석에 따라 조정 할 수 있다 샘플 준비 프로토콜에 실험 결과 개선 하기 위해. 이 절차는 최소한의 수정, TR-SFX 데이터 수집을 위해 준비 하는 다른 단백질을 적응 시킬 수 있다 및 제한 XFEL beamtime의 효율적인 사용에 기여할 것입니다. 그냥 그들의 작업44,45 synchrotrons28,30,40,41 인젝터 기반 직렬 데이터 수집 방법의 전송 시작 하는 새로운 XFEL 시설 , 다음 몇 년 동안 확실 하 게 계속 제공할 것 이다 단백질 목표의 적 넓은 범위의 구조 역학에 대 한 흥미로운 새로운 통찰력.
프로토콜
1. 단백질 크리스탈 샘플 준비
- 약 30 분 전에 샘플, 주입 하는 것입니다 monoolein 크리스탈-라덴의 부하 50 µ L 100 µ L 주사기에 LCP을 기반으로.
- 대기압에서 주입에 대 한: 부하 10 µ L 주사기를 두 번째의 뒤쪽으로 액체 파라핀의. 수직으로 주사기를 들고, 주사기에서 공기 방울을 추방.
- 진공 환경으로 주입에 대 한: 매기 7.9와 두 번째 주사기의 뒤쪽으로 액체 파라핀의 5 µ L의 부하 5 µ L. 수직으로 주사기를 들고, 주사기에서 공기 방울을 추방.
- 파라핀/매기 7.9 표준 주사기 커플러에 주사기를 연결, 눌러 부드럽게 플런저에 작은 볼륨까지 커플러에서 공기를 제거 (< 1 µ L) 파라핀/지질의 커플러 바늘의 끝에 표시 됩니다.
- 샘플으로 공기를 소개 하지를 돌보는 주사기 커플러를 샘플 주사기를 연결 합니다. 커플러를 통해 시료를 여러 번 전달 하 여 지질/파라핀에 섞어.
- 또 다른 100 µ L 주사기에 premixed LCP (27% 말뚝, 100 mM 소 렌 슨 pH 5.6 + 모)의 20 µ L를 로드 합니다. 필요에 따라 기포를 제거 합니다.
- 커플러에서 빈 주사기를 제거 하 고 표준 주사기 커플러를 사용 하 여 주사기를 포함 하는 크리스탈에 premixed LCP를 연결 합니다. 100 번 커플러를 통해 샘플을 전달 합니다.
참고: 샘플을 열 수 있습니다 샘플 혼합 약간46. 혼합 할 수 느린 속도로 어디 샘플의 온도 보전 될 수 있다 합리적으로 일정. - 빛의 원천에 대 한 투명성에 대 한 샘플을 검사 합니다. 명확한 균질 LCP, 형성 하는 단계로 1.9 이동 합니다.
- 입방 단계에 샘플을가지고, monoolein의 3 µ L을 추가 하 고 50 번 (위에서 설명한) 혼합. 그냥 투명 한 단계 monoolein의 과잉을 피하기 위해 형성 될 때까지이 절차를 반복 합니다.
참고:는 LCP의 형성 온도 종속47 이며 최상의 결과 20 ° c.의 위 약간 달성 추가 monoolein 양의 필요 결정 화에서이 월 된 잔여 precipitant 솔루션의 볼륨에 따라 달라 집니다. - 예비로 샘플 강성 (예상 대로 LCP 단계에서) 및 돌출 하는 능력에 대 한 테스트, 주사기 커플러에서 빈 주사기를 분리 하 고, 수직으로 주사기를 들고, 시비 거는 작은 양의 샘플 (< 2 µ L) 커플러를 통해. 밀어낸된 샘플 수직 실린더, 형성 하는 경우,이 예제는 압출 테스트에 대 한 준비.
- (1.5 단계)로 더 premixed LCP를 추가 하 여 100 µ L 샘플의 전체 볼륨을 조정 합니다.
- (앞으로 커플러에서 공기를 제거) 하는 3 방향 주사 통 커플러를 샘플 주사기와 두 개의 빈 주사기를 첨부 합니다. 적어도 50 번 (또는 혼합 될 때까지 균질) 두 번째 주사기에는 샘플의 절반을 전달 하 고 다음 눌러 샘플의 두 반쪽 3 주사기로 동시에.
- 결정의 균일 분포를 확인 하기 위해 스테레오 현미경 혼합된 샘플을 포함 하는 주사기를 놓습니다.
2. 테스트 샘플 입체 고속 카메라 설치를 사용 하 여
- 실험적인 매개 변수를 결정합니다.
- 테스트에 대 한 노즐 크기를 선택 합니다.
참고: 노즐 크기는 일반적으로 50 또는 75 µ m 내부 직경 (ID), 모든 크기에서 대략 30-100 µ m ID 간주 될 수 있습니다. 선택 의미 막힘 시간, 배경 산란, 샘플 소비, 명 중 율 사이의 균형을 기반으로 합니다. - 실험적인 레이저 크기 (1/e2 직경), 및 데이터 수집 계획 (예: 인터리빙된 빛과 어둠)는 XFEL에 사용 될에 따라 최적의 흐름 속도 계산 합니다.
- 원하는 흐름 속도 계산 (
 ) 최적의 흐름 속도에서 샘플의 (
) 최적의 흐름 속도에서 샘플의 (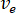 )와 선택 된 노즐 직경 (
)와 선택 된 노즐 직경 (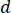 ):
):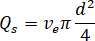
흐름 속도 결정 (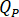 )는 증폭 요인에 따라 HPLC 펌프에 입력 해야 합니다 (
)는 증폭 요인에 따라 HPLC 펌프에 입력 해야 합니다 (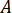 ) 인젝터의.
) 인젝터의.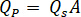
최대 압력 계산 (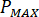 )는 노즐의 정격된 압력에서 (
)는 노즐의 정격된 압력에서 (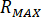 )와 인젝터의 증폭 요인은 (
)와 인젝터의 증폭 요인은 (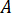 ):
):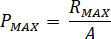
- 테스트에 대 한 노즐 크기를 선택 합니다.
- 그림 1에서 같이 오프 라인 사용에 대 한 고 점도 압출 인젝터의 설정.
참고: 유압 압출에 의해 인젝터 함수는 HPLC 펌프에 의해 구동 하 고 공동 흐르는 헬륨 가스 칼 집 가스 레 귤 레이 터에 의해 제어를 사용 합니다. 펌프와 레 귤 레이 터 설치 하지이 프로토콜에서 설명 되어 있습니다. 제 4 제임스 (2015)48 에 대 한 상세한 매뉴얼을 참조 하십시오.- 펌프와 정확 하 게는 flowrates를 보장 하기 위해 모든 물 라인을 제거. 인젝터의 유압 단계 제거.
- 프레임 및 고속 동영상에 대 한 집중을 촉진 하는 3 축 단계에는 인젝터 (또는 카메라)를 탑재 합니다. 대물 렌즈, 조명, 반사, 스크린과 잡으려고 보낸된 샘플 작은 비 커에 대 한 주입 점의 주위 공간을 남겨 주세요.
- "더미 노즐" 구성 (노즐 연결 된 빈 저수지) 위치, 초점, 및 조명 인젝터에 설치.
- 목표의 초점 근처 노즐 팁 고속 카메라를 탑재 합니다.
- 인젝터 뒤 반사 화면을 전면 빛 노즐 조명 조정.
- 설정 하 고 제공 된 소프트웨어와 함께 카메라에 연결. 시각적 피드백에 대 한 실행 라이브 비디오, 노즐 팁, 프레임의 중앙에 놓고 3 축 단 초점으로 그것을.
- 노즐은 명확 하 게 표시 될 때까지 배경 균등 하 게 조명 조명을 조정 합니다.
- 고속 기록 시간 경과 비디오 카메라를 구성합니다.
- 1000 fps 설정된 프레임 속도입니다. 512 x 512 픽셀 해상도 설정 합니다.
- 지금 프레임 속도 설정 노출 시간, 조명 레벨 조정 노즐 표시 될 때까지 (즉, 아닌-또는 설쳐). 위치 변경 노즐 팁은 중심을 왼쪽에서 오른쪽 프레임의 최고 세 번째에 위치 하 고.
- 어떤 배경 보정 이나 화이트 밸런스 작업을 실행 합니다.
- 시간 경과 모드로 카메라를 설정 합니다. 간격에 30 s 반복 및 40 시간, 임의의 (또는 임의 리셋), 트리거 모드를 설정 하 고 1000녹화 프레임 수를 입력.
- 테스트 샘플의 20 µ L와 저수지를 로드 하 고 모 세관 노즐 연결 합니다.
- 인젝터 채워진된 저수지를 연결 합니다. 포트 노즐에 가스 관을 연결 하 고 가스 흐름을 시작 합니다.
- 수동으로 인라인 밸브를 개방 하 고 눌러 주사기 피스톤을 사전. 때 피스톤 저수지에서 샘플 고체 접촉 밸브를 닫습니다.
- 계산 된 유량과 펌프를 프로그램 하 고 계산 된 값을 최대 압력을 설정 (단계 2.1.3 참조).
- 펌프 및 카메라 녹화 시작 동시에.
- 돌출 시작으로, 조정 안정성을 증가 하는 가스 압력. 열 대신 노즐의 끝에 한 방울을 형성 하는 액체 가스 압력을 증가. 감소 압력 돌출 한다고 해 서 가스 흐름에서 과도 한 전단 또는 급속 하 게 진동 하는 경우 (흔든 다).
- 돌출을 모니터링 (10 분은 일반적으로 균질 성 흐름 상태를 인식 하는 충분 한) 중단 하 고, 급격히 펌프 압력은 최대 예상된 종료 시간 근처 경사로 때 기록, 펌프, 차단 시스템 압력 릴리프 밸브를 개방 하 여 환기.
- 비디오 파일의 분석
참고: 현실적으로 적절 하지 않은 샘플 압출 상세한 분석을 필요 하지 않습니다. 그러나, 그것은 여전히 실패 모드를 식별 하는 샘플을 최적화할 수 있습니다 유용 합니다.- 분석 소프트웨어 (예: 피지49) 비디오 파일을 열고 측정 도구를 보정 합니다.
- 선 선택 도구로 비디오 이미지에서 알려진 길이의 라인을 선택 하 여 측정을 보정. 분석을 통해 비율 설정 창을 엽니다 | 설정 규모 알려진된 거리와 측정 단위를 입력 하십시오.
참고: 노즐의 알려진된 직경이 측정에 대 한 적절 한 교정 길이 제공합니다. - 비디오에서 한 프레임을 찾아 돌출에 추적 기능 표시 (예, 크리스털)입니다. 프레임 번호를 기록 합니다.
- 프레임 같은 기능 볼 수는 있지만 이전 단계에서의 위치에서 이동 하는 비디오를 사전. 프레임 번호를 기록 합니다.
- 기능 시작 및 분석을 통해 끝점에서 거리 측정 직선 측정 도구를 사용 하 여 | 측정.
참고: 추적 거리 측정에 적은 오류가 더 이상 것입니다 영향을 계산 - 측정된 거리와 경과 시간 (경과 된 프레임 나눈 프레임의 수입니다.)에서 제트 속도 계산
- 동영상의 모든 세그먼트에 대 한 단계 2.11.3-2.11.6 몇 번을 반복 합니다.
- 그림2 데이터 계열을 플롯 합니다.
결과
여기에 설명 된 절차 (그림 3)에 대 한 이상적인 시작 물자는 인젝터를 위한 점성 운반대 매체에 통합 하는 microcrystals의 높은 밀도 이다. 절차의 크리스탈 라덴 각 준비를 위해 약 50 µ L에 대 한 호출합니다. 이러한 bR9,10 여기, 예를 들어 (그림 4), 사용 또는 기존의 증기 확산 설정에서 ?...
토론
점성 돌출 인젝터와 TR SFX 메서드 bacteriorhodopsin9,10 , photosystem II13 의 구조 역학 연구에 대 한 가능한 기술을 입증 하 고 지금 공부 단백질 다른 운전 준비가 보인다 사진 빛 구동 이온 전송 등 감각 지 각5,50생물 학적 프로세스. 위에서 설명한 프로토콜 bacteriorhodopsin, TR-SFX 데이터 컬렉션의 성공...
공개
저자는 전혀 상반 되는 관심사를 선언합니다.
감사의 말
우리 인정 Gebhard Schertler, 라파엘 이탈리아 크리스 Milne PSI에 높은 점도 인젝터의 사용을 지원 합니다. 리처드 Neutze와 그의 팀은 시간 해결 결정학 및 샘플 배달 고 점도 인젝터를 사용 하 여 토론에 대 한 인정 됩니다. 스위스 국립 과학 재단 교부 금 31003A_141235, 31003A_159558 (에 제)에 대 한 재정 지원에 대 한 인정 및 (P.N.)를 PZ00P3_174169. 이 프로젝트는 유럽 연합의 수평선 2020 연구와 마리-Sklodowska-퀴리 부여 계약 아니오 701646 혁신 프로그램에서 자금을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| Mosquito LCP Syringe Coupling | TTP labtech store | 3072-01050 | |
| Hamilton Syringe 1710 RNR, 100 µl | Hamilton | HA-81065 | |
| Hamilton Syringe 1750 RNR, 500 µl | Hamilton | HA-81265 | |
| Monoolein | Nu-Chek Prep, Inc. | M-239 | |
| 7.9 MAG | Avanti Polar Lipids Inc. | 850534O | |
| 50% w/v PEG 2000 | Molecular Dimensions | MD2-250-7 | |
| Paraffin (liquid) | Sigma-Aldrich | 1.07162 | |
| High speed camera | Photron | Photron Mini AX | |
| High magnification lens | Navitar | 12X Zoom Lens System | |
| Three axis stage | ThorLabs | PT3/M | |
| Fiber light | Thorlabs | OSL2 | |
| Fused silica fiber | Molex/Polymicro | TSP-505375 | |
| Lite touch ferrule | IDEX | LT-100 | |
| ASU high viscosity injector | Arizona State University | Purchasable from Uwe Weierstall (weier@asu.edu) | |
| HPLC pump | Shimadzu | LC-20AD | |
| Electronic gas regulator | Proportion Air | GP1 |
참고문헌
- Neutze, R., Wouts, R., van der Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-77 (2011).
- Barty, A., et al. Self-terminating diffraction gates femtosecond X-ray nanocrystallography measurements. Nature photonics. 6 (December), 35-40 (2012).
- Aquila, A., et al. Time-resolved protein nanocrystallography using an X-ray free-electron laser. Optics express. 20 (3), 2706-2716 (2012).
- Panneels, V., et al. Time-resolved structural studies with serial crystallography: A new light on retinal proteins. Structural Dynamics. 2 (4), 041718 (2015).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Pande, K., et al. Femtosecond structural dynamics drives the trans/cis isomerization in photoactive yellow protein. Science (New York, N.Y.). 352 (6286), 725-729 (2016).
- Barends, T. R. M., et al. Direct observation of ultrafast collective motions in CO myoglobin upon ligand dissociation. Science (New York, N.Y.). 350 (6259), 445-450 (2015).
- Nango, E., et al. A three-dimensional movie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Nogly, P., et al. Retinal isomerization in bacteriorhodopsin captured by a femtosecond x-ray laser. Science. 0094 (June), (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2017).
- Kupitz, C., et al. Serial time-resolved crystallography of photosystem II using a femtosecond X-ray laser. Nature. , (2014).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Stagno, J. R., et al. Structures of riboswitch RNA reaction states by mix-and-inject XFEL serial crystallography. Nature. 541 (7636), 242-246 (2017).
- Wang, D., Weierstall, U., Pollack, L., Spence, J. C. H. Liquid Mixing Jet for XFEL Study of Chemical Kinetics. Journal of synchrotron radiation. , 1364-1366 (2014).
- Hekstra, D. R., White, K. I., Socolich, M. A., Henning, R. W., Šrajer, V., Ranganathan, R. Electric-field-stimulated protein mechanics. Nature. 540 (7633), 400-405 (2016).
- Liu, W., Ishchenko, A., Cherezov, V. Preparation of microcrystals in lipidic cubic phase for serial femtosecond crystallography. Nature. 9 (9), 2123-2134 (2014).
- Kupitz, C., Grotjohann, I., Conrad, C. E., Roy-Chowdhury, S., Fromme, R., Fromme, P. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological sciences. 369 (1647), (2014).
- Falkner, J. C., et al. Generation of Size-Controlled, Submicrometer Protein Crystals. Chemistry of Materials. 17 (10), 2679-2686 (2005).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature communications. 5, 3309 (2014).
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: a novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences of the United States of America. 93 (December), 14532-14535 (1996).
- Caffrey, M. A comprehensive review of the lipid cubic phase or in meso method for crystallizing membrane and soluble proteins and complexes. Acta Crystallographica Section F Structural Biology Communications. 71 (1), 3-18 (2015).
- Cherezov, V. Lipidic cubic phase technologies for membrane protein structural studies. Current Opinion in Structural Biology. 21 (4), 559-566 (2011).
- Conrad, C. E., et al. A novel inert crystal delivery medium for serial femtosecond crystallography. IUCrJ. 2 (4), 421-430 (2015).
- Sugahara, M., et al. Hydroxyethyl cellulose matrix applied to serial crystallography. Scientific Reports. 7 (1), 703 (2017).
- Sugahara, M., et al. Grease matrix as a versatile carrier of proteins for serial crystallography. Nature Methods. 12 (1), 61-63 (2014).
- Sugahara, M., et al. Oil-free hyaluronic acid matrix for serial femtosecond crystallography. Scientific Reports. 6 (1), 24484 (2016).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Kovácsová, G., et al. Viscous hydrophilic injection matrices for serial crystallography. IUCrJ. 4 (4), 400-410 (2017).
- Martin-Garcia, J. M., et al. Serial millisecond crystallography of membrane and soluble protein microcrystals using synchrotron radiation. IUCrJ. 4 (4), 439-454 (2017).
- Fromme, R., et al. Serial femtosecond crystallography of soluble proteins in lipidic cubic phase. IUCrJ. 2, 545-551 (2015).
- Caffrey, M., Li, D., Howe, N., Shah, S. T. A. "Hit and run" serial femtosecond crystallography of a membrane kinase in the lipid cubic phase. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130621 (2014).
- Liu, W., et al. Serial femtosecond crystallography of G protein-coupled receptors. Science (New York, N.Y.). 342 (6165), 1521-1524 (2013).
- Zhang, H., et al. Structure of the Angiotensin Receptor Revealed by Serial Femtosecond Crystallography. Cell. 161 (4), 833-844 (2015).
- Fenalti, G., et al. Structural basis for bifunctional peptide recognition at human δ-opioid receptor. Nature Structural & Molecular Biology. (February), (2015).
- Kang, Y., et al. Crystal structure of rhodopsin bound to arrestin by femtosecond X-ray laser. Nature. 523 (7562), 561-567 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and Delivery of Protein Microcrystals in Lipidic Cubic Phase for Serial Femtosecond Crystallography. Journal of Visualized Experiments. 9 (115), 2123-2134 (2016).
- Batyuk, A., et al. Native phasing of x-ray free-electron laser data for a G protein-coupled receptor. Science Advances. 2 (9), e1600292 (2016).
- Nakane, T., et al. Native sulfur/chlorine SAD phasing for serial femtosecond crystallography. Acta Crystallographica Section D Biological Crystallography. 71 (12), 2519-2525 (2015).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tosha, T., et al. Capturing an initial intermediate during the P450nor enzymatic reaction using time-resolved XFEL crystallography and caged-substrate. Nature Communications. 8 (1), 1585 (2017).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314 (2016).
- Abela, R., et al. Perspective: Opportunities for ultrafast science at SwissFEL. Structural Dynamics. 4 (6), 061602 (2017).
- Marx, V. Structural biology: doors open at the European XFEL. Nature Methods. 14 (9), 843-846 (2017).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chemistry and Physics of Lipids. 95 (1), 11-21 (1998).
- Qiu, H., Caffrey, M. The phase diagram of the monoolein/water system: Metastability and equilibrium aspects. Biomaterials. 21 (3), 223-234 (2000).
- James, D. . Injection Methods and Instrumentation for Serial X-ray Free Electron Laser Experiments. , (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Moffat, K. Femtosecond structural photobiology. Science (New York, N.Y.). 361 (6398), 127-128 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유