È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Miglioramento di estrusione ad alta viscosità di microcristalli per Time-resolved Serial Femtosecond cristallografia a raggi x laser
In questo articolo
Riepilogo
Il successo di un esperimento di cristallografia risolti in tempo ai femtosecondi seriale dipende dalla consegna efficiente dei campioni. Qui, descriviamo protocolli per ottimizzare l'estrusione di microcristalli bacteriorhodopsin da un iniettore di micro-estrusione ad alta viscosità. La metodologia si basa sull'omogeneizzazione del campione con un romanzo accoppiatore di tre vie e la visualizzazione con una telecamera ad alta velocità.
Abstract
Iniettori di micro-estrusione ad alta viscosità hanno ridotto drasticamente il consumo del campione nel serial femtosecond cristallografici esperimenti (SFX) al laser a elettroni liberi a raggi x (XFELs). Una serie di esperimenti utilizzando la batteriorodopsina pompa protonica luce-driven ulteriormente hanno stabilito questi iniettori come un'opzione preferita di consegnare cristalli per risolti in tempo ai femtosecondi seriale cristallografia (TR-SFX) risolvere le modifiche strutturali del proteine dopo fotoattivazione. Per ottenere più strutturali istantanee di alta qualità, è essenziale per raccogliere grandi quantità di dati e garantire la liquidazione dei cristalli tra ogni impulso del laser di pompa. Qui, descriviamo in dettaglio come abbiamo ottimizzato l'estrusione di microcristalli bacteriorhodopsin per i nostri esperimenti di TR-SFX risale alle origine Linac della luce coerente (LCL). L'obiettivo del metodo è quello di ottimizzare estrusione per un flusso stabile e continuo, mantenendo un'alta densità di cristalli per aumentare il tasso a cui i dati possono essere raccolti in un TR-SFX sperimentare. Raggiungiamo questo obiettivo attraverso la preparazione di fase lipidica cubico con una distribuzione omogenea dei cristalli utilizzando una siringa di tre vie romanzo dispositivo seguito regolando la composizione del campione sulla base di misurazioni della stabilità dell'estrusione scattate con un'alta velocità di attacco installazione della telecamera. La metodologia può essere adattata per ottimizzare il flusso di altri microcristalli. L'installazione sarà disponibile per gli utenti del nuovo stabilimento svizzero Free Electron Laser.
Introduzione
Seriale a femtosecondi cristallografia (SFX) è una tecnica di biologia strutturale che sfrutta le proprietà uniche dei raggi x laser ad elettroni liberi (XFEL) per determinare le strutture di temperatura ambiente da migliaia di cristalli di dimensioni micrometriche mentre outrunning la maggior parte delle il danno da radiazione della "diffrazione prima distruzione" principio1,2,3.
In un'estensione di tempo-risolta di SFX (TR-SFX), gli impulsi a femtosecondi dal XFEL sono utilizzati per studiare i cambiamenti strutturali in proteine4,5. La proteina di interesse viene attivata con un laser ottico (o un'altra attività trigger) appena prima di essere ripresi da XFEL in un'installazione di pompa-sonda. Controllando con precisione il ritardo tra gli impulsi di pompa e sonda, la proteina dell'obiettivo possa essere catturata in Stati diversi. Film molecolare dei cambiamenti strutturali nel corso di undici ordini di grandezza in tempo dimostrare il potere delle nuove fonti XFEL per studiare la dinamica di diverse proteine target6,7,8,9, 10,11,12,13. Principalmente, il metodo unisce le tecniche strutturali con spettroscopiche e statiche dinamiche in uno, fornendo un assaggio nelle dinamiche di proteina a vicino a risoluzione atomica.
Sistemi semplici per TR-SFX possono contenere un trigger endogeno di attivazione con un componente fotosensibile come retinica bacteriorhodopsin (bR)9,10, i cromofori nel fotosistema II12,13, proteina gialla fotoattivi (PYP)6,7 reversibilmente fotomodulabili proteina fluorescente11, o un monossido di carbonio photolyzable in mioglobina8. Emozionanti varianti della tecnica ancora in fase di sviluppo si basano su mix e iniettare schemi14,15 per studiare le reazioni enzimatiche o un campo elettrico usato per indurre cambiamenti strutturali16. Dato che fonti XFEL sono rese disponibili solo per pochi anni e l'estrapolazione successi del passato verso il futuro, il metodo Mostra il potenziale come un vero e proprio gioco-changer rispetto alla nostra comprensione di come funzione di proteine.
Perché campioni biologici sono distrutti da una singola esposizione a un'ad alta potenza impulso XFEL, nuovi approcci alla cristallografia di proteine erano necessari. Tra queste procedure, la capacità di crescere grandi quantità di microcristalli uniforme doveva essere sviluppato17,18,19. Per abilitare la raccolta di dati a un XFEL, questi cristalli devono essere consegnati, scartati e poi rinnovati per ogni impulso XFEL. Dato che XFELs fuoco utilizzabili impulsi a 10-120 Hz, consegna del campione deve essere veloce, stabile e affidabile, mantenendo anche i cristalli intatto e limitando il consumo. Tra le soluzioni di maggior successo è un iniettore di micro-estrusione ad alta viscosità, che trasporta un continiously colonna della temperatura ambiente crystal-carico lipidico cubi fase (LCP) in streaming attraverso il pulsato di fascio raggi x20. Cristalli orientati casualmente, incorporate nel flusso di LCP, che vengono intercettati dallo spargimento di impulsi XFEL raggi x su un rivelatore dove si è registrato un pattern di diffrazione. LCP è stata una scelta naturale per un mezzo di consegna del campione, poiché viene frequentemente utilizzata come mezzo di crescita per membrana proteina cristalli17,21,22,23, ancora altri supporti informatici di alta viscosità 24,25,26,27,28,29,30 e31 di proteine solubili sono stati utilizzati anche nell'iniettore. SFX con l'iniettore ad alta viscosità è riuscita durante la determinazione della struttura della membrana proteine13,32 compreso il G proteina-ha accoppiato i ricevitori (GPCR)33,34, 36, 35,37, con qualità di dati sufficiente per nativo phasing38,39 pur essendo esempio efficiente e tempo. Attualmente, questi iniettori vengono utilizzati più ordinariamente per misure di temperatura al sincrotrone fonti28,30,40,41 , così come durante il più tecnicamente esigente esperimenti TR-SFX a XFELs9,10,13,42.
Esperimenti di TR-SFX paragonabili sono stati effettuati utilizzando altri tipi di iniettori come fase liquida consegna in un flusso concentrato di ugello6,7,12, tuttavia, questo metodo richiede una quantità di proteina non è disponibile per molti biologicamente interessanti destinazioni. Per la determinazione delle strutture statiche mediante estrusione viscoso un consumo medio di 0,072 mg di proteina per diffrazione 10.000 indicizzate rispetto alle 9,35 mg per il getto di liquido ugelli sono stati segnalati (cioè circa 130 volte più campione efficiente)20. L'iniettore ad alta viscosità ha dimostrato di essere un dispositivo di consegna campione valido per TR-SFX mentre solo sacrificare alcuni di questo esempio efficienza43. In Nogly et al (2018)10, ad esempio, il consumo del campione era circa 1,5 mg per 10.000 modelli indicizzate, che paragona favorevole a simili esperimenti di TR-SFX utilizzando il PYP dove il consumo medio del campione era molto più alto con 74 mg di proteina per 10.000 indicizzata modelli6. Iniettori ad alta viscosità sono così evidenti vantaggi quando sta limitando la quantità di proteina disponibile o quando cristalli sono coltivati direttamente in LCP.
Per TR-SFX utilizzando ad alta viscosità iniettori a cedere i dati più affidabili diversi problemi tecnici devono essere affrontate: la velocità di flusso deve rimanere sopra un minimo valore critico; la hit-rate dovrebbe essere mantenuta ad un livello che non esegue il rendering lento di raccolta di dati (ad es., superiore al 5%); e campione deve essere consegnato senza eccessive interruzioni. Idealmente, questi requisiti sono già soddisfatti molto prima che un esperimento di TR-SFX pianificato per utilizzare il tempo disponibile XFEL efficientemente come possibile. Primis, un rallentamento del flusso di LCP può permettere di cristalli che sono stati attivati con più di un impulso laser ottico e risultato in Stati attivi misti di sondaggio sondaggio materiale pompato quando umpumped materiale è previsto nel fascio. Un ulteriore vantaggio dell'iniezione pre-test è che i tempi di inattività durante la raccolta di dati presso un XFEL è ridotta a icona come tempo relegato alla sostituzione ugelli intasati, cambiando i campioni non-espulsione, e altre attività di manutenzione è ridotto.
Qui, presentiamo un metodo per ottimizzare la consegna del campione per la raccolta di dati di TR-SFX con un iniettore di micro-estrusione ad alta viscosità. Per semplicità, i metodi descritti non si basano sull'accesso ad una sorgente di raggi x, anche se lavoro presso un sincrotrone beamline29 sarebbe fornire ulteriori informazioni sui tassi di successo previsti e diffrazione di cristallo. I nostri protocolli sono stati sviluppati per ottimizzare gli esperimenti per catturare isomerizzazione retinica nella pompa protonica bacteriorhodopsin10 e sono svolte in due fasi a partire con la preparazione dei campioni di cristallo per estrusione seguita monitorando l'estrusione utilizzando un programma di installazione di telecamere ad alta velocità. Nella prima fase, il LCP carichi di cristallo è mescolato con ulteriori LCP, lipidi di transizione bassa temperatura o altri additivi per garantire che la miscela finale è adatta per il recapito nell'ambiente campione senza intasamento o rallentando. Un nuovo coupler siringa a tre vie è stato sviluppato per migliorare la miscelazione omogeneità delle prestazioni e del campione. La seconda fase è costituito da una prova di estrusione registrata da una telecamera ad alta velocità per misurare direttamente la stabilità di velocità di estrusione. In seguito all'analisi dei dati video, possono effettuare regolazioni per il protocollo di preparazione del campione per migliorare i risultati sperimentali. Queste procedure possono essere adattate per preparare altre proteine per la raccolta di dati di TR-SFX, con modifiche minime e contribuiranno all'uso efficiente delle limitate XFEL valutazione. Con nuove strutture XFEL appena iniziando la loro operazione44,45 e il trasferimento dei metodi di raccolta dati seriale basata su iniettore a sincrotroni28,30,40,41 , nei prossimi anni saranno sicuramente continuerà a fornire emozionanti nuove intuizioni le dinamiche strutturali di una gamma sempre più ampia di bersagli proteici.
Protocollo
1. preparazione del campione di cristallo proteina
- Circa 30 min prima il campione deve essere iniettato, carico 50 µ l di monoolein carichi di cristallo base LCP in siringa 100 µ l.
- Per l'iniezione a pressione atmosferica: carico 10 µ l di paraffina liquida nel retro di una seconda siringa. Tenendo la siringa in posizione verticale, espellere le bolle d'aria dalla siringa.
- Per iniezione in ambiente sottovuoto: carico 5 µ l di MAG 7,9 e 5 µ l di paraffina liquida nel retro di una seconda siringa. Tenendo la siringa in posizione verticale, espellere le bolle d'aria dalla siringa.
- Collegare la siringa con paraffina/MAG 7,9 per un accoppiatore di siringa standard, spurgare l'aria dall'accoppiatore premendo delicatamente lo stantuffo fino a un piccolo volume (< 1 µ l) di paraffina/lipidica è visibile sulla punta dell'ago accoppiatore.
- Collegare la siringa di esempio per l'accoppiatore di siringa, avendo cura di non introdurre aria nel campione. Mescolarvi il lipido/paraffina passando il materiale campione attraverso l'accoppiatore più volte.
- Caricate 20 µ l di premiscelati LCP (27% PEG, 100 mM pH Sorensen 5.6 + MO) in un altro 100 µ l siringa. Rimuovere le bolle d'aria come necessario.
- Rimuovere la siringa vuota dall'accoppiatore e allegare il LCP premiscelata al cristallo contenente la siringa utilizzando un accoppiatore di siringa standard. Passare il campione attraverso l'accoppiatore 100 volte.
Nota: Esempio di miscelazione può riscaldare il campione leggermente46. Miscelazione deve essere eseguita ad un ritmo lento dove la temperatura del campione può essere ritenuta ragionevolmente costante. - Ispezionare il campione per trasparenza contro una sorgente di luce. Se si è formato un LCP chiaro omogeneo, andare al passaggio 1,9.
- Per portare il campione nella fase cubica, aggiungere 3 µ l di monoolein e mescolare 50 volte (come descritto sopra). Ripetere questa procedura fino a quando una fase trasparente ha formato per evitare un eccesso di monoolein.
Nota: La formazione di LCP è temperatura dipendente47 e migliori risultati si ottengono leggermente di sopra di 20 ° C. La quantità di monoolein ulteriori necessarie dipenderà il volume di soluzione precipitante residui riportato da cristallizzazione. - Come preliminare testare campione rigidità (come previsto dalla fase di LCP) e capacità di estrusione, staccare la siringa vuota dall'accoppiatore di siringa e, tenendo la siringa in posizione verticale, spremere una piccola quantità di campione (< 2 µ l) attraverso l'accoppiatore. Se il campione estruso forma un cilindro verticale, il campione è pronto per il collaudo di estrusione.
- Regolare il volume totale del campione a 100 µ l aggiungendo più premiscelato LCP (come al punto 1.5).
- Collegare la siringa campione e due siringhe vuote per l'accoppiatore di siringa a tre vie (spurgo aria da accoppiatore come prima). Mescolare almeno 50 volte (o fino a quando non omogeneo) passando metà del campione nella seconda siringa e quindi premendo contemporaneamente entrambe le metà del campione nella siringa terza.
- Posizionare la siringa contenente il campione miscelato al microscopio stereo per verificare una distribuzione omogenea dei cristalli.
2. estrusione di esempio utilizzando una configurazione di macchina fotografica ad alta velocità di prova
- Determinazione parametri sperimentali.
- Selezionare le dimensioni dell'ugello per il test.
Nota: Ugelli sono in genere 50 o 75 µm diametro interno (ID), ma qualsiasi dimensione da circa 30-100 µm ID può essere considerato. Selezione si basa su un equilibrio tra tempo medio di intasamento, sfondo scattering, consumo del campione e tasso di successo. - Calcolare la velocità di flusso ottimale basato sulla dimensione dello spot laser sperimentale (diametro2 1/e) e il piano di raccolta di dati (ad es., interleaved chiaro e scuro) che verrà utilizzato presso il XFEL.
- Calcolare la portata desiderata (
 ) del campione dalla velocità di flusso ottimale (
) del campione dalla velocità di flusso ottimale (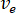 ) e il diametro dell'ugello selezionato (
) e il diametro dell'ugello selezionato (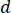 ):
):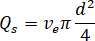
Determinare il tasso di flusso (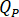 ) che devono essere immessi alla pompa HPLC in base al fattore di amplificazione (
) che devono essere immessi alla pompa HPLC in base al fattore di amplificazione (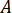 ) dell'iniettore.
) dell'iniettore.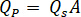
Calcolare la pressione massima (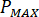 ) da pressione nominale dei raccordi ugello (
) da pressione nominale dei raccordi ugello (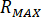 ) e il fattore di amplificazione dell'iniettore (
) e il fattore di amplificazione dell'iniettore (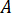 ):
):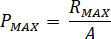
- Selezionare le dimensioni dell'ugello per il test.
- Installazione dell'iniettore di estrusione ad alta viscosità per l'utilizzo offline come mostrato in Figura 1.
Nota: Le funzioni di iniettore per estrusione a idraulico alimentato da una pompa HPLC e utilizza una guaina di gas elio co-fluente comandata da un regolatore di gas. Il programma di installazione di pompa e regolatore non sono discussi in questo protocollo. Vedere capitolo quattro James (2015)48 per un manuale dettagliato.- Spurgare la pompa e tutte le linee d'acqua per garantire che le portate sono accurate. Eliminare la fase idraulico dell'iniettore.
- Montare l'iniettore (o la fotocamera) su un palcoscenico di tre assi per facilitare l'inquadratura e messa a fuoco per i video ad alta velocità. Lasciare spazio attorno al punto di iniezione per la lente obiettiva, illuminazione, schermo riflettente e un piccolo Becher per prendere il campione esaurito.
- Costruire un ugello"fittizio" (un serbatoio vuoto con un ugello collegato) e installarlo sull'iniettore per facilitare il posizionamento, la messa a fuoco e l'illuminazione.
- Montare la videocamera ad alta velocità con la punta di ugello vicino al punto focale dell'obiettivo.
- Posizionare lo schermo riflettente dietro l'iniettore e regolare l'illuminazione per luce frontale l'ugello.
- Accendere e collegare la telecamera con il software in dotazione. Con un video live in esecuzione per il feedback visivo, posizionare la punta dell'ugello al centro del telaio e portarlo a fuoco con la tappa di tre assi.
- Regolare l'illuminazione fino a quando l'ugello è chiaramente visibile e lo sfondo è uniformemente illuminato.
- Configurazione della videocamera per registrare un video time-lapse ad alta velocità.
- Impostare framerate a 1000 fps. Impostare la risoluzione a 512 x 512 pixel.
- Con il tempo di esposizione ora impostato il frame rate, regolare il livello di illuminazione fino a quando l'ugello è visibile (cioè, non sotto- o sovraesposta). Riposizionare la punta dell'ugello in modo che si è centrato a sinistra a destra e si trova nel terzo superiore del telaio.
- Eseguire qualsiasi correzione di fondo o le operazioni di bilanciamento del bianco.
- Impostare la fotocamera in modalità Time-lapse. Intervallo di 30 s e si ripete a 40 volte, impostare la modalità di trigger a casuale (o reset casuale) e immettere il numero di fotogrammi per registrare a 1000.
- Caricare il serbatoio con 20 µ l del campione da analizzare e attaccare l'ugello capillare.
- Fissare il serbatoio riempito all'iniettore. Collegare la tubazione del gas alla porta sull'ugello e iniziare il flusso di gas.
- Manualmente è possibile avanzare il pistone aprendo la valvola in linea e premendo la siringa. Quando il pistone rende solido contatto con il campione nel serbatoio, chiudere la valvola.
- Programmare la pompa con la portata calcolata e la pressione massima al valore calcolato (Vedi punto 2.1.3).
- Avviare simultaneamente la pompa e la registrazione.
- Come inizia l'estrusione, regolare la pressione del gas per aumentare la stabilità. Aumentare la pressione del gas se il liquido forma una goccia sulla punta dell'ugello invece di una colonna. Diminuzione della pressione se l'estrusione è rotto a causa di eccessivo taglio dal flusso del gas, o è oscillante rapidamente (da montare).
- Monitorare l'estrusione (10 min è solitamente sufficiente per riconoscere una condizione di flusso omogeneo) e, quando la pressione della pompa acutamente rampe vicino la data di fine prevista, interrompere la registrazione, spegnere la pompa e sfogare la pressione del sistema aprendo la valvola di sfiato.
- Analisi dei file video
Nota: Estrusione di campione che è chiaramente inadeguato non richiede un'analisi dettagliata. Tuttavia, è ancora utile identificare la modalità di guasto, in modo che il campione può essere ottimizzato.- Aprire il file video con il software di analisi (ad es., Fiji49) e calibrare gli strumenti di misurazione.
- Calibrare le misure selezionando una linea di lunghezza nota nell'immagine video con lo strumento di selezione di linea. Aprire la finestra Imposta scala via Analyze | Impostare la scala e immettere la distanza nota e le unità di misura.
Nota: Il diametro dell'ugello noto fornisce una lunghezza adeguata calibrazione per queste misurazioni. - Trovare un fotogramma del video dove c'è una caratteristica tracciabile visibile (ad esempio, un cristallo) nell'estrusione. Registrare il numero di telaio.
- Avanzare il video un fotogramma dove la stessa caratteristica è visibile ma ha spostato dalla sua posizione nel passaggio precedente. Registrare il numero di telaio.
- Utilizzando lo strumento di misurazione di linea retta, misurare la distanza dall'inizio della funzionalità e dell'endpoint tramite Analyze | Misura.
Nota: Più lunga la distanza tracciabile, i meno errori nella misurazione influenzerà i calcoli - Calcolare la velocità di getto dalla distanza misurata e il tempo trascorso (il numero di fotogrammi trascorsi diviso per framerate).
- Ripetere i passaggi 2.11.3-2.11.6 un paio di volte per ogni segmento del video.
- Tracciare le serie di dati come in Figura 2.
Risultati
Il materiale di partenza ideale per le procedure qui descritte (Figura 3) sono alte densità di microcristalli incorporato nel mezzo viscoso dell'elemento portante per l'iniettore. La procedura richiede circa 50 µ l di cristallo laden elemento portante per ogni preparazione. Questi possono essere coltivati direttamente in LCP come con il bR9,10 utilizzato qui, come esempio (Figur...
Discussione
Il metodo di TR-SFX con l'iniettore di estrusione viscoso ha dimostrato di essere una tecnica valida per gli studi di dinamica strutturale di bacteriorhodopsin9,10 e fotosistema II13 e ora sembra pronto a studiare proteine guida altro processi biologici foto ad esempio trasporto di ioni luce-driven o percezione sensoriale5,50. I protocolli descritti sopra sono stati progettati per ...
Divulgazioni
Gli autori non dichiarano nessun conflitto di interessi.
Riconoscimenti
Riconosciamo Gebhard Schertler, Rafael Abela e Chris Milne per sostenere l'uso di iniettori ad alta viscosità allo PSI. Richard Neutze e il suo team sono riconosciuti per le discussioni sulla cristallografia risolta in tempo e consegna del campione usando gli iniettori ad alta viscosità. Sostegno finanziario, riconosciamo la Swiss National Science Foundation per sovvenzioni 31003A_141235, 31003A_159558 (a J.S.) e PZ00P3_174169 (a P.N.). Questo progetto ha ricevuto finanziamenti dal programma di innovazione nell'ambito della sovvenzione Marie Sklodowska-Curie accordo No 701646 e ricerca Orizzonte 2020 dell'Unione europea.
Materiali
| Name | Company | Catalog Number | Comments |
| Mosquito LCP Syringe Coupling | TTP labtech store | 3072-01050 | |
| Hamilton Syringe 1710 RNR, 100 µl | Hamilton | HA-81065 | |
| Hamilton Syringe 1750 RNR, 500 µl | Hamilton | HA-81265 | |
| Monoolein | Nu-Chek Prep, Inc. | M-239 | |
| 7.9 MAG | Avanti Polar Lipids Inc. | 850534O | |
| 50% w/v PEG 2000 | Molecular Dimensions | MD2-250-7 | |
| Paraffin (liquid) | Sigma-Aldrich | 1.07162 | |
| High speed camera | Photron | Photron Mini AX | |
| High magnification lens | Navitar | 12X Zoom Lens System | |
| Three axis stage | ThorLabs | PT3/M | |
| Fiber light | Thorlabs | OSL2 | |
| Fused silica fiber | Molex/Polymicro | TSP-505375 | |
| Lite touch ferrule | IDEX | LT-100 | |
| ASU high viscosity injector | Arizona State University | Purchasable from Uwe Weierstall (weier@asu.edu) | |
| HPLC pump | Shimadzu | LC-20AD | |
| Electronic gas regulator | Proportion Air | GP1 |
Riferimenti
- Neutze, R., Wouts, R., van der Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-77 (2011).
- Barty, A., et al. Self-terminating diffraction gates femtosecond X-ray nanocrystallography measurements. Nature photonics. 6 (December), 35-40 (2012).
- Aquila, A., et al. Time-resolved protein nanocrystallography using an X-ray free-electron laser. Optics express. 20 (3), 2706-2716 (2012).
- Panneels, V., et al. Time-resolved structural studies with serial crystallography: A new light on retinal proteins. Structural Dynamics. 2 (4), 041718 (2015).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Pande, K., et al. Femtosecond structural dynamics drives the trans/cis isomerization in photoactive yellow protein. Science (New York, N.Y.). 352 (6286), 725-729 (2016).
- Barends, T. R. M., et al. Direct observation of ultrafast collective motions in CO myoglobin upon ligand dissociation. Science (New York, N.Y.). 350 (6259), 445-450 (2015).
- Nango, E., et al. A three-dimensional movie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Nogly, P., et al. Retinal isomerization in bacteriorhodopsin captured by a femtosecond x-ray laser. Science. 0094 (June), (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2017).
- Kupitz, C., et al. Serial time-resolved crystallography of photosystem II using a femtosecond X-ray laser. Nature. , (2014).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Stagno, J. R., et al. Structures of riboswitch RNA reaction states by mix-and-inject XFEL serial crystallography. Nature. 541 (7636), 242-246 (2017).
- Wang, D., Weierstall, U., Pollack, L., Spence, J. C. H. Liquid Mixing Jet for XFEL Study of Chemical Kinetics. Journal of synchrotron radiation. , 1364-1366 (2014).
- Hekstra, D. R., White, K. I., Socolich, M. A., Henning, R. W., Šrajer, V., Ranganathan, R. Electric-field-stimulated protein mechanics. Nature. 540 (7633), 400-405 (2016).
- Liu, W., Ishchenko, A., Cherezov, V. Preparation of microcrystals in lipidic cubic phase for serial femtosecond crystallography. Nature. 9 (9), 2123-2134 (2014).
- Kupitz, C., Grotjohann, I., Conrad, C. E., Roy-Chowdhury, S., Fromme, R., Fromme, P. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological sciences. 369 (1647), (2014).
- Falkner, J. C., et al. Generation of Size-Controlled, Submicrometer Protein Crystals. Chemistry of Materials. 17 (10), 2679-2686 (2005).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature communications. 5, 3309 (2014).
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: a novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences of the United States of America. 93 (December), 14532-14535 (1996).
- Caffrey, M. A comprehensive review of the lipid cubic phase or in meso method for crystallizing membrane and soluble proteins and complexes. Acta Crystallographica Section F Structural Biology Communications. 71 (1), 3-18 (2015).
- Cherezov, V. Lipidic cubic phase technologies for membrane protein structural studies. Current Opinion in Structural Biology. 21 (4), 559-566 (2011).
- Conrad, C. E., et al. A novel inert crystal delivery medium for serial femtosecond crystallography. IUCrJ. 2 (4), 421-430 (2015).
- Sugahara, M., et al. Hydroxyethyl cellulose matrix applied to serial crystallography. Scientific Reports. 7 (1), 703 (2017).
- Sugahara, M., et al. Grease matrix as a versatile carrier of proteins for serial crystallography. Nature Methods. 12 (1), 61-63 (2014).
- Sugahara, M., et al. Oil-free hyaluronic acid matrix for serial femtosecond crystallography. Scientific Reports. 6 (1), 24484 (2016).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Kovácsová, G., et al. Viscous hydrophilic injection matrices for serial crystallography. IUCrJ. 4 (4), 400-410 (2017).
- Martin-Garcia, J. M., et al. Serial millisecond crystallography of membrane and soluble protein microcrystals using synchrotron radiation. IUCrJ. 4 (4), 439-454 (2017).
- Fromme, R., et al. Serial femtosecond crystallography of soluble proteins in lipidic cubic phase. IUCrJ. 2, 545-551 (2015).
- Caffrey, M., Li, D., Howe, N., Shah, S. T. A. "Hit and run" serial femtosecond crystallography of a membrane kinase in the lipid cubic phase. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130621 (2014).
- Liu, W., et al. Serial femtosecond crystallography of G protein-coupled receptors. Science (New York, N.Y.). 342 (6165), 1521-1524 (2013).
- Zhang, H., et al. Structure of the Angiotensin Receptor Revealed by Serial Femtosecond Crystallography. Cell. 161 (4), 833-844 (2015).
- Fenalti, G., et al. Structural basis for bifunctional peptide recognition at human δ-opioid receptor. Nature Structural & Molecular Biology. (February), (2015).
- Kang, Y., et al. Crystal structure of rhodopsin bound to arrestin by femtosecond X-ray laser. Nature. 523 (7562), 561-567 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and Delivery of Protein Microcrystals in Lipidic Cubic Phase for Serial Femtosecond Crystallography. Journal of Visualized Experiments. 9 (115), 2123-2134 (2016).
- Batyuk, A., et al. Native phasing of x-ray free-electron laser data for a G protein-coupled receptor. Science Advances. 2 (9), e1600292 (2016).
- Nakane, T., et al. Native sulfur/chlorine SAD phasing for serial femtosecond crystallography. Acta Crystallographica Section D Biological Crystallography. 71 (12), 2519-2525 (2015).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tosha, T., et al. Capturing an initial intermediate during the P450nor enzymatic reaction using time-resolved XFEL crystallography and caged-substrate. Nature Communications. 8 (1), 1585 (2017).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314 (2016).
- Abela, R., et al. Perspective: Opportunities for ultrafast science at SwissFEL. Structural Dynamics. 4 (6), 061602 (2017).
- Marx, V. Structural biology: doors open at the European XFEL. Nature Methods. 14 (9), 843-846 (2017).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chemistry and Physics of Lipids. 95 (1), 11-21 (1998).
- Qiu, H., Caffrey, M. The phase diagram of the monoolein/water system: Metastability and equilibrium aspects. Biomaterials. 21 (3), 223-234 (2000).
- James, D. . Injection Methods and Instrumentation for Serial X-ray Free Electron Laser Experiments. , (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Moffat, K. Femtosecond structural photobiology. Science (New York, N.Y.). 361 (6398), 127-128 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon