Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verbesserung der hohen Viskosität Extrusion der Mikrokristalle für zeitaufgelöste serielle Femtosekunden Kristallographie an x-ray Laser
In diesem Artikel
Zusammenfassung
Der Erfolg eines seriellen Femtosekunden zeitaufgelöste Kristallographie Experiments ist effiziente Musterlieferung abhängig. Hier beschreiben wir Protokolle, um die Extrusion von Bakteriorhodopsin Mikrokristalle aus eine hohe Viskosität Mikro-Extrusion Injektor zu optimieren. Die Methodik setzt auf Probe Homogenisierung mit einem neuartigen Dreiwege Kupplung und Visualisierung mit einer Highspeed-Kamera.
Zusammenfassung
Hoher Viskosität Mikro-Extrusion Injektoren haben dramatisch Probe in seriellen Femtosekunden kristallographischen Experimente (SFX) auf Röntgen-freie-Elektronen-Laser (XFELs) reduziert. Eine Reihe von Experimenten mit der lichtgetriebenen Proton Pumpe Bakteriorhodopsin haben als bevorzugte Option Kristalle für serielle Femtosekunden zeitaufgelöste Kristallographie (TR-SFX) strukturelle Veränderungen des aufzulösenden liefern diese Injektoren festgestellt Proteine nach Photoaktivierungen. Um mehrere strukturelle Momentaufnahmen von hoher Qualität zu erhalten, ist es wichtig, große Mengen an Daten zu sammeln und Abfertigung der Kristalle zwischen jedem Laserpuls Pumpe zu gewährleisten. Hier beschreiben wir ausführlich, wie wir die Extrusion von Bakteriorhodopsin Mikrokristalle für unsere jüngsten TR-SFX-Experimente an Linac kohärentes Licht Quelle (LCLS) optimiert. Das Ziel der Methode ist es, Extrusion für eine stabile und kontinuierliche Strömung unter Beibehaltung einer hohen Dichte von Kristallen, die Rate zu erhöhen optimieren experimentieren, auf welche Daten in einem TR-SFX aufgefangen werden können. Dieses Ziel erreichen wir durch die Ausarbeitung von Lipid-kubische Phase mit einer homogenen Verteilung der Kristalle mit einer neuartigen Dreiwege Spritze Gerät gefolgt durch Anpassen der Probenzusammensetzung basierend auf Messungen der Extrusion Stabilität genommen mit einer Highspeed-Kupplung Kamera-Setup. Die Methodik kann den Fluss der anderen Mikrokristalle optimieren angepasst werden. Das Setup wird für die Nutzer der neuen Schweizer freie-Elektronen-Laser-Anlage zur Verfügung.
Einleitung
Serielle Femtosekunden Kristallographie (SFX) ist eine strukturelle Biologie-Technik, die die einzigartigen Eigenschaften des Röntgen-freie-Elektronen-Laser (XFEL) auf Raumtemperatur Strukturen bestimmen nutzt aus Tausenden von Mikrometer große Kristalle während schneller als die meisten die Strahlenschäden durch den "Beugung vor Zerstörung" Prinzip1,2,3.
In einer zeitaufgelösten Verlängerung von SFX (TR-SFX) dienen der Femtosekunden-Impulse aus der XFEL, strukturelle Veränderungen in Proteine4,5zu studieren. Das Protein des Interesses ist mit einem optischen Laser (oder eine andere Aktivität Trigger) kurz vor dem Schuss von XFEL in einem Pumpe-Sonde-Setup aktiviert. Durch die präzise Steuerung die Verzögerung zwischen Pumpe und Sonde Impulsen, kann das Zielprotein in verschiedenen Staaten erfasst werden. Molekulare Filme von strukturellen Veränderungen über elf Größenordnungen in der Zeit demonstrieren die Macht der neuen XFEL-Quellen, die Dynamik von mehreren Protein Ziele6,7,8,9zu studieren, 10,11,12,13. Grundsätzlich schließt sich die Methode der dynamischen spektroskopischen und statische strukturelle Techniken ineinander, bietet einen Einblick in Proteindynamik am in der Nähe von atomarer Auflösung.
Einfache Systeme für TR-SFX enthalten eine endogene Auslöser der Aktivierung mit einer lichtempfindlichen Komponente wie Retinal in Bakteriorhodopsin (bR)9,10, die Chromophore in Photosystem II12,13, photoaktiven gelbe Protein (PYP)6,7 reversibel photoschaltbare fluoreszierendes Protein11oder eine Photolyzable Kohlenmonoxid in Myoglobin8. Spannende Varianten der Technik noch in der Entwicklung setzen auf Mischung und Regelungen14,15 enzymatischer Reaktionen oder ein elektrisches Feld verwendet, um strukturelle Veränderungen16induzieren studieren zu injizieren. Angesichts der Tatsache, dass XFEL Quellen nur ein paar Jahre lang zur Verfügung wurden und Erfolge der Vergangenheit in die Zukunft extrapolieren, die Methode potential wie ein richtiges Spiel-Wechsler in Bezug auf unser Verständnis, wie zeigt Proteine Funktion.
Da biologische Proben von einer einzigen Exposition zu einer high-Power-XFEL Puls zerstört werden, wurden neue Ansätze für die Proteinkristallographie notwendig. Die Fähigkeit, große Mengen an einheitliche Mikrokristalle wachsen musste unter diesen Verfahren entwickelten17,18,19sein. Zur Erfassung der Daten auf einem XFEL zu ermöglichen, müssen diese Kristalle geliefert, verworfen und dann für jede XFEL Puls erneuert. Angesichts der Tatsache, dass XFELs nutzbare Impulse bei 10-120 Hz Feuer, muss Musterlieferung schnell, stabil und zuverlässig, dabei auch die Kristalle intakt und Begrenzung Verbrauch. Unter den erfolgreichsten Lösungen ist ein hohe Viskosität Mikro-Extrusion Injektor, der eine kontinuierlich streaming Spalte Raumtemperatur Kristall-beladenen Lipid-kubische Phase (LCP) über die gepulste Röntgen Strahl20liefert. Zufällig orientierte Kristalle, eingebettet in der LCP-Stream, das sind von der XFEL Impulse Scatter Röntgenstrahlen auf einen Detektor, wo ein Beugungsmuster aufgezeichnet wird, abgefangen. LCP war eine natürliche Wahl für ein Probe-Lieferung-Medium, da es häufig als ein Wachstumsmedium für Membran-Protein Kristalle17,21,22,23, noch andere hohe Viskosität Trägermedien verwendet wird 24,25,26,27,28,29,30 und lösliche Proteine31 auch im Injektor verwendet wurden. SFX mit hoher Viskosität Injektor war erfolgreich bei der Strukturaufklärung von Membran Proteine13,32 einschließlich G-Protein-gekoppelten Rezeptoren (GPCRs)33,34, 35,36,37, mit der Datenqualität für native Phasenabgleich38,39 dabei Zeit und Probe effizient ausreichend. Derzeit, diese Injektoren werden mehr routinemäßig für Temperatur-Messungen am Synchrotron Quellen28,30,40,41 sowie während der mehr technisch anspruchsvolle TR-SFX-Experimente am XFELs9,10,13,42.
Vergleichbare TR-SFX-Experimente wurden durchgeführt mit anderen Injektor-Typen wie Flüssigphase Lieferung in einem Fluss Düse6,7,12konzentriert, jedoch erfordert diese Methode Protein Mengen nicht verfügbar für viele biologisch interessante Ziele. Zur Bestimmung der statischen Strukturen mit viskosen Extrusion einen durchschnittlichen Verbrauch von 0,072 mg Protein pro 10.000 indizierten Beugungsmuster im Vergleich zu 9,35 mg für Flüssigkeitsstrahls wurden Düsen (d. h. über 130 Mal mehr Probe gemeldet effiziente)20. Die hohe Viskosität-Injektor hat sich gezeigt, eine tragfähige Probe Abgabegerät für TR-SFX zu sein, während nur einige dieser Probe Effizienz43zu opfern. In Nogly Et Al. (2018)10, z. B. Probe Verbrauch war ca. 1,5 mg pro 10.000 indizierten Muster, die günstig im Vergleich zu ähnlichen TR-SFX-Experimenten mit PYP wo durchschnittliche Probe Verbrauch viel höher bei 74 mg Protein pro 10.000 war indizierte Muster6. Hohe Viskosität Injektoren haben somit klare Vorteile, wenn Begrenzung der Höhe des Proteins zur Verfügung oder Kristalle direkt in LCP angebaut werden.
Für TR-SFX mit hoher Viskosität Injektoren den zuverlässigsten Daten liefern mehrere technische Probleme angegangen werden müssen: die Fließgeschwindigkeit muss weiterhin über kritische Mindestwert; die Hit-Rate sollte beibehalten werden, auf einem Niveau, das nicht langsame Datenerfassung dargestellt wird (z. B. mehr als 5 %); und Probe ohne übermäßige Störungen geliefert werden. Im Idealfall werden diese Bedingungen bereits erfüllt lange vor einer geplanten TR-SFX-Experiment zu XFEL Zeit möglichst effizient zu nutzen. Pricipally, können eine Verlangsamung in der LCP-Stream, sondieren Kristalle, die mit mehreren optischen Laserpuls und Ergebnis in gemischten aktive Zustände aktiviert wurden, oder sondieren gepumpte Material, Umpumped Material in den Strahlengang erwartet wird. Ein weiterer Vorteil der Injection Pre-Tests ist, dass Ausfallzeiten während der Datenerfassung in einem XFEL als Zeit verbannt zu ersetzen verstopfte Düsen, ändern sich nicht Extrudieren Proben minimiert und andere Wartungsaufgaben wird reduziert wird.
Hier präsentieren wir Ihnen eine Methode zur Optimierung der Musterlieferung für TR-SFX-Datenerfassung mit einer hohen Viskosität Mikro-Extrusion Injektor. Der Einfachheit halber uns die beschriebenen Methoden verlassen nicht auf Zugriff auf eine Röntgenquelle, obwohl Arbeit bei einem Synchrotron Strahlrohr29 weiter über erwartete Trefferquoten und Kristall Beugung informieren würde. Unsere Protokolle wurden entwickelt, um Experimente zur Netzhaut Isomerisierung in den-Protonenpumpe Bakteriorhodopsin10 erfassen zu optimieren und erfolgt in zwei Phasen, beginnend mit Kristall Probenvorbereitung für Extrusion, gefolgt von der Überwachung der extrusion verwenden eine High-Speed-Kamera-Setup. In Phase eins wird der Kristall-beladenen LCP mit zusätzlichen LCP, niedrigen Übergang Temperatur Lipide oder andere Zusatzstoffe, um sicherzustellen, dass die endgültige Mischung für die Lieferung in die Probenumgebung geeignet ist, ohne Verstopfung oder Verlangsamung gemischt. Ein neues drei-weg-Spritze-Koppler wurde entwickelt, um die mischenden Leistungsfähigkeit und Probe Homogenität zu verbessern. Die zweite Phase besteht aus einer Extrusion Test aufgezeichnet von einer Hochgeschwindigkeitskamera der Extrusion Drehzahlstabilität direkt zu messen. Nach der Analyse die Videodaten können Anpassungen des Probe-Vorbereitung-Protokolls vorgenommen werden, um experimentelle Ergebnisse zu verbessern. Diese Verfahren können angepasst werden, um andere Proteine für TR-SFX-Datenerhebung, mit minimalen Änderungen vorzubereiten und werden dazu beitragen, die effiziente Nutzung der begrenzten XFEL Strahlzeit. Mit neuen XFEL-Einrichtungen, die gerade erst ihren Betrieb44,45 und die Übertragung der Injektor-basierte serielle Methoden der Datenerhebung an Synchrotrons28,30,40,41 , die nächsten Jahre werden sicherlich weiterhin spannende neue Einblicke in die strukturelle Dynamik von ein immer breiteres Spektrum an Protein-Targets.
Protokoll
(1) Protein Crystal Probenvorbereitung
- Ca. 30 min vor die Probe injiziert werden, basieren Last 50 µL Kristall-beladenen Monoolein LCP in einer 100 µL Spritze.
- Für die Injektion bei Atmosphärendruck: Last 10 µL Paraffinöl in die Rückseite einer zweiten Spritze. Vertreiben Sie die Spritze senkrecht halten, die Luftblasen aus der Spritze.
- Für die Injektion in Vakuum: Last 5 µL MAG 7,9 und 5 µL Paraffinöl in die Rückseite einer zweiten Spritze. Vertreiben Sie die Spritze senkrecht halten, die Luftblasen aus der Spritze.
- Verbinden Sie die Spritze mit Paraffin/MAG 7,9 auf eine standard-Spritze-Koppler, die Luft aus der Kupplung entlüften, durch leichtes Drücken auf den Kolben bis zu einem kleinen Volumen (< 1 µL) Paraffin/Lipid ist sichtbar an der Spitze der Nadel Koppler.
- Verbinden Sie Probe-Spritze mit der Spritze Koppler, kümmert sich um alle Luft nicht in die Probe einzuführen. Das Lipid/Paraffin indem man das Probenmaterial durch den Koppler mehrfach unterrühren.
- Ein weiterer 100 µL Spritze 20 µL vorgemischten LCP (27 % PEG, 100 mM Sorensen pH 5,6 + MO) bestücken. Entfernen Sie Luftblasen nach Bedarf.
- Entfernen Sie die leere Spritze aus der Kupplung und den Kristall mit Spritze verwenden eine standard-Spritze-Koppler beimessen Sie vorgemischte LCP. Übergeben Sie die Probe durch den Koppler 100 Mal.
Hinweis: Probe mischen die Probe erhitzen kann leicht46. Mischen sollte in einem langsamen Tempo durchgeführt werden, wo die Temperatur der Probe kann einigermaßen konstant gehalten werden. - Überprüfen Sie das Beispiel für Transparenz gegen eine Lichtquelle. Wenn eine klare homogene LCP gebildet hat, gehen Sie zu Schritt 1,9.
- Um die Probe in die kubische Phase bringen, 3 µL Monoolein und mischen Sie 50mal (wie oben beschrieben). Wiederholen Sie diesen Vorgang, bis nur eine transparente Phase gebildet hat, um ein Übermaß an Monoolein zu vermeiden.
Hinweis: Die Bildung der LCPS ist Temperatur abhängige47 und beste Ergebnisse werden erzielt, knapp über 20 ° C. Die Höhe der zusätzlichen Monoolein benötigt das Volumen der verbleibenden Fällungsmittel Lösung aus Kristallisation übertragene abhängen. - Als Vorbereitung für die Probe Steifigkeit (erwartungsgemäß von der LCP-Phase) und Extrudieren-Fähigkeit testen, lösen die leere Spritze aus der Spritze-Koppler und, die Spritze senkrecht halten, drücken Sie eine kleine Menge der Probe (< 2 µL) durch den Koppler. Wenn die extrudierte Probe einen aufrechte Zylinder bildet, ist die Probe bereit für Extrusion zu testen.
- Passen Sie das Gesamtvolumen der Probe zu 100 µL durch Zugabe von mehr vorgemischten LCP (wie in Schritt 1.5).
- Der drei-weg-Spritze-Koppler (Reinigung der Luft von den Koppler als vor) zuordnen Sie der Probe-Spritze und zwei leere Spritzen. Mischen Sie mindestens 50 Mal (bzw. bis homogene) indem die Hälfte der Probe in die zweite Spritze und dann beide Hälften der Probe in die dritte Spritze gleichzeitig drücken.
- Legen Sie die Spritze mit der Mischprobe unter dem Stereo-Mikroskop, eine homogene Verteilung der Kristalle zu überprüfen.
2. testen Probe Extrusion mit einer High-Speed-Kamera-Setup
- Bestimmung der Versuchsparameter.
- Wählen Sie die Größe der Düse für den Test.
Hinweis: Düsengrößen sind in der Regel 50 oder 75 µm Innendurchmesser (ID), aber jeder Größe von etwa 30-100 µm ID angesehen werden kann. Auswahl basiert auf einem Gleichgewicht zwischen meine Verstopfung, Hintergrund Streuung, Probe Verbrauch und Hit-Rate. - Berechnen Sie die optimale Fließgeschwindigkeit basierend auf experimentellen Laser spot-Größe (1/e2 Durchmesser) und die Sammlung Datenschema (z. B. interleaved hell und dunkel), die bei der XFEL verwendet werden.
- Berechnen Sie die gewünschte Durchflussgeschwindigkeit (
 ) der Probe aus der optimale Fließgeschwindigkeit (
) der Probe aus der optimale Fließgeschwindigkeit (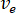 ) und die gewählte Düsendurchmesser (
) und die gewählte Düsendurchmesser (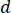 ):
):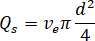
Die Durchflussmenge bestimmen (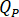 ) an der HPLC-Pumpe anhand der Verstärkungsfaktor eingegeben werden sollten (
) an der HPLC-Pumpe anhand der Verstärkungsfaktor eingegeben werden sollten (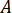 ) des Injektors.
) des Injektors.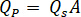
Berechnen Sie den maximalen Druck (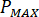 ) aus der Nenndruck der Düse Armaturen (
) aus der Nenndruck der Düse Armaturen (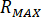 ) und der Verstärkungsfaktor des Injektors (
) und der Verstärkungsfaktor des Injektors (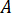 ):
):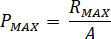
- Wählen Sie die Größe der Düse für den Test.
- Einrichtung von hoher Viskosität Extrusion Injektor zur offline-Nutzung wie in Abbildung 1dargestellt.
Hinweis: Die Injektor-Funktionen mittels hydraulischen Strangpressen eine HPLC-Pumpe angetrieben und nutzt eine Co fließenden Helium Gas Scheide durch einen Gasregler gesteuert. Die Pumpe und Regler-Setup werden nicht in diesem Protokoll behandelt. Kapitel vier James (2015)48 ein ausführliches Handbuch.- Spülen Sie die Pumpe und alle Wasserleitungen um sicherzustellen, dass die Regelgarnitur korrekt sind. Die hydraulische Bühne des Injektors zu bereinigen.
- Montieren Sie den Injektor (oder der Kamera) auf einer 3-Achsen-Bühne, Bildrahmen und Fokus für die High-Speed-Videos zu erleichtern. Lassen Sie Platz rund um die Einstichstelle für das Objektiv, Beleuchtung, reflektierende Bildschirm und einen kleinen Becher, die abgebrannte Probe fangen.
- Konstruieren Sie eine "Dummy-Düse" (ein leeres Reservoir mit einer Düse befestigt) und installieren Sie es auf dem Injektor, Positionierung, Ausrichtung und Beleuchtung zu erleichtern.
- Montieren Sie die High-Speed-Kamera mit der Düsenspitze in der Nähe der zentrale Punkt des Ziels.
- Positionieren Sie die reflektierende Bildschirm hinter dem Injektor und passen Sie die Beleuchtung um Front-Düse Licht.
- Und eine Verbindung der Kamera mit der mitgelieferten Software. Positionieren Sie mit einem live-Video läuft für visuelles Feedback die Düsenspitze in der Mitte des Rahmens, und in den Fokus mit der 3-Achsen-Bühne zu bringen.
- Passen Sie die Beleuchtung, bis die Düse deutlich sichtbar ist und der Hintergrund wird gleichmäßig ausgeleuchtet.
- Konfigurieren der Kamera High-Speed-Zeitraffer-Video aufzeichnen.
- Eingestellten Bildrate auf 1000 fps. Stellen Sie die Auflösung auf 512 x 512 Pixel.
- Mit der Belichtungszeit stellen Sie nun die Frame-Rate, passen Sie die Beleuchtungsstärke, bis die Düse sichtbar ist (d. h. nicht unter- oder überbelichtet). Positionieren Sie die Düsenspitze, so dass es links nach rechts zentriert ist und sich im oberen Drittel des Rahmens befindet.
- Führen Sie keine Untergrundkorrektur oder die Weißabgleich-Operationen.
- Richten Sie die Kamera im Zeitraffer-Modus. Eingestellten Intervall, 30 s und wiederholt zu 40-Mal, den Triggermodus auf zufällig (oder zufällige zurücksetzen) festgelegt, und geben Sie die Anzahl der Frames auf 1000aufnehmen.
- Laden Sie das Reservoir mit 20 µL der Probe, und befestigen Sie die Kapillare Düse.
- Befestigen Sie den gefüllten Behälter zum Injektor. Befestigen Sie die Gasleitung mit dem Anschluss an die Düse und starten Sie den Gasdurchfluss.
- Den Kolben manuell durch Inline-Ventil öffnen und die Spritze drücken voraus. Schließen Sie das Ventil, wenn der Kolben festen Kontakt mit der Probe in das Reservoir macht.
- Programmieren Sie die Pumpe mit der berechnete Volumenstrom und den maximalen Druck auf den berechneten Wert festgelegt (siehe Punkt 2.1.3).
- Gleichzeitig starten der Pumpe und der Kamera-Aufnahme.
- Während die Extrusion anfängt, passen Sie den Gas-Druck zur Erhöhung der Stabilität. Gasdruck zu erhöhen, wenn die Flüssigkeit einen Tropfen an der Spitze der Düse anstelle einer Spalte bildet. Rückgang Druck wenn die Extrusion gebrochen durch übermäßige Scherung aus dem Gasstrom ist oder ist schnell oszillierende Schlagsahne ().
- Überwachen die Extrusion (10 min ist in der Regel genug, um eine homogene Strömung Bedingung zu erkennen) und, wenn der Pumpendruck stark, in der Nähe der erwartete Endzeit Rampen, stoppen Sie die Aufnahme, die Pumpe abgeschaltet und entlüften den Systemdruck durch das Sicherheitsventil öffnen.
- Analyse der video-Dateien
Hinweis: Probe-Extrusion, die schlicht nicht ausreicht erfordert keine detaillierte Analyse. Es ist jedoch immer noch nützlich, Failure Mode zu identifizieren, so dass die Probe optimiert werden kann.- Öffnen Sie die Videodatei mit der Analysesoftware (z. B. Fidschi49) und kalibrieren Sie die Messgeräte zu.
- Kalibrieren Sie die Messungen durch eine Reihe von bekannten Länge im Videobild mit dem Line-Auswahl-Werkzeug auswählen. Öffnen Sie das Fenster Einstellen Skala über analysieren | Maßstab festlegen und geben Sie die bekannten Abstand und die Maßeinheiten.
Hinweis: Die bekannte Durchmesser der Düse bietet eine adäquate Kalibrierung Länge für diese Messungen. - Suchen Sie einen Frame im Video wo gibt es in der Extrusion ein verfolgbaren Features sichtbar (z. B. ein Kristall). Notieren Sie die Frame-Nummer.
- Vorab das Video zu einem Bild, wo die gleiche Funktion ist sichtbar, aber von seiner Position im vorherigen Schritt verschoben hat. Notieren Sie die Frame-Nummer.
- Mit der geraden Linie Messwerkzeug messen Sie den Abstand von den Funktion Start- und Endpunkt über analysieren | Maßnahme.
Hinweis: Je länger der verfolgbaren Abstand, die weniger Fehler bei der Messung der Berechnungen wirken - Berechnung der Austrittsgeschwindigkeit aus der gemessenen Distanz und die verstrichene Zeit (die Anzahl der verstrichenen Frames geteilt durch Framerate.)
- Wiederholen Sie die Schritte 2.11.3-2.11.6 ein paar Mal für jedes Segment des Videos.
- Zeichnen Sie die Datenreihe wie in Abbildung 2.
Ergebnisse
Das ideale Ausgangsmaterial für die hier beschriebenen Verfahren (Abbildung 3) sind hohe Dichten von Mikrokristalle in viskosen Trägermedium für die Einspritzdüse integriert. Das Verfahren erfordert etwa 50 µL Kristall beladenem Träger für jede Zubereitung. Diese können direkt im LCP als mit dem bR-9,-10 diente hier als Beispiel (Abbildung 4), oder Kristalle gewac...
Diskussion
Die TR-SFX-Methode mit dem zähflüssigen Extrusion Injector erweist sich eine praktikable Technik für Strukturdynamik Studien Bakteriorhodopsin9,10 und Photosystem II13 und jetzt scheint bereit, fahren andere Proteine zu studieren Foto biologischen Prozessen wie lichtgetriebenen Ionentransport oder Sinneswahrnehmung5,50. Die oben beschriebenen Protokolle wurden entwickelt, um den...
Offenlegungen
Die Autoren erklären keine widerstreitenden Interessen.
Danksagungen
Wir erkennen Gebhard Schertler, Rafael Abela und Chris Milne zur Unterstützung des Einsatzes von hoher Viskosität Injektoren am PSI. Richard Neutze und sein Team sind für Diskussionen über die zeitaufgelöste Kristallographie und Probeneingang mit hoher Viskosität Injektoren anerkannt. Für die finanzielle Unterstützung, wir erkennen den Schweizerischen Nationalfonds für Zuschüsse 31003A_141235, 31003A_159558 (zu j.s.) und PZ00P3_174169 (um P.N.). Dieses Projekt wird finanziell von der Europäischen Union Horizont 2020 Forschungs- und Innovationsprogramm unter Marie Sklodowska-Curie-Stipendium Vereinbarung Nr. 701646.
Materialien
| Name | Company | Catalog Number | Comments |
| Mosquito LCP Syringe Coupling | TTP labtech store | 3072-01050 | |
| Hamilton Syringe 1710 RNR, 100 µl | Hamilton | HA-81065 | |
| Hamilton Syringe 1750 RNR, 500 µl | Hamilton | HA-81265 | |
| Monoolein | Nu-Chek Prep, Inc. | M-239 | |
| 7.9 MAG | Avanti Polar Lipids Inc. | 850534O | |
| 50% w/v PEG 2000 | Molecular Dimensions | MD2-250-7 | |
| Paraffin (liquid) | Sigma-Aldrich | 1.07162 | |
| High speed camera | Photron | Photron Mini AX | |
| High magnification lens | Navitar | 12X Zoom Lens System | |
| Three axis stage | ThorLabs | PT3/M | |
| Fiber light | Thorlabs | OSL2 | |
| Fused silica fiber | Molex/Polymicro | TSP-505375 | |
| Lite touch ferrule | IDEX | LT-100 | |
| ASU high viscosity injector | Arizona State University | Purchasable from Uwe Weierstall (weier@asu.edu) | |
| HPLC pump | Shimadzu | LC-20AD | |
| Electronic gas regulator | Proportion Air | GP1 |
Referenzen
- Neutze, R., Wouts, R., van der Spoel, D., Weckert, E., Hajdu, J. Potential for biomolecular imaging with femtosecond X-ray pulses. Nature. 406 (6797), 752-757 (2000).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470 (7332), 73-77 (2011).
- Barty, A., et al. Self-terminating diffraction gates femtosecond X-ray nanocrystallography measurements. Nature photonics. 6 (December), 35-40 (2012).
- Aquila, A., et al. Time-resolved protein nanocrystallography using an X-ray free-electron laser. Optics express. 20 (3), 2706-2716 (2012).
- Panneels, V., et al. Time-resolved structural studies with serial crystallography: A new light on retinal proteins. Structural Dynamics. 2 (4), 041718 (2015).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Pande, K., et al. Femtosecond structural dynamics drives the trans/cis isomerization in photoactive yellow protein. Science (New York, N.Y.). 352 (6286), 725-729 (2016).
- Barends, T. R. M., et al. Direct observation of ultrafast collective motions in CO myoglobin upon ligand dissociation. Science (New York, N.Y.). 350 (6259), 445-450 (2015).
- Nango, E., et al. A three-dimensional movie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Nogly, P., et al. Retinal isomerization in bacteriorhodopsin captured by a femtosecond x-ray laser. Science. 0094 (June), (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2017).
- Kupitz, C., et al. Serial time-resolved crystallography of photosystem II using a femtosecond X-ray laser. Nature. , (2014).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Stagno, J. R., et al. Structures of riboswitch RNA reaction states by mix-and-inject XFEL serial crystallography. Nature. 541 (7636), 242-246 (2017).
- Wang, D., Weierstall, U., Pollack, L., Spence, J. C. H. Liquid Mixing Jet for XFEL Study of Chemical Kinetics. Journal of synchrotron radiation. , 1364-1366 (2014).
- Hekstra, D. R., White, K. I., Socolich, M. A., Henning, R. W., Šrajer, V., Ranganathan, R. Electric-field-stimulated protein mechanics. Nature. 540 (7633), 400-405 (2016).
- Liu, W., Ishchenko, A., Cherezov, V. Preparation of microcrystals in lipidic cubic phase for serial femtosecond crystallography. Nature. 9 (9), 2123-2134 (2014).
- Kupitz, C., Grotjohann, I., Conrad, C. E., Roy-Chowdhury, S., Fromme, R., Fromme, P. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological sciences. 369 (1647), (2014).
- Falkner, J. C., et al. Generation of Size-Controlled, Submicrometer Protein Crystals. Chemistry of Materials. 17 (10), 2679-2686 (2005).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature communications. 5, 3309 (2014).
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: a novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences of the United States of America. 93 (December), 14532-14535 (1996).
- Caffrey, M. A comprehensive review of the lipid cubic phase or in meso method for crystallizing membrane and soluble proteins and complexes. Acta Crystallographica Section F Structural Biology Communications. 71 (1), 3-18 (2015).
- Cherezov, V. Lipidic cubic phase technologies for membrane protein structural studies. Current Opinion in Structural Biology. 21 (4), 559-566 (2011).
- Conrad, C. E., et al. A novel inert crystal delivery medium for serial femtosecond crystallography. IUCrJ. 2 (4), 421-430 (2015).
- Sugahara, M., et al. Hydroxyethyl cellulose matrix applied to serial crystallography. Scientific Reports. 7 (1), 703 (2017).
- Sugahara, M., et al. Grease matrix as a versatile carrier of proteins for serial crystallography. Nature Methods. 12 (1), 61-63 (2014).
- Sugahara, M., et al. Oil-free hyaluronic acid matrix for serial femtosecond crystallography. Scientific Reports. 6 (1), 24484 (2016).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Kovácsová, G., et al. Viscous hydrophilic injection matrices for serial crystallography. IUCrJ. 4 (4), 400-410 (2017).
- Martin-Garcia, J. M., et al. Serial millisecond crystallography of membrane and soluble protein microcrystals using synchrotron radiation. IUCrJ. 4 (4), 439-454 (2017).
- Fromme, R., et al. Serial femtosecond crystallography of soluble proteins in lipidic cubic phase. IUCrJ. 2, 545-551 (2015).
- Caffrey, M., Li, D., Howe, N., Shah, S. T. A. "Hit and run" serial femtosecond crystallography of a membrane kinase in the lipid cubic phase. Philosophical Transactions of the Royal Society B: Biological Sciences. 369 (1647), 20130621 (2014).
- Liu, W., et al. Serial femtosecond crystallography of G protein-coupled receptors. Science (New York, N.Y.). 342 (6165), 1521-1524 (2013).
- Zhang, H., et al. Structure of the Angiotensin Receptor Revealed by Serial Femtosecond Crystallography. Cell. 161 (4), 833-844 (2015).
- Fenalti, G., et al. Structural basis for bifunctional peptide recognition at human δ-opioid receptor. Nature Structural & Molecular Biology. (February), (2015).
- Kang, Y., et al. Crystal structure of rhodopsin bound to arrestin by femtosecond X-ray laser. Nature. 523 (7562), 561-567 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and Delivery of Protein Microcrystals in Lipidic Cubic Phase for Serial Femtosecond Crystallography. Journal of Visualized Experiments. 9 (115), 2123-2134 (2016).
- Batyuk, A., et al. Native phasing of x-ray free-electron laser data for a G protein-coupled receptor. Science Advances. 2 (9), e1600292 (2016).
- Nakane, T., et al. Native sulfur/chlorine SAD phasing for serial femtosecond crystallography. Acta Crystallographica Section D Biological Crystallography. 71 (12), 2519-2525 (2015).
- Nogly, P., et al. Lipidic cubic phase serial millisecond crystallography using synchrotron radiation. IUCrJ. 2 (2), 168-176 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tosha, T., et al. Capturing an initial intermediate during the P450nor enzymatic reaction using time-resolved XFEL crystallography and caged-substrate. Nature Communications. 8 (1), 1585 (2017).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314 (2016).
- Abela, R., et al. Perspective: Opportunities for ultrafast science at SwissFEL. Structural Dynamics. 4 (6), 061602 (2017).
- Marx, V. Structural biology: doors open at the European XFEL. Nature Methods. 14 (9), 843-846 (2017).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chemistry and Physics of Lipids. 95 (1), 11-21 (1998).
- Qiu, H., Caffrey, M. The phase diagram of the monoolein/water system: Metastability and equilibrium aspects. Biomaterials. 21 (3), 223-234 (2000).
- James, D. . Injection Methods and Instrumentation for Serial X-ray Free Electron Laser Experiments. , (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Moffat, K. Femtosecond structural photobiology. Science (New York, N.Y.). 361 (6398), 127-128 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten