需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
气泡柱光生物反应器中绿色微藻的培养及中性脂质的测定
摘要
在这里, 我们提出了一个协议, 以构建实验室规模的气泡柱光生物反应器, 并将其用于培养微藻。为测定培养生长速率和中性脂质含量提供了一种方法。
摘要
人们对研究微藻用于生产生物燃料、高价值产品和处理废物等工程应用非常感兴趣。由于大多数新的研究工作都是从实验室规模开始的, 因此需要有成本效益高的方法, 以可重复的方式培养微藻。在这里, 我们交流了在实验室规模的光生物反应器中培养微藻的有效方法, 并测量了该藻类的生长和中性脂质含量。还包括关于如何建立光生物反应器系统的说明。虽然该生物是小球藻和auxeno·bella 的种类, 但该系统可以适应培养各种微藻, 包括藻类与非藻类物种的共培养。股票文化首先是在瓶子中生长, 以产生光比生物反应器系统的接种剂。藻类接种物被浓缩并转移到光生物反应器中, 以便在批量生产模式下进行培养。每天收集样本以获取光学密度读数。在批处理培养结束时, 细胞通过离心机收获, 清洗, 并冻干, 以获得最终的干重浓度。最后的干重浓度用于建立光学密度和干重浓度之间的相关性。随后采用改进的 folch 法从冻干生物质中提取总脂质, 并采用微板法检测其中性脂质含量。此检测方法以前已发布, 但此处包含了协议步骤, 以突出显示经常发生错误的过程中的关键步骤。这里描述的生物反应器系统填补了一个小众之间简单的烧瓶种植和完全控制的商业生物反应器。即使每次治疗只有3-4 个生物复制物, 我们培养藻类的方法也会导致生长和脂质检测的标准偏差很严格。
引言
近年来, 微藻在工程和生物技术中的应用引起了极大的兴趣。微藻正在研究中, 用于废水处理1、2、3、4、生物燃料生产5、6、7、8和生产保健品和其他高价值产品9,10。藻类也在以更高的速度进行转基因, 以提高其对特定工程应用的适应性11,12。因此, 人们非常希望在受控环境中试验与工业有关的生物体。该方法的目的是传达一种在可控实验室环境中培养微藻的有效方法, 并测量微藻的生长和中性脂质含量。提高微藻的生长速度和中性脂质含量已被确定为藻类生物燃料商业化的两个关键瓶颈13。
为了实验目的, 人们已经使用了广泛的方法来培养藻类。一般来说, 这些方法可以分为大规模室外种植和小规模室内种植。光生物反应器和开放池塘的室外种植适合于旨在扩大已经在实验室规模上证明的工艺的实验 (例如,测试扩大新的高脂藻类毒株)14。然而, 在开发新的或改良的藻类菌株或进行旨在了解生物机制的实验时, 室内小规模种植是适当的。在后一种情况下, 需要高度的实验控制来梳理生物行为的微妙变化。为此, 通常需要进行空气酸培养, 以尽量减少与其他生物 (如细菌、其他藻类) 有关的复杂生物因素, 这些生物不可避免地生长在大规模的室外系统中。即使在研究藻类和其他生物之间的相互作用时, 我们发现, 在研究15、16、17生物体之间的分子交换时, 使用高度控制的实验条件是有帮助的。
在小型室内藻类养殖类别中, 采用了一系列办法。也许最常见的方法是在 18、19 的灯光库下面的振动台上种植 erlenmeyer 烧瓶中的藻类。氧气和二氧化碳的交换是通过烧瓶顶部的泡沫塞通过被动扩散进行的。一些研究人员通过对烧瓶20 进行主动曝气, 改进了这种设置。另一种方法是在瓶子中培养藻类, 混合搅拌棒和主动曝气。尽管它们很简单, 但我们发现, 烧瓶和瓶子的使用往往会导致生物复制之间的结果不一致。这大概是由于位置效应造成的--不同的位置接收不同数量的光线, 这也会影响内部反应堆的温度。反应堆每天轮换到新的位置可以帮助但不能缓解这一问题, 因为藻类生长的某些阶段 (例如,早期指数) 比其他阶段 (如日志阶段) 对位置效应更敏感。
在技术成熟度的对立面是完全控制的商业光生物反应器。这些系统持续监测和调整反应堆的条件, 以优化藻类的生长。它们具有可编程照明、实时温度控制和 ph 控制。不幸的是, 它们很贵, 每个反应堆通常需要几千元。大多数科学和工程期刊都需要对结果进行生物复制, 因此需要购买多个生物反应器。我们在这里介绍了一个气泡柱反应器系统, 它弥合了实验室规模藻类养殖的简单 (烧瓶) 和复杂 (完全控制的生物反应器) 方法之间的鸿沟。气泡柱使用上升的气泡来促进气体交换和混合反应堆。这种方法提供了对照明和温度的一定程度的控制, 但这样做的方式具有成本效益。此外, 我们发现, 与烧瓶或瓶法相比, 该系统在生物复制中产生了高度一致的结果, 减少了获得统计意义结果所需的生物复制所需的数量。我们还利用该系统成功地培育了藻类和细菌的混合物21。除了藻类养殖外, 我们还概述了测量养殖藻类中性脂质含量的方法。后一种方法已在其他地方发布 22, 但我们在这里包括了一个过程, 以提供如何成功使用它的分步指导。
研究方案
1. 气泡柱光生物反应器的设置
- 从1升玻璃瓶和杂交管附带的塑料盖中构建一套通风盖 (有关原理图和照片, 请参见图 1 )。为加湿器、混合疏水阀、每个空气提升光反应器和每个瓶反应器建造盖子。
- 在盖子上钻孔: 生物反应器和加湿器盖需要2个孔;混合疏水阀需要3个孔。
- 将一个-"o 形圈在一个-8" 面板安装 luer 管接头的螺纹上滑动, 并将其滑入在盖子上钻的 "孔 (图 1a)。
- 将第二个-"o 形圈滑过螺纹, 使盖子夹在两个 o 形圈之间。将锁紧螺母滑到螺纹上, 然后拧紧以固定面板安装 luer 的位置。
- 从盖子突出的暴露的男性 luer 上的扣锁环。对盖子上的每个孔重复步骤 1.1.2-1.1.4。
- 对于将用于气泡柱和瓶反应器的盖子, 将半 "女性 luer 连接到 1.5" 件的 id pvc 管。将这些连接到盖子上的每个暴露在外的男性 luer 配件上。
- 将止回阀 (指向远离盖子) 连接到其中一个 "件" 的自由端。
注: 这将作为生物反应器的排气口。 - 将男性 luer 连接到从盖子突出的第二块半 "管。单击旋转的锁环到位, 并将 0.2 mm 空气滤清器固定在此上。
注: 这将作为反应堆的入口端口。

图1。用于构建生物反应器的原理图和照片。(a) 用于制造组装生物反应器盖的生物反应器盖 (b) 照片的示意图, 以及用于加湿器的组装盖的 (c) 照片。请注意, 加湿器配件应涂上防水硅胶, 以确保与盖子密封。请点击这里查看此图的较大版本.
- 组装送风系统 (有关原理图和照片, 请参见图 2 a 和 2 b) 。
- 将 npt 线连接到每个流量计背面的进气口和出口上的倒钩配件上。
注: 200-2500 厘米3/分钟转子直径用于加湿器上游的气压调制, 100-1000 厘米3/分钟转子直径用于瓶式反应器, 50-500 cm 3/分钟转子直径用于空气提升生物反应器, 和 5-50 cm 3//最小的轮式是二氧化碳的流量调节。建议将转子安装在固定的表面 (例如塑料板) 上, 这样它们在操作过程中就不会掉落。 - 关闭压缩空气源, 然后用软管夹将 "id 柔性 pvc 管材连接到压缩空气源。向下的软管直径为半 "id pvc 软管使用一个-" 女性的倒钩配件和一个半 "男性的倒钩配件。
- 将伊尔管的自由端连接到200-2500 厘米 3/分钟转子的入口.
注: 此流量计的出口将通过 "id 管" 进给加湿器瓶。 - 将半 "管连接到通风口盖 (使用女性 luer 进行倒钩配件以进行连接)。然后将第二块半管连接到面板安装配件的内部。
注: 这一块将挂在加湿器和泡沫空气通过水。 - 将半 "雌性 luer 连接到一个半" id 管的每一端的倒钩配件, 并使用这一块将加湿器的出口连接到混合疏水阀的入口。
- 与1.2.5 一样, 将 co2 调节器的出口连接到混合疏水阀上的第二个端口。
- 构建一个流形, 使用半 "管和半" 多端口倒钩 (见图 2c), 将空气输送到流量计的银行。
注: 这些转子将用于供应生物反应器。避免串联建造6个以上的转子。相反, 使用转子的平行银行来扩展系统。确保所有反应器的总流量需求小于 2,500厘米 3/min (否则将需要更大的流量计在加湿器的上游)。 - 使用 "管和半" 女性将混合疏水阀的出口 (第3端口) 连接到新建的旋转管。
- 将足够长的管连接到转子库中每个流量计的出口, 以便为生物反应器提供空气。标记管道的两端以及银行中的旋转参数。
- 在加湿器和混合疏水阀盖上的所有端口上使用防水硅胶, 以确保其密封。
- 将 npt 线连接到每个流量计背面的进气口和出口上的倒钩配件上。
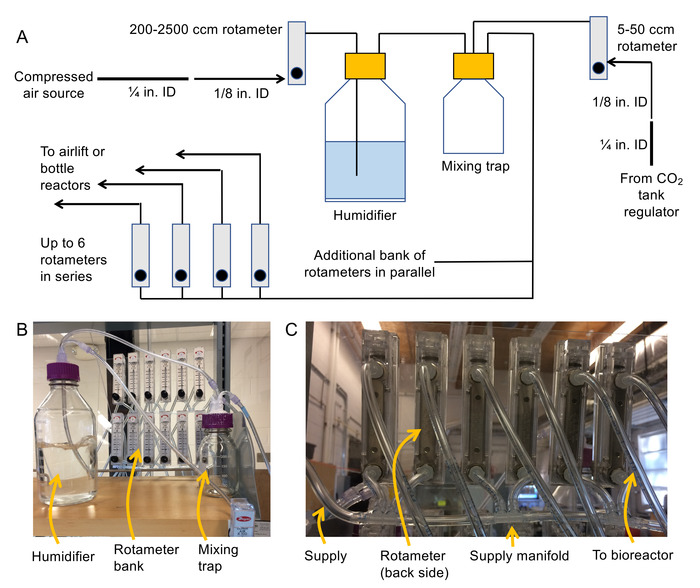
图2。用于组装气泡柱系统的原理图和照片。(a) 加湿器、混合疏水阀和旋转管的曝气系统 (b) 照片的示意图, 以及用于将旋转管库连接在一起的歧管的 (c) 照片。请点击这里查看此图的较大版本.
- 设置鱼缸、搅拌板和灯 (图 3)。
注意: 该系统需要大量的插座和足够的电路容量来支持所有组件。避免以菊花链的方式将多个电源线和延长线串在一起, 因为这是一种电气危害。由于系统中存在水, 因此大力鼓励使用 gfi 类型的出水口和电源线。- 在足够坚固的水平表面上安排低姿态的磁力搅拌器, 以承受充满水的鱼缸的重量。
- 将小的木制或塑料块 (比搅拌板稍高) 放在搅拌板的周长周围, 以支撑鱼缸的重量。
注意: 避免将鱼缸直接放置在搅拌板上, 因为它们的重量会压碎它们。 - 将鱼缸放在搅拌板和支撑块上, 然后在鱼缸中灌满水。
- 切一块坚硬的塑料布, 以适应鱼缸的顶部作为盖子。在这个盖子上切割孔, 将杂交管滑入和滑出。也为鱼缸加热器开一个洞。
- 安排鱼缸旁边的荧光灯库, 为生物反应器提供水平照明。将光库插入光定时器, 以设置白天/夜间循环。

图3。瓶生物反应器 (左) 和气泡柱光生物反应器 (右) 的系统原理图。这一数字已从 higgins等人开始修改。17.请点击此处查看此图的较大版本.
2. 微藻接种剂的制备
- 从低温保存、电镀或液体培养中获得微藻接种。
注: 建议在用作接种剂之前将冷冻保存的生物体镀甲, 以确保细胞是可行的, 并确保由此产生的培养是无生气的。琼脂培养基 (例如atcc #5 孢子琼脂)21是一种丰富的培养基, 可很好地恢复低温储存中的小球藻和auxeno什么的。 - 准备适用于特定微藻种类的 2.4 l 矿物培养基。
注: 这方面的例子包括 小球藻的 n8 培养基23、小球藻的n8-nh 4 培养基21 。使用适合藻类应变的介质是确保藻类生长强劲的最重要步骤之一。 - 将 2.4 l 的矿物介质均匀地放入三个 1 l 玻璃瓶中, 在每个玻璃瓶中加入搅拌条, 并为每个瓶子组装出盖 (图 1)。仔细检查曝气管是否在进气口一侧, 每个瓶子中是否有一个搅拌杆。
- 使用液体灭菌循环 (121°c) 对库存瓶进行30分钟的高压灭菌器100毫升的去离子水 (dh2o)和大约 1.5 ml 管, 这些管随后将用于电镀。让培养基在一夜之间冷却。或者, 将反应器冷却到室温, 然后在接种前加气2小时。
- 在生物安全柜 (bsc) 中, 将板中的微藻或无源液体培养体接种到库存瓶中。使用无菌技术, 以保持无菌培养在以下步骤。
- 在无菌的50毫升离心管中加入20 毫升的高压灭菌 dh2o。使用无菌10μl 一次性循环从步骤2.1 中选取几个单个菌落。将环路浸入50毫升管中, 将藻类细胞洗入蒸压 dh2o.摇匀50毫升管, 形成均匀的微藻溶液。
- 将6毫升微藻溶液输送到每个库存瓶中, 并配有10毫升无菌血清学移液器。旋转瓶子, 将微藻均匀地混合到培养基中。
- 使用2毫升无菌血清学移液器从每个库存瓶中提取1毫升样品, 并转移到无菌 1.5 ml 管中。
注: 由于存在污染风险, 不建议在此步骤中使用微移液器。拧紧库存瓶上的通风盖。 - 将库存瓶放在搅拌板上 (约150转/分), 并根据物种调整气流流量、二氧化碳和照明水平。每天旋转库存瓶位置。
- 稀释在第2.6 步 (无菌水中100倍稀释通常效果良好) 中获得的1毫升样品, 并将板材扩散到丰富的琼脂介质上。
注: 这些板块可用于检查污染情况, 并作为未来藻类接种的来源, 以便进一步实验。 - 每两天从瓶子中提取样本 (在 bsc 中), 以检查微藻的生长。
将样品放入96孔微板中, 一式三份 (200μl), 每两天以550纳米和680纳米的速度测量光学密度 (od), 直到 od 达到 0.2-0.3 (通常需要 5-7)。 - 停止孵化, 并将库存瓶放在24-48 的长凳上, 以允许藻类细胞在重力下沉淀。
注: 已确定的细胞将用于接种气泡柱光生物反应器旁边。如果需要更快速的细胞收集, 细胞可以在不超过 1, 000 x 克的情况下离心, 以收集细胞。
3. 气泡柱光生物反应器中微藻的培养
- 在生物反应器接种之前的天, 准备适当的媒介并且转移 200 ml (或期望容量) 到气泡专栏光生物反应器管 (杂交管)。带介质和通风盖的高压灭菌管。
注: 如果使用废水作为生长介质, 则对空生物反应器进行高压灭菌, 并添加经过消毒过滤的废水 (如果需要进行无菌培养)。 - 利用真空泵去除上清剂, 浓缩已沉淀的微藻库存。在每个瓶子中留下小于100毫升的培养基, 但避免去除已沉淀的藻类。
注: 在平衡计分卡内执行此过程, 并遵循无菌技术。一个简单的真空装置可以用真空瓶或瓶子来制造。将无菌血清式移液器安装在管材的末端。 - 暂停藻类浆料并将其转移到无菌的50毫升离心管中。以 1, 000 x 克离心 5分钟, 进一步浓缩藻类。
- 在 bsc 中, 去除足够的上清液, 使12个光生物反应器的海藻精矿总量达到 ~ 80 毫升。避免吸尘出颗粒。将海藻精矿转移到无菌容器 (或使用过的藻类储备瓶)。
- 用无菌的10毫升血清式移液器在每个光生物反应器中加入6毫升的藻类浆。
- 无菌过滤器 (0.2 mm 注射器或真空过滤器), 并添加适当数量的任何其他化合物 (如维生素库存), 这些化合物不能高压灭菌。
- 旋转生物反应器将藻类混合到培养基中。
- 使用血清学移液器从每个生物反应器中提取一个2毫升样本, 并转移到2毫升管。每24小时收集2毫升样本 (在 bsc 中), 以监测文化进展情况。使用试纸检查样品的 ph 值, 并根据需要使用 3 m naoh 或 3m hcl 调整反应器。
- 拧紧生物反应器盖, 并将所有生物反应器放入鱼缸水浴中。将曝气、二氧化碳和照明调整到适合该物种的水平。采样后每天旋转生物反应器位置 (步骤 3.8)。
- 将每个培养样品的200μl 一式三份应用到96井微板的井中。测量550纳米和680纳米的光学密度 (od)。
- 在培养期的最后一天, 在不同的稀释系数 (例如, 1x、2倍、4x、8倍、16x 和 32x) 下测量 od, 以建立 od 与收获后实际干重之间的相关性 (第4步)。
- 以 12, 000 x g 离心2毫升样品管5分钟。
- 通过0.2μm 非无菌注射器过滤器过滤上清液, 并将上清液 (如果需要, 则将颗粒) 存储在不高于-20°c 的状态下, 以便长期储存, 并随后分析介质成分的变化。
4. 微藻生物质的收获和冷冻干燥
- 用一个刻度圆筒 (例如,从最初含有200毫升介质的生物反应器中测量每个生物反应器的固定藻类培养量, 并将其转移到离心机瓶中。在每次测量之间用dh2o 冲洗刻度缸。
- 离心以 4, 696 x 克5分钟的速度离心, 通过小心吸尘将上清剂取出。
- 将颗粒转移到标记为50毫升管的管。用dh2o 冲洗离心机瓶, 并将内装物转移到50毫升管中。确保管总体积不超过45毫升。
- 用dh2o 清洗藻类颗粒以去除盐。
- 以 4, 696 x 克离心 50 ml 管 5分钟, 并丢弃上清液。
- 在每个50毫升管中加入 40 ml dh2o;漩涡混合。再次离心为 4, 696 x 克 5分钟, 并丢弃上清液。
- 再次重复步骤4.4.2。
- 标记和称空的15毫升离心机管在4个十进制的平衡 (标签盖和管, 并称他们在一起)。每个藻类培养一个管的重量。每根15毫升管称量两次, 以最大限度地减少误差。
- 最后清洗后, 丢弃上清液, 在每个50毫升管中加入7.5 毫升的 dh2o.涡旋并将藻类浆料转移到预称的15毫升管中。用额外的 dh2o 冲洗50毫升管, 并将液体转移到15毫升管。避免在15毫升管中总体积超过12毫升。
- 以 4, 696 x 克离心15毫升管 5分钟, 并对上清液进行分离。在-80°c 下, 用颗粒将管材冷冻至少 30分钟, 为冷冻干燥做准备。
- 冷冻干燥一夜或直到干燥。
- 称重并记录冻干的15毫升管与藻类。
5. 用改良折叠法提取脂质 24
- 将20毫克的冻干藻类生物量称量成2毫升螺帽聚丙烯管 (检查制造商标签, 确保产品适用于珠子提取)。
- 在每管2毫升管 (含有20毫克冻干藻类) 中加入1.5 毫升的 folch 溶剂 (2:1 氯双甲醇)。将 ~ 0.5 ml 锆/二氧化硅珠 (0.5 mm) 浸入每个管中, 直到管内液位达到2毫升。
注意: 在烟罩中处理氯仿和甲醇, 避免吸入烟雾或皮肤接触。 - 将藻类样品在珠磨中以 6.5 m/的速度进行 20倍, 将试管转移到冰上 30秒, 使样品冷却。再重复五次, 以完全提取脂质。
- 通过包含不锈钢网盘 (#60 网) 的5毫升注射器过滤均质, 将珠子拉拔, 在 15 ml 管中收集滤液。
- 用1.5 毫升的 folch 溶剂清洗珠子, 必要时用注射器将液体推送通过。再重复两次清洗, 收集15毫升管内的所有滤液, 最终体积约为6毫升。
- 在 15 ml 管中的 folch 萃取物中加入 1.2 ml 的 0.9% (w/v) ncl 溶液, 搅拌均匀。
注: 如有必要, 可以使用更多的 folch 溶剂清洗珠子 (使用0.2倍的总洗涤量0.9% 氯化钠溶液诱导相分离)。 - 以 6, 000 x 克离心 15 ml 管, 5分钟. 使用 15 ml 管一侧的线, 将底部氯仿 (绿色) 相位体积记录到最接近的 0.1 ml。使用玻璃巴斯德移液器将底部相转移到玻璃小瓶 (带盖子) 上。
- 如果有计划使用此提取物进行脂肪酸分析, 请将脂质存放在-20°c 或 (-80°c)。
6. 使用微板法进行中性脂质检测 (改编自higgins 等人, 2014年22)
- 准备库存解决方案。以氯仿的形式制备10毫升 1 mg/ml 植物油标准, 并在-20°c 下储存。
注: 本试验中可能使用任何植物油, 因为它对脂肪酸的类型不敏感。在二甲基亚硫酸盐 (dmso) 中制备10μgml 尼罗河红液, 并在室温下在黑暗中储存。 - 在烟罩中预热干燥的微板块至55°c。而这是加热, 稀释脂质提取物和植物油标准与甲醇3倍。
注: 这种稀释可以根据藻类的脂质含量来改变, 但这一水平对大多数小球藻都很管用。 - 对于每个稀释样品, 在96井聚丙烯微板中加入 80μl, 一式两份。
注意: 不建议在有机溶剂中使用聚苯乙烯塑料制品。 - 对于溶剂空白, 将2:1 种甲烷氯仿应用 80μl, 共四份。对于标准, 添加10、30、60、90和120μl 的稀释植物油标准, 一式两份。
- 将微板置于55°c 的干块加热器中, 时间为 20-30, 直到所有溶剂都蒸发。当溶剂蒸发时, 准备工作的尼罗河红色溶液 (每个板需要200μl 的 1μg ml 溶液)。例如, 12个样本和一套完整的标准需要16毫升的1.0μg/ml 溶液;通过将200μgml 库存 (dmso) 溶解到16毫升 dh2o中进行制备。
- 从加热块中取出微板, 冷却至室温。在每口井中加入30μl 异丙醇, 并通过上下移液混合。确保所有移液器通道混合溶液并重新悬浮脂质, 产生均匀的绿色液体。
- 在每口井中加入200μl 尼罗河红液 (1μg/ml), 将移液器向上部混合10次。在室温下将板材孵化5分钟。在等待时, 通过将漂白剂 (6% 次氯酸盐) 与每口干 dh2o. 20μl 混合, 制备50% 的漂白剂溶液.制备3毫升的50% 漂白剂就足以满足12个样品和一套完整的标准。
- 在每个微板井中加入20μl 的漂白剂溶液, 上下移液器 5次, 搅拌均匀。在室温下孵化30分钟。
- 30分钟后, 在 530 nm 发射时每5-10 读一次荧光, 530 nm 发射, 自动截止设置为 530 nm, 直到藻类样品发出的信号稳定。通常情况下, 总孵育60分钟就足够了。
- 创建植物油标准的校准曲线 (在0-40 纳克油井的范围内)。
注: 线性配合适用于低 (和 lt;30 ng/well) 油浓度, 如果标准超过 30 ng/well, 则可使用多项式配合。使用这种相关性来量化样品井中的中性脂质。
结果
此过程在 od 550 nm 处生成藻类光学密度数据的时间过程 (图 4 a)。光学密度和干重浓度数据可以相互关联 (图 4b)。这是通过在冷冻干燥步骤后首先计算最终的干重藻类浓度来实现的。其次, 培养系列稀释的光学密度 (在取样的最后一天进行) 与实际干重浓度可以相互关联。对于低细胞浓度, 可以使用线性相关性, 而对于较高的细胞浓...
讨论
在养殖藻类时, 最重要的考虑因素是了解生物体或生物群的具体需求。这里描述的藻类养殖系统可以用来培养广泛的藻类, 但具体的非生物因素 (温度、介质、ph 值、光强、二氧化碳水平、曝气率) 需要根据生物体的需要进行调整。请注意, 此处描述的参数用于培养小球藻和auxenooclella。这些生物具有工业意义, 因为它们能耐受高营养、光和温度水平27。然而, 通...
披露声明
作者没有什么可透露的。
致谢
美国农业部国家粮食和农业舱口项目 ala0higins 和奥本大学院长办公室、研究副总裁和 samuel ginn 工程学院为这项研究提供了支持。nsf 赠款 cbet-1438211 也提供了支助。
材料
| Name | Company | Catalog Number | Comments |
| Supplies for airlift photobioreactor setup | |||
| 1 L Pyrex bottles | Corning | 16157-191 | For bottle reactors, humidifiers |
| 1/2" hose clamp | Home Depot | UC953A | or equivalent |
| 1/4" female luer to barb | Nordson biomedical | Nordson FTLL360-6005 | 1/4" ID, PP |
| 1/4" ID, 3/8" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-244 | 50' |
| 1/4" in O-rings | Grainger | 1REC5 | #010 Medium Hard Silicone O-Ring, 0.239" I.D., 0.379"O.D. |
| 1/8" Female luer to barb | Nordson biomedical | FTLL230-6005 | |
| 1/8" ID, 1/4" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-608 | 250' |
| 1/8" male spinning luer to barb | Nordson biomedical | MLRL013-6005 | |
| 1/8" multiport barb | Nordson biomedical | 4PLL230-6005 | 1/8" multiport barb |
| 1/8" NPT to barb | Nordson biomedical | 18230-6005 | 1/8" 200 series barb |
| 1/8" panel mount luer | Nordson biomedical | Nordson MLRLB230-6005 | 1/8", PP |
| 10 gallon fish tank | Walmart | 802262 | Can hold up to 8 bioreactors depending on layout |
| 100-1000 ccm flow meter | Dwyer | RMA-13-SSV | For bottle reactors |
| 2 ft fluorescent light bank | Agrobrite | FLT24 T5 | |
| 200-2500 ccm flow meter | Dwyer | RMA-14-SSV | For air regulation upstream of humidifier |
| 250 mL Pyrex bottles | Corning | 16157-136 | For gas mixing after humidifier |
| 50-500 ccm flow meter | Dwyer | RMA-12-SSV | For hybridization tube reactors |
| 5-50 ccm flow meter | Dwyer | RMA-151-SSV | For CO2 flow rate control |
| Air filters 0.2 µm | Whatman/ Fisher | 09-745-1A | Polyvent, 28 mm, 0.2 µm, PTFE, 50 pack |
| Check valves | VWR | 89094-714 | |
| Corning lids for pyrex bottles | VWR | 89000-233 | 10 GL45 lids |
| Female luer endcap | Nordson biomedical | Nordson FTLLP-6005 | Female stable PP |
| Hybridization tubes | Corning | 32645-030 | 35x300 mm, pack of 2 |
| Light timer | Walmart | 556393626 | |
| Locknuts | Nordson biomedical | Nordson LNS-3 | 1/4", red nylon |
| Low profile magnetic stirrer | VWR | 10153-690 | Low profile magnetic stirrer |
| Male luer endcap | Nordson biomedical | Nordson LP4-6005 | Male plug PP |
| Spinning luer lock ring | Nordson biomedical | Nordson FSLLR-6005 | |
| Stir bars - long | VWR | 58949-040 | 38.1 mm, for bottle reactors |
| Stir bars - medium | VWR | 58949-034 | 25 mm, for hyridization tubes |
| Supplies and reagents for culturing algae | |||
| 0.2 µm filters | VWR | 28145-491 | 13 mm, PTFE, for filtering spent media from daily culture sampling |
| 1 mL syringes | Air-tite | 89215-216 | For filtering spent media from daily culture sampling |
| 1.5 mL tubes | VWR | 87003-294 | Sterile (or equivalent) |
| 10 mL Serological pipettes | Greiner Bio-One | 82050-482 | Sterile (or equivalent) |
| 100 mm plates | VWR | 25384-342 | 100x15 mm stackable petri dishes, sterile |
| 15 mL tubes | Greiner Bio-One | 82050-276 | Sterile (or equivalent), polypropylene |
| 2 mL Serological pipette tips | Greiner Bio-One | 82051-584 | Sterile (or equivalent) |
| 2 mL tubes | VWR | 87003-298 | Sterile (or equivalent) |
| 50 mL tubes | Greiner Bio-One | 82050-348 | Sterile (or equivalent), polypropylene |
| 96 well microplate | Greiner Bio-One | 89089-578 | Polystyrene with lid, flat bottom |
| Inocculating loops | VWR | 80094-478 | Sterile (or equivalent) |
| Liquid carbon dioxide tank and regulator | Airgas | CD-50 | |
| Supplies and reagents for lipid extraction and neutral lipid assay | |||
| 2 mL bead tubes | VWR | 10158-556 | Polypropylene tube w/ lid |
| 96 well microplates | Greiner Bio-One | 82050-774 | Polypropylene, flat bottom |
| Bleach | Walmart | 550646751 | Only use regular bleach, not cleaning bleach |
| Chloroform | BDH | BDH1109-4LG | |
| Dimethyl sulfoxide | BDH | BDH1115-1LP | |
| Isopropyl alcohol | BDH | BDH1133-1LP | |
| Methanol | BDH | BDH20864.400 | |
| Nile red | VWR | TCN0659-5G | |
| Pasteur pipette tips | VWR | 14673-010 | |
| Sodium chloride | BDH | BDH9286-500G | |
| Vegetable oil | Walmart | 9276383 | Any vegetable oil should work as long as it is fresh |
| Zirconia/ silica beads (0.5 mm diameter) | Biospec products | 11079105z | |
| Equipment | |||
| Analytical balance | Mettler-Toledo | XS205DU | Capable of at least 4 decimal accuracy |
| Bead homogenizer | Omni | 19-040E | |
| Benchtop micro centrifuge | Thermo | Heraeus Fresco 21 with 24x2 | Including rotor capable of handling 1.5 and 2 mL tubes |
| Dry block heater | VWR | 75838-282 | Including dry block for a microplate |
| Freeze dryer | Labconco | 7670520 | 2.5L freeze drying system |
| Large benchtop centrifuge | Thermo | Heraeus Megafuge 16R Tissue | Including rotors capable of handling 400 mL bottles, 50 mL tubes, and 15 mL tubes |
| Microplate reader | Molecular Devices | SpectraMax M2 | Capable of reading absorbance and fluorescence |
| Vortex mixer | VWR | 10153-838 |
参考文献
- Prandini, J. M., et al. Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgae Scenedesmus spp. Bioresource Technology. , 67-75 (2016).
- Liu, C., et al. Phycoremediation of dairy and winery wastewater using Diplosphaera sp. MM1. Journal of Applied Phycology. 28 (6), 3331-3341 (2016).
- Passero, M., Cragin, B., Coats, E. R., McDonald, A. G., Feris, K. Dairy Wastewaters for Algae Cultivation, Polyhydroxyalkanote Reactor Effluent Versus Anaerobic Digester Effluent. BioEnergy Research. 8 (4), 1647-1660 (2015).
- Hodgskiss, L. H., Nagy, J., Barnhart, E. P., Cunningham, A. B., Fields, M. W. Cultivation of a native alga for biomass and biofuel accumulation in coal bed methane production water. Algal Research. 19, 63-68 (2016).
- Gao, C., et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics. 15, (2014).
- Burch, A. R., Franz, A. K. Combined nitrogen limitation and hydrogen peroxide treatment enhances neutral lipid accumulation in the marine diatom Phaeodactylum tricornutum. Bioresource Technology. 219, 559-565 (2016).
- Brennan, L., Owende, P. Biofuels from microalgae--A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable Sustainable Energy Reviews. 14 (2), 557-577 (2009).
- Branyikova, I., et al. Microalgae - Novel highly efficient starch producers. Biotechnology and Bioengineering. 108 (4), 766-776 (2010).
- Chalima, A., et al. Utilization of Volatile Fatty Acids from Microalgae for the Production of High Added Value Compounds. Fermentation. 3 (4), (2017).
- Harun, R., Singh, M., Forde, G. M., Danquah, M. K. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and Sustainable Energy Reviews. 14 (3), 1037-1047 (2010).
- Liu, L., et al. Development of a new method for genetic transformation of the green alga Chlorella ellipsoidea. Molecular biotechnology. 54 (2), 211-219 (2013).
- Cheng, J., et al. Mutate Chlorella sp. by nuclear irradiation to fix high concentrations of CO2. Bioresource Technology. 136, 496-501 (2013).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Sales, C. M., Au, Comparison of Scale in a Photosynthetic Reactor System for Algal Remediation of Wastewater. Journal of Visualized Experiments. (121), e55256 (2017).
- Higgins, B. T., et al. Cofactor symbiosis for enhanced algal growth, biofuel production, and wastewater treatment. Algal Research. 17, 308-315 (2016).
- Higgins, B., et al. Algal-bacterial synergy in treatment of winery wastewater. Nature Clean Water. 1 (6), (2017).
- Higgins, B. T., et al. Impact of thiamine metabolites and spent medium from Chlorella sorokiniana on metabolism in the green algae Auxenochlorella prototheciodes. Algal Research. 33, 197-208 (2018).
- Lépinay, A., et al. First insight on interactions between bacteria and the marine diatom Haslea ostrearia: Algal growth and metabolomic fingerprinting. Algal Research. 31, 395-405 (2018).
- Franchino, M., Comino, E., Bona, F., Riggio, V. A. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate. Chemosphere. 92 (6), 738-744 (2013).
- Choix, F. J., Lopez-Cisneros, C. G., Mendez-Acosta, H. O. Azospirillum brasilense Increases CO2 Fixation on Microalgae Scenedesmus obliquus, Chlorella vulgaris, and Chlamydomonas reinhardtii Cultured on High CO2 Concentrations. Microbial Ecology. 76 (2), 430-442 (2018).
- Higgins, B., VanderGheynst, J. Effects of Escherichia coli on mixotrophic growth of Chlorella minutissima and production of biofuel precursors. PLoS One. 9 (5), e96807 (2014).
- Higgins, B., Thornton-Dunwoody, A., Labavitch, J. M., VanderGheynst, J. S. Microplate assay for quantitation of neutral lipids in extracts from microalgae. Analytical Biochemistry. 465, 81-89 (2014).
- Tanadul, O. U., Vandergheynst, J. S., Beckles, D. M., Powell, A. L., Labavitch, J. M. The impact of elevated CO2 concentration on the quality of algal starch as a potential biofuel feedstock. Biotechnology and Bioengineering. 111 (7), 1323-1331 (2014).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Higgins, B. T., et al. Informatics for improved algal taxonomic classification and research: A case study of UTEX 2341. Algal Research. 12, 545-549 (2015).
- Garrett, R. H., Grisham, C. M. . Biochemistry. , 578-730 (2012).
- de-Bashan, L. E., Trejo, A., Huss, V. A. R., Hernandez, J. -. P., Bashan, Y. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater. Bioresource Technology. 99 (11), 4980-4989 (2008).
- Wang, Q., Higgins, B., Ji, H., Zhao, D. . Annual International Meeting of the ASABE. , (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。