Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kabarcık sütun Photobioreactors ve bir tahlil yeşil mikroalg ekimi için nötr lipitler
Bu Makalede
Özet
Burada, laboratuvar ölçekli kabarcık sütun photobioreactors oluşturmak ve onları kültür mikroalg için kullanmak için bir iletişim kuralı mevcut. Ayrıca kültür büyüme oranı ve tarafsız lipid içeriğin belirlenmesi için bir yöntem sağlar.
Özet
Mikroalg üretim Biyoyakıt, yüksek değerli ürünler, gibi mühendislik uygulamaları için ve atıkları tedavisi için çalışmanın önemli ilgi vardır. En yeni araştırma çabalarının laboratuvar ölçekte başladığınızda, tekrarlanabilir bir şekilde mikroalg kültür için uygun maliyetli yöntemler için bir ihtiyaç vardır. Burada, biz kültür mikroalg laboratuvar ölçekli photobioreactors ve büyüme ve tarafsız lipid içeriğin bu alg ölçmek için etkili bir yaklaşım iletişim. Yönergeler de photobioreactor sistemi kurmak nasıl yer almaktadır. Örnek organizmalar Chlorella ve Auxenochlorellatür olmakla birlikte, bu sistem mikroalg yosun sigara-alg türleri ile ortak kültürleri de dahil olmak üzere, çok çeşitli yetiştirmek için adapte edilebilir. Hisse senedi kültürler ilk inoculum photobioreactor sistemi için üretmek şişelerde yetiştirilmektedir. Yosun inoculum konsantre ve photobioreactors ekimi toplu modunda aktarılır. Örnekleri her gün optik yoğunluk okumaları için toplanır. Toplu iş kültür sonunda hücreleri tarafından yıkanmış, santrifüj, hasat ve son Kuru ağırlık konsantrasyonu elde etmek için kuru dondurma. Son Kuru ağırlık konsantrasyon optik yoğunluk ve Kuru ağırlık konsantrasyonu arasında bir ilişki oluşturmak için kullanılır. Değiştirilmiş Folch yöntemi daha sonra toplam lipidler dondurularak biyokütle ayıklamak için kullanılır ve özü Mikroplaka tahlil kullanarak tarafsız lipid içeriğini denetlesinler. Bu tahlil daha önce yayımlandı, ancak protokol adımları burada kritik hataları sık sık oluştuğu yordamın adımlarını vurgulamak için dahil edildi. Burada açıklanan biyoreaktör sistemi basit şişesi yetiştirme ve ticari Biyoreaktörler tam kontrollü arasında bir niş doldurur. Hatta sadece 3-4 biyolojik ile tedavi çoğaltır, yosun kültür bizim yaklaşım büyüme ve lipid deneyleri sıkı standart sapmaları yol açar.
Giriş
Mikroalg Mühendisliği ve Biyoteknoloji Uygulama son yıllarda büyük ilgi çekti. Mikroalg okudu kullanılmak üzere Atıksu Arıtma1,2,3,4, biyoyakıt üretimi5,6,7,8ve üretim nutraceuticals ve diğer değeri yüksek ürünler9,10. Yosun da genetik olarak daha büyük oranlarda bir çaba onların zindelik belirli mühendislik uygulamaları11,12geliştirmek için değiştirilen. Sonuç olarak, deneme büyük ilgi ile endüstriyel ilgili kontrollü ayarları organizmalarda vardır. Bu yöntemin amacı kültür mikroalg kontrollü laboratuvar ortamında etkili bir yaklaşım iletişim kurmak ve büyüme ve tarafsız lipid içeriğin bu alg ölçmek için var. Büyüme artırma oranları ve tarafsız lipid mikroalg içeriğini iki anahtar performans sorunlarını ticarileştirilmesi alg biyoyakıt13doğru olarak belirlenmiştir.
Çok çeşitli yaklaşımlar kültür algler için Deneysel amaçlar için kullanıldığını. Genel olarak, bu yaklaşımları büyük ölçekli açık ekimi ve küçük ölçekli kapalı ekimi arasında bölünmüş olabilir. Photobioreactors ve açık havuzlar açık ekimi için deneme amaçlı laboratuvar ölçekte (ölçek-up yeni yüksek-lipid zorlanma alg sınamak içinÖrneğin, ) zaten kanıtlanmış süreçleri kadar ölçekleme uygun14. Ancak, kapalı küçük ölçekli ekimi yeni veya geliştirilmiş yosun suşları geliştirilirken uygundur veya biyolojik mekanizmaları anlama deneyler yapmak amaçlı. Bu ikinci durumda, deneysel kontrol derecesini yüksek biyolojik davranışı ince değişiklikleri dışarı alay için gereklidir. Bu amaçla, axenic kültürlerin kez kaçınılmaz olarak büyük ölçekli açık sistemlerinde büyümeye diğer organizmalar (Örneğin bakteri, diğer algler) ile ilişkili karmaşık biyotik faktörler en aza indirmek için gereklidir. Alg ve diğer organizmalar arasındaki etkileşimler bile okurken, biz son derece kontrollü deneysel koşullar kullanımı organizmalar15,16,17arasında moleküler değişimi incelerken yararlı bulduk.
Küçük ölçekli kapalı yosun ekimi kategori içinde yaklaşımlar bir dizi kullanılmıştır. Belki de en yaygın bir shaker tablo altında bir ışık banka18,19Erlenmeyer şişeler içinde yosun büyümeye yaklaşımdır. Oksijen ve CO2 Exchange tarafından pasif difüzyon balonun üstündeki bir köpük fiş aracılığıyla gerçekleşir. Bazı araştırmacılar bu kurulum şişeler20etkin havalandırma yoluyla iyileştirilmiştir. Yosun heyecan bar ve etkin havalandırma tarafından karışık şişelerde yetiştirmek için başka bir yaklaşımdır. Onların basitliğine rağmen bulduk şişe ve şişe kez biyolojik çoğaltır arasında tutarsız sonuçlara yol açar. Muhtemelen bu pozisyon etkileri nedeniyle - farklı pozisyonlarda da iç Reaktör sıcaklığı etkiler ışık, farklı miktarda almak. Günlük rotasyon reaktörler yeni pozisyonlar için yardımcı olabilir ama sorun çünkü hafifletmek değil yosun büyümesini belirli aşamalarında (Örneğin, erken üstel) pozisyonel etkileri (Örneğin, log fazı) diğerlerine göre daha hassas.
Teknolojik gelişmişliği spektrum karşı tarafta tam kontrollü ticari photobioreactors vardır. Bu sistemler sürekli olarak izlemek ve yosun büyümesini optimize etmek için reaktör koşullarda ayarlayın. Programlanabilir aydınlatma, gerçek zamanlı sıcaklık kontrolü ve pH kontrolü ellerinde. Ne yazık ki, onlar pahalı ve genellikle reaktör birkaç bin dolarlık mal. En bilimsel ve mühendislik günlükleri sonuçlarının birden çok Biyoreaktörler satın gerektiren biyolojik çoğaltma gerektirir. Burada basit (balon) ve sofistike (biyoreaktör) tam kontrollü arasındaki laboratuvar ölçekli yosun ekimi için yaklaşımlar bu köprü bir kabarcık sütun reaktör sistem mevcut. Kabarcık sütunları gaz kabarcıkları gaz alışverişini kolaylaştırmak ve reaktör karışımı kullanın. Bu yaklaşım bazı ışık ve sıcaklık kontrol sağlayan ama çok maliyet-etkili bir şekilde yapar. Ayrıca, biz biyolojik çoğaltır şişesi veya şişe yaklaşım karşılaştırıldığında istatistiksel olarak anlamlı sonuçlar elde etmek için gerekli olan gerekli sayısını azaltarak biyolojik çoğaltır arasında son derece tutarlı sonuçlar için bu sistemi bulduk. Bu sistem de başarıyla karışımları yosun ve bakteri21yetiştirmek için kullandık. Yosun ekimi yanı sıra, kültürlü yosun tarafsız lipid içeriğindeki ölçmek için bir yordam anahat. İkinci yöntem olmuştur, ama başka bir yerde22yayınlanan nasıl başarılı bir şekilde istihdam konusunda adım adım yönergeler sağlamak için yordam eklemeniz.
Protokol
1. Kurulum kabarcık sütun Photobioreactors
- 1 L cam şişeler ve hibridizasyon tüpler (şematik ve fotoğraflar için Şekil 1 bakınız) birlikte gelen plastik kapakları dan Bacalı kapakları kümesi oluşturun. Tuzak, her hava Asansör photobioreactor ve her şişe reaktör karıştırma nemlendirici için kapakları oluşturmak.
- Matkap ¼" kapak delik: 2 delik için biyoreaktör ve nemlendirici kapakları; ihtiyaç vardır 3 delik karıştırma tuzak için ihtiyaç vardır.
- Bir ¼" O-ring konu üzerinde bir 1/8" paneli monte radarı uydurma, kayma ve bu kapak (Şekil 1A) delinmiştir ¼" delik kaydırın.
- Kayma bir ikinci ¼" O-ring konu üzerinde böylece kapak iki O-halkalar arasında sandviç olduğunu. Konu üzerine bir locknut kayma ve panel montaj radarı yerde düzeltmek için sıkın.
- Kilit halkaları maruz erkek radarı kapak projelendirme üzerine oturtun. Adımları 1.1.2-1.1.4 her deliğin kapağı için yineleyin.
- Kabarcık reaktörler üzerinde sütun ve şişe, kullanılan kapaklar eklemek için 1/8" kadın radarı barb bağlantı parçaları için 1,5" için 1/8" kimliği PVC boru parçaları. Bunlar her birine kapağı üzerinde maruz erkek radarı bağlantı parçaları ekleyin.
- Bir kontrol vanası (uzak kapağı işaret) ücretsiz bir 1/8" için ucunu parçalar.
Not: Bu biyoreaktör için egzoz bağlantı noktası olarak görev yapacak. - Barb ikinci parçası 1/8" kapak projelendirme boru için uygun bir erkek radarı bağlayın. Yerine dönen kilit halkayı tıklatın ve 0.2 mm hava filtresi bu tutturmak.
Not: Bu reaktör için giriş noktası olarak görev yapacak.

Şekil 1. Şematik ve Biyoreaktörler oluşturmak için fotoğraflar. (A)şematik biyoreaktör inşaatı için kapakları monte biyoreaktör kapak fotoğrafı (B) ve (C) için nemlendirici kullanılan birleştirilmiş kapak fotoğrafı. Nemlendirici bağlantı parçaları içinde bir hava sızdırmaz conta kapak ile emin olmak için su geçirmez silikon kaplı olması unutmayın. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- Hava dağıtım sistemi montajı ( Şekil 2A ve 2B'yi bir şematik ve fotoğraf için bakınız).
- Giriş ve çıkışları her Rotametre arkasında için barb bağlantı parçaları için 1/8" NPT iş parçacığı ekleme.
Not: 200-2500 cm3/min rotameters hava basıncı modülasyon, nemlendirici için akıntıya karşı 100-1000 cm3/min rotameters çoğu için şişe reaktörler, 50-500 cm3/min rotameters olan hava Asansör Biyoreaktörler ve 5-50 cm3için / Min rotemeters için CO2 akışı düzenleme vardır. Bu Dağı rotameters sabit bir yüzeye (Örneğin plastik levha) için tavsiye edilir böylece onlar işlemi sırasında düşmemesi. - Basınçlı hava kaynağı çeneni, ardından ¼" kimliği esnek PVC boru basınçlı hava kaynağı için bir hortum kelepçesi ile bağlayın. Hortum çapı 1/8" kimliği PVC esnek boru bir ¼" barb uygun ve bir 1/8" barb montaj için erkek kadın kullanarak adım.
- Ücretsiz 1/8" kimliği boru 200-2500 cm3/min Rotametre koya ucunu.
Not: Bu Rotametre çıkış yolu ile 1/8" kimliği boru nemlendirici şişe besleyecek. - 1/8" Bacalı kapak (kullanım barb bağlantıyı yapmak için uygun bir kadın radarı) için bir giriş için boru bağlayın. Sonra ikinci biteviye-in 1/8" paneli monte iç boru bağlanmak uygun.
Not: Bu parça aşağı içine nemlendirici ve su balonu havada askıda kalacaktır. - 1/8" eklemek bağlantı parçaları için bir parça kimliği boru 1/8" her iki ucuna barb ve çıkış yeri nemlendirici, karıştırma tuzak koya bağlanmak için bu parça için kadın radarı.
- 1.2.5 aynı şekilde, CO2 regülatör priz karıştırma tuzak üzerinde ikinci bir bağlantı noktasına bağlayın.
- 1/8" kullanarak bir manifold oluşturmak boru ve 1/8" birden çok bağlantı noktalı barb ( 2 C rakamhava Rotametre bankalar beslemek için bakınız).
Not: Bu rotameters Biyoreaktörler sağlamak için kullanılır. Serisi 6'dan fazla rotameters inşa kaçının. Rotameters paralel bankalar sistemi genişletmek için kullanın. Toplam akış isteğe bağlı tüm reaktörler için 2500 cm3/min daha az olduğundan emin olun (veya başka bir büyük Rotametre gerekli olacak nemlendirici, ters yönde). - 1/8" Borulama ve bir 1/8" barb radarı kadın kullanarak yeni inşa edilmiş Rotametre bankalara karıştırma tuzak (3rd bağlantı noktası) çıkış bağlayın.
- Yeterince uzun 1/8" her Rotametre Biyoreaktörler için hava sağlamak için Rotametre bankada Outlet boru bağlayın. Banka rotameters yanı sıra tüp ucunun etiketleyin.
- Tüm bağlantı noktaları etrafında su geçirmez silikon nemlendirici ve hava sıkı olduklarından emin olmak için tuzak kapağı karıştırma uygulayın.
- Giriş ve çıkışları her Rotametre arkasında için barb bağlantı parçaları için 1/8" NPT iş parçacığı ekleme.
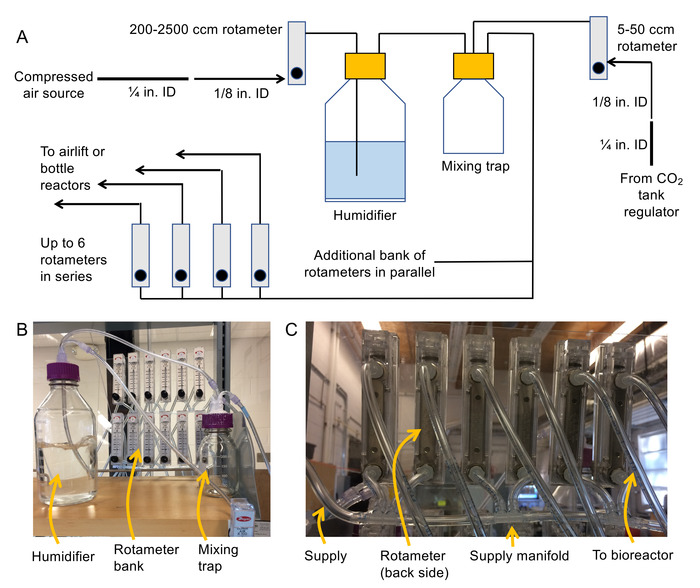
Şekil 2. Şematik ve kabarcık sütun sistemi montajı için fotoğraflar. Nemlendirici ve havalandırma sistemi (B) fotoğraf(a)şeması tuzak ve Rotametre banka ve (C) fotoğraf Rotametre bankalar birbirine bağlamak için kullanılan Manifoldlar, karıştırma. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- Balık tank ayarla, tabak ve ışıkları (Şekil 3) ilave edin.
Dikkat: Bu sistem çok sayıda satış ve tüm bileşenleri desteklemek için yeterli devre kapasitesi gerektirir. Bu bir elektrik tehlikesi olduğu için birlikte birden çok anahtarlı uzatma kabloları ve uzatma kablosu bir zincirleme moda çekimi kaçının. GFI türü çıkışları ve anahtarlı uzatma kabloları içinde belgili tanımlık sistem son derece su varlığı nedeniyle teşvik edilmektedir.- Düşük profilli manyetik karıştırıcı balık su dolu tank ağırlık tutabilecek kadar güçlü bir yüzeyin üzerinde düzenleyin.
- (Biraz karıştırın tabakları uzun olan) küçük ahşap veya plastik blok çevresinde balık tank ağırlığını desteklemek için heyecan plakaların yerleştirin.
Dikkat: ağırlığı onları ezeriz gibi balık tank doğrudan heyecan tabaklarda yerleştirmekten kaçının. - Balık tank karıştırın tabakları üzerinde koyun ve blok destek ve tankları su ile doldurun.
- Üstünde tepe-in akvaryum bir kapak olarak sığacak şekilde sert bir plastik levha bir parça kes. Hibridizasyon tüpler içeri ve dışarı kaydırmak için bu kapağı delik kesti. Ayrıca balık tank ısıtıcı için bir delik.
- Floresan ışık bankalar Biyoreaktörler yatay aydınlatma sağlamak için akvaryumun yanındaki Düzenle. Işık banka bir gün/gece döngüsü ayarlamak için hafif bir Zamanlayıcı takın.

Şekil 3. Sistem (solda) şişe Biyoreaktörler ve kabarcık sütun photobioreactors (sağda) için şematik. Bu rakam Higgins vd. değiştirildi 17. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
2. mikroalg Inoculum hazırlanması
- Mikroalg inoculum soguk korunmuş, kaplama veya sıvı kültüründen elde edilir.
Not: Bu cryopreserved organizmalar olarak inoculum hücreler uygun ve ortaya çıkan kültür axenic olduğundan emin olun kullanmak önce kaplama tavsiye edilir. Agar Orta (Örn., ATCC #5 agar sporulating)21 yaşında iyi Chlorella ve Auxenochlorella tür cryo-depolama canlandırılması için çalışır bir zengin Orta. - Belirli mikroalg türler için uygun olan mineral Orta 2.4 L hazırlayın.
Not: N8 orta23 Chlorella, N8-NH4 orta21 Auxenochlorellatür için tür için örnekler. Bir orta için yosun zor uygun sağlam yosun büyüme sağlanması yönünde en önemli adımlardan birini kullanmaktır. - Eşit içine üç 1 L cam şişeler, mineral orta aliquot 2.4 L barlar her şişe karıştırın ve Bacalı kapakları (Şekil 1) araya her şişe için ekleyin. Bu havalandırma tüpü giriş yan ve her şişe üzerinde kontrol bir heyecan barı var.
- Otoklav sıvı sterilizasyon kullanarak hisse senedi şişe (121 ° C) kaplama için kullanılan daha sonra aynı anda 30 dk. otoklav 100 mL deiyonize su (dH2O) ve bazı 1,5 mL tüpler için döngüsü. Orta serin gece kalmak için izin verir. Alternatif olarak, oda sıcaklığında reaktöre serin ve aşılama öncesinde 2 h için havalandırmak.
- Bir Biyogüvenlik içinde dolap (BSC), hisse senedi şişe mikroalg bir tabak veya axenic sıvı kültürü aşılamak. Aşağıdaki adımlarda axenic kültürleri korumak için steril tekniği kullanın.
- Autoclaved dH2O 20 mL steril 50 mL santrifüj tüpü ekleyin. Steril bir 10 µL tek kullanımlık döngü tek sömürgeler kimden adım 2.1 tabaktan almak için kullanın. Döngü 50 mL tüp içine daldırma ve yosun hücreleri 20 mL autoclaved dH2O. bir homojen mikroalg çözüm yapmak için Shake 50 mL tüp yıkayın.
- 6 mL mikroalg çözeltisi her hisse senedi şişe içine ile 10 mL steril serolojik pipet pipet. Mikroalg eşit olarak orta karıştırmak için şişe girdap.
- 2 mL steril serolojik pipet 1 mL numune her hisse senedi şişe ve transfer steril 1,5 mL tüpler içine çizmek için kullanın.
Not: Mikropipetler kirlenme riski nedeniyle bu adım için tavsiye edilmez. Hisse senedi şişe üzerinde Bacalı kapakları sıkın. - Hisse senedi şişe karıştırın tabakları (~ 150 devir/dakika) yerleştirin ve hava debisi, CO2ve bu tür için uygun aydınlatma düzeyleri ayarlayın. Hisse senedi şişe pozisyon her gün döndürün.
- Adım 2.6 sırasında elde edilen 1 mL numune seyreltik (steril su 100-fold seyreltme genellikle iyi çalışıyor) ve zengin agar orta tabağa yayıldı.
Not: Bu plakaları kirlenme örneklerini de gelecek yosun inoculum için bir kaynak olarak hizmet olarak daha fazla deneyler için kontrol etmek için kullanılabilir. - Örnekleri mikroalg büyüme denetlemek için iki günde şişelerde (BSC) almak.
96-şey Mikroplaka nüsha (200 µL) içinde gerçekleşti örnekleri ve ölçmek optik yoğunluk (OD) de 550 nm ve 680 nm iki günde OD kadar ulaşır 0.2-0.3 (ki genellikle 5-7 gün) gerektirir. - Kuluçka durdurmak ve bir banka için 24-48 h yosun hücreleri yerçekimi tarafından yerleşmek için izin vermek hisse senedi şişe yerleştirin.
Not: Kapatılan hücreleri sonraki kabarcık sütun photobioreactors aşılamak için kullanılacaktır. Daha hızlı bir hücre toplama isterseniz, hücreler hücreleri toplamak için fazla 1000 x g centrifuged.
3. kabarcık sütun Photobioreactors mikroalg tarımı
- Biyoreaktör aşılama, önceki gün uygun ortam hazırlamak ve kabarcık sütun photobioreactor transfer 200 mL (veya istediğiniz birime) (hibridizasyon tüpler) tüpleri. Otoklav tüpleri ile medya ve Bacalı kapakları yerinde.
Not: Eğer Atıksu otoklav boş bir büyüme aracı olarak kullanarak Biyoreaktörler ve (axenic kültür arzu edilirse) Atıksu steril süzülmüş ekleyin. - Kapatılan mikroalg hisse senedi bir vakum pompası kullanarak süpernatant kaldırarak konsantre. Her şişe daha az 100 mL orta terk ancak kapatılan yosun kaldırma kaçının.
Not: Bu yordam bir BSC içinde yapmak ve steril tekniği uygulayın. Basit bir vakum aparatı vakum şişesi veya şişe kullanarak oluşturulabilir. Steril serolojik pipet tüp sonuna uygun. - Askıya alma ve yosun Bulamaç steril 50 mL santrifüj tüpleri için transfer. Daha fazla 5 min için 1000 x g, santrifüj yosun konsantre ol.
- BSC, yosun konsantreleri 12 photobioreacters için ~ 80 mL toplam hacmi elde etmek için yeterli süpernatant kaldırın. Pelet vakumlama kaçının. Yosun konsantre steril bir kap (veya kullanılan alg stok şişe) aktarın.
- Yosun Bulamaç 6 mL steril 10 mL serolojik pipet ile her photobioreactor içine ekleyin.
- Steril filtre (0.2 mm şırınga veya vakum filtre) ve autoclaved olamaz herhangi bir diğer bileşikler (Örneğin vitamini stokları) uygun miktarda ekleyebilirsiniz.
- Yosun orta karıştırmak için Biyoreaktörler girdap.
- 2 mL örnek bir serolojik pipet ve 2 mL tüp transferi kullanarak her biyoreaktör çizmek. 2 mL örnek (BSC içinde) her 24 h kültür ilerlemesini izlemek için toplamak. Kontrol pH kullanmak için örnek şeritler test ve reaktör ile 3 M NaOH veya 3 M HCl gerektiği gibi ayarlayın.
- Biyoreaktör kapakları sıkın ve tüm Biyoreaktörler balık tank su banyosu yerleştirin. Havalandırma, CO2ve aydınlatma türler için uygun seviyeye ayarlayın. Biyoreaktör pozisyon (adım 3.8) örnekleme sonra her gün döndürün.
- Nüsha her kültür örneğinin 200 µL 96 iyi Mikroplaka wells için geçerlidir. Ölçmek optik yoğunluk (OD) 550 nm ve 680 nm.
- Kültür dönemin son günü OD altında farklı seyreltme faktörler (Örneğin, 1 x, 2 x, 4 x, 8 x, 16 x ve 32 x) hasat (adım 4) sonra OD ve gerçek kuru ağırlığı arasında bir ilişki kurmak için ölçmek.
- 2 mL örnek tüp 12.000 x g 5 min için de santrifüj kapasitesi.
- Süpernatant 0.2 µm steril olmayan şırınga filtre ve süpernatant (ve gerekirse Pelet) Hayır saklamak-20 ° C uzun vadeli depolama ve medya bileşiminde değişiklikler daha sonraki analiz için daha yüksek.
4. hasat ve donma kurutma Microalgal biyokütle
- Yosun kültürü her biyoreaktör dereceli silindir (Örneğin, bir biyoreaktör orta o aslında içerdiği 200 mL den 160 mL) ile sabit bir hacim ölçmek ve santrifüj şişe aktarın. DH2O her ölçüm arasında ile mezun silindir durulayın.
- 5 dakika süreyle 4696 x g, santrifüj süpernatant atmak dikkatle dışarı vakumlama tarafından.
- Granül etiketli 50 mL tüpler için transfer. Santrifüj şişe dH2O ile ve transfer içeriği 50 mL tüpler için durulayın. Toplam boru birim 45 mL aşmaz olun.
- Yosun granül tuzları kaldırmak için dH2O ile yıkayın.
- 4696 x g 5 min için de 50 mL tüpler santrifüj kapasitesi ve süpernatant atın.
- 40 mL dH2O her 50 mL tüp ekleyin; girdap karıştırmak için. Tekrar 4696 x g 5 min için de santrifüj kapasitesi ve süpernatant atın.
- 4.4.2 tekrar adımları yineleyin.
- Etiket ve bir 4-ondalık denge üzerinde boş 15 mL santrifüj tüpleri tartmak (kapak ve tüp etiket ve onları birlikte tartmak). Yosun kültür başına bir tüp tartın. İki kez hata en aza indirmek için her 15 mL tüp tartın.
- Son yıkama sonra süpernatant atın ve dH2O 7.5 mL her 50 mL tüp ekleyin. Girdap ve transfer yosun çamurlar içine önceden ağırlığını 15 mL tüpler. 50 mL tüpler ek dH2O ile durulayın ve sıvı 15 mL tüpler için transfer. 15 mL tüpler toplam hacminin 12 mL aşmasını önlemek.
- 4696 x g 5 min için de 15 mL tüpler santrifüj kapasitesi ve süpernatant dikkatle boşaltmak. Granül-80 ° c en az 30 dk içinde dağılması için hazırlık için tüplerini dondur.
- Dondurma kuru gecede veya kurutulmuş kadar.
- Tartmak ve freeze kurutulmuş 15 mL tüpler yosun ile kayıt.
5. lipid ayıklama bir değişikliğin Folch yöntemi24 kullanarak
- 20 mg 2 mL vidalı kapak polipropilen boru (ürün boncuk çekimi için uygun olduğundan emin olmak için onay üretici etiket) içine kurutulmuş yosun biyokütle tartın.
- Folch solvent (2:1 kloroform/metanol) 1,5 mL (kurutulmuş yosun 20 mg içeren) her 2 mL tüp ekleyin. 2 mL sıvı düzeyi tüp ulaşana kadar ~0.5 mL zirkon/silika boncuk (0.5 mm) her tüpün içine dökün.
Dikkat: kloroform ve metanol duman başlıklı işlemek ve duman nefes önlemek veya ilgili kişi cilt. - Alg örnekleri 20 boncuk fabrikasında homojenize s 6,5 m/s Transfer tüplere 30 için buz hızında örnekleri sakinleşmesini s. Tam lipidler ayıklamak için beş kez daha tekrarlayın.
- Homogenate filtrate 15 mL tüp içinde toplama boncuklar, dışarı zorlanma bir paslanmaz çelik tel kafes disk (#60 mesh) içeren bir 5 mL şırınga aracılığıyla filtre.
- Boncuk Folch solvent, gereken şırınga sıvı itme 1,5 mL ile yıkayın. Bu yıkama iki kez daha tekrarlayın ve son hacmi yaklaşık 6 mL verimli 15 mL Tüp, tüm filtrate toplamak.
- 1.2 mL % 0,9 (w/v) NaCl çözüm 15 mL tüp Folch ayıklamak için ve girdap karıştırın ekleyin.
Not: gerekirse, daha fazla Folch solvent boncuk (kullanım %0,2 0,9 NaCl çözüm faz ayrımı ikna etmek için toplam yıkama hacmi x) yıkamak için kullanılabilir. - 6.000 x g 5 dk. kayıt yakın 0.1 mL 15 mL tüp tarafında hatlarını kullanarak alt kloroform (yeşil) faz birime de 15 mL tüpler santrifüj kapasitesi. Bir cam Pasteur pipet kullanarak alt aşamaya bir cam şişe (kapaklı) aktarın.
- -20 ° C'de lipid depolamak veya (varsa-80 ° C bu özü yağ asidi analiz için kullanmayı planlıyor).
6. nötr Lipid Mikroplaka yöntemiyle tahlil (Higgins vd. 201422) adapte
- Hisse senedi çözümleri hazırlayın. 10 mL 1 mg/mL bitkisel yağ standardında kloroform hazırlamak ve -20 ° C'de depolayın
Not: herhangi bir bitkisel yağ, yağ asitleri, türleri için duyarlı olmadığından bu tahlil kullanılıyor olabilir. 10 mL 200 µg/mL dimetil sülfoksit (DMSO) Nil kırmızı çözümde hazırlamak ve karanlık oda sıcaklığında saklayın. - Bir duman başlıklı 55 ° C bloğuna kuru Mikroplaka ön ısı. Bu Isıtma iken, lipid özleri ve bitkisel yağ standart 3-fold seyreltik metanol ile.
Not: Bu seyreltme algler lipid içeriğine göre değiştirilebilir, ancak bu seviyede de çoğu Chlorellaiçin çalışır. - Seyreltilmiş her örnek için bir 96 de Polipropilen Mikroplaka quadruplicate içinde 80 µL ekleyin.
Dikkat: Polistren plasticware kullanımı organik çözücüler ile kullanmak için tavsiye edilmez. - Boş çözücü için 80 µL 2:1 metanol/kloroform quadruplicate içinde geçerlidir. Standartları, 10, 30, 60, 90 ve 120 µL quadruplicate içinde standart seyreltilmiş bitkisel yağ ekleyin.
- Tüm çözücü buharlaşıp vardır kadar 20-30 dk 55 ° C'de bir kuru blok ısıtıcı Mikroplaka yerleştirin. Çözücü buharlaşarak iken, çalışma hazırlamak Nil kırmızı çözüm (1 µg/ml solüsyon plaka iyi ücret, gerek 200 µL). Örneğin, on iki örnekleri ve standartlara tam bir set gerektirir 1.0 µg/mL solüsyon 16 mL; 16 mL dH2O. (içinde DMSO) 200 µg/mL stokunun 80 µL çözülerek hazırlamak
- Mikroplaka Isıtma bloğundan kaldırmak ve oda sıcaklığında soğumaya bırakın. İzopropil alkol 30 µL her şey için ve yukarı ve aşağı pipetting tarafından karıştırın. Tüm pipet kanallar çözüm karıştırma ve homojen bir yeşil sıvı verimli lipidler, resuspending emin olun.
- Her şey, pipet için Nil kırmızı çözüm (1 µg/mL) 200 µL yukarı/aşağı karıştırmak için 10 kez ekleyin. Oda sıcaklığında 5 min için plaka kuluçkaya. Beklerken, bir % 50 çamaşır suyu çözüm çamaşır suyu (%6 hipoklorit) karıştırılarak2O. 20 µL iyi başına ihtiyaç vardır dH ile hazırlayın. 3 mL % 50 çamaşır suyu hazırlanması 12 örnekleri ve standartlar tam bir dizi için yeterlidir.
- Çamaşır suyu çözüm 20 µL her Mikroplaka de ekleyin ve iyice karıştırın için 5 kere yukarı ve aşağı pipet. Oda sıcaklığında 30 dk kuluçkaya.
- 30 dakika sonra floresans örneklerde her 5-10 dk 530 nm uyarma/575 nm Emisyon, 570'ayarla otomatik kesim ile okumak kadar alg örnekleri sinyalini stabilize nm. Tipik olarak, toplam kuluçka 60 dk yeterli olur.
- (0-40 ng petrol/iyi aralığında) bitkisel yağ standartları için bir kalibrasyon eğrisi oluşturun.
Not: Bir doğrusal inşaat düşük için de uygun (< 30 ng/iyi) yağ konsantrasyonu ve uygun bir polinom standart 30 ng/iyi geçmesi durumunda kullanılabilir. Bu korelasyon örnek Wells tarafsız lipid ölçmek için kullanın.
Sonuçlar
Bu yordamı bir zaman ders OD 550 nm (Şekil 4A) yosun optik yoğunluk veri verir. Optik yoğunluk ve Kuru ağırlık veri-ebilmek var olmak konsantrasyon korelasyon (Şekil 4B). Bu son Kuru ağırlık yosun konsantrasyon freeze-drying adım sonra hesaplayarak gerçekleştirilir. Daha sonra optik yoğunluğu (örnekleme son gününde gerçekleştirilen) kültür seri seyreltme ve gerçek Kuru ağırlık konsantrasyonları ile ili...
Tartışmalar
Yosun kültür zaman en önemli faktör bir organizma veya grup organizmalar özel ihtiyaçlarını anlaşılmasıdır. Yetiştirme sistemi burada anlatılan yosunlar ama belirli abiyotik faktörler (sıcaklık, medya, pH, ışık şiddeti, CO2 düzeyi, havalandırma oranı) geniş bir kültür için kullanılabilir yosun organizma ihtiyaçlarına ayarlanması gerekir. Not burada açıklanan parametreleri tarım Chlorella ve Auxenochlorellaiçin kullanıldı. Yüksek besin, ışık ve sıcakl...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu araştırma için destek USDA Ulusal Enstitüsü Gıda ve tarım ambarı projesi ALA0HIGGINS ve Provost, ahlak bozukluğu başkan için araştırma ve Samuel Ginn kolej mühendislik Auburn Üniversitesi ofisleri tarafından sağlandı. Destek de NSF tarafından sağlanan CBET 1438211 verin.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Supplies for airlift photobioreactor setup | |||
| 1 L Pyrex bottles | Corning | 16157-191 | For bottle reactors, humidifiers |
| 1/2" hose clamp | Home Depot | UC953A | or equivalent |
| 1/4" female luer to barb | Nordson biomedical | Nordson FTLL360-6005 | 1/4" ID, PP |
| 1/4" ID, 3/8" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-244 | 50' |
| 1/4" in O-rings | Grainger | 1REC5 | #010 Medium Hard Silicone O-Ring, 0.239" I.D., 0.379"O.D. |
| 1/8" Female luer to barb | Nordson biomedical | FTLL230-6005 | |
| 1/8" ID, 1/4" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-608 | 250' |
| 1/8" male spinning luer to barb | Nordson biomedical | MLRL013-6005 | |
| 1/8" multiport barb | Nordson biomedical | 4PLL230-6005 | 1/8" multiport barb |
| 1/8" NPT to barb | Nordson biomedical | 18230-6005 | 1/8" 200 series barb |
| 1/8" panel mount luer | Nordson biomedical | Nordson MLRLB230-6005 | 1/8", PP |
| 10 gallon fish tank | Walmart | 802262 | Can hold up to 8 bioreactors depending on layout |
| 100-1000 ccm flow meter | Dwyer | RMA-13-SSV | For bottle reactors |
| 2 ft fluorescent light bank | Agrobrite | FLT24 T5 | |
| 200-2500 ccm flow meter | Dwyer | RMA-14-SSV | For air regulation upstream of humidifier |
| 250 mL Pyrex bottles | Corning | 16157-136 | For gas mixing after humidifier |
| 50-500 ccm flow meter | Dwyer | RMA-12-SSV | For hybridization tube reactors |
| 5-50 ccm flow meter | Dwyer | RMA-151-SSV | For CO2 flow rate control |
| Air filters 0.2 µm | Whatman/ Fisher | 09-745-1A | Polyvent, 28 mm, 0.2 µm, PTFE, 50 pack |
| Check valves | VWR | 89094-714 | |
| Corning lids for pyrex bottles | VWR | 89000-233 | 10 GL45 lids |
| Female luer endcap | Nordson biomedical | Nordson FTLLP-6005 | Female stable PP |
| Hybridization tubes | Corning | 32645-030 | 35x300 mm, pack of 2 |
| Light timer | Walmart | 556393626 | |
| Locknuts | Nordson biomedical | Nordson LNS-3 | 1/4", red nylon |
| Low profile magnetic stirrer | VWR | 10153-690 | Low profile magnetic stirrer |
| Male luer endcap | Nordson biomedical | Nordson LP4-6005 | Male plug PP |
| Spinning luer lock ring | Nordson biomedical | Nordson FSLLR-6005 | |
| Stir bars - long | VWR | 58949-040 | 38.1 mm, for bottle reactors |
| Stir bars - medium | VWR | 58949-034 | 25 mm, for hyridization tubes |
| Supplies and reagents for culturing algae | |||
| 0.2 µm filters | VWR | 28145-491 | 13 mm, PTFE, for filtering spent media from daily culture sampling |
| 1 mL syringes | Air-tite | 89215-216 | For filtering spent media from daily culture sampling |
| 1.5 mL tubes | VWR | 87003-294 | Sterile (or equivalent) |
| 10 mL Serological pipettes | Greiner Bio-One | 82050-482 | Sterile (or equivalent) |
| 100 mm plates | VWR | 25384-342 | 100x15 mm stackable petri dishes, sterile |
| 15 mL tubes | Greiner Bio-One | 82050-276 | Sterile (or equivalent), polypropylene |
| 2 mL Serological pipette tips | Greiner Bio-One | 82051-584 | Sterile (or equivalent) |
| 2 mL tubes | VWR | 87003-298 | Sterile (or equivalent) |
| 50 mL tubes | Greiner Bio-One | 82050-348 | Sterile (or equivalent), polypropylene |
| 96 well microplate | Greiner Bio-One | 89089-578 | Polystyrene with lid, flat bottom |
| Inocculating loops | VWR | 80094-478 | Sterile (or equivalent) |
| Liquid carbon dioxide tank and regulator | Airgas | CD-50 | |
| Supplies and reagents for lipid extraction and neutral lipid assay | |||
| 2 mL bead tubes | VWR | 10158-556 | Polypropylene tube w/ lid |
| 96 well microplates | Greiner Bio-One | 82050-774 | Polypropylene, flat bottom |
| Bleach | Walmart | 550646751 | Only use regular bleach, not cleaning bleach |
| Chloroform | BDH | BDH1109-4LG | |
| Dimethyl sulfoxide | BDH | BDH1115-1LP | |
| Isopropyl alcohol | BDH | BDH1133-1LP | |
| Methanol | BDH | BDH20864.400 | |
| Nile red | VWR | TCN0659-5G | |
| Pasteur pipette tips | VWR | 14673-010 | |
| Sodium chloride | BDH | BDH9286-500G | |
| Vegetable oil | Walmart | 9276383 | Any vegetable oil should work as long as it is fresh |
| Zirconia/ silica beads (0.5 mm diameter) | Biospec products | 11079105z | |
| Equipment | |||
| Analytical balance | Mettler-Toledo | XS205DU | Capable of at least 4 decimal accuracy |
| Bead homogenizer | Omni | 19-040E | |
| Benchtop micro centrifuge | Thermo | Heraeus Fresco 21 with 24x2 | Including rotor capable of handling 1.5 and 2 mL tubes |
| Dry block heater | VWR | 75838-282 | Including dry block for a microplate |
| Freeze dryer | Labconco | 7670520 | 2.5L freeze drying system |
| Large benchtop centrifuge | Thermo | Heraeus Megafuge 16R Tissue | Including rotors capable of handling 400 mL bottles, 50 mL tubes, and 15 mL tubes |
| Microplate reader | Molecular Devices | SpectraMax M2 | Capable of reading absorbance and fluorescence |
| Vortex mixer | VWR | 10153-838 |
Referanslar
- Prandini, J. M., et al. Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgae Scenedesmus spp. Bioresource Technology. , 67-75 (2016).
- Liu, C., et al. Phycoremediation of dairy and winery wastewater using Diplosphaera sp. MM1. Journal of Applied Phycology. 28 (6), 3331-3341 (2016).
- Passero, M., Cragin, B., Coats, E. R., McDonald, A. G., Feris, K. Dairy Wastewaters for Algae Cultivation, Polyhydroxyalkanote Reactor Effluent Versus Anaerobic Digester Effluent. BioEnergy Research. 8 (4), 1647-1660 (2015).
- Hodgskiss, L. H., Nagy, J., Barnhart, E. P., Cunningham, A. B., Fields, M. W. Cultivation of a native alga for biomass and biofuel accumulation in coal bed methane production water. Algal Research. 19, 63-68 (2016).
- Gao, C., et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics. 15, (2014).
- Burch, A. R., Franz, A. K. Combined nitrogen limitation and hydrogen peroxide treatment enhances neutral lipid accumulation in the marine diatom Phaeodactylum tricornutum. Bioresource Technology. 219, 559-565 (2016).
- Brennan, L., Owende, P. Biofuels from microalgae--A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable Sustainable Energy Reviews. 14 (2), 557-577 (2009).
- Branyikova, I., et al. Microalgae - Novel highly efficient starch producers. Biotechnology and Bioengineering. 108 (4), 766-776 (2010).
- Chalima, A., et al. Utilization of Volatile Fatty Acids from Microalgae for the Production of High Added Value Compounds. Fermentation. 3 (4), (2017).
- Harun, R., Singh, M., Forde, G. M., Danquah, M. K. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and Sustainable Energy Reviews. 14 (3), 1037-1047 (2010).
- Liu, L., et al. Development of a new method for genetic transformation of the green alga Chlorella ellipsoidea. Molecular biotechnology. 54 (2), 211-219 (2013).
- Cheng, J., et al. Mutate Chlorella sp. by nuclear irradiation to fix high concentrations of CO2. Bioresource Technology. 136, 496-501 (2013).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Sales, C. M., Au, Comparison of Scale in a Photosynthetic Reactor System for Algal Remediation of Wastewater. Journal of Visualized Experiments. (121), e55256 (2017).
- Higgins, B. T., et al. Cofactor symbiosis for enhanced algal growth, biofuel production, and wastewater treatment. Algal Research. 17, 308-315 (2016).
- Higgins, B., et al. Algal-bacterial synergy in treatment of winery wastewater. Nature Clean Water. 1 (6), (2017).
- Higgins, B. T., et al. Impact of thiamine metabolites and spent medium from Chlorella sorokiniana on metabolism in the green algae Auxenochlorella prototheciodes. Algal Research. 33, 197-208 (2018).
- Lépinay, A., et al. First insight on interactions between bacteria and the marine diatom Haslea ostrearia: Algal growth and metabolomic fingerprinting. Algal Research. 31, 395-405 (2018).
- Franchino, M., Comino, E., Bona, F., Riggio, V. A. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate. Chemosphere. 92 (6), 738-744 (2013).
- Choix, F. J., Lopez-Cisneros, C. G., Mendez-Acosta, H. O. Azospirillum brasilense Increases CO2 Fixation on Microalgae Scenedesmus obliquus, Chlorella vulgaris, and Chlamydomonas reinhardtii Cultured on High CO2 Concentrations. Microbial Ecology. 76 (2), 430-442 (2018).
- Higgins, B., VanderGheynst, J. Effects of Escherichia coli on mixotrophic growth of Chlorella minutissima and production of biofuel precursors. PLoS One. 9 (5), e96807 (2014).
- Higgins, B., Thornton-Dunwoody, A., Labavitch, J. M., VanderGheynst, J. S. Microplate assay for quantitation of neutral lipids in extracts from microalgae. Analytical Biochemistry. 465, 81-89 (2014).
- Tanadul, O. U., Vandergheynst, J. S., Beckles, D. M., Powell, A. L., Labavitch, J. M. The impact of elevated CO2 concentration on the quality of algal starch as a potential biofuel feedstock. Biotechnology and Bioengineering. 111 (7), 1323-1331 (2014).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Higgins, B. T., et al. Informatics for improved algal taxonomic classification and research: A case study of UTEX 2341. Algal Research. 12, 545-549 (2015).
- Garrett, R. H., Grisham, C. M. . Biochemistry. , 578-730 (2012).
- de-Bashan, L. E., Trejo, A., Huss, V. A. R., Hernandez, J. -. P., Bashan, Y. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater. Bioresource Technology. 99 (11), 4980-4989 (2008).
- Wang, Q., Higgins, B., Ji, H., Zhao, D. . Annual International Meeting of the ASABE. , (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır