É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cultivo de microalgas verdes em fotobiorreatores coluna de bolha e um ensaio para lípidos neutros
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para construir laboratório-escala bolha coluna fotobiorreatores e usá-los para a cultura de microalgas. Ele também fornece um método para a determinação da taxa de crescimento da cultura e do conteúdo de lipídios neutros.
Resumo
Há grande interesse no estudo das microalgas para aplicações de engenharia, tais como a produção de biocombustíveis, produtos de alto valor e para o tratamento de resíduos. Como a maioria dos novos esforços de pesquisa começam em escala de laboratório, há uma necessidade de métodos de baixo custo para cultivo de microalgas de forma reproduzível. Aqui, nós nos comunicamos uma abordagem eficaz para cultura de microalgas em fotobiorreatores escala de laboratório e para medir o crescimento e o conteúdo de lipídios neutros de que algas. Também estão incluídas para instruções sobre como configurar o sistema de photobioreactor. Embora os organismos de exemplo são espécie de Chlorella e Auxenochlorella, este sistema pode ser adaptado para cultivar uma grande variedade de microalgas, incluindo co culturas de algas com espécies não-algas. Culturas-mãe primeiro são cultivadas em garrafas para produzir inóculo para o sistema de photobioreactor. Inóculo de algas é concentrado e transferido para fotobiorreatores para cultivo em modo de lote. As amostras são coletadas diariamente para as leituras da densidade óptica. No final da cultura lote, as células são colhidas por centrifugação, lavada e congelam secas para obter uma concentração final de peso seco. A concentração final de peso seco é usada para criar uma correlação entre a densidade óptica e a concentração de peso seco. Um método de Folch modificado subsequentemente é usado para extrair lipídios totais a partir da biomassa liofilizada e o extrato é analisado por seu conteúdo de lipídio neutro usando um ensaio de microplacas. Este ensaio foi publicado anteriormente, mas as etapas do protocolo foram incluídas aqui para destacar os passos críticos no procedimento onde frequentemente ocorrem erros. O sistema de biorreator descrito aqui preenche um nicho entre balão simples cultivo e biorreatores comerciais totalmente controlado. Mesmo com apenas 3-4 biológico repetições por tratamento, nossa abordagem para cultivo de algas leva a desvios-padrão apertados nos ensaios crescimento e lipídios.
Introdução
O aplicativo de microalgas em engenharia e biotecnologia tem atraído grande interesse nos últimos anos. Microalgas estão sendo estudados para uso em águas residuais tratamento1,2,3,4, biocombustível produção5,6,7,8e o produção de nutracêuticos e outros produtos de alto valor9,10. As algas são também sendo geneticamente modificadas em taxas maiores em um esforço para melhorar a sua aptidão para específicas aplicações engenharia11,12. Consequentemente, há grande interesse na experimentação com organismos relevantes industrialmente em ambientes controlados. A finalidade desse método é comunicar uma abordagem eficaz para cultura de microalgas em um ambiente controlado de laboratório e para medir o crescimento e o conteúdo de lipídios neutros de que algas. Melhorar o crescimento conteúdo de lipídios neutros de microalgas e taxas foram identificados como dois principais gargalos em direção a comercialização de biocombustíveis de algas13.
Uma ampla gama de abordagens tem sido usado para algas cultura para fins experimentais. Em geral, estas abordagens podem ser divididas entre cultivo ao ar livre em grande escala e cultivo indoor em pequena escala. Cultivo ao ar livre em fotobiorreatores e lagoas abertas é apropriado para a experimentação vista ampliação de processos que já tenham sido comprovados em escala de laboratório (por exemplo, para testar a aumentar de uma nova linhagem de alta-lipídios das algas)14. No entanto, cultivo indoor de pequena escala é apropriado durante o desenvolvimento de cepas de algas novos ou melhorados ou realizando experiências visa compreender os mecanismos biológicos. Nestes últimos casos, um alto grau de controle experimental é necessário para destrinchar mudanças sutis no comportamento biológico. Para esse fim, axénica culturas são muitas vezes necessárias para minimizar os fatores bióticos complexos associados com outros organismos (por exemplo, bactérias, outras algas) que inevitavelmente crescem em sistemas de grande escala ao ar livre. Mesmo quando estuda as interações entre as algas e outros organismos, encontramos que o uso das condições experimentais altamente controlado é útil aquando da análise molecular intercâmbio entre organismos15,16,17.
Dentro da categoria de cultivo de algas indoor em pequena escala, uma variedade de abordagens têm sido utilizados. Talvez a abordagem mais comum é a crescer algas em Erlenmeyers numa mesa de abanador sob uma luz banco18,19. Troca de oxigênio e CO2 ocorre por difusão passiva através de um plug de espuma no topo do balão. Alguns pesquisadores têm melhorado este set-up através de aeração ativa dos frascos20. Outra abordagem é a cultivar algas em garrafas, mixadas por barra de agitação e aeração ativa. Apesar de sua simplicidade, achamos que o uso de frascos e garrafas, muitas vezes, leva a resultados inconsistentes entre repetições biológicas. Presumivelmente devido aos efeitos de posição - diferentes posições recebem quantidades diferentes de luz, que também afetam as temperaturas internas do reator. Rotação diária dos reactores para novas posições pode ajudar, mas não é aliviar o problema porque determinados estágios de crescimento de algas (por exemplo, cedo exponencial) são mais sensíveis aos efeitos posicionais que outros (por exemplo, fase de registro).
No lado oposto do espectro da sofisticação tecnológica são totalmente controlado comercial fotobiorreatores. Estes sistemas de continuamente monitorar e ajustar as condições no reator para otimizar o crescimento de algas. Eles têm iluminação programável, controle de temperatura em tempo real e controle do pH. Infelizmente, eles são caros e normalmente custam milhares de dólares por reator. Mais revistas científicas e de engenharia exigem replicação biológica dos resultados, exigindo a compra de vários biorreatores. Apresentamos aqui um sistema de reator de coluna de bolhas que o fosso entre o simples (balão) e sofisticada (totalmente controlado bioreator) aproxima-se para o cultivo de algas de laboratório-escala de pontes. Colunas de bolha usam levantando bolhas de gás para facilitar a troca gasosa e misturar o reator. Essa abordagem fornece algum grau de controle sobre a iluminação e a temperatura, mas fá-lo de uma forma que é rentável. Além disso, encontramos este sistema produz resultados altamente consistentes entre réplicas biológicas, reduzindo o número necessário de repetições biológicos necessários para obter resultados estatisticamente significativos quando comparado com a abordagem de frasco ou garrafa. Também usamos este sistema para cultivar com sucesso as misturas de algas e bactérias21. Além do cultivo de algas, descrevem um procedimento para medir o teor de lipídios neutros nas algas cultivadas. O último método tem sido publicado em outro lugar22, mas incluímos aqui o procedimento para fornecer instruções passo a passo de como empregá-lo com sucesso.
Protocolo
1. configuração de bolha coluna fotobiorreatores
- Construa um conjunto de tampas ventiladas das tampas de plástico que veio com as garrafas de vidro de 1 L e tubos de hibridação (ver Figura 1 para esquemas e fotos). Construa tampas para o umidificador, armadilha, cada ar elevador photobioreactor e cada frasco reator de mistura.
- ¼" furos na tampa: 2 furos são necessários para as tampas de biorreator e umidificador; 3 furos são necessários para a armadilha da mistura.
- Deslizar um ¼" o-ring sobre os segmentos de um encaixe de Luer de montagem de painel 1/8" e isto Introduza o ¼" buraco perfurado na tampa (figura 1A).
- Deslize um segundo ¼" o-ring sobre os tópicos para que a tampa é imprensada entre os dois O-rings. Deslize uma contraporca para os segmentos e aperte para corrigir o Luer de montagem do painel no lugar.
- Anéis de bloqueio para o exposto projetando de Luer macho da tampa de encaixe. Repita as etapas 1.1.2-1.1.4 para cada buraco na tampa.
- Para a anexação de tampas que serão usadas em reatores de coluna e garrafa de bolha, 1/8" fêmea Luer para ligações estriadas para 1.5" pedaços de 1/8" tubos de PVC de ID. Anexe estas a cada um dos acessórios Luer machos expostos na tampa.
- Conectar uma válvula de retenção (apontando para longe a tampa) para a extremidade livre de um da 1/8" peças.
Nota: Isto irá servir como porta de escape para o biorreator. - Conecte um conector Luer macho barb, ajustando-se para a segunda parte de 1/8" tubos projetando da tampa. O anel de bloqueio rotativo estalido e aperte um filtro de ar de 0,2 mm para isto.
Nota: Isto irá servir como porta de entrada para o reator.

Figura 1. Esquema e fotos para a construção de biorreatores. (A) diagrama esquemático para construção do bioreator tampas (B) foto da tampa do biorreator montado e (C) foto da tampa montada usada para o umidificador. Observe que os encaixes do umidificador devem ser revestidos em silicone à prova de água para assegurar um selo hermético com a tampa. Clique aqui para ver uma versão maior desta figura.
- Montar o sistema de distribuição de ar (consulte 2B e Figura 2A para um esquema e foto).
- Anexe 1/8" rosca NPT para ligações estriadas para as entradas e saídas na parte traseira de cada rotâmetro.
Nota: 200-2.500 cm3/min rotâmetros são para modulação de pressão ar montante do umidificador, 100-1.000 cm3/min rotâmetros são para reatores de garrafa, 50-500 cm3/min rotâmetros são para biorreatores de elevador de ar e de 5-50 cm3/ rotemeters min são para regulação de fluxo do CO2 . Recomenda-se o monte de rotâmetros para uma superfície fixa (por exemplo, folha plástica) para que eles não caem durante a operação. - Desligue a fonte de ar comprimido e, em seguida, conectar a fonte de ar comprimido com uma braçadeira de mangueira ¼" ID tubos de PVC flexível. Retirar-se o diâmetro da mangueira de 1/8" tubos flexíveis de PVC ID usando um ¼" fêmea para encaixe de barb e um 1/8" macho para montagem de barb.
- Conecte a extremidade livre do tubo de ID 1/8" para a entrada de um rotâmetro / min 200-2.500 cm3.
Nota: A saída do rotâmetro alimentará garrafa do umidificador através de 1/8" tubos de ID. - Conectar-se a 1/8" tubos para uma entrada a uma tampa exalada (uso um Luer fêmea a barb apropriado para fazer a conexão). Em seguida, conectar um segundo pedaço de 1/8" tubos para o interior do Monte painel apropriado.
Nota: Esta peça será pendem para o umidificador e ar de bolha através da água. - Anexar 1/8" fêmea Luer barb encaixes para cada extremidade de um pedaço de tubo de ID 1/8" e usar esta peça para conectar a saída do umidificador para a entrada da armadilha da mistura.
- Da mesma forma como 1.2.5, conecte a saída do CO2 regulador de uma segunda porta na mistura armadilha.
- Construir um colector usando 1/8" barb multiporta e tubo de 1/8" (ver Figura 2 C) para alimentar o ar para os bancos do rotâmetro.
Nota: Estes rotâmetros serão usados para fornecer os biorreatores. Evite a construção de mais de 6 rotâmetros em série. Em vez disso, use margens paralelas de rotâmetros para expandir o sistema. Certifique-se de que a demanda de fluxo total para todos os reatores é inferior a 2.500 cm3/min (ou mais serão necessários um rotâmetro maior montante do umidificador). - Conecte a saída (3rd Porto) da armadilha da mistura para os bancos de rotâmetro recém construídos usando 1/8" tubos e um 1/8" fêmea para barb Luer.
- Conectar-se suficientemente longa 1/8" tubos para as tomadas de cada rotâmetro no banco rotâmetro para fornecer ar para os biorreatores. Rotule as extremidades da tubulação, bem como os rotâmetros no banco.
- Aplica silicone à prova de água em torno de todas as portas o umidificador e tampas de armadilha para garantir que eles são ar apertado de mistura.
- Anexe 1/8" rosca NPT para ligações estriadas para as entradas e saídas na parte traseira de cada rotâmetro.
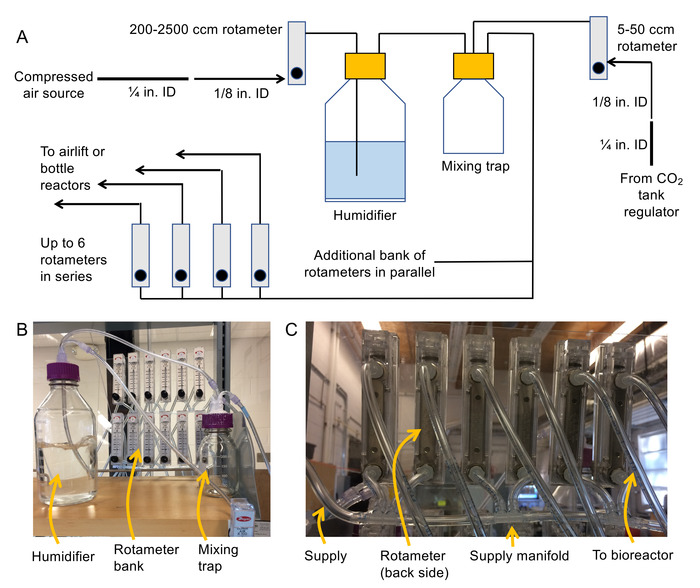
Figura 2. Esquema e fotos para montar o sistema de coluna de bolhas. (A) diagrama esquemático da foto de sistema (B) a aeração do umidificador, mistura de armadilha e banco de rotâmetro e (C) foto de colectores de usado para se conectar os bancos de rotâmetro juntos. Clique aqui para ver uma versão maior desta figura.
- Configurar os tanques de peixes, agitar as placas e luzes (Figura 3).
Atenção: Este sistema requer um grande número de estabelecimentos e capacidade de circuito suficiente para suportar todos os componentes. Evite a amarração junto vários cabos de alimentação e cabos de extensão, em forma de cascata, porque este é um risco de choque elétrico. Uso de tomadas do tipo GFI e réguas de energia é altamente incentivado devido à presença de água no sistema.- Organize os Agitadores magnéticos de perfil baixo, sobre uma superfície plana que é forte o suficiente para suportar o peso dos tanques de peixe cheio de água.
- Lugar pequeno de madeira ou plásticos blocos (que são ligeiramente mais altos que as placas de agitação) em torno do perímetro das placas celeuma para suportar o peso dos tanques de peixe.
Atenção: Evite colocar os tanques de peixe diretamente sobre as placas de agitação, como o peso irá esmagá-los. - Coloque os tanques de peixes sobre as placas de agitação e suporte a blocos e encher os tanques com água.
- Corte um pedaço de uma folha de plástico duro para caber em cima do tanque de peixes como uma tampa. Esses buracos nesta cobertura para deslizar os tubos de hibridização e sair. Também corte um buraco para o aquecedor do tanque de peixes.
- Organize os bancos fluorescentes luz ao lado do tanque de peixes para fornecer a iluminação horizontal de biorreatores a. Conecte o banco leve um temporizador luz para definir um ciclo de dia/noite.

Figura 3. Sistema esquemático para os frasco de biorreatores (à esquerda) e a bolha coluna fotobiorreatores (à direita). Esta figura foi modificada de Higgins et al . 17. clique aqui para ver uma versão maior desta figura.
2. preparação do inóculo de microalgas
- Obter o inóculo de microalgas de uma cultura de crio-preservados, chapeada ou líquida.
Nota: É recomendável que organismos criopreservados ser banhados antes da utilização como inóculo para garantir que as células são viáveis e que a cultura resultante é axénica. Ágar-ágar (EG., ATCC #5 esporuladas ágar)21 é um meio rico que funciona bem para reviver espécies de Chlorella e Auxenochlorella de armazenamento criogénico. - Prepare 2,4 L de meio mineral que é apropriado para as espécies de microalgas particular.
Nota: Os exemplos incluem N8 médio23 para espécies de Chlorella, N8-NH4 médio21 espécies de Auxenochlorella. Utilização de um meio adequado para o tipo de algas é um dos passos mais importantes para garantir o crescimento de algas robusto. - Alíquota 2,4 L de meio mineral igualmente em três frascos de vidro de 1 L, adicionar agita bares de cada garrafa e montar as tampas ventiladas (Figura 1) para cada garrafa. Verifique que o tubo de aeração é do lado da entrada e cada garrafa tem uma barra de agitação.
- Autoclavar os frascos de estoque usando uma líquido esterilização ciclo (121 ° C) por 30 min. Autoclave 100 mL de água desionizada (dH2O) e alguns tubos de 1,5 mL, ao mesmo tempo, que mais tarde será usado para o chapeamento. Permitir que o meio legal durante a noite. Alternativamente, esfriar o reator a temperatura ambiente e em seguida arejar durante 2 h antes da inoculação.
- Em uma biossegurança do armário (BSC), inocule microalgas de uma placa ou axénica cultura líquida nas garrafas das ações. Utilize técnica asséptica para manter axénica culturas nas etapas a seguir.
- Adicione 20 mL de autoclavado dH2O para um tubo de centrífuga de 50ml estéril. Use um loop descartável estéril de 10 µ l para escolher várias colónias única da placa da etapa 2.1. Mergulhe o tubo de 50 mL do loop e lave as células de algas nos 20 mL de autoclavado dH2Shake O. o tubo de 50 mL, tornar-se uma solução homogênea de microalgas.
- Pipete 6 mL de solução de microalgas para cada frasco de estoque com uma pipeta sorológica estéril de 10 mL. Agite o frasco para misturar as microalgas uniformemente no meio de.
- Use uma pipeta sorológica estéril de 2 mL desenhar amostras de 1 mL de cada frasco de estoque e a transferência em tubos estéreis 1,5 mL.
Nota: Micropipetas não são recomendadas para esta etapa, devido ao risco de contaminação. Aperte as tampas ventiladas em frascos de estoque. - Coloque as garrafas do estoque em placas de agitação (~ 150 rpm) e ajustar os níveis de iluminação conforme apropriado para a espécie, taxa de fluxo de ar e CO2. Gire a posição de estoque garrafa todos os dias.
- Diluir as amostras de 1 mL obtidas durante a etapa de 2.6 (100 vezes diluição em água estéril geralmente funciona bem) e espalhe a placa sobre um rico ágar-ágar.
Nota: Estas placas podem ser usadas para verificar se há casos de contaminação, bem como servir como uma fonte de inóculo de algas futuras para mais experiências. - Recolher amostras dos frascos (no BSC) em dois dias para verificar o crescimento de microalgas.
Colocar as amostras em uma microplaca de 96 poços em triplicado (200 µ l) e medir a densidade óptica (OD) em 550 nm e 680 nm a cada dois dias até OD atinge 0.2-0.3 (que geralmente requer 5-7 dias). - Parar a incubação e coloque as garrafas de estoque em um banco por 24-48 h permitir que as células de algas resolver pela gravidade.
Nota: As células se estabeleceram serão usadas em seguida para inocular a bolha coluna fotobiorreatores. Se uma coleção de células mais rápida é desejada, as células podem ser centrifugadas a não mais do que 1.000 g x para coletar as células.
3. cultivo de microalgas em fotobiorreatores de coluna de bolhas
- O dia antes da inoculação do biorreator, preparar a mídia adequada e transferência 200 mL (ou volume desejado) para a bolha coluna photobioreactor tubos (tubos de Hibridização). Tubos de autoclave com mídia e tampas ventiladas no lugar.
Nota: Se utilizar águas residuais como um meio de crescimento, autoclave o vazio biorreatores e adicionar estéril filtrada de águas residuais (se axénica cultura é desejada). - Concentre-se o estoque de microalgas resolvido removendo o sobrenadante usando uma bomba de vácuo. Deixe a menos de 100 mL do meio em cada garrafa, mas evite remover algas se estabeleceram.
Nota: Realizar este procedimento dentro de um BSC e siga a técnica estéril. Um aparelho de vácuo simples pode ser construído usando um balão de vácuo ou garrafa. Cabe uma pipeta estéril serológica na extremidade do tubo. - Suspender e transferir o chorume de algas para tubos de centrífuga de 50ml estéril. Centrifugar a 1.000 x g por 5 min concentrar ainda mais as algas.
- O BSC, remova suficiente sobrenadante para alcançar um volume total de ~ 80 mL de concentrados de algas para 12 photobioreacters. Evite limpar para fora a pelota. Transferi o concentrado de algas para um recipiente estéril (ou a garrafa de estoque de algas usadas).
- Adicione 6 mL de chorume de algas em cada photobioreactor com uma pipeta sorológica 10ml estéril.
- Filtro estéril (filtro de seringa ou vácuo 0,2 mm) e adicionar quantidades apropriadas de quaisquer outros compostos (por exemplo, estoques de vitamina) que não podem ser esterilizados em autoclavadas.
- Biorreatores para misturar algas entram no meio do redemoinho.
- Desenhe uma amostra de 2 mL de cada biorreator utilizando uma pipeta sorológica e transfira para um tubo de 2 mL. Recolha uma amostra de 2 mL (em um BSC) cada 24h para monitorar o progresso da cultura. Confira a amostra para pH usando tiras-teste e ajustar o reator quando necessário com 3 M NaOH ou 3 M de HCl.
- Aperte as tampas do biorreator e coloque todos os biorreatores para o banho de água do tanque de peixe. Ajuste a aeração, CO2e iluminação para o nível adequado para a espécie. Gire a posição de biorreator cada dia após a amostragem (passo 3.8).
- Aplicam-se aos poços de uma microplaca 96 bem 200 µ l de cada amostra de cultura em triplicado. Medir a densidade óptica (OD) em 550 nm e 680 nm.
- No último dia do período de cultura, medir OD sob fatores diferentes de diluição (por exemplo, um 1 x, 2x, 4x, 8x, x 16 e 32 x) para estabelecer uma correlação entre o OD e o peso seco após a colheita (passo 4).
- Centrifugar o tubo 2 mL de amostra a 12.000 x g por 5 min.
- Filtrar o sobrenadante através de filtro de não-estéril Seringa 0,2 µm e armazenar o sobrenadante (e pelota se necessário) sem nenhum superior a-20 ° C para armazenamento a longo prazo e posteriores análises de alterações na composição da mídia.
4. colheita e secagem de biomassa de microalgas de gelo
- Medir um volume fixo de cultura de algas de cada biorreator com um cilindro graduado (por exemplo, 160 mL de um biorreator que originalmente continha 200 mL de meio) e transferir para garrafas de centrífuga. Lave a proveta graduada com dH2O entre cada medição.
- Centrifugar 4.696 x g por 5 min. descartar o sobrenadante aspirando cuidadosamente para fora.
- Transferi as pelotas para tubos de 50ml rotulados. Lave as garrafas de centrífuga com dH2O e a transferência de conteúdo para os tubos de 50 mL. Certifique-se que o volume total do tubo não deve exceder 45 mL.
- Lave as pelotas de algas com dH2O para remover os sais.
- Centrifugar os tubos de 50 mL a 4.696 x g por 5 min e descartar o sobrenadante.
- Adicionar 40 mL dH2O para cada tubo de 50 mL; vórtice de misturar. Centrifugar novamente a 4.696 x g durante 5 min e descartar o sobrenadante.
- Repita a etapa 4.4.2 novamente.
- Rotular e pesar tubos de centrífuga 15ml vazio em um equilíbrio de 4-decimal (etiqueta da tampa e o tubo e pesá-los juntos). Pese um tubo por cultura de algas. Pese cada tubo de 15 mL duas vezes para minimizar o erro.
- Após a última lavagem, desprezar o sobrenadante e adicionar 7,5 mL de dH2O para cada tubo de 50 mL. Vórtice e transferência as lamas de algas para a 15ml pré-pesados tubos. Lave os tubos de 50 mL com adicionais dH2O e transferir o líquido para os tubos de 15 mL. Evite exceder 12 mL de volume total em tubos de 15 mL.
- Centrifugar os tubos de 15 mL a 4.696 x g por 5 min e decante o sobrenadante. Congele os tubos com pelotas a-80 ° C durante pelo menos 30 min em preparação para a liofilização.
- Congelamento a seco durante a noite ou até secas.
- Pesar e registar os tubos de 15 mL liofilizado com algas.
5. lipídios extração usando um método de Folch modificado24
- Pese 20 mg de liofilizado da biomassa das algas em um tubo de polipropileno 2 mL tampa de rosca (verificação da etiqueta do fabricante para garantir o produto é apropriado para extrações do grânulo).
- Adicione 1,5 mL de solvente Folch (clorofórmio/metanol 2:1) para cada tubo 2 mL (que contém 20 mg de liofilizado algas). Despeje ~0.5 grânulos de zircônia/sílica mL (0,5 mm) em cada tubo até o nível do líquido no tubo atinge 2 mL.
Atenção: Lidar com clorofórmio e metanol em uma coifa e Evite respirar vapores ou contacto com a pele. - Homogeneizar as amostras de algas em um moinho do grânulo por 20 s a uma velocidade de tubos de transferência 6,5 m/s. para gelo por 30 s para acalmar as amostras. Repeti cinco vezes mais que totalmente extrair lipídios.
- Filtre o homogeneizado com uma seringa de 5 mL contendo um disco de malha de arame de aço inoxidável (malha #60) a tensão para fora os grânulos, recolhendo o filtrado em um tubo de 15 mL.
- Lave os grânulos com 1,5 mL de solvente Folch, empurrando o líquido com a seringa, se necessário. Repetir esta lavagem mais duas vezes e recolher todos os filtrado no tubo de 15 mL, produzindo um volume final de aproximadamente 6 mL.
- Adicione 1,2 mL de 0,9% (p/v), solução de NaCl para o extrato de Folch no tubo de 15 mL e vórtice para misturar bem.
Nota: Se necessário, mais Folch solvente pode ser usado para lavar os grânulos (uso 0.2 x o volume de lavagem total da solução de NaCl 0,9% para induzir a separação de fases). - Centrifuga os tubos de 15 mL a 6.000 x g durante 5 min. do registro do volume de fase (verde) de clorofórmio inferior para o mL 0,1 mais próximo usando linhas no lado do tubo de 15 mL. Transferi a fase inferior para um frasco de vidro (com tampa) usando um pipeta Pasteur de vidro.
- Armazene o lipídeo a-20 ° C ou -80 ° C (se há planos para usar este extrato para análise de ácidos graxos).
6. neutro lipídico ensaio usando um método Microplate (adaptado de Higgins et al . 201422)
- Prepare soluções estoque. Preparar padrão de óleo vegetal 1 mg/mL 10 mL de clorofórmio e armazenar a-20 ° C.
Nota: Qualquer óleo vegetal pode ser utilizado neste ensaio porque não é sensível aos tipos de ácidos graxos. Prepare-se 10 mL de 200 µ g/mL de solução de vermelho de Nilo em dimetilsulfóxido (DMSO) e armazenar no escuro à temperatura ambiente. - Pré-aqueça o bloco de microplacas seco a 55 ° C em uma coifa. Enquanto isso é aquecimento, diluir o lipido extratos e óleo vegetal padrão 3 vezes com metanol.
Nota: Esta diluição pode ser alterada com base no conteúdo lipídico das algas, mas este nível funciona bem para a maioria dos Chlorella. - Para cada amostra diluída, adicione 80 µ l de uma microplaca 96 bem polipropileno em quadruplicado.
Cuidado: O uso de poliestireno plasticware não é recomendado para uso com solventes orgânicos. - Para o solvente em branco, aplica 80 µ l de 2:1 metanol/clorofórmio em quadruplicado. Para os padrões, adicione 10, 30, 60, 90 e 120 µ l de óleo vegetal diluído padrão em quadruplicado.
- Coloque o microplate em um aquecedor de bloco seco a 55 ° C por 20-30 min até todos solvente evapore. Enquanto o solvente evapora, preparar o trabalho solução de vermelho de Nilo (necessidade 200 µ l da solução de 1 µ g/ml por placa bem). Por exemplo, doze amostras e um conjunto completo de normas requer 16 mL de 1,0 µ g/mL de solução; Prepare-se dissolvendo 80 µ l do estoque de 200 µ g/mL (em DMSO) em 16 mL dH2O.
- Remover a microplaca do bloco de aquecimento e deixe esfriar a temperatura ambiente. Adicionar 30 µ l de álcool isopropílico a cada poço e misture pipetando para cima e para baixo. Certifique-se de todos os canais de pipeta estão misturando a solução e resuspending os lipídios, produzindo um líquido verde homogêneo.
- Adicione 200 µ l de solução de vermelho de Nile (1 µ g/mL) para cada poço, Pipetar para cima/para baixo 10 vezes para misturar. Incube a placa por 5 min à temperatura ambiente. Enquanto espera, prepare uma solução de água sanitária 50% pela mistura de água sanitária (6% de hipoclorito) com dH2O. 20 µ l por alvéolo são necessários. Preparação de 3 mL de água sanitária 50% é suficiente para 12 amostras e um conjunto completo de normas.
- Adicionar 20 µ l de solução de água sanitária para cada microplate bem e pipetar e descer 5 vezes para misturar bem. Incube 30 min à temperatura ambiente.
- Após 30 min, lê a fluorescência nas amostras de cada 5-10 min no 530 emissão de nm de excitação/575 nm com corte automático, defina a 570 nm até estabiliza o sinal de amostras de algas. Normalmente, 60 min. de incubação total é suficiente.
- Crie uma curva de calibração para os padrões de óleo vegetal (na faixa de 0-40 ng/poço).
Nota: Um linear ajuste funciona bem para baixo (< 30 ng/poço) concentrações de óleo e um polinômio caber podem ser usados se o padrão for superior a 30 ng/bem. Use esta correlação para quantificar o lipídio neutro em poços de amostra.
Resultados
Este procedimento resulta em um curso de tempo dos dados de densidade óptica das algas em OD 550 nm (Figura 4A). A densidade óptica e peso seco concentração de dados podem ser correlacionados (Figura 4B). Isso é feito calculando a concentração de algas de peso seco final após a etapa de liofilização. Em seguida, a densidade óptica da diluição serial cultura (realizada no último dia de amostragem) e as concentraçõe...
Discussão
A consideração mais importante quando o cultivo de algas é uma compreensão das necessidades específicas do organismo ou grupo de organismos. As algas, sistema de cultivo descrito aqui pode ser usado para a cultura de uma grande variedade de algas, mas os específicos fatores abióticos (temperatura, mídia, pH, intensidade de luz, nível de CO2 , a taxa de aeração) precisam ser ajustado às necessidades do organismo. Observe os parâmetros descritos aqui foram usados para o cultivo de Chlorella...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Suporte para esta pesquisa foi fornecido pelo USDA, Instituto Nacional de alimentos e agricultura Hatch projeto ALA0HIGGINS e escritórios da Universidade de Auburn de reitor, Vice-Presidente de pesquisa e o Samuel Ginn faculdade de engenharia. Suporte também foi fornecido pelo NSF conceder CBET-1438211.
Materiais
| Name | Company | Catalog Number | Comments |
| Supplies for airlift photobioreactor setup | |||
| 1 L Pyrex bottles | Corning | 16157-191 | For bottle reactors, humidifiers |
| 1/2" hose clamp | Home Depot | UC953A | or equivalent |
| 1/4" female luer to barb | Nordson biomedical | Nordson FTLL360-6005 | 1/4" ID, PP |
| 1/4" ID, 3/8" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-244 | 50' |
| 1/4" in O-rings | Grainger | 1REC5 | #010 Medium Hard Silicone O-Ring, 0.239" I.D., 0.379"O.D. |
| 1/8" Female luer to barb | Nordson biomedical | FTLL230-6005 | |
| 1/8" ID, 1/4" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-608 | 250' |
| 1/8" male spinning luer to barb | Nordson biomedical | MLRL013-6005 | |
| 1/8" multiport barb | Nordson biomedical | 4PLL230-6005 | 1/8" multiport barb |
| 1/8" NPT to barb | Nordson biomedical | 18230-6005 | 1/8" 200 series barb |
| 1/8" panel mount luer | Nordson biomedical | Nordson MLRLB230-6005 | 1/8", PP |
| 10 gallon fish tank | Walmart | 802262 | Can hold up to 8 bioreactors depending on layout |
| 100-1000 ccm flow meter | Dwyer | RMA-13-SSV | For bottle reactors |
| 2 ft fluorescent light bank | Agrobrite | FLT24 T5 | |
| 200-2500 ccm flow meter | Dwyer | RMA-14-SSV | For air regulation upstream of humidifier |
| 250 mL Pyrex bottles | Corning | 16157-136 | For gas mixing after humidifier |
| 50-500 ccm flow meter | Dwyer | RMA-12-SSV | For hybridization tube reactors |
| 5-50 ccm flow meter | Dwyer | RMA-151-SSV | For CO2 flow rate control |
| Air filters 0.2 µm | Whatman/ Fisher | 09-745-1A | Polyvent, 28 mm, 0.2 µm, PTFE, 50 pack |
| Check valves | VWR | 89094-714 | |
| Corning lids for pyrex bottles | VWR | 89000-233 | 10 GL45 lids |
| Female luer endcap | Nordson biomedical | Nordson FTLLP-6005 | Female stable PP |
| Hybridization tubes | Corning | 32645-030 | 35x300 mm, pack of 2 |
| Light timer | Walmart | 556393626 | |
| Locknuts | Nordson biomedical | Nordson LNS-3 | 1/4", red nylon |
| Low profile magnetic stirrer | VWR | 10153-690 | Low profile magnetic stirrer |
| Male luer endcap | Nordson biomedical | Nordson LP4-6005 | Male plug PP |
| Spinning luer lock ring | Nordson biomedical | Nordson FSLLR-6005 | |
| Stir bars - long | VWR | 58949-040 | 38.1 mm, for bottle reactors |
| Stir bars - medium | VWR | 58949-034 | 25 mm, for hyridization tubes |
| Supplies and reagents for culturing algae | |||
| 0.2 µm filters | VWR | 28145-491 | 13 mm, PTFE, for filtering spent media from daily culture sampling |
| 1 mL syringes | Air-tite | 89215-216 | For filtering spent media from daily culture sampling |
| 1.5 mL tubes | VWR | 87003-294 | Sterile (or equivalent) |
| 10 mL Serological pipettes | Greiner Bio-One | 82050-482 | Sterile (or equivalent) |
| 100 mm plates | VWR | 25384-342 | 100x15 mm stackable petri dishes, sterile |
| 15 mL tubes | Greiner Bio-One | 82050-276 | Sterile (or equivalent), polypropylene |
| 2 mL Serological pipette tips | Greiner Bio-One | 82051-584 | Sterile (or equivalent) |
| 2 mL tubes | VWR | 87003-298 | Sterile (or equivalent) |
| 50 mL tubes | Greiner Bio-One | 82050-348 | Sterile (or equivalent), polypropylene |
| 96 well microplate | Greiner Bio-One | 89089-578 | Polystyrene with lid, flat bottom |
| Inocculating loops | VWR | 80094-478 | Sterile (or equivalent) |
| Liquid carbon dioxide tank and regulator | Airgas | CD-50 | |
| Supplies and reagents for lipid extraction and neutral lipid assay | |||
| 2 mL bead tubes | VWR | 10158-556 | Polypropylene tube w/ lid |
| 96 well microplates | Greiner Bio-One | 82050-774 | Polypropylene, flat bottom |
| Bleach | Walmart | 550646751 | Only use regular bleach, not cleaning bleach |
| Chloroform | BDH | BDH1109-4LG | |
| Dimethyl sulfoxide | BDH | BDH1115-1LP | |
| Isopropyl alcohol | BDH | BDH1133-1LP | |
| Methanol | BDH | BDH20864.400 | |
| Nile red | VWR | TCN0659-5G | |
| Pasteur pipette tips | VWR | 14673-010 | |
| Sodium chloride | BDH | BDH9286-500G | |
| Vegetable oil | Walmart | 9276383 | Any vegetable oil should work as long as it is fresh |
| Zirconia/ silica beads (0.5 mm diameter) | Biospec products | 11079105z | |
| Equipment | |||
| Analytical balance | Mettler-Toledo | XS205DU | Capable of at least 4 decimal accuracy |
| Bead homogenizer | Omni | 19-040E | |
| Benchtop micro centrifuge | Thermo | Heraeus Fresco 21 with 24x2 | Including rotor capable of handling 1.5 and 2 mL tubes |
| Dry block heater | VWR | 75838-282 | Including dry block for a microplate |
| Freeze dryer | Labconco | 7670520 | 2.5L freeze drying system |
| Large benchtop centrifuge | Thermo | Heraeus Megafuge 16R Tissue | Including rotors capable of handling 400 mL bottles, 50 mL tubes, and 15 mL tubes |
| Microplate reader | Molecular Devices | SpectraMax M2 | Capable of reading absorbance and fluorescence |
| Vortex mixer | VWR | 10153-838 |
Referências
- Prandini, J. M., et al. Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgae Scenedesmus spp. Bioresource Technology. , 67-75 (2016).
- Liu, C., et al. Phycoremediation of dairy and winery wastewater using Diplosphaera sp. MM1. Journal of Applied Phycology. 28 (6), 3331-3341 (2016).
- Passero, M., Cragin, B., Coats, E. R., McDonald, A. G., Feris, K. Dairy Wastewaters for Algae Cultivation, Polyhydroxyalkanote Reactor Effluent Versus Anaerobic Digester Effluent. BioEnergy Research. 8 (4), 1647-1660 (2015).
- Hodgskiss, L. H., Nagy, J., Barnhart, E. P., Cunningham, A. B., Fields, M. W. Cultivation of a native alga for biomass and biofuel accumulation in coal bed methane production water. Algal Research. 19, 63-68 (2016).
- Gao, C., et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics. 15, (2014).
- Burch, A. R., Franz, A. K. Combined nitrogen limitation and hydrogen peroxide treatment enhances neutral lipid accumulation in the marine diatom Phaeodactylum tricornutum. Bioresource Technology. 219, 559-565 (2016).
- Brennan, L., Owende, P. Biofuels from microalgae--A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable Sustainable Energy Reviews. 14 (2), 557-577 (2009).
- Branyikova, I., et al. Microalgae - Novel highly efficient starch producers. Biotechnology and Bioengineering. 108 (4), 766-776 (2010).
- Chalima, A., et al. Utilization of Volatile Fatty Acids from Microalgae for the Production of High Added Value Compounds. Fermentation. 3 (4), (2017).
- Harun, R., Singh, M., Forde, G. M., Danquah, M. K. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and Sustainable Energy Reviews. 14 (3), 1037-1047 (2010).
- Liu, L., et al. Development of a new method for genetic transformation of the green alga Chlorella ellipsoidea. Molecular biotechnology. 54 (2), 211-219 (2013).
- Cheng, J., et al. Mutate Chlorella sp. by nuclear irradiation to fix high concentrations of CO2. Bioresource Technology. 136, 496-501 (2013).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Sales, C. M., Au, Comparison of Scale in a Photosynthetic Reactor System for Algal Remediation of Wastewater. Journal of Visualized Experiments. (121), e55256 (2017).
- Higgins, B. T., et al. Cofactor symbiosis for enhanced algal growth, biofuel production, and wastewater treatment. Algal Research. 17, 308-315 (2016).
- Higgins, B., et al. Algal-bacterial synergy in treatment of winery wastewater. Nature Clean Water. 1 (6), (2017).
- Higgins, B. T., et al. Impact of thiamine metabolites and spent medium from Chlorella sorokiniana on metabolism in the green algae Auxenochlorella prototheciodes. Algal Research. 33, 197-208 (2018).
- Lépinay, A., et al. First insight on interactions between bacteria and the marine diatom Haslea ostrearia: Algal growth and metabolomic fingerprinting. Algal Research. 31, 395-405 (2018).
- Franchino, M., Comino, E., Bona, F., Riggio, V. A. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate. Chemosphere. 92 (6), 738-744 (2013).
- Choix, F. J., Lopez-Cisneros, C. G., Mendez-Acosta, H. O. Azospirillum brasilense Increases CO2 Fixation on Microalgae Scenedesmus obliquus, Chlorella vulgaris, and Chlamydomonas reinhardtii Cultured on High CO2 Concentrations. Microbial Ecology. 76 (2), 430-442 (2018).
- Higgins, B., VanderGheynst, J. Effects of Escherichia coli on mixotrophic growth of Chlorella minutissima and production of biofuel precursors. PLoS One. 9 (5), e96807 (2014).
- Higgins, B., Thornton-Dunwoody, A., Labavitch, J. M., VanderGheynst, J. S. Microplate assay for quantitation of neutral lipids in extracts from microalgae. Analytical Biochemistry. 465, 81-89 (2014).
- Tanadul, O. U., Vandergheynst, J. S., Beckles, D. M., Powell, A. L., Labavitch, J. M. The impact of elevated CO2 concentration on the quality of algal starch as a potential biofuel feedstock. Biotechnology and Bioengineering. 111 (7), 1323-1331 (2014).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Higgins, B. T., et al. Informatics for improved algal taxonomic classification and research: A case study of UTEX 2341. Algal Research. 12, 545-549 (2015).
- Garrett, R. H., Grisham, C. M. . Biochemistry. , 578-730 (2012).
- de-Bashan, L. E., Trejo, A., Huss, V. A. R., Hernandez, J. -. P., Bashan, Y. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater. Bioresource Technology. 99 (11), 4980-4989 (2008).
- Wang, Q., Higgins, B., Ji, H., Zhao, D. . Annual International Meeting of the ASABE. , (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados