需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基于脉冲激光二极管的桌面光声层析成像在大鼠皮质血管内监测染料的洗入和洗脱
摘要
基于平板脉冲激光二极管的桌面光声层析成像 (LDD-PAT) 系统被证明用于小动物皮质血管的高速动态体内成像。
摘要
光声 (PA) 断层扫描 (pat) 成像是一种新兴的生物医学成像模式, 适用于各种临床前和临床应用。定制的基于圆形环阵列的传感器和传统的笨重 Nd: YAG/OPO 激光器抑制了 PAT 系统的转换到诊所。超紧凑型脉冲激光二极管 (Pld) 目前正被用作 PA 成像的近红外激发的替代来源。高速动态体内成像已被证明使用了紧凑型基于 pld 的桌面 PAT 系统 (PLD-PAT)。本文提出了一种利用桌面 PLD-PAT 系统进行动态脑成像的可视化实验方案。该协议描述了桌面 PLD-PAT 系统配置、脑血管成像动物的制备以及大鼠皮质血管中肌内腺绿色 (ICG) 染料吸收和清除过程的动态成像过程。
引言
光声计算机断层扫描 (pactse-pat) 是一种很有前途的非侵入性生物医学成像方式, 它结合了丰富的光学对比度和高超声分辨率1,2,3, 4,5. 当纳秒脉冲激光将能量沉积到任何生物组织内的吸光色相中时, 局部温度升高, 导致组织的热弹性膨胀和收缩, 从而产生压力波。这些压力波被称为超声波或光声 (PA) 波, 可以通过样品周围的超声波传感器检测到。利用各种重建算法6、7、8、9对检测到的 pa 信号进行重构, 生成横截面 pa 图像。PA 成像提供结构和功能信息, 从宏观器官到微观细胞器, 由于存在于体内10的内源性色母象的波长依赖性。PAT 成像已成功地用于乳腺癌检测1, 前哨淋巴结成像11, 氧血红蛋白 (hbo2) 的映射, 脱氧血红蛋白 (HbO), 总血红蛋白浓度 (HbO), 氧饱和度 (so2)12,13、肿瘤血管生成14例, 小动物全身成像15例, 等应用。
Nd:yag/opo 激光器是第一代 PAT 系统的常规激发源, 广泛应用于光声界的小动物成像和深层组织成像16。这些激光器在 ~ 10-100 Hz 的低重复率下提供 ~ 100 mJ 能量脉冲。由于脉冲重复率有限, 使用这些昂贵且笨重的激光的 PAT 成像系统不适合使用单元素超声传感器 (Sut) 进行高速成像。这就抑制了对动物体内高速发生的生理变化的实时监测。使用基于阵列的传感器, 如带有 nd:yag 激光激发的线性、半圆、圆形和体积阵列, 可以进行高速成像。然而, 这些阵列传感器价格昂贵, 与 Sut 相比, 它们的灵敏度较低;然而, 成像速度受到激光低重复率的限制。最先进的单脉冲 PACT 系统与定制的全环阵列传感器获得 PA 数据在 50 Hz 帧速率17.这些阵列传感器需要复杂的后端接收电子和信号放大器, 使整个系统更加昂贵, 临床使用更加困难。
其紧凑的尺寸、较低的成本要求和较高的脉冲重复率 (KHz 顺序) 使脉冲激光二极管 (Pld) 更有前途, 适用于实时成像。由于这些优点, 在第二代 PAT 系统中, Pld 被积极用作备用励磁源。基于pld 的 pat 系统已成功地证明, 高帧率成像使用阵列传感器 18, 深组织和大脑成像19,20,21, 心血管疾病诊断22和风湿病诊断23。由于与阵列传感器相比, Sut 具有高度敏感和更低的成本, 因此它们仍被广泛用于 PAT 成像。基于光纤的 PLD 系统已被证明用于幻象成像 24。以前通过将 PLD 安装在 PAT 扫描仪25内, 已经演示了便携式 pld-pat 系统。使用一个 SUT 圆形扫描仪, 在3次扫描时间内进行幻影成像, 并在5维使用 PLD-PAT 系统19在5个时间内进行大鼠脑成像。
此外, 还对该 pld-pat 系统进行了改进, 使其更加紧凑, 并使用8个基于声学反射的单元素超声波传感器 (subr)26、27创建桌面模型。在这里, Sut 被放置在一个垂直的, 而不是水平的方向, 在90°声学反射器28的帮助下。该系统可用于组织成像和体内小动物大脑成像中的扫描时间高达 0.5 s 和约3厘米深。在这项工作中, 这个桌面 PLD-PAT 系统用于提供实验的视觉演示, 用于在小动物的体内大脑成像和动态可视化的吸收和清除过程的食品和药物管理局 (FDA) 批准的碘苯胺大鼠大脑中的绿色染料 (ICG)。
研究方案
所有动物实验都是根据新加坡南洋理工大学动物护理和使用机构委员会批准的指导方针和条例 (动物议定书编号 ARF-SBS/NIE-0331) 进行的。
1. 系统描述
- 将 PLD 激光安装到圆形扫描仪中, 并将光学扩散器 (OD) 安装在 PLD 出口窗口的前面, 以使输出光束均匀, 如图 1a 所示。将 PLD 连接到激光驱动器单元 (LDU)。
注: PLD 产生 ~ 816 nm 波长脉冲, 脉冲持续时间约 107-10千, 最大脉冲能量约 3.4 Mj, 重复速率高达 2 Khz。LDU 由冷水机组、12 V 电源、控制激光功率的可变高压电源和改变脉冲重复率的功能发生器组成。 - 将所有 8个 Sutr 逐个安装在每个 SUTR 支架上, 使每个声学反射器的表面朝向扫描区域的中心, 如图 1 b 所示。借助连接电缆, 将每根 SUTR 电缆连接到低噪声信号放大器。
注: 超声波传感器的中心频率为 5 MHz, 具有13毫米直径的活动区域。每个通道的 24 dB 增益中的两个放大器串联在一起。 - 打开冷水机组的电源, 然后打开冷水机组的开关, 将温度设置在20°c 至25°c 之间。
- 打开低压电源的电源, 慢慢地打开电流控制, 将电流限制设置为 0.3 A. 将电压设置为 12 v, 验证电流不超过 0.1 A。
- 打开高压电源的电源。按下 "预设" 按钮, 将电流设置为 1 A, 将电压设置为 0 V. 启用 "输出" 按钮: 0 V/0 A。
- 打开功能发生器的电源。按下 "召回" 按钮, 并选择一个 2 KHz 配置, 以产生激光脉冲在这种重复率。
- 如图 1 a所示, 将丙烯酸罐放入扫描仪内, 并将水箱灌满水, 使 sur 的检测表面完全浸入水中。
- 确保所有的 Sutr 检测表面都在水介质内。打开低噪声信号放大器的电源。
2. 大鼠脑成像的动物准备
注: 健康的雌性大鼠 (见材料表) 被用来演示上述桌面 pld-pat 系统, 用于小动物皮质血管成像。
- 通过停止头部和身体的运动, 将动物抱在其背上。通过腹腔注射2毫升氯胺酮 (100 Mg/ml)、2毫升木氨酸 (20 Mg/ml) 和1毫升盐水 (用量为 0.2 ml·100克) 的混合物对动物进行麻醉。
注: 注射后, 动物的脚趾被挤压, 以测试任何积极的反射, 如腿部或身体运动, 发声, 或呼吸明显增加。没有这种反射作用证实了动物的成功麻醉。 - 为了防止因麻醉和激光照射而干燥, 非常小心地将人工泪液膏涂在大鼠眼睛上。将动物放置在工作台上的俯卧位置, 用修剪头发的方法去除动物头皮上的皮毛, 轻轻地将脱毛霜涂在剃光区域, 完全取出皮草。
- 4-5分钟后, 用棉签取下应用的奶油。
- 将配备呼吸面罩 (见材料表) 的定制动物支架安装在实验室插孔上。
- 将动物放置在支架上的俯卧位置, 使头部停留在支架的水平平台上。使用手术胶带将动物固定在支架上。
- 确保呼吸面罩覆盖大鼠的鼻子和嘴巴, 以提供麻醉混合物。呼吸面罩是根据成像窗口量身定制的。10% 的商业上可获得的鼻锥被切割, 然后连接到一块手套。
- 在打开之前, 将呼吸面罩连接到麻醉机。
- 打开麻醉机, 将其设置为将含有 1.0 lmmin 氧气的麻醉混合物与0.75 异氟醚输送到动物呼吸面罩。
- 将脉搏血氧仪夹紧动物的后腿之一, 以监测其生理状况。
- 使用棉尖施药器将一层无色超声波凝胶涂在大鼠的头皮上。将实验室插孔位置调整到扫描仪的中心, 并手动调整实验室插孔的高度, 使成像平面位于声学反射器的中心。
3. 大鼠脑系统中导航卫星委员会吸收和清除过程的动态体内成像
- 在数据采集软件 (参见材料表) 中设置用于360°采集扫描的参数。
- 通过启用函数发生器的输出 (将开始发射激光) 来打开 PLD 激光发射。然后, 慢慢地将可变高压电源的电压提高到 120 V, 以实现最大的每脉冲能量。
- 运行数据采集软件 (参见材料表) 程序, 在4秒的扫描时间内360°旋转所有8个子 tr。
注: 例如, 如果 Subr 旋转 4 s, PLD 将提供 8, 000个 (= 4 x 2, 000) 脉冲, 并且每个 SUTR 收集 8000 a 线。这 8 000条 a 线通过平均超过20个信号减少到 400条 (平均 a 线 = 8000/20 = 400)。利用基于延迟和和回投影算法的重建程序, 找出了每个 SUTR 的扫描半径。 - 禁用函数发生器的输出以关闭激光发射。
- 利用数据处理软件中的重建算法 (见材料表), 利用反投影算法, 通过试错法找出所有 8个 sutr 的扫描半径。
- 在数据采集软件 (参见材料表) 中设置参数, 以便在0.5秒的扫描时间内进行45°采集。
注: 例如, 如果 Sutr 旋转 0.5 s, PLD 将提供 1, 000个 (= 0.5 x 2, 000) 脉冲, 并且每个 SUTR 收集 1000 a 线。这 1, 000条 a 线通过平均超过20个信号 (在平均 a 线 = 1000/20 = 50 后) 减少到 400条)。 - 使函数发生器的输出能够打开激光发射。
- 运行数据采集软件 (见材料表) 程序, 在45°范围内旋转所有8个子 tr, 以获得初始控制数据, 然后再管理 icg。
- 禁用函数发生器的输出以关闭激光发射。
- 识别动物的尾静脉, 并将0.3 毫升的 ICG (见材料表) (323 μm) 注入大鼠的尾静脉。
4. 我的工作是什么?
注: 使用微型称重机称重1.25 毫克 ICG 粉末, 并与5毫升蒸馏水混合, 使 ICG 溶液的浓度为323微米。
- 使函数发生器的输出能够打开激光发射。
- 运行数据采集软件 (参见材料表) 程序, 在45°旋转的0.5秒扫描时间内获取 a 线。
5。
注: 在0.5秒扫描时间内获得的 a 线用于生成一张横截面图像。每次扫描之间的时间间隔约为0.4–0.6秒。
- 数据采集结束后, 利用数据处理软件中的反投影算法 (参见材料表), 从保存的 a 线重建横截面大脑图像。
- 关闭激光, 然后关闭麻醉机, 降低实验室插孔, 并将动物从舞台上移开。将动物送回笼子和监视器, 直到它恢复意识。
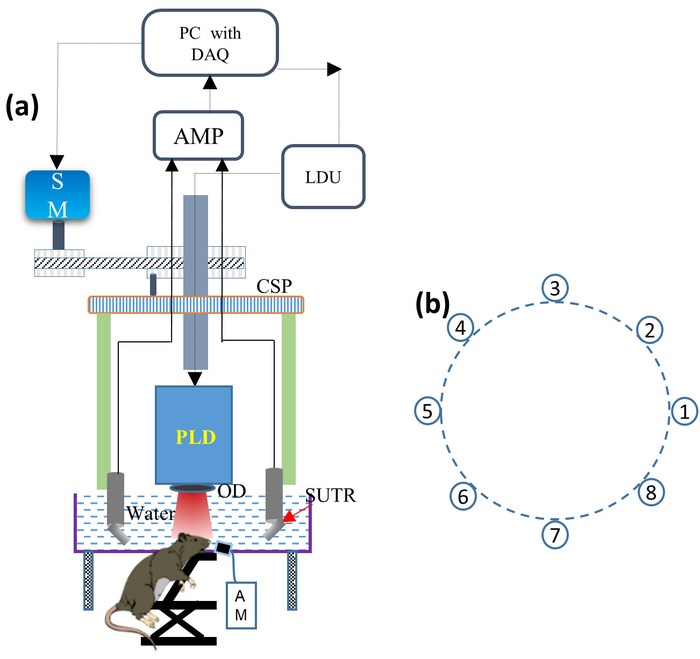
图 1: 桌面 pld-pat 系统的原理图.(A) 桌面 PLD-PAT 的原理图。PLD: 脉冲激光二极管, OD: 光学扩散器, SUTR: 基于声学反射器的单元素超声换能器, AM: 麻醉机, CSP: 圆形扫描板, SM: 步进电机, LDU: 激光驱动单元, AMP: 放大器, DAQ: 数据采集卡。(B) 扫描中心周围有 8个 ttr 的圆形排列。请点击这里查看此图的较大版本.
结果
该协议展示了所描述的桌面 PLD-PAT 系统在体内动态脑成像中的潜力, 并给出了相应的结果。通过对健康雌性大鼠进行体内脑成像, 证明了桌面 PLD-PAT 系统的高速成像能力。PA 信号是使用 8个 SUTRs 在360°和45°周围的大鼠大脑中旋转收集的, 扫描速度分别为4秒和0.5秒。图 2A. b 显示了一只雌性大鼠 (98 克) 的大脑图像, 扫描速度分别为4秒和0.5秒。在这两个图像中都可?...
讨论
这项工作提出了一个协议, 使用桌面 PLD-PAT 系统进行实验小动物, 如老鼠体内大脑成像和动态快速吸收和清除过程的造影剂, 如 ICG。笨重、昂贵的 OPO-PAT 系统需要几分钟 (2-5) 才能获得体内单个横截面图像。紧凑、低成本、第一代便携式 PLD-PAT 系统可在5秒内提供单个体内横截面图像。相比之下, 高速、紧凑、低成本的台式机 PLD-PAT 系统仅在 0.5秒26中呈现高质量的2D 横截面体内图像?...
披露声明
作者没有相关的经济利益或潜在的利益冲突需要披露。
致谢
这项研究得到了新加坡卫生部国家医学研究委员会 (NMRC/OFIRGY000/2016:M4062012) 的支持。作者要感谢周伟宏博比先生对机器车间的支持。
材料
| Name | Company | Catalog Number | Comments |
| 12 V power supply | Voltcraft | PPS-11810 | To supply operating voltage for PLD |
| Acoustic reflector | Olympus | F102 | 45 degree reflector augmented to the ultrasound transducer |
| Acrylic water tank | NTU workshop | Custom-made | It is used to hold water that acts as an acoustic coupling medium between animal brain and detector |
| Anesthetic Machine | Medical plus pte ltd | Non-Rebreathing Anaesthesia machine with oxygen concentrator. | Supplies oxygen and isoflurane to animal |
| Animal distributor | In Vivos Pte Ltd, Singapore | Animal distributor that supplies small animals for research purpose | |
| Animal holder | NTU workshop | Custom-made | Used for holding animal on its abdomen |
| Breathing mask | NTU workshop | Custom-made | Used along with animal holder to supply anesthesia mixture to the animal |
| Circular Scanner | NTU workshop | Custom-made | Scanner is made out of aluminum |
| DAQ (Data acquisition) Card | Spectrum | M2i.4932-exp | 16 bit, 30 Ms/s, 8 channels, 1 Gs, PCIe |
| Data acqusition software | National Instruments Corporation,Austin,TX,USA) | NI LabVIEW 2015 SP1 (32 bit) | LabVIEW based program developed in our laboratory for controlling the stepper motor and acquring the PA singnals from the detector |
| Data processing software | Matlab (Mathworks, Natick, MA, USA) | Matlab R2015b | Matlab code developed in our laboratory for reconstructing cross-sectional PA images |
| Function generator | RIGOL | DG1022 | To change the repetition rate of the PLD. It will provide TTL signal to synchronize the DAQ with the laser excitation. |
| Low noise signal amplifier | Genetron | Custom-made using Mini-circuits, ZFL-500LN-BNC | To receive, and amplify the PA signal from SUTR. Its gain is 24 dB. |
| Optical diffuser | Thorlabs | DG-120 | Used to to make the laser beam homogeneous |
| Pulsed laser diode | Quantel, France | QD-Q1924-ILO-WATER | It is the excitation laser source with specifications of 816 nm wavelength, 3.4 mJ per pulse energy, 107 ns pulse width, 2 KHz maximum pulse repitition rate, dimensions : 13.0 x 7.6 x 5.0 cm |
| Rats | In Vivos Pte Ltd, Singapore | NTac:SD, Sprague Dawley / SD | Female, weight 100±10g, strain of rats: Sprague Dawley, age: 4-5 weeks |
| Stepper motor with gearbox | LIN Engineering (Servo Dynamics) | Motor: CO-5718L-01P-RO, Gearbox: DPL64/1; Power supply PW-100-24 | To move the detector holder in a circular geometry. Torque: 2.08 N-m, Rotor inertia: 2.6 kg-cm2 |
| Ultrasound gel | Progress/parker acquasonic gel | PA-GEL-CLEA-5000 | Clear ultrasound gel |
| Ultrasound Transducer | Olympus | V309-SU/ U8423013 | Ultrasonic sensors used for photoacoustic detection. Central freqency 5 MHz, 0.5 in |
| Variable high voltage power supply | Elektro-Automatik | EA-PS 8160-04 T | To change the laser output power |
参考文献
- Lin, L., et al. Single-breath-hold photoacoustic computed tomography of the breast. Nature Communications. 9 (1), 2352 (2018).
- Upputuri, P. K., Pramanik, M. Fast photoacoustic imaging systems using pulsed laser diodes: a review. Biomedical Engineering Letters. 8 (2), 167-181 (2018).
- Yao, J., Wang, L. V. Recent progress in photoacoustic molecular imaging. Current Opinion in Chemical Biology. 45, 104-112 (2018).
- Upputuri, P. K., Pramanik, M. Recent advances toward preclinical and clinical translation of photoacoustic tomography: a review. Journal of Biomedical Optics. 22 (4), 041006 (2017).
- Yao, J., Wang, L. V. Photoacoustic microscopy. Laser & Photonics Reviews. 7 (5), 758-778 (2013).
- Awasthi, N., Kalva, S. K., Pramanik, M., Yalavarthy, P. K. Image Guided Filtering for Improving Photoacoustic Tomographic Image Reconstruction. Journal of Biomedical Optics. 23 (9), 091413 (2018).
- Kalva, S. K., Pramanik, M. Experimental validation of tangential resolution improvement in photoacoustic tomography using a modified delay-and-sum reconstruction algorithm. Journal of Biomedical Optics. 21 (8), 086011 (2016).
- Pramanik, M. Improving tangential resolution with a modified delay-and-sum reconstruction algorithm in photoacoustic and thermoacoustic tomography. The Journal of the Optical Society of America. 31 (3), 621-627 (2014).
- Xu, M., Wang, L. V. Universal back-projection algorithm for photoacoustic computed tomography. Physical Review E. 71 (1), 016706 (2005).
- Wang, L. V., Hu, S. Photoacoustic Tomography: In Vivo Imaging from Organelles to Organs. Science. 335 (6075), 1458-1462 (2012).
- Sivasubramanian, K., Periyasamy, V., Pramanik, M. Non-invasive sentinel lymph node mapping and needle guidance using clinical handheld photoacoustic imaging system in small animal. Journal of Biophotonics. 11 (1), e201700061 (2018).
- Hu, S., Maslov, K., Wang, L. V. Second-generation optical-resolution photoacoustic microscopy with improved sensitivity and speed. Optics Letters. 36 (7), 1134-1136 (2011).
- Stein, E. W., Maslov, K., Wang, L. V. Noninvasive, in vivo imaging of blood-oxygenation dynamics within the mouse brain using photoacoustic microscopy. Journal of Biomedical Optics. 14 (2), 020502 (2009).
- Ku, G., Wang, X. D., Xie, X. Y., Stoica, G., Wang, L. V. Imaging of tumor angiogenesis in rat brains in vivo by photoacoustic tomography. Applied Optics. 44 (5), 770-775 (2005).
- Ma, R., Taruttis, A., Ntziachristos, V., Razansky, D. Multispectral optoacoustic tomography (MSOT) scanner for whole-body small animal imaging. Optics Express. 17 (24), 21414-21426 (2009).
- Zhou, Y., et al. A Phosphorus Phthalocyanine Formulation with Intense Absorbance at 1000 nm for Deep Optical Imaging. Theranostics. 6 (5), 688-697 (2016).
- Li, L., et al. Single-impulse panoramic photoacoustic computed tomography of small-animal whole-body dynamics at high spatiotemporal resolution. Nature Biomedical Engineering. 1 (1), 0071 (2017).
- Sivasubramanian, K., Pramanik, M. High frame rate photoacoustic imaging at 7000 frames per second using clinical ultrasound system. Biomedical Optics Express. 7 (2), 312-323 (2016).
- Upputuri, P. K., Pramanik, M. Dynamic in vivo imaging of small animal brain using pulsed laser diode-based photoacoustic tomography system. Journal of Biomedical Optics. 22 (9), 090501 (2017).
- Upputuri, P. K., Periyasamy, V., Kalva, S. K., Pramanik, M. A High-performance compact photoacoustic tomography system for in vivo small-animal brain imaging. Journal of Visualized Experiments. (124), e55811 (2017).
- Upputuri, P. K., Pramanik, M. Pulsed laser diode based optoacoustic imaging of biological tissues. Biomedical Physics & Engineering Express. 1 (4), 045010-045017 (2015).
- Arabul, M. U., et al. Toward the detection of intraplaque hemorrhage in carotid artery lesions using photoacoustic imaging. Journal of Biomedical Optics. 22 (4), (2016).
- Daoudi, K., et al. Handheld probe integrating laser diode and ultrasound transducer array for ultrasound/photoacoustic dual modality imaging. Optics Express. 22 (21), 26365-26374 (2014).
- Allen, J. S., Beard, P. Pulsed near-infrared laser diode excitation system for biomedical photoacoustic imaging. Optics Letters. 31 (23), 3462-3464 (2006).
- Upputuri, P. K., Pramanik, M. Performance characterization of low-cost, high-speed, portable pulsed laser diode photoacoustic tomography (PLD-PAT) system. Biomed Opt Express. 6 (10), 4118-4129 (2015).
- Kalva, S. K., Upputuri, P. K., Pramanik, M. High-speed, low-cost, pulsed-laser-diode-based second-generation desktop photoacoustic tomography system. Optics Lett. 44 (1), 81-84 (2019).
- Kalva, S. K., Hui, Z. Z., Pramanik, M. Calibrating reconstruction radius in a multi single-element ultrasound-transducer-based photoacoustic computed tomography system. J Opt Soc Am A. 35 (5), 764-771 (2018).
- Kalva, S. K., Pramanik, M. Use of acoustic reflector to make compact photoacoustic tomography system. Journal of Biomedical Optics. 22 (2), 026009 (2017).
- . American National Standard for Safe Use of Lasers. ANSI Standard Z136.1-2007. , (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。