Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tomographie photoacoustique de bureau à diode laser pulsée pour la surveillance du lavage et du lavage de colorant dans la vascularisation corticale de rat
Dans cet article
Résumé
Un système de tomodensitométrie photoacoustique (PLD-PAT) de bureau à diode laser pulsée compacte est démontré pour l’imagerie dynamique in vivo à grande vitesse de la vascularisation corticale des petits animaux.
Résumé
L’imagerie par tomographie photoacoustique (PA) est une modalité d’imagerie biomédicale émergente, utile dans diverses applications précliniques et cliniques. Les transducteurs à anneau circulaire sur mesure et les lasers volumineux ND: YAG/OPO conventionnels inhibent la traduction du système PAT dans les cliniques. Les diodes laser pulsées ultra-compactes (PLD) sont actuellement utilisées comme source alternative d’excitation proche infrarouge pour l’imagerie PA. L’imagerie dynamique in vivo à haute vitesse a été démontrée à l’aide d’un système de PAT de bureau compact basé sur PLD (PLD-PAT). Un protocole expérimental visualisé utilisant le système PLD-PAT de bureau est fourni dans ce travail pour l’imagerie cérébrale dynamique in vivo. Le protocole décrit la configuration du système PLD-PAT de bureau, la préparation de l’animal pour l’imagerie vasculaire cérébrale, et la procédure pour la visualisation dynamique de l’absorption de colorant de vert d’indocyanine (ICG) et le processus de clairance dans le vasculature corticale de rat.
Introduction
La tomodensitométrie photoacoustique (PACT/Pat) est une modalité d’imagerie biomédicale non invasive prometteuse combinant un contraste optique riche avec une haute résolution ultrasond1,2,3,4, 5. quand un laser pulsé nanoseconde dépose de l’énergie sur des chromophores absorbant la lumière présents dans tout tissu biologique, les augmentations de température locales conduisant à l’expansion thermoélastique et la contraction du tissu, entraînant la génération de les vagues de pression. Ces ondes de pression sont connues sous le nom d’ondes ultrasoniques ou d’ondes photoacoustiques (PA), qui peuvent être détectées par des sondes ultrasoniques autour de l’échantillon. Les signaux PA détectés sont reconstruits à l’aide de divers algorithmes de reconstruction6,7,8,9 pour générer des images de PA transversales. L’imagerie PA fournit des informations structurelles et fonctionnelles des organes macroscopiques aux organites microscopiques en raison de la dépendance de longueur d’onde des chromophores endogènes présents à l’intérieur du corps10. L’imagerie PAT a été utilisée avec succès pour la détection du cancer du sein1, l’imagerie du ganglion sentinelle11, la cartographie de l’oxyhémoglobine (HBO2), la désoxyhémoglobine (HBr), la concentration totale en hémoglobine (hbt), la saturation en oxygène (SO 2) les le 12 , 13, angiogenèse de tumeur14, imagerie de corps entier de petit animal15, et d’autres applications.
Les lasers Nd: YAG/OPO sont des sources d’excitation conventionnelles pour les systèmes PAT de première génération qui sont largement utilisés dans la communauté photoacoustique pour l’imagerie des petits animaux et l’imagerie des tissus profonds16. Ces lasers fournissent ~ 100 impulsions d’énergie mJ à des taux de répétition faible de ~ 10-100 Hz. Les systèmes d’imagerie PAT utilisant ces lasers coûteux et encombrants ne conviennent pas à l’imagerie à haute vitesse avec des sondes à ultrasons à un seul élément (TS), en raison du taux de répétition d’impulsions limité. Cela inhibe la surveillance en temps réel des changements physiologiques survenant à des vitesses élevées à l’intérieur de l’animal. L’utilisation de capteurs à base de baies comme les matrices linéaires, semi-circulaires, circulaires et volumétriques avec l’excitation laser Nd: YAG, l’imagerie haute vitesse est possible. Cependant, ces capteurs de tableau sont coûteux et fournissent des sensibilités inférieures par rapport aux SUTs; Pourtant, la vitesse d’imagerie est limitée par le faible taux de répétition du laser. Les systèmes PACT à impulsion unique à la pointe de la technologie avec transducteur à anneau complet sur mesure obtiennent les données PA à des fréquences d’image de 50 Hz17. Ces capteurs de matrice ont besoin de l’électronique de réception de back-end complexe et des amplificateurs de signal, rendant le système global plus coûteux et difficile pour une utilisation clinique.
Leur taille compacte, leurs exigences de coût moindres et leur taux de répétition d’impulsions plus élevé (ordre de KHz) rendent les diodes laser pulsées plus prometteuses pour l’imagerie en temps réel. En raison de ces avantages, les PLD sont activement utilisés comme source d’excitation alternative dans les systèmes PAT de deuxième génération. Les systèmes Pat basés sur PLD ont été démontrés avec succès pour l’imagerie à cadence élevée à l’aide de sondes matricielles18, des tissus profonds et de l’imagerie cérébrale19,20,21, diagnostic des maladies cardiovasculaires22 et le diagnostic de rhumatologie23. Comme les SUTs sont très sensibles et moins coûteux par rapport aux capteurs de matrice, ils sont encore largement utilisés pour l’imagerie PAT. Des systèmes PLD basés sur des fibres ont été démontrés pour l’imagerie fantôme24. Un système PLD-PAT portatif a déjà été démontré par le montage du PLD à l’intérieur du scanneur PAT25. Avec un scanner circulaire SUT, l’imagerie fantôme a été réalisée pendant 3 s de temps de balayage, et l’imagerie cérébrale in vivo de rat a été réalisée pendant une période de 5 s utilisant ce système PLD-PAT19.
En outre, des améliorations ont été apportées à ce système PLD-Pat pour le rendre plus compact et créer un modèle de bureau à l’aide de huit capteurs acoustiques à un seul élément à base de réflecteur (SUTRS)26,27. Ici, les SUTs ont été placés dans une verticale au lieu de la direction horizontale à l’aide d’un réflecteur acoustique 90° 28. Ce système peut être utilisé pour des temps de balayage allant jusqu’à 0,5 s et environ 3 cm de profondeur dans l’imagerie tissulaire et dans l’imagerie cérébrale des petits animaux in vivo. Dans ce travail, ce système PLD-PAT de bureau est utilisé pour fournir la démonstration visuelle d’expériences pour l’imagerie cérébrale in vivo chez les petits animaux et pour la visualisation dynamique du processus d’absorption et de clairance de l’indocyanine approuvée par la FDA (Food and Drug Administration) colorant vert (ICG) dans les cerveaux de rat.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les expérimentations animales ont été effectuées conformément aux directives et règlements approuvés par le Comité institutionnel de soins et d’utilisation des animaux de l’Université technologique de Nanyang, Singapour (numéro de protocole animal ARF-SBS/NIE-A0331).
1. Description du système
- Montez le laser PLD dans le scanneur circulaire et montez le diffuseur optique (OD) devant la fenêtre de sortie PLD pour rendre le faisceau de sortie homogène, comme illustré à la figure 1a. Raccordez le PLD à l’unité de pilote laser (LDU).
Remarque: le PLD génère des impulsions de longueur d’onde ~ 816 nm, des impulsions de ~ 107 NS dans la durée, et jusqu’à un taux de répétition de 2 KHz avec une énergie d’impulsion maximale de ~ 3,4 mJ. Le LDU se compose de refroidisseur, alimentation de 12 V, alimentation à haute tension variable pour contrôler la puissance du laser, et le générateur de fonction pour changer le taux de répétition d’impulsion. - Montez les huit SUTRs sur chaque support SUTR un par un de telle sorte que la surface de chaque réflecteur acoustique soit orientée vers le centre de la zone de numérisation, comme illustré à la figure 1b. Connectez chaque câble SUTR à l’amplificateur de signal à faible bruit à l’aide de câbles de connexion.
Remarque: la fréquence centrale du transducteur ultrasonique est de 5 MHz et sa surface active est de 13 mm de diamètre. Deux amplificateurs chacun d’un gain de 24 dB sont connectés en série pour chaque canal. - Allumez l’alimentation du refroidisseur, puis allumez l’interrupteur du refroidisseur pour régler la température entre 20 ° c et 25 ° c.
- Allumez l’alimentation de l’alimentation basse tension et tournez lentement la commande de courant pour régler la limite de courant à 0,3 A. Réglez la tension sur 12 V. Vérifiez que le courant ne dépasse pas 0,1 A.
- Allumez l’alimentation haute tension. Appuyez sur le bouton "Preset" et réglez le courant sur 1 A et la tension sur 0 V. activer le bouton "output": 0 V/0 A.
- Allumez l’alimentation du générateur de fonction. Appuyez sur le bouton "Recall" et choisissez une configuration de 2 KHz pour générer les impulsions laser à ce taux de répétition.
- Placez le réservoir acrylique à l’intérieur du scanneur comme illustré à la figure 1a et remplissez le réservoir d’eau de telle sorte que la surface de détection des SUTRS soit immergée complètement à l’intérieur de l’eau.
- Assurez-vous que toutes les SUTRs détectant les surfaces sont à l’intérieur du milieu d’eau. Allumez l’alimentation de l’amplificateur à faible bruit de signal.
2. préparation animale pour l’imagerie cérébrale de rat
Remarque: des rats femelles en bonne santé (voir le tableau des matériaux) ont été utilisés pour démontrer le système PLD-Pat de bureau décrit ci-dessus pour l’imagerie de la vascularisation corticale des petits animaux.
- Tenez l’animal sur son dos en arrêtant le mouvement de la tête et du corps. Anesthésier l’animal par injection intrapéritonéale d’un mélange de 2 mL de kétamine (100 mg/mL), de 2 mL de xylazine (20 mg/mL) et de 1 mL de solution saline (dosage de 0,2 mL/100 g).
Remarque: après l’injection, l’orteil de l’animal est pincé pour tester les réflexes positifs tels que les mouvements de la jambe ou du corps, la vocalisation ou l’augmentation marquée des respirations. L’absence de telles actions réflexes confirme une anesthésie réussie de l’animal. - Pour éviter la sécheresse due à l’anesthésie et l’illumination laser, appliquez très soigneusement la pommade de déchirure artificielle aux yeux de rat. Placez l’animal en position sujette sur le banc de travail et enlevez la fourrure sur le cuir chevelu de l’animal en utilisant un coupe-cheveux et appliquez doucement la crème d’épilation à la zone rasée et enlevez la fourrure complètement.
- Après 4 à 5 min, enlevez la crème appliquée à l’aide d’un coton-tige.
- Montez le porte-animal sur mesure (voir tableau des matériaux) muni d’un masque respiratoire (voir tableau des matériaux) sur un cric de laboratoire.
- Placez l’animal en position sujette sur le support de sorte que la tête repose sur la plate-forme horizontale du support. Utiliser du ruban chirurgical pour fixer l’animal au support.
- Assurez-vous que le masque respiratoire recouvre le nez et la bouche du rat pour fournir un mélange d’anesthésie. Le masque respiratoire est personnalisé pour convenir à la fenêtre d’imagerie. 10% du cône de nez disponible dans le commerce est coupé puis relié à un morceau de gant.
- Raccordez le masque respiratoire à la machine d’anesthésie avant de l’allumer.
- Allumez la machine d’anesthésie et réglez-la pour délivrer un mélange anesthésique contenant 1,0 L/min d’oxygène avec 0,75% d’isoflurane au masque respiratoire de l’animal.
- Fixez l’oxymètre de pouls à l’une des pattes postérieures de l’animal pour surveiller son état physiologique.
- Appliquez une couche de gel ultrasonique incolore sur le cuir chevelu du rat à l’aide d’un applicateur à pointe de coton. Réglez la position de la prise de laboratoire au centre du scanneur et ajustez la hauteur de la prise de laboratoire manuellement afin que le plan d’imagerie se trouve au centre du réflecteur acoustique.
3. imagerie dynamique in vivo de l’absorption et du processus de clairance de l’ICG dans le cerveau de rat
- Définissez les paramètres dans le logiciel d’acquisition de données (voir tableau des matériaux) pour une analyse d’acquisition 360 °.
- Activez l’émission laser PLD en activant la sortie du générateur de fonction (l’émission laser démarrera). Ensuite, augmentez lentement la tension de l’alimentation à haute tension variable à 120 V pour un maximum par impulsion d’énergie.
- Exécutez le logiciel d’acquisition de données (voir le tableau des matériaux) pour faire pivoter les huit SUTRS en 360 ° sur une durée de balayage de 4 s.
Remarque: par exemple, si les SUTRs sont pivotés pour 4s, le PLD délivre 8 000 (= 4 x 2 000) impulsions et chaque SUTR recueille 8000 lignes A. Ces 8 000 lignes A sont réduites à 400 en moyennant plus de 20 signaux (après une moyenne de A-Lines = 8000/20 = 400). Un programme de reconstruction basé sur l’algorithme de projection différée de retard-et-somme est utilisé pour trouver le rayon de balayage de chaque SUTR. - Désactivez la sortie du générateur de fonction pour éteindre l’émission laser.
- En utilisant l’algorithme de reconstruction dans le logiciel de traitement de données (voir le tableau des matériaux), Découvrez le rayon de balayage des huit SUTRS par essai et erreur, à l’aide de l’algorithme de rétroprojection.
- Définissez les paramètres dans le logiciel d’acquisition de données (voir tableau des matériaux) pour l’acquisition de 45 ° sur une durée de balayage de 0,5 s.
Remarque: par exemple, si les SUTRs sont tournés pour 0.5 s, le PLD délivre 1 000 (= 0,5 x 2 000) impulsions et chaque SUTR recueille 1000 lignes A. Ces 1 000 lignes A sont réduites à 400 en moyennant plus de 20 signaux (après une moyenne de A-Lines = 1000/20 = 50). - Activez la sortie du générateur de fonction pour allumer l’émission laser.
- Exécutez le logiciel d’acquisition de données (voir tableau des matériaux) pour faire pivoter les huit SUTRS en 45 ° pour obtenir les données de contrôle initiales avant d’administrer ICG.
- Désactivez la sortie du générateur de fonction pour éteindre l’émission laser.
- Identifiez la veine de queue de l’animal et injectez 0,3 mL de ICG (voir tableau des matériaux) (323 μM) dans la veine de queue du rat.
4.
NOTE: 1,25 mg de poudre d’ICG a été pesé à l’aide d’un micro-appareil de pesage et mélangé avec 5 mL d’eau distillée pour obtenir une concentration de 323 μM pour la solution ICG.
- Activez la sortie du générateur de fonction pour allumer l’émission laser.
- Exécutez le logiciel d’acquisition de données (voir tableau des matériaux) pour acquérir des lignes a sur une durée de balayage de 0,5 s en rotation de 45 °.
5.
Remarque: les lignes A acquises au cours d’une période de balayage de 0,5 s sont utilisées pour générer une image transversale. Il y a un écart temporel de ~ 0,4 à 0,6 s entre chaque balayage.
- Une fois l’acquisition de données terminée, en utilisant l’algorithme de rétroprojection dans le logiciel de traitement des données (voir tableau des matériaux), reconstruisez l’image du cerveau transversal à partir des lignes A enregistrées.
- Éteignez le laser, puis éteignez la machine d’anesthésie, baissez la prise de laboratoire et retirez l’animal de la scène. Retournez l’animal à la cage et surveillez jusqu’à ce qu’il retrouve la conscience.
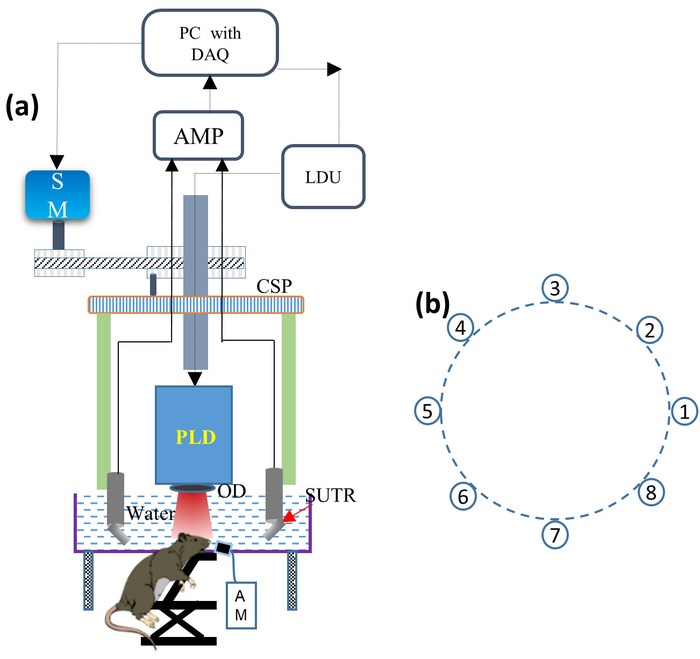
Figure 1: schéma du système PLD-Pat de bureau. (A) schéma du Bureau PLD-Pat mis en place. PLD: diode laser pulsée, OD: diffuseur optique, SUTR: capteur ultrasonique à base de réflecteur acoustique, AM: machine d’anesthésie, CSP: plaque de balayage circulaire, SM: moteur pas à pas, LDU: unité de conduite laser, AMP: amplificateur, DAQ: carte d’acquisition de données. B) disposition circulaire de huit SUTRS autour du centre de numérisation. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Access restricted. Please log in or start a trial to view this content.
Résultats
La potentialité du système PLD-PAT de bureau décrit pour l’imagerie cérébrale dynamique in vivo a été présentée dans ce protocole avec des résultats correspondants. La capacité d’imagerie à grande vitesse du système PLD-PAT de bureau a été démontrée en effectuant une imagerie cérébrale in vivo de rats femelles sains. Les signaux PA ont été recueillis à l’aide de huit SUTRs tournant en 360 ° et 45 ° autour du cerveau de rat à des vitesses de balayage de 4 s e...
Access restricted. Please log in or start a trial to view this content.
Discussion
Ce travail présente un protocole pour utiliser un système PLD-PAT de bureau pour mener des expériences sur de petits animaux comme des rats pour l’imagerie cérébrale in vivo et le processus dynamique d’absorption rapide et de clairance des agents de contraste comme ICG. Les systèmes OPO-PAT volumineux et coûteux prennent plusieurs minutes (2-5 min) pour acquérir une seule image in vivo en coupe transversale. Un système PLD-PAT portatif compact, peu coûteux et de première génération fournit des images in ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts financiers pertinents ou de conflits d’intérêts potentiels à divulguer.
Remerciements
La recherche est soutenue par le Conseil national de recherches médicales du ministère de la santé de Singapour (NMRC/OFIRG/0005/2016: M4062012). Les auteurs aimeraient remercier m. Chow Wai Hoong Bobby pour le support de l’atelier de machines.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 12 V power supply | Voltcraft | PPS-11810 | To supply operating voltage for PLD |
| Acoustic reflector | Olympus | F102 | 45 degree reflector augmented to the ultrasound transducer |
| Acrylic water tank | NTU workshop | Custom-made | It is used to hold water that acts as an acoustic coupling medium between animal brain and detector |
| Anesthetic Machine | Medical plus pte ltd | Non-Rebreathing Anaesthesia machine with oxygen concentrator. | Supplies oxygen and isoflurane to animal |
| Animal distributor | In Vivos Pte Ltd, Singapore | Animal distributor that supplies small animals for research purpose | |
| Animal holder | NTU workshop | Custom-made | Used for holding animal on its abdomen |
| Breathing mask | NTU workshop | Custom-made | Used along with animal holder to supply anesthesia mixture to the animal |
| Circular Scanner | NTU workshop | Custom-made | Scanner is made out of aluminum |
| DAQ (Data acquisition) Card | Spectrum | M2i.4932-exp | 16 bit, 30 Ms/s, 8 channels, 1 Gs, PCIe |
| Data acqusition software | National Instruments Corporation,Austin,TX,USA) | NI LabVIEW 2015 SP1 (32 bit) | LabVIEW based program developed in our laboratory for controlling the stepper motor and acquring the PA singnals from the detector |
| Data processing software | Matlab (Mathworks, Natick, MA, USA) | Matlab R2015b | Matlab code developed in our laboratory for reconstructing cross-sectional PA images |
| Function generator | RIGOL | DG1022 | To change the repetition rate of the PLD. It will provide TTL signal to synchronize the DAQ with the laser excitation. |
| Low noise signal amplifier | Genetron | Custom-made using Mini-circuits, ZFL-500LN-BNC | To receive, and amplify the PA signal from SUTR. Its gain is 24 dB. |
| Optical diffuser | Thorlabs | DG-120 | Used to to make the laser beam homogeneous |
| Pulsed laser diode | Quantel, France | QD-Q1924-ILO-WATER | It is the excitation laser source with specifications of 816 nm wavelength, 3.4 mJ per pulse energy, 107 ns pulse width, 2 KHz maximum pulse repitition rate, dimensions : 13.0 x 7.6 x 5.0 cm |
| Rats | In Vivos Pte Ltd, Singapore | NTac:SD, Sprague Dawley / SD | Female, weight 100±10g, strain of rats: Sprague Dawley, age: 4-5 weeks |
| Stepper motor with gearbox | LIN Engineering (Servo Dynamics) | Motor: CO-5718L-01P-RO, Gearbox: DPL64/1; Power supply PW-100-24 | To move the detector holder in a circular geometry. Torque: 2.08 N-m, Rotor inertia: 2.6 kg-cm2 |
| Ultrasound gel | Progress/parker acquasonic gel | PA-GEL-CLEA-5000 | Clear ultrasound gel |
| Ultrasound Transducer | Olympus | V309-SU/ U8423013 | Ultrasonic sensors used for photoacoustic detection. Central freqency 5 MHz, 0.5 in |
| Variable high voltage power supply | Elektro-Automatik | EA-PS 8160-04 T | To change the laser output power |
Références
- Lin, L., et al. Single-breath-hold photoacoustic computed tomography of the breast. Nature Communications. 9 (1), 2352(2018).
- Upputuri, P. K., Pramanik, M. Fast photoacoustic imaging systems using pulsed laser diodes: a review. Biomedical Engineering Letters. 8 (2), 167-181 (2018).
- Yao, J., Wang, L. V. Recent progress in photoacoustic molecular imaging. Current Opinion in Chemical Biology. 45, 104-112 (2018).
- Upputuri, P. K., Pramanik, M. Recent advances toward preclinical and clinical translation of photoacoustic tomography: a review. Journal of Biomedical Optics. 22 (4), 041006(2017).
- Yao, J., Wang, L. V. Photoacoustic microscopy. Laser & Photonics Reviews. 7 (5), 758-778 (2013).
- Awasthi, N., Kalva, S. K., Pramanik, M., Yalavarthy, P. K. Image Guided Filtering for Improving Photoacoustic Tomographic Image Reconstruction. Journal of Biomedical Optics. 23 (9), 091413(2018).
- Kalva, S. K., Pramanik, M. Experimental validation of tangential resolution improvement in photoacoustic tomography using a modified delay-and-sum reconstruction algorithm. Journal of Biomedical Optics. 21 (8), 086011(2016).
- Pramanik, M. Improving tangential resolution with a modified delay-and-sum reconstruction algorithm in photoacoustic and thermoacoustic tomography. The Journal of the Optical Society of America. 31 (3), 621-627 (2014).
- Xu, M., Wang, L. V. Universal back-projection algorithm for photoacoustic computed tomography. Physical Review E. 71 (1), 016706(2005).
- Wang, L. V., Hu, S. Photoacoustic Tomography: In Vivo Imaging from Organelles to Organs. Science. 335 (6075), 1458-1462 (2012).
- Sivasubramanian, K., Periyasamy, V., Pramanik, M. Non-invasive sentinel lymph node mapping and needle guidance using clinical handheld photoacoustic imaging system in small animal. Journal of Biophotonics. 11 (1), e201700061(2018).
- Hu, S., Maslov, K., Wang, L. V. Second-generation optical-resolution photoacoustic microscopy with improved sensitivity and speed. Optics Letters. 36 (7), 1134-1136 (2011).
- Stein, E. W., Maslov, K., Wang, L. V. Noninvasive, in vivo imaging of blood-oxygenation dynamics within the mouse brain using photoacoustic microscopy. Journal of Biomedical Optics. 14 (2), 020502(2009).
- Ku, G., Wang, X. D., Xie, X. Y., Stoica, G., Wang, L. V. Imaging of tumor angiogenesis in rat brains in vivo by photoacoustic tomography. Applied Optics. 44 (5), 770-775 (2005).
- Ma, R., Taruttis, A., Ntziachristos, V., Razansky, D. Multispectral optoacoustic tomography (MSOT) scanner for whole-body small animal imaging. Optics Express. 17 (24), 21414-21426 (2009).
- Zhou, Y., et al. A Phosphorus Phthalocyanine Formulation with Intense Absorbance at 1000 nm for Deep Optical Imaging. Theranostics. 6 (5), 688-697 (2016).
- Li, L., et al. Single-impulse panoramic photoacoustic computed tomography of small-animal whole-body dynamics at high spatiotemporal resolution. Nature Biomedical Engineering. 1 (1), 0071(2017).
- Sivasubramanian, K., Pramanik, M. High frame rate photoacoustic imaging at 7000 frames per second using clinical ultrasound system. Biomedical Optics Express. 7 (2), 312-323 (2016).
- Upputuri, P. K., Pramanik, M. Dynamic in vivo imaging of small animal brain using pulsed laser diode-based photoacoustic tomography system. Journal of Biomedical Optics. 22 (9), 090501(2017).
- Upputuri, P. K., Periyasamy, V., Kalva, S. K., Pramanik, M. A High-performance compact photoacoustic tomography system for in vivo small-animal brain imaging. Journal of Visualized Experiments. (124), e55811(2017).
- Upputuri, P. K., Pramanik, M. Pulsed laser diode based optoacoustic imaging of biological tissues. Biomedical Physics & Engineering Express. 1 (4), 045010-045017 (2015).
- Arabul, M. U., et al. Toward the detection of intraplaque hemorrhage in carotid artery lesions using photoacoustic imaging. Journal of Biomedical Optics. 22 (4), (2016).
- Daoudi, K., et al. Handheld probe integrating laser diode and ultrasound transducer array for ultrasound/photoacoustic dual modality imaging. Optics Express. 22 (21), 26365-26374 (2014).
- Allen, J. S., Beard, P. Pulsed near-infrared laser diode excitation system for biomedical photoacoustic imaging. Optics Letters. 31 (23), 3462-3464 (2006).
- Upputuri, P. K., Pramanik, M. Performance characterization of low-cost, high-speed, portable pulsed laser diode photoacoustic tomography (PLD-PAT) system. Biomed Opt Express. 6 (10), 4118-4129 (2015).
- Kalva, S. K., Upputuri, P. K., Pramanik, M. High-speed, low-cost, pulsed-laser-diode-based second-generation desktop photoacoustic tomography system. Optics Lett. 44 (1), 81-84 (2019).
- Kalva, S. K., Hui, Z. Z., Pramanik, M. Calibrating reconstruction radius in a multi single-element ultrasound-transducer-based photoacoustic computed tomography system. J Opt Soc Am A. 35 (5), 764-771 (2018).
- Kalva, S. K., Pramanik, M. Use of acoustic reflector to make compact photoacoustic tomography system. Journal of Biomedical Optics. 22 (2), 026009(2017).
- American National Standard for Safe Use of Lasers. ANSI Standard Z136.1-2007. , NY. (2007).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon