このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ラット皮質脈管構造での洗浄・インおよび染料の洗浄を監視するためのパルスレーザーダイオードベースのデスクトップ光音響断層撮影
要約
密集した脈打ったレーザーのダイオード・ベースの卓上の光音響の断層撮影 (PLD-PAT) システムは小さい動物の皮質の脈管構造の高速動的のインビボのイメージ投射のために証明される。
要約
光音響 (PA) 断層撮影 (PAT) 画像化は、様々な前臨床および臨床的適用において有用な新生生物医学的画像化モダリティである。カスタムメイドの円形リングアレイベースのトランスデューサと従来のかさばる Nd: YAG/OPO レーザーは、診療所への PAT システムの翻訳を阻害します。超小型パルスレーザダイオード (PLDs) は、現在、PA イメージングのための近赤外励起の代替源として使用されています。高速度動的 in vivo イメージングは、コンパクト PLD ベースのデスクトップ PAT システム (PLD-PAT) を使用して実証されています。デスクトップ PLD-PAT システムを使用して視覚化された実験的なプロトコルは動的な in vivo 脳イメージ投射のためのこの仕事で提供される。プロトコルは、デスクトップ PLD-PAT システム構成、脳血管イメージングのための動物の調製、およびラット皮質脈管構造におけるインドシアニングリーン (ICG) 染料取り込みおよびクリアランスプロセスの動的な可視化のための手順を説明する。
概要
光音響計算断層撮影法 (協定/PAT) は、高 ultrasond 解像度1、2、3、4と豊富な光学的コントラストを組み合わせた有望な非侵襲的生体イメージングモダリティです。5.ナノ秒パルスレーザーが生体組織内に存在する光吸収発色団にエネルギーを堆積させると、局所的な温度が上昇して組織の thermoelastic の拡大と収縮をもたらし、結果として発生する圧力波これらの圧力波は、超音波または光音響 (PA) 波として知られており、サンプルの周りの超音波トランスデューサによって検出することができる。検出された pa 信号は、断面 pa 画像を生成するために、6、7、8、9の様々な再構成アルゴリズムを使用して再構築される。PA イメージングは、体10の中に存在する内因性発色団の波長依存性に起因する巨視的な器官からの微細なオルガネラに構造的および機能的情報を提供する。PAT イメージングが正常に使用された乳がん検出1、センチネルリンパ節イメージング11、オキシヘモグロビン (HbO2)、deoxyhemoglobin (HbR)、総ヘモグロビン濃度 (HbT)、酸素飽和度 (2)12,図13は、腫瘍の血管新生14、動物全体の全身イメージング15、および他の用途である。
Nd: YAG/OPO レーザは、小型動物イメージングおよび深部組織画像化16のための光音響コミュニティで広く使用されている第一世代の PAT システムに対する従来の励起源である。これらのレーザーは ~ 10-100 Hz の低い繰り返し率で ~ 100 mJ エネルギーパルスを提供します。これらの高価でかさばるレーザーを使用した PAT イメージングシステムは、パルス反復速度が限られているため、単元素超音波トランスデューサ (SUTs) による高速イメージングには適していません。これは、動物の内部で高速で発生する生理的変化のリアルタイムモニタリングを阻害する。リニア、半円形、円形、容積型アレイなどのアレイ・ベースのトランスデューサを Nd: YAG レーザー励起で使用することで、高速イメージングが可能です。しかし、これらの配列トランスデューサは高価であり、SUTs に比べて低い感度を提供します。しかし、撮像速度は、レーザの低い繰り返し速度によって制限される。カスタマイズされたフルリングの配列のトランスデューサーが付いている最先端の単一インパルスの協定システムは50の Hz フレーム率17で PA データを得る。これらのアレイトランスデューサは、複雑なバックエンドの受信電子機器および信号増幅器を必要とするため、システム全体のコストが高くなり、臨床使用が困難になります。
小型、低コスト、高パルス繰り返し率 (KHz の次数) により、パルスレーザダイオード (PLDs) がよりリアルタイムイメージングにより有望になります。これらの利点のために、PLDs は第二世代 PAT システムの代替励起源として積極的に使用されています。PLD に基づいた PAT システムは、アレイトランスデューサ18を用いた高フレームレートイメージングに対して正常に実証されており、深部組織および脳イメージング19、20、21、心血管疾患診断22、リウマチ診断23.SUTs は、アレイトランスデューサと比較して高感度で安価であるため、PAT イメージングにも広く使用されています。繊維ベース PLD システムは、ファントムイメージング24のために実証されている。携帯用 PLD-PAT システムは PAT スキャナ25の中の PLD を取付けることによって前に証明された。1 SUT 環状走査器を用いて、3 s の走査時間の間にファントム画像化を行い、そしてインビボでラット脳画像化を、この PLD − PAT システム19を用いて 5 s 期間中に行った。
さらに、この PLD-PAT システムを改良して、8つの音響リフレクタベースの単一要素超音波トランスデューサ (SUTRs)26,27を使用して、よりコンパクトにしてデスクトップモデルを作成しました。ここで、SUTs は、90°音響反射器28の補助を用いて水平方向の代わりに垂直に配置した。このシステムはティッシュのイメージ投射およびインビボの小さい動物の頭脳のイメージ投射の 0.5 s そして〜 3 cm までのスキャンの時間のために使用することができる。この作品では、このデスクトップ PLD-PAT システムは、小動物におけるインビボ脳イメージングのための実験の視覚的なデモンストレーションを提供し、食品医薬品局 (FDA) の取り込みおよびクリアランスプロセスの動的な可視化のために使用されています-承認インドシアニン緑 (ICG) ラットの脳内染料。
プロトコル
全ての動物実験は、シンガポールの南洋理工大学の動物医療・ユース委員会 (動物プロトコル番号 ARF-SBS/NIE-A0331) が承認したガイドラインと規制に従って実施された。
1. システム記述
- PLD レーザーを円形スキャナーにマウントし、PLD 出口窓の前に光ディフューザー (OD) を取り付けて出力ビームを均質にします (図 1aを見て)。PLD をレーザー・ドライバー・ユニット (LDU) に接続します。
注: PLD は、~ 816 nm の波長パルス、持続時間で ~ 107 ns のパルス、最大パルスエネルギーである ~ 3.4 mJ までの 2 KHz 繰り返しレートを生成します。LDU は、冷却器、12 V 電源、レーザーパワーを制御するための可変高圧電源、およびパルス繰り返し速度を変更する機能ジェネレータで構成されています。 - 図 1bに示すように、各音響反射器の表面が走査領域の中心に向かって向くように、各 SUTR ホルダーに8個の SUTRs を1つずつ取り付けます。接続ケーブルの助けを借りて、各 SUTR ケーブルを低雑音信号アンプに接続します。
注: 超音波のトランスデューサーの中央頻度は5つの MHz であり、13の mm の直径の活動的な区域を備えている。2つのアンプはそれぞれ 24 dB のゲインを各チャンネルごとに直列に接続します。 - チラーの電源をオンにし、チラーのスイッチをオンにして、20° c ~ 25 ° c の温度を設定します。
- 低電圧電源の電源をオンにし、現在のコントロールをゆっくりと回転させて、現在のリミットを0.3 に設定します。電圧を12v に設定します。電流が0.1 を超えないことを確認します。
- 高圧電源装置の電源をオンにします。「プリセット」ボタンを押して、電流を 1 A、電圧を 0 V に設定します。「出力」ボタンを有効にします: 0 V/0 A。
- ファンクションジェネレータの電源をオンにします。この繰り返し速度でレーザーパルスを生成するには、「リコール」ボタンを押して 2 KHz の設定を選択します。
- 図 1aに示すように、スキャナー内部にアクリルタンクを置き、SUTRs の検出面が水の中に完全に浸漬されるように水槽を水で満たしてください。
- すべての SUTRs 検出サーフェスが水媒体の内側にあることを確認します。低雑音信号増幅器の電源をオンにします。
2. ラット脳イメージングのための動物の調製
注: 健康な雌ラット (材料のテーブルを参照) は、小動物の皮質脈管構造を画像化するための上記のデスクトップ PLD-PAT システムを実証するために使用されました。
- 頭と体の動きを逮捕することによって、その背中に動物を保持します。麻酔は、2ミリミンの2ml の混合物 (100 mg/mL)、キシラジンの 2ml (20mg/mL)、および 1 mL の生理食塩水 (0.2 mL/100g の投与量) の腹腔内注射によって動物を接種する。
注: 注射の後、動物のつま先は、そのような脚や体の動き、発声、または呼吸の著しい増加などの正の反射をテストするために挟まれています。このような反射作用の欠如は、動物の成功した anesthetization を確認する。 - 麻酔とレーザー照明による乾燥を防ぐために、非常に慎重に、人工涙液軟膏をラットの目に適用します。作業台の上にうつ伏せの位置に動物を配置し、毛トリマーを使用して動物の頭皮に毛皮を削除し、優しく剃毛領域に脱毛クリームを適用し、完全に毛皮を削除します。
- 4〜5分後、綿棒を使用して適用されたクリームを取り除きます。
- ラボジャックの呼吸マスク (資料の表を参照) が装備されたカスタムメイドの動物ホルダー (材料のテーブルを参照) をマウントします。
- 頭がホルダーの水平プラットフォーム上に置かれるように、ホルダーの上にうつ伏せの位置に動物を置きます。動物をホルダーに固定するために、外科用テープを使用してください。
- 呼吸マスクがラットの鼻と口を覆い、麻酔の混合物を送達することを確認してください。呼吸のマスクはイメージ投射窓に適するためにカスタマイズされる。市販のノーズコーンの 10% が切断され、次に手袋の一部に接続される。
- それをオンにする前に、麻酔装置に呼吸マスクを接続します。
- 麻酔機械のスイッチを入れ、動物の呼吸マスクに 0.75% イソフルランの酸素の 1.0 L/min を含んでいる麻酔の混合物を提供するためにそれを置くために設定しなさい。
- パルス濃度計を動物の後肢の1つに固定し、その生理的状態を監視する。
- 綿の先端アプリケータを使用して、ラットの頭皮に無色の超音波ゲルの層を適用します。ラボジャックの位置をスキャナーの中央に合わせ、ラボジャックの高さを手動で調整して、イメージングプレーンがアコースティックリフレクタの中心になるようにします。
3. ラット脳における ICG の取込みとクリアランス過程の動的 in vivo イメージング
- 360°集録スキャンのデータ集録ソフトウェア (材料表を参照) のパラメータを設定します。
- ファンクションジェネレータの出力を有効にして PLD レーザー放射をオンにします (レーザー放射が開始されます)。その後、可変高電圧電源の電圧を、パルスエネルギーあたり最大の 120 V にゆっくりと増加させます。
- データ集録ソフトウェア (資料表を参照) を実行して、4秒間のスキャン時間にわたって8つの SUTRs すべてを360°で回転させます。
注: たとえば、SUTRs が4s 用に回転された場合、PLD は 8000 (= 4 x 2000) パルスを送信し、各 SUTR は 8000 A 線を収集します。これらの 8000 A 線は、20個以上の信号を平均することで400に減少します (A 線平均 = 8000/20 = 400)。遅延・サム・バック・プロジェクション・アルゴリズムに基づく再構築プログラムは、各 SUTR のスキャン半径を調べるために使用されます。 - ファンクションジェネレータの出力を無効にして、レーザー放射をオフにします。
- データ処理ソフトウェアの再構築アルゴリズムを使用して (資料の表を参照)、バック・プロジェクション・アルゴリズムを使用して、試行錯誤によってすべての8つの SUTRs の走査半径を調べます。
- 0.5 s スキャン時間にわたって45°の集録を行うには、データ集録ソフトウェア (材料の表を参照) のパラメータを設定します。
注: たとえば、SUTRs が 0.5 s のために回転する場合、PLD は 1000 (= 0.5 x 2000) パルスを提供し、各 SUTR は 1000 A ラインを収集します。これらの 1000 A 線は、20個以上の信号を平均することで400に減少します (A 線平均 = 1000/20 = 50)。 - ファンクションジェネレーターの出力を有効にしてレーザー発光をオンにします。
- データ集録ソフトウェア (材料表参照) プログラムを実行して、45°の8つの SUTRs をすべて回転させ、ICG を投与する前に初期制御データを取得します。
- ファンクションジェネレータの出力を無効にして、レーザー放射をオフにします。
- 動物の尾静脈を特定し、0.3 mL の ICG (材料表参照) (323 μ m) をラットの尾静脈に注入します。
4.
注: 1.25 ICG 粉末の mg をマイクロ計量機を用いて秤量し、5ml の蒸留水と混合し、ICG 溶液に対して323μ m の濃度を得た。
- ファンクションジェネレーターの出力を有効にしてレーザー発光をオンにします。
- データ集録ソフトウェア (材料表参照) プログラムを実行して、0.5 秒間のスキャン時間を45°回転で a 線を取得します。
5.
注: 0.5 s スキャン時間の間に取得された A 線は、1つの断面イメージを生成するために使用します。各スキャンの間には、約 0.4 ~ 0.6 秒の時間差があります。
- データ取得が終わったら、データ処理ソフトウェア (資料の表を参照) でバックプロジェクションアルゴリズムを使用して、保存された A ラインから断面の脳画像を再構築します。
- レーザーをオフにして、麻酔マシンをオフにし、ラボジャックを下げて、ステージから動物を削除します。動物をケージに戻し、意識を取り戻すまでモニターしてください。
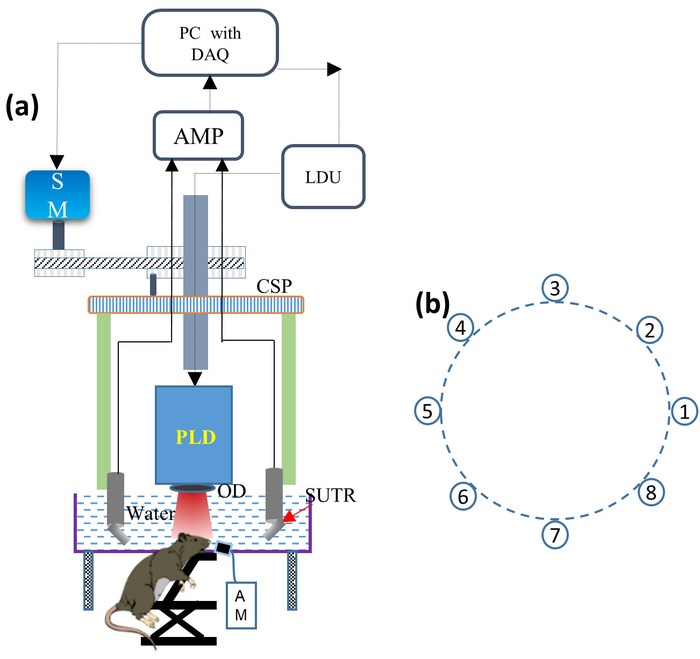
図 1: デスクトップ PLD-PAT システムの概略。(A) デスクトップ PLD-PAT の概略を設定します。PLD: パルスレーザーダイオード、OD: 光ディフューザー、SUTR: 音響リフレクタベースの単一要素超音波トランスデューサ、AM: 麻酔機、CSP: 円形スキャニングプレート、SM: ステッピングモータ、LDU: レーザー駆動部、アンプ: アンプ、DAQ: データ集録カード。(B) 走査中心を中心とした 8 SUTRs の円形配置。この図の大規模なバージョンを表示するには、ここをクリックしてください。
結果
ダイナミックな in vivo 脳イメージングのために説明されたデスクトップ PLD-PAT システムの可能性は、対応する結果とこのプロトコルで展示しています。デスクトップ PLD-PAT システムの高速画像化能力は、健康な雌ラットのインビボ脳画像化を行うことによって実証された。PA 信号は、それぞれ 4 s と 0.5 s のスキャン速度でラット脳の周りの360°と45°で回転する 8 SUTRs ?...
ディスカッション
本研究では、ICG のような造影剤の生体内脳イメージングや動的な高速取り込み・クリアランスプロセスについて、ラットのような小動物の実験を行うためのデスクトップ PLD-PAT システムを使用するためのプロトコルを提示する。かさばる、高価な OPO システムは、インビボ画像の単一の断面を取得するために数分 (2-5 分) かかります。密集した、低価格の、第1世代の携帯用 PLD-PAT システムは5...
開示事項
著者は、開示するために、関連する金銭的利害や潜在的な対立の利害関係を持っていません。
謝辞
この研究は、シンガポール保健省の国立医学研究評議会 (ユーザー/OFIRG/0005/2016: M4062012) によって支援されています。著者は、マシンショップのサポートのためのチョウワイ Hoong ボビー氏に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 12 V power supply | Voltcraft | PPS-11810 | To supply operating voltage for PLD |
| Acoustic reflector | Olympus | F102 | 45 degree reflector augmented to the ultrasound transducer |
| Acrylic water tank | NTU workshop | Custom-made | It is used to hold water that acts as an acoustic coupling medium between animal brain and detector |
| Anesthetic Machine | Medical plus pte ltd | Non-Rebreathing Anaesthesia machine with oxygen concentrator. | Supplies oxygen and isoflurane to animal |
| Animal distributor | In Vivos Pte Ltd, Singapore | Animal distributor that supplies small animals for research purpose | |
| Animal holder | NTU workshop | Custom-made | Used for holding animal on its abdomen |
| Breathing mask | NTU workshop | Custom-made | Used along with animal holder to supply anesthesia mixture to the animal |
| Circular Scanner | NTU workshop | Custom-made | Scanner is made out of aluminum |
| DAQ (Data acquisition) Card | Spectrum | M2i.4932-exp | 16 bit, 30 Ms/s, 8 channels, 1 Gs, PCIe |
| Data acqusition software | National Instruments Corporation,Austin,TX,USA) | NI LabVIEW 2015 SP1 (32 bit) | LabVIEW based program developed in our laboratory for controlling the stepper motor and acquring the PA singnals from the detector |
| Data processing software | Matlab (Mathworks, Natick, MA, USA) | Matlab R2015b | Matlab code developed in our laboratory for reconstructing cross-sectional PA images |
| Function generator | RIGOL | DG1022 | To change the repetition rate of the PLD. It will provide TTL signal to synchronize the DAQ with the laser excitation. |
| Low noise signal amplifier | Genetron | Custom-made using Mini-circuits, ZFL-500LN-BNC | To receive, and amplify the PA signal from SUTR. Its gain is 24 dB. |
| Optical diffuser | Thorlabs | DG-120 | Used to to make the laser beam homogeneous |
| Pulsed laser diode | Quantel, France | QD-Q1924-ILO-WATER | It is the excitation laser source with specifications of 816 nm wavelength, 3.4 mJ per pulse energy, 107 ns pulse width, 2 KHz maximum pulse repitition rate, dimensions : 13.0 x 7.6 x 5.0 cm |
| Rats | In Vivos Pte Ltd, Singapore | NTac:SD, Sprague Dawley / SD | Female, weight 100±10g, strain of rats: Sprague Dawley, age: 4-5 weeks |
| Stepper motor with gearbox | LIN Engineering (Servo Dynamics) | Motor: CO-5718L-01P-RO, Gearbox: DPL64/1; Power supply PW-100-24 | To move the detector holder in a circular geometry. Torque: 2.08 N-m, Rotor inertia: 2.6 kg-cm2 |
| Ultrasound gel | Progress/parker acquasonic gel | PA-GEL-CLEA-5000 | Clear ultrasound gel |
| Ultrasound Transducer | Olympus | V309-SU/ U8423013 | Ultrasonic sensors used for photoacoustic detection. Central freqency 5 MHz, 0.5 in |
| Variable high voltage power supply | Elektro-Automatik | EA-PS 8160-04 T | To change the laser output power |
参考文献
- Lin, L., et al. Single-breath-hold photoacoustic computed tomography of the breast. Nature Communications. 9 (1), 2352 (2018).
- Upputuri, P. K., Pramanik, M. Fast photoacoustic imaging systems using pulsed laser diodes: a review. Biomedical Engineering Letters. 8 (2), 167-181 (2018).
- Yao, J., Wang, L. V. Recent progress in photoacoustic molecular imaging. Current Opinion in Chemical Biology. 45, 104-112 (2018).
- Upputuri, P. K., Pramanik, M. Recent advances toward preclinical and clinical translation of photoacoustic tomography: a review. Journal of Biomedical Optics. 22 (4), 041006 (2017).
- Yao, J., Wang, L. V. Photoacoustic microscopy. Laser & Photonics Reviews. 7 (5), 758-778 (2013).
- Awasthi, N., Kalva, S. K., Pramanik, M., Yalavarthy, P. K. Image Guided Filtering for Improving Photoacoustic Tomographic Image Reconstruction. Journal of Biomedical Optics. 23 (9), 091413 (2018).
- Kalva, S. K., Pramanik, M. Experimental validation of tangential resolution improvement in photoacoustic tomography using a modified delay-and-sum reconstruction algorithm. Journal of Biomedical Optics. 21 (8), 086011 (2016).
- Pramanik, M. Improving tangential resolution with a modified delay-and-sum reconstruction algorithm in photoacoustic and thermoacoustic tomography. The Journal of the Optical Society of America. 31 (3), 621-627 (2014).
- Xu, M., Wang, L. V. Universal back-projection algorithm for photoacoustic computed tomography. Physical Review E. 71 (1), 016706 (2005).
- Wang, L. V., Hu, S. Photoacoustic Tomography: In Vivo Imaging from Organelles to Organs. Science. 335 (6075), 1458-1462 (2012).
- Sivasubramanian, K., Periyasamy, V., Pramanik, M. Non-invasive sentinel lymph node mapping and needle guidance using clinical handheld photoacoustic imaging system in small animal. Journal of Biophotonics. 11 (1), e201700061 (2018).
- Hu, S., Maslov, K., Wang, L. V. Second-generation optical-resolution photoacoustic microscopy with improved sensitivity and speed. Optics Letters. 36 (7), 1134-1136 (2011).
- Stein, E. W., Maslov, K., Wang, L. V. Noninvasive, in vivo imaging of blood-oxygenation dynamics within the mouse brain using photoacoustic microscopy. Journal of Biomedical Optics. 14 (2), 020502 (2009).
- Ku, G., Wang, X. D., Xie, X. Y., Stoica, G., Wang, L. V. Imaging of tumor angiogenesis in rat brains in vivo by photoacoustic tomography. Applied Optics. 44 (5), 770-775 (2005).
- Ma, R., Taruttis, A., Ntziachristos, V., Razansky, D. Multispectral optoacoustic tomography (MSOT) scanner for whole-body small animal imaging. Optics Express. 17 (24), 21414-21426 (2009).
- Zhou, Y., et al. A Phosphorus Phthalocyanine Formulation with Intense Absorbance at 1000 nm for Deep Optical Imaging. Theranostics. 6 (5), 688-697 (2016).
- Li, L., et al. Single-impulse panoramic photoacoustic computed tomography of small-animal whole-body dynamics at high spatiotemporal resolution. Nature Biomedical Engineering. 1 (1), 0071 (2017).
- Sivasubramanian, K., Pramanik, M. High frame rate photoacoustic imaging at 7000 frames per second using clinical ultrasound system. Biomedical Optics Express. 7 (2), 312-323 (2016).
- Upputuri, P. K., Pramanik, M. Dynamic in vivo imaging of small animal brain using pulsed laser diode-based photoacoustic tomography system. Journal of Biomedical Optics. 22 (9), 090501 (2017).
- Upputuri, P. K., Periyasamy, V., Kalva, S. K., Pramanik, M. A High-performance compact photoacoustic tomography system for in vivo small-animal brain imaging. Journal of Visualized Experiments. (124), e55811 (2017).
- Upputuri, P. K., Pramanik, M. Pulsed laser diode based optoacoustic imaging of biological tissues. Biomedical Physics & Engineering Express. 1 (4), 045010-045017 (2015).
- Arabul, M. U., et al. Toward the detection of intraplaque hemorrhage in carotid artery lesions using photoacoustic imaging. Journal of Biomedical Optics. 22 (4), (2016).
- Daoudi, K., et al. Handheld probe integrating laser diode and ultrasound transducer array for ultrasound/photoacoustic dual modality imaging. Optics Express. 22 (21), 26365-26374 (2014).
- Allen, J. S., Beard, P. Pulsed near-infrared laser diode excitation system for biomedical photoacoustic imaging. Optics Letters. 31 (23), 3462-3464 (2006).
- Upputuri, P. K., Pramanik, M. Performance characterization of low-cost, high-speed, portable pulsed laser diode photoacoustic tomography (PLD-PAT) system. Biomed Opt Express. 6 (10), 4118-4129 (2015).
- Kalva, S. K., Upputuri, P. K., Pramanik, M. High-speed, low-cost, pulsed-laser-diode-based second-generation desktop photoacoustic tomography system. Optics Lett. 44 (1), 81-84 (2019).
- Kalva, S. K., Hui, Z. Z., Pramanik, M. Calibrating reconstruction radius in a multi single-element ultrasound-transducer-based photoacoustic computed tomography system. J Opt Soc Am A. 35 (5), 764-771 (2018).
- Kalva, S. K., Pramanik, M. Use of acoustic reflector to make compact photoacoustic tomography system. Journal of Biomedical Optics. 22 (2), 026009 (2017).
- . American National Standard for Safe Use of Lasers. ANSI Standard Z136.1-2007. , (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved