Method Article
李斯特菌单细胞基因感染后小鼠脾脏原位干扰素伽马生产的成像
摘要
在这里,我们描述了一个简单的共聚焦成像方法,以可视化细胞在原位定位,在鼠次淋巴器官中分泌细胞因子干扰素伽马的细胞。该协议可以扩展用于不同组织中其他细胞因子的可视化。
摘要
细胞因子是由细胞分泌的小蛋白质,调解细胞-细胞通信,这对有效的免疫反应至关重要。细胞因子的一个特征是其胸腔,因为它们是由多种细胞类型产生的,并可以影响多种细胞类型。因此,重要的是要不仅了解哪些细胞正在产生细胞因子,而且了解它们在哪个环境中产生细胞因子,以便确定更具体的治疗方法。在这里,我们描述了一种在细菌感染后原位可视化细胞因子生产的方法。该技术依靠成像细胞因子生成细胞在其原生环境中通过共聚焦显微镜。为此,组织部分被染色,用于多种细胞类型的标记物以及细胞因子染色。关键,细胞因子分泌在收获感兴趣的组织之前直接在体内阻断,从而能够检测在产生细胞内积累的细胞因子。此方法的优点是多重的。首先,细胞因子的产生微环境得以保留,这最终可以通知细胞因子生产所需的信号以及受这些细胞因子影响的细胞细胞。此外,这种方法还指示细胞因子在体内产生的位置,因为它不依赖于人工体外再刺激的产生细胞。然而,在接收细胞因子的细胞内,不可能同时分析细胞因子下游信号。同样,观测到的细胞因子信号仅对应于细胞因子分泌被阻断的时间窗口。虽然我们描述了细胞内细菌李斯特菌单细胞基因感染小鼠后脾脏中细胞因子干扰素(IFN)伽马的可视化,但这种方法有可能适用于任何细胞因子的可视化。大多数器官。
引言
要协调对病原体的有效免疫反应,需要复杂地整合各种免疫细胞显示的信号,这些信号通常分散在生物体中。为了沟通,这些细胞产生具有多种生物功能的小可溶性蛋白质,这些生物功能充当名为细胞因子的免疫调节剂。细胞因子控制细胞的招募,激活和增殖,因此被认为是促进免疫反应1的关键角色。有效的免疫反应要求细胞因子以非常有条理的时空模式释放,连接特定细胞以诱导特定信号。因此,考虑到细胞因子的产生微观环境,研究细胞因子的产生及其原位信号至关重要。
李斯特菌单细胞基因(L. 单细胞基因) 是一种革兰氏阳性细胞内细菌,用作研究小鼠细胞内病原体的免疫反应的主要模型。一个细胞因子,IFN伽马(IFN+)在L.单细胞基因感染后24小时内迅速产生。这是必要的病原体清除,因为被敲出IFN®的小鼠极易受到L.单细胞基因感染2。IFN® 是多胞胎,由感染3后由多个细胞产生。虽然由天然杀伤剂(NK)细胞产生的IFN®是直接抗菌活性4所必需的,但来自其他来源的IFN®已被证明具有其他功能。事实上,我们和其他人最近发现,由CD8+T细胞产生的IFN®在直接调节T细胞分化5,6,7中具有特定功能。因此,了解哪些细胞产生IFN®(以及哪个微环境)对于解剖其功能至关重要。
研究细胞因子生产的最常见技术依赖于流式细胞测定分析的细胞内细胞因子染色。该方法允许在单个样品中同时检测多个细胞因子与细胞表面标记,为研究细胞因子生产提供了极其有用的工具。但是,使用上述技术意味着丢失任何空间信息。此外,细胞因子检测通常依赖于体外再刺激,以实现细胞因子检测。因此,对给定细胞产生细胞因子的能力进行了分析,它不一定与实际细胞因子原位分泌相关。其他方法使用荧光蛋白表达与细胞因子转录相关的报告小鼠,并允许在单细胞级8上进行可视化。虽然这种方法可以原位跟踪细胞因子转录,但可用的细胞因子-报告小鼠数量有限。此外,转录、翻译和分泌有时可以不相通,荧光蛋白的半寿命不同于他们报告的细胞因子,使得这种方法有时不足以进行原位细胞因子的可视化。
在这里,我们描述了一种在单细胞分辨率下通过共聚焦显微镜来可视化原位细胞因子生产的方法。这种技术能够可视化细胞源和组织内的周围利基。该协议特别描述了在L.单细胞基因感染小鼠的脾脏中IFN®生产的可视化,这里的重点是NK细胞和抗原特异性CD8+T细胞的IFN®生产。然而,它可以扩展和适应任何细胞因子生产在产生细胞因子的其他情况下,如感染,炎症或自身免疫性疾病,只要靶向细胞因子可以保留在细胞中细胞内蛋白运输抑制剂。
研究方案
所有涉及小鼠的实验都符合1986年《英国科学程序法》。
1. 小鼠中抗原特异性CD8+T细胞的采用转移
- 从T细胞受体转基因小鼠的淋巴结悬浮液中分离出表达绿色荧光蛋白(OTI-GFP)或红色荧光蛋白(OTI-RFP)的蛋白(OVA)特异性CD8+T细胞(OTI)9,10CD8= T 细胞隔离套件,符合制造说明。准备细胞悬浮液,使用注射器柱塞粉碎淋巴结,如前所述11。
- 通过静脉注射将OTI-GFP或OTI-RFP细胞(3 x 106细胞)转移到C57BL/6野生型小鼠受体中,如Cahalan等人所述。使用通常6~12周年龄的小鼠。
注:此步骤是可选的,仅可用于跟踪抗原特异性 CD8和T 细胞。
2.李斯特菌单细胞基因感染
- 扩大L.单细胞基因转基因,以表达OVA (LM-OVA)13在轻柔搅拌下在37°C下在肉汤心脏输注的指数级生长阶段,直到OD600达到0.08–0.1,如前面在参考中所述14.
- 将100μL(最大体积= 200μL)0.1±0.5 LD50 LM-OVA稀释在磷酸盐缓冲盐水(PBS)中,使用29G胰岛素注射器静脉注射,注射到C57BL/6野生型小鼠受体中,如指示,携带OTI-GFP或OTI-RFP细胞。
注:在我们手中,0.1 x LD50 LM-OVA 对应于 2 x 104菌落形成单元 (CFU)。L. 单细胞基因经过基因改造以表达OVA,用于激活先前转移的OTI CD8+ T细胞,但可以使用其他单细胞基因菌株。
3. 布雷费尔丁A(BFA)治疗以阻止细胞因子分泌
- 在使用29G胰岛素注射器在小鼠牺牲前6小时在200μL的PBS中注射250μg的BFA。
注:冻干BFA首先在二甲基亚硫酸盐(DMSO)中重新悬浮,以制备25mg/mL浓度的库存。然后在室温 (RT) 下在 PBS 中稀释 BFA,以避免注射前结晶。细胞因子分泌的抑制诱导细胞中IFN®的积累。这对细胞因子检测至关重要。
4. 收获脾脏
- 使用CO2浓度升高,然后宫颈脱位,使小鼠安乐死。
注:遵循当地机构对小鼠进行人道安乐死的指导方针。 - 用70%乙醇清洁腹部,用剪刀切开,使1⁄2厘米的切口穿过小鼠左侧的皮肤,而脾脏位于那里。小心地在围肠切开,露出脾脏,用钳子把它拿出来。收获脾脏,小心不要用钳子挤压或切开它,以避免破坏脾脏结构。
5. 用甲醛(PFA)固定脾脏
- 通过混合 3.75 mL 的 PBS 和 3.75 mL 的 0.2 M L-莱辛来制备固定溶液。加入21毫克m-牙周酸钠,搅拌均匀。然后加入2.5 mL 4%PFA和20 μL的12 N NaOH。
注:在同一天使用固定溶液并丢弃多余的溶液。不要存储它。如果样品含有荧光蛋白(如GFP),则此固定步骤非常重要。不要使用含有甲醇痕迹的PFA,因为它使荧光蛋白变性。
警告:PFA 是有毒的,必须谨慎处理。 - 将脾脏浸入固定器中,在温和的搅拌下,通常在 4°C 下固定至少 4 小时,通常为 16-20 小时。
- 在轻柔的搅拌下,放弃固定溶液,在RT处加入5 mL的PBS5分钟。
- 在温和的搅拌下,在4°C下,用5 mL的新鲜PBS孵育1小时。
- 用 5 mL 30% 蔗糖替换 PBS,孵育 12-24 小时。
注:这种方法有助于维持组织形态。使用蔗糖溶液孵育后,器官应沉入井底。
6. 冷冻和分割
- 将干冰放入一个大容器中,将一个较小的贮器放入内,内装约 50 mL 的纯甲醇和几块干冰。
- 用无绒擦拭轻轻擦干脾脏。
- 将脾脏放在底部含有一滴最佳切削温度 (OCT) 化合物的基础模具内。小心不要产生任何气泡。在脾脏上添加OCT。
- 用钳子将基础模具沉积在甲醇表面,确保它不会接触OCT。尽快冻结组织,以尽量减少伪影。
- 冻结后,继续切片。
注:冷冻脾脏可保持在-80°C下几个月。 -
使用低温微生物将组织分割。
- 将冷冻室温度设置为-21°C。切割所需厚度的部分(通常约为 10 μm)。此协议适用于厚度高达 30 μm 的厚度。
- 收集部分到玻璃显微镜幻灯片上(见材料表),并目视检查。
注:部分可保持在-80°C几个月。
7. 免疫荧光染色
- 允许该节到 RT。
- 在组织部分周围用液体阻滞剂(例如,PAP 笔)画一个圆圈。在 OCT 外部绘制,否则不会粘住。
- 干燥后,在组织部分放置PBS 5分钟,重新补充样品。
注:放置该节的音量取决于节的大小。我们通常使用 100~300 μL。一旦补充水分,不要让这些部分变干。 - 用 PBS 冲洗至少两次,以确保该部分与幻灯片良好粘附。
-
向该部分添加阻断溶液,以减少抗体的非特异性结合。
- 准备阻滞溶液如下:PBS与0.1%Triton X100,2%胎儿小牛血清(FCS),2.5μg/mL Fc受体阻滞剂(抗小鼠CD16/32)。然后加入染色面板各二级抗体的2~5%正常血清。
注:如果抗体直接结合/生物异化,添加每种原抗体的物种的5%正常血清。如果原抗体和二级抗体之一来自同一物种(例如,在兔子和次生兔抗鼠中培养的原抗体),则不要使用正常的血清种类,因为它会增加背景信号。 - 通过吸气轻轻从截面上取下PBS,并每个样品部分添加100μL的阻滞溶液。在RT的有盖湿室中孵育至少1小时。
- 准备阻滞溶液如下:PBS与0.1%Triton X100,2%胎儿小牛血清(FCS),2.5μg/mL Fc受体阻滞剂(抗小鼠CD16/32)。然后加入染色面板各二级抗体的2~5%正常血清。
-
与原抗体染色。
- 以阻滞溶液中的最佳浓度稀释原抗体。一般起始点抗体浓度为5μg/mL,但应针对每种抗体和组织进行优化。
注:如果抗体直接结合,在使用前在4°C下以17.135 x g(13.500 rpm)将抗体混合物离心15分钟。 荧光草可以沉淀。此步骤将颗粒沉淀物,从而防止沉淀抗体在幻灯片上非特异性沉积。 - 用每个样品的主要抗体混合物替换阻断溶液。
- 在RT下孵育4小时,或在4°C下在有盖的湿室中孵育4小时。
- 以阻滞溶液中的最佳浓度稀释原抗体。一般起始点抗体浓度为5μg/mL,但应针对每种抗体和组织进行优化。
-
执行洗涤。
- 通过将 2% FCS 添加到 PBS 来准备洗涤缓冲液。
- 用洗涤缓冲液洗涤4次:一次快速(无孵化),一次10分钟,2次5分钟。然后用PBS进行最后洗涤5分钟。
-
用二级抗体染色。
- 以阻隔溶液中的最佳浓度稀释感兴趣的二级抗体。离心机混合物,如描述的主要抗体。
- 取出最终洗涤液。在部分顶部加入二级抗体混合物,在带顶的湿室中在RT孵育1⁄4小时。
- 用洗涤缓冲液洗涤4次:一次快速(无孵化),一次10分钟,2次5分钟。然后用PBS进行最后洗涤5分钟。
- 取出最终洗涤液。允许 PBS 蒸发,但不要过度干燥部分。将安装介质的一滴放在样品顶部,并小心地将盖玻璃放在其顶部。安装介质必须恢复整个部分。让它在RT时聚合OVN免受光的照射。
注:在应用安装介质之前,在幻灯片背面的截面周围画一个圆圈。一旦应用安装介质,组织可能变得难以看到。 - 将幻灯片存放在 4°C 的黑暗中,直到准备好图像。
8. 成像和分析
- 使用共聚焦显微镜对染色进行成像。
注:在此协议中,使用倒置光谱激光扫描显微镜(参见材料表),以及目标10x/NA 0.40或60x/NA 1.4(用于分析细胞因子亚细胞定位)。在材料表中,每个荧光和荧光蛋白的激发和发射波长显示出来。 - 使用图像处理软件(例如,Imaris 或斐济)根据需要执行分析和量化。
结果
在李斯特菌单细胞基因感染后的第一个24小时内产生的IFN®对于控制这种病原体的传播至关重要。使用该协议,我们不仅可以可视化哪些细胞正在产生IFN®,还可以想象它们是否位于特定的微环境中。为了帮助我们划定脾脏的结构,我们标记了已知在脾脏内有特定位置的细胞。标记 F4/80 标记所有巨噬细胞并突出显示红色纸浆。标记 B220 标记 B 细胞并突出显示 T 细胞区域周围的 B 细胞毛囊。标记 CD169 标记边缘区域巨噬细胞,围绕白色纸浆 (图 1)。大多数OTI细胞,无论它们表达IFN®与否,都存在于白浆中,因此,所有图像都是白浆的,除非注明。
该协议的一个关键步骤是使用BFA抑制细胞因子分泌。事实上,当小鼠未接受BFA治疗时,NK细胞对IFN®的检测受到很大损害(图2)。使用我们的协议,我们可以发现,至少有两种细胞类型在感染后产生IFN®24小时[NK细胞和抗原特异性CD8+T细胞(图3)——与流式细胞测定3之前发现的类似。
IFN® 生产细胞的原位成像表明,IFN® 生产不是扩散到整个脾脏,而是集中在隐蔽区域(图4)。事实上,我们发现T细胞在整个脾脏被激活(T细胞聚类突出显示),这不一定与IFN®生产相关。一个可能的解释是,IFN® 的生产仅限于受感染细胞15、16和 T 细胞激活的位置(由聚类表示)可以由受感染(IFN® 阳性)和未感染 (IFN® ) 提供支持阴性)抗原呈现细胞。需要其他污渍来精确定位,并指示限制IFN® 生产到此区域的机制及其与抗原转移的关系。有趣的是,我们发现活性、聚类、抗原特异性T细胞位于脾脏的白浆中,但它们只在NK细胞与它们共存的区域产生IFN®(图5)。因此,NK细胞的存在划定了白浆中特定的微环境,其中聚集的T细胞产生IFN®,而不是白浆另一部分的聚集T细胞。这表明T细胞激活不足以决定IFN®此时的生产。
我们的协议强调的另一个有趣的功能是,在NK与CD8+T细胞5中,IFN®的子细胞定位不同。如图6所示,当NK细胞中的IFN®定位在细胞中扩散时,CD8+ T细胞通常向另一个T细胞招募IFN+。

图1:突出显示脾结构的标记。小鼠感染2 x 104 CFU LM-OVA,感染后24小时安乐死。脾脏被除种和处理,如议定书所述。(A) NK细胞(抗NCR1后跟抗山羊IgG-FITC;绿色)、OTI-RFP细胞(红色)和巨噬细胞(抗F4/80-APC;品红色)的节被染色。RP = 红浆;WP = 白浆。比例条 = 200 μm . (B) 部分被染色为 B 细胞 (抗 B220-太平洋蓝色;蓝色)、OTI-GFP细胞(以红色显示的GFP信号)和边缘区域巨噬细胞(抗CD169-Alexa647;品红色)。RP = 红浆;BF = B 细胞卵泡;TZ = T 单元区。刻度条 = 50 μm。这是 3 个独立实验 (N = 4) 的代表性图像。请点击此处查看此图的较大版本。
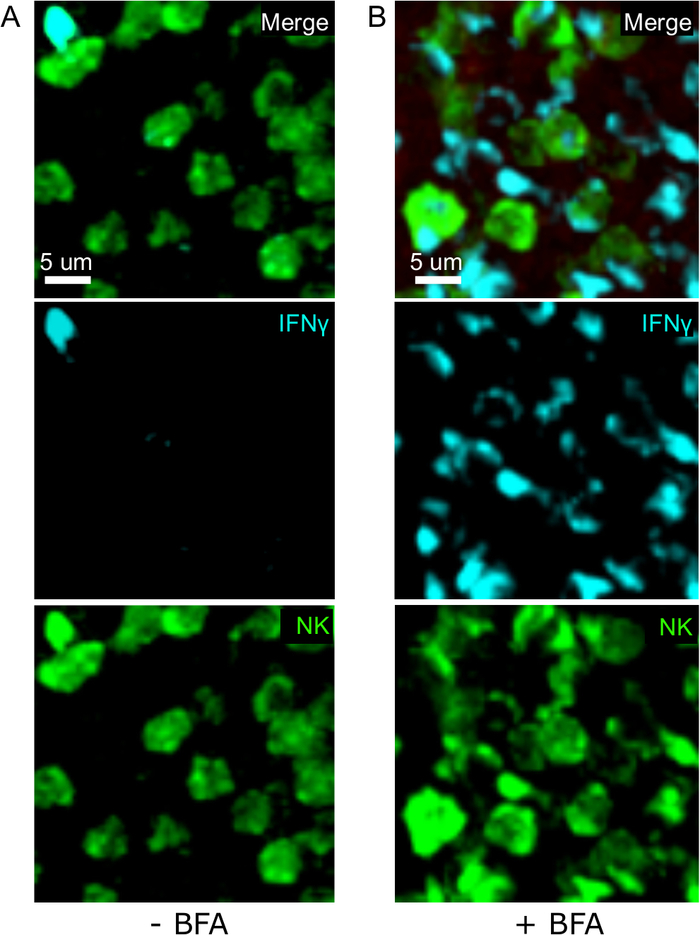
图2:BFA治疗允许在原位检测细胞内IFN®。N+ 生产仅限于在 ses 小鼠的特定区域感染 2 x 104 CFU LM-OVA,并在 18 小时后使用 BFA (A) 或未治疗 (B) 进行治疗。脾脏被除种和处理,如议定书所述。NK细胞(抗NCR1后跟抗山羊IgG-FITC;绿色)、OTI-RFP细胞(红色)和IFN®(抗IFN®-BV421;青色)的分段被染色。刻度条 = 5 μm。这是来自3个独立实验(N = 3)的NK细胞富集区的代表性图像。请点击此处查看此图的较大版本。
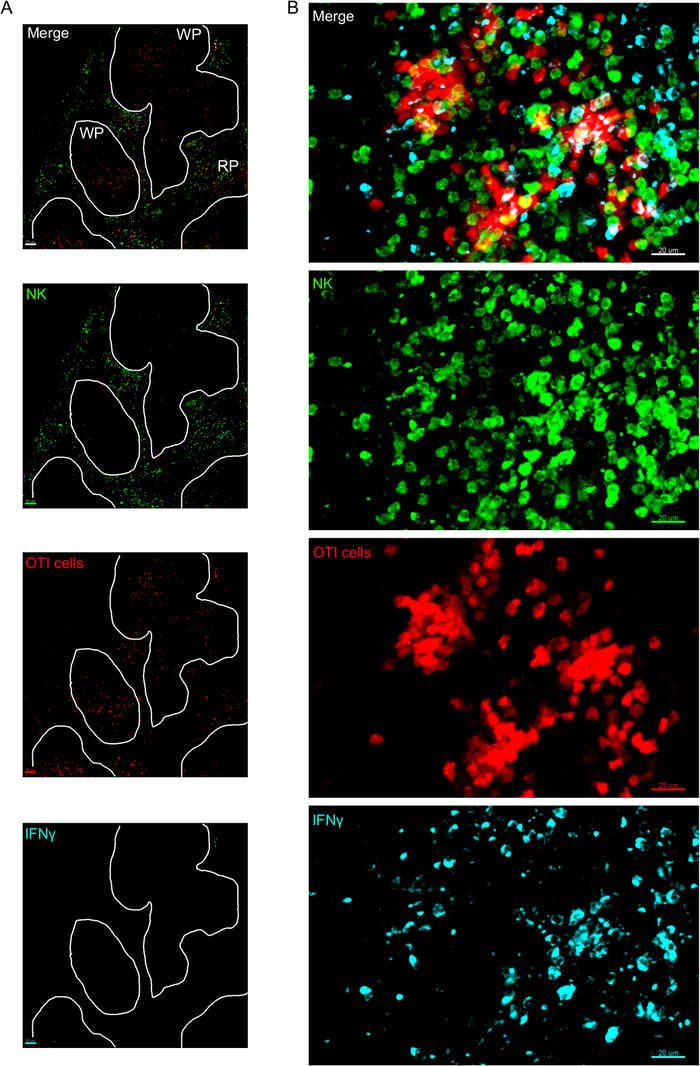
图3:IFN®在脾脏中产生细胞。小鼠在18小时后被感染2 x 104 CFU LM-OVA,在18小时后用BFA治疗,小鼠在感染后24小时被安乐死。脾脏被除种和处理,如议定书所述。NK细胞(抗NCR1后跟抗山羊IgG-FITC;绿色)、OTI-RFP细胞(红色)和IFN®(抗IFN®-BV421;青色)的分段被染色。(A) 来自未受感染的幼鼠的脾脏的代表性图像,以表明没有 IFN® 非特异性染色。白线划定了白浆。WP = 白浆;RP = 红浆。(B) 受LM-OVA感染的小鼠脾脏的白浆代表图像,显示NK细胞对白浆的入侵和NK细胞、OTI细胞和非标记细胞对IFN®的产生。图像代表4个独立实验(N = 4)。刻度条 = 70 μm (A);和 20 μm (B)。请点击此处查看此图的较大版本。
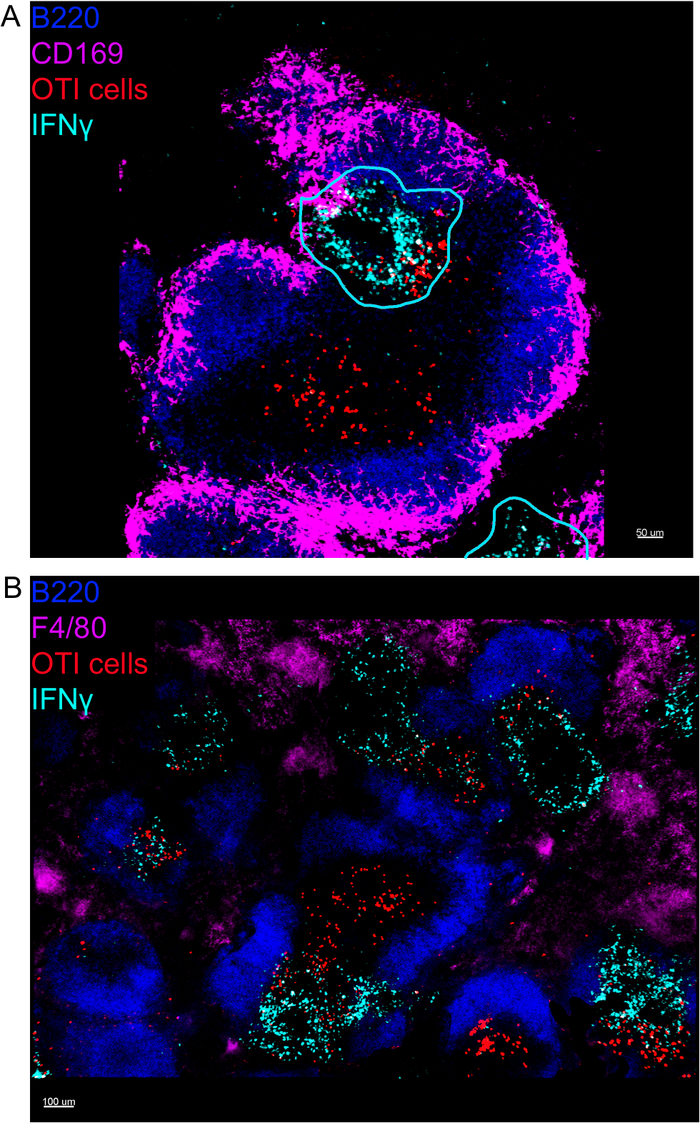
图4:在LM-OVA感染后,IFN® 生产仅限于脾脏的特定区域。小鼠感染2 x 104 CFU LM-OVA,18小时后用BFA治疗,小鼠在感染后24小时被安乐死。脾脏被除种和处理,如议定书所述。所有部分都染色为B细胞(B220-太平洋蓝Ab,蓝色)和IFN®(抗IFN®生物锡,其次是链球菌-PE;青色)。OTI-GFP细胞(GFP信号以红色显示)。青色线对应于 IFN® 高生产区域。这些是4个独立实验(N = 4)的代表性图像。(A) 部分被染色为边缘区域巨噬细胞 (抗 CD169-Alexa 647, 品红色)。比例条 = 50 μm. (B) 部分对所有巨噬细胞 (F4/80) 进行了染色。比例尺 = 100 μm。请点击此处查看此图的较大版本。
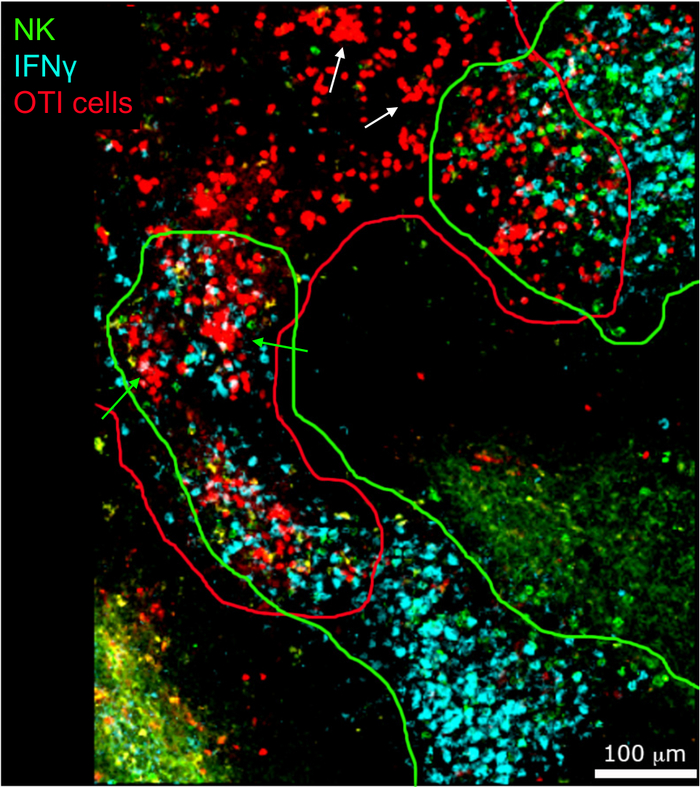
图5:由激活的OTI细胞生产的IFN®发生在特定的微环境中。小鼠感染2 x 104 CFU LM-OVA,18小时后用BFA治疗,小鼠在感染后24小时被安乐死。脾脏被除草和处理,如议定书所述。NK细胞(抗NCR1后跟抗山羊IgG-FITC;绿色)、OTI-RFP细胞(红色)和IFN®(抗IFN®-BV421;青色)的分段被染色。绿色和红线分别突出显示 NK 和 OTI 单元格区域。白色箭头表示 T 细胞簇未生成 IFN® 的示例。生成 IFN® 的 T 细胞簇的绿色箭头示例。刻度条 = 100 μm。这是四个独立实验(N = 4)的代表性图像。请点击此处查看此图的较大版本。
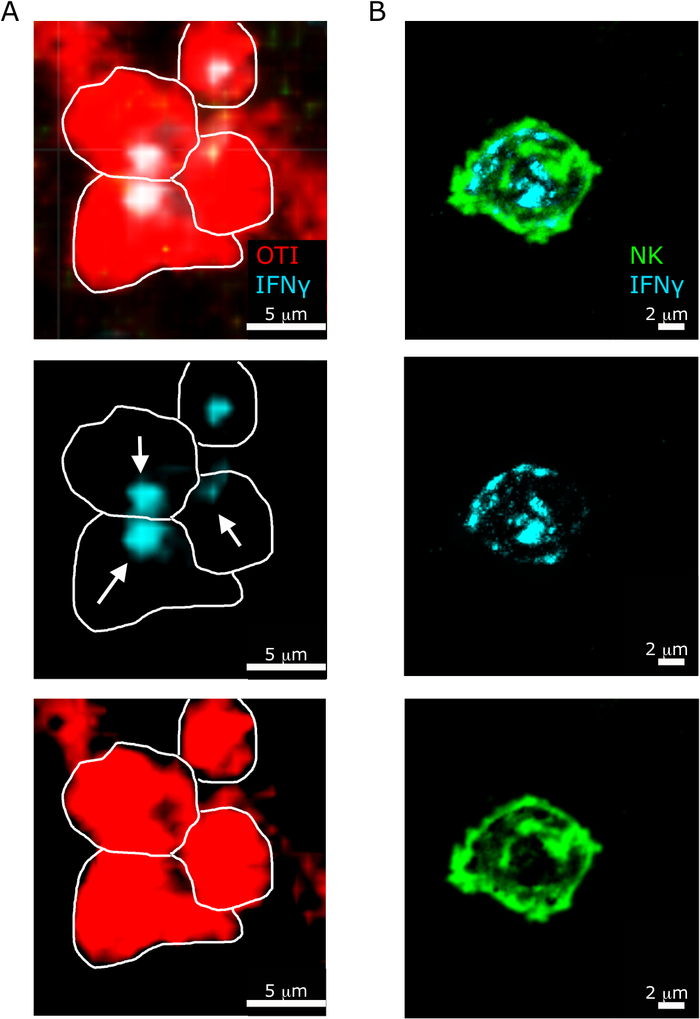
图6:NK细胞和T细胞中IFN®的亚细胞定位。小鼠感染2 x 104 CFU LM-OVA,18小时后用BFA治疗,小鼠在感染后24小时被安乐死。脾脏被除种和处理,如议定书所述。所有部分都染上了IFN®(反IFN®-BV421;青色)。白线划定单元格边缘,白色箭头显示分泌的方向性。这是两个独立实验(N = 5)的代表性图像。(A) - OTI-RFP 细胞以红色显示。刻度条 = 5 μm. (B) 部分被染色为 NK 细胞 (抗 NCR1 后反山羊 IgG-FITC; 绿色.比例尺 = 2 μm.请点击此处查看此图的较大版本。
讨论
在这份手稿中,我们提出了一种在小鼠感染L.单细胞基因后,在脾脏中可视化IFN®生产的方法。该协议很简单,可以适应其他组织和细胞因子触发器,但必须考虑以下几个方面。细胞通常能迅速分泌出它们产生的细胞因子,而细胞因子则被邻近细胞迅速拾起。就地检测细胞因子是太难了。快速启动细胞因子生产的常用方法是通过酶链接免疫吸附剂测定,在培养基中重新刺激细胞体外体内的细胞因子检测。在此背景下,有关细胞因子生成细胞的空间定位的任何信息都丢失。此外,再刺激后的细胞因子生产不一定反映细胞因子是否真正在体内产生和分泌,而是指示特定细胞群产生细胞因子的能力。因此,这两种方法将提供不同的信息,并应考虑哪些信息对于他们的实验最有价值。
为了检测细胞内细胞因子,我们的方法使用细胞内蛋白传输抑制剂在细胞内捕获细胞因子,并增加信号检测。然而,需要注意的是,这些抑制剂影响蛋白质从内皮视网膜 (RE) 到 Golgi 仪器的正常运输,以及影响其释放的分泌囊泡的正常运输,这可能导致毒性。因此,BFA或其他抑制剂应使用短时间,通常不超过几个小时。因此,在抑制剂剂量和治疗时间之间找到适当的平衡非常重要,以便优化细胞内滞留的细胞因子水平,而不会造成严重的细胞毒性影响。这些变量在细胞因子和BFA的给给途径之间可能有所不同。在我们的感染模型中,BFA被管理内腹,以提供快速的系统分散,但它也可以通过静脉注射。
最常用的细胞内蛋白传输抑制剂是BFA,这里使用,和单宁(MN)。这些抑制剂经常用模糊的方式积累和研究细胞因子的产生,但它们在作用机制上略有不同。MN抑制Golgi仪器内蛋白质的运输,从而在Golgi17中积累蛋白质,而BFA则防止凝血蛋白复合体-I招募,抑制蛋白质逆行运动到内质神经质(ER)从而促进ER18中细胞因子的积累。因此,选择最佳的细胞内蛋白运输抑制剂将取决于不同的因素,如要检测的细胞因子。例如,在单核细胞的脂多糖诱导细胞内染色中,BFA比MN19更有效地测量细胞因子IL-1+、IL-6和TNF。
该协议涉及通过共聚焦显微镜对原位细胞因子进行可视化,因此只有数量有限的标记,可用于研究细胞因子生成细胞及其微环境。还有必要考虑蛋白质运输抑制剂,如BFA或MN干扰几种蛋白质的正常表达,因此,在研究某些活化细胞表面标记物同时表达时,必须接近其使用仔细。例如,BFA但不是MN会阻止CD69在鼠淋巴细胞20中的表达。尽管存在这种限制,共聚焦成像支持细胞因子的亚细胞定位,以及细胞内细胞因子分泌的方向。使用该协议生成的数据表明,NK细胞倾向于以漫反射模式分泌IFN-y,而CD8+ T细胞似乎将IFN+分泌定向到与它们直接相互作用的其他CD8+T细胞5。
总之,该协议适用于原位可视化各种细胞因子,并识别产生细胞及其微环境后,许多触发因素,如感染或自身免疫。获得的信息有助于了解不同细胞类型的体内空间协调的重要性及其产生的细胞因子,这是有效免疫反应所必需的。
披露声明
作者没有什么可透露的。
致谢
我们感谢肯尼迪研究所成像设施人员在成像方面提供技术支持。这项工作得到了肯尼迪信托基金(向A.G.)和生物技术和生物科学研究委员会(BB/R015651/1至A.G.)的赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| Brefeldin A | Cambridge bioscience | CAY11861 | |
| Paraformaldehyde | Agar scientific | R1018 | |
| L-Lysin dihydrochloride | Sigma lifescience | L5751 | |
| Sodium meta-periodate | Thermo Scientific | 20504 | |
| D(+)-saccharose | VWR Chemicals | 27480.294 | |
| Precision wipes paper Kimtech science | Kimberly-Clark Professional | 75512 | |
| O.C.T. compound, mounting medium for cryotomy | VWR Chemicals | 361603E | |
| Fc block, purified anti-mouse CD16/32, clone 93 | Biolegend | 101302 | Antibody clone and Concentration used: 2.5 mg/ml |
| Microscope slides - Superfrost Plus | VWR Chemicals | 631-0108 | |
| anti-CD169 - AF647 | Biolegend | 142407 | Antibody clone and Concentration used: clone 3D6.112 1.6 mg/ml Excitation wavelength: 650 Emission wavelength: 65 |
| anti-F4/80 - APC | Biolegend | 123115 | Antibody clone and Concentration used: clone BM8 2.5 mg/ml Excitation wavelength: 650 Emission wavelength: 660 |
| anti-B220 - PB | Biolegend | 103230 | Antibody clone and Concentration used: clone RA3-6B2 1.6 mg/mL Excitation wavelength: 410 Emission wavelength: 455 |
| anti-IFNg - biotin | Biolegend | 505804 | Antibody clone and Concentration used: clone XMG1.2 5 mg/mL |
| anti-IFNg - BV421 | Biolegend | 505829 | Antibody clone and Concentration used: clone XMG1.2 5 mg/mL Excitation wavelength: 405 Emission wavelength: 436 |
| anti-Nkp46/NCRI | R&D Systems | AF2225 | Antibody clone and Concentration used: goat 2.5 mg/mL |
| anti-goat IgG-FITC | Novusbio | NPp 1-74814 | Antibody clone and Concentration used: 1 mg/mL Excitation wavelength: 490 Emission wavelength: 525 |
| Streptavidin - PE | Biolegend | 405203 | Antibody clone and Concentration used: 2.5 mg/mL Excitation wavelength: 565 Emission wavelength: 578 |
| Streptavidin - FITC | Biolegend | 405201 | Antibody clone and Concentration used: 2.5 mg/mlL Excitation wavelength: 490 Emission wavelength: 525 |
| Fluoromount G | SouthernBiotech | 0100-01 | |
| Cover glasses 22 mm x 40 mm | Menzel-Glazer | 12352128 | |
| Liquid blocker super PAP PEN mini | Axxora | CAC-DAI-PAP-S-M | |
| Imaris - Microscopy Image Analysis Software | Bitplane | ||
| Confocal microscope - Olympus FV1200 Laser scanning microscope | Olympus | ||
| Cryostat - CM 1900 UV | Leica | ||
| Base mould disposable | Fisher Scientific UK Ltd | 11670990 | |
| PBS 1x | Life Technologies Ltd | 20012068 | |
| BHI Broth | VWR Brand | 303415ZA | |
| GFP | Excitation wavelength: 484 Emission wavelength: 507 | ||
| RFP | Excitation wavelength: 558 Emission wavelength: 583 | ||
| Insulin syringe, with needle, 29 G | VWR International | BDAM324824 | |
| C57BL/6 wild type mice | Charles River |
参考文献
- Iwasaki, A., Medzhitov, R. Control of adaptive immunity by the innate immune system. Nature Immunology. 16 (4), 343-353 (2015).
- Harty, J. T., Bevan, M. J. Specific immunity to Listeria monocytogenes in the absence of IFN gamma. Immunity. 3 (1), 109-117 (1995).
- Kubota, K., Kadoya, Y. Innate IFN-gamma-producing cells in the spleen of mice early after Listeria monocytogenes infection: importance of microenvironment of the cells involved in the production of innate IFN-gamma. Frontiers in Immunology. 2 (26), (2011).
- Dunn, P. L., North, R. J. Early gamma interferon production by natural killer cells is important in defense against murine listeriosis. Infection and Immunity. 59 (9), 2892-2900 (1991).
- Krummel, M. F., et al. Paracrine costimulation of IFN-gamma signaling by integrins modulates CD8+ T cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 115 (45), 11585-11590 (2018).
- Curtsinger, J. M., Agarwal, P., Lins, D. C., Mescher, M. F. Autocrine IFN-gamma promotes naive CD8+ T cell differentiation and synergizes with IFN-alpha to stimulate strong function. Journal of Immunology. 189 (2), 659-668 (2012).
- Hosking, M. P., Flynn, C. T., Whitton, J. L. Antigen-specific naive CD8++ T cells produce a single pulse of IFN-gamma in vivo within hours of infection, but without antiviral effect. Journal of Immunology. 193 (4), 1873-1885 (2014).
- Croxford, A. L., Buch, T. Cytokine reporter mice in immunological research: perspectives and lessons learned. Immunology. 132 (1), 1-8 (2011).
- Gerard, A., et al. Secondary T cell-T cell synaptic interactions drive the differentiation of protective CD8++ T cells. Nature Immunology. 14 (4), 356-363 (2013).
- Engelhardt, J. J., et al. Marginating dendritic cells of the tumor microenvironment cross-present tumor antigens and stably engage tumor-specific T cells. Cancer Cell. 21 (3), 402-417 (2012).
- Matheu, M. P., Cahalan, M. D. Isolation of CD4+ T cells from mouse lymph nodes using Miltenyi MACS purification. Journal of Visualized Experiments. (9), 409 (2007).
- Matheu, M. P., Parker, I., Cahalan, M. D. Dissection and 2-photon imaging of peripheral lymph nodes in mice. Journal of Visualized Experiments. (7), 265 (2007).
- Pope, C., et al. Organ-specific regulation of the CD8+ T cell response to Listeria monocytogenes infection. Journal of Immunology. 166 (5), 3402-3409 (2001).
- Jones, G. S., D'Orazio, S. E. Listeria monocytogenes: cultivation and laboratory maintenance. Current Protocols in Microbiology. 31, 1-7 (2013).
- Kang, S. J., Liang, H. E., Reizis, B., Locksley, R. M. Regulation of hierarchical clustering and activation of innate immune cells by dendritic cells. Immunity. 29 (5), 819-833 (2008).
- Chang, S. R., et al. Characterization of early gamma interferon (IFN-gamma) expression during murine listeriosis: identification of NK1.1+ CD11c+ cells as the primary IFN-gamma-expressing cells. Infection and Immunity. 75 (3), 1167-1176 (2007).
- Mollenhauer, H. H., Morre, D. J., Rowe, L. D. Alteration of intracellular traffic by monensin; mechanism, specificity and relationship to toxicity. Biochimica et Biophysica Acta. 1031 (2), 225-246 (1990).
- Helms, J. B., Rothman, J. E. Inhibition by brefeldin A of a Golgi membrane enzyme that catalyses exchange of guanine nucleotide bound to ARF. Nature. 360 (6402), 352-354 (1992).
- Schuerwegh, A. J., Stevens, W. J., Bridts, C. H., De Clerck, L. S. Evaluation of monensin and brefeldin A for flow cytometric determination of interleukin-1 beta, interleukin-6, and tumor necrosis factor-alpha in monocytes. Cytometry. 46 (3), 172-176 (2001).
- Nylander, S., Kalies, I. Brefeldin A, but not monensin, completely blocks CD69 expression on mouse lymphocytes: efficacy of inhibitors of protein secretion in protocols for intracellular cytokine staining by flow cytometry. Journal of Immunology Methods. 224 (1-2), 69-76 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。