Method Article
Изображение In Situ Интерферон Гамма Производство в мышь селезенки после Listeria monocytogenes инфекции
В этой статье
Резюме
Здесь мы описываем простой метод конфокальной визуализации для визуализации локализации клеток на месте, выделяющих гамму цитокинов интерферона в вторичных лимфоидных органах мурина. Этот протокол может быть расширен для визуализации других цитокинов в различных тканях.
Аннотация
Цитокины являются небольшие белки, выделяемые клетками, посреднические клеточные связи, которые имеют решающее значение для эффективной иммунной реакции. Одной из характерных особенностей цитокинов является их плейотропизм, так как они производятся и могут повлиять на множество типов клеток. Таким образом, важно понимать не только, какие клетки производят цитокины, но и в какой среде они делают это, с тем чтобы определить более конкретные терапии. Здесь мы описываем метод визуализации производства цитокинов на месте после бактериальной инфекции. Этот метод опирается на визуализацию цитокинов производства клеток в их родной среде конфокальной микроскопии. Для этого, ткани разделы окрашены для маркеров нескольких типов клеток вместе с цитокиновым пятном. Ключ к этому методу, секреция цитокинов блокируется непосредственно in vivo перед сбором ткани интерес, что позволяет обнаружить цитокинов, которые накапливаются внутри производящих клеток. Преимущества этого метода многочисленны. Во-первых, сохраняется микросреда, в которой производятся цитокины, что в конечном итоге может сообщить о сигналах, необходимых для производства цитокинов, и клетках, пораженных этими цитокинов. Кроме того, этот метод дает указание на расположение производства цитокинов in vivo, так как он не полагается на искусственную инпротр-стимуляцию клеток. Однако, это не возможно одновременно анализировать цитокинов вниз по течению сигнализации в клетках, которые получают цитокинов. Аналогичным образом, наблюдаемые сигналы цитокинов соответствуют только временному окну, в течение которого секреция цитокинов была заблокирована. В то время как мы описываем визуализацию цитокинов Интерферон (IFN) гамма в селезенке после мышиной инфекции внутриклеточных бактерий Listeria monocytogenes, этот метод потенциально может быть адаптирован к визуализации любого цитокина в большинства органов.
Введение
Оркестровка эффективного иммунного ответа против патогена требует сложной интеграции сигналов, отображаемых различными иммунными клетками, которые часто рассеиваются между организмом. Для того, чтобы общаться, эти клетки производят небольшие растворимые белки с несколькими биологическими функциями, которые действуют как иммуномодуляторы имени цитокинов. Cytokines контроля набора клеток, активации и распространения и, следовательно, как известно, ключевые игроки в продвижении иммунных ответов1. Эффективные иммунные реакции требуют, чтобы цитокины выпускались в очень организованном пространственно-временном узоре, соединяющем конкретные клетки для индуцирования конкретных сигналов. Поэтому крайне важно изучить производство цитокинов и его сигнализацию на месте, принимая во внимание микросреду, в которой производятся цитокины.
Листерии моноцитогены (L. monocytogenes) является грамположительных внутриклеточных бактерий, используемых в качестве основной модели для изучения иммунных реакций на внутриклеточные патогены у мышей. Один цитокин, IFN гамма (ИФНЗ) производится быстро, в течение 24 ч после инфекции L. monocytogenes. Это необходимо для очистки патогена, так как мыши, выбитые дляИФНЗ, очень восприимчивы к инфекции L. monocytogenes 2. ИФНЗ является плейотропным и вырабатывается несколькими клетками после инфекции3. В то время как иФНЗ, производимые естественнымиклетками-убийцами (НК), необходимы для прямой антибактериальной активности 4, было показано, что ИФНЗ из других источников имеет другие функции. В самом деле, мы и другие недавно обнаружили, что IFN, производимые CD8 "Т-клетки имеет определенную функцию в непосредственном регулировании Дифференциации Т-клеток5,6,7. Таким образом, понимание того, какие клетки производят ИФНЗ (и в какой микросреде) имеет решающее значение для вскрытия его функции.
Наиболее распространенный метод для изучения производства цитокинов опирается на внутриклеточные цитокины окрашивания проанализированы поток цитометрии. Этот метод позволяет одновременное обнаружение нескольких цитокинов в сочетании с маркерами поверхности клеток в одном образце, обеспечивая чрезвычайно полезный инструмент для изучения производства цитокинов. Однако использование вышеупомянутой методики подразумевает потерю любой пространственной информации. Кроме того, обнаружение цитокинов часто опирается на повторную стимуляцию in vitro, чтобы обеспечить обнаружение цитокинов. Таким образом, способность данной клетки производить цитокин анализируется, и это не обязательно коррелирует с фактической секреции цитокинов на месте. Другие методы используют репортер мышей, для которых флуоресцентное выражение белка коррелирует с цитокинов транскрипции и позволяет визуализации на одноклеточном уровне8. Хотя этот метод может отслеживать транскрипцию цитокинов на месте, Есть ограниченное число цитокинов-репортер мышей доступны. Кроме того, транскрипция, перевод и секреция иногда могут быть несвязанными, и флуоресцентные белки имеют другой период полураспада, чем цитокинони они сообщают, что делает этот метод иногда не достаточно для визуализации цитокинов на месте.
Здесь мы описываем метод визуализации в производстве цитокинов на месте конфокальной микроскопией с разрешением одного клеток. Этот метод позволяет визуализировать клеточный источник и окружающую нишу внутри ткани. Этот протокол конкретно описывает визуализацию производства ИФНЗ в селезенке инфицированных мышей L. monocytogenes, сосредоточив здесь на производстве ИФНЗ нк-клетками и антигеном специфических CD8и Т-клеток. Тем не менее, он может быть расширен и адаптирован к характеристике любого производства цитокинов в контексте других ситуаций, когда цитокины производятся такие как инфекции, воспаление или аутоиммунные заболевания, до тех пор, пока целевой цитокин может быть сохранен в клетках ингибитором внутриклеточного переноса белка.
протокол
Все эксперименты с участием мышей были согласованы с Законом Великобритании о научных процедурах 1986 года.
1. Приемная передача антигенных CD8и Т-клеток у мышей
- Изолировать овальбумин (OVA)-специфические CD8и Т-клетки (OTI), выражающие зеленый флуоресцентный белок (OTI-GFP) или красный флуоресцентный белок (OTI-RFP) от лимфатического узла подвески Т-клеточных рецепторов трансгенных мышей9,10 с помощью мыши Комплект изоляции клеток CD8и T в указании по производству. Подготовка подвески клеток, разбив лимфатических узлов с помощью шприца поршень, как ранее описано11.
- Передача OTI-GFP или OTI-RFP клеток (3 х 106 клеток) в C57BL/6 диких цициптов типа мышей получателей путем внутривенной инъекции, как описано Cahalan, и др.12. Используйте мышей, которые, как правило, 6-12 недель.
ПРИМЕЧАНИЕ: Этот шаг является необязательным и требуется только для отслеживания антигена конкретных CD8и Т-клеток.
2. Листерия моноцитогены инфекции
- Расширьте L. monocytogenes genetically доработанные для того чтобы выразить OVA (LM-OVA)13 к экспоненциальной фазе роста в настомии сердца бульона на 37 c под нежным агитировать до тех пор пока OD600 не достигнет 0.08-0.1, как ранее описано в справке 14.
- Впрыските 100 л (максимальный объем 200 л) 0,1-0,5 ЛД50 LM-OVA, разбавленный фосфатно-буферным солевым раствором (PBS) путем внутривенной инъекции с использованием шприца инсулина 29 Г, в C57BL/6 получателей диких мышей типа подшипников OTI-GFP или OTI-RFP клеток, когда указано.
ПРИМЕЧАНИЕ: В наших руках 0,1 х ЛД50 LM-OVA соответствует 2 х 104 колонии формирования единиц (CFU). L. monocytogenes genetically modified to express OVA используется для активации ранее переданных OTI CD8и Т-клеток, но другие штаммы L. monocytogenes могут быть использованы.
3. Лечение брефельдином A (BFA) для блокирования секреции цитокинов
- Введите 250 мкг BFA в 200 Л PBS интраперитонеалли 6 ч перед мышью жертву с помощью 29 G инсулина шприц.
ПРИМЕЧАНИЕ: Лиофилизированный БФА впервые переприки в диметилсулькид (DMSO) для подготовки запасов 25 мг/мл концентрации. BFA затем разбавляют в PBS при комнатной температуре (RT), чтобы избежать кристаллизации до инъекции. Ингибирование секреции цитокинов индуцирует накопление ИФНЗ в клетках. Это имеет решающее значение для обнаружения цитокинов.
4. Сбор селезенки
- Эвтаназия мышей с использованием растущей концентрации CO2 с последующим вывихом шейки матки.
ПРИМЕЧАНИЕ: Следуйте местным руководящим принципам учреждения для гуманной эвтаназии мышей. - Очистите живот с помощью 70% этанола, сделайте разрез ножницами, чтобы сделать 1-2 см, прорезанного через кожу на левом фланге мыши, где находится селезенка. Тщательно сделайте разрез в перитонеуме, чтобы разоблачить селезенку и вынуть ее с помощью пинцета. Урожай селезенки, стараясь не сжать его щипками или сократить его, чтобы избежать нарушения архитектуры селезенки.
5. Фиксация селезенки параформальдегидом (PFA)
- Подготовьте фиксаторное решение, перемешив ая 3,75 мл PBS и 3,75 мл 0,2 М Л-лизин. Добавить 21 мг натрия м-периодата и хорошо перемешать. Затем добавьте 2,5 мл 4% PFA и 20 л из 12 N NaOH.
ПРИМЕЧАНИЕ: Используйте фиксаторное решение в тот же день и отбросить избыток. Не храните его. Этот шаг фиксации важен, если в образце содержатся флуоресцентные белки, такие как GFP. Не используйте ПФА, содержащий следы метанола, так как он денатурирует флуоресцентные белки.
ПРЕДЕКТО: ПФА является токсичным и должны быть обработаны с осторожностью. - Погрузите селезенку в фиксатор и зафиксировать минимум 4 ч, как правило, 16-20 ч при 4 градусах при нежном возбуждении.
- Откажитесь от фистового раствора и добавьте 5 мл PBS в течение 5 минут на RT под нежным возбуждением.
- Замените PBS 5 мл свежего ИНкубации PBS на 1 ч при 4 градусах Цельсия при нежном возбуждении.
- Замените PBS 5 мл сахарозы, инкубация для 12-24 ч.
ПРИМЕЧАНИЕ: Этот метод помогает поддерживать морфологию тканей. После инкубации сахарозным раствором орган должен онуться на дне колодца.
6. Замораживание и секционирование
- Поместите сухой лед в большой сосуд и поместите меньший сосуд внутри, содержащий около 50 мл чистого метанола и несколько кусков сухого льда.
- Аккуратно высушите селезенку на безворску.
- Поместите селезенку внутри базовой формы, содержащей каплю оптимальной температуры резки (OCT) соединения в нижней части. Будьте осторожны, чтобы не производить любые пузырьки. Добавьте OCT над селезенкой.
- С щипками, депозит базовой формы на поверхности метанола, убедившись, что он не касается OCT. Замораживание ткани как можно быстрее, чтобы свести к минимуму артефакты.
- Когда он заморожен, приступить к секции.
ПРИМЕЧАНИЕ: Замороженная селезенка может храниться при -80 градусов в течение нескольких месяцев. -
Раздел ткани с помощью криомикротома.
- Установите температуру камеры на криостат должен -21 градусов по Цельсию. Вырезать участки желаемой толщины (обычно около 10 мкм). Этот протокол работает с толщиной до 30 мкм.
- Соберите разделы на стеклянные слайды микроскопа (см. таблицуматериалов) и проверить визуально.
ПРИМЕЧАНИЕ: Разделы могут храниться при -80 градусов по Цельсию в течение нескольких месяцев.
7. Иммунофлуоресцентное окрашивание
- Разрешить раздел прийти к RT.
- Нарисуйте круг с жидким блокатором (например, пером PAP) вокруг раздела ткани. Нарисуйте за пределами OCT или он не будет придерживаться.
- После того, как он высох, регидратирует образец, поместив PBS на ткани разделе в течение 5 мин.
ПРИМЕЧАНИЕ: Объем, надеваемый на секцию, зависит от размера секции. Обычно мы используем 100-300 л. Не позволяйте секции высохнуть, как только они регидратируются. - Промыть PBS по крайней мере дважды, чтобы убедиться, что раздел хорошо придерживается слайда.
-
Добавьте блокирующее решение в раздел, чтобы уменьшить неспецифическую связывание антител.
- Подготовка блокирующее решение по следующим образом: PBS с 0,1% Triton X100, 2% сыворотки икры плода (FCS), 2,5 мкг/мл fc блокатор рецепторов (анти-мышь CD16/32). Затем добавьте 2-5% нормальной сыворотки видов каждого вторичного антитела окрашивания панели.
ПРИМЕЧАНИЕ: Если антитела непосредственно конъюгированы/биотинители, добавьте 5% нормальной сыворотки видов каждого первичного антитела. Если первичное антитело и одно из вторичных антител относятся к одному и тому же виду (например, первичные антитела, выращенные у кролика и вторичного кролика анти-крысы), не используйте обычные виды сыворотки, так как это увеличит фоновый сигнал. - Аккуратно удалите PBS из раздела по аспирации и добавьте 100 зл. Инкубировать в крытой мокрой камере не менее 1 ч на RT.
- Подготовка блокирующее решение по следующим образом: PBS с 0,1% Triton X100, 2% сыворотки икры плода (FCS), 2,5 мкг/мл fc блокатор рецепторов (анти-мышь CD16/32). Затем добавьте 2-5% нормальной сыворотки видов каждого вторичного антитела окрашивания панели.
-
Пятно с первичными антителами.
- Разбавить первичные антитела при оптимальной концентрации в блокирующем растворе. Общая концентрация антител является 5 мкг/мл, но она должна быть оптимизирована для каждого антитела и ткани.
ПРИМЕЧАНИЕ: Если антитела непосредственно спряжены, центрифуги смесь антител на 17,135 х г (13,500 об/ ч) в течение 15 минут при 4 градусах Цельсия, прежде чем использовать его. Флюорофоры могут осаждать. Этот шаг будет гранулы осадок и тем самым предотвратить неспецифическое осаждение осажденных антител на слайде. - Замените блокирующее решение первичной смесью антител для каждого образца.
- Инкубировать в течение 4 ч на RT или на ночь (OVN) при 4 градусах по Цельсию в крытой влажной камере.
- Разбавить первичные антитела при оптимальной концентрации в блокирующем растворе. Общая концентрация антител является 5 мкг/мл, но она должна быть оптимизирована для каждого антитела и ткани.
-
Выполняйте стирку.
- Подготовка мыть буфера, добавив 2% FCS к PBS.
- Вымойте 4 раза с мытьем буфера: один быстрый (без инкубации), один на 10 мин и два на 5 мин. Затем выполните окончательную стирку с PBS в течение 5 минут.
-
Окрашивание вторичными антителами.
- Разбавить вторичные антитела, представляющие интерес при оптимальной концентрации в блокирующем растворе. Центрифуге смесь, как описано для первичных антител.
- Удалите окончательное решение для мытья. Добавить вторичную смесь антител в верхней части раздела и инкубировать в течение 1-4 ч на RT в покрытой мокрой камере.
- Вымойте 4 раза с мытьем буфера: один быстрый (без инкубации), один на 10 мин и два на 5 мин. Затем выполните окончательную стирку с PBS в течение 5 минут.
- Удалите окончательное решение для мытья. Разрешить PBS испаряться, но не переусушить раздел. Поместите каплю монтажной среды поверх образца и аккуратно поместите крышку стекла на нем. Монтируя среда должна восстановить весь раздел. Пусть это полимераза OVN на RT защищены от света.
ПРИМЕЧАНИЕ: Нарисуйте круг вокруг раздела на обратной стороне слайда перед нанесением монтажной среды. Как только монтажная среда применяется, ткани может стать трудно увидеть. - Храните слайды в темноте при 4 градусах Цельсия до готовности к изображению.
8. Визуализация и анализ
- Выполните визуализацию окрашивания с помощью конфокального микроскопа.
ПРИМЕЧАНИЕ: В этом протоколе использовался перевернутый спектральный лазерный сканирующий микроскоп (см. таблицуматериалов), вместе с целями 10x/NA 0.40 или 60x/NA 1.4 (для анализа субклеточной локализации цитокинов). Длины волн возбуждения и излучения отображаются для каждого флворофора и флуоресцентного белка в таблицематериалов. - Выполнять анализ и количественную оценку по мере необходимости с помощью программного обеспечения для обработки изображений (например, Imaris или Фиджи).
Результаты
ИФНЗ, произведенная в течение первых 24 ч после того, как инфекция Listeria monocytogenes имеет решающее значение для контроля распространения этого патогена. Используя этот протокол, мы можем визуализировать не только то, какие клетки производят ИФНЗ, но и находятся ли они в определенной микросреде. Чтобы помочь нам разграничить архитектуру селезенки, мы назвали клетки, которые, как известно, имеют определенное расположение внутри селезенки. Маркер F4/80 маркирует все макрофаги и выделяет красную мякоть. Маркер B220 маркирует В-клетки и выделяет В-клеточные фолликулы, окружающие зону Т-клеток. Маркер CD169 этикетки маргинальных макрофагов зоны, окружающие белую мякоть(рисунок 1). Большинство клеток OTI, независимо от того, выражают они ИФНЗ или нет, присутствуют в белой мякоти, и как таковые, все изображения являются изображениями белой мякоти, если не указано.
Одним из важнейших шагов в этом протоколе является использование BFA для ингибирования секреции цитокинов. Действительно, обнаружение ИФНЗ клетками НК было значительно нарушено, когда мышей не лечили БФА(рисунок 2). Используя наш протокол, мы могли бы обнаружить, что по крайней мере два типа клеток производят IFN 24 h после инфекции-NK-клеток и антиген-специфических CD8и Т-клеток (Рисунок 3)-подобно тому, что было найдено ранее поток цитометрии3.
На месте изображения ифнепроизводящих клеток показали, что производство ИФНЗ не распространяется по всей селезенке, а сосредоточено в незаметных областях(рисунок 4). В самом деле, мы обнаружили, что Т-клетки были активированы по всей селезенки (выделены Т-клеток кластеризации), и это не обязательно коррелирует с производством IFN. Одним из вероятных объяснений является то, что производство ИФНЗ ограничено расположением инфицированных клеток15,16,и активацией Т-клеток, представленной кластеризацией, может быть поддержано как инфицированными (IFN) и неинфицированными (IFN) отрицательных) антиген-представляющих клеток. Другие пятна будут необходимы, чтобы определить точное местоположение и получить указание на механизм, ограничивающий производство IFN' в этой области и его связь с передачей антигена. Интересно, что мы обнаружили, что активированные, кластерные, антиген-специфические Т-клетки расположены по всей белой мякоти селезенки, но они производят ИФНЗ только в регионах, где НК-клетки сосуществуют с ними(рисунок 5). Таким образом, наличие НК-клеток очертит определенную микросреду в белой мякоти, в которой кластерные Т-клетки производят ИФНЗ, в отличие от кластерных Т-клеток в другой части белой пульпы. Это говорит о том, что активации Т-клеток недостаточно для того, чтобы диктовать производство ИФНЗ в этот момент времени.
Еще одной интересной особенностью, выделенной нашим протоколом, является различные субклеточные локализации ИФНЗ в НК по сравнению с CD8и Т-клетками5. Как показано на рисунке 6, в то время как локализация ИФНЗ в НК-клетках рассеивается в цитозоле, CD8и Т-клетки часто вербуют ИФНЗ к другой Т-клетке.

Рисунок 1: Маркеры, подчеркивающие архитектуру селезенки. Мыши были инфицированы 2 х 104 CFU LM-OVA и усыпил24 ч после инфекции. Селезенка была высажена и обработана, как описано в протоколе. (A) Разделы были окрашены для НК-клеток (анти-NCR1 следуют анти-коза IgG-FITC; зеленый), OTI-RFP клеток (красный) и макрофагов (анти-F4/80-APC; маджра). РП - Красная мякоть; WP - Белая мякоть. Шкала бар No 200 мкм. (B) Разделы были окрашены для B-клеток (анти-B220-Тихоокеанский синий; Синий), OTI-GFP -" (сигнал GFP показан красным цветом) и макрофаги маргинальных зон (anti-CD169-Alexa647; magenta). РП - Красная мякоть; Фолликул с ячейками БФ и В; ТЗ - Т-клеточная зона. Шкала бар 50 мкм. Это репрезентативное изображение 3 независимых экспериментов (N No 4). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
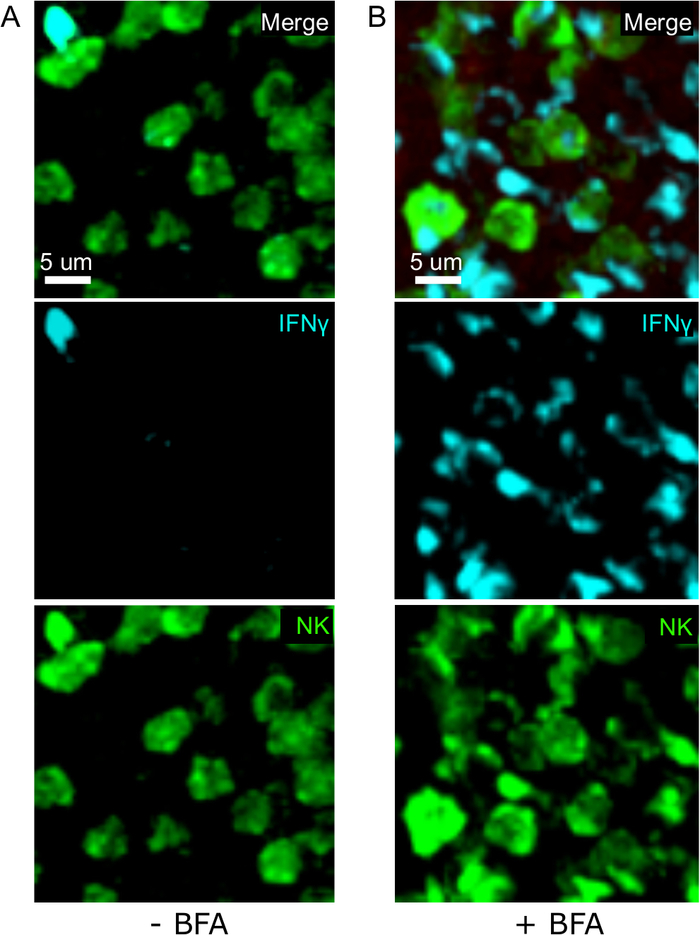
Рисунок 2: Лечение BFA позволяет обнаружить внутриклеточные ИФНЗ на месте. Производство НЗ ограничено конкретными областями в селенци мышей были инфицированы 2 х 104 CFU LM-OVA и лечение с BFA (A) или оставили без лечения (B) после 18 ч. Мыши были усыплены 24 ч после инфекции. Селезенка была высажена и обработана, как описано в протоколе. Разделы были окрашены для НК-клеток (анти-NCR1 следуют анти-коза IgG-FITC; зеленый), OTI-RFP клеток (красный) и ИФНЗ (анти-IFN-BV421; циан). Шкала бар 5 мкм. Это репрезентативное изображение районов, богатых ячейками НК, из 3 независимых экспериментов (N No 3). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
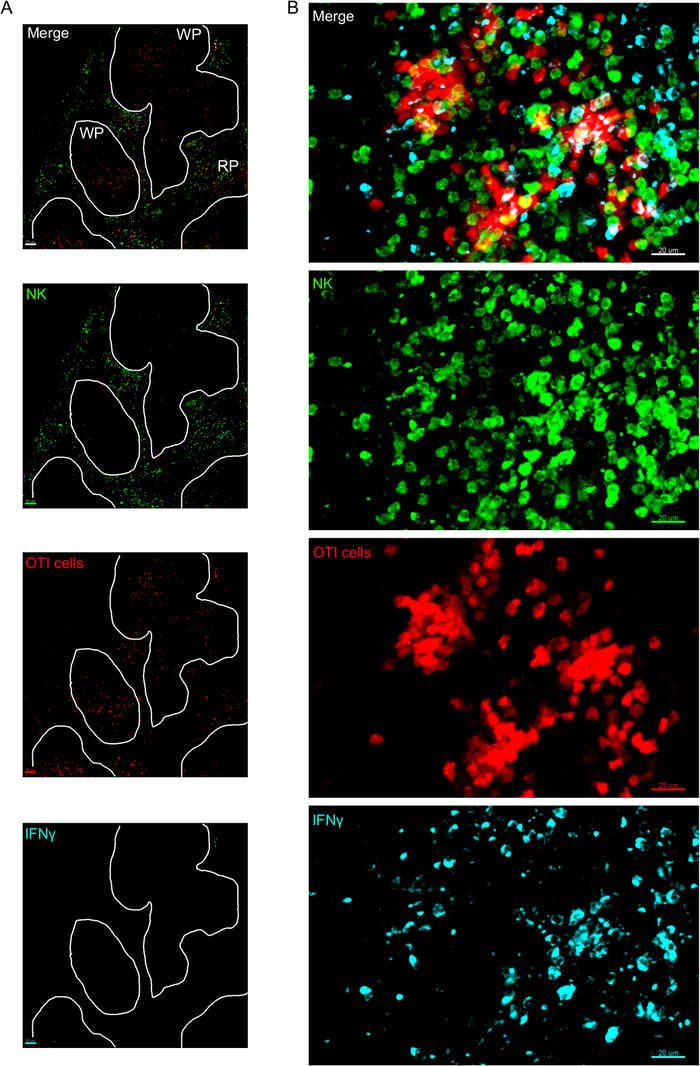
Рисунок 3: ИФНЗ производит клетки в селезенке. Мыши были инфицированы 2 х 104 CFU LM-OVA, когда указано и лечение BFA после 18 ч. Мыши были усыплены 24 ч после инфекции. Селезенка была высажена и обработана, как описано в протоколе. Разделы были окрашены для НК-клеток (анти-NCR1 следуют анти-коза IgG-FITC; зеленый), OTI-RFP клеток (красный) и ИФНЗ (анти-IFN-BV421; циан). (A) Представитель изображение селезенки из неинфицированных наивных мышей, чтобы продемонстрировать отсутствие ИФНЗ неспецифических окрашивания. Белые линии разграничива белую мякоть. WP - Белая мякоть; РП - Красная мякоть. (B) Репрезентативное изображение белой пульпы из селезенки мыши, зараженной LM-OVA, показывая вторжение НК-клеток в белую мякоть и производство ИФНЗ клетками НК, клетками OTI и немаркированными клетками. Изображения являются репрезентативными из 4 независимых экспериментов (N No 4). Шкала баров - 70 мкм (А); и 20 мкм (B). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
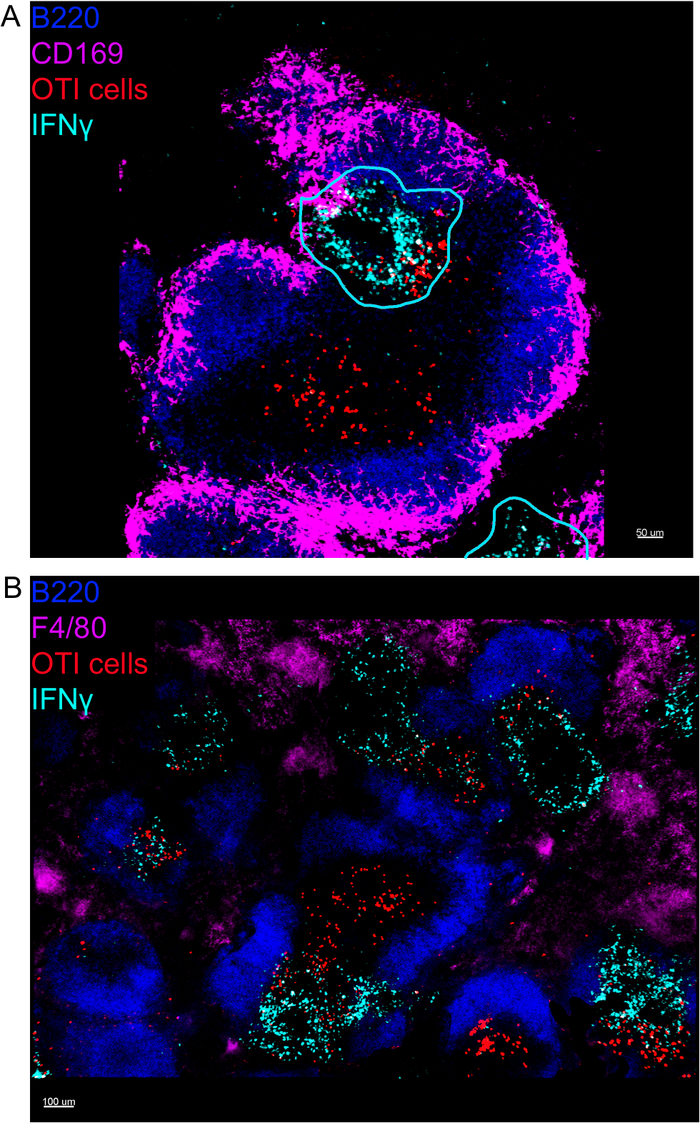
Рисунок 4: Производство ИФНЗ ограничено конкретными областями селезенки после инфекции LM-OVA. Мыши были инфицированы 2 х 104 CFU LM-OVA и лечение бФА после 18 ч. Мыши были усыплены 24 ч после инфекции. Селезенка была высажена и обработана, как описано в протоколе. Все секции были окрашены в В-клетки (B220-Pacific Blue Ab, Blue) и ИФНЗ (анти-ИФНЗ-биотин, за которым следуют стрептавидин-PE; голубой). Ячейки OTI-GFP (сигнал GFP показан красным цветом). Линии cyan соответствуют зонам высокого производства IFN. Это репрезентативные изображения 4 независимых экспериментов (N No 4). (A) Разделы были окрашены для маргинальных макрофагов зоны (анти-CD169-Alexa 647, пурпурный). Шкала бар 50 мкм. (B) Разделы были окрашены для всех макрофагов (F4/80). Шкала бар 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
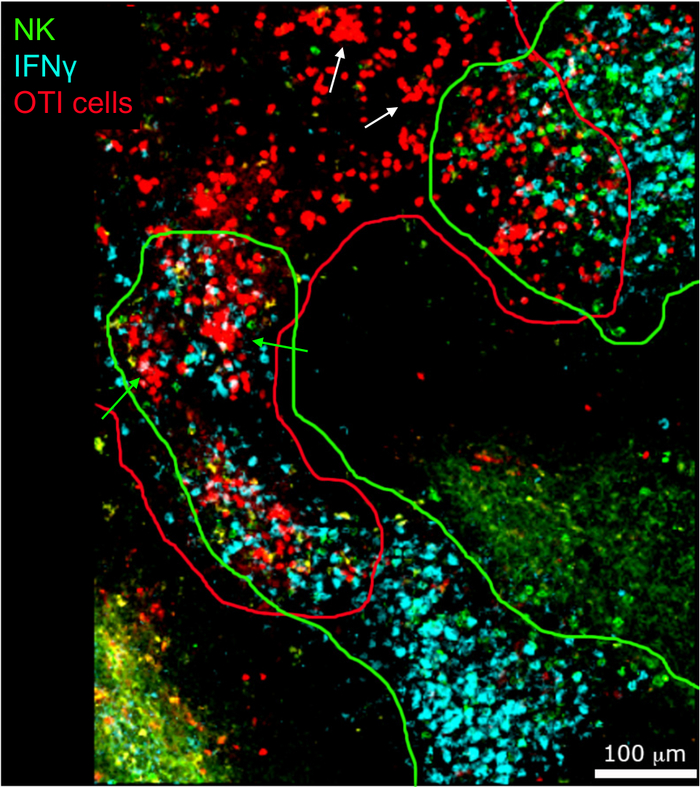
Рисунок 5: Производство ИФНЗ активированными клетками OTI происходит в определенной микросреде. Мыши были инфицированы 2 х 104 CFU LM-OVA и лечение бФА после 18 ч. Мыши были усыплены 24 ч после инфекции. Селезенки были высажены и обработаны, как описано в протоколе. Разделы были окрашены для НК-клеток (анти-NCR1 следуют анти-коза IgG-FITC; зеленый), OTI-RFP клеток (красный) и ИФНЗ (анти-IFN-BV421; циан). Зеленые и красные линии подчеркивают зоны клеток NK и OTI соответственно. Белая стрелка указывает на примеры Т-клеточных кластеров, не производящих ИФНЗ. Зеленые стрелки примеры Т-клеточных кластеров, производящих ИФНЗ. Шкала бар 100 мкм. Это репрезентативное изображение четырех независимых экспериментов (N No 4). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
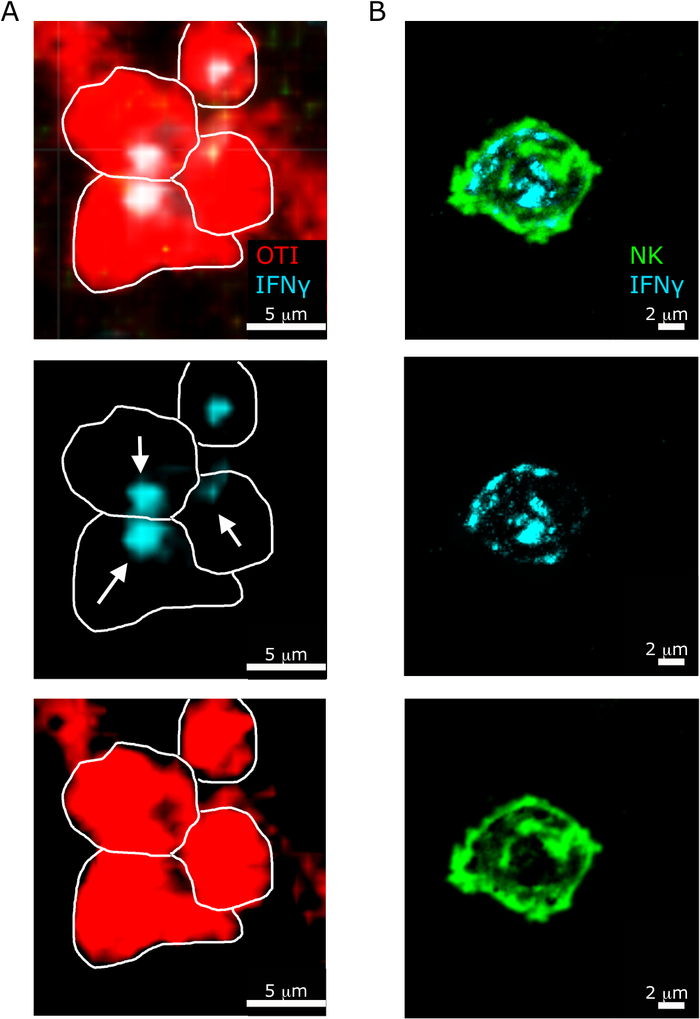
Рисунок 6: Субклеточная локализация ИФНЗ в НК-клетках и Т-клетках. Мыши были инфицированы 2 х 104 CFU LM-OVA и лечение бФА после 18 ч. Мыши были усыплены 24 ч после инфекции. Селезенка была высажена и обработана, как описано в протоколе. Все секции были запятнаны для ИФНЗ (анти-ИФНЗ-БВ421; циань). Белые линии очертания огранки ячеек и белые стрелки показывают направленность секреции. Это репрезентативное изображение двух независимых экспериментов (N No 5). (A)- OTI-RFP-клетки показаны красным цветом. Шкала бар No 5 мкм. (B) Разделы были окрашены для НК-клеток (анти-NCR1 следуют анти-коза IgG-FITC; зеленый. Шкала бар 2 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
В этой рукописи мы представляем метод визуализации производства ИФНЗ в селезенке после инфекции L. monocytogenes у мышей. Этот протокол прост и может быть адаптирован к другим тканям и цитокиновым триггерам, но необходимо учитывать следующие аспекты. Клетки часто быстро выделяют цитокины, которые они производят, и цитокины быстро подбираются соседними клетками. Как таковой трудно обнаружить цитокины на месте. Распространенный метод для быстрого повторного инициирования производства цитокинов является повторно стимулировать клетки ex vivo с последующим обнаружением цитокинов в средствах массовой информации с помощью фермент-связанного иммуносорбента. В этом контексте теряется любая информация о пространственной локализации клеток, производящих цитокины. Кроме того, производство цитокинов после повторной стимуляции не обязательно отражает ли цитокины на самом деле производятся и выделяется in vivo, а скорее указывает на способность данной популяции клеток производить цитокины. Таким образом, оба метода будут предоставлять различную информацию, и следует рассмотреть, какая информация является наиболее ценным для их эксперимента.
Для того, чтобы обнаружить внутриклеточные цитокины, наш метод использует ингибитор внутриклеточного белка для ловушки цитокинов внутри клеток и увеличения обнаружения сигнала. Однако важно отметить, что эти ингибиторы влияют на нормальную транспортировку белков из эндотелиальной ретикулум (RE) в аппарат Голги и на секреторный везикул, ухудшающий их высвобождение, что может вызвать токсичность. Как следствие, BFA, или другой ингибитор, должны использоваться в течение короткого периода времени, как правило, не более нескольких часов. Следовательно, важно найти правильный баланс между дозой ингибитора и временем лечения, чтобы оптимизировать уровень цитокинов, попавших в клетку, не вызывая серьезных цитотоксических эффектов. Эти переменные могут отличаться между цитокинов и маршрут администрации для BFA. В нашей модели инфекции, BFA был администрирован интраперитоневский для того, чтобы обеспечить быструю системную дисперсию, но она также может быть доставлена внутривенно.
Наиболее часто используемыми ингибиторами внутриклеточного белка являются BFA, используемые здесь, и monensin (MN). Эти ингибиторы часто используются невнятно для накопления и изучения производства цитокинов, но они имеют небольшие различия в их механизмах действия. MN ингибирует транспортировку белков в аппарате Golgi, следовательно, накапливая белки в Golgi17 в то время как BFA предотвращает коатомерный белковый комплекс-I вербовки, ингибируя ретроградное движение белков в эндоплазмический ретикулум (ER) и тем самым способствуя накоплению цитокинов в ER18. Таким образом, выбор наилучшего ингибитора внутриклеточного белка будет зависеть от различных факторов, таких как цитокин, который будет обнаружен. Например, было показано в липополисахарида индуцированной внутриклеточного окрашивания моноцитов, что BFA является более эффективным для измерения цитокинов IL-1 , IL-6 и TNF, чем MN19.
Этот протокол включает в себя визуализацию цитокинов на месте конфокальной микроскопии и, следовательно, Есть только ограниченное количество маркеров, чем может быть использовандля для изучения цитокинов производства клеток и их микроокружения. Необходимо также учитывать, что ингибиторы переноса белка, такие как BFA или MN нарушают нормальное выражение нескольких белков и, следовательно, их использование при изучении одновременного выражения определенных маркеров поверхности клеток активации должны быть приближены Тщательно. Например, BFA, но не MN блокирует выражение CD69 в лимфоцитах мурин20. Несмотря на это ограничение, конфокальная визуализация позволяет субклеточной локализации цитокинов, а также направление секреции цитокинов внутри клетки. Данные, генерируемые с помощью этого протокола, свидетельствуют о том, что НК-клетки, как правило, выделяют IFN-y в диффузном шаблоне, в то время как CD8и Т-клетки, кажется, направляют секрецию IFN' на другие CD8и Т-клетки, которые находятся в непосредственном взаимодействии с ними5.
В заключение, этот протокол подходит для визуализации различных цитокинов на месте и определить производящие клетки и их микроокружение после многих триггеров, таких как инфекция или аутоиммунные заболевания. Полученная информация имеет важное значение для понимания важности пространственной оркестровки in vivo различных типов клеток и цитокинов, которые они производят, необходимых для эффективного иммунного ответа.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим сотрудников Института Кеннеди за техническую помощь в визуализации. Эта работа была поддержана грантами от Фонда Кеннеди (до А.Г.) и Научно-исследовательского совета по биотехнологии и биологическим наукам (BB/R015651/1 до A.G.).
Материалы
| Name | Company | Catalog Number | Comments |
| Brefeldin A | Cambridge bioscience | CAY11861 | |
| Paraformaldehyde | Agar scientific | R1018 | |
| L-Lysin dihydrochloride | Sigma lifescience | L5751 | |
| Sodium meta-periodate | Thermo Scientific | 20504 | |
| D(+)-saccharose | VWR Chemicals | 27480.294 | |
| Precision wipes paper Kimtech science | Kimberly-Clark Professional | 75512 | |
| O.C.T. compound, mounting medium for cryotomy | VWR Chemicals | 361603E | |
| Fc block, purified anti-mouse CD16/32, clone 93 | Biolegend | 101302 | Antibody clone and Concentration used: 2.5 mg/ml |
| Microscope slides - Superfrost Plus | VWR Chemicals | 631-0108 | |
| anti-CD169 - AF647 | Biolegend | 142407 | Antibody clone and Concentration used: clone 3D6.112 1.6 mg/ml Excitation wavelength: 650 Emission wavelength: 65 |
| anti-F4/80 - APC | Biolegend | 123115 | Antibody clone and Concentration used: clone BM8 2.5 mg/ml Excitation wavelength: 650 Emission wavelength: 660 |
| anti-B220 - PB | Biolegend | 103230 | Antibody clone and Concentration used: clone RA3-6B2 1.6 mg/mL Excitation wavelength: 410 Emission wavelength: 455 |
| anti-IFNg - biotin | Biolegend | 505804 | Antibody clone and Concentration used: clone XMG1.2 5 mg/mL |
| anti-IFNg - BV421 | Biolegend | 505829 | Antibody clone and Concentration used: clone XMG1.2 5 mg/mL Excitation wavelength: 405 Emission wavelength: 436 |
| anti-Nkp46/NCRI | R&D Systems | AF2225 | Antibody clone and Concentration used: goat 2.5 mg/mL |
| anti-goat IgG-FITC | Novusbio | NPp 1-74814 | Antibody clone and Concentration used: 1 mg/mL Excitation wavelength: 490 Emission wavelength: 525 |
| Streptavidin - PE | Biolegend | 405203 | Antibody clone and Concentration used: 2.5 mg/mL Excitation wavelength: 565 Emission wavelength: 578 |
| Streptavidin - FITC | Biolegend | 405201 | Antibody clone and Concentration used: 2.5 mg/mlL Excitation wavelength: 490 Emission wavelength: 525 |
| Fluoromount G | SouthernBiotech | 0100-01 | |
| Cover glasses 22 mm x 40 mm | Menzel-Glazer | 12352128 | |
| Liquid blocker super PAP PEN mini | Axxora | CAC-DAI-PAP-S-M | |
| Imaris - Microscopy Image Analysis Software | Bitplane | ||
| Confocal microscope - Olympus FV1200 Laser scanning microscope | Olympus | ||
| Cryostat - CM 1900 UV | Leica | ||
| Base mould disposable | Fisher Scientific UK Ltd | 11670990 | |
| PBS 1x | Life Technologies Ltd | 20012068 | |
| BHI Broth | VWR Brand | 303415ZA | |
| GFP | Excitation wavelength: 484 Emission wavelength: 507 | ||
| RFP | Excitation wavelength: 558 Emission wavelength: 583 | ||
| Insulin syringe, with needle, 29 G | VWR International | BDAM324824 | |
| C57BL/6 wild type mice | Charles River |
Ссылки
- Iwasaki, A., Medzhitov, R. Control of adaptive immunity by the innate immune system. Nature Immunology. 16 (4), 343-353 (2015).
- Harty, J. T., Bevan, M. J. Specific immunity to Listeria monocytogenes in the absence of IFN gamma. Immunity. 3 (1), 109-117 (1995).
- Kubota, K., Kadoya, Y. Innate IFN-gamma-producing cells in the spleen of mice early after Listeria monocytogenes infection: importance of microenvironment of the cells involved in the production of innate IFN-gamma. Frontiers in Immunology. 2 (26), (2011).
- Dunn, P. L., North, R. J. Early gamma interferon production by natural killer cells is important in defense against murine listeriosis. Infection and Immunity. 59 (9), 2892-2900 (1991).
- Krummel, M. F., et al. Paracrine costimulation of IFN-gamma signaling by integrins modulates CD8+ T cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 115 (45), 11585-11590 (2018).
- Curtsinger, J. M., Agarwal, P., Lins, D. C., Mescher, M. F. Autocrine IFN-gamma promotes naive CD8+ T cell differentiation and synergizes with IFN-alpha to stimulate strong function. Journal of Immunology. 189 (2), 659-668 (2012).
- Hosking, M. P., Flynn, C. T., Whitton, J. L. Antigen-specific naive CD8++ T cells produce a single pulse of IFN-gamma in vivo within hours of infection, but without antiviral effect. Journal of Immunology. 193 (4), 1873-1885 (2014).
- Croxford, A. L., Buch, T. Cytokine reporter mice in immunological research: perspectives and lessons learned. Immunology. 132 (1), 1-8 (2011).
- Gerard, A., et al. Secondary T cell-T cell synaptic interactions drive the differentiation of protective CD8++ T cells. Nature Immunology. 14 (4), 356-363 (2013).
- Engelhardt, J. J., et al. Marginating dendritic cells of the tumor microenvironment cross-present tumor antigens and stably engage tumor-specific T cells. Cancer Cell. 21 (3), 402-417 (2012).
- Matheu, M. P., Cahalan, M. D. Isolation of CD4+ T cells from mouse lymph nodes using Miltenyi MACS purification. Journal of Visualized Experiments. (9), 409 (2007).
- Matheu, M. P., Parker, I., Cahalan, M. D. Dissection and 2-photon imaging of peripheral lymph nodes in mice. Journal of Visualized Experiments. (7), 265 (2007).
- Pope, C., et al. Organ-specific regulation of the CD8+ T cell response to Listeria monocytogenes infection. Journal of Immunology. 166 (5), 3402-3409 (2001).
- Jones, G. S., D'Orazio, S. E. Listeria monocytogenes: cultivation and laboratory maintenance. Current Protocols in Microbiology. 31, 1-7 (2013).
- Kang, S. J., Liang, H. E., Reizis, B., Locksley, R. M. Regulation of hierarchical clustering and activation of innate immune cells by dendritic cells. Immunity. 29 (5), 819-833 (2008).
- Chang, S. R., et al. Characterization of early gamma interferon (IFN-gamma) expression during murine listeriosis: identification of NK1.1+ CD11c+ cells as the primary IFN-gamma-expressing cells. Infection and Immunity. 75 (3), 1167-1176 (2007).
- Mollenhauer, H. H., Morre, D. J., Rowe, L. D. Alteration of intracellular traffic by monensin; mechanism, specificity and relationship to toxicity. Biochimica et Biophysica Acta. 1031 (2), 225-246 (1990).
- Helms, J. B., Rothman, J. E. Inhibition by brefeldin A of a Golgi membrane enzyme that catalyses exchange of guanine nucleotide bound to ARF. Nature. 360 (6402), 352-354 (1992).
- Schuerwegh, A. J., Stevens, W. J., Bridts, C. H., De Clerck, L. S. Evaluation of monensin and brefeldin A for flow cytometric determination of interleukin-1 beta, interleukin-6, and tumor necrosis factor-alpha in monocytes. Cytometry. 46 (3), 172-176 (2001).
- Nylander, S., Kalies, I. Brefeldin A, but not monensin, completely blocks CD69 expression on mouse lymphocytes: efficacy of inhibitors of protein secretion in protocols for intracellular cytokine staining by flow cytometry. Journal of Immunology Methods. 224 (1-2), 69-76 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены