Method Article
基于原生自荧光的sFLIM测量植物部分荧光探针和木质素之间的相互作用
摘要
该协议描述了结合光谱和荧光寿命测量的原始设置,以评估在厚植物部分直接测定基于红胺的荧光探针和木质素聚合物之间的Fürster共振能量转移(FRET)。
摘要
在木质纤维素生物量(LB)中,酶的活性受到水解过程中与木质素的非特异性相互作用的影响,而木质素保持酶远离其基质。因此,这些复杂相互作用的特征是LB等复杂基板的一个挑战。该方法测量荧光标记分子与原生自荧光木质素之间的分子相互作用,由Fürster共振能量转移(FRET)揭示。与使用两种外源性荧光荧光源的活细胞中的FRET测量相反,由于木质素复杂的自荧光,在植物中使用木质素的FRET测量并非易事。我们开发了一个原始的采集和分析管道,对荧光的两个互补特性进行相关观察:荧光发射和寿命。sFLIM(光谱和荧光寿命成像显微镜)提供高灵敏度的这些相互作用的定量,揭示生物分子和木质素之间的不同相互作用水平。
引言
水解木纤维素到单糖,如葡萄糖需要酶。其活性已知受到酶和木质素1、2之间非特异性相互作用的建立的制约,后者是疏水性聚合物和木质纤维素3的主要成分。因此,在细胞规模上直接定量测量这种相互作用是一个挑战,必须解决,以优化酶催化活性和木质纤维素预处理4。
Fürster(或荧光)共振能量转移(FRET)测量是一种选择的方法,用于在原位对生物分子相互作用进行评估。这种非辐射能量转移可能发生在供体和受体荧光酸之间,如果它们满足不同的条件。供体发射谱必须重叠,至少部分重叠接受器激励谱。因此,荧光草的选择对于这种实验至关重要。然后,传输效率随着距离5的第六功率而降低,并且仅在两个分子都靠近(通常在纳米范围内)时才会发生。其他意外情况可能会改变传输效率,如偶极子定向,但如果荧光道具有灵活性,则可缓解。
FRET可以通过不同的技术来测量,详细的描述可以在文献6,7中找到。总之,主要方法依赖于:(一) 敏感发射,其中接受器发射荧光的变化遵循,主要提供定性结果;ii) 接受者光漂白,其中供体发射荧光测量之前和之后接受者光漂白(在这种情况下,可以实现更精确的FRET估计,但需要强大的激光功率应用于固定样品);和 iii) 在接受者在场的情况下,供体减少的寿命测量。此方法需要特定的仪器,并允许在荧光量之间进行精确和敏感的相互作用测量。考虑到荧光探针和木纤维素之间的FRET测量,主要困难是木质纤维素不是单一的很好地特征的荧光素:它具有很强的原生和光谱范围的自荧光,主要来自木质素,并依赖于生物量物种8,9。
在本文中,我们提出了一个新的和原始的程序,以适应部分木材/植物样品。这种基于sFLIM的方法为在原生木纤维素样品中的荧光探针和木质素之间的定量FRET测量开辟了道路。
研究方案
1. 样品制备
注:图1中描述了准备示例的连续步骤。
- 植物样品制备
- 从木材树干或碎片,切割1厘米长的样品与剃须刀刀片,而不会损坏其结构。
- 将样品嵌入聚乙烯乙二醇(PEG)介质中,通过浸入水中稀释的PEG浓度增加的连续溶液中,直至达到100%PEG。
- 将样品置于真空下以除水。
- 轻轻搅拌样品在30%v/v PEG 24小时。
- 轻轻搅拌样品在50%v/v PEG 24小时。
- 在 100% PEG 中轻轻搅拌样品,在 70°C 下搅拌 24 小时(纯 PEG 在室温下是固体)。
- 将样品置于70°C(热板上)的胶囊中,并逐渐降低温度,直到达到室温。
- 使用微胎和一次性刀片,从这些 PEG 块中仔细准备 30-60 μm 厚度平截面。
- 收集并洗涤部分,连续洗涤5分钟,以去除该部分的PEG。
- 荧光探针制备
- 在pH6.0下制备30mM磷酸盐的缓冲液。
- 称重 PEG rhand dextran 罗丹胺探针粉。
- 在黑暗中,将探针粉末溶解到缓冲液中,在玻璃瓶中连续搅拌1小时,最终浓度为0.1 g/L。
- 植物样品染色
- 用500 μL的荧光探针(见1.2.3)在暗箱中孵育部分72小时(无搅拌)(每管不超过3节)。
- 用刷子拾取部分,用干净的纸吸附缓冲液(避免干燥该部分),然后将孵育部分安装在盖玻璃和#1.5H 盖玻片之间。
2. 荧光寿命和光谱测量系统校准
注:sFLIM测量的完整工作流程如图2所示。
- 确定 sFLIM 探测器的光谱窗口宽度。
- 将尿素晶体放入具有 0.17 μm 玻璃底部的培养盒中。
- 将培养盒放在显微镜样品架上,然后选择 20x 物镜。
- 选择波长为 900 nm 且功率为 2% 的 Ti:Sa 激光,然后打开扫描。
- 在 sFLIM 探测器上收集第二次谐波信号。
注:二次谐波信号以450nm的半激励波长发射;在瞬时时,该措施还提供系统的仪器响应功能。 - 逐渐调整激光激发波长从900到980nm,直到第二个光谱通道(462.5nm)中收集第二次谐波信号。
- 确定光谱窗口长度 (12.5 nm)。
- 如果光谱范围与预期不同,则通过执行以下操作进行故障排除。
- 将激光调节到 910 nm。
- 使用滚轮移动光栅位置,仅测量第一通道(第一通道边界)上的二次谐波信号。
- 将激光调节到 935 nm。
- 使用滚轮移动光栅位置,仅测量第一通道(第二通道边界)上的二次谐波信号。
- 校准整个光谱仪通道
- 将镜子插入显微镜舞台。
- 选择可见连续激光(458 nm,功率1%)。
- 收集 sFLIM 探测器上的反射信号,并检查光子是否在适当的光谱通道中测量。
- 使用所有可用的连续激光器(514 nm、561 nm 和 633 nm)重复步骤 2.2.2 和 2.2.3。
- 如果光谱通道与预期不同,则用滚轮移动光栅位置,并重复步骤 2.1 和 2.2。
3. 样品荧光表征
- 在装有薄膜支架附件的光谱仪(例如,Jasco FP-8500 仪器)中,放置植物部分样品(未使用荧光探头孵育)。
- 测量荧光发射通常在300-600nm范围内,而刺激样品通常在250-550nm范围内。
- 绘制荧光强度与激发和发射波长,以绘制 3D 荧光图。
- 确定绘图中的最大激发/发射区域。
4. 光谱 FRET 测量
- 自荧光校准
- 选择目标 20x (NA: 0.8)。
- 将双光子激光激发设定为 750 nm。
- 将麦秆 (WS) 单独放置在滑轨和盖玻片之间的植物部分。
- 在软件中应用以下参数。切换到 lambda 模式。选择分辨率为 9.7 nm 的光谱探测器 ChS。选择 420 到 722 nm 之间的光谱范围。
- 获取映像。
- 确定供体排放峰值(使用此设置为 470 nm)。
- 接受方的校准
- 将基于红胺的荧光探头放入具有 0.17 μm 玻璃底部的培养盒中。
- 使用相同的设置获取图像。
- 确定接受器发射峰值(使用此设置为 570 nm)。
- 确定最大"仅 WS"信号和没有接受信号的光谱范围,作为仅供体发射 sFLIM 测量(460-490 nm,此设置)。
- 样品测量
- 将染色的植物部分放在滑轨和盖玻片之间。
- 使用相同的设置获取图像。
- 保存 lsm 文件。
- 与"WS 单独样本"相比,强 FRET 事件与供体排放峰值的减少和接受器排放峰值与罗达明样品相比的增加进行了定性关联。
5. sFLIM 测量
注: 对于 sFLIM 设置,所使用的系统是一个时域 sFLIM 设置,如前面10所述。可使用直立显微镜和各种时间相关的单光子计数卡和共聚焦显微镜制造商,并相应地调整协议。
- 将系统切换到 sFLIM 模式。
- 设置共聚焦显微镜,如 4.1.1 和 4.1.2 中所述。
- 切换到软件中的非扫描模式,将荧光子发送到 sFLIM 探测器。
- 将 sFLIM 采集设置为启用模式,以允许光子计数在 SPC150 上。
- 在 SPC150 上选择 30 s 时间集合。
- 检查差价合约是否介于 1 x 105和 1 x 106之间。
注意:确保 TCSPC 卡上测量的光子数始终小于激光激发频率的 1%(在此设置中,激光激发频率为 80 Mhz,任何像素的检测速率不能超过 800 kHz,以避免累积效应11)。
- 将"单独 WS"工厂部分放在幻灯片和盖玻片之间。
- 将软件设置为连续模式以允许激光扫描。
- 选择样品上的测量区域。
- 单击 SPC150 上的"开始"。
- 保存 sdt 文件。
- 对每个条件至少重复 10 个样本的过程。
- 将染色的植物部分放在滑轨和盖玻片之间。
- 重复步骤 5.2.1 - 5.2.5。
6. sFLIM 分析
- 选择"仅 WS"上获取的 sFLIM 数据,然后使用文件将它们导入 SPCImage 软件|导入。
- 选择拟合参数。
- 从选项 |模型,选择不完整的多指数 :12.5 ns。
- 从选项 |首选项,选择自动计算工具响应。
- 从主面板的右侧菜单中选择 2 指数拟合模型:
- 对于每个通道,应用拟合模型并将拟合参数保存到电子表格(1、2、t1、t2)。
- 为了比较通道和实验,在电子表格中计算平均荧光寿命 (Tm):
- 计算所有通道中所有样本(至少 10 个)的平均生存期。
- 分析捐赠通道上的 Tm(从通道 1 到 3:460-490 nm),并确定显示最高光子数并对应于木质素最大发射的专用通道(通道 2 对应于 467.5 - 480 nm)。必须在步骤 6.7 中使用通道 2 中的值。
- 选择在彩色 WS 上获取的 sFLIM 数据并将其导入 SPCImage 软件。
- 重复步骤 6.1-6.4。
- 计算前一个选定通道WS 单独 (TmD)和彩色植物样品 (TmDA)中供体的 FRET 效率 EFRET :
- 比较 WS 和示例之间的 sFLIM 和 EFRET值。
- 考虑与 WS 和要作为 FRET 事件分析的样本之间的同质寿命减少相关的正 EFRET(参见 Spriet 等人 12 和 Terryn 等人12和 Terryn 等人10的代表性结果和作品,了解详细信息)。
- 考虑寿命减少分布不同是由于FRET和木质素压实水平的混合,不解释为分子相互作用。
- 将无寿命修改视为缺少可测量的 FRET 信号,但不视为缺少与木质素的交互
结果
为了证明sFLIM能够解剖木质素和荧光标记分子之间的分子相互作用,我们首先使用了三个不同的样本(图3):原生小麦稻草(WS),用PEG标记的PEG培育的本地小麦稻草(PR10),以及带有红胺标记的本地麦秆(DR10)。PR10已知与木质素相互作用,而DR10应该是惰性13,14,15。sFLIM 曲线(图 3,上图)显示了参考样本 (WS) 和两个交互情况(DR10 和 PR10)之间可以实现的一些修改。事实上,人们首先可以很容易地注意到与红胺发射范围相对应的光谱区域的荧光增加。仔细观察三个第一通道光子衰减曲线也显示DR10比PR10更强。在拟合光子衰减曲线并计算每个通道的平均荧光寿命后,FRET特征变得更加明显(图3,底部)。事实上,虽然荧光寿命交替增加和减少沿荧光光谱的WS样品,一个明显的FRET特征观察到PR10和DR10与:1)一个恒定的寿命寿命值在供体仅发射通道(3第一通道,蓝色);2) 光谱通道中荧光寿命的增加,与高寿命供体荧光的增贡献相对应。
一旦确定明确的FRET,木质素荧光寿命(通道2)的比较允许定量WS(0.47 ns)、DR10(0.42 ns)和PR10(0.36 ns)之间的寿命减少,从而揭示木质素与PR10 和 DR10 均具有更强的 PR10 亲和力。
为了说明这种方法对不同相互作用水平的量化相关性,我们选择另外三个样本,模拟经过处理的植物样品的酶可访问性:酸处理的WS (AWS),结合5 kDa和20 kDa(PR5和PR20)两个对比分子量的PR。经过仔细检查sFLIM特征,提取木质素荧光寿命(图4)。如前所述,木质素荧光寿命可由其环境16、17改变。酸处理后,AWS 中的荧光寿命测量值 (0.28 ns) 将低于之前为 WS (0.47 ns) 测得的荧光寿命测量值,这证实了 sFLIM 程序对寿命减少的明确解释以及每个测试条件需要负控制的要求。正如预期的那样,在将 PR 添加到 AWS 时,当它与木质素交互时,观察到其寿命的急剧下降。此外,与 PR20 (0.16 ns) 相比,PR5 (0.14 ns) 的交互力更强,这与其流体动力半径测量(PR5 和 PR20 分别为 2.3 nm 和 4.8 nm)一致,导致不同的石原约束,从而具有较高的 PR5 对木质素的可及性。
两项实验都表明,这种方法与酶的木质素相互作用的相关性,取决于其大小和植物样品的预处理。

图1:样品的不同制备步骤。小麦草 ( WS) (A) 首先减小大小 (B) 嵌入 PEG 介质 (C. . ) 中。块使用装有一次性刀片 (D) 的微缩器切割。洗涤后,结果部分 (E) 被放置在 PEG 或 dextran 标记-罗达明溶液 (F) 中孵育。贴有标签的截面安装用于 sFLIM 测量 (G) 。刻度条为 2 厘米 (A), 1 厘米 (B和C), 200 μm (E和G)。请点击此处查看此图的较大版本。
图2:基于光谱FRET的交互测量的完整工作流程。该图显示了结合光谱荧光强度和寿命测量的设置。光谱荧光图像通过共聚焦显微镜获取,每个光谱范围的连续荧光寿命通过sFLIM检测器测量。分析光子衰变曲线可以精确确定样品和感兴趣的分子之间的相互作用。校准必须经过处理,以避免人工制品。首先,sFLIM探测器需要光谱校准,并检查其仪器响应功能。其次,在添加接受分子之前,必须为每个样品精确校准复杂的自荧光信号,以确定每个通道的荧光寿命。请点击此处查看此图的较大版本。

图 3:代表性 sFLIM 测量值。sFLIM 曲线(顶部面板)是在原生麦秆 (WS) 上获得的,WS 孵育有 PEG 标记有罗达明 (WS+PEG) 和原生小麦稻草标记有罗达明 (WS_DEX)。对于每个样品,sFLIM 曲线都装有双指数衰减模型,并计算了每个通道(底部面板)的平均荧光寿命。WS_PEG 和 WS_DEX 样本在仅与自荧光相对应的通道中的荧光寿命减少(三个第一条),与与自荧光和红胺混合排放相对应的通道寿命增加相关。这种行为是木质素和红胺标记分子之间的FRET事件的特征。请点击此处查看此图的较大版本。
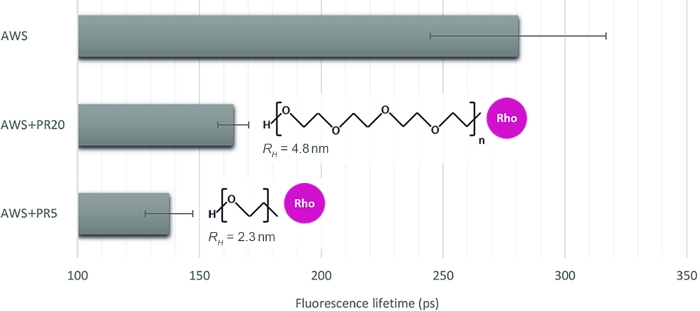
图4:与木质素自荧光对应的通道的荧光寿命分析。在基于 sFLIM 特征验证 FRET 事件后,在酸处理的 WS (AWS) 上与 PR5 或 PR20(分别为 5 kDa 和 20 kDa)结合测量平均荧光寿命。虽然两个PR样本的寿命都减少了,但较小的样本的特点是寿命减少更强,显示出与木质素的分子相互作用更强。因此,该方法足够敏感,可以区分两者(表示平均值和标准误差,每个条件为 n>10)。请点击此处查看此图的较大版本。
讨论
关联荧光寿命和发射光谱测量可以结合两种方法的优点。事实上,光谱测量本身缺乏灵敏度,而且保持定性。另一方面,荧光寿命是传统定量FRET测量的首选方法,但事实证明,木质素自荧光可能因木质素成分和环境而异。因此,木质素与接受器或木质素结构变化的相互作用不能被区分,因为它们都会导致寿命减少。如所演示的,开发的方法对植物部分木质素和接受分子之间的相互作用进行了明确、敏感和定量的测量。即使对方法的不同步骤进行了严格优化,也必须特别注意以下几点。
关于样品,工厂部分的质量对于确保聚焦成像至关重要。应严格遵守 PEG 嵌入的不同步骤。最后的洗涤步骤对于确保样品中不残留的 PEG 干扰至关重要。此外,缓冲液浓度和pH值在所有测量中应严格保持一致,因为任何变化都会对荧光特性产生强烈的影响。
终生测量也可能很精细。供体的荧光寿命可能不稳定,例如因为高激发。在这种情况下,调整激光功率和变焦可以解决此问题。TCSPC 测量中另一个众所周知的人工制品来源是光子脉冲堆积。事实上,TCSPC 无法测量同一两个激光脉冲之间发射的两个光子的速度。虽然植物样品结构高度结构化,但荧光不均匀,可能导致隐藏的脉冲堆积效应。虽然每秒的光子数仍然低于 1% 的激发限制,但在某些采样区域,光子数可能更高。为了确保没有堆积实验,可以考虑以不同的光子通量测量供体荧光寿命。如果寿命增加,而通量减少,堆积效应正在改变测量。最佳光子通量与捐赠者的寿命稳定性相一起实现。
关于sFLIM衰减曲线分析,我们建议依靠每个单独的曲线拟合,以确保模型准确描述测量值。如果不是这样,首先确保前面提到的人工制品都没有损坏数据。然后,步骤 2.1.4 提供了系统的仪器响应功能 (IRF)。如果 IRF 出现一些异常,请优化光路以最小化它们。也可以使用用于步骤 6.2 期间的装配测量 IRF。最后,在步骤 6.2 中,拟合模型的自由度可以增加到三衰减。但是,单个寿命和比例确定所需的光子数量很高,因此建议仅使用它们来实现步骤 6.4 中更稳定的平均寿命。关于FLIM的详尽资料,其特征18,sFLIM及其应用12,特别是木质素10,可以在文献中找到。
尽管具有挑战性,但使用原生自荧光在植物组织中进行 FRET 测量显示出一些优势。与对活组织进行的FRET测量相比,生物分子之间的相互作用研究往往需要基因工程来表达内在的荧光标记,这里介绍的木质素植物组织提供了天然自动荧光和外向伙伴荧光探头可以很容易地添加,节省大量时间。然而,根据分析的植物种类和可能进行的预处理,自荧光可能会被修改,因此需要仔细描述,并可能需要调整用作探针的荧光。
sFLIM方法必须应用于缺乏催化活性的荧光探头(PEG和dextran)。在植物木质纤维素水解框架中,可以在各种生物量样品中进行酶的相互作用,这可能导致确定定位(细胞和组织)对相互作用强度的影响。下一个优化步骤将是分析步骤的自动化。事实上,通过足够的分析数据,可以部署基于机器学习的分析程序进行自动表型分析,这将提高其可操作性,以快速筛选酶-生物量效率。此外,sFLIM不需要固定样品,并可以很容易地应用于动态酶-木质素相互作用研究。这种独特的方法有可能指导酶工程策略和生物量预处理,以优化木质纤维素的抗性。
披露声明
作者没有什么可透露的。
致谢
范妮·洛朗(FARE)对编制这些数字表示衷心感谢。FRABio研究联合会(里尔大学,CNRS)因提供有利于实现这项工作的技术环境而得到承认。资金来自法国国家研究局(利诺普罗格项目ANR-14-CE05-0026)。
材料
| Name | Company | Catalog Number | Comments |
| Confocal microscope | ZEISS | LSM 710 NLO | for confocal imaging |
| fine brush | to collect sections | ||
| glass vials | for incubations | ||
| high precision microscope cover glasses 170+/-5µm n°1,5# | Marienfeld | 0107032 | saled by Dutscher s.a in France |
| Infra-red pulsed laser | COHERENT | CHAMELEON VISION | For sample excitation |
| Micropipette Research Plus monocanal 20-200µL | Eppendorf | with corresponding tips | |
| Micropipette Research Plus monocanal 2-20µL | Eppendorf | with corresponding tips | |
| Microscope slides ca. 76 x 26 mm ground edges frosted end | Thermo Fisher Scientific | LR45D | |
| microtome blades disposable (pack of 50) | Agar Scientific | T5024 | saled by Oxford Instruments in France |
| mPEG-Rhodamine, 10 kDa | Creative Peg Works | PSB-2263 | |
| mPEG-Rhodamine, 20 kDa | Creative Peg Works | PSB-22642 | |
| mPEG-Rhodamine, 5 kDa | Creative Peg Works | PSB-2264 | |
| nail polish | for mounting | ||
| pH meter five easy plus | Mettler toledo | FEP20 | with electrode |
| poly (ethylene Glycol) average mol wt 1450 | Merck (sigma-Aldrich) | P5402-1kg | for sample embedding |
| razor blades, single edges blades, stainless steel, box of 100 | Agar Scientific | T586 | for fragments preparation saled by Oxford Instruments in France |
| rotary microtome | Microm Microtech | HM 360 | |
| sFLim detector | BECKER-HICKL | SPC 150 | for lifetime acquisition |
| sodium dihydrogen phosphate dihydrate NaH2PO4, 2H2O | Merck (sigma-Aldrich) | 71500 | for buffer solution |
| sodium phosphate dibasic dihydrate Na2HPO4,2H2O | Merck (sigma-Aldrich) | 30435-1kg | for buffer solution, old reference, the new one is 71643-1kg |
| tetramethyl rhodamine isothiocyanate-dextran 10 k Da | Merck (sigma-Aldrich) | R8881-100mg |
参考文献
- Inouye, H., et al. Multiscale deconstruction of molecular architecture in corn stover. Scientific Reports. 4, 3756 (2014).
- Li, X., Zheng, Y. Lignin-enzyme interaction: Mechanism, mitigation approach, modeling, and research prospects. Biotechnology Advances. 35 (4), 466-489 (2017).
- Vogel, J. Unique aspects of the grass cell wall. Current Opinion in Plant Biology. 11 (3), 301-307 (2008).
- Lynd, L. R. The grand challenge of cellulosic biofuels. Nature Biotechnology. 35, 912 (2017).
- Clegg, R. M. Fluorescence resonance energy transfer. Current Opinion in Biotechnology. 6, 103-110 (1995).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. C. Advanced fluorescence microscopy techniques-FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Pietraszewska-Bogiel, A., Gadella, T. W. J. FRET microscopy: from principle to routine technology in cell biology. Journal of Microscopy. 241 (2), 111-118 (2011).
- Herbaut, M., et al. Multimodal analysis of pretreated biomass species highlights generic markers of lignocellulose recalcitrance. Biotechnology for Biofuels. 11, 52 (2018).
- Chabbert, B., et al. Fluorescence techniques can reveal cell wall organization and predict saccharification in pretreated wood biomass. Industrial Crops and Products. 123, 84-92 (2018).
- Terryn, C., Paës, G., Spriet, C. FRET-SLiM on native autofluorescence: a fast and reliable method to study interactions between fluorescent probes and lignin in plant cell wall. Plant Methods. 14 (1), 74 (2018).
- Jovin, T. M., Arndt-Jovin, D. J., Kohen, E. . Cell Structure and Function by Microspectrofluorometry. , 99-117 (1989).
- Spriet, C., et al. Correlated fluorescence lifetime and spectral measurements in living cells. Microscopy Research and Technique. 70 (2), 85-94 (2007).
- Donaldson, L. A., Newman, R. H., Vaidya, A. Nanoscale interactions of polyethylene glycol with thermo-mechanically pre-treated Pinus radiata biofuel substrate. Biotechnology and Bioengineering. 111 (4), 719-725 (2014).
- Herbaut, M., Zoghlami, A., Paës, G. Dynamical assessment of fluorescent probes mobility in poplar cell walls reveals nanopores govern saccharification. Biotechnology for Biofuels. 11 (1), 271 (2018).
- Paës, G., Chabbert, B. Characterization of arabinoxylan / cellulose nanocrystals gels to investigate fluorescent probes mobility in bio-inspired models of plant secondary cell wall. Biomacromolecules. 13, 206-214 (2012).
- Donaldson, L. A., Radotic, K. Fluorescence lifetime imaging of lignin autofluorescence in normal and compression wood. Journal of Microscopy. 251 (2), 178-187 (2013).
- Auxenfans, T., Terryn, C., Paës, G. Seeing biomass recalcitrance through fluorescence. Scientific Reports. 7, 8838 (2017).
- Waharte, F., Spriet, C., Héliot, L. Setup and characterization of a multiphoton FLIM instrument for protein-protein interaction measurements in living cells. Cytometry A. 4, 299-306 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。