Method Article
Messung von Wechselwirkungen zwischen fluoreszierenden Sonden und Lignin in Pflanzenabschnitten durch sFLIM basierend auf nativer Autofluoreszenz
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein originelles Setup, bei dem Spektral- und Fluoreszenzlebensdauermessungen kombiniert werden, um die Förster-Resonanzenergieübertragung (FRET) zwischen rhodeminbasierten Fluoreszenzsonden und Ligninpolymer direkt in dicken Pflanzenabschnitten zu bewerten.
Zusammenfassung
In lignozellulosehaltiger Biomasse (LB) wird die Aktivität von Enzymen durch das Auftreten unspezifischer Wechselwirkungen mit Lignin während des Hydrolyseprozesses eingeschränkt, der Enzyme weit von ihrem Substrat entfernt hält. Die Charakterisierung dieser komplexen Wechselwirkungen ist daher eine Herausforderung bei komplexen Substraten wie LB. Die Methode misst hier molekulare Wechselwirkungen zwischen fluorophor-markierten Molekülen und nativem autofluoreszierendem Lignin, das durch Förster Resonanzenergietransfer (FRET) aufgedeckt wird. Im Gegensatz zu FRET-Messungen in lebenden Zellen mit zwei exogenen Fluorophoren sind FRET-Messungen in Pflanzen mit Lignin aufgrund ihrer komplexen Autofluoreszenz nicht trivial. Wir haben eine ursprüngliche Akquisitions- und Analysepipeline mit korrelierter Beobachtung von zwei sich ergänzenden Eigenschaften der Fluoreszenz entwickelt: Fluoreszenzemission und Lebensdauer. sFLIM (spektrale und fluoreszierende Lebensdauer-Bildgebungsmikroskopie) liefert die Quantifizierung dieser Wechselwirkungen mit hoher Empfindlichkeit und zeigt unterschiedliche Wechselwirkungsniveaus zwischen Biomolekülen und Lignin auf.
Einleitung
Die Hydrolyse von Lignocellulose in monomere Zucker wie Glukose erfordert Enzyme. Ihre Aktivität ist bekanntlich durch die Etablierung unspezifischer Wechselwirkungen zwischen Enzymen und Lignin1,2eingeschränkt, wobei letzteres ein hydrophobes Polymer und ein wichtiger Bestandteil von Lignocellulose3ist. Daher ist die quantitative Messung solcher Wechselwirkungen direkt auf der zellulären Skala eine Herausforderung, die angegangen werden muss, um die enzymkatalytische Enzymaktivität und die Lignocellulose-Vorbehandlung zu optimieren4.
Die Förster-Resonanzenergieübertragung (FRET) ist eine Methode der Wahl, um die Wechselwirkung von Biomolekülen vor Ort zu untersuchen. Diese nicht strahlungsbestrahlungsige Energieübertragung kann zwischen einem Spender und einem Akzeptor fluorophor auftreten, wenn sie unterschiedliche Bedingungen erfüllen. Das Emissionsspektrum der Spender muss sich zumindest teilweise überdas Erregungsspektrum der Akzeptoren überschneiden. Die Wahl der Fluorophore ist daher für solche Experimente von entscheidender Bedeutung. Dann nimmt die Übertragungseffizienz mit der sechsten Leistung ihrer Entfernung5 ab und tritt nur auf, wenn sich beide Moleküle in unmittelbarer Nähe befinden (typischerweise im Nanometerbereich). Andere Eventualitäten können die Übertragungseffizienz wie die Dipol-Dipol-Ausrichtung verändern, werden jedoch gemildert, wenn Fluorophore flexibel sind.
FRET kann mit verschiedenen Techniken gemessen werden und detaillierte Beschreibungen finden Sie in Literatur6,7. Kurz gesagt, die wichtigsten Methoden stützen sich auf: i) sensibilisierte Emission, bei der die Variation der Akzeptor-Emissionsfluoreszenz verfolgt wird und hauptsächlich qualitative Ergebnisse liefert; ii) Akzeptanz-Photobleichung, bei der die Spenderemissionsfluoreszenz vor und nach dem Aufnahmephotobleichvorgang gemessen wird (in diesem Fall können genauere FRET-Schätzungen erreicht werden, erfordern jedoch eine starke Laserleistung, die auf feste Proben angewendet wird); und iii) Lebensdauermessung, die für den Spender in Gegenwart des Akzeptors abnimmt. Diese Methode erfordert spezifische Instrumente und ermöglicht präzise und empfindliche Wechselwirkungsmessungen zwischen Fluorophoren. Betrachtet man die FRET-Messung zwischen Fluoreszenzsonden und Lignocellulose, so besteht die Hauptschwierigkeit darin, dass Lignocellulose kein einziges gut charakterisiertes Fluorophor ist: Es hat eine starke native und spektral breite Autofluoreszenz, die hauptsächlich aus Lignin stammt und von der Biomasseart8,9abhängt.
In diesem Papier schlagen wir ein neues und originelles Verfahren vor, das an Holz-/Pflanzenproben angepasst ist. Diese sFLIM-basierte Methode öffnet den Weg für quantitative FRET-Messungen zwischen Fluoreszenzsonden und Lignin in nativen Lignocellulose-Proben.
Protokoll
1. Probenvorbereitung
HINWEIS: Die aufeinanderfolgenden Schritte zur Vorbereitung der Proben sind in Abbildung 1beschrieben.
- Pflanzenprobenvorbereitung
- Aus Holzstämmen oder Fragmenten, schneiden Sie 1 cm lange Proben mit Rasierklingen, ohne ihre Struktur zu beschädigen.
- Einbetten von Proben in das Medium Polyethylenglykol (PEG), indem Sie sie in aufeinander folgende Lösungen mit erhöhter PEG-Konzentration eintauchen, die in Wasser verdünnt wird, bis sie 100% PEG erreichen.
- Legen Sie die Probe unter Vakuum, um Wasser zu entfernen.
- Proben in 30% v/v PEG für 24 h vorsichtig rühren.
- Proben in 50% v/v PEG für 24 h vorsichtig rühren.
- Proben in 100% PEG für 24 h bei 70 °C vorsichtig rühren (reine PEG ist bei Raumtemperatur fest).
- Legen Sie Proben in Kapseln bei 70 °C (auf einer Kochplatte) und verringern Sie die Temperatur schrittweise, bis die Raumtemperatur erreicht ist.
- Bereiten Sie sorgfältig 30-60 'm Dicke flache Abschnitte aus diesen PEG-Blöcken mit einem Mikrotom und Einwegklingen.
- Sammeln und waschen Abschnitte in drei aufeinanderfolgenden Bädern von Wasser für 5 min, um PEG aus den Abschnitten zu entfernen.
- Fluoreszierende Sondenvorbereitung
- Pufferlösung von 30 mM Phosphat bei pH 6,0 vorbereiten.
- Wiegen PEG rhand dextran rhodamine Sonde Pulver.
- Sondenpulver in den Puffer unter kontinuierlichem Rühren in einer Glasdurchstechflasche für 1 h im Dunkeln bei einer Endkonzentration von 0,1 g/L auflösen.
- Pflanzenprobenfärbung
- Inkubieren Sie Abschnitte mit 500 l der Leuchtstoffsonde (siehe 1.2.3) für 72 h (kein Rühren) in einem Kunststoffrohr (nicht mehr als 3 Abschnitte pro Rohr) im Dunkeln.
- Nehmen Sie einen Abschnitt mit einer Bürste auf, adsorbieren Sie den Puffer mit einem sauberen Blatt (vermeiden Sie das Trocknen des Abschnitts), und montieren Sie dann die inkubierten Abschnitte zwischen einem Deckglas und einem #1.5H-Abdeckungsslip.
2. Fluoreszenzlebensdauer und Spektralmessungssystemkalibrierung
HINWEIS: Der komplette Workflow für die sFLIM-Messung ist in Abbildung 2dargestellt.
- Bestimmen Sie die Spektralfensterbreite des sFLIM-Detektors.
- Harnstoffkristalle in eine Kulturbox mit einem 0,17 m Glasboden geben.
- Legen Sie die Kulturbox auf einen Mikroskopprobenhalter und wählen Sie das 20-fache Objektiv aus.
- Wählen Sie einen Ti:Sa-Laser mit einer Wellenlänge von 900 nm und einer Leistung von 2 % aus, und schalten Sie das Scannen ein.
- Sammeln Sie das zweite harmonische Signal auf dem sFLIM-Detektor.
ANMERKUNG: Das zweite harmonische Signal wird bei genau der halben Anregungswellenlänge von 450 nm emittiert; Diese Maßnahme bietet zwar augenblicklich, bietet aber auch die instrumentelle Reaktionsfunktion des Systems. - Stellen Sie die Wellenlänge der Laseranregung schrittweise von 900 bis 980 nm ein, bis das zweite harmonische Signal im zweiten Spektralkanal (462,5 nm) gesammelt wird.
- Bestimmen Sie die Länge des Spektralfensters (12,5 nm).
- Wenn sich der Spektralbereich von den Erwartungen unterscheidet, beheben Sie die Fehlerbehebung im Folgenden.
- Stellen Sie den Laser auf 910 nm ein.
- Bewegen Sie die Gitterposition mit einem Scrollrad, um das zweite harmonische Signal nur auf dem ersten Kanal zu messen (erste Kanalgrenze).
- Stellen Sie den Laser auf 935 nm ein.
- Bewegen Sie die Gitterposition mit einem Scrollrad, um das zweite harmonische Signal nur auf dem ersten Kanal zu messen (zweite Kanalgrenze).
- Kalibrierung der gesamten Spektrometerkanäle
- Setzen Sie den Spiegel auf die Mikroskopstufe.
- Wählen Sie den sichtbaren kontinuierlichen Laser (458 nm, 1% Leistung).
- Sammeln Sie das Reflexionssignal auf dem sFLIM-Detektor und prüfen Sie, ob Photonen im entsprechenden Spektralkanal gemessen werden.
- Wiederholen Sie Schritt 2.2.2 und 2.2.3 mit allen verfügbaren Kontinuierlichen Lasern (514 nm, 561 nm und 633 nm).
- Wenn sich der Spektralkanal von den Erwartungen unterscheidet, bewegen Sie die Gitterposition mit dem Scrollrad und wiederholen Sie die Schritte 2.1 und 2.2.
3. Probenfluoreszenzcharakterisierung
- In einem Spektrofluorometer, das mit einem Filmhalterzubehör (z. B. Jasco FP-8500-Instrument) ausgestattet ist, legen Sie die Pflanzensektionsprobe (nicht mit der Fluoreszenzsonde inkubiert) auf.
- Messen Sie die Fluoreszenzemission typischerweise im Bereich von 300-600 nm, während die Probe typischerweise im Bereich von 250-550 nm spannend wird.
- Zeichnen Sie die Fluoreszenzintensität im Vergleich zu Anregungs- und Emissionswellenlängen, um eine 3D-Fluoreszenzkarte zu zeichnen.
- Bestimmen Sie die maximale Anregungs-/Emissionsfläche aus dem Plot.
4. Spektrale FRET-Messung
- Autofluoreszenzkalibrierung
- Wählen Sie das Ziel 20x (NA: 0.8).
- Stellen Sie die Zwei-Photonen-Lasererregung auf 750 nm.
- Platzieren Sie den Weizenstroh (WS) allein Pflanzenabschnitt zwischen der Rutsche und dem Deckelrutsch.
- Wenden Sie die folgenden Parameter in der Software an. Wechseln Sie in den Lambda-Modus. Wählen Sie den Spektraldetektor ChS mit einer Auflösung von 9,7 nm. Wählen Sie den Spektralbereich zwischen 420 und 722 nm aus.
- Erfassen Sie das Bild.
- Bestimmen Sie die Spenderemissionsspitze (470 nm mit diesem Setup).
- Kalibrierung des Akzeptors
- Legen Sie rhodaminbasierte Fluoreszenzsonden in eine Kulturbox mit einem 0,17 m-Glasboden.
- Erfassen Sie das Bild mit derselben Einstellung.
- Bestimmen Sie die Emissionsspitze des Akzeptors (570 nm mit diesem Setup).
- Bestimmen Sie den Spektralbereich mit dem maximalen "WS alone"-Signal und kein Akzeptorsignal als Spender-Only-Emission für sFLIM-Messungen (460-490 nm mit diesem Setup).
- Probenmessung
- Platzieren Sie den gebeizten Pflanzenabschnitt zwischen der Rutsche und dem Deckel.
- Erfassen Sie das Bild mit derselben Einstellung.
- Speichern Sie die lsm-Datei.
- Qualitativ verbinden Sie ein starkes FRET-Ereignis mit einer Abnahme der Spenderemissionsspitze im Vergleich zur "WS-Allein-Probe" und einer Erhöhung der Akzeptor-Emissionsspitze im Vergleich zur Rhodamine-Probe.
5. sFLIM-Messungen
HINWEIS: Für die sFLIM-Einrichtung ist das verwendete System eine Zeitdomänen-SFLIM-Einrichtung, wie zuvorbeschrieben 10. Ein aufrechtes Mikroskop und verschiedene zeitkorrelierte Einzel-Photonenzählkarten und Konfokalmikroskophersteller können verwendet werden und das Protokoll sollte entsprechend angepasst werden.
- Schalten Sie das System in den sFLIM-Modus.
- Stellen Sie das konfokale Mikroskop wie in 4.1.1 und 4.1.2 beschrieben ein.
- Wechseln Sie in den Nicht-Descanned-Modus in der Software, um fluoreszierende Photonen an den sFLIM-Detektor zu senden.
- Legen Sie die sFLIM-Erfassung auf den Aktivierungsmodus fest, damit die Photonzählung auf dem SPC150 möglich ist.
- Wählen Sie 30 s Zeitsammlung auf SPC150.
- Überprüfen Sie, ob der CFD zwischen 1 x 105 und 1 x 106liegt.
VORSICHT: Stellen Sie sicher, dass die Anzahl der auf der TCSPC-Karte gemessenen Photonen immer weniger als 1 % der Laseranregungsfrequenz beträgt (in diesem Setup beträgt die Laseranregungsfrequenz 80 Mhz und die Erkennungsrate darf 800 kHz in einem Pixel nicht überschreiten, um einen Aufhäufungseffekt zu vermeiden11).
- Platzieren Sie den Werksabschnitt "WS alone" zwischen der Rutsche und dem Deckblatt.
- Stellen Sie die Software auf den kontinuierlichen Modus ein, um den Laserscan zu ermöglichen.
- Wählen Sie den Messbereich auf der Probe aus.
- Klicken Sie auf Start auf dem SPC150.
- Speichern Sie die sdt-Datei.
- Wiederholen Sie den Vorgang für mindestens 10 Proben pro Bedingung.
- Platzieren Sie den gebeizten Pflanzenabschnitt zwischen der Rutsche und dem Deckel.
- Wiederholen Sie die Schritte 5.2.1 - 5.2.5.
6. sFLIM-Analyse
- Wählen Sie sFLIM-Daten erworbene Datei auf "WS allein" und importieren Sie sie in die SPCImage-Software mit Datei | Importieren.
- Wählen Sie Anpassungsparameter aus.
- Von Option | Modell, wählen Sie Unvollständige Multi-Exponentials: 12,5 ns.
- Von Option | Voreinstellungen, wählen Sie Automatisch Instrumentale Antwort berechnenaus .
- Wählen Sie im rechten Menü des Hauptfensters das 2 exponentielle Anpassungsmodell aus:
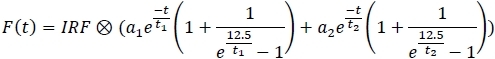
- Wenden Sie für jeden Kanal das Anpassungsmodell an, und speichern Sie die Anpassungsparameter in einer Kalkulationstabelle (a1, a2, t1, t2).
- Für den Vergleich zwischen Kanälen und Experimenten wird die mittlere Fluoreszenzlebensdauer in einer Kalkulationstabelle berechnet (Tm):
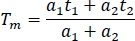
- Berechnen Sie die mittlere Lebensdauer aller Samples (mindestens 10) in allen Kanälen.
- Analysieren Sie Tm auf Spenderkanälen (von Kanal 1 bis 3: 460-490 nm) und bestimmen Sie den dedizierten Kanal (Kanal 2 entspricht 467,5 - 480 nm), der die höchste Photonenzahl anzeigt und der lininmaximalen Emission entspricht. Werte aus Kanal 2 müssen in Schritt 6.7 verwendet werden.
- Wählen Sie sFLIM-Daten erworbene Datei auf gebeizt WS und importieren Sie sie in die SPCImage-Software.
- Wiederholen Sie die Schritte 6.1-6.4.
- Berechnen Sie die FRET-Effizienz EFRET für den Spender im vorherigen ausgewählten Kanal WS Alone (TmD) und aus gebeizter Pflanzenprobe (TmDA):
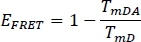
- Vergleichen Sie sFLIM- und EFRET-Werte zwischen WS und Beispiel.
- Betrachten Sie eine positive EFRET, die mit einer homogenen Lebensdauerabnahme zwischen WS und der zu analysierenden Probe als FRET-Ereignis verbunden ist (detailssiehe repräsentative Ergebnisse und Arbeiten von Spriet et al.12 und Terryn et al.10).
- Betrachten Sie eine Lebenslange Nabenabsenkung, die anders verteilt ist, als auf eine Mischung aus FRET- und Lignin-Verdichtungsstufe zurückzuführen und interpretieren Sie sie nicht als molekulare Wechselwirkungen.
- Betrachten Sie keine Lebensdauer-Modifikation als ein Fehlen von messbarem FRET-Signal, aber nicht als ein Mangel an Interaktion mit Lignin
Ergebnisse
Um die sFLIM-Fähigkeit zur Sezieren molekularer Wechselwirkungen zwischen Lignin und fluoreszierend getaggten Molekülen zu demonstrieren, verwendeten wir zunächst drei verschiedene Proben(Abbildung 3):natives Weizenstroh (WS), natives Weizenstroh, das mit PEG mit Rhodalin (PR10) beglastet ist, und natives Weizenstroh mit Dextran, das mit Rhodalin (DR10) markiert ist. PR10 ist dafür bekannt, mit Lignin zu interagieren, während DR10 inert13,14,15sein soll. sFLIM-Kurven (Abbildung 3, oben) zeigen einige Änderungen, die zwischen dem Referenzbeispiel (WS) und zwei Interaktionsfällen (DR10 und PR10) erreicht werden können. Tatsächlich kann man zunächst leicht feststellen, dass die Fluoreszenz in Spektralregionen, die dem Rhodininat-Emissionsbereich entsprechen, zunimmt. Eine sorgfältige Beobachtung der drei Photonenzerfallskurven des ersten Kanals zeigt auch eine stärkere Beugung für DR10 als für PR10. Nach dem Anpassen der Photonenzerfallskurven und der Berechnung der mittleren Fluoreszenzlebensdauer jedes Kanals wird die FRET-Signatur deutlicher(Abbildung 3, unten). Während die Fluoreszenzlebensdauer alternativ entlang des Fluoreszenzspektrums für die WS-Probe zunimmt und abnimmt, wird sowohl für PR10 als auch für DR10 eine klare FRET-Signatur mit: 1) einem konstanten Lebensdauerwert im emissionsfreien Emissionskanal (3 erste Kanäle, in blau) beobachtet; und 2) eine zunehmende Fluoreszenzlebensdauer im Spektralkanal, die einem zunehmenden Beitrag des Hochlebensdauerspenderfluorophors entspricht.
Nach der eindeutigen FR-Lebensdauer (Kanal 2) ermöglicht der Vergleich der Lignin-Fluoreszenzlebensdauer (Kanal 2) die Quantifizierung der Lebensdauerabnahme zwischen WS (0,47 ns), DR10 (0,42 ns) und PR10 (0,36 ns) und zeigt somit molekulare Wechselwirkungen zwischen Lignin und PR10 und DR10 mit einer stärkeren Affinität zu PR10.
Um die Relevanz dieser Methode für die Quantifizierung verschiedener Wechselwirkungsebenen zu veranschaulichen, wählen wir drei weitere Proben aus, die die Zugänglichkeit von Enzymen auf behandelten Pflanzenproben imitieren: säurebehandeltes WS (AWS), in Kombination mit PR von zwei kontrastreichen Molekulargewichten von 5 kDa und 20 kDa (PR5 und PR20). Nach sorgfältiger Prüfung der sFLIM-Signaturen wird die Lebensdauer der Ligninfluoreszenz extrahiert (Abbildung 4). Wie bereits erwähnt, kann die Lebensdauer der Ligninfluoreszenz durch seine Umgebung verändert werden16,17. Nach der Säurebehandlung werden die Fluoreszenzlebensdauermessungen in AWS (0,28 ns) niedriger als bisher für WS (0,47 ns) gemessen, was die Anforderung des sFLIM-Verfahrens für eine eindeutige Interpretation der Lebensdauerabnahme und die Notwendigkeit negativer Kontrollen für jede getestete Bedingung bestätigt. Wie erwartet wird beim Hinzufügen von PR zu AWS ein starker Rückgang der Lebensdauer beobachtet, während es mit dem Lignin interagiert. Darüber hinaus ist die Wechselwirkung mit PR5 (0,14 ns) stärker als PR20 (0,16 ns), was mit ihrer hydrodynamischen Radiusmessung (2,3 nm bzw. 4,8 nm für PR5 bzw. PR20) übereinstimmt, was zu unterschiedlichen serischen Einschränkungen und damit zu einer höheren Zugänglichkeit von PR5 zu Lignin führt.
Beide Experimente zeigen die Relevanz dieser Methode zur feinbeurteilung der Lignin-Wechselwirkungen mit Enzymen, abhängig von ihrer Größe und der Vorbehandlung von Pflanzenproben.

Abbildung 1: Verschiedene Vorbereitungsschritte der Proben. Weizenstroh (WS) (A) wird zuerst in der Größe reduziert (B) in PEG Medium (C) eingebettet werden. Der Block wird mit einem Mikrotom geschnitten, das mit Einwegklingen (D) ausgestattet ist. Nach dem Waschen werden die resultierenden Abschnitte (E) zur Inkubation in PEG oder dextran-getaggt-rhodamine-Lösung (F) platziert. Für sFLIM-Messungen sind beschriftete Abschnitte montiert (G). Die Skalenstäbe sind 2 cm (A), 1 cm (B und C), 200 m (E und G). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
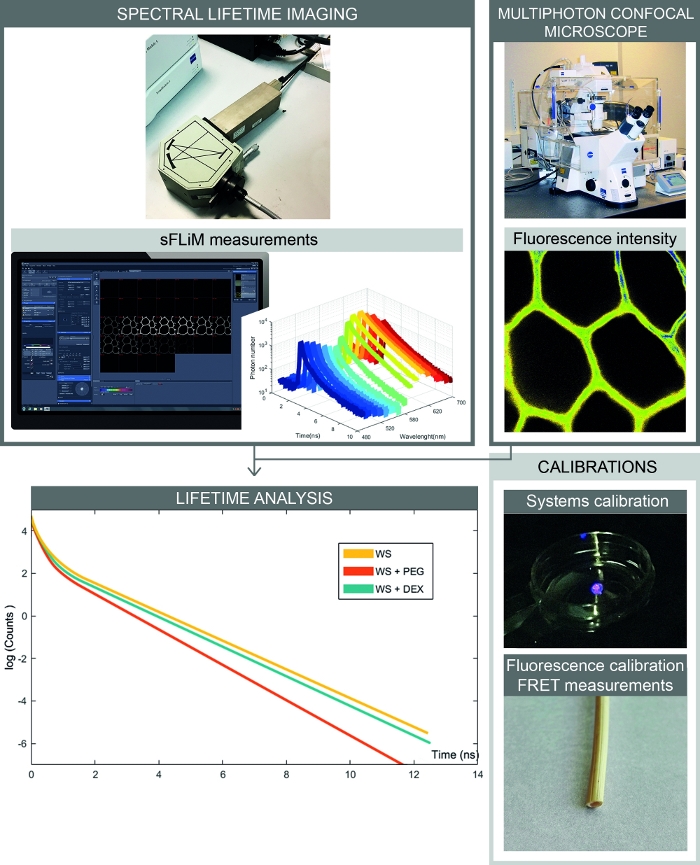
Abbildung 2: Vollständiger Workflow von spektralen FRET-basierten Interaktionsmessungen. Die Abbildung zeigt das Setup, das spektrale Fluoreszenzintensität und Lebensdauermessungen kombiniert. Spektrale Fluoreszenzbilder werden mit einem konfokalen Mikroskop erfasst, und sequenzielle Fluoreszenzlebensdauern für jeden Spektralbereich werden mit dem sFLIM-Detektor gemessen. Die Analyse von Photonenzerfallskurven ermöglicht eine genaue Bestimmung der Wechselwirkungen zwischen der Probe und molekülen von Interesse. Kalibrierungen müssen verarbeitet werden, um Artefakte zu vermeiden. Zunächst muss der sFLIM-Detektor spektral kalibriert und seine instrumentelle Reaktionsfunktion überprüft werden. Zweitens muss das komplexe Autofluoreszenzsignal für jede Probe präzise kalibriert werden, um die Fluoreszenzlebensdauer in jedem Kanal vor Zugabe eines Akzeptormoleküls zu bestimmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Repräsentative sFLIM-Messungen. sFLIM-Kurven (Top-Panel) wurden auf einheimischem Weizenstroh (WS), WS mit PEG mit Rhodamine (WS+PEG) und nativem Weizenstroh mit Dextran mit Rhodamine (WS+DEX) begrüsst erworben. Für jede Probe wurden sFLIM-Kurven mit einem bi-exponentiellen Zerfallsmodell ausgestattet und die mittlere Fluoreszenzlebensdauer für jeden Kanal (untere Platte) berechnet. WS+PEG- und WS+DEX-Proben zeigen eine Abnahme der Fluoreszenzlebensdauer im Kanal, die nur der Autofluoreszenz (drei erste Balken) entspricht, die mit einer Lebensdauererhöhung des Kanals verbunden ist, die einer gemischten Emission von Autofluoreszenz und Rhodamin entspricht. Dieses Verhalten ist charakteristisch für ein FRET-Ereignis zwischen Lignin- und Rhodaamin-markierten Molekülen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
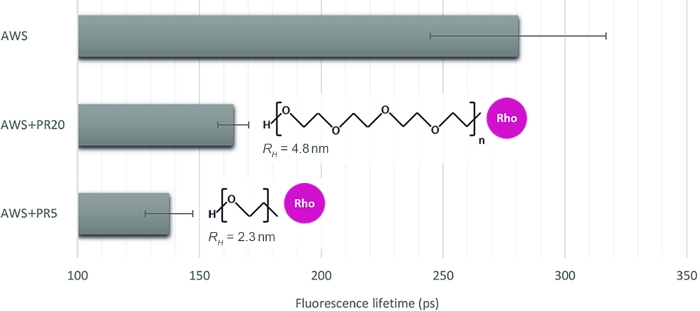
Abbildung 4: Fluoreszenzlebensdaueranalyse des Kanals entsprechend der Lignin-Autofluoreszenz. Nach der Validierung eines FRET-Ereignisses auf der Grundlage der sFLIM-Signatur wurde die mittlere Fluoreszenzlebensdauer an säurebehandeltem WS (AWS) in Kombination mit PR5 bzw. PR20 (5 kDa bzw. 20 kDa) gemessen. Während beide PR-Proben eine lebenslange Abnahme darstellen, ist die kleinere durch eine stärkere Lebensdauerreduktion gekennzeichnet, die eine stärkere molekulare Wechselwirkung mit Lignin offenbart. Die Methode ist daher sensibel genug, um zwischen beiden zu unterscheiden (Mittelwert und Standardfehler werden dargestellt, n>10 pro Bedingung). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Korrelation von Fluoreszenzlebensdauer- und Emissionsspektrummessungen ermöglicht die Kombination von Vorteilen beider Methoden. Tatsächlich mangelt es allein den Spektralmessungen an Sensibilität und sie bleiben qualitativ. Auf der anderen Seite ist die Fluoreszenzlebensdauer die Methode der Wahl für traditionelle quantitative FRET-Messungen, aber es wurde gezeigt, dass die Lignin-Autofluoreszenz je nach Ligninzusammensetzung und Umgebung variieren kann16. Daher können Lignin-Wechselwirkungen mit einem Akzeptor oder Lignin-Strukturveränderungen nicht diskriminiert werden, da beide zu einer lebenslangen Abnahme führen. Wie gezeigt, ermöglicht die entwickelte Methode eine eindeutige, empfindliche und quantitative Messung von Wechselwirkungen zwischen Lignin und Akzeptormolekülen in Pflanzenabschnitten. Auch wenn die verschiedenen Schritte der Methode rigoros optimiert wurden, ist insbesondere bei den folgenden Punkten Vorsicht geboten.
In Bezug auf die Proben ist die Qualität des Pflanzenteils entscheidend, um eine fokussische Bildgebung zu gewährleisten. Die verschiedenen Schritte für die PEG-Einbettung sollten strikt befolgt werden. Der letzte Waschschritt ist wichtig, um sicherzustellen, dass keine Interferenzen von PEG in den Proben verbleiben. Darüber hinaus sollten Pufferkonzentration und pH-Wert für alle Messungen streng identisch gehalten werden, da jede Änderung einen starken Einfluss auf die Fluoreszenzeigenschaften haben kann.
Die Lebensdauermessung kann auch empfindlich sein. Die Fluoreszenzlebensdauer des Spenders kann instabil sein, z. B. aufgrund einer hohen Anregung. In einem solchen Fall kann das Tuning der Laserleistung und des Zooms das Problem beheben. Eine weitere bekannte Quelle von Artefakten in TCSPC-Messungen ist photonenpulse pile-up. Tatsächlich kann TCSPC die Geschwindigkeit von zwei Photonen, die zwischen denselben beiden Laserpulsen emittiert werden, nicht messen. Während Pflanzenproben stark strukturiert sind, ist die Fluoreszenz nicht homogen und kann zu einem versteckten Puls-Pfup-Effekt führen. Während die Anzahl der Photonen pro Sekunde unter der Anregungsgrenze von 1% bleibt, kann sie in einigen Probenbereichen höher sein. Um keine Anhäufungsexperimente zu gewährleisten, kann die Messung der Spenderfluoreszenzlebensdauer bei einem anderen Photonenfluss in Betracht gezogen werden. Wenn die Lebensdauer steigt, während der Fluss abnimmt, ändert ein Anhäufungseffekt die Messungen. Der optimale Photonenfluss wird mit der Lebensdauer stabilität des Spenders erreicht.
In Bezug auf die sFLIM-Zerfallskurvenanalyse empfehlen wir, sich auf jede einzelne Kurvenanpassung zu verlassen, um sicherzustellen, dass das Modell die Messungen genau beschreibt. Wenn dies nicht der Fall ist, stellen Sie zunächst sicher, dass keines der zuvor genannten Artefakte die Daten beschädigt hat. Anschließend stellt Schritt 2.1.4 die Instrumentionfunktion (IRF) des Systems bereit. Wenn IRF einige Anomalien enthält, optimieren Sie den optischen Pfad, um sie zu minimieren. Ein gemessener IRF für die Montage in Schritt 6.2 kann ebenfalls verwendet werden. Schließlich können die Freiheitsgrade des passenden Modells in Schritt 6.2 auf einen dreiexponentiellen Zerfall erhöht werden. Die Anzahl der Photonen, die für die individuelle Lebensdauer und Proportionsbestimmung benötigt werden, ist jedoch hoch und es wird daher empfohlen, sie nur zu verwenden, um eine stabilere mittlere Lebensdauer ab Schritt 6.4 zu erreichen. Ausführlichere Informationen über FLIM, seine Charakterisierung18, sFLIM und seine Anwendung12 insbesondere auf Lignin10, finden Sie in der Literatur.
Obwohl die FRET-Messung in Pflanzengeweben mit nativer Autofluoreszenz anspruchsvoll ist, zeigt sich einige Vorteile. Im Vergleich zu FRET-Messungen an lebenden Geweben, bei denen Interaktionsstudien zwischen Biomolekülen häufig von der Gentechnik verlangt, um intrinsische Fluoreszenzmarker, lignifiziertes Pflanzengewebe, wie hier vorgestellt, auszudrücken, Autofluoreszenz und extrinsische Partner-Fluoreszenzsonden können leicht hinzugefügt werden, was viel Zeit spart. Abhängig von den analysierten Pflanzenarten und möglichen Vorbehandlungen ist es jedoch wahrscheinlich, dass die Autofluoreszenz modifiziert wird, so dass sie sorgfältig charakterisiert und Fluorophor als Sonden verwendet werden muss.
Die sFLIM-Methode muss auf fluoreszierende Sonden ohne katalytische Aktivität (PEG und Dextran) angewendet werden. Im Rahmen der pflanzenlignozellulosezellulosehydrolyse könnten Wechselwirkungen von Enzymen in verschiedenen Biomasseproben durchgeführt werden, was möglicherweise zur Bestimmung der Auswirkungen der Lokalisation (Zellen und Gewebe) auf die Wechselwirkungsstärke führen könnte. Der nächste Optimierungsschritt ist die Automatisierung des Analyseschritts. Tatsächlich könnte mit genügend analysierten Daten ein maschinelles Lernverfahren für die automatisierte Phänotypanalyse eingesetzt werden, das seine Amenability für ein schnelles Enzym-Biomasse-Effizienzscreening erhöhen würde. Darüber hinaus erfordert sFLIM keine Fixierung der Probe und kann leicht auf dynamische Enzym-Lignin-Interaktionsstudien angewendet werden. Eine solche einzigartige Methode ist wahrscheinlich, um Enzym-Engineering-Strategie und Biomasse-Vorbehandlung zu leiten, um lignocellulose Valorisierung zu optimieren.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Fanny Laurent (FARE) wird herzlich für die Vorbereitung der Figuren gedankt. Die Forschungsföderation FRABio (Universität Lille, CNRS) ist dafür anerkannt, dass sie das technische Umfeld bietet, das der Erreichung dieser Arbeiten förderlich ist. Die Finanzierung wurde von der französischen Nationalen Forschungsagentur (LIGNOPROG-Projekt ANR-14-CE05-0026) erhalten.
Materialien
| Name | Company | Catalog Number | Comments |
| Confocal microscope | ZEISS | LSM 710 NLO | for confocal imaging |
| fine brush | to collect sections | ||
| glass vials | for incubations | ||
| high precision microscope cover glasses 170+/-5µm n°1,5# | Marienfeld | 0107032 | saled by Dutscher s.a in France |
| Infra-red pulsed laser | COHERENT | CHAMELEON VISION | For sample excitation |
| Micropipette Research Plus monocanal 20-200µL | Eppendorf | with corresponding tips | |
| Micropipette Research Plus monocanal 2-20µL | Eppendorf | with corresponding tips | |
| Microscope slides ca. 76 x 26 mm ground edges frosted end | Thermo Fisher Scientific | LR45D | |
| microtome blades disposable (pack of 50) | Agar Scientific | T5024 | saled by Oxford Instruments in France |
| mPEG-Rhodamine, 10 kDa | Creative Peg Works | PSB-2263 | |
| mPEG-Rhodamine, 20 kDa | Creative Peg Works | PSB-22642 | |
| mPEG-Rhodamine, 5 kDa | Creative Peg Works | PSB-2264 | |
| nail polish | for mounting | ||
| pH meter five easy plus | Mettler toledo | FEP20 | with electrode |
| poly (ethylene Glycol) average mol wt 1450 | Merck (sigma-Aldrich) | P5402-1kg | for sample embedding |
| razor blades, single edges blades, stainless steel, box of 100 | Agar Scientific | T586 | for fragments preparation saled by Oxford Instruments in France |
| rotary microtome | Microm Microtech | HM 360 | |
| sFLim detector | BECKER-HICKL | SPC 150 | for lifetime acquisition |
| sodium dihydrogen phosphate dihydrate NaH2PO4, 2H2O | Merck (sigma-Aldrich) | 71500 | for buffer solution |
| sodium phosphate dibasic dihydrate Na2HPO4,2H2O | Merck (sigma-Aldrich) | 30435-1kg | for buffer solution, old reference, the new one is 71643-1kg |
| tetramethyl rhodamine isothiocyanate-dextran 10 k Da | Merck (sigma-Aldrich) | R8881-100mg |
Referenzen
- Inouye, H., et al. Multiscale deconstruction of molecular architecture in corn stover. Scientific Reports. 4, 3756 (2014).
- Li, X., Zheng, Y. Lignin-enzyme interaction: Mechanism, mitigation approach, modeling, and research prospects. Biotechnology Advances. 35 (4), 466-489 (2017).
- Vogel, J. Unique aspects of the grass cell wall. Current Opinion in Plant Biology. 11 (3), 301-307 (2008).
- Lynd, L. R. The grand challenge of cellulosic biofuels. Nature Biotechnology. 35, 912 (2017).
- Clegg, R. M. Fluorescence resonance energy transfer. Current Opinion in Biotechnology. 6, 103-110 (1995).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. C. Advanced fluorescence microscopy techniques-FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Pietraszewska-Bogiel, A., Gadella, T. W. J. FRET microscopy: from principle to routine technology in cell biology. Journal of Microscopy. 241 (2), 111-118 (2011).
- Herbaut, M., et al. Multimodal analysis of pretreated biomass species highlights generic markers of lignocellulose recalcitrance. Biotechnology for Biofuels. 11, 52 (2018).
- Chabbert, B., et al. Fluorescence techniques can reveal cell wall organization and predict saccharification in pretreated wood biomass. Industrial Crops and Products. 123, 84-92 (2018).
- Terryn, C., Paës, G., Spriet, C. FRET-SLiM on native autofluorescence: a fast and reliable method to study interactions between fluorescent probes and lignin in plant cell wall. Plant Methods. 14 (1), 74 (2018).
- Jovin, T. M., Arndt-Jovin, D. J., Kohen, E. . Cell Structure and Function by Microspectrofluorometry. , 99-117 (1989).
- Spriet, C., et al. Correlated fluorescence lifetime and spectral measurements in living cells. Microscopy Research and Technique. 70 (2), 85-94 (2007).
- Donaldson, L. A., Newman, R. H., Vaidya, A. Nanoscale interactions of polyethylene glycol with thermo-mechanically pre-treated Pinus radiata biofuel substrate. Biotechnology and Bioengineering. 111 (4), 719-725 (2014).
- Herbaut, M., Zoghlami, A., Paës, G. Dynamical assessment of fluorescent probes mobility in poplar cell walls reveals nanopores govern saccharification. Biotechnology for Biofuels. 11 (1), 271 (2018).
- Paës, G., Chabbert, B. Characterization of arabinoxylan / cellulose nanocrystals gels to investigate fluorescent probes mobility in bio-inspired models of plant secondary cell wall. Biomacromolecules. 13, 206-214 (2012).
- Donaldson, L. A., Radotic, K. Fluorescence lifetime imaging of lignin autofluorescence in normal and compression wood. Journal of Microscopy. 251 (2), 178-187 (2013).
- Auxenfans, T., Terryn, C., Paës, G. Seeing biomass recalcitrance through fluorescence. Scientific Reports. 7, 8838 (2017).
- Waharte, F., Spriet, C., Héliot, L. Setup and characterization of a multiphoton FLIM instrument for protein-protein interaction measurements in living cells. Cytometry A. 4, 299-306 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten