Method Article
מדידת אינטראקציות בין הפלורסנט לליגנין בסעיפים צמחיים על ידי sFLIM בהתבסס על מבוסס על קרינה פלואורסצנטית מקורית
In This Article
Summary
פרוטוקול זה מתאר התקנה מקורית המשלבת מדידות ספקטרליות ולאורך החיים כדי להעריך förster תהודה העברת אנרגיה (לדאוג) בין מבוססי rhodamine בבדיקות פלורסנט ליגנין פולימר ישירות בסעיפים צמח עבה.
Abstract
ביומסה (LB), הפעילות של אנזימים מוגבלת על ידי מראה של אינטראקציות לא ספציפיות עם ליגנין בתהליך הידרוליזה, אשר שומר על אנזימים הרחק המצע שלהם. אפיון של אינטראקציות מורכבות אלה מהווה אתגר באמצעות מצעים מורכבים כגון LB. השיטה כאן מודדת אינטראקציות מולקולריות בין פלואור-מולקולות מתויגות ו-פלורסנט מקורית ליגניב, להתגלות על ידי העברת אנרגיה בתהודה של Förster (לדאוג). בניגוד מדידות למדוד בתאי החיים באמצעות שני fluorסוגני אקסוגניים, מדידות למדוד בצמחים באמצעות ליגנין הוא לא טריוויאלי עקב מורכבים autoפלואורסצנטית שלה. פיתחנו צינור הרכישה המקורי ניתוח עם התבוננות בקורלציה של שני מאפיינים משלימים של פלואורסצנטית: פליטת הזריחה והחיים. sFLIM (מיקרוסקופ הדמיה של תקופת החיים ספקטרלית ופלורסנט) מספק את הקוונפיקציה של אינטראקציות אלה עם רגישות גבוהה, חשיפת רמות אינטראקציה שונות בין biomolecules ו lignin.
Introduction
הידרוליזינג ללינותאית לסוכרים monomeric כגון גלוקוז דורש אנזימים. הפעילות שלהם ידוע להיות מרוסן על ידי הקמתה של אינטראקציות שאינן ספציפיות בין אנזימים לבין ליגנין1,2, השני הוא פולימר הידרופובי ומהווה העיקרי של lignocellulose3. לפיכך, מדידת האינטראקציות כאלה ישירות בקנה מידה הסלולר הוא אתגר כי חייב להיות ממוען כדי למטב את פעילות האנזים קטליטי ו ליגנותאית טרום טיפול4.
Förster (או זריחה) העברת אנרגיה התהודה (לדאוג) מדידה היא שיטה של בחירה לישבנים biomolecules אינטראקציה באתרו. זה העברה אנרגיה רדיוטיבית יכול להתרחש בין תורם לבין הקבלה fluorophore אם הם ממלאים תנאים שונים. הספקטרום של פליטת התורמים חייב לחפוף, לפחות באופן חלקי, את ספקטרום העירור. הבחירה של fluorophores הוא ולכן קריטי עבור ניסויים כאלה. לאחר מכן, יעילות המעבר יורדת עם הכוח השישי של מרחק שלהם5 ורק מתרחשת אם שתי המולקולות הן בסביבה קרובה (בדרך כלל בטווח ננומטר). מגירה אחרת יכול לשנות את היעילות העברה כגון התמצאות dipole-dipole אבל הם הרבה יותר אם fluorophores יש גמישות.
לדאוג ניתן למדוד על ידי טכניקות שונות ותיאורים מפורטים ניתן למצוא בספרות6,7. בקצרה, השיטות העיקריות להסתמך על: i) הפליטה רגישות שבה הווריאציה על הפליטה לקבלה להיות מוכן ומספק תוצאות איכותיות בעיקר; ii) קבלת photobleaching לבנה שבה פליטת התורם הפלואורסצנטית נמדד לפני ואחרי קבלת הלבנת התמונות (במקרה זה, הערכות מדויקות יותר של הערכת ניתן להשיג אך דורשים כוח לייזר חזק להחיל דגימות קבועות); ו-iii) מדידה לכל החיים הפוחתת עבור התורם בנוכחות המאשר. שיטה זו מחייבת מכשירים ספציפיים ומאפשרת מדידות אינטראקציה מדויקות ורגישות בין fluorophores. בהתחשב מדידה הקשת בין הפלורסנט בדיקה ליגנותאית, הקושי העיקרי הוא כי lignocellulose הוא לא אחד היטב מאופיין fluorophore: יש לו מקורית חזקה ובעלת היקף מקורי, בעיקר שמקורם lignin, תלוי מינים ביומסה8,9.
במאמר זה, אנו מציעים הליך חדש ומקורי המותאמים למקטעים של דגימות עץ/צמחים. זו שיטה מבוססת sflim פותח את הדרך למדידות מדידה כמותית בין בדיקות פלורסנט לליגנין בדוגמאות יליד ליגנותאית.
Protocol
1. הכנה לדוגמא
הערה: שלבים רצופים להכנת הדגימות מתוארים באיור 1.
- הכנה לדגימת צמחים
- מגזעי עץ או רסיסים, חותכים 1 ס מ דגימות ארוכות עם סכיני גילוח מבלי לפגוע במבנה שלהם.
- הטמע דגימות פוליאתילן גליקול (יתד) בינונית, על ידי לטבול אותם בפתרונות רצופים של הגדלת הריכוז יתד מדולל במים עד להגיע 100% פג.
- מניחים לדוגמה תחת ואקום כדי להסיר מים.
- בעדינות לערבב דגימות ב 30% v/v פג עבור 24 שעות.
- בעדינות לערבב דגימות ב 50% v/v פג עבור 24 שעות.
- בעדינות לערבב דגימות ב 100% פג עבור 24 שעות ב 70 ° צ' (טהור יתד היא יציבה בטמפרטורת החדר).
- מניחים דגימות בקפסולות ב-70 ° צ' (על צלחת חמה) ומפחיתים את הטמפרטורה בהדרגה עד שמגיעים לטמפרטורת החדר.
- להכין בזהירות 30-60 יקרומטר עובי שטוח מקטעים אלה בלוקים יתד באמצעות להבים מיקרוטומה ו חד פעמי.
- לאסוף ולשטוף קטעים בשלוש אמבטיות עוקבות של מים עבור 5 דקות כדי להסיר את פג מן הסעיפים.
- הכנה לבדיקה פלואורסצנטית
- הכינו פתרון מאגר של 30 מ"מ פוספט ב-pH 6.0.
- שוקלים לשקול את. אבקת הבדיקה של דקטרן
- התמוססות אבקת בדיקה לתוך המאגר עם ערבוב רציפה בבקבוקון זכוכית עבור 1 h בחושך בריכוז הסופי של 0.1 g/L.
- צביעת דגימת צמחים
- מקטעים דגירה עם 500 μL של בדיקה פלורסנט (ראה 1.2.3) עבור 72 h (ללא ערבוב) בצינור פלסטיק (לא יותר מ 3 מקטעים לצינור) בחושך.
- איסוף מקטע עם מברשת, ספוח המאגר עם גיליון נקי (להימנע מייבוש את הסעיף), ולאחר מכן לטעון את המקטעים מודחים בין זכוכית כיסוי לבין שמיכות #1 5h.
2. מערכת חיים פלואורסצנטית ומדידה ספקטרלית
הערה: זרימת העבודה המלאה עבור מדידה של sFLIM מוצגת באיור 2.
- לקבוע את רוחב החלון ספקטרלי של גלאי sFLIM.
- לשים גבישים אוריאה בתיבת תרבות עם קרקעית זכוכית 0.17 יקרומטר.
- מניחים את תיבת התרבות על מחזיק דגימת המיקרוסקופ ולבחור את המטרה 20x.
- בחרו לייזר Ti: Sa עם אורך גל של 900 ננומטר ו-2% כוח, והפעל את הסריקה.
- לאסוף את האות ההרמוני השני על גלאי sFLIM.
הערה: האות ההרמוני השני נפלט בדיוק בחצי האורך גל עירור של 450 ננומטר; בעוד מיידי, מידה זו מספקת גם את פונקציית התגובה האינסטרומנטלית של המערכת. - בהדרגה להתאים את הריגוש לייזר אורך הגל מ 900 אל 980 nm עד האות הרמוני השני נאסף בערוץ ספקטרלי השני (462.5 nm).
- לקבוע את אורך החלון ספקטרלי (12.5 nm).
- אם הטווח הספקטרלי שונה ממה שמצופה, פתור את הפעולות הבאות.
- להתאים את הלייזר ל 910 ננומטר.
- הזז את מיקום הפומפיה באמצעות גלגל גלילה כדי למדוד את האות ההרמוני השני בערוץ הראשון בלבד (גבול הערוץ הראשון).
- להתאים את הלייזר ל 935 ננומטר.
- הזז את מיקום הפומפיה באמצעות גלגל גלילה כדי למדוד את האות ההרמוני השני בערוץ הראשון בלבד (גבול הערוץ השני).
- כיול ערוצי הספקטרומטר הכוללים
- הכנס את המראה. על במת המיקרוסקופ
- בחר את לייזר מתמשך גלוי (458 ננומטר, 1% כוח).
- לאסוף את האות השתקפות על גלאי sFLIM ולבדוק אם הפוטונים נמדדים בערוץ ספקטרלי המתאים.
- חזור על שלב 2.2.2 ו 2.2.3 עם כל הלייזר הזמין (514 nm, 561 nm ו 633 nm).
- אם הערוץ הספקטרלי שונה ממה שצפוי, הזז את מיקום הפומפיה עם גלגל הגלילה וחזור על שלבים 2.1 ו-2.2.
3. אפיון מדגם פלואורסצנטית
- ב ספקטרופלואורומטר מצויד אביזר מחזיק הסרט (למשל, Jasco FP-8500 מכשיר), במקום מדגם סעיף צמח (לא מודדת עם בדיקה פלורסנט).
- למדוד פליטת פלואורסצנטית בדרך כלל על טווח 300-600 ננומטר בזמן מרגש את המדגם בדרך כלל על טווח 250-550 ננומטר.
- מתווה את עוצמת הקרינה לעומת עירור ואורכי הגל כדי לצייר מפת הזריחה 3D.
- קבע את אזור העירור/הפליטה המירבי מההתוויה.
4. מדידת הסריג הספקטרלי
- כיול פלואורסצנטית אוטומטי
- בחר את המטרה 20x (NA: 0.8).
- להגדיר את עירור שני פוטון לייזר ב 750 nm.
- הצב את קש החיטה (WS) לבד בחלק הצמח בין השקופית לבין הכיסויים.
- החל את הפרמטרים הבאים בתוכנה. מעבר למצב למדא. בחר את הגלאי הספקטרלי עם רזולוציה 9.7 ננומטר. בחר את טווח ספקטרלי בין 420 ל 722 nm.
- לרכוש את התמונה.
- קבע את שיא פליטת התורמים (470 ננומטר עם הגדרה זו).
- כיול של איקטור
- מניחים מבוסס rhodamine בבדיקות פלורסנט בתיבת תרבות עם תחתית זכוכית 0.17 יקרומטר.
- השג את התמונה באותה הגדרה.
- קבע את שיא הפליטה של האיקטור (570 ננומטר עם הגדרה זו).
- קבע את הטווח הספקטרלי עם האות המקסימלי "WS לבד" ואין אות קבלה כפליטת התורם בלבד עבור מדידות sFLIM (460-490 ננומטר עם הגדרה זו).
- מדידה לדוגמה
- הצב את החלק של הצמח הוכתם בין השקופית לבין הכיסויים.
- השג את התמונה באותה הגדרה.
- שמור את קובץ ה-lsm.
- באיכות משותף מחבר אירוע מאוד חזק עם ירידה בשיא פליטת התורמים בהשוואה ל "מדגם WS בלבד" ועליה בשיא הפליטה של הקבלה בהשוואה לדגימת הרודטין.
5. מדידות הפלימטר
הערה: עבור ההתקנה של sFLIM, המערכת שבה נעשה שימוש היא קבוצת מחשבים של שעון הערך sFLIM כמתואר בעבר10. מיקרוסקופ זקוף ומתאם זמן שונים מקשר הפוטון בודד כרטיסי מיקרוסקופ קונפוקלית וקד ניתן להשתמש בפרוטוקול צריך להיות מותאם בהתאם.
- העבר את המערכת למצב sFLIM.
- הגדר את המיקרוסקופ הקונמומוקד כמתואר ב4.1.1 וב4.1.2.
- עבור למצב שאינו נסרק בתוכנה לשליחת פוטונים של פלורסנט לגלאי sFLIM.
- הגדר את הרכישה sFLIM למצב אפשור כדי לאפשר ספירת פוטון ב-SPC150.
- בחר באוסף הזמן של 30 s ב-SPC150.
- בדוק כי CFD הוא בין 1 x 105 ו 1 x 106.
התראה: ודא כי מספר הפוטונים שנמדדו בכרטיס TCSPC הוא תמיד פחות מ-1% מתדירות עירור הלייזר (בכיוונון זה, תדירות עירור הלייזר היא 80 Mhz ושיעור איתור אינו יכול לחרוג 800 kHz בפיקסל כלשהו כדי להימנע מערימה של אפקט11).
- הצב את המקטע "WS לבד" בין השקופית לבין הכיסויים.
- הגדר את התוכנה למצב רציף כדי לאפשר סריקת לייזר.
- בחרו באזור המדידה בדוגמה.
- לחץ על התחל ב-SPC150.
- שמור את הקובץ sdt.
- חזור על התהליך עבור 10 דגימות לפחות לכל תנאי.
- הצב את החלק של הצמח הוכתם בין השקופית לבין הכיסויים.
- חזור על שלבים 5.2.1-5.2.5.
6. ניתוח sFLIM
- בחר באפשרות sFLIM נתונים שנרכשו על "WS בלבד" ולייבא אותם לתוכנה SPCImage באמצעות קובץ | . בסדר, יבא
- בחר פרמטרים להתאמה.
- מהאפשרות | מודל, בחר באפשרות מרובת החזקהמלאה: 12.5 ns.
- מהאפשרות | העדפות, בחר באפשרות ' חשב תגובה אינסטרומנטלית ' באופן אוטומטי.
- מהתפריט הימני של הלוח הראשי, בחר את 2 מודל ההתאמה המעריכית:
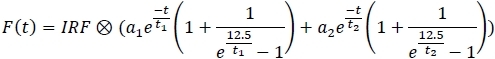
- עבור כל אחד מהערוצים, החל את המודל המתאים ושמור את הפרמטרים של התאמה לגיליון אלקטרוני (a1, a2, t1, t2).
- להשוואה בין ערוצים וניסויים, לחשב את תקופת החיים הפלואורסצנטית ממוצע בגיליון אלקטרוני (Tm):
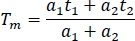
- לחשב את אורך החיים הממוצע עבור כל הדגימות (לפחות 10) בכל הערוצים.
- לנתח Tm על ערוצי תורם (מערוץ 1 אל 3:460-490 ננומטר) ולקבוע את הערוץ ייעודי (ערוץ 2 תואם 467.5-480 nm) המציגה את מספר הפוטון הגבוה ביותר ומקביל ליגנין פליטה מקסימלית. יש להשתמש בערכים מערוץ 2 בשלב 6.7.
- בחר בקובץ sFLIM נתונים שנרכשו ב-WS ויטראז ויבא אותם לתוכנה SPCImage.
- חזור על שלבים 6.1-6.4.
- לחשב את היעילותלדאוג E לתורם בערוץ הקודם שנבחר WS לבד (tmD) ומדגם צמח ויטראז ' (תא):
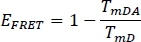
- השוואת ערכי sFLIM ו-E של הערכיםבין ה- WS לבין המדגם.
- שקוללדאוג E חיובי הקשורים עם הקטנת חיים הומוגנית בין WS לבין המדגם כדי להיות מנותח כאירוע סריג (לראות את התוצאות הנציג ויצירות של מינוט et al.12 ו terryn ואח '10 לפרטים).
- לשקול את הירידה בחיים המופצים באופן שונה כדי להיות בשל שילוב של הרמה הדחיסה של ליגניב ו-ליגנין ואינם מפרשים כאינטראקציות מולקולריות.
- אין לשקול שינוי לכל החיים כהעדר מדידה של אות מדיד, אך לא כחוסר באינטראקציה עם ליגנין
תוצאות
כדי להדגים את היכולת sflim כדי לנתח אינטראקציות מולקולריות בין ליגנין ו fluorescently מולקולות מתויגות, השתמשנו הראשון בשלושה דגימות שונות (איור 3): קש חיטה יליד (WS), קש חיטה יליד מודבטים עם יתד מתויג עם rhodamine (PR10), ו קש חיטה יליד עם תוספי מתויג עם rhodam PR10 ידוע לתקשר עם ליגנין בעוד DR10 אמור להיות אדיש13,14,15. עקומות sFLIM (איור 3, למעלה) מציגות מספר שינויים שניתן להשיג בין דגימת ההפניה (WS) לבין שני מקרי אינטראקציה (DR10 ו-PR10). אכן, ניתן להבחין בקלות בעלייה הפלואורסצנטית באזורים ספקטרלי המתאימים לטווח הפליטה rhodamine. התבוננות זהירה של שלושה הערוץ הראשון הפוטון ריקבון הפוטונים גם חושף הפיתול חזק יותר עבור DR10 מאשר PR10. לאחר התאמת הפוטונים ריקבון פוטון וחישוב כל ממוצע של כל ערוץ החיים הזריחה, החתימה לדאוג הופך ברור יותר (איור 3, למטה). אכן, בעוד תקופת החיים של הזריחה לחילופין מגדילה ופוחתת לאורך הספקטרום של הזריחה עבור מדגם WS, חתימה ברורה של הקשת היא נצפתה הן PR10 ו DR10 עם: 1) ערך לכל החיים קבוע בערוץ לתרום בלבד פליטה (3 הערוצים הראשונים, בכחול); ו 2) חיים הזריחה הגוברת בערוץ ספקטרלי המתאים תרומה הולכת וגוברת של החיים הגבוהים התורמים fluorophore.
לאחר לפרט חד משמעי נקבע, השוואה של ליגנין לאורך החיים הפלואורסצנטית (ערוץ 2) מאפשר לכמת את הירידה במשך החיים בין WS (0.47 ns), DR10 (0.42 ns) ו PR10 (0.36 ns) וכך, חושף אינטראקציות מולקולריות בין ליגנין ו PR10 וגם DR10 עם זיקה חזקה יותר עבור PR10.
כדי להמחיש את הרלוונטיות של שיטה זו לכמת רמות אינטראקציה שונות, אנו בוחרים שלוש דגימות אחרות, מחקה את הנגישות האנזים על דגימות הצמח מטופלים: חומצה מטופלים WS (AWS), בשילוב עם PR של שני משקולות מולקולרי בניגוד של 5 kDa ו 20 kDa (PR5 ו PR20). לאחר בדיקה זהירה של החתימות sFLIM, מופק ליגניב חיים הזריחה (איור 4). כפי שנאמר קודם, ליגניב חיים הזריחה ניתן לשנות על ידי סביבתו16,17. לאחר טיפול בחומצה, מדדים החיים הפלואורסצנטית ב AWS (0.28 ns) הופך נמוך יותר מאשר נמדד בעבר עבור WS (0.47 ns), אשר מאשרת את הדרישה של הליך sFLIM עבור פרשנות חד משמעית של ירידה בחיים ואת הצורך פקדים שליליים עבור כל תנאי נבדק. כצפוי, ירידה במשך החיים חזק הוא נצפתה בעת הוספת PR ל-AWS בזמן שהוא מקיים אינטראקציה עם lignin. יתר על כן, האינטראקציה חזקה יותר עם PR5 (0.14 ns) לעומת PR20 (0.16 ns), אשר עקבית עם מדידה רדיוס הידרודינמי שלהם (2.3 nm ו 4.8 nm עבור PR5 ו PR20, בהתאמה), גרימת אילוצים אפקט סטרי שונים ולכן נגישות גבוהה יותר של PR5 כדי lignin.
שני הניסויים מדגימים את הרלוונטיות של שיטה זו כדי להעריך ליגנין באופן דק אינטראקציות עם אנזימים, בהתאם לגודלם ולטיפול בדגימות צמחים מראש.

איור 1: צעדי הכנה שונים של הדגימות. קשית חיטה (WS) (א) מופחתת לראשונה בגודל (ב) כדי להיות מוטבע ב-יתד בינונית (C). הבלוק נחתך באמצעות מיקרוטומה מצויד בלהבים חד פעמיות (D). לאחר כביסה, סעיפים הנובעים (E) ממוקמים עבור דגירה ב-יתד או תוספי מתויג-rhodamine (F). מקטעים המוצגים מורכבים עבור מדידות sFLIM (G). סרגלי קנה מידה הם 2 ס"מ (A), 1 ס מ (ב ו C), 200 יקרומטר (E ו- G). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
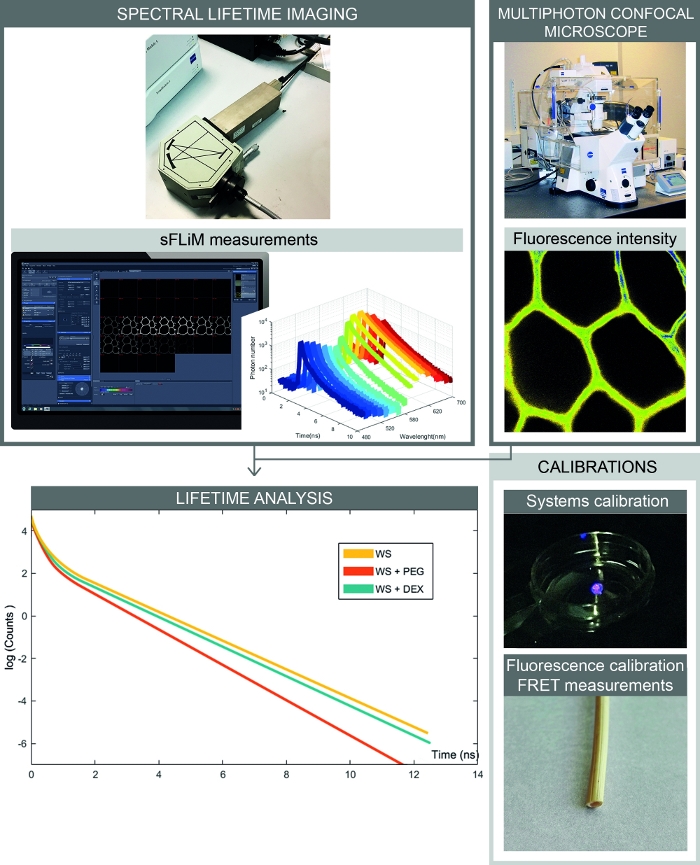
איור 2: זרימת עבודה מלאה של מדידות ספקטרליות מבוססות-הגומלין של המבוסס. הדמות מציגה את ההתקנה המשלבת עוצמת קרינה ספקטרלית ומדידות לכל החיים. תמונות של קרינה פלואורסצנטית הם רכשה עם מיקרוסקופ קונפוקלית וקד, ותקופות חיים של הזריחה הפלואורסצנטית עבור כל טווח ספקטרלי מודדים עם גלאי sflim. ניתוח עקומות פוטון מאפשר נחישות מדויקת של האינטראקציות בין המדגם לבין המולקולות של הריבית. כיול צריך להיות מעובד כדי למנוע חפצי אמנות. ראשית, הגלאי sFLIM צריך להיות מכויל באמצעות הספקטרום ואת פונקציית התגובה האינסטרומנטלית שלו יש לבדוק. שנית, האות האוטומטי המורכב של הזריחה צריך להיות מכויל במדויק עבור כל דוגמה כדי לקבוע את אורך החיים של הזריחה בכל ערוץ לפני הוספת מולקולה מקבל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: מדידות הנציג הספלימטר sflim עקומות (הפאנל העליון) נרכשו על קש חיטה יליד (ws), WS מודב עם יתד מתויג עם rhodamine (ws + יתד) ו קש חיטה יליד עם תוספי עם התגית rhodamine (ws + DEX). עבור כל דוגמה, עקומות sFLIM הותאמו במודל ריקבון דו-מעריכי ומשמעות החיים הפלואורסצנטית הממוצע חושבה עבור כל ערוץ (הלוח התחתון). הדגימות WS + יתד ו-WS + DEX מציגות ירידה במשך החיים הפלואורסצנטית בערוץ המתאים לזריחה בלבד (שלושה בארים ראשונים) המשויכת לעלייה בחיים בערוץ המתאים לפליטת מעורבת של פלואורסצנטית אוטומטי ו-rhodamine. התנהגות זו אופיינית לאירוע של סריג בין ליגנין לבין מולקולות מתויגות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
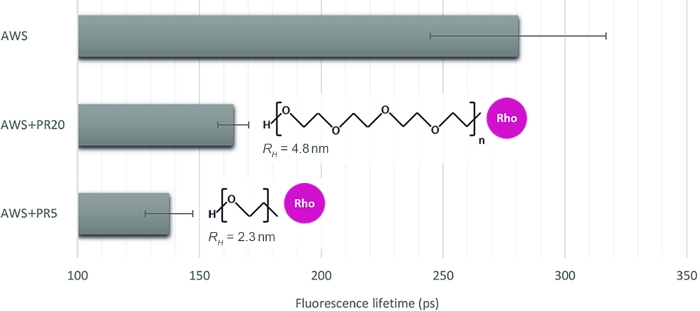
איור 4: ניתוח חיים של הקרינה הפלואורסצנטית של הערוץ תואם ליגנין autoפלואורסצנטית. לאחר אימות אירוע סריג המבוסס על חתימת sFLIM, המשמעות של תקופת החיים הפלואורסצנטית נמדד על חומצה מטופלים WS (AWS), בשילוב עם PR5 או PR20 (5 kDa ו 20 kDa, בהתאמה). בעוד דגימות PR להציג להקטין את החיים, הקטן מאופיין על ידי הפחתת חיים חזקה יותר, חשיפת אינטראקציה מולקולרית חזקה יותר עם lignin. ולכן השיטה רגישה מספיק כדי להפלות בין הן (ערך ממוצע ושגיאה סטנדרטית מיוצגים, n > 10 לכל תנאי). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
מדידות של אורך החיים הפלואורסצנטית וספקטרום פליטה מאפשר שילוב יתרונות של שתי השיטות. ואכן, מדידות ספקטרליות חסרות רגישות בלבד ונשארות איכותיות. מצד שני, החיים הפלואורסצנטית היא שיטת הבחירה עבור מדידות מסורתיות הכמותי, אבל זה היה הוכיחה כי ליגנין autoפלואורסצנטית יכול להשתנות בהתאם ליגנין קומפוזיציה וסביבה16. לפיכך, ליגנין אינטראקציות עם קבלה או לימוד של שינויים מבניים לא יכולים להיות מפלים מאחר ששניהם גורמים לירידה בחיים. כפי שמתואר, השיטה המפותחת מספקת מדידה חד משמעית, רגישה וכמותית של אינטראקציות בין ליגנין לבין מולקולות לקבלה בסעיפים הצמח. גם אם השלבים השונים של השיטה היו ממוטבים בקפדנות, יש לנקוט זהירות במיוחד עבור הנקודות הבאות.
בנוגע לדגימות, איכות סעיף הצמח היא קריטית כדי להבטיח הדמיה בפוקוס. השלבים השונים עבור הטבעה יתד יש לעקוב בקפדנות. שלב הכביסה הסופי חיוני כדי להבטיח שאין הפרעות מ-פג הנותרים בדגימות. יתר על כן, ריכוז המאגר ו-pH יש לשמור באופן זהה לחלוטין עבור כל המדידות מאז כל שינוי יכול להיות השפעה חזקה על תכונות הזריחה.
מדידת חיים יכולה גם להיות עדינה. החיים הפלואורסצנטית של התורם יכול להיות לא יציב, למשל בגלל עירור גבוה. במקרה כזה, כוונון כוח הלייזר והזום יכולים לפתור את הבעיה. עוד מקור ידוע של חפצי אמנות במדידות TCSPC הוא הדופק פוטון ערימת. אכן, TCSPC לא יכול למדוד את המהירות של שני פוטונים הנפלטים בין שני פולסים לייזר. בעוד דגימות צמחים מובנים מאוד, הקרינה הפלואורסצנטית אינו הומוגנית והוא עלול להוביל לאפקט מוסתר השרשרת. בעוד מספר הפוטונים לשנייה נשאר מתחת למגבלת 1% עירור, זה יכול להיות גבוה יותר באזורים לדוגמה מסוימים. מדידת החיים הפלואורסצנטית של התורם בשטף פוטון שונה יכול להיחשב. , אם החיים מגדילים בזמן ששטף הזרם יורד. אפקט השרשרת משנה מדידות שטף פוטון אופטימלי מגיע. עם יציבות החיים של התורם
בנוגע לניתוח העקומה של sFLIM, מומלץ להסתמך על כל התאמה של עקומת הפרט כדי להבטיח שהמודל מתאר במדויק את המידות. אם זה לא המקרה, ראשית ודא שאף אחד מחפצי האמנות שהוזכרו בעבר השחית את הנתונים. לאחר מכן, step 2.1.4 מספק את פונקציית התגובה האינסטרומנטלית (IRF) של המערכת. אם IRF מציג מספר חריגות, מטב את הנתיב האופטי כדי למזער אותם. ניתן להשתמש ב-IRF הנמדד לצורך התאמה במהלך שלב 6.2. לבסוף, ניתן להגדיל את דרגות החופש של המודל המתאים לדעיכה בעלת שלושה מעריכי בשלב 6.2. עם זאת, מספר הפוטונים הנדרשים לאורך חיים בודדים וקביעת פרופורציה הוא גבוה, ולכן מומלץ להשתמש בהם רק כדי להשיג חיים יציבים יותר ממוצע משלב 6.4. מידע ממצה נוסף על FLIM, האפיון שלה18, sflim ויישומו12 במיוחד לליגנין10, ניתן למצוא בספרות.
למרות מאתגרת, מדידה של הרקמה ברקמות הצמחים באמצעות המקור האוטומטי מראה כמה יתרונות. בהשוואה למדידות מדידות שבוצעו על רקמות החיים שבו מחקרים אינטראקציה בין biomolecules לעתים קרובות דורש הנדסה גנטית כדי לבטא סמנים פלורסנט מהותי, רקמות הצמח לחיות כמו אלה המוצגים כאן, להציע טבעי פלואורסצנט אוטומטי, ו שותף חיצוני הבדיקות הפלורסנט ניתן להוסיף בקלות, חוסך זמן רב. עם זאת, בהתאם מינים הצמח מנותח ועל הטיפולים מראש אפשרי שבוצעו, המחשב האוטומטי צפוי להיות שונה, כך שהוא צריך להיות מאופיין בזהירות fluorophore המשמש בבדיקות עשוי להיות צורך להתאים.
יש להחיל את שיטת sFLIM על מחלות פלורסנט חסרות פעילות קטליטי (פג ו dextran). במסגרת של ליגנותאית הידרוליזה, אינטראקציות של אנזימים בדגימות ביומסה שונות יכול להתבצע, ואולי כתוצאה מכך קביעת ההשפעה של לוקליזציה (תאים ורקמות) על כוח האינטראקציה. שלב האופטימיזציה הבא יהיה אוטומציה של שלב הניתוח. אכן, עם מספיק נתונים מנותח, ניתוח מבוסס למידה מחשב הליך יכול להיות פרוס עבור ניתוח פנוטיפ אוטומטי, אשר יגביר את היכולת שלה מהירה אנזימים ביומסה יעילות ההקרנה. יתר על כן, sFLIM אינו דורש קיבעון של המדגם והוא יכול להיות בקלות להחיל אנזימים דינמיים-lignin לימודי אינטראקציה. שיטה ייחודית זו עשויה להנחות את אסטרטגיית הנדסת אנזימים וביומסה טרום טיפול כדי לייעל ליגנותאית valorization.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
פאני לורן (מחיר) מודה בחום על הכנת הדמויות. הפדרציה מחקר FRABio (אוניברסיטת ליל, CNRS) הוא הודה לספק את הסביבה הטכנית תורמת להשגת עבודה זו. מימון התקבל מסוכנות המחקר הלאומי הצרפתי (ליגנופרוג פרוייקט ANR-14-CE05-0026).
Materials
| Name | Company | Catalog Number | Comments |
| Confocal microscope | ZEISS | LSM 710 NLO | for confocal imaging |
| fine brush | to collect sections | ||
| glass vials | for incubations | ||
| high precision microscope cover glasses 170+/-5µm n°1,5# | Marienfeld | 0107032 | saled by Dutscher s.a in France |
| Infra-red pulsed laser | COHERENT | CHAMELEON VISION | For sample excitation |
| Micropipette Research Plus monocanal 20-200µL | Eppendorf | with corresponding tips | |
| Micropipette Research Plus monocanal 2-20µL | Eppendorf | with corresponding tips | |
| Microscope slides ca. 76 x 26 mm ground edges frosted end | Thermo Fisher Scientific | LR45D | |
| microtome blades disposable (pack of 50) | Agar Scientific | T5024 | saled by Oxford Instruments in France |
| mPEG-Rhodamine, 10 kDa | Creative Peg Works | PSB-2263 | |
| mPEG-Rhodamine, 20 kDa | Creative Peg Works | PSB-22642 | |
| mPEG-Rhodamine, 5 kDa | Creative Peg Works | PSB-2264 | |
| nail polish | for mounting | ||
| pH meter five easy plus | Mettler toledo | FEP20 | with electrode |
| poly (ethylene Glycol) average mol wt 1450 | Merck (sigma-Aldrich) | P5402-1kg | for sample embedding |
| razor blades, single edges blades, stainless steel, box of 100 | Agar Scientific | T586 | for fragments preparation saled by Oxford Instruments in France |
| rotary microtome | Microm Microtech | HM 360 | |
| sFLim detector | BECKER-HICKL | SPC 150 | for lifetime acquisition |
| sodium dihydrogen phosphate dihydrate NaH2PO4, 2H2O | Merck (sigma-Aldrich) | 71500 | for buffer solution |
| sodium phosphate dibasic dihydrate Na2HPO4,2H2O | Merck (sigma-Aldrich) | 30435-1kg | for buffer solution, old reference, the new one is 71643-1kg |
| tetramethyl rhodamine isothiocyanate-dextran 10 k Da | Merck (sigma-Aldrich) | R8881-100mg |
References
- Inouye, H., et al. Multiscale deconstruction of molecular architecture in corn stover. Scientific Reports. 4, 3756 (2014).
- Li, X., Zheng, Y. Lignin-enzyme interaction: Mechanism, mitigation approach, modeling, and research prospects. Biotechnology Advances. 35 (4), 466-489 (2017).
- Vogel, J. Unique aspects of the grass cell wall. Current Opinion in Plant Biology. 11 (3), 301-307 (2008).
- Lynd, L. R. The grand challenge of cellulosic biofuels. Nature Biotechnology. 35, 912 (2017).
- Clegg, R. M. Fluorescence resonance energy transfer. Current Opinion in Biotechnology. 6, 103-110 (1995).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. C. Advanced fluorescence microscopy techniques-FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Pietraszewska-Bogiel, A., Gadella, T. W. J. FRET microscopy: from principle to routine technology in cell biology. Journal of Microscopy. 241 (2), 111-118 (2011).
- Herbaut, M., et al. Multimodal analysis of pretreated biomass species highlights generic markers of lignocellulose recalcitrance. Biotechnology for Biofuels. 11, 52 (2018).
- Chabbert, B., et al. Fluorescence techniques can reveal cell wall organization and predict saccharification in pretreated wood biomass. Industrial Crops and Products. 123, 84-92 (2018).
- Terryn, C., Paës, G., Spriet, C. FRET-SLiM on native autofluorescence: a fast and reliable method to study interactions between fluorescent probes and lignin in plant cell wall. Plant Methods. 14 (1), 74 (2018).
- Jovin, T. M., Arndt-Jovin, D. J., Kohen, E. . Cell Structure and Function by Microspectrofluorometry. , 99-117 (1989).
- Spriet, C., et al. Correlated fluorescence lifetime and spectral measurements in living cells. Microscopy Research and Technique. 70 (2), 85-94 (2007).
- Donaldson, L. A., Newman, R. H., Vaidya, A. Nanoscale interactions of polyethylene glycol with thermo-mechanically pre-treated Pinus radiata biofuel substrate. Biotechnology and Bioengineering. 111 (4), 719-725 (2014).
- Herbaut, M., Zoghlami, A., Paës, G. Dynamical assessment of fluorescent probes mobility in poplar cell walls reveals nanopores govern saccharification. Biotechnology for Biofuels. 11 (1), 271 (2018).
- Paës, G., Chabbert, B. Characterization of arabinoxylan / cellulose nanocrystals gels to investigate fluorescent probes mobility in bio-inspired models of plant secondary cell wall. Biomacromolecules. 13, 206-214 (2012).
- Donaldson, L. A., Radotic, K. Fluorescence lifetime imaging of lignin autofluorescence in normal and compression wood. Journal of Microscopy. 251 (2), 178-187 (2013).
- Auxenfans, T., Terryn, C., Paës, G. Seeing biomass recalcitrance through fluorescence. Scientific Reports. 7, 8838 (2017).
- Waharte, F., Spriet, C., Héliot, L. Setup and characterization of a multiphoton FLIM instrument for protein-protein interaction measurements in living cells. Cytometry A. 4, 299-306 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved