Method Article
Medición de interacciones entre sondas fluorescentes y lignina en secciones de plantas por sFLIM basado en autofluorescencia nativa
En este artículo
Resumen
Este protocolo describe una configuración original que combina mediciones de vida útil espectral y fluorescencia para evaluar la transferencia de energía por resonancia de Farster (FRET) entre las sondas fluorescentes a base de rodamina y el polímero de lignina directamente en secciones gruesas de la planta.
Resumen
En la biomasa lignocelulósica (LB), la actividad de las enzimas está limitada por la aparición de interacciones no específicas con lignina durante el proceso de hidrólisis, que mantiene las enzimas lejos de su sustrato. La caracterización de estas interacciones complejas es por lo tanto un desafío en sustratos complejos como LB. El método aquí mide las interacciones moleculares entre las moléculas etiquetadas con fluoróforo y la lignina autofluorescente nativa, que serán reveladas por la transferencia de energía por resonancia de Farster (FRET). Contrariamente a las mediciones de FRET en células vivas que utilizan dos fluoróforos exógenos, las mediciones de FRET en plantas que utilizan lignina no son triviales debido a su compleja autofluorescencia. Hemos desarrollado una tubería de adquisición y análisis original con la observación correlacionada de dos propiedades complementarias de la fluorescencia: emisión de fluorescencia y vida útil. sFLIM (microscopía de imágenes de por vida espectral y fluorescente) proporciona la cuantificación de estas interacciones con alta sensibilidad, revelando diferentes niveles de interacción entre biomoléculas y lignina.
Introducción
La hidrolcelulosa hidrolizante en azúcares monoméricos como la glucosa requiere enzimas. Su actividad es conocida por ser restringida por el establecimiento de interacciones no específicas entre enzimas y lignina1,2, siendo este último un polímero hidrófobo y un componente importante de lignocelulosa3. Por lo tanto, medir cuantitativamente estas interacciones directamente a escala celular es un desafío que debe abordarse para optimizar la actividad catalítica enzimática y el pretratamiento de lignocelulosa4.
La medición de la transferencia de energía por resonancia (FRET) es un método de elección para asses biomoléculas de interacción in situ. Esta transferencia de energía no radiativa puede ocurrir entre un donante y un fluoróforo aceptador si cumplen condiciones diferentes. El espectro de emisión de donantes debe superponerse, al menos parcialmente, al espectro de excitación de los aceptadores. Por lo tanto, la elección de fluoróforos es crucial para tales experimentos. Entonces, la eficiencia de transferencia disminuye con la sexta potencia de su distancia5 y sólo ocurre si ambas moléculas están cerca (típicamente en el rango de nanómetros). Otra contingencia puede alterar la eficiencia de transferencia, como la orientación dipolo-dipolo, pero se mitigan si los fluoróforos tienen flexibilidad.
FRET se puede medir por diferentes técnicas y descripciones detalladas se pueden encontrar en la literatura6,7. En resumen, los principales métodos se basan en: i) emisiones sensificadas en las que se sigue la variación en la fluorescencia de emisión de aceptación y proporciona resultados principalmente cualitativos; ii) fotoblanqueo del aceptador en el que se mide la fluorescencia de emisión del donante antes y después del fotoblanqueo del aceptador (en este caso, se pueden lograr estimaciones más precisas de FRET, pero requieren una fuerte potencia láser aplicada a las muestras fijas); y iii) medición de por vida que disminuye para el donante en presencia del aceptador. Este método requiere instrumentos específicos y permite mediciones de interacción precisas y sensibles entre fluoróforos. Teniendo en cuenta la medición de FRET entre las sondas fluorescentes y la lignocelulosa, la principal dificultad es que la lignocelulosa no es un solo fluoróforo bien caracterizado: tiene una fuerte autofluorescencia nativa y espectralmente amplia, principalmente originada a partir de lignina, y dependiente de la especiedebiomasa8,9.
En este documento, proponemos un procedimiento nuevo y original adaptado a secciones de muestras de madera/planta. Este método basado en sFLIM abre el camino a mediciones cuantitativas de FRET entre sondas fluorescentes y lignina en muestras nativas de lignocelulosa.
Protocolo
1. Preparación de la muestra
NOTA: Los pasos sucesivos para preparar las muestras se describen en la Figura 1.
- Preparación de muestras vegetales
- A partir de troncos de madera o fragmentos, cortar muestras de 1 cm de largo con cuchillas de afeitar sin dañar su estructura.
- Incruste muestras en medio de polietilenglicol (PEG), sumergiéndolas en soluciones sucesivas de aumento de la concentración de PEG diluidas en agua hasta alcanzar el 100% de PEG.
- Coloque la muestra al vacío para eliminar el agua.
- Revuelva suavemente las muestras en PEG 30% v/v durante 24 horas.
- Revuelva suavemente las muestras en 50% v/v PEG durante 24 horas.
- Revuelva suavemente las muestras en 100% PEG durante 24 h a 70 oC (el PEG puro es sólido a temperatura ambiente).
- Colocar las muestras en cápsulas a 70 oC (en una placa caliente) y disminuir progresivamente la temperatura hasta alcanzar la temperatura ambiente.
- Prepare cuidadosamente secciones planas de 30-60 m de espesor de estos bloques PEG utilizando un microtome y cuchillas desechables.
- Recoger y lavar secciones en tres baños sucesivos de agua durante 5 minutos para eliminar PEG de las secciones.
- Preparación de la sonda fluorescente
- Preparar la solución tampón de fosfato de 30 mM a pH 6.0.
- Pesar PEG rhand dextran rhodamine sonda en polvo.
- Disolver el polvo de la sonda en el tampón con agitación continua en un vial de vidrio durante 1 h en la oscuridad a una concentración final de 0,1 g/L.
- Tinción de muestras de plantas
- Incubar secciones con 500 ml de la sonda fluorescente (ver 1.2.3) durante 72 h (sin agitación) en un tubo de plástico (no más de 3 secciones por tubo) en la oscuridad.
- Recoja una sección con un cepillo, posicione el tampón con una hoja limpia (evitar secar la sección) y luego monte las secciones incubadas entre un cristal de cubierta y un cubreobjetos de #1.5H.
2. Duración de la fluorescencia y calibración del sistema de medición espectral
NOTA: El flujo de trabajo completo para la medición sFLIM se presenta en la Figura 2.
- Determine el ancho de la ventana espectral del detector sFLIM.
- Coloque los cristales de urea en una caja de cultivo con un fondo de vidrio de 0,17 m.
- Coloque la caja de cultivo en un soporte de muestra de microscopio y seleccione el objetivo 20x.
- Seleccione un láser Ti:Sa con una longitud de onda de 900 nm y un 2% de potencia, y encienda el escaneo.
- Recoja la segunda señal armónica en el detector sFLIM.
NOTA: La segunda señal armónica se emite exactamente a la mitad de la longitud de onda de excitación de 450 nm; instantáneamente, esta medida también proporciona la función de respuesta instrumental del sistema. - Ajuste gradualmente la longitud de onda de excitación láser de 900 a 980 nm hasta que se recoja la segunda señal armónica en el segundo canal espectral (462,5 nm).
- Determine la longitud de la ventana espectral (12,5 nm).
- Si el rango espectral difiere de lo esperado, solucione los problemas haciendo lo siguiente.
- Ajuste el láser a 910 nm.
- Mueva la posición de rejilla con una rueda de desplazamiento para medir la segunda señal armónica solo en el primer canal (límite del primer canal).
- Ajuste el láser a 935 nm.
- Mueva la posición de rejilla con una rueda de desplazamiento para medir la segunda señal armónica solo en el primer canal (límite del segundo canal).
- Calibración de los canales generales del espectrómetro
- Inserte el espejo en la etapa del microscopio.
- Seleccione el láser continuo visible (458 nm, 1% de potencia).
- Recoja la señal de reflexión en el detector sFLIM y compruebe si los fotones se miden en el canal espectral adecuado.
- Repita los pasos 2.2.2 y 2.2.3 con todos los láseres continuos disponibles (514 nm, 561 nm y 633 nm).
- Si el canal espectral difiere de lo esperado, mueva la posición de rejilla con la rueda de desplazamiento y repita los pasos 2.1 y 2.2.
3. Caracterización de fluorescencia de muestra
- En un espectrofluorómetro equipado con un accesorio portapelículas (por ejemplo, instrumento Jasco FP-8500), coloque la muestra de sección de la planta (no incubada con la sonda fluorescente).
- Mida la emisión de fluorescencia típicamente en el rango de 300-600 nm mientras excita la muestra típicamente en el rango 250-550 nm.
- Trazar la intensidad de fluorescencia frente a la excitación y las longitudes de onda de emisión para dibujar un mapa de fluorescencia 3D.
- Determine el área máxima de excitación/emisión de la parcela.
4. Medición espectral de FRET
- Calibración de la autofluorescencia
- Seleccione el objetivo 20x (NA: 0.8).
- Establezca la excitación láser de dos fotones en 750 nm.
- Coloque la sección de la planta de paja de trigo (WS) entre el portaobjetos y el cubreobjetos.
- Aplique los siguientes parámetros en el software. Cambie al modo lambda. Seleccione el detector espectral ChS con una resolución de 9,7 nm. Seleccione el rango espectral entre 420 y 722 nm.
- Adquiere la imagen.
- Determinar el pico de emisión del donante (470 nm con esta configuración).
- Calibración del aceptador
- Coloque las sondas fluorescentes a base de rodamina en una caja de cultivo con un fondo de vidrio de 0,17 m.
- Adquiera la imagen con la misma configuración.
- Determine el pico de emisión del aceptador (570 nm con esta configuración).
- Determine el rango espectral con la señal máxima "WS sola" y la señal no aceptable como la emisión del donante solamente para mediciones sFLIM (460-490 nm con esta configuración).
- Medición de muestras
- Coloque la sección de la planta manchada entre el portaobjetos y el cubreobjetos.
- Adquiera la imagen con la misma configuración.
- Guarde el archivo lsm.
- Asocie cualitativamente un evento FRET fuerte con una disminución en el pico de emisión de donantes en comparación con la "muestra solo WS" y un aumento en el pico de emisión del aceptador en comparación con la muestra de rodamina.
5. Mediciones sFLIM
NOTA: Para la configuración de sFLIM, el sistema utilizado es una configuración sFLIM de dominio de tiempo como se describió anteriormente10. Se puede utilizar un microscopio vertical y varias tarjetas de recuento de fotones correlacionados en varias ocasiones y fabricantes de microscopios confocales, y el protocolo debe adaptarse en consecuencia.
- Cambie el sistema al modo sFLIM.
- Ajuste el microscopio confocal como se describe en 4.1.1 y 4.1.2.
- Cambie al modo no desescaneado en el software para enviar fotones fluorescentes al detector sFLIM.
- Establezca la adquisición sFLIM en el modo Habilitar para permitir el recuento de fotones en el SPC150.
- Seleccione la colección de tiempo de 30 s en SPC150.
- Compruebe que el CFD está entre 1 x 105 y 1 x 106.
ADVERTENCIA: Asegúrese de que el número de fotones medidos en la tarjeta TCSPC sea siempre inferior al 1% de la frecuencia de excitación láser (en esta configuración, la frecuencia de excitación láser es de 80 Mhz y la tasa de detección no puede superar los 800 kHz en cualquier píxel para evitar un efecto de acumulación11).
- Coloque la sección de la planta "WS solo" entre el portaobjetos y el cubreobjetos.
- Ajuste el software al modo Continuo para permitir el escaneo láser.
- Elija el área de medición de la muestra.
- Haga clic en Inicio en el SPC150.
- Guarde el archivo sdt.
- Repita el proceso para al menos 10 muestras por condición.
- Coloque la sección de la planta manchada entre el portaobjetos y el cubreobjetos.
- Repita los pasos 5.2.1 - 5.2.5.
6. Análisis sFLIM
- Seleccione el archivo de datos sFLIM adquirido en "WS solo" e impórtelos al software SPCImage utilizando Archivo . Importar.
- Seleccione los parámetros de ajuste.
- Desde la opción de la opción de la opción de la Modelo, seleccione Multirexponenciales incompletos: 12,5 ns.
- Desde la opción de la opción de la opción de la Preferencias, seleccione Calcular respuesta instrumental automáticamente.
- En el menú derecho del panel principal, seleccione el modelo de ajuste exponencial 2:
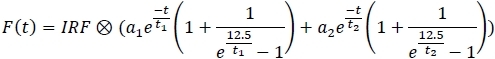
- Para cada canal, aplique el modelo de ajuste y guarde los parámetros de ajuste en una hoja de cálculo (a1,a 2, t1, t2).
- Para comparar entre canales y experimentos, calcule la duración media de la fluorescencia en una hoja de cálculo (Tm):
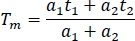
- Calcule la duración media de todas las muestras (al menos 10) en todos los canales.
- Analizar Tm en canales donantes (del canal 1 al 3: 460-490 nm) y determinar el canal dedicado (Canal 2 correspondiente a 467.5 - 480 nm) que muestra el número de fotones más alto y corresponde a la emisión máxima de lignina. Los valores del canal 2 se deben utilizar en el paso 6.7.
- Seleccione el archivo sFLIM de datos adquiridos en WS manchado e impórtelos al software SPCImage.
- Repita los pasos 6.1-6.4.
- Calcular la eficiencia FRET EFRET para el donante en el canal seleccionado anterior WS Alone (TmD) y de la muestra de planta manchada (TmDA):
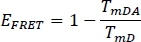
- Compare los valores sFLIM y EFRET entre el WS y el ejemplo.
- Considere un EFRET positivo asociado con una disminución homogénea de la vida útil entre WS y la muestra que se analizará como un evento FRET (véanse los resultados representativos y los trabajos de Spriet et al.12 y Terryn et al.10 para más detalles).
- Considere una disminución de la vida útil distribuida de manera diferente para deberse a una mezcla de nivel de compactación de FRET y lignina y no interprete como interacciones moleculares.
- Considere ninguna modificación de por vida como una ausencia de señal FRET medible, pero no como una falta de interacción con lignina
Resultados
Para demostrar la capacidad de sFLIM para diseccionar interacciones moleculares entre lignina y moléculas etiquetadas fluorescentesmente, primero usamos tres muestras diferentes(Figura 3):paja de trigo nativa (WS), paja de trigo nativa incubada con PEG etiquetada con rodamina (PR10), y paja de trigo nativa con dextran etiquetada con rodadamina (DR10). PR10 es conocido por interactuar con lignina mientras que DR10 se supone que es inerte13,14,15. Las curvas sFLIM(Figura 3, superior) muestran algunas modificaciones que se pueden lograr entre la muestra de referencia (WS) y dos casos de interacción (DR10 y PR10). De hecho, uno puede notar primero fácilmente el aumento de fluorescencia en las regiones espectrales correspondientes al rango de emisión de rodamina. La observación cuidadosa de las tres curvas de descomposición de fotones del primer canal también revela una inflexión más fuerte para DR10 que para PR10. Después de ajustar las curvas de decaimiento de fotones y calcular la duración media de la fluorescencia de cada canal, la firma FRET se vuelve más obvia(Figura 3,inferior). De hecho, mientras que la vida útil de la fluorescencia aumenta y disminuye alternativamente a lo largo del espectro de fluorescencia para la muestra WS, se observa una firma FRET clara tanto para PR10 como para DR10 con: 1) un valor de vida útil constante en el canal de emisión solo del donante (3 primeros canales, en azul); y 2) una creciente vida útil de fluorescencia en el canal espectral correspondiente a una contribución cada vez mayor del fluoróforo de donantes de alta duración.
Una vez que se ha determinado el FRET inequívoco, la comparación de la vida útil de la fluorescencia de lignina (canal 2) permite cuantificar la disminución de la vida útil entre WS (0,47 ns), DR10 (0,42 ns) y PR10 (0,36 ns) y, por lo tanto, revela interacciones moleculares entre lignina y lignina y PR10 y DR10 con una afinidad más fuerte por PR10.
Para ilustrar la relevancia de este método para cuantificar diferentes niveles de interacción, elegimos otras tres muestras, imitando la accesibilidad enzimática sobre muestras de plantas tratadas: WS tratada con ácido (AWS), en combinación con PR de dos pesos moleculares contrastados de 5 kDa y 20 kDa (PR5 y PR20). Después de una cuidadosa inspección de las firmas sFLIM, se extrae la vida útil de la fluorescencia de lignina(Figura 4). Como se ha indicado anteriormente, la vida útil de la fluorescencia de la lignina puede ser alterada por su entorno16,17. Después del tratamiento con ácido, las medidas de vida útil de fluorescencia en AWS (0,28 ns) son inferiores a las medidas previamente medidas para WS (0,47 ns), lo que confirma el requisito del procedimiento sFLIM para una interpretación inequívoca de la disminución de la vida útil y la necesidad de controles negativos para cada condición probada. Como era de esperar, se observa una fuerte disminución de la vida útil al agregar PR a AWS mientras interactúa con la lignina. Además, la interacción es más fuerte con PR5 (0,14 ns) en comparación con PR20 (0,16 ns), que es consistente con su medición de radio hidrodinámico (2,3 nm y 4,8 nm para PR5 y PR20, respectivamente), induciendo diferentes restricciones estericas y por lo tanto mayor accesibilidad de PR5 a lignina.
Ambos experimentos demuestran la relevancia de este método para evaluar finamente las interacciones de lignina con enzimas, dependiendo de su tamaño y del pretratamiento de muestras de plantas.

Figura 1: Diferentes pasos de preparación de las muestras. La paja de trigo (WS) (A) se reduce primero en tamaño (B) para ser incrustada en el medio PEG (C). El bloque se corta utilizando un microtome equipado con cuchillas desechables (D). Después del lavado, las secciones resultantes (E) se colocan para la incubación en PEG o dextran tagged-rhodamine solution (F). Las secciones etiquetadas se montan para mediciones sFLIM (G). Las barras de escala son de 2 cm (A), 1 cm(B y C), 200 m (E y G). Haga clic aquí para ver una versión más grande de esta figura.
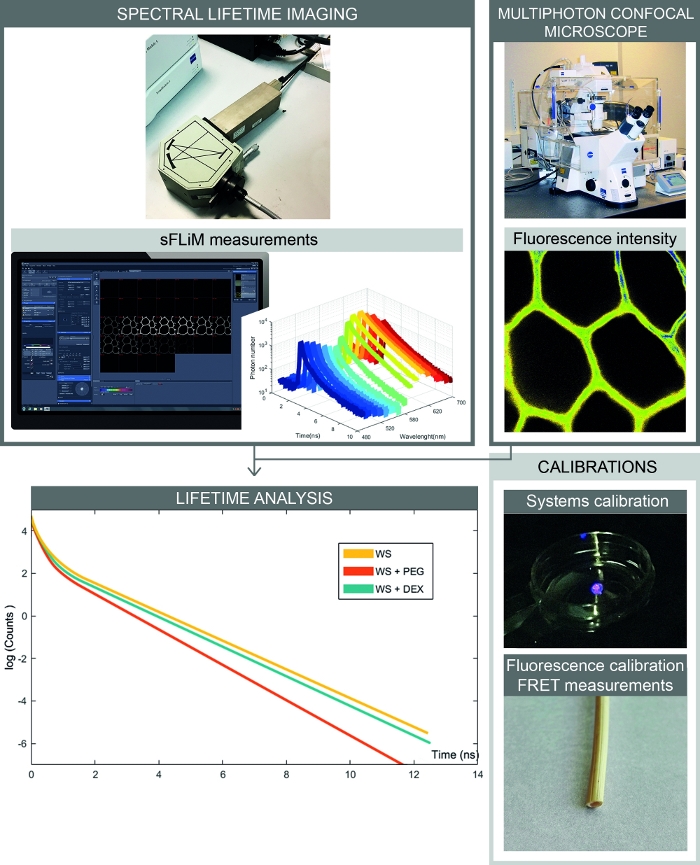
Figura 2: Flujo de trabajo completo de las mediciones de interacciones espectrales basadas en FRET. La figura presenta la configuración que combina la intensidad de fluorescencia espectral y las mediciones de por vida. Las imágenes de fluorescencia espectral se adquieren con un microscopio confocal, y las vidas útiles de fluorescencia secuencialparas para cada rango espectral se miden con el detector sFLIM. El análisis de las curvas de descomposición del fotón permite determinar con precisión las interacciones entre la muestra y las moléculas de interés. Las calibraciones deben procesarse para evitar artefactos. En primer lugar, el detector sFLIM necesita ser calibrado espectralmente y su función de respuesta instrumental tiene que ser verificada. En segundo lugar, la señal de autofluorescencia compleja debe calibrarse con precisión para cada muestra para determinar la vida útil de la fluorescencia en cada canal antes de la adición de una molécula de aceptación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Mediciones representativas de sFLIM. las curvas sFLIM (panel superior) se adquirieron en paja de trigo nativa (WS), WS incubada con PEG etiquetada con roddamina (WS+PEG) y paja de trigo nativa con dextran etiquetado con rodamina (WS+DEX). Para cada muestra, las curvas sFLIM se equiparon con un modelo de descomposición biexponencial y se calculó la vida útil media de la fluorescencia para cada canal (panel inferior). Las muestras WS+PEG y WS+DEX presentan una disminución en la vida útil de la fluorescencia en el canal correspondiente a la autofluorescencia solamente (tres primeras barras) asociada a un aumento de por vida en el canal correspondiente a una emisión mixta de autofluorescencia y rodamina. Este comportamiento es característico de un evento FRET entre moléculas con etiqueta de lignina y rodamina. Haga clic aquí para ver una versión más grande de esta figura.
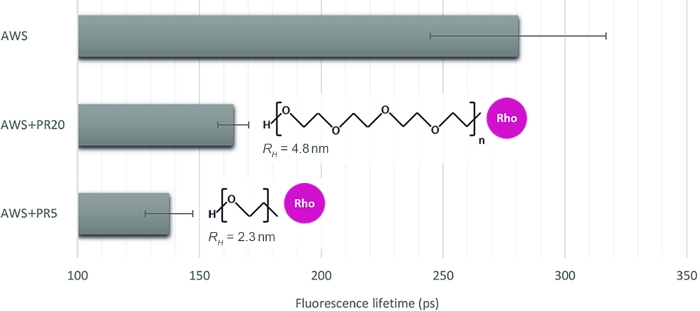
Figura 4: Análisis de la vida útil de la fluorescencia del canal correspondiente a la autofluorescencia de lignina. Después de validar un evento FRET basado en la firma sFLIM, la vida útil media de la fluorescencia se midió en WS (AWS) tratado con ácido, en combinación con PR5 o PR20 (5 kDa y 20 kDa, respectivamente). Mientras que ambas muestras de PR presentan una disminución de la vida útil, la más pequeña se caracteriza por una reducción de la vida más fuerte, revelando una interacción molecular más fuerte con lignina. Por lo tanto, el método es lo suficientemente sensible como para discriminar entre ambos (se representan el valor medio y el error estándar, n>10 por condición). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La correlación de la vida útil de la fluorescencia y las mediciones del espectro de emisiones permiten combinar las ventajas de ambos métodos. De hecho, las mediciones espectrales por sí solas carecen de sensibilidad y siguen siendo cualitativas. Por otro lado, la vida útil de la fluorescencia es el método de elección para las mediciones cuantitativas tradicionales de FRET, pero se demostró que la autofluorescencia de lignina podría variar dependiendo de la composición de la lignina y el entorno16. Por lo tanto, las interacciones de lignina con un aceptador o cambios estructurales de lignina no pueden ser discriminadas ya que ambas resultan en una disminución de por vida. Como se ha demostrado, el método desarrollado proporciona una medición inequívoca, sensible y cuantitativa de las interacciones entre la lignina y las moléculas de los aceptadores en las secciones de las plantas. Incluso si los diferentes pasos del método se optimizaron rigurosamente, se debe tener especial cuidado con los siguientes puntos.
En cuanto a las muestras, la calidad de la sección de la planta es fundamental para garantizar imágenes enfocadas. Los diferentes pasos para la incrustación de PEG deben seguirse estrictamente. El paso final de lavado es esencial para garantizar que no quede interferencia de PEG en las muestras. Además, la concentración de tampón y el pH deben mantenerse estrictamente idénticos para todas las mediciones, ya que cualquier cambio puede tener un fuerte impacto en las propiedades de fluorescencia.
La medición de por vida también puede ser delicada. La vida útil de la fluorescencia del donante puede ser inestable, por ejemplo debido a una alta excitación. En tal caso, ajustar la potencia del láser y el zoom puede solucionar el problema. Otra fuente bien conocida de artefactos en las mediciones de TCSPC es la acumulación de pulsos de fotones. De hecho, TCSPC no puede medir la velocidad de dos fotones emitidos entre los mismos dos pulsos láser. Mientras que las muestras de plantas están altamente estructuradas, la fluorescencia no es homogénea y puede conducir a un efecto de acumulación de pulso oculto. Mientras que el número de fotones por segundo permanece por debajo del límite de excitación del 1%, puede ser mayor en algunas áreas de muestra. Para garantizar que no haya experimentos de acumulación, se puede considerar la medición de la vida útil de la fluorescencia del donante en un flujo de fotones diferente. Si la vida útil aumenta mientras el flujo disminuye, un efecto de acumulación está alterando las mediciones. El flujo de fotón óptimo se alcanza con la estabilidad de por vida del donante.
En cuanto al análisis de curva de descomposición sFLIM, se recomienda confiar en cada ajuste de curva individual para asegurarse de que el modelo describe con precisión las mediciones. Si no es el caso, primero asegúrese de que ninguno de los artefactos mencionados anteriormente ha dañado los datos. A continuación, el paso 2.1.4 proporciona la función de respuesta instrumental (IRF) del sistema. Si el IRF presenta algunas anomalías, optimice la trayectoria óptica para minimizarlas. También se puede utilizar un IRF medido para el montaje durante el paso 6.2. Por último, los grados de libertad del modelo de ajuste se pueden aumentar a una decadencia triexponencial en el paso 6.2. Sin embargo, el número de fotones necesarios para la determinación individual de la vida útil y la proporción es alto y, por lo tanto, se recomienda usarlos solo para lograr una vida media más estable a partir del paso 6.4. Información más exhaustiva sobre FLIM, su caracterización18,sFLIM y su aplicación12 notablemente a lignin10, se puede encontrar en la literatura.
Aunque es difícil, la medición de FRET en tejidos vegetales utilizando autofluorescencia nativa muestra algunas ventajas. En comparación con las mediciones FRET realizadas en tejidos vivos en los que los estudios de interacción entre biomoléculas a menudo requieren ingeniería genética para expresar marcadores fluorescentes intrínsecos, los tejidos vegetales inflamados como los presentados aquí, ofrecen autofluorescencia, y las sondas fluorescentes de pareja extrínsicas se pueden agregar fácilmente, ahorrando mucho tiempo. Sin embargo, dependiendo de las especies vegetales analizadas y de los posibles pretratamientos realizados, es probable que se modifique la autofluorescencia, por lo que es necesario caracterizarla cuidadosamente y que el fluoróforo utilizado como sondas pueda necesitar ser adaptado.
El método sFLIM debe aplicarse a sondas fluorescentes que carezcan de actividad catalítica (PEG y dextran). En el marco de la hidrólisis de lignocelulosa vegetal, se podrían realizar interacciones de enzimas en diversas muestras de biomasa, lo que posiblemente resultaría en la determinación del impacto de la localización (células y tejidos) en la fuerza de interacción. El siguiente paso de optimización será la automatización del paso de análisis. De hecho, con suficientes datos analizados, se podría implementar un procedimiento de análisis basado en el aprendizaje automático para el análisis automatizado de fenotipos, lo que aumentaría su amenabilidad a un rápido cribado de eficiencia enzimática-biomasa. Además, sFLIM no requiere fijación de la muestra y se puede aplicar fácilmente a estudios dinámicos de interacción enzima-lignina. Tal método único es probable que guíe la estrategia de ingeniería enzimática y el pretratamiento de la biomasa para optimizar la valorización de la lignocelulosa.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Fanny Laurent (FARE) es calurosamente agradecida por la preparación de las cifras. La Federación de Investigación FRABio (Universidad de Lille, CNRS) es reconocida por proporcionar el entorno técnico propicio para lograr este trabajo. Se obtuvo financiación de la Agencia Nacional de Investigación francesa (proyecto LIGNOPROG ANR-14-CE05-0026).
Materiales
| Name | Company | Catalog Number | Comments |
| Confocal microscope | ZEISS | LSM 710 NLO | for confocal imaging |
| fine brush | to collect sections | ||
| glass vials | for incubations | ||
| high precision microscope cover glasses 170+/-5µm n°1,5# | Marienfeld | 0107032 | saled by Dutscher s.a in France |
| Infra-red pulsed laser | COHERENT | CHAMELEON VISION | For sample excitation |
| Micropipette Research Plus monocanal 20-200µL | Eppendorf | with corresponding tips | |
| Micropipette Research Plus monocanal 2-20µL | Eppendorf | with corresponding tips | |
| Microscope slides ca. 76 x 26 mm ground edges frosted end | Thermo Fisher Scientific | LR45D | |
| microtome blades disposable (pack of 50) | Agar Scientific | T5024 | saled by Oxford Instruments in France |
| mPEG-Rhodamine, 10 kDa | Creative Peg Works | PSB-2263 | |
| mPEG-Rhodamine, 20 kDa | Creative Peg Works | PSB-22642 | |
| mPEG-Rhodamine, 5 kDa | Creative Peg Works | PSB-2264 | |
| nail polish | for mounting | ||
| pH meter five easy plus | Mettler toledo | FEP20 | with electrode |
| poly (ethylene Glycol) average mol wt 1450 | Merck (sigma-Aldrich) | P5402-1kg | for sample embedding |
| razor blades, single edges blades, stainless steel, box of 100 | Agar Scientific | T586 | for fragments preparation saled by Oxford Instruments in France |
| rotary microtome | Microm Microtech | HM 360 | |
| sFLim detector | BECKER-HICKL | SPC 150 | for lifetime acquisition |
| sodium dihydrogen phosphate dihydrate NaH2PO4, 2H2O | Merck (sigma-Aldrich) | 71500 | for buffer solution |
| sodium phosphate dibasic dihydrate Na2HPO4,2H2O | Merck (sigma-Aldrich) | 30435-1kg | for buffer solution, old reference, the new one is 71643-1kg |
| tetramethyl rhodamine isothiocyanate-dextran 10 k Da | Merck (sigma-Aldrich) | R8881-100mg |
Referencias
- Inouye, H., et al. Multiscale deconstruction of molecular architecture in corn stover. Scientific Reports. 4, 3756 (2014).
- Li, X., Zheng, Y. Lignin-enzyme interaction: Mechanism, mitigation approach, modeling, and research prospects. Biotechnology Advances. 35 (4), 466-489 (2017).
- Vogel, J. Unique aspects of the grass cell wall. Current Opinion in Plant Biology. 11 (3), 301-307 (2008).
- Lynd, L. R. The grand challenge of cellulosic biofuels. Nature Biotechnology. 35, 912 (2017).
- Clegg, R. M. Fluorescence resonance energy transfer. Current Opinion in Biotechnology. 6, 103-110 (1995).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. C. Advanced fluorescence microscopy techniques-FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Pietraszewska-Bogiel, A., Gadella, T. W. J. FRET microscopy: from principle to routine technology in cell biology. Journal of Microscopy. 241 (2), 111-118 (2011).
- Herbaut, M., et al. Multimodal analysis of pretreated biomass species highlights generic markers of lignocellulose recalcitrance. Biotechnology for Biofuels. 11, 52 (2018).
- Chabbert, B., et al. Fluorescence techniques can reveal cell wall organization and predict saccharification in pretreated wood biomass. Industrial Crops and Products. 123, 84-92 (2018).
- Terryn, C., Paës, G., Spriet, C. FRET-SLiM on native autofluorescence: a fast and reliable method to study interactions between fluorescent probes and lignin in plant cell wall. Plant Methods. 14 (1), 74 (2018).
- Jovin, T. M., Arndt-Jovin, D. J., Kohen, E. . Cell Structure and Function by Microspectrofluorometry. , 99-117 (1989).
- Spriet, C., et al. Correlated fluorescence lifetime and spectral measurements in living cells. Microscopy Research and Technique. 70 (2), 85-94 (2007).
- Donaldson, L. A., Newman, R. H., Vaidya, A. Nanoscale interactions of polyethylene glycol with thermo-mechanically pre-treated Pinus radiata biofuel substrate. Biotechnology and Bioengineering. 111 (4), 719-725 (2014).
- Herbaut, M., Zoghlami, A., Paës, G. Dynamical assessment of fluorescent probes mobility in poplar cell walls reveals nanopores govern saccharification. Biotechnology for Biofuels. 11 (1), 271 (2018).
- Paës, G., Chabbert, B. Characterization of arabinoxylan / cellulose nanocrystals gels to investigate fluorescent probes mobility in bio-inspired models of plant secondary cell wall. Biomacromolecules. 13, 206-214 (2012).
- Donaldson, L. A., Radotic, K. Fluorescence lifetime imaging of lignin autofluorescence in normal and compression wood. Journal of Microscopy. 251 (2), 178-187 (2013).
- Auxenfans, T., Terryn, C., Paës, G. Seeing biomass recalcitrance through fluorescence. Scientific Reports. 7, 8838 (2017).
- Waharte, F., Spriet, C., Héliot, L. Setup and characterization of a multiphoton FLIM instrument for protein-protein interaction measurements in living cells. Cytometry A. 4, 299-306 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados