Method Article
Medindo interações entre sondas fluorescentes e lignina em seções de plantas por sFLIM Com base na autofluorescência nativa
Neste Artigo
Resumo
Este protocolo descreve uma configuração original que combina medições espectrais e fluorescência ao longo da vida para avaliar a transferência de energia de ressonância Förster (FRET) entre sondas fluorescentes à base de rodamina e polímero de lignina diretamente em seções de plantas espessas.
Resumo
Na biomassa lignocelulósica (LB), a atividade das enzimas é limitada pelo aparecimento de interações não específicas com a lignina durante o processo de hidrolise, que mantém enzimas longe de seu substrato. A caracterização dessas interações complexas é, portanto, um desafio em substratos complexos, como a LB. O método aqui mede as interações moleculares entre moléculas com marcação de fluorofofóbico e a lignina autofluorescente nativa, a ser revelada pela transferência de energia de ressonância förster (FRET). Ao contrário das medições de FRET em células vivas usando dois fluorofônicos exógenos, as medições de FRET em plantas que usam lignina não são triviais devido à sua complexa autofluorescência. Desenvolvemos um pipeline original de aquisição e análise com observação correlacionada de duas propriedades complementares de fluorescência: emissão de fluorescência e vida ao longo da vida. SFLIM (microscopia de imagem espectral e fluorescente ao longo da vida) fornece a quantificação dessas interações com alta sensibilidade, revelando diferentes níveis de interação entre biomoléculas e lignina.
Introdução
A lignocelulose hidrolicada em açúcares mononóicos, como a glicose, requer enzimas. Sua atividade é conhecida por ser contida pelo estabelecimento de interações não específicas entre enzimas e lignina1,2, sendo este último um polímero hidrofóbico e um componente importante da lignocelulose3. Assim, medir quantitativamente tais interações diretamente na escala celular é um desafio que deve ser abordado para otimizar a atividade catalítica enzimática e a lignocelulose pré-tratamento4.
Förster (ou fluorescência) de transferência de energia de ressonância (FRET) medição é um método de escolha para assa biomoléculas interação in situ. Esta transferência de energia não radiativa pode ocorrer entre um doador e um fluorofiforre aceitante se cumprirem condições diferentes. O espectro de emissão de doadores deve sobrepor-se, pelo menos parcialmente, ao espectro de excitação dos aceitadores. A escolha dos fluoroforreos é, portanto, crucial para tais experimentos. Em seguida, a eficiência de transferência diminui com a sexta potência de sua distância5 e só ocorre se ambas as moléculas estão nas proximidades (normalmente na faixa de nanômetros). Outra contingência pode alterar a eficiência de transferência, como orientação dipolo-dipolo, mas são atenuadas se os flúoros tiverem flexibilidade.
O FRET pode ser medido por diferentes técnicas e descrições detalhadas podem ser encontradas na literatura6,7. Em resumo, os principais métodos dependem de: i) emissão sensibilizada em que a variação na fluorescência de emissão de aceitamento é seguida e fornece principalmente resultados qualitativos; ii) o retolix do acceptor em que a fluorescência da emissão do doador é medida antes e depois do photobleaching do aceitador (neste caso, umas estimativas mais precisas do FRET podem ser conseguidas mas exigem o poder forte do laser aplicado às amostras fixas); e iii) medida vitalícia que diminui para o doador na presença do aceitador. Este método requer instrumentos específicos e permite medições de interação precisas e sensíveis entre fluorofóforos. Considerando a medição do FRET entre sondas fluorescentes e lignocelulose, a principal dificuldade é que a lignocelulose não é um único fluoroffore bem caracterizado: tem uma forte autofluorescência nativa e espectrarally-wide, principalmente proveniente da lignina, e dependente de espécies de biomassa8,9.
Neste artigo, propomos um procedimento novo e original adaptado a seções de amostras de madeira/planta. Este método baseado em SFLIM abre o caminho para medições quantitativas de FRET entre sondas fluorescentes e lignina em amostras de lignocelulose nativas.
Protocolo
1. Preparação da amostra
NOTA: Etapas sucessivas para preparar as amostras são descritas na Figura 1.
- Preparação da amostra da planta
- De troncos de madeira ou fragmentos, corte amostras de 1 cm de comprimento com lâminas de barbear sem danificar sua estrutura.
- Incorporar amostras em polietileno glicol (PEG) médio, mergulhando-os em soluções sucessivas de aumento da concentração PEG diluído em água até chegar a 100% PEG.
- Coloque a amostra vácuo para remover a água.
- Misture delicadamente amostras em 30% v/v PEG por 24 h.
- Misture delicadamente amostras em 50% v/v PEG por 24 h.
- Mexa delicadamente amostras em 100% PEG para 24 h a 70 °C (PEG puro é sólido à temperatura ambiente).
- Coloque amostras em cápsulas a 70 °C (em uma placa quente) e diminua progressivamente a temperatura até atingir a temperatura ambiente.
- Prepare cuidadosamente 30-60 μm espessura seções planas a partir desses blocos PEG usando um microtome e lâminas descartáveis.
- Coletar e lavar seções em três banhos sucessivos de água por 5 minutos para remover PEG das seções.
- Preparação fluorescente da ponta de prova
- Prepare a solução tampão de fosfato de 30 mM em pH 6.0.
- Pese PEG rhand dextran rhodamine probe powder.
- Dissolva o pó da ponta de prova no amortecedor com agitação contínua em um frasco de vidro para 1 h na obscuridade em uma concentração final de 0.1 g/L.
- Mancha da amostra da planta
- Incubate seções com 500 μL da sonda fluorescente (ver 1.2.3) para 72 h (sem agitação) em um tubo de plástico (não mais de 3 seções por tubo) no escuro.
- Pegue uma seção com um pincel, adsorb o buffer com uma folha limpa (evite secar a seção), e, em seguida, montar as seções incubadas entre um copo de cobertura e um coverslip #1,5H.
2. Fluorescência ao longo da vida e calibração do sistema de medição espectral
NOTA: O fluxo de trabalho completo para medição sFLIM é apresentado na Figura 2.
- Determine a largura da janela espectral do detector sFLIM.
- Coloque cristais de urea em uma caixa de cultura com um fundo de vidro de 0,17 μm.
- Coloque a caixa de cultura em um suporte de amostra de microscópio e selecione o objetivo 20x.
- Selecione um laser Ti:Sa com um comprimento de onda de 900 nm e 2% de potência, e ligue a digitalização.
- Colete o segundo sinal harmônico no detector sFLIM.
NOTA: O segundo sinal harmônico é emitido exatamente em metade do comprimento de onda de excitação de 450 nm; embora instantâneo, esta medida também fornece a função de resposta instrumental do sistema. - Ajuste gradualmente o comprimento de onda de excitação a laser de 900 para 980 nm até que o segundo sinal harmônico seja coletado no segundo canal espectral (462,5 nm).
- Determine o comprimento da janela espectral (12,5 nm).
- Se a faixa espectral difere do que é esperado, solucionar problemas, fazendo o seguinte.
- Ajuste o laser para 910 nm.
- Mova a posição de grade com uma roda de rolagem para medir o segundo sinal harmônico apenas no primeiro canal (limite do primeiro canal).
- Ajuste o laser para 935 nm.
- Mova a posição de grade com uma roda de rolagem para medir o segundo sinal harmônico apenas no primeiro canal (limite do segundo canal).
- Calibração dos canais espectrômetros gerais
- Insira o espelho no estágio do microscópio.
- Selecione o laser contínuo visível (458 nm, 1% de potência).
- Colete o sinal de reflexão no detector sFLIM e verifique se os fótons são medidos no canal espectral apropriado.
- Repita o passo 2.2.2 e 2.2.3 com todos os lasers contínuos disponíveis (514 nm, 561 nm e 633 nm).
- Se o canal espectral difere do que é esperado, mova a posição de grade com a roda de rolagem e repita os passos 2.1 e 2.2.
3. Caracterização da fluorescência da amostra
- Em um espectrofluorometer equipado com um acessório titular de filme (por exemplo, instrumento Jasco FP-8500), coloque a amostra da seção de plantas (não incubada com a sonda fluorescente).
- Medir a emissão de fluorescência normalmente na faixa de 300-600 nm, enquanto empolgante a amostra normalmente na faixa 250-550 nm.
- Traçar a intensidade da fluorescência versus excitação e comprimentos de onda de emissão para desenhar um mapa de fluorescência 3D.
- Determine a área máxima de excitação/emissão do enredo.
4. Medida espectral do FRET
- Calibração da autofluorescência
- Selecione o objetivo 20x (NA: 0,8).
- Defina a excitação a laser de dois fótons em 750 nm.
- Coloque a palha de trigo (WS) seção única planta entre o slide eo coverslip.
- Aplique os seguintes parâmetros no software. Mude para o modo lambda. Selecione o detector espectral ChS com uma resolução de 9,7 nm. Selecione a faixa espectral entre 420 a 722 nm.
- Adquirir a imagem.
- Determinar o pico de emissão de doadores (470 nm com esta configuração).
- Calibração do aceitador
- Coloque sondas fluorescentes à base de rodamina em uma caixa de cultura com um fundo de vidro de 0,17 μm.
- Adquirir a imagem com a mesma configuração.
- Determine o pico de emissão de aceitadores (570 nm com esta configuração).
- Determine a faixa espectral com o sinal máximo "WS sozinho" e nenhum sinal de aceitador como a única emissão do doador para medições sFLIM (460-490 nm com esta configuração).
- Medição da amostra
- Coloque a seção de planta manchada entre o escorregador e o deslizamento de capa.
- Adquirir a imagem com a mesma configuração.
- Guarde o arquivo lsm.
- Qualitativamente associar um evento forte fret com uma diminuição no pico de emissão de doadores em comparação com a "amostra WS sozinho" e um aumento no pico de emissão de aceitadores em comparação com a amostra de rodína.
5. medições sFLIM
NOTA: Para a configuração sFLIM, o sistema utilizado é uma configuração sFLIM domínio do tempo, como descrito anteriormente10. Um microscópio ereto e vários tempos correlacionados cartões de contagem de fótons individuais e fabricantes de microscópio confocal podem ser usados e o protocolo deve ser adaptado em conformidade.
- Mude o sistema para o modo sFLIM.
- Defina o microscópio confocal como descrito em 4.1.1 e 4.1.2.
- Mude para o modo não digitalizado no software para enviar fótons fluorescentes para o detector sFLIM.
- Defina a aquisição sFLIM para o modo Habilitar para permitir que o fólio contem o SPC150.
- Selecione a coleta de tempo de 30 anos no SPC150.
- Verifique se o CFD está entre 1 x 105 e 1 x 106.
CUIDADO: Certifique-se de que o número de fótons medidos no cartão TCSPC é sempre inferior a 1% da freqüência de excitação a laser (nesta configuração, a freqüência de excitação a laser é de 80 Mhz e taxa de detecção não pode exceder 800 kHz em qualquer pixel para evitar um efeito de acumulação11).
- Coloque a seção de plantas "WS sozinho" entre o slide e o deslizamento de capa.
- Defina o software para o modo contínuo para permitir a varredura a laser.
- Escolha a área de medição na amostra.
- Clique Em Iniciar o SPC150.
- Guarde o arquivo sdt.
- Repita o processo para pelo menos 10 amostras por condição.
- Coloque a seção de planta manchada entre o escorregador e o deslizamento de capa.
- Repita os passos 5.2.1 - 5.2.5.
6. análise sFLIM
- Selecione os dados sFLIM adquiriram arquivo em "WS sozinho" e importá-los para o software SPCImage usando Arquivo | Importação.
- Selecione parâmetros de ajuste.
- A partir de opção | Modelo, selecione multi-exponencios incompletos: 12,5 ns.
- A partir de opção | Preferências, selecione calcular resposta instrumental automaticamente.
- Do menu direito do painel principal, selecione o modelo de ajuste exponencial 2:
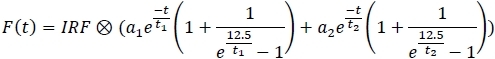
- Para cada canal, aplique o modelo de montagem e salve os parâmetros de ajuste a uma planilha (a1,a2,t1, t2).
- Para comparação entre canais e experimentos, calcule a vida média de fluorescência em uma planilha (Tm):
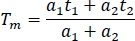
- Calcule a vida média para todas as amostras (pelo menos 10) em todos os canais.
- Analise Tm em canais de doadores (do canal 1 a 3: 460-490 nm) e determine o canal dedicado (Canal 2 correspondente a 467,5 - 480 nm) que mostra o maior número de fótons e corresponde à emissão máxima de lignina. Os valores do canal 2 devem ser usados na etapa 6.7.
- Selecione os dados sFLIM adquiridos arquivo sobre WS manchado e importá-los para o software SPCImage.
- Repita os passos 6.1-6.4.
- Calcule a eficiência do FRET EFRET para o doador no canal selecionado anterior WS Alone (TmD) e a partir de amostra de planta manchada (TmDA):
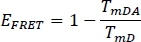
- Compare os valores sFLIM e EFRET entre o WS e a amostra.
- Considere um EFRET positivo associado a uma diminuição homogênea ao longo da vida entre a SW e a amostra a ser analisada como um evento de FRET (veja resultados representativos e obras de Spriet et al.12 e Terryn et al.10 para detalhes).
- Considere uma diminuição da vida distribuída de forma diferente devido a uma mistura de FRET e nível de compactação de lignina e não interprete como interações moleculares.
- Considere nenhuma modificação vitalícia como uma ausência de sinal de FRET mensurável, mas não como uma falta de interação com a lignina
Resultados
Para demonstrar a capacidade sFLIM de dissecar interações moleculares entre a lignina e moléculas fluorescentes marcadas, usamos pela primeira vez três amostras diferentes(Figura 3):palha de trigo nativa (WS), palha de trigo nativa incubada com PEG marcada com rodamina (PR10) e palha de trigo nativa com dextran marcado com rhodamina (DR10). PR10 é conhecido por interagir com a lignina, enquanto DR10 é suposto ser inerte13,14,15. Curvas sFLIM(Figura 3,superior) mostram algumas modificações que podem ser alcançadas entre a amostra de referência (WS) e dois casos de interação (DR10 e PR10). Na verdade, pode-se primeiro perceber facilmente o aumento da fluorescência em regiões espectrais correspondentes à faixa de emissão de rodímina. A observação cuidadosa das três primeiras curvas de decadência do fótons do canal também revela uma inflexão mais forte para DR10 do que para PR10. Depois de encaixar as curvas de decadência do fótons e calcular cada canal média de fluorescência ao longo da vida, a assinatura fret torna-se mais óbvia(Figura 3, inferior). De fato, enquanto a vida de fluorescência aumenta e diminui ao longo do espectro de fluorescência para a amostra ws, uma assinatura fret clara é observada tanto para PR10 quanto PARA DR10 com: 1) um valor vitalício constante no canal de emissão somente para doadores (3 primeiros canais, em azul); e 2) uma vida crescente da fluorescência na canaleta espectral que corresponde a uma contribuição crescente do fluorophore elevado do doador da vida.
Uma vez que o FRET inequívoco foi determinado, a comparação da vida da fluorescência da lignina (canal 2) permite a quantificação da diminuição da vida entre WS (0.47 ns), DR10 (0.42 ns) e PR10 (0.36 ns) e assim, revela interações moleculares entre a lignina e PR10 e DR10 com uma afinidade mais forte para PR10.
Para ilustrar a relevância deste método para quantificar diferentes níveis de interação, escolhemos três outras amostras, imitando a acessibilidade enzimática em cima de amostras de plantas tratadas: WS tratada com ácido (AWS), em combinação com PR de dois pesos moleculares contrastados de 5 kDa e 20 kDa (PR5 e PR20). Após uma inspeção cuidadosa das assinaturas sFLIM, a vida de fluorescência de lignina é extraída(Figura 4). Como dito anteriormente, a vida de fluorescência de lignina pode ser alterada pelo seu ambiente16,17. Após o tratamento ácido, as medidas de fluorescência ao longo da vida na AWS (0,28 ns) tornam-se menores do que a medida anteriormente para OM (0,47 ns), o que confirma a exigência do procedimento sFLIM para interpretação inequívoca da diminuição ao longo da vida e a necessidade de controles negativos para cada condição testada. Como esperado, uma forte diminuição ao longo da vida é observada ao adicionar PR à AWS enquanto interage com a lignina. Além disso, a interação é mais forte com PR5 (0,14 ns) em relação ao PR20 (0,16 ns), o que é consistente com a medição do raio hidrodinâmico (2,3 nm e 4,8 nm para PR5 e PR20, respectivamente), induzindo diferentes restrições steric e, portanto, maior acessibilidade de PR5 à lignina.
Ambos os experimentos demonstram a relevância deste método para avaliar finamente as interações com a lignina com enzimas, dependendo de seu tamanho e de amostras de plantas pré-tratamento.

Figura 1: Diferentes etapas de preparação das amostras. Palha de trigo (WS) (A)é reduzida pela primeira vez em tamanho (B)a ser incorporado no meio PEG (C). O bloco é cortado usando um microtome equipado com lâminas descartáveis (D). Após a lavagem, as seções resultantes (E)são colocadas para incubação em PEG ou solução de rhodamina marcada(F). As seções rotuladas são montadas para medições sFLIM (G). Barras de escala são 2 cm (A), 1 cm (B e C),200 μm (E e G). Clique aqui para ver uma versão maior deste número.
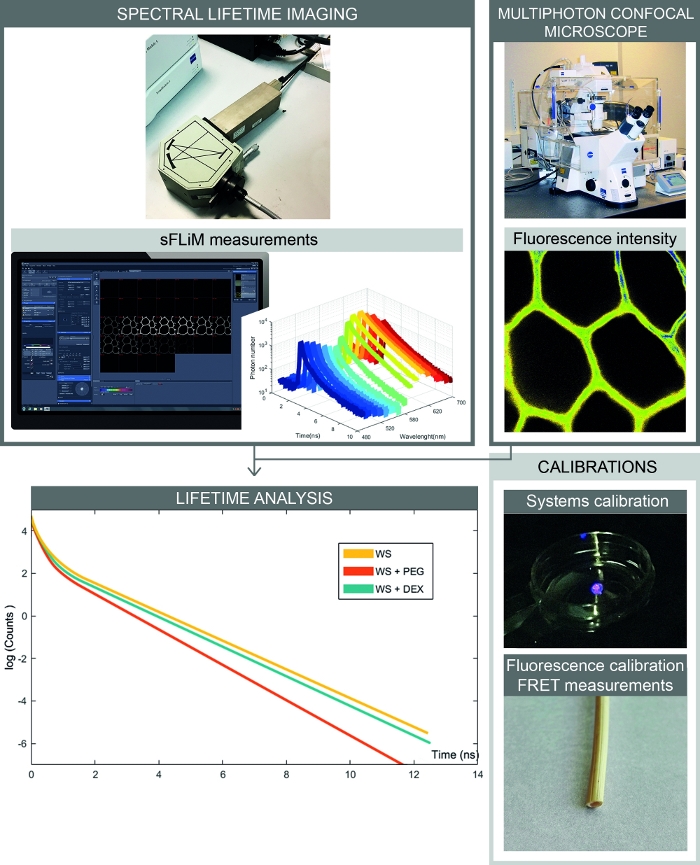
Figura 2: Fluxo de trabalho completo de medições de interações baseadas em FRET espectral. A figura apresenta a configuração que combina a intensidade espectral da fluorescência e as medidas da vida. As imagens de fluorescência espectral são adquiridas com um microscópio confocal, e as vidas sequencialmente fluorescência para cada faixa espectral são medidas com o detector sFLIM. A análise das curvas de decaimento do fótons permite a determinação precisa das interações entre a amostra e as moléculas de interesse. As calibrações têm de ser processadas para evitar artefactos. Primeiro, o detector de sFLIM precisa ser calibrado e spectrally e sua função de resposta instrumental tem que ser verificada. Em segundo lugar, o complexo sinal de autofluorescência tem que ser calibrado com precisão para cada amostra para determinar a vida de fluorescência em cada canal antes da adição de uma molécula aceitadora. Clique aqui para ver uma versão maior deste número.

Figura 3: Medidas representativas do sFLIM. curvas sFLIM (painel superior) foram adquiridas em palha de trigo nativa (WS), WS incubada com PEG marcado com rhodamine (WS + PEG) e palha de trigo nativo com dextran marcado com rodomina (WS + DEX). Para cada amostra, as curvas sFLIM foram equipadas com um modelo de decaimento biexponencial e o tempo médio de fluorescência foi calculado para cada canal (painel inferior). As amostras WS+PEG e WS+DEX apresentam uma diminuição na vida de fluorescência no canal correspondente apenas à autofluorescência (três primeiras barras) associadaa a um aumento vitalício no canal correspondente a uma emissão mista de autofluorescência e roddamina. Esse comportamento é característico de um evento de FRET entre moléculas marcadas por lignina e rodamina. Clique aqui para ver uma versão maior deste número.
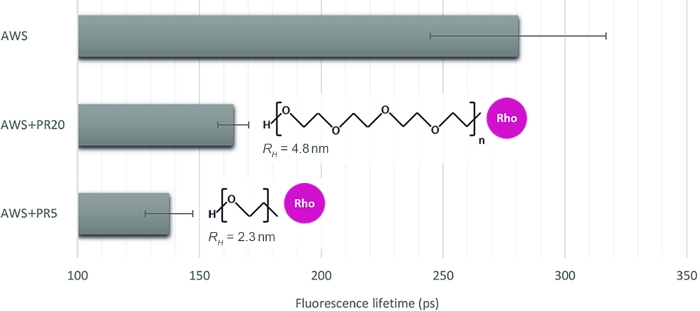
Figura 4: Análise vitalícia da fluorescência do canal correspondente à autofluorescência da lignina. Depois de validar um evento de FRET com base na assinatura sFLIM, a vida média de fluorescência foi medida em WS (AWS), tratada com ácido, em combinação com PR5 ou PR20 (5 kDa e 20 kDa, respectivamente). Quando ambas as amostras do fotorreceptor apresentarem uma diminuição da vida, menor é caracterizada por uma redução mais forte da vida, revelando uma interação molecular mais forte com o ligignin. O método é, portanto, sensível o suficiente para discriminar entre ambos (valor médio e erro padrão estão representados, n >10 por condição). Clique aqui para ver uma versão maior deste número.
Discussão
As medições de espectro de fluorescência e espectro de emissões de correlação permite combinar vantagens de ambos os métodos. De fato, as medições espectrais por si só carecem de sensibilidade e permanecem qualitativas. Por outro lado, a vida de fluorescência é o método de escolha para as medições quantitativas tradicionais de FRET, mas foi demonstrado que a autofluorescência da lignina poderia variar dependendo da composição da lignina e do ambiente16. Assim, as interações de lignina com um aceitador ou lignina mudanças estruturais não podem ser discriminadas, uma vez que ambos resultam em uma diminuição ao longo da vida. Como demonstrado, o método desenvolvido fornece a medida inequívoca, sensível e quantitativa das interações entre moléculas da lignina e do aceitador em seções da planta. Mesmo que as diferentes etapas do método tenham sido rigorosamente otimizadas, o cuidado deve ser particularmente tomado para os seguintes pontos.
Em relação às amostras, a qualidade da seção de plantas é fundamental para garantir imagens em foco. As etapas diferentes para peg incorporação devem ser rigorosamente seguidas. A etapa final da lavagem é essencial para garantir que não haja interferência do PEG restante nas amostras. Além disso, a concentração tampão e o pH devem ser mantidos estritamente idênticos para todas as medidas desde que toda a mudança pode ter um impacto forte em propriedades da fluorescência.
A medição da vida também pode ser delicada. A vida útil da fluorescência do doador pode ser instável, por exemplo por causa de uma alta excitação. Nesse caso, ajustar o poder do laser e o zoom pode corrigir o problema. Outra fonte bem conhecida de artefatos em medições TCSPC é o acúmulo de pulso de fótons. Na verdade, tcspc não pode medir a velocidade de dois fótons emitidos entre os mesmos dois pulsos de laser. Quando as amostras da planta forem estruturadas altamente, a fluorescência não é homogênea e pode conduzir a um efeito escondido do pileup do pulso. Embora o número de fótons por segundo permaneça abaixo do limite de excitação de 1%, pode ser maior em algumas áreas amostrais. Para garantir que não haja experimentos de engavetamento, a medição da vida de fluorescência do doador em um fluxo de fótons diferente pode ser considerada. Se a vida aumenta enquanto o fluxo diminui, um efeito pileup está alterando as medições. Fluxo de fótons ideal é alcançado com a estabilidade vitalícia do doador.
Em relação à análise da curva de decaimento sFLIM, recomendamos confiar em cada curva individual adequada para garantir que o modelo descreva com precisão as medições. Se não for o caso, primeiro garantir que nenhum dos artefatos mencionados anteriormente corromperam os dados. Em seguida, a etapa 2.1.4 fornece a função de resposta instrumental (IRF) do sistema. Se a IRF apresentar algumas anomalias, otimize o caminho óptico para minimizá-las. Um IRF medido para a montagem durante a etapa 6.2 pode igualmente ser usado. Finalmente, os graus de liberdade do modelo de montagem podem ser aumentados a uma deterioração três-exponencial na etapa 6.2. No entanto, o número de fótons necessários para a determinação individual de vida e proporção é alto e, portanto, é recomendado apenas usá-los para alcançar uma vida média mais estável a partir do passo 6.4. Informações mais exaustivas sobre a FLIM, sua caracterização18,sFLIM e sua aplicação12, nomeadamente à lignina10,podem ser encontradas na literatura.
Embora desafiador, a medida do FRET nos tecidos da planta usando o autofluorescence nativo mostra algumas vantagens. Em comparação com as medições de FRET realizadas em tecidos vivos em que os estudos de interação entre biomoléculas muitas vezes requer engenharia genética para expressar marcadores fluorescentes intrínsecos, tecidos vegetais dignificados como os apresentados aqui, oferecem autofluorescência, e extrínseco parceiro sondas fluorescentes podem ser facilmente adicionados, economizando muito tempo. No entanto, dependendo das espécies de plantas analisadas e de possíveis pré-tratamentos realizados, a autofluorescência provavelmente será modificada, de modo que ela precise ser cuidadosamente caracterizada e o fluorofifore usado como sondas pode precisar ser adaptado.
O método sFLIM deve ser aplicado a sondas fluorescentes sem atividade catalítica (PEG e dextran). No quadro da hidrólise da lignocelulose vegetal, foram realizadas interações de enzimas em várias amostras de biomassa, possivelmente resultando na determinação do impacto da localização (células e tecidos) na força de interação. A próxima etapa de otimização será a automação da etapa de análise. De fato, com dados analisados suficientes, um procedimento de análise baseado em aprendizado de máquina poderia ser implantado para análise automatizada do fenótipo, o que aumentaria sua comodidade para o rastreamento rápido de eficiência de biomassa de enzimas. Além disso, o sFLIM não requer fixação da amostra e pode ser facilmente aplicado a estudos dinâmicos de interação enzima-lignina. Tal método único é susceptível de orientar a estratégia de engenharia enzimática e pré-tratamento de biomassa para otimizar a valorização da lignocelulose.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Fanny Laurent (FARE) é calorosamente agradecida pela preparação dos números. A Federação de Pesquisa FRABio (Universidade de Lille, CNRS) é reconhecida por fornecer o ambiente técnico propício para a realização deste trabalho. O financiamento foi obtido pela Agência Nacional de Pesquisa Francesa (PROJETO LIGNOPROG ANR-14-CE05-0026).
Materiais
| Name | Company | Catalog Number | Comments |
| Confocal microscope | ZEISS | LSM 710 NLO | for confocal imaging |
| fine brush | to collect sections | ||
| glass vials | for incubations | ||
| high precision microscope cover glasses 170+/-5µm n°1,5# | Marienfeld | 0107032 | saled by Dutscher s.a in France |
| Infra-red pulsed laser | COHERENT | CHAMELEON VISION | For sample excitation |
| Micropipette Research Plus monocanal 20-200µL | Eppendorf | with corresponding tips | |
| Micropipette Research Plus monocanal 2-20µL | Eppendorf | with corresponding tips | |
| Microscope slides ca. 76 x 26 mm ground edges frosted end | Thermo Fisher Scientific | LR45D | |
| microtome blades disposable (pack of 50) | Agar Scientific | T5024 | saled by Oxford Instruments in France |
| mPEG-Rhodamine, 10 kDa | Creative Peg Works | PSB-2263 | |
| mPEG-Rhodamine, 20 kDa | Creative Peg Works | PSB-22642 | |
| mPEG-Rhodamine, 5 kDa | Creative Peg Works | PSB-2264 | |
| nail polish | for mounting | ||
| pH meter five easy plus | Mettler toledo | FEP20 | with electrode |
| poly (ethylene Glycol) average mol wt 1450 | Merck (sigma-Aldrich) | P5402-1kg | for sample embedding |
| razor blades, single edges blades, stainless steel, box of 100 | Agar Scientific | T586 | for fragments preparation saled by Oxford Instruments in France |
| rotary microtome | Microm Microtech | HM 360 | |
| sFLim detector | BECKER-HICKL | SPC 150 | for lifetime acquisition |
| sodium dihydrogen phosphate dihydrate NaH2PO4, 2H2O | Merck (sigma-Aldrich) | 71500 | for buffer solution |
| sodium phosphate dibasic dihydrate Na2HPO4,2H2O | Merck (sigma-Aldrich) | 30435-1kg | for buffer solution, old reference, the new one is 71643-1kg |
| tetramethyl rhodamine isothiocyanate-dextran 10 k Da | Merck (sigma-Aldrich) | R8881-100mg |
Referências
- Inouye, H., et al. Multiscale deconstruction of molecular architecture in corn stover. Scientific Reports. 4, 3756 (2014).
- Li, X., Zheng, Y. Lignin-enzyme interaction: Mechanism, mitigation approach, modeling, and research prospects. Biotechnology Advances. 35 (4), 466-489 (2017).
- Vogel, J. Unique aspects of the grass cell wall. Current Opinion in Plant Biology. 11 (3), 301-307 (2008).
- Lynd, L. R. The grand challenge of cellulosic biofuels. Nature Biotechnology. 35, 912 (2017).
- Clegg, R. M. Fluorescence resonance energy transfer. Current Opinion in Biotechnology. 6, 103-110 (1995).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. C. Advanced fluorescence microscopy techniques-FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Pietraszewska-Bogiel, A., Gadella, T. W. J. FRET microscopy: from principle to routine technology in cell biology. Journal of Microscopy. 241 (2), 111-118 (2011).
- Herbaut, M., et al. Multimodal analysis of pretreated biomass species highlights generic markers of lignocellulose recalcitrance. Biotechnology for Biofuels. 11, 52 (2018).
- Chabbert, B., et al. Fluorescence techniques can reveal cell wall organization and predict saccharification in pretreated wood biomass. Industrial Crops and Products. 123, 84-92 (2018).
- Terryn, C., Paës, G., Spriet, C. FRET-SLiM on native autofluorescence: a fast and reliable method to study interactions between fluorescent probes and lignin in plant cell wall. Plant Methods. 14 (1), 74 (2018).
- Jovin, T. M., Arndt-Jovin, D. J., Kohen, E. . Cell Structure and Function by Microspectrofluorometry. , 99-117 (1989).
- Spriet, C., et al. Correlated fluorescence lifetime and spectral measurements in living cells. Microscopy Research and Technique. 70 (2), 85-94 (2007).
- Donaldson, L. A., Newman, R. H., Vaidya, A. Nanoscale interactions of polyethylene glycol with thermo-mechanically pre-treated Pinus radiata biofuel substrate. Biotechnology and Bioengineering. 111 (4), 719-725 (2014).
- Herbaut, M., Zoghlami, A., Paës, G. Dynamical assessment of fluorescent probes mobility in poplar cell walls reveals nanopores govern saccharification. Biotechnology for Biofuels. 11 (1), 271 (2018).
- Paës, G., Chabbert, B. Characterization of arabinoxylan / cellulose nanocrystals gels to investigate fluorescent probes mobility in bio-inspired models of plant secondary cell wall. Biomacromolecules. 13, 206-214 (2012).
- Donaldson, L. A., Radotic, K. Fluorescence lifetime imaging of lignin autofluorescence in normal and compression wood. Journal of Microscopy. 251 (2), 178-187 (2013).
- Auxenfans, T., Terryn, C., Paës, G. Seeing biomass recalcitrance through fluorescence. Scientific Reports. 7, 8838 (2017).
- Waharte, F., Spriet, C., Héliot, L. Setup and characterization of a multiphoton FLIM instrument for protein-protein interaction measurements in living cells. Cytometry A. 4, 299-306 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados