Method Article
在兔子中使用完全的白眼切除术建立严重干眼模型
摘要
提出了一种通过手术切除所有轨道乳腺来诱发兔子慢性干眼病的新方法。该方法与先前报道的方法不同,产生了一个稳定、可重复的缺水干眼模型,非常适合研究撕裂生理学、病理生理学和眼治疗。
摘要
干眼病(DED)是一种复杂的疾病,具有多种病因和可变症状,以眼表面炎症为主要病理生理学步骤。尽管我们在了解DED方面取得了进展,但仍然存在重大的知识差距。进展有限,部分原因是缺乏翔实的动物模型。作者最近报告了一种通过注射所有轨道乳腺(LG)组织与环凝剂A诱导的DED方法。在这里,我们报告基于所有轨道LG(腺切除术)组织的外科切除水性DED的新模型。这两种方法都使用兔子,因为它们在眼表面的大小和结构上与人眼相似。去除补膜一周后,在麻醉下手术切除轨道优越的LG,然后去除帕佩巴拉尔高级LG,最后去除劣质LG.Dacryeadenecec-Ed,证明在撕裂分解时间和Schirmer的撕裂测试中显著减少,并显著增加撕裂渗透和玫瑰刺染色。达冷冻切除术引起的DED至少持续了八个星期。没有并发症,动物对手术的容忍性很好。具有充分手术经验和对相关兔子解剖学的欣赏的人可以相对容易地掌握这项技术。由于该模型概括了人类缺水DED的特征,因此适用于眼表面平衡、DED和候选疗法的研究。
引言
保护眼表面和维护角膜的光学特性需要眼泪。它们由三层组成:内粘素涂层、中间水分量和脂质覆盖1。粘蛋白层主要产生于结膜的果子细胞中,水分物主要在乳胶腺(LG),脂质层主要在美博米亚腺1、2。轨道LG是眼泪水分和许多保护表面免受细菌攻击的蛋白质的主要来源。当水性撕裂产量降至临界水平以下时,眼表面疾病随之而来,使眼部的上皮表面失去水分量和关键的撕裂成分,包括生长因子、裂解酶和乳铁蛋白。在LG减少泪分产生的情况下,结膜和角膜组织进行适应,以补偿环境的变化。
了解从轨道LG和眼表面的补偿机制衍生的撕裂成分的贡献,当这缺乏影响我们对眼睛前部分的生理和病理生理学,以及更广泛的全球健康和疾病的理解。解决这些问题的实验方法需要一个翔实的动物模型。因此,几个小组试图开发动物模型,其中轨道LG被移除,从而有助于评估眼泪在眼部健康中的作用。最近,鼠标4报告了一个这样的模型。然而,与啮齿动物模型相比,兔子提供了许多明显的优势,包括LG的类似解剖和组织结构,也许更重要的是,与人类同行相比,角膜和结膜组织的大小和表面积相似。
通过手术切除兔子的LG组织,导致水性缺乏干眼病(DED)并非新鲜。许多报告描述了LG组织的切除,其成功程度各不相同,这反映在Schirmer的撕裂试验5、6、7、8测量的撕裂量变化中。全面了解兔子的相关解剖学和解剖学术语的清晰性对复制这种方法非常有帮助。下文对两者进行了全面概述。
乳痛腺的解剖学
兔子有两个轨道LG:较大的劣质LG(ILG)和较小的上级LG(SLG;图 1.ILG沿着轨道边缘的低劣和后向延伸。除了可变大小外,ILG 的前部分具有相当均匀的球状外观,可视为地球下皮肤的突起(图 2)。由于其相对于腺体其余部分的特征外观,它被称为 ILG 的"头"。头部的一部分环绕,躺在酶骨的外表面。这是超声生物显微镜的一个有用的里程碑,用于指导注射ILG。头部的其余部分在轨道上更分之9。
由于 ILG 剩余部分的特性外观(长而薄),因此此段称为"尾部"。尾部沿着劣等轨道边缘运行,从ILG的头部到轨道边缘,在低级和后轨道边缘以可变解剖结束(图3A)。尾部位于从轨道内容物中分离出来的深(中)的酶骨,在大部分过程中由一个星带分离,直到它到达轨道的后缘,它再次延伸到酶骨的外表面。ILG 从胡萝卜动脉的分支接收其血液供应。
SLG 有两个类似于人类的组件。一个是Palpebral优越LG(PSLG),它位于上后眼睑内向的牙垢板。它在自然界中看起来是球状的,并且有许多用于排泄水撕裂液的开口,当用 2% 的荧光素覆盖时更容易看到(图3B)。
第二个是轨道上级LG(OSLG),位于上级轨道的中位位置(图3C)。由于其靠近头骨中线的位置,不可能使用从时间或低轨道的外部手术方法成功地识别它。在新鲜尸检样本或手术病例中,当对地球施加温和的中压时,可通过位于头骨背表面的后孔进行脱垂。这种腺组织脱垂可以通过超声波生物显微镜记录。
PSLG 和 OSLG 是相邻的结构。OSLG 是一种管状结构,其导管结构合并到主排泄管中。该管道通过超轨道脊下,在PSLG端接的上盖组织中运行。沿着排泄管,腺组织符合戴维斯的原始描述已识别10(图3D)。
关于术语的说明
优秀和全面的解剖描述也使用不同的术语。戴维斯的经典轨道解剖只定义了上下LG10。然而,他对上部LG的描述清楚地详细介绍了这里更具体定义的部分,即PSLG和OSLG,而他对下部LG的描述则详细说明了这里定义为ILG的头部和尾部的部分。一个更新的和彻底的解剖图集11定义这些组织为酶腺和附件LG。术语"乳腺"在这里用于包括上述PSLG和OSLG。此术语更适合在不引起过度混淆的情况下重现此方法。
研究方案
所有脊椎动物研究均按照所有相关的法规和体制准则完成。所有研究均获得石溪大学机构审查委员会的批准,并根据视觉和眼科研究协会(ARVO)关于在眼科和视觉研究中使用动物的声明进行。
1. 动物和住房
- 使用重达 2⁄3 公斤的新西兰白兔( NZW)。
- 家兔在严格控制的环境中单独:温度(65 ± 5 °F)、湿度(45 ± 5%)和照明(12 小时开/关周期)。
注意:由于在集体饲养的兔子之间经常表现出的攻击性行为,将动物关在单独的笼子里,以防止无意的眼部损伤。 - 让兔子无限制地获得标准的兔舍和水。
- 不提供其他饮食丰富,以防止意外补充维生素A,可能会影响干眼。
- 在记录 DED 参数之前至少两周使兔子适应。
2. 去除补膜
注:为简单起见,下面将介绍右眼技术。以相同的方式在左眼完成此过程。
- 在适应期(通常是第一周)双边去除补膜。
- 将兔子放在一个适当大小的限制袋中。
- 使用1cc注射器和26G针头在肩部施用甲苯丙酮(1mg/kg)皮下注射,以使兔子安稳。这种轻度镇静的终点是当动物保持一个放松的头部位置,没有正常的扫描运动,其耳朵不再完全直立。
- 使用微移液器,应用25μL无防腐剂利多卡因(1%)眼睛。在眼睑之间插入一个线盖规格。
- 用0.3钳子(或同等)抓住顶点的膜,并将其拉过角膜表面。使用26G针将1%的利多卡因注射至膜的亚结合空间,注射1:100,000肾上腺素。注入约0.3 mL,在膜上形成中等大小的球状。超过1 mL的注射量在兔子的安全剂量范围内(2⁄4毫克/千克)。
- 拆下导线规格。等待大约5分钟,使利多卡因和肾上腺素生效。在此期间,在同胞的眼睛执行相同的程序。
- 更换导线盖规格。用0.3钳子抓住并延长角膜表面的膜。用异位切开剪刀或等效的膜在其底部切割膜。
注:出血通常很小,但在附近保持高温电池烧灼装置,并根据需要使用以尽量减少出血。直接压力在切口膜的切割基上也可以用来阻止小出血,如果它发生。 - 拆下导线盖规格。将局部抗生素膏(新霉素、多霉素、巴氏素和水皮质酮)放在角膜表面。
- 执行与协议所示的同仁眼睛相同的程序。
- 将动物放回单独的笼子里,让动物愈合至少一周,或直到结膜表面从临床角度完全愈合,然后再进行任何进一步的检测或干预。
注: 完全临床愈合表明缺乏任何肿胀,注射或从结膜表面放电。动物应该保持眼睛正常,没有保护性的ptosis。
3. 测量干眼参数和收集撕裂样本
- 根据实验协议,测量以下 DED 参数:撕裂渗透、撕裂时间、Schirmer 的撕裂测试以及玫瑰刺染色。执行他们如前所述12,与至少两名调查员的团队。
注:一个至少由两名调查员组成的团队允许在同一时钟时间附近有效测量较大的动物群体(6个或更多),从而防止可能的昼夜变化影响结果。
4. 手术准备和麻醉
- 将动物轻轻安放放在一个限制袋中,上面有皮下乙丙丙酮(1毫克/千克)。
- 去除颅骨面部和背表面的所有毛皮,以可视化手术地标。
- 用切割剪修剪毛皮,留下约1毫米长的残余细毛皮(图4A,左)。
- 按照制造商的说明,使用温和的脱毛膏去除所有残留的毛皮(图4A,右图)。
- 用手术笔标记手术切口部位。
- 通过向地球施加内压,确定后切口部位,使 OSLG 的后部护身镜在皮肤上形成小凸起。
- 用手术打分笔,在头骨背表面的皮肤上以前/后方向做一个线性的2厘米标记。
- 在规划去除 ILG 的切口时,在眼睛周围标记一条长的曲线(从下部和时态页边距 1 厘米)从后(时态)轨道延伸到前(中)形。使标记沿着后轨道延伸到中乘或只是优于该水平(图4B)。在一些解剖中,将连接去除 OSLG 和 ILG 的切口。
注:此时进行双边手术时,标记两个轨道。
- 修剪一块2至3厘米宽的毛皮,在每个大腿的侧表面剪下剪切,以允许放置单极烧灼板。
- 应用超声波凝胶,确保与单极烧灼板良好的电气接触。
- 如果需要,在耳朵的一个边缘静脉中放置一个25G静脉注射(IV)导管,以施用药物或液体。
- 给予皮下木兰辛(1毫克/千克)和IV氯胺酮(15毫克/千克)进行麻醉的初始诱导(通过IV访问)。
注:如果兔子事先使用乙丙丙酮镇静,足以保留步骤2.3中描述的终点,请使用带外法兰的防毒面具镇静剂作为替代品。 - 使用弹性带或弦将喉膜气道固定到位,以固定和维护气道。
- 将面罩连接到麻醉机,氧气流量设置为 1 L/min。
- 首先将异曲兰设定为5%,然后根据动物镇定水平降低耐受性。
- 保持半拉尼在或以上2%,直到最终伤口关闭。
注:通过监测呼吸速率和运动以响应手术或痛苦的刺激来评估镇静水平。如果呼吸速率超过每分钟10次呼吸,如果兔子开始在气道维护器上咀嚼,或者如果观察到任何对疼痛刺激的反应运动,增加麻醉深度。
- 使用多参数监测设备或其他适当设备监测脉搏血氧仪、造血术、血压、直肠体温和心率。
- 在手术过程中持续监测生命体,每 10 到 15 分钟记录一次。
- 将兔子放在手术室 (OR) 桌子上,放在加热垫上,以防止体温过低。将桌子倾斜在大约 30° 的反向 Trendelenburg 位置,以尽量减少出血。
- 用将非酮碘溶液稀释到半强度,用无菌水和窗帘为手术区域准备,以保持无菌场。
5. 完全手术性腺切除术
注: 完整的手术性腺切除术,如本文所述,是使用0.3组织钳子,子宫切除剪刀,非齿组织钳,和剪刀。这些仪器可以与基于外科医生偏好执行相同功能的类似仪器互换。
- 首先删除 OSLG。
- 使用带 30 G 针头的 5 cc 注射器(图 5A)与 1:100,000 肾上腺素和 0.5% 的 bupivacain 混合 50:50 混合,然后渗透到切口部位(手术标记笔线和上后盖)。
注:注射器和针头大小并不重要。 - 使用连接到电外科装置的科罗拉多针,使皮肤切口沿手术标记。设置可能因临床反应而异,通常切和凝固的单位在 10 到 15 个单位之间(图 5B)。
- 在皮肤切口上施加相反的张力,以分离组织并暴露底层前颌肌肉纤维。
- 对地球施加中压,以帮助OSLG的可视化,被视为仅位于前囊性肌肉纤维的中部或深层的凸起组织。如有必要,将这些肌肉纤维移到一侧,以暴露底层的保险。
- 用齿钳 (0.3) 和盖帽切开剪刀,轻轻地缩回并切割在 OSLG 上的纤维胶囊。OSLG 通常具有淡褐色 (图 5C)。
- 使用齿或非齿钳,抓住OSLG腺体组织,并使用"手把手"技术轻轻地将其拉出上级的保险。使用胸肌切开剪刀切割小纤维带,将腺体从其在轨道上的位置释放(图5D)。
注:当OSLG腺体组织被移除时,它将开始合并成一个大型的管状结构(主排泄管)。 - 当腺体尽可能完整地被切除时,用科罗拉多针使用慷慨的烧焦物来制造组织炭,尽可能深入地截断密封圈。这将在以后作为在删除PSLG期间的确认性里程碑。
- 使用带 30 G 针头的 5 cc 注射器(图 5A)与 1:100,000 肾上腺素和 0.5% 的 bupivacain 混合 50:50 混合,然后渗透到切口部位(手术标记笔线和上后盖)。
- 拆下 PSLG。
- 使用棉布施用器将上眼睑用上眼睑。PSLG 的球形端通常很容易看到。
注:在某些解剖解剖中,有可能将主排泄管想象为约1或2毫米宽的淡线性结构。 - 用齿钳(0.3)接用PSLG,并将其从眼睑表面缩回,同时使用胸围切开剪刀,将其从底层焦油中分离到其底座周围(图6A)。
- 控制单极烧灼的中度出血。
- 对分离的组织施加连续牵引,以维持组织平面进行解剖。这将允许去除SLG的主要排泄管(图6B)。
注:在进行解剖时,它通常会推进到高级轨道边缘,在那里可以看到从去除更优越和更美观的OSLG上留下的烧焦痕迹。
- 使用棉布施用器将上眼睑用上眼睑。PSLG 的球形端通常很容易看到。
- 恢复 ILG。
- 让局部麻醉剂至少5分钟生效。
- 用科罗拉多微解剖针和分离的类血肌肉,将下级苍白的压膜肌肉、酶形肌的酶体部分和双目肌与科罗拉多微解剖针分离,如第 5.1 节中的 OSLG。
- 保持单极烧灼性。
- 当切口通过皮肤标记进行得更深时,在酶骨或按摩肌肉的表面部分寻找关节平面的光泽。此时,使用科罗拉多针进行切割,保持组织平面并使其更优越地朝轨道边缘移动(图7A)。
注:为了识别ILG,最简单的是,在ILG的头部进行这部分解剖,通常低于眼睛的前肢。 - 在识别和切开ILG周围的胶囊后,识别ILG的褐色组织。只有 ILG 头的前部分可见 (图 7B)。然而,头部可以被梅地跟踪,因为它通过下酶弓和过渡到尾巴(图7C)。
- 使用脱风剪刀沿下级边缘切割轨道隔膜,露出 ILG 尾部的更后部分。一旦确定组织平面,沿整个切口线后延伸解剖(图7D)。
注:ILG的导管穿过下纤维结缔组织进入盖子时间方面的下部结膜空间。在后缘,ILG的尾部可以有不同的解剖配置。有时它终止的劣等(横向)罐,而在其他解剖中,它更优越的围绕时间轨道延伸。 - 使用极端小心,以防止意外损害血液供应,ILG从胡萝卜动脉的分支接收。血液供应可以在解剖的这一部分看到 (图 7E)。
- 在尾部(横向)下终止的情况下,可能需要将前部肌肉的时态部分一分为二,以暴露ILG的尾部,而ILG位于酶骨骼上。
- 隔离并暴露整个 ILG 后,将其移除。由于其体积大,通常最好用剪刀将腺体切成两半,并将头与尾部分开。
- 在移除 ILG 的头部时,请非常小心,因为它紧邻轨道上的一个大静脉主塞。虽然在手术切除期间这种结构出血没有发生, 有充足的止血辅助物存在,以减轻这种风险.
- 切除所有腺组织后,用多个中断的5-0乙烯对苯二甲酸缝合线关闭深层结缔组织平面。使用 0.3 组织钳和针驱动器关闭表面肌肉和皮肤与运行 6-0 聚曲素 910 缝合线 (图 7F)。
6. 术后护理
- 用无菌水清除动物,清洁手术部位。
- 在切口应用局部眼科抗生素和类固醇药膏(新霉素、多霉素、巴氏杆菌和氢皮质酮)。每天继续此应用程序两次,持续 2 天。
- 使用26G针在肩部刀片上注射20 mL正常盐水的皮下注射。
- 使用1cc注射器和30G针头进行皮下丁丙诺啡0.01毫克/千克或酮profen 3mg/kg的疼痛控制。
注:动物应在1~2天内恢复正常饮食摄入量和活动。应至少每周评估一次兔子的临床感染迹象,如切口部位的渐进性肿胀、疼痛、红斑、卡路里或化脓分。动物也必须遵守,以确保他们不开始划伤切口部位/缝合线。在进行腺切除手术之前修剪所有爪子可能在这方面有所帮助。如果观察到切口线划伤,则可以使用标准保护环来防止自伤。 - 逆转麻醉。
- 动物对刺激做出反应后,除去气道维护器,并开始显示自发咀嚼,但在气道维护器可能受损之前。
- 监测动物约1⁄2小时或直到它们完全从麻醉中恢复过来,这从笼子里的自发运动就证明了这一点。
- 评估动物的疼痛,并适当治疗。
- 允许动物在手术后至少1周恢复,然后再采取任何DED的临床措施。
结果
这里描述的完整的腺切除术方法在8只动物身上进行了。它需要适度的外科技能。双边手术的平均手术时间约为2.2小时,不包括切除膜,这是单独完成的,需要<10分钟。没有死亡或手术并发症,也没有兔子需要任何止血援助,除了适度的烧灼。
我们的手术方法成功地诱导了所有眼睛的干眼。DED的临床和实验室标记小组证实了这一点(表1)。在8周的观察中,平均TBUT被超过75%的术前水平(p < 0.0001 所有时间点)抑制。同样,Schirmer的撕裂测试减少了大约50%,在8周的观察中仍然如此;在后续期间,没有出现复苏的趋势。术后,泪渗透率与DED一致,增加10%,术后至少持续8周。角膜的玫瑰染色也有所增加,在8周的随访中没有出现恢复的迹象(图8)。所有接受完全脱衣切除术的眼睛都显示,与干眼(结膜印象细胞学)一致的果子细胞数量和上皮变化明显减少。

图1:兔乳腺解剖(右眼)。轨道优越的乳胶体(OSLG)由较大的轨道部分和更小的胸腺组成。较大的下部乳胶体 (ILG) 由前/头和后/尾部分组成。坐标轴显示用于文本中使用的所有方向描述的术语。请点击此处查看此图的较大版本。
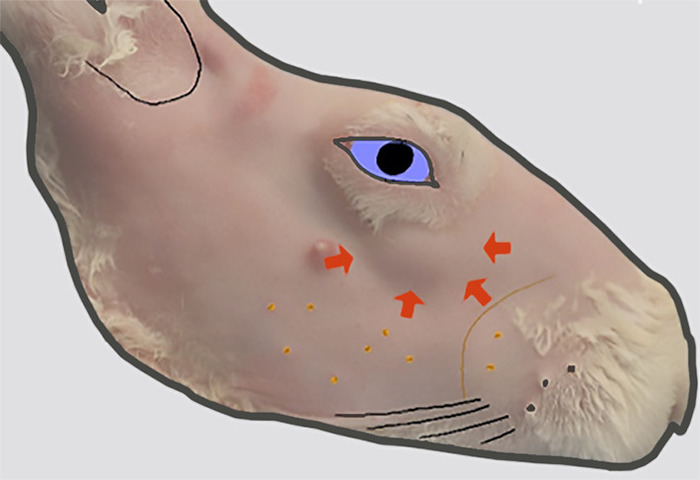
图2:ILG头的位置。去除毛皮后右脸的横向视图。皮肤轮廓(用粗箭头指示)的凸起(由前轨道表示)表示位于此位置的酶骨外表面的 ILG 头的位置。请点击此处查看此图的较大版本。
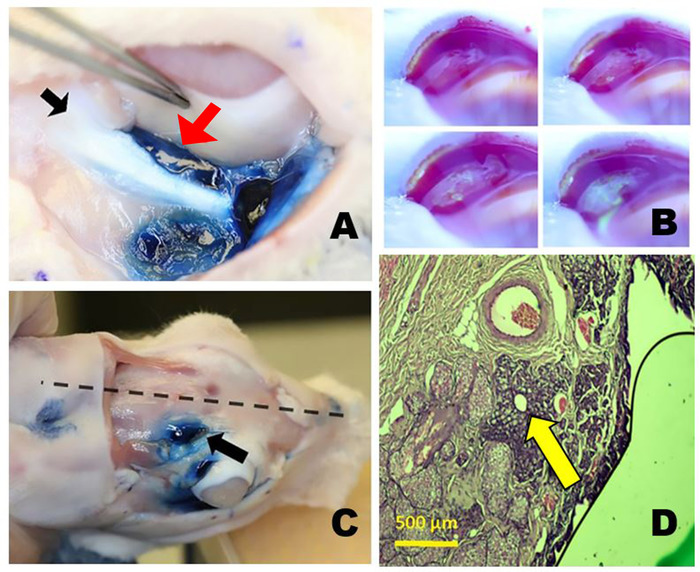
图3:轨道乳胶腺体。(A) 与埃文斯蓝色染料染色后,右下部乳胶体 (ILG) 显示 ILG (红色箭头) 的尾部非常接近,正好与酶骨(黑箭头)相近,低于地球。(B) 从帕佩布拉尔高级乳胶体 (PSLG) 中产生撕裂。在局部应用2%荧光后拍摄的延时照片。来自 PSLG 的水液稀释了最初深蓝色或黑色荧光剂染料,使其变成明亮的黄色绿色(类似于 Seidel 测试)。(C) 轨道 SLG (OSLG) 的位置在兔子头骨中,位于后切口(箭头)内,靠近头骨的中线(虚线)。埃文斯蓝色染料被注射到OSLG和帕佩布拉尔优越的乳胶腺体。(D) 组织学部分通过 OSLG 的主要排泄管,周围是少量的腺组织(箭头),在此组织病理学横截面上,通过右上眼睑的后部(时态)方面采集的血氧素和 eosin 染料。请点击此处查看此图的较大版本。
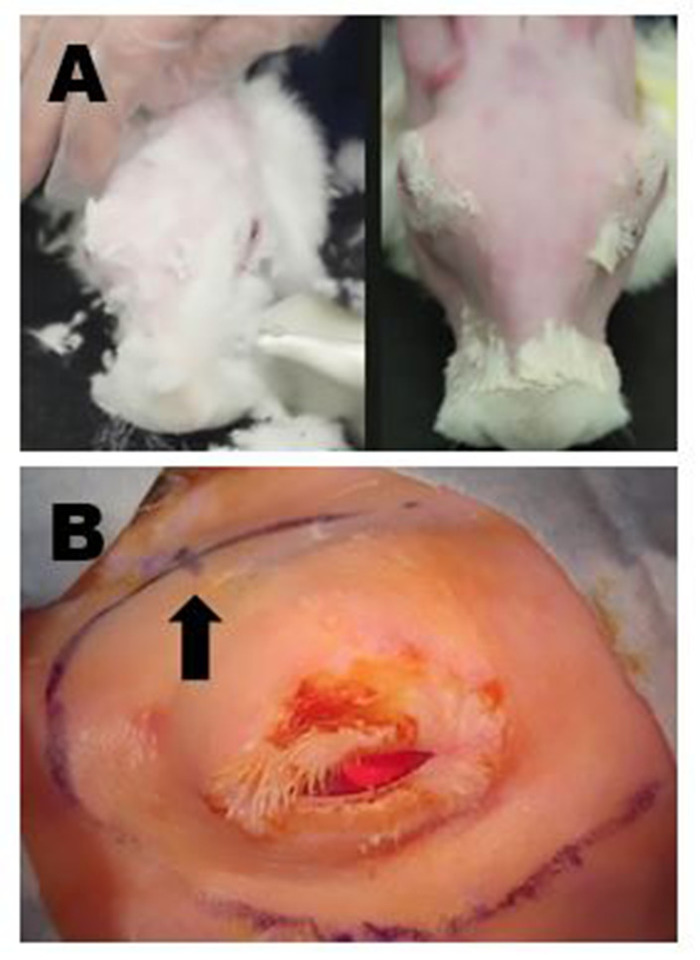
图4:手术部位准备。(A) 左上角面板:用剪切去除长毛皮。所有残留的细毛皮随后被去除与温和的脱毛霜。右上面板:完全去除毛皮后的最终外观,允许进行ILG的手术标记和高质量超声波。(B) 显示右轨道区域的适当手术标记;在此示例中,移除 OSLG 和 ILG 的切口已连接以创建一个长曲线切口。后切口的位置由曲线切口站点标记(箭头)上的小哈希标记指示。请点击此处查看此图的较大版本。
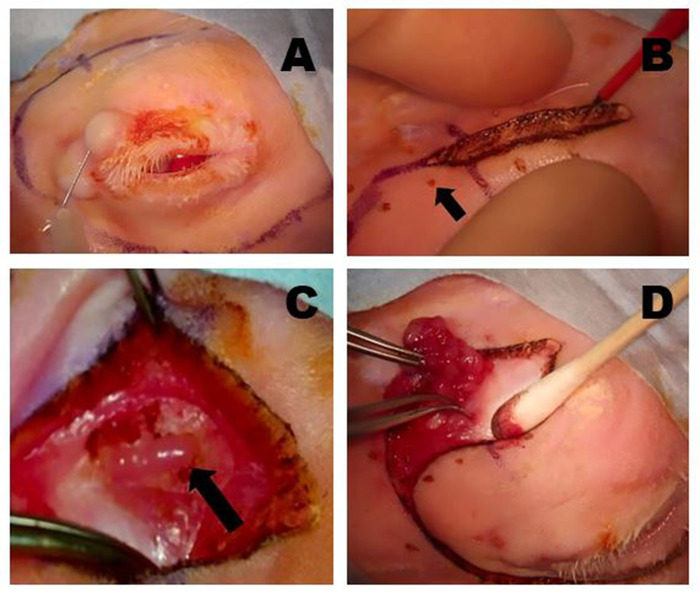
图 5:删除 OSLG。(A) 手术部位使用50:50与1:100,000肾上腺素和0.5%的乙苯甲酸混合使用麻醉剂渗透,注射到上盖和切口线,以尽量减少手术过程中的不适。(B) 科罗拉多州微解剖针用于沿着预先标记的手术切口部位切开皮肤和表面肌肉层。在伤口上施加柔和的牵引,以帮助创建解剖平面。小定点烧伤(箭头)是用科罗拉多针在切口线的等距点,以帮助在伤口闭合期间优化组织。(C) OSLG 在组织覆盖后保险后(箭头)后暴露。腺体的胶囊已被切开。OSLG 可以通过向全球施加内压来促进其移除。(D) 钳子用于接合 OSLG,并通过后切口轻轻地将其从轨道内的较深位置移开。请点击此处查看此图的较大版本。
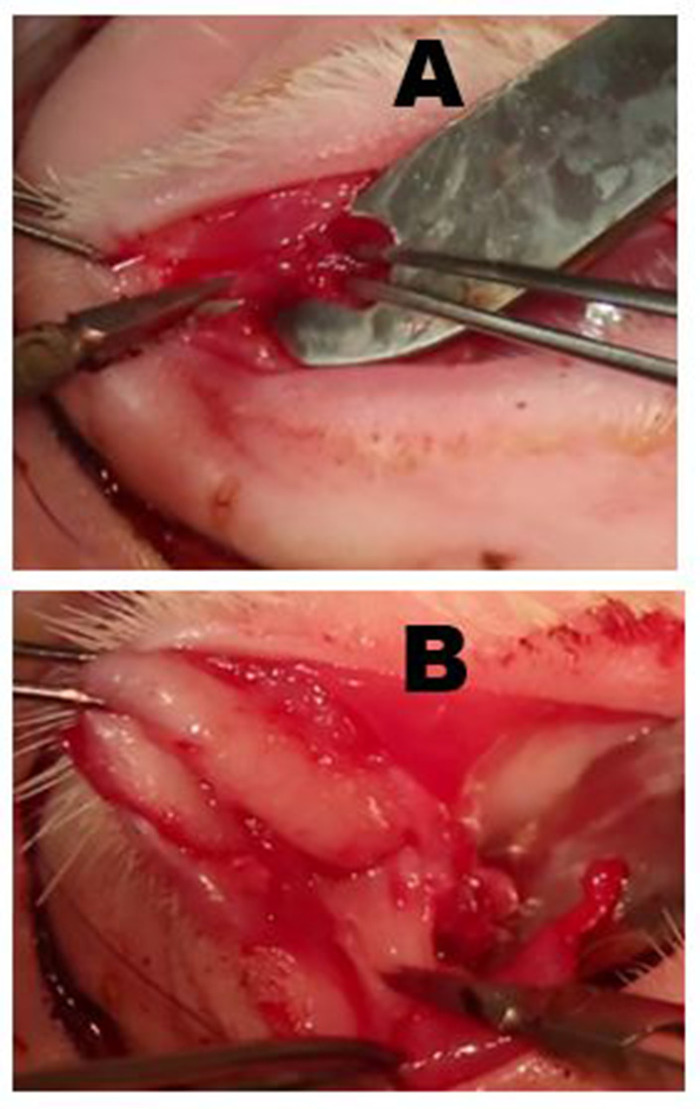
图6:去除帕佩布拉高级乳胶腺体(PSLG)和排泄管。(A) 上眼睑的去向后,PSLG的球状部分与钳子接触,并用剪刀解剖掉焦油。用钳子施加到PSLG的牵引力对于维持手术平面至关重要。(B) PSLG和主乳管的解剖,在腺体和导管组织上采用尖锐的解剖和连续牵引,以优先向轨道边缘进行解剖,以保持适当的手术平面。解剖应进行到 OSLG 被移除的点。请点击此处查看此图的较大版本。
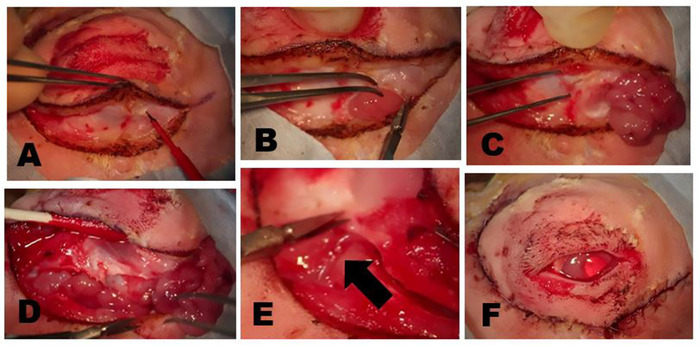
图7:去除ILG。(A) 皮肤和表面肌肉被切开,直到覆盖酶骨或按摩肌肉表面部分的关节平面达到。ILG 的头部通常明显是位于前肢下的小凸起。(B) ILG的纤维胶囊用剪刀切开,露出ILG。一旦胶囊被切开,腺体的深层部分可以很容易地去除。(C) ILG 头部最外在的位于酶骨上的部分已经暴露并反射,并出现前体显示底层的酶骨。(D) 沿着下部边缘的轨道隔膜的切口暴露了ILG的尾部。(E) 外部胡萝卜动脉的分支为 ILG(箭头)的尾部提供食物。(F) 完全切除皮肤切除术后皮肤切口闭合后的外观。请点击此处查看此图的较大版本。

图8:角膜表面的玫瑰孟加拉染色。外部照片显示突出的染色,最值得注意的是鼻象限。所有接受完全子宫切除术的眼睛都出现了类似的变化,在手术后1周内明显变化,并持续至少6周。值得注意的是,环闪光的光反射显示从干燥的眼部表面失真,表明干燥的眼睛会对视力造成不良影响。请点击此处查看此图的较大版本。
| 达克里诺腺切除术 | ||
| 均值 = SEM;n = 16 只眼睛 | ||
| 基线 | 第2周 | |
| 撕裂分手时间,s | 60.0 ± 0.0 | 4.5 × 1.2 |
| p < 0.0001 | ||
| 撕裂渗透, mOsm | 291.2 × 3.7 | 315.3 × 5.5 |
| p = 0.001 | ||
| 希尔默撕裂测试,毫米 | 18.3 × 1.3 | 10.5 × 1.6 |
| p = 0.0006 | ||
| 玫瑰孟加拉,修改NEI得分 | 0.0 × 0.0 | 4.28 ± 0.6 |
| p < 0.0001 | ||
| 已操作vs。基线:达冷冻切除术: TBUT, p < 0.0001;撕裂渗透, p < 0.001;希尔默撕裂测试,p < 0.0006);和玫瑰孟加拉。 | ||
表1:术后第2周的干眼参数。
讨论
DED根据对泪膜稳定性的影响分为两大类:水缺陷(泪膜水分量减少;DED的20%)和蒸发(泪膜蒸发量增加;DED增加50%)。约30%的DED患者同时显示这两种证据(混合DED)。炎症是DED的核心机制,其多样性的病因汇聚在13,14。我们的方法模拟了水缺乏的DED。
如前所述,复制我们方法的重要第一步是欣赏兔子的轨道乳胶腺(LG)解剖的细微之处,并避免各种、有时相互矛盾的解剖术语造成的混淆。教皇科等人11年的解剖图集非常透彻。对于那些不太适应兔子的解剖,解剖尸检标本可以很容易地熟悉这些结构,并有助于他们在活标本中手术切除。
有关动物房屋和适应的重要意见已在附书12中发表。同一篇文章还提供了有用的注释,用于对两种方法中使用的 DED 参数进行测量。
与前一种方法12不同,这种方法需要更高的外科技能,因为去除LG所需的技术的范围和侵入性更大。在这些手术期间,最大的风险是伤害靠近LG的主要血管(如胡萝卜动脉的分支)造成的灾难性出血。通过充分可视化每个LG及其在手术领域的利润来避免这种情况。最后,过度地去除膜可能导致硬质腺脱垂,从而破坏泪膜评估。
应注意通过去除PSLG来减少结膜中断,这是我们方法的一个新方面,可提高可重复性,提高DED的严重程度。只要将牵引施加到组织上,建立解剖平面并将其带回上级轨道脊是令人惊讶的。能够看到来自OSLG截断的烧焦痕迹,令人欣慰;他们确认完全去除腺体的主要排泄管。
完全取消ILG也带来了挑战。首先隔离腺体的头,因为这是最容易可视化的部分。腺组织的整个头很容易从周围的组织分离;然而,必须使用一些小心,以防止损坏大静脉鼻利,这是内联ILG的头部。ILG的尾部在从酶骨下经过时可以跟随回来。大多数尾巴很容易被隔离。然而,由于解剖学的变数和接近胡萝卜的中等大小的分支,尾巴最后部分可能更具挑战性。仔细的解剖应能清楚地看到ILG的所有边缘,便于将其完全移除。调查员应准备进行更优越的解剖的情况下,腺体的尾巴结束下侧节,如在早先讨论解剖的乳胶腺。值得注意的是,作者在通过沿时间和劣质地球的曲线切口剖析ILG时,从未能够识别OSLG的任何部分。虽然这在技术上是可能的,但手术方法具有严重出血的风险过高。通过后保险接近OSLG证明要安全得多。
ILG 的排泄管在通过下部结膜角时,可穿透劣等的fascial平面。偶尔,这里也会看到腺体出现组织的小球,可以小心地去除。
维护LG切除的秩序是非常有帮助的,如这里介绍的。如果首先删除 ILG,则从技术上讲,隔离 OSLG 将变得更加困难。主要原因是,在删除ILG之后,OSLG不能轻易进行脱除,从而无法识别。
我们的模型的一个显著优点是它可以是"模块化的"。换句话说,可以校准由腺切除术引起的DED程度以满足实验需要。例如,切除所有LG会导致最大的DED,但仅切除SLG会导致最温和的DED形式,只有ILG的切除会产生中等严重性疾病。
我们的方法概括了减少撕裂产生的独特病理生理学事件,与已经报告的方法相比,提供了额外的优势。简单地说,没有其他手术模型消除撕裂生产的所有轨道LG5,6,7,15,16;包括对LG17的寄生性否认,以及药理学抑制撕裂生产18,19,后两者具有其偏离目标的影响作为重大混淆。最后,该模型将主要对研究人员依赖的偏见最小化,即LG的不完全切除,因为手术技术提供了完整的可视化;这得益于以下事实:除了烧灼外,不需要有肉质。
研究者应该认识到,所有轨道LG的完全切除不会产生完全没有眼泪,例如,Schirmer的撕裂测试值接近零是不应该预期的。这是因为总有其他泪液来源,如沃尔夫林和克劳斯的附属LG和来自结膜血管20、21、22的血浆泄漏。从实验的角度来看,这应该被看作是该方法的一个积极方面,因为它保持眼表面;完全的二甲苯甲酸血症将完全摧毁角膜否定模型的有用性。此外,在其当前实施例中,该模型为研究这些较小隔间中的补偿机制和流体输送提供了绝佳的机会。
总之,这里介绍了一种新颖和多才多艺的诱导水性缺陷DED方法的细节,该方法有助于研究撕裂生理学、DED的发病机制和为这种指示开发的治疗剂的研究。
披露声明
作者宣布,除了BR在Medicon制药公司和Apis治疗有限责任公司拥有股权的BR外,没有竞争利益;和LH,Medicon制药公司的雇员,在阿皮斯治疗有限责任公司拥有股权。
致谢
我们感谢石溪大学医学院的"目标研究机会"赠款和来自纽约塞陶克特的Medicon制药公司的研究资助。我们感谢米歇尔·麦克特南的编辑支持。
材料
| Name | Company | Catalog Number | Comments |
| acepromazine, Aceproinj | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| anesthesia vaporizer | VetEquip, Pleasanton, CA | Item # 911103 | Protocol 4.8 |
| animal restraining bag | Henry Schein Animal Health, Dublin, OH | Jorvet J0170 | Use appropriately sized bag. |
| bupivacaine, 0.5% | Hospira Inc, Lake Forest IL | NDC: 0409-1162-02 | Mixed 50:50 with 2% lidocaine with 1:100,000 epinephrine for infiltration of incision sites, protocol 5.1 |
| buprenorphine | Henry Schein Animal Health, Dublin, OH | 0.01 mg/kg, for postprocedural care, 6.1.4 | |
| cautery unit, high-temperature, battery-powered | Medline Industries Inc, Northfield, IL | REF ESCT001 | Keep on hand in case of bleeding, protocol 2.7 |
| clipper, Wahl Mini Arco | Henry Schein Animal Health, Dublin, OH | No. 022573 | Cordless shears for fur removal, protocol 4.2 |
| Colorado needle | Stryker Craniomaxillofacial, Kalamazoo, MI | N103A | Use with electrosurgical unit to make incisions, protocol 5.1 & 5.3 |
| electrosurgical unit with monopolar cautery plate | Valleylab, Boulder, CO | Force FXc | Use with electrosurgical unit to make incisions, protocol 5.1 & 5.3 |
| fluorescein, Ak-Fluor 10% | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT, measurement of dry eye parameters, protocol 3.1 |
| foceps, curved dressing | Bausch and Lomb (Storz), Bridgewater, NJ | Storz E1406 | delicate serrated dressing forceps |
| forceps, 0.3 | Bausch and Lomb (Storz), Bridgewater, NJ | ET6319 | For removal of nictating membrane, protocol 2.5 |
| forceps, Bishop Harmon | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Use toothed forceps for dacryoadenectomy, protocol 5.1 & 5.2 |
| hair remover lotion, Nair | Widely available | Softening Baby oil | Dipilitory cream for sensitive skin, protocol 4.2 |
| isoflurane | Henry Schein Animal Health, Dublin, OH | 29405 | Possible alternative sedation, protocol 4.7 |
| IV catheter, Terumo Surflo ETFE 24-gauge | Terumo, Tokyo, Japan; available from Fisher Sci., VWR, McKesson, etc. | SR-OX2419CA | 25-gauge for smaller rabbits; protocol 4.6 |
| ketamine | Henry Schein Animal Health, Dublin, OH | NDC 11695-0701-1; NADA 200-055 | 15 mg/kg, protocol 4.7 |
| ketoprofen | Hospira, Inc., Lake Forest, IL | 3 mg/kg, for postprocedural care, 6.1.4 | |
| laryngeal mask airway | Docsinnovent Ltd, London, UK | Vgel R3 | Protocol 4.8 |
| lid speculum, wire | Bausch and Lomb (Storz), Bridgewater, NJ | Barraquer SUH01 | For removal of nictating membrane, protocol 2.4 |
| lidocaine 2% with epinephrine 1:100,000; 50:50 mixture | Hospira Inc, Lake Forest IL | NDC 0409-3182-02 | Pre-treat before removal of nictating membranes, protocol 2.4 |
| lidocaine, preservative-free | Sigma-Aldrich, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent, for application to eye, protocol 2.4 |
| micropipette | Eppendorf | Research Plus 100 uL | For application of preservative-free lidocaine to eye, protocol 2.4 |
| micropipette tips | World Wide Medical Products | 41071052 | For application of preservative-free lidocaine to eye, protocol 2.4 |
| monitoring device, multi-parameter | SurgiVet, Waukesha, WI | V9201 | For monitoring of vitals, protocol 4.9 |
| needle, 26-gauge | BD, Franklin Lakes, NJ | REF 305115 | For injection of lidocaine/epinephrine, protocol 2.3 & 2.5 |
| needle, 30-gauge | BD, Franklin Lakes, NJ | REF 305106 | For infiltration of incision sites; syringe and needle size are not critical, protocol 5.1 |
| osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity measurement of dry eye parameters, protocol 3.1 |
| osmometer, TearLab | TearLab Corp., San Diego, CA | Model#200000W REV A | Measure tear osmolarity, measurement of dry eye parameters, protocol 3.1 |
| povidone-iodine solution | Medline Industries Inc, Northfield, IL | PVP Prep Solution, NDC: 53329-939-04, REF MDS 093944 | To maintain sterile field, protocol 4.11 |
| rabbit, New Zealand White | Charles River Labs, Waltham, MA (NZW) | 2-3 kg | Research animals |
| Rose bengal stain | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, for staining the ocular surface, measurement of dry eye parameters, protocol 3.1 |
| saline, normal | B. Braun Medical, Irvine, CA | REF R5200-01 | For postprocedural care, protocol 6.1.3 |
| Schirmer Tear Test strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production, measurement of dry eye parameters, protocol 3.1 |
| scissors, Vannas | McKesson Medical-Surgical, San Francisco, CA | Miltex 2-130 | Capsulotomy scissors for dacryoadenectomy, protocol 5.1 & 5.2 |
| scissors, Westcott tenotomy | McKesson Medical-Surgical, San Francisco, CA | Miltex 18-1480 | For removal of nictating membrane, protocol 2.7 |
| sedation gas mask | DRE Veterinary, Louisville, KY | #1381 | Possible alternative sedation, protocol 4.7 |
| surgical marking pen | Medical Action Industries, Arden, ND | REF 115 | Protocol 4.2 |
| sutures, 5-0 Mersilene | Ethicon US, LLC | Ethylene terephthalate sutures, used for deep connective tissue closure, protocol 5.3.11 | |
| sutures, Vicryl 6-0 | Ethicon US, LLC | Polyglactin 910 sutures, used for superficial muscle and skin closure, protocol 5.3.11 | |
| syringe, 1 cc | BD, Franklin Lakes, NJ | ref 309659 | For injection of lidocaine/epinephrine, protocol 2.3 & 2.5 |
| syringe, 5 cc | BD, Franklin Lakes, NJ | REF 309603 | For infiltration of incision sites; syringe and needle size are not critical, protocol 5.1 |
| tissue forceps, 0.8mm Graefe | Roboz Surgical Store, Gaithersburg, MD | RS-5150 | Curved Weck forceps |
| topical antibiotic ointment (neomycin, polymyxin, bacitracin, and hydrocortisone) | Bausch and Lomb, Tampa, FL | NDC 24208-785-55 | Applied after removal of nictating membrane, protocol 2.8, and for postprocedural care, protocol 6.1.2 |
| ultrasound gel | Parker Laboratories, Inc., Fairfield, NJ | Aquasonic 100 | To ensure electrical contact with monopolar cautery plate, protocol 4.5 |
| xylazine | Henry Schein Animal Health, Dublin, OH | NADA: 139-236 | 1 mg/kg, protocol 4.7 |
参考文献
- Gillan, W. D. H. Tear biochemistry: A review. South African Optometrist. 69 (2), 100-106 (2010).
- Conrady, C. D., Joos, Z. P., Patel, B. C. Review: The Lacrimal Gland and Its Role in Dry Eye. Journal of Ophthalmology. 2016, 7542929 (2016).
- Schechter, J. E., Warren, D. W., Mircheff, A. K. A lacrimal gland is a lacrimal gland, but rodents' and rabbits' are not human. Ocular Surface. 8 (3), 111-134 (2010).
- Shinomiya, K., Ueta, M., Kinoshita, S. A new dry eye mouse model produced by exorbital and intraorbital lacrimal gland excision. Scientific Reports. 8 (1), 1483 (2018).
- Bhattacharya, D., et al. Tear Production After Bilateral Main Lacrimal Gland Resection in Rabbits. Investigative Ophthalmology and Visual Science. 56 (13), 7774-7783 (2015).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Li, N., et al. Establishment of the mild, moderate and severe dry eye models using three methods in rabbits. BioMed Central Ophthalmology. 13, 50 (2013).
- Honkanen, R., et al. A New Rabbit Model of Chronic Dry Eye Disease Induced by Complete Surgical Dacryoadenectomy. Current Eye Research. , 1-10 (2019).
- Nisha, S., Deepak, K. An Insight Into Ophthalmic Drug Delivery System. International Journal of Pharmaceutical Studies and Research. 3 (2), 9-13 (2012).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, (1929).
- Popesko, P., Rajitova, V., Horak, J. Rabbit - Guinea Pig. A Colour Atlas of the Anatomy of Small Laboratory Animals. 1, (1992).
- Honkanen, R. A., Huang, L., Rigas, B. A rabbit model of aqueous-deficient dry eye disease induced by concanavalin A injection into the lacrimal glands: Application to drug efficacy studies. Journal of Visualized Experiments. , e59631 (2019).
- Wei, Y., Asbell, P. A. The core mechanism of dry eye disease is inflammation. Eye & Contact Lens. 40 (4), 248-256 (2014).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology and Visual Science. 28 (2), 225-228 (1987).
- Odaka, A., et al. Efficacy of retinol palmitate eye drops for dry eye in rabbits with lacrimal gland resection. Clinical Ophthalmology. 6, 1585-1593 (2012).
- Toshida, H., Nguyen, D. H., Beuerman, R. W., Murakami, A. Evaluation of novel dry eye model: preganglionic parasympathetic denervation in rabbit. Investigative Ophthalmology and Visual Science. 48 (10), 4468-4475 (2007).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology and Visual Science. 49 (5), 1850-1856 (2008).
- Shiue, M. H., et al. Pharmacological modulation of fluid secretion in the pigmented rabbit conjunctiva. Life Science. 66 (7), 105 (2000).
- Li, Y., et al. Rabbit conjunctival epithelium transports fluid, and P2Y2(2) receptor agonists stimulate Cl(-) and fluid secretion. American Journal of Physiology: Cell Physiology. 281 (2), C595-C602 (2001).
- Dartt, D. A. Regulation of mucin and fluid secretion by conjunctival epithelial cells. Progress in Retinal and Eye Research. 21 (6), 555-576 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。