Method Article
Établissement d'un modèle d'oeil sec grave utilisant la Dacryoadenectomy complète dans des lapins
Dans cet article
Résumé
Une nouvelle approche est présentée pour induire la maladie chronique sèche d'oeil dans des lapins en enlevant chirurgicalement toutes les glandes lacrimal orbitales. Cette méthode, distincte de ceux précédemment rapportés, produit un modèle stable et reproductible de l'oeil sec déficient aqueous bien adapté pour étudier la physiologie et la pathophysiologie de lare et les thérapeutiques oculaires.
Résumé
La maladie oculaire sèche (DED) est une maladie complexe avec des étiologies multiples et des symptômes variables, ayant l'inflammation oculaire de surface comme étape pathophysiologique principale. Malgré les progrès réalisés dans notre compréhension de la DED, d'importantes lacunes subsistent en matière de connaissances. Les progrès sont limités en partie en raison de l'absence de modèles animaux informatifs. Les auteurs ont récemment rapporté sur une méthode de DED induite en injectant tous les tissus orbitaux de glande lacrimale (LG) avec la concanavaline de lectine A. Ici, nous rapportons un modèle nouveau de DED aqueous-déficient basé sur la résection chirurgicale de tous les tissus orbitaux de LG (dacryoadenectomy). Les deux méthodes utilisent les lapins en raison de leur similitude avec les yeux humains en termes de taille et de structure de la surface oculaire. Une semaine après le déplacement de la membrane nictiatating, le LG supérieur orbital a été chirurgicalement enlevé sous l'anesthésie, suivi par le déplacement du LG supérieur palpebral, et finalement le déplacement du LG inférieur. Dacryoadenectomy induit DED grave, démontré par un réduction marquée de l'essai de temps de rupture de déchirure et du test de déchirure du Schirmer, et a augmenté de manière significative l'osmolarité de déchirure et la coloration de bengal de rose. Dacryoadenectomy-induit DED a duré au moins huit semaines. Il n'y avait aucune complication et les animaux ont bien toléré la procédure. La technique peut être maîtrisée relativement facilement par ceux qui ont une expérience chirurgicale adéquate et l'appréciation de l'anatomie de lapin pertinente. Puisque ce modèle récapitule les dispositifs de DED aquous-déficient humain, il convient aux études de l'homéostasie de surface oculaire, deDe, et des thérapies de candidat.
Introduction
Des déchirures sont nécessaires pour la protection de la surface oculaire et pour le maintien des propriétés optiques de la cornée. Ils se composent de trois couches: un revêtement de mucine interne, un composant aqueux moyen, et une superpose de lipides1. La couche de mucine est produite principalement dans les cellules de gobelet de la conjonctive, le composant aqueux principalement dans les glandes lacrimales (LG), et la couche lipidique principalement dans les glandes meibomian1,2. Les LG orbitaux sont la principale source pour la composante aqueuse des larmes et pour beaucoup de protéines qui protègent la surface contre l'attaque bactérienne3. Les maladies oculaires de surface s'ensuivent lorsque la production de déchirure séquenaise est diminuée en dessous d'un niveau critique, privant les surfaces épithéliales de l'œil de la composante aqueuse et des constituants cruciaux de déchirure comprenant des facteurs de croissance, le lysozyme, et la lactoferrine. Dans les cas de diminution de la production de déchirurepare par les LG, les tissus conjonctifs et cornéens subissent des adaptations pour compenser l'altération de l'environnement.
Comprendre la contribution de la composante lacrymale dérivée des LG orbitales et des mécanismes compensatoires de la surface oculaire lorsque cela fait défaut a des répercussions sur notre appréciation de la physiologie et de la pathophysiologie du segment antérieur de l'œil et, plus largement, de la santé et de la maladie dans le monde entier. L'approche expérimentale de ces questions exige un modèle animal informatif. Par conséquent, plusieurs groupes ont tenté de développer des modèles animaux dans lesquels les LG orbitaux sont enlevés, facilitant ainsi l'évaluation du rôle des larmes dans la santé oculaire. Un tel modèle a été récemment rapporté pour la souris4. Le lapin offre, cependant, de nombreux avantages distincts sur les modèles de rongeurs, y compris les structures anatomiques et histologiques similaires de la LG, et peut-être plus important encore, la taille similaire et la surface des tissus cornés et conjonctivals par rapport à leurs homologues humains3.
La création de la maladie aqueuse déficiente d'oeil sec (DED) par la résection chirurgicale du tissu de LG dans des lapins n'est pas nouvelle. De nombreux rapports décrivent la résection des tissus LG avec un succès variable reflété dans les changements variables dans la production de déchirure mesurées par le test de déchirure de Schirmer5,6,7,8. Une compréhension approfondie de l'anatomie pertinente du lapin et la clarté sur la terminologie anatomique sont très utiles dans la reproduction de cette méthode. Un aperçu complet des deux est fourni ci-dessous.
Anatomie des glandes lacrymales
Le lapin a deux LG orbitaux : le Plus grand LG inférieur (ILG) et le Plus petit LG supérieur (SLG ; Figure 1). L'ILG s'étend le long de l'aspect inférieur et postérieur de la jante orbitale. À l'exception de la taille variable, la partie antérieure de l'ILG a un aspect bulbeux assez uniforme qui peut être considéré comme une protubérance dans la peau sous le globe (Figure 2). En raison de son aspect caractéristique par rapport au reste de la glande, il est appelé la «tête» de l'ILG. Une partie de la tête s'enroule autour et se trouve sur la surface externe de l'os zygomatique. Ceci sert de point de repère utile sur la biomicroscopie d'ultrason pour guider des injections dans l'ILG. Le reste de la tête réside plus médially9 dans l'orbite.
En raison de l'aspect caractéristique de la partie restante de l'ILG, qui est longue et mince, ce segment est appelé la «queue». La queue longe la jante orbitale inférieure, de la tête de l'ILG à la jante orbitale où elle se termine par une anatomie variable à la jante orbitale inférieure et postérieure (Figure 3A). La queue se trouve profonde (médiane) à l'os zygomatique séparé du contenu orbital par une bande fasciale pour la plupart de son cours jusqu'à ce qu'il atteigne le bord postérieur de l'orbite où il s'étend une fois de plus sur la surface externe de l'os zygomatique. L'ILG reçoit son approvisionnement en sang des branches de l'artère carotide.
Le SLG a deux composants analogues à l'humain. L'un est le lG supérieur palpébral (PSLG), qui réside dans la paupière postérieure supérieure médiale à la plaque tarse. Il semble bulbel dans la nature et a de nombreuses ouvertures de ponctate qui drainent le liquide lacrymal aqueux qui est plus facilement vu lorsqu'il est couvert de fluorescéine 2% (Figure 3B).
Le second est le LG supérieur orbital (OSLG), résidant en position médiale dans l'orbite supérieure (Figure 3C). En raison de sa position près de la ligne médiane du crâne, il a été impossible de l'identifier avec succès en utilisant des approches chirurgicales externes de l'orbite temporelle ou inférieure. Dans les échantillons d'autopsie fraîches ou les cas chirurgicaux, cette glande peut être prolapsus par l'incisure postérieure située dans la surface dorsal du crâne quand la pression médiale douce est appliquée au globe. Le prolapsus de ce tissu glandulaire peut être documenté avec la biomicroscopie d'ultrason.
Le PSLG et l'OSLG sont des structures contigus. L'OSLG est une structure tubuloalveolaire dont l'architecture ductale se rescouse dans le canal excréteur principal. Ce conduit passe sous la crête supra-orbitale et s'exécute dans les tissus du couvercle supérieur se terminant dans le PSLG. Le long du conduit excréteur, le tissu glandulaire compatible avec les descriptions originales de Davis a été identifié10 (figure 3D).
Une note sur la terminologie
D'excellentes et complètes descriptions anatomiques utilisent une terminologie variable ainsi. L'anatomie orbitale classique de Davis ne définit qu'un LG10supérieur et inférieur. Cependant, sa description du LG supérieur détaille clairement les parties plus spécifiquement définies ici comme le PSLG et l'OSLG, tandis que sa description du LG inférieur détaille les parties définies ici comme la tête et la queue de l'ILG. Un atlas anatomique plus récent et plus complet11 définit ces tissus comme la glande zygomatique et l'accessoire LG. Le terme « glande lacrimale » est utilisé ici pour comprendre le PSLG et l'OSLG susmentionnés. Cette terminologie est mieux adaptée pour reproduire cette méthode sans confusion indue.
Protocole
Toutes les études sur les animaux vertébrés ont été réalisées conformément à toutes les lignes directrices réglementaires et institutionnelles pertinentes. Toutes les études ont été approuvées par la Commission d'examen institutionnel de l'Université Stony Brook et réalisées conformément à l'énoncé de l'Association for Research in Vision and Ophthalmology (ARVO) sur l'utilisation d'animaux dans la recherche ophtalmique et visuelle.
1. Animaux et logement
- Utilisez des lapins blancs néo-zélandais (NZW) pesant 2 à 3 kg.
- Loger les lapins individuellement dans un environnement strictement contrôlé : température (65 '5 'F), humidité (45 ' 5%), et éclairage (12 h sur/hors cycle).
REMARQUE : En raison de comportements agressifs souvent exposés entre les lapins qui sont logés en groupe, gardez les animaux dans des cages individuelles pour prévenir les blessures oculaires par inadvertance. - Donnez aux lapins un accès illimité à la chow et à l'eau de lapin standard.
- Ne fournissez aucun autre enrichissement diététique de façon à empêcher la supplémentation par inadvertance de vitamine A qui pourrait affecter l'oeil sec.
- Acclimater les lapins au moins deux semaines avant d'enregistrer les paramètres DED.
2. Enlèvement de la membrane nictitating
REMARQUE: Pour la simplicité, la technique pour l'œil droit est décrite ci-dessous. Terminer cette procédure sur l'œil gauche d'une manière identique.
- Enlever la membrane nictitating bilatéralement pendant la période d'acclimatation (généralement la première semaine).
- Placer le lapin dans un sac de retenue de taille appropriée.
- Administrer une injection sous-cutanée d'acépromazine (1 mg/kg) sur les épaules à l'aide d'une seringue de 1 cc et d'une aiguille de 26 G pour calmer le lapin. Le point d'évaluation de cette sédation légère est lorsque l'animal maintient une position de tête détendue sans mouvements de balayage normaux et ses oreilles ne sont plus entièrement debout.
- À l'aide d'une micropipette, appliquer 25 llidocaïnes sans agent de conservation (1 %) à l'œil. Insérez un spéculum de couvercle de fil entre les paupières.
- Saisissez la membrane nictitating à son sommet avec 0.3 forceps (ou équivalent) et tirez-la au-dessus de la surface cornéenne. Injecter 1 % de lidocaïne avec 1:100 000 épinéphrine dans l'espace subconjonctivale de la membrane nictitating à l'aide d'une aiguille de 26 G. Injecter environ 0,3 ml pour former une tache de taille modeste sur la membrane nictitating. Les volumes d'injection de plus de 1 ml sont bien dans une fourchette de dose sûre pour les lapins (2 à 4 mg/kg).
- Retirez le spéculum de fil. Attendez environ 5 min pour que la lidocaïne et l'épinéphrine prennent effet. Pendant ce temps, effectuer la même procédure dans l'œil de l'autre.
- Remplacer le spéculum du couvercle métallique. Saisir et étendre la membrane nictitating sur la surface cornéenne à l'aide de 0,3 forceps. Couper la membrane à sa base avec des ciseaux à tenotomie ou équivalent.
REMARQUE : Les saignements sont habituellement minimes, mais gardez une unité de cautérisation à haute température à proximité et utilisez-la au besoin pour minimiser les saignements. La pression directe au-dessus de la base de coupe de la membrane nictitating peut également être employée pour arrêter de petits saignements s'il se produit. - Retirez le spéculum du couvercle métallique. Placez l'onguent antibiotique topique (néomycine, polymyxine, bacitracin, et hydrocortisone) au-dessus de la surface cornéenne.
- Effectuer une procédure identique à l'œil de l'autre comme indiqué par le protocole.
- Placez les animaux dans des cages individuelles et laissez-les guérir pendant au moins une semaine, ou jusqu'à ce que la surface conjonctive ait guéri complètement d'un point de vue clinique, avant d'effectuer d'autres essais ou interventions.
REMARQUE : La guérison clinique complète est indiquée par l'absence de tout gonflement, injection ou décharge des surfaces conjonctives. Les animaux doivent garder les yeux ouverts normalement, sans la présence de ptose protectrice.
3. Mesure des paramètres des yeux secs et collecte d'échantillons de déchirure
- Mesurez les paramètres DED suivants, le cas échéant au protocole expérimental : osmolarité lacrymale, temps de rupture de déchirure, test de déchirure de Schirmer, et coloration de bengal de rose. Exécutez-les comme décrit précédemment12, avec une équipe d'au moins deux enquêteurs.
REMARQUE : Une équipe d'au moins deux chercheurs permet de mesurer efficacement de plus grands groupes d'animaux (6 ou plus) autour du même temps d'horloge empêchant ainsi la variation circadienne possible d'impacter des résultats.
4. Préparation chirurgicale et anesthésie
- Animaux légèrement sédatifs placés dans un sac de retenue avec acépromazine sous-cutanée comme ci-dessus (1 mg/kg).
- Enlever toute la fourrure sur le visage et la surface dorsale du crâne pour visualiser les repères chirurgicaux.
- Couper la fourrure avec des cisailles de coupe laissant la fourrure fine résiduelle d'environ 1 mm de longueur(figure 4A, à gauche).
- Retirer toute la fourrure résiduelle à l'aide d'une crème dépilatoire douce suivant les instructions du fabricant (Figure 4A, droite).
- Marquez les emplacements chirurgicaux d'incision avec un stylo chirurgical.
- Identifiez le site d'incision au-dessus de l'incisure postérieure en appliquant la pression médiale au globe causant un petit renflement pour se développer dans la peau au-dessus de l'incisure postérieure du prolapsus de l'OSLG.
- Faire une marque linéaire de 2 cm dans la direction antérieure/postérieure sur la peau au-dessus de la surface dorsal du crâne directement au-dessus de ce site avec un stylo de marquage chirurgical.
- Lors de la planification de l'incision pour l'élimination de l'ILG, marquez une longue ligne curviligne autour de l'œil (1 cm de la marge inférieure et temporelle du couvercle) s'étendant de l'orbite postérieure (temporelle) au canthus antérieur (médial). Faire le marquage s'étendre le long de l'orbite postérieure au niveau du canthus médial ou tout simplement supérieur à cela (Figure 4B). Dans certaines dissections, les incisions pour enlever l'OSLG et l'ILG seront connectées.
REMARQUE : Lors de l'exécution de la chirurgie bilatérale, marquez les deux orbites en ce moment.
- Couper un morceau de fourrure de 2 à 3 cm de large avec des cisailles sur la surface latérale de chaque cuisse pour permettre le placement d'une plaque de cautérisation monopolaire.
- Appliquer le gel à ultrasons pour assurer un bon contact électrique avec la plaque de cautérisation monopolaire.
- Placez un cathéter intraveineux de 25 G (IV) dans l'une des veines marginales de l'oreille pour administrer des médicaments ou des liquides si nécessaire.
- Donner de la xylazine sous-cutanée (1 mg/kg) et de la kétamine IV (15 mg/kg) pour l'induction initiale de l'anesthésie (par l'accès IV).
REMARQUE : Si le lapin est sous sédatif à l'avance avec de l'acépromazine suffisante pour conserver le point de terminaison décrit à l'étape 2.3, utilisez la sédation du masque à gaz avec l'isoflurane comme alternative. - Placez une voie aérienne de masque laryngé e tenu en place à l'aide d'une bande élastique ou d'une ficelle pour fixer et entretenir les voies respiratoires.
- Connectez le masque à la machine d'anesthésie avec un flux d'oxygène réglé à 1 L/min.
- Fixer l'isoflurane à 5% d'abord, puis réduire comme toléré en fonction du niveau de sédation animale.
- Maintenir l'isoflurane à ou au-dessus de 2% jusqu'à la fermeture finale de la plaie.
REMARQUE : Évaluer le niveau de sédation en surveillant la fréquence respiratoire et les mouvements en réponse à des stimuli chirurgicaux ou douloureux. Augmentez la profondeur de l'anesthésie si le taux respiratoire augmente au-dessus de 10 respirations par minute, si le lapin commence à mâcher sur le mainteneur des voies respiratoires, ou si des mouvements en réponse à des stimuli douloureux sont observés.
- Surveillez l'oxymétrie des impulsions, la capnographie, la pression artérielle, la température corporelle rectale et la fréquence cardiaque à l'aide d'un dispositif de surveillance multiparamètres ou d'autres dispositifs appropriés.
- Surveillez les éléments vitaux en permanence pendant la procédure et enregistrez toutes les 10 à 15 min.
- Placez le lapin sur la table de la salle d'opération (OR) au-dessus d'un coussin chauffant pour prévenir l'hypothermie. Inclinez la table en position inverse de Trendelenburg à environ 30 degrés pour minimiser les saignements.
- Préparer la zone chirurgicale avec une solution povidone-iode diluée à demi-force avec de l'eau stérile et draper afin de maintenir un champ stérile.
5. Dacryoadenectomy chirurgical complet
REMARQUE : La dacryoadenectomy chirurgicale complète, comme décrit ci-tête, a été faite utilisant 0.3 forceps de tissu, ciseaux de tenotomy, forceps de tissu non-dentés, et ciseaux. Ces instruments peuvent être échangés avec des instruments similaires qui remplissent la même fonction en fonction de la préférence du chirurgien.
- Retirez d'abord l'OSLG.
- Infiltrer les sites d'incision (lignes de stylo de marquage chirurgical et couvercle postérieur supérieur) avec un mélange de 50:50 de lidocaïne de 2% avec 1:100.000 épinéphrine et 0.5% bupivacaine utilisant une seringue de 5 cc avec une aiguille de 30 G (figure 5A).
REMARQUE : La taille de la seringue et de l'aiguille n'est pas critique. - Utilisez une aiguille du Colorado reliée à une unité électrochirurgicale pour faire les incisions de la peau le long des marques chirurgicales. Les paramètres peuvent varier en fonction de la réponse clinique et se sirent généralement entre 10 et 15 unités pour la coupe et la coagulation (figure 5B).
- Appliquer la tension opposée à travers l'incision de la peau pour séparer les tissus et exposer les fibres musculaires frontoscutularis sous-jacentes.
- Appliquer une pression médiale sur le globe pour faciliter la visualisation de l'OSLG, considéré comme un tissu bombé situé juste médial ou profond aux fibres musculaires frontoscutularis. Si nécessaire, déplacez ces fibres musculaires sur le côté afin d'exposer l'incisure sous-jacente.
- Avec des forceps à dents (0,3) et des ciseaux capsulotomy, rétractez doucement et coupez la capsule fibreuse qui recense l'OSLG. L'OSLG a généralement une couleur beige pâle (Figure 5C).
- À l'aide de forceps à dentousiqueous ou non à dent, saisissez le tissu de la glande OSLG et tirez-le doucement par l'incisure supérieure à l'aide d'une technique de « main sur main ». Couper de petites bandes fibreuses à l'aide de ciseaux capsulotomy pour libérer la glande de sa position dans l'orbite (Figure 5D).
REMARQUE : Au fur et à mesure que le tissu de la glande OSLG est enlevé, il commencera à se resserrez en une grande structure tubulaire (canal excréteur principal). - Lorsque la glande a été enlevée aussi complètement que possible, utilisez la cautérisation généreuse avec l'aiguille du Colorado pour créer l'omble de tissu, tronquant la glande dans l'incisure aussi profondément que possible. Cela servira plus tard de point de repère de confirmation lors de la suppression de la PSLG.
- Infiltrer les sites d'incision (lignes de stylo de marquage chirurgical et couvercle postérieur supérieur) avec un mélange de 50:50 de lidocaïne de 2% avec 1:100.000 épinéphrine et 0.5% bupivacaine utilisant une seringue de 5 cc avec une aiguille de 30 G (figure 5A).
- Retirez le PSLG.
- Evert la paupière supérieure à l'aide d'un applicateur à pointe de coton. L'extrémité bulbeuse du PSLG est généralement facilement visible.
REMARQUE : Dans certaines dissections anatomiques, il peut être possible de visualiser le conduit excréteur principal comme une structure linéaire pâle d'environ 1 ou 2 mm de large. - Engagez le PSLG avec des forceps dentés (0,3) et retirez-le de la surface de la paupière tout en utilisant des ciseaux de capsulotomie pour couper autour de sa base en la séparant du tarse sous-jacent (figure 6A).
- Contrôlez le saignement modéré avec la cautérisation monopolaire.
- Appliquer une traction continue sur le tissu séparé pour maintenir un plan tissulaire pour la dissection. Cela permettra également d'enlever le conduit excréteur principal du SLG (figure 6B).
REMARQUE : Au fur et à mesure que la dissection est effectuée, elle avance généralement vers la jante orbitale supérieure où il est possible de voir les marques de cautérisation laissées derrière de l'enlèvement de l'OSLG plus supérieur et medially situé.
- Evert la paupière supérieure à l'aide d'un applicateur à pointe de coton. L'extrémité bulbeuse du PSLG est généralement facilement visible.
- Resect l'ILG.
- Laisser entrer en vigueur au moins 5 min pour que l'anesthésique local prenne effet.
- Inciser la peau, le muscle dépresseur du palpebra inférieur, la partie zygomaticolabial du muscle zygomatique, et le muscle orbicularis avec l'aiguille de microdissection du Colorado et séparé comme pour l'OSLG dans la section 5.1.
- Maintenir l'hémostase avec la cautérisation monopolaire.
- Comme l'incision est portée plus profondément à travers le marquage de la peau, chercher l'éclat d'un plan fascial sur l'os zygomatique ou partie superficielle du muscle masseur. À ce stade, maintenez le plan tissulaire et portez-le de façon supérieure vers la jante orbitale à l'aide de l'aiguille du Colorado pour la coupe (Figure 7A).
REMARQUE : Dans le but d'identifier l'ILG, il est plus facile d'exécuter cette partie de la dissection au-dessus de la tête de l'ILG qui est typiquement inférieure au limbus antérieur de l'oeil. - Après avoir identifié et incisé la capsule entourant l'ILG, identifiez le tissu tan de l'ILG. Seule la partie antérieure de la tête de l'ILG sera visible (figure 7B). Cependant, la tête peut être suivie médialement comme il passe sous l'arc zygomatique et les transitions dans la queue (Figure 7C).
- Utilisez des ciseaux ténotomy pour couper le septum orbital le long de la jante inférieure exposant la partie plus postérieure de la queue ILG. Une fois que le plan tissulaire est identifié, étendre la dissection postérieurement le long de toute la ligne d'incision (figure 7D).
REMARQUE : Le conduit de l'ILG passe par les tissus conjonctifs fibreux inférieurs pour entrer dans l'espace conjonctival inférieur dans l'aspect temporel du couvercle. À la jante postérieure, la queue de l'ILG peut avoir des configurations anatomiques variables. Parfois, il se termine inférieur au canthus postérieur (latéral), tandis que dans d'autres dissections, il s'étend plus supérieurement autour de l'orbite temporelle. - Utilisez des soins extrêmes pour prévenir les dommages par inadvertance à l'approvisionnement en sang, que l'ILG reçoit des branches de l'artère carotide. L'approvisionnement en sang peut être vu pendant cette partie de la dissection (Figure 7E).
- Dans les cas où la queue se termine sous le canthus postérieur (latéral), il peut être nécessaire de couper en deux la partie temporelle du muscle frontoscutulaire pour exposer la queue de l'ILG, qui se trouve le long de l'os zygomatique.
- Après que l'ENSEMBLE de l'ILG a été isolé et exposé, retirez-le. En raison de sa grande taille, il est souvent préférable de couper la glande en deux avec des ciseaux et enlever la tête séparément de la queue.
- Procédez très prudemment lors de l'enlèvement de la tête de l'ILG car elle se trouve immédiatement à côté d'un grand sinus veineux dans l'orbite. Bien que le saignement de cette structure pendant les résections chirurgicales ne s'est pas produit, ont des aides hémostatiques suffisantes présentes pour atténuer ce risque.
- Après l'enlèvement de tous les tissus de glande, fermez le plan de tissu conjonctif profond avec les sutures interrompues multiples de teréphtalate d'éthylène 5-0. Fermez les muscles superficiels et la peau avec une polyglacttine en cours d'exécution 6-0 suture 910 (Figure 7F) en utilisant 0,3 forceps de tissu et un conducteur d'aiguille.
6. Soins post-procédurales
- Dérapalez les animaux et nettoyez les sites chirurgicaux avec de l'eau stérile.
- Appliquer l'antibiotique ophtalmique topique et onguent stéroïde (néomycine, polymyxine, bacitracin, et hydrocortisone) aux incisions. Continuez cette application deux fois par jour pendant 2 jours.
- Donnez une injection sous-cutanée de 20 ml de saline normale sur les omoplates à l'aide d'une aiguille de 26 G.
- Donnez de la buprénorphine sous-cutanée 0,01 mg/kg ou du kétoprofène 3 mg/kg pour le contrôle de la douleur à l'aide d'une seringue de 1 cc et d'une aiguille de 30 G.
REMARQUE : Les animaux devraient retourner à leur apport alimentaire normal et à leurs activités dans un délai d'un à deux jours. Les lapins doivent être évalués au moins chaque semaine pour les signes cliniques de l'infection comme en témoigne l'enflure progressive, la douleur, l'érythème, le calor ou la décharge purulente sur les sites d'incision. Les animaux doivent également être observés pour s'assurer qu'ils ne commencent pas à rayer les sites d'incision / lignes de suture. Couper toutes les griffes avant la dacryoadenectomy peut être utile à cet égard. Si l'on observe des rayures des lignes d'incision, des colliers de protection standard peuvent être utilisés pour prévenir l'automutilation. - Inversez l'anesthésie.
- Retirez le mainteneur des voies respiratoires après que l'animal a répondu aux stimuli et commence à montrer la mastication spontanée, mais avant que le mainteneur des voies respiratoires peut être endommagé.
- Surveillez les animaux pendant environ 1 h et 2 h ou jusqu'à ce qu'ils se soient complètement remis de l'anesthésie, comme en témoigne le mouvement spontané dans leurs cages.
- Évaluez les animaux pour la douleur et traitez de façon appropriée.
- Permettre aux animaux de récupérer pendant au moins 1 semaine après la chirurgie avant de prendre des mesures cliniques de DED.
Résultats
La méthode complète de dacryoadenectomy décrite ici a été exécutée sur 8 animaux. Il exige un degré modéré de compétence chirurgicale. Le temps chirurgical a été moyen d'environ 2,2 h pour la chirurgie bilatérale, à l'exclusion de l'ablation de la membrane nictitating, qui a été faite séparément et a exigé le lt;10 minutes. Il n'y avait aucun décès ou complications peropératoires et aucun lapin n'a exigé n'importe quelle aide hémostatique autre que la cautérisation modeste.
Notre approche chirurgicale a avec succès induit l'oeil sec dans tous les yeux. Cela a été confirmé par un panel de marqueurs cliniques et de laboratoire de DED (tableau 1). Pendant les 8 semaines d'observation, le TBUT moyen a été supprimé par plus de 75% des niveaux préopératoires (p lt; 0.0001 pour tous les points de temps). De même, le test de déchirure du Schirmer a diminué d'environ 50%, restant ainsi pour les 8 semaines d'observation ; il n'a montré aucune tendance à la reprise au cours de la période de suivi. Postopératoirement, l'osmolarité de déchirure a montré une augmentation de 10% compatible avec DED, soutenu pendant au moins 8 semaines postopératoirement. La coloration rose bengal de la cornée a également augmenté et n'a pas montré de signes de rétablissement au cours des 8 semaines de suivi (figure 8). Tous les yeux subissant la dacryoadenectomy complète ont montré la réduction marquée des nombres de cellules de gobelet et des changements épithélial compatibles avec l'oeil sec (cytologie d'impression conjonctivale).

Figure 1 : Anatomie de glande lacrymale de lapin (oeil droit). La glande lacrimale supérieure orbitale (OSLG) est composée d'une plus grande partie orbitale et d'une composante palpebral plus petite. La plus grande glande lacrimale inférieure (ILG) est composée des parties antérieures/tête et postérieures/queue. Les axes de coordination montrent la terminologie utilisée pour toutes les descriptions d'orientation utilisées dans le texte. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
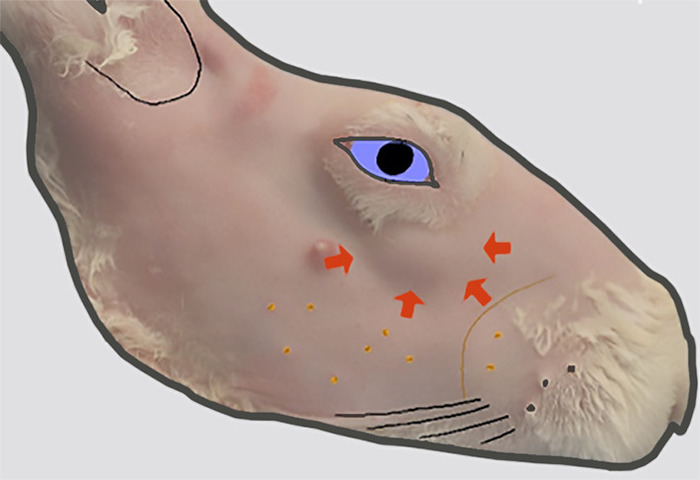
Figure 2 : Localisation du chef de l'ILG. La vue latérale du visage droit après l'enlèvement de la fourrure. Un renflement dans le contour de la peau (indiqué par des flèches épaisses) inférieur à l'orbite antérieure indique l'emplacement de la tête de l'ILG qui se trouve sur la surface externe de l'os zygomatique à cet endroit. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
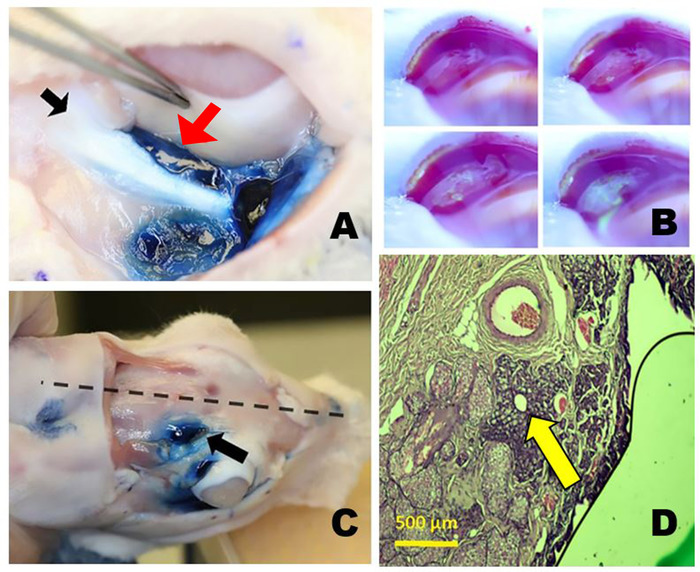
Figure 3 : Les glandes lacrimal orbitales. (A) La glande lacrimale inférieure droite (ILG) après coloration avec le colorant bleu d'Evans montrant la proximité de la queue de l'ILG (flèche rouge) juste médial à l'os zygomatique (flèche noire) et inférieur au globe. (B) Production de déchirure de la glande lacrimale supérieure palpébrale (PSLG). Photos en accéléré prises après application topique de 2% de fluorescéine. Le liquide aqueux émanant du PSLG dilue le colorant à la fluorescéine bleu foncé ou noir qui le transforme en vert jaune vif (semblable aux tests de Seidel). (C) Position du SLG orbital (OSLG) dans le crâne de lapin, se trouvant près de la ligne médiane du crâne (ligne pointillée) dans l'incisure postérieure (flèche). Le colorant bleu d'Evans a été injecté dans la glande lacrimale supérieure d'OSLG et palpebral. (D) La section d'histologie par le conduit excréteur principal de l'OSLG entouré d'une petite quantité de tissu glandulaire (flèche) est vue dans cette section transversale histopathologique tachée d'hématoxylin et de colorants d'éosin eprises pris par l'aspect postérieur (temporel) de la paupière droite supérieure. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
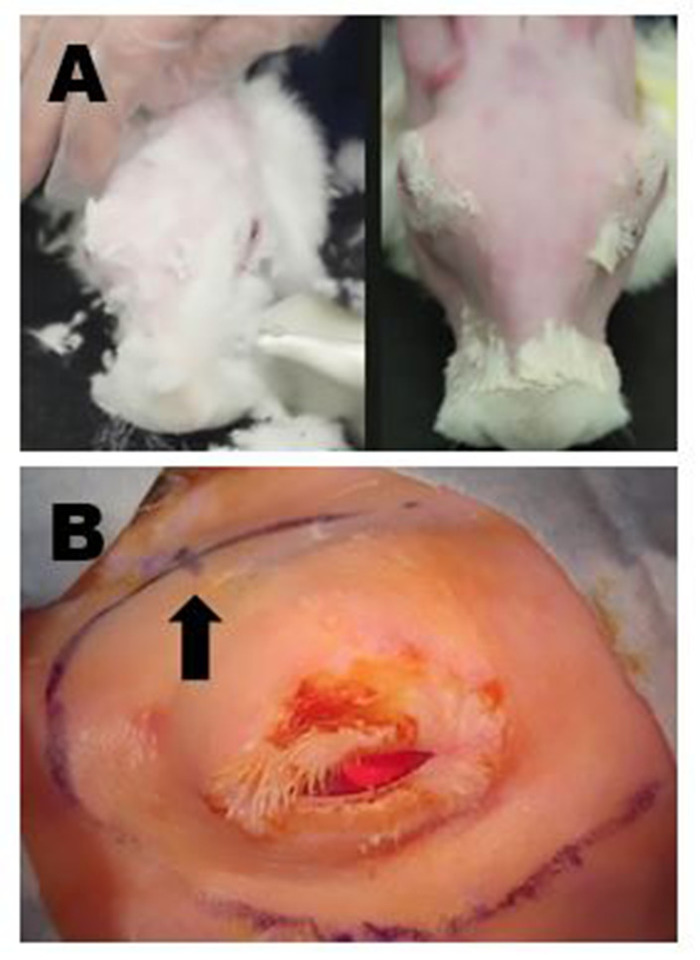
Figure 4 : Préparation du site chirurgical. (A) Panneau supérieur gauche : Enlèvement de la fourrure longue avec des cisailles. Toute la fourrure fine résiduelle est ensuite enlevée avec une crème dépilatoire douce. Panneau supérieur droit : Aspect final après l'enlèvement complet de fourrure qui permet le marquage chirurgical et l'ultrason de haute qualité de l'ILG à effectuer. (B) Des marques chirurgicales appropriées de la bonne région périorbitale sont montrées ; dans cet exemple, les incisions pour enlever l'OSLG et l'ILG ont été reliées pour créer une longue incision curviligne. L'emplacement de l'incisure postérieure est indiqué par une petite marque de hh sur le marquage curviligne du site d'incision (flèche). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
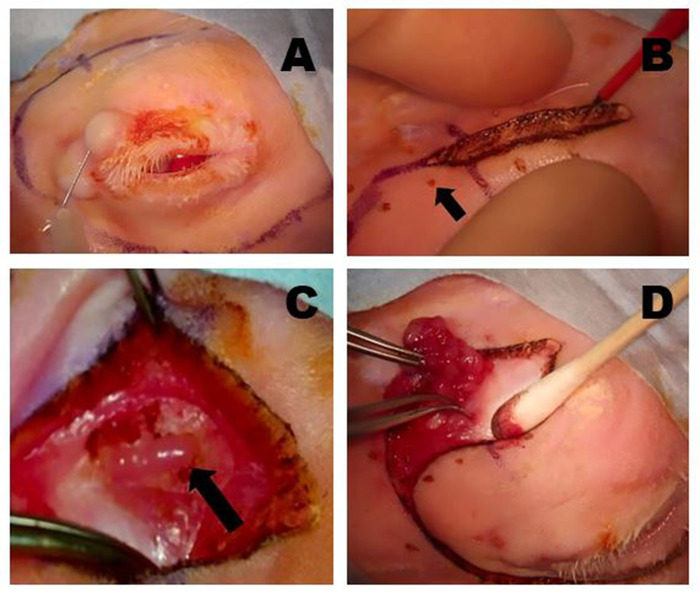
Figure 5 : Suppression de l'OSLG. (A) Les sites chirurgicaux sont infiltrés avec l'anesthésique à l'aide d'une combinaison 50:50 de 2% de lidocaïne avec 1:100.000 épinéphrine et 0,5% bupivacaine, qui est injecté dans le couvercle supérieur et le long des lignes d'incision pour minimiser l'inconfort pendant la procédure. (B) Une aiguille de microdissection du Colorado est utilisée pour inciser la peau et les couches musculaires superficielles le long des sites d'incision chirurgicale pré-marqués. Une légère traction à travers la plaie est appliquée pour aider à créer le plan de dissection. Les petites brûlures ponctuelles (flèche) ont été faites avec l'aiguille du Colorado à des points équidistants le long de la ligne d'incision pour aider à réaligner de façon optimale les tissus pendant la fermeture de la plaie. (C) L'OSLG est exposé après que des tissus revêtus de l'incisure postérieure ont été mobilisés (flèche). La capsule de la glande a été incisée. L'OSLG peut être prolapsus en appliquant une pression médiale au globe facilitant son retrait. (D) Les Forceps sont utilisés pour engager l'OSLG et le retirer doucement de sa position plus profonde dans l'orbite grâce à l'incisure postérieure. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
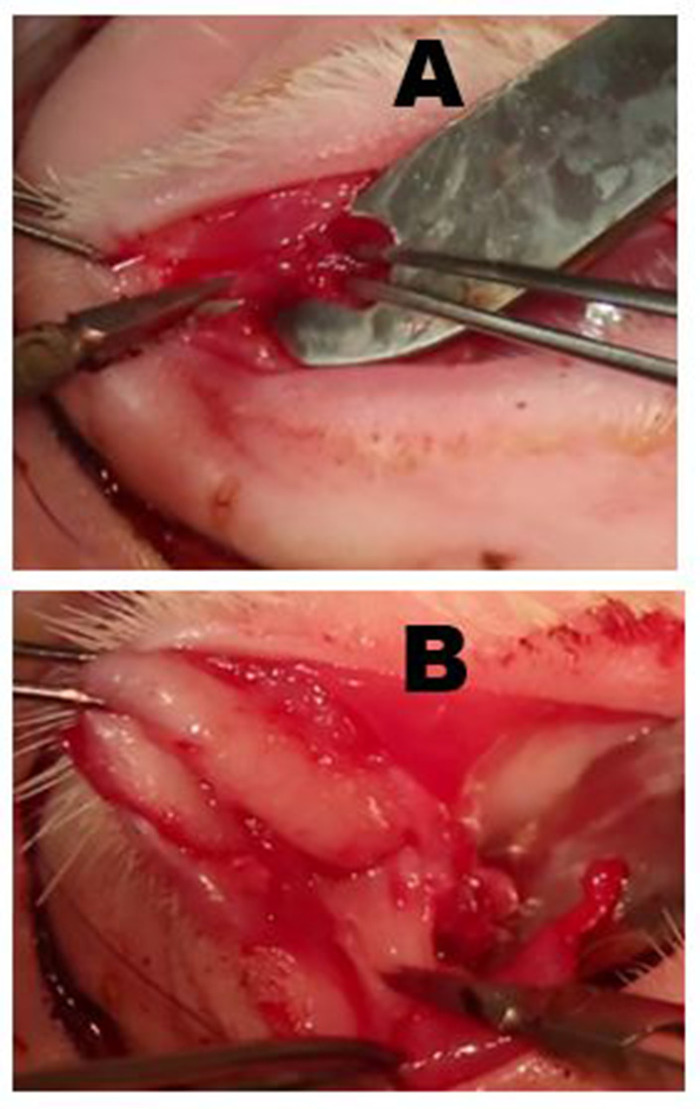
Figure 6 : Enlèvement de la glande lacrimale supérieure palpébrale (PSLG) et du conduit excréteur. (A) Suite à l'éversion de la paupière supérieure, la partie bulbeuse du PSLG est engagée avec des forceps et disséquée du tarse à l'aide de ciseaux. La traction appliquée au PSLG avec des forceps est essentielle au maintien de l'avion chirurgical. (B) La dissection du PSLG et du canal lacrimal principal est portée de façon supérieure vers la jante orbitale à l'aide d'une dissection pointue et d'une traction continue sur les tissus de la glande et des canaux pour maintenir le plan chirurgical approprié. La dissection doit se faire au point où l'OSLG a été supprimé. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
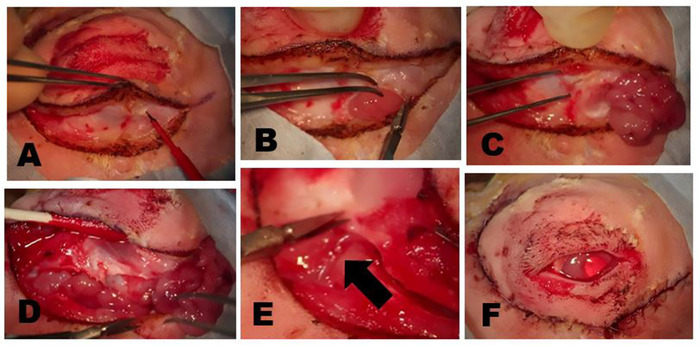
Figure 7 : Suppression du GIL. (A) La peau et le muscle superficiel sont incisés jusqu'à ce que le plan fascial qui recense l'os zygomatique ou la partie superficielle du muscle masseur est atteint. La tête de l'ILG est généralement clairement évidente comme un petit renflement situé sous le limbus antérieur. (B) La capsule fibreuse de l'ILG est incisée avec des ciseaux exposant l'ILG. Une fois la capsule incisée, les parties plus profondes de la glande peuvent être facilement enlevées. (C) La partie la plus externe de la tête ilG qui se trouve sur l'os zygomatique a été exposée et réfléchie antérieurement montrant l'os zygomatique sous-jacent. (D) L'incision du septum orbital le long de la jante inférieure expose la queue de l'ILG. (E) Une branche de l'artère carotide externe alimente la queue de l'ILG (flèche). (F) Apparition après la fermeture des incisions cutanées après dacryoadenectomy complet. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 8 : Coloration du Bengale de rose de la surface cornéenne. Photographie externe montrant la coloration proéminente, la plus notable sur le quadrant nasal. Tous les yeux subissant le dacryoadenectomy complet ont développé des changements semblables qui étaient évidents par 1 semaine après chirurgie et ont persisté pendant au moins 6 semaines. Il est à noter que le réflexe de lumière du flash de l'anneau montre une distorsion d'une surface oculaire sèche démontrant comment l'œil sec peut avoir un impact négatif sur la vision. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Dacryoadenectomy | ||
| moyenne - SEM; n 16 yeux | ||
| Base | Semaine 2 | |
| Temps de rupture de déchirure, s | 60,0 à 0,0 | 4,5 à 1,2 |
| p lt; 0,0001 | ||
| Osmolarité de déchirure, mOsm | 291,2 à 3,7 | 315,3 à 5,5 |
| p 0,001 | ||
| Test de déchirure de Schirmer, mm | 18,3 à 1,3 | 10,5 à 1,6 |
| p 0,0006 | ||
| Rose bengal, score NEI modifié | 0,0 à 0,0 | 4,28 à 0,6 |
| p lt; 0,0001 | ||
| Opéré vs. ligne de base: Dacryoadenectomy: TBUT, p 'lt; 0.0001; osmolarité larmoyante, p 'lt; 0.001; Test de déchirure de Schirmer, p 'lt; 0.0006); et rose bengale. | ||
Tableau 1 : Paramètres oculaires secs sur la semaine postopératoire 2.
Discussion
DED est classé en deux grands groupes en fonction de l'effet sur la stabilité du film lacrymal : le déficient aqueux (diminution de la production de la composante aqueuse du film lacrymal; 20% de DED) et l'évaporation (évaporation accrue du film lacrymal; 50% de DED). Environ 30% des patients de DED montrent l'évidence des deux (DED mélangé). L'inflammation est le mécanisme central de DED à laquelle ses diverses étiologies convergent13,14. Notre méthode modélise un DED aqueous-déficient.
Comme mentionné précédemment, les premières étapes importantes dans la reproduction de notre méthode sont une appréciation des points fins de l'anatomie des glandes lacrimal orbitales (LG) du lapin et d'éviter la confusion par la terminologie anatomique variée et parfois contradictoire. L'atlas anatomique de Popesko et coll.11 est extrêmement complet. Pour ceux qui sont moins à l'aise avec l'anatomie du lapin, la dissection des spécimens d'autopsie fournit une familiarité facile avec ces structures et facilite leur déplacement chirurgical dans les spécimens vivants.
Des conseils critiques sur le logement et l'acclimatation des animaux ont été donnés dans notre publicationcomplémentaire 12. Le même article présente également des commentaires utiles pour l'analyse des paramètres de DED utilisés dans les deux méthodes.
Contrairement à la méthode précédente12, celle-ci nécessite un niveau plus élevé de compétences chirurgicales en raison de l'étendue et la nature plus invasive des techniques nécessaires pour enlever les LG. Le plus grand risque au cours de ces résections est un saignement catastrophique causé par des blessures de grands vaisseaux qui sont à proximité des LG tels que les branches de l'artère carotide. Ceci est évité en visualisant adéquatement chaque LG et ses marges dans le domaine chirurgical. Enfin, l'ablation trop zélée de la membrane nictitating pourrait mener au prolapsus de la glande harderienne, qui peut perturber l'évaluation de film de déchirure.
Il faut prendre soin de minimiser la quantité de perturbation conjonctive avec l'élimination de la PSLG, un aspect nouveau de notre méthode qui améliore la reproductibilité et améliore la sévérité de DED. Il est étonnamment facile d'établir le plan de dissection et de le ramener à la crête orbitale supérieure tant que la traction est appliquée sur les tissus. Il est rassurant de pouvoir voir les marques de cautérisation de la troncation de l'OSLG; ils confirment l'ablation complète du conduit excréteur principal de la glande.
La suppression de l'ILG dans son intégralité présente également des défis. Isoler la tête de la glande d'abord, car c'est la partie la plus facile à visualiser. La tête entière du tissu de glande se sépare facilement des tissus environnants ; cependant, certains soins doivent être utilisés pour prévenir les dommages au grand sinus veineux, qui se trouve médial à la tête de l'ILG. La queue de l'ILG peut alors être suivie en arrière comme il passe sous l'os zygomatique. La majorité de la queue est facile à isoler. Cependant, l'aspect le plus postérieur de la queue peut s'avérer plus difficile en raison de l'anatomie variable et de sa proximité avec une branche de taille moyenne de la carotide. Une dissection soigneuse devrait permettre de voir clairement toutes les marges de l'ILG, ce qui faciliterait son élimination complète. L'investigateur devrait être disposé à porter la dissection plus supérieure dans les cas où la queue de la glande se termine sous le canthus latéral, comme expliqué dans la discussion plus tôt de l'anatomie des glandes lacrimal. Il convient de noter que les auteurs n'ont jamais été en mesure d'identifier une partie de l'OSLG lors de la dissection de l'ILG par une incision curviligne le long du globe temporel et inférieur. Bien que cela puisse être techniquement possible, cette approche chirurgicale comporte un risque trop élevé de saignements graves. L'approche de l'OSLG par l'incisure postérieure s'avère beaucoup plus sûre.
Le conduit excréteur de l'ILG peut être vu pénétrant à travers le plan fascial inférieur comme il passe dans le fornix conjonctif inférieur. De temps en temps, de petits lobules de tissu glandulaire-apparaissant sont vus ici aussi bien et peuvent être soigneusement enlevés.
Il est très utile de maintenir l'ordre de résection LG tel que présenté ici. Si l'ILG est supprimé en premier, l'isolement de l'OSLG devient techniquement beaucoup plus difficile. La raison principale est que, après le retrait de l'ILG, l'OSLG ne peut pas être facilement prolapsus et ainsi identifié.
Un avantage important de notre modèle est qu'il peut être «modulaire». En d'autres termes, le degré de DED induit par la dacryoadenectomy peut être calibré pour servir des besoins expérimentaux. Par exemple, la résection de tous les LG causerait le DED maximal, mais la résection de seulement le SLG causerait la forme la plus douce de DED et la résection de seulement l'ILG produirait la maladie de la sévérité intermédiaire.
Notre approche, qui récapitule l'événement pathophysiologique distinct de la production réduite de larmes offre des avantages supplémentaires par rapport aux méthodes déjà rapportées. En bref, aucun autre modèle chirurgical n'a éliminé la production de déchirures par tous les LG orbitaux5,6,7,15,16; y compris la dénervation parasympathique des LGs17, et la suppression pharmacologique de la production dedéchirures 18,19, les deux derniers ayant leurs effets hors cible en tant que facteurs de confusion significatifs. Enfin, ce modèle minimise le principal biais dépendant de l'investigateur, à savoir la résection incomplète des LG, puisque la technique chirurgicale permet leur visualisation complète; ceci est facilité par le fait qu'aucune hemostasis, autre que la cautérisation, n'est exigée.
L'investigateur doit être conscient que la résection complète de tous les LG orbitaux ne génère pas l'absence complète de larmes, et, par exemple, les valeurs de test de déchirure de Schirmer approchant zéro ne devraient pas être prévues. Cela est dû au fait qu'il existe toujours d'autres sources de liquide lacrymal comme les LG accessoires de Wolfring et Krause et les fuites de plasma des vaisseaux conjonctifs20,21,22. D'un point de vue expérimental, cela devrait être considéré comme un aspect positif de la méthode car elle maintient la surface oculaire; xerophthalmia complète détruirait totalement la cornée niant l'utilité du modèle. En outre, dans son incarnation actuelle, ce modèle offre une excellente occasion d'étudier ces mécanismes compensatoires et le transport des fluides à travers ces compartiments plus petits.
En conclusion, présentés ici sont les spécificités d'une méthode nouvelle et polyvalente d'induire deLaD aqueuse-déficiente qui se prête à l'étude de la physiologie de déchirure, à la pathogénie de DED et à l'étude des agents thérapeutiques développés pour cette indication.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent, sauf pour BR qui a une participation dans Medicon Pharmaceuticals, Inc. et Apis Therapeutics, LLC; et LH, un employé de Medicon Pharmaceuticals, Inc. avec une participation dans Apis Therapeutics, LLC.
Remerciements
Nous reconnaissons le soutien financier d'une subvention d'opportunités de recherche ciblée de la Stony Brook University School of Medicine et d'une subvention de recherche de Medicon Pharmaceuticals, Inc., Setauket, NY. Nous remercions Michele McTernan pour son soutien éditorial.
matériels
| Name | Company | Catalog Number | Comments |
| acepromazine, Aceproinj | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| anesthesia vaporizer | VetEquip, Pleasanton, CA | Item # 911103 | Protocol 4.8 |
| animal restraining bag | Henry Schein Animal Health, Dublin, OH | Jorvet J0170 | Use appropriately sized bag. |
| bupivacaine, 0.5% | Hospira Inc, Lake Forest IL | NDC: 0409-1162-02 | Mixed 50:50 with 2% lidocaine with 1:100,000 epinephrine for infiltration of incision sites, protocol 5.1 |
| buprenorphine | Henry Schein Animal Health, Dublin, OH | 0.01 mg/kg, for postprocedural care, 6.1.4 | |
| cautery unit, high-temperature, battery-powered | Medline Industries Inc, Northfield, IL | REF ESCT001 | Keep on hand in case of bleeding, protocol 2.7 |
| clipper, Wahl Mini Arco | Henry Schein Animal Health, Dublin, OH | No. 022573 | Cordless shears for fur removal, protocol 4.2 |
| Colorado needle | Stryker Craniomaxillofacial, Kalamazoo, MI | N103A | Use with electrosurgical unit to make incisions, protocol 5.1 & 5.3 |
| electrosurgical unit with monopolar cautery plate | Valleylab, Boulder, CO | Force FXc | Use with electrosurgical unit to make incisions, protocol 5.1 & 5.3 |
| fluorescein, Ak-Fluor 10% | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT, measurement of dry eye parameters, protocol 3.1 |
| foceps, curved dressing | Bausch and Lomb (Storz), Bridgewater, NJ | Storz E1406 | delicate serrated dressing forceps |
| forceps, 0.3 | Bausch and Lomb (Storz), Bridgewater, NJ | ET6319 | For removal of nictating membrane, protocol 2.5 |
| forceps, Bishop Harmon | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Use toothed forceps for dacryoadenectomy, protocol 5.1 & 5.2 |
| hair remover lotion, Nair | Widely available | Softening Baby oil | Dipilitory cream for sensitive skin, protocol 4.2 |
| isoflurane | Henry Schein Animal Health, Dublin, OH | 29405 | Possible alternative sedation, protocol 4.7 |
| IV catheter, Terumo Surflo ETFE 24-gauge | Terumo, Tokyo, Japan; available from Fisher Sci., VWR, McKesson, etc. | SR-OX2419CA | 25-gauge for smaller rabbits; protocol 4.6 |
| ketamine | Henry Schein Animal Health, Dublin, OH | NDC 11695-0701-1; NADA 200-055 | 15 mg/kg, protocol 4.7 |
| ketoprofen | Hospira, Inc., Lake Forest, IL | 3 mg/kg, for postprocedural care, 6.1.4 | |
| laryngeal mask airway | Docsinnovent Ltd, London, UK | Vgel R3 | Protocol 4.8 |
| lid speculum, wire | Bausch and Lomb (Storz), Bridgewater, NJ | Barraquer SUH01 | For removal of nictating membrane, protocol 2.4 |
| lidocaine 2% with epinephrine 1:100,000; 50:50 mixture | Hospira Inc, Lake Forest IL | NDC 0409-3182-02 | Pre-treat before removal of nictating membranes, protocol 2.4 |
| lidocaine, preservative-free | Sigma-Aldrich, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent, for application to eye, protocol 2.4 |
| micropipette | Eppendorf | Research Plus 100 uL | For application of preservative-free lidocaine to eye, protocol 2.4 |
| micropipette tips | World Wide Medical Products | 41071052 | For application of preservative-free lidocaine to eye, protocol 2.4 |
| monitoring device, multi-parameter | SurgiVet, Waukesha, WI | V9201 | For monitoring of vitals, protocol 4.9 |
| needle, 26-gauge | BD, Franklin Lakes, NJ | REF 305115 | For injection of lidocaine/epinephrine, protocol 2.3 & 2.5 |
| needle, 30-gauge | BD, Franklin Lakes, NJ | REF 305106 | For infiltration of incision sites; syringe and needle size are not critical, protocol 5.1 |
| osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity measurement of dry eye parameters, protocol 3.1 |
| osmometer, TearLab | TearLab Corp., San Diego, CA | Model#200000W REV A | Measure tear osmolarity, measurement of dry eye parameters, protocol 3.1 |
| povidone-iodine solution | Medline Industries Inc, Northfield, IL | PVP Prep Solution, NDC: 53329-939-04, REF MDS 093944 | To maintain sterile field, protocol 4.11 |
| rabbit, New Zealand White | Charles River Labs, Waltham, MA (NZW) | 2-3 kg | Research animals |
| Rose bengal stain | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, for staining the ocular surface, measurement of dry eye parameters, protocol 3.1 |
| saline, normal | B. Braun Medical, Irvine, CA | REF R5200-01 | For postprocedural care, protocol 6.1.3 |
| Schirmer Tear Test strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production, measurement of dry eye parameters, protocol 3.1 |
| scissors, Vannas | McKesson Medical-Surgical, San Francisco, CA | Miltex 2-130 | Capsulotomy scissors for dacryoadenectomy, protocol 5.1 & 5.2 |
| scissors, Westcott tenotomy | McKesson Medical-Surgical, San Francisco, CA | Miltex 18-1480 | For removal of nictating membrane, protocol 2.7 |
| sedation gas mask | DRE Veterinary, Louisville, KY | #1381 | Possible alternative sedation, protocol 4.7 |
| surgical marking pen | Medical Action Industries, Arden, ND | REF 115 | Protocol 4.2 |
| sutures, 5-0 Mersilene | Ethicon US, LLC | Ethylene terephthalate sutures, used for deep connective tissue closure, protocol 5.3.11 | |
| sutures, Vicryl 6-0 | Ethicon US, LLC | Polyglactin 910 sutures, used for superficial muscle and skin closure, protocol 5.3.11 | |
| syringe, 1 cc | BD, Franklin Lakes, NJ | ref 309659 | For injection of lidocaine/epinephrine, protocol 2.3 & 2.5 |
| syringe, 5 cc | BD, Franklin Lakes, NJ | REF 309603 | For infiltration of incision sites; syringe and needle size are not critical, protocol 5.1 |
| tissue forceps, 0.8mm Graefe | Roboz Surgical Store, Gaithersburg, MD | RS-5150 | Curved Weck forceps |
| topical antibiotic ointment (neomycin, polymyxin, bacitracin, and hydrocortisone) | Bausch and Lomb, Tampa, FL | NDC 24208-785-55 | Applied after removal of nictating membrane, protocol 2.8, and for postprocedural care, protocol 6.1.2 |
| ultrasound gel | Parker Laboratories, Inc., Fairfield, NJ | Aquasonic 100 | To ensure electrical contact with monopolar cautery plate, protocol 4.5 |
| xylazine | Henry Schein Animal Health, Dublin, OH | NADA: 139-236 | 1 mg/kg, protocol 4.7 |
Références
- Gillan, W. D. H. Tear biochemistry: A review. South African Optometrist. 69 (2), 100-106 (2010).
- Conrady, C. D., Joos, Z. P., Patel, B. C. Review: The Lacrimal Gland and Its Role in Dry Eye. Journal of Ophthalmology. 2016, 7542929 (2016).
- Schechter, J. E., Warren, D. W., Mircheff, A. K. A lacrimal gland is a lacrimal gland, but rodents' and rabbits' are not human. Ocular Surface. 8 (3), 111-134 (2010).
- Shinomiya, K., Ueta, M., Kinoshita, S. A new dry eye mouse model produced by exorbital and intraorbital lacrimal gland excision. Scientific Reports. 8 (1), 1483 (2018).
- Bhattacharya, D., et al. Tear Production After Bilateral Main Lacrimal Gland Resection in Rabbits. Investigative Ophthalmology and Visual Science. 56 (13), 7774-7783 (2015).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Li, N., et al. Establishment of the mild, moderate and severe dry eye models using three methods in rabbits. BioMed Central Ophthalmology. 13, 50 (2013).
- Honkanen, R., et al. A New Rabbit Model of Chronic Dry Eye Disease Induced by Complete Surgical Dacryoadenectomy. Current Eye Research. , 1-10 (2019).
- Nisha, S., Deepak, K. An Insight Into Ophthalmic Drug Delivery System. International Journal of Pharmaceutical Studies and Research. 3 (2), 9-13 (2012).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, (1929).
- Popesko, P., Rajitova, V., Horak, J. Rabbit - Guinea Pig. A Colour Atlas of the Anatomy of Small Laboratory Animals. 1, (1992).
- Honkanen, R. A., Huang, L., Rigas, B. A rabbit model of aqueous-deficient dry eye disease induced by concanavalin A injection into the lacrimal glands: Application to drug efficacy studies. Journal of Visualized Experiments. , e59631 (2019).
- Wei, Y., Asbell, P. A. The core mechanism of dry eye disease is inflammation. Eye & Contact Lens. 40 (4), 248-256 (2014).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology and Visual Science. 28 (2), 225-228 (1987).
- Odaka, A., et al. Efficacy of retinol palmitate eye drops for dry eye in rabbits with lacrimal gland resection. Clinical Ophthalmology. 6, 1585-1593 (2012).
- Toshida, H., Nguyen, D. H., Beuerman, R. W., Murakami, A. Evaluation of novel dry eye model: preganglionic parasympathetic denervation in rabbit. Investigative Ophthalmology and Visual Science. 48 (10), 4468-4475 (2007).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology and Visual Science. 49 (5), 1850-1856 (2008).
- Shiue, M. H., et al. Pharmacological modulation of fluid secretion in the pigmented rabbit conjunctiva. Life Science. 66 (7), 105 (2000).
- Li, Y., et al. Rabbit conjunctival epithelium transports fluid, and P2Y2(2) receptor agonists stimulate Cl(-) and fluid secretion. American Journal of Physiology: Cell Physiology. 281 (2), C595-C602 (2001).
- Dartt, D. A. Regulation of mucin and fluid secretion by conjunctival epithelial cells. Progress in Retinal and Eye Research. 21 (6), 555-576 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon