Method Article
Etablierung eines schweren Trockenauges modell mit vollständiger Dakryoadenektomie bei Kaninchen
In diesem Artikel
Zusammenfassung
Ein neuartiger Ansatz wird vorgestellt, um chronische trockene Augenerkrankungen bei Kaninchen zu induzieren, indem alle orbitalen Tränendrüsen operativ entfernt werden. Diese Methode, die sich von den zuvor berichteten unterscheidet, produziert ein stabiles, reproduzierbares Modell eines wässrigen mangelhaften trockenen Auges, das gut geeignet ist, Tränenphysiologie und Pathophysiologie und Augentherapeutika zu studieren.
Zusammenfassung
Trockene Augenkrankheit (DED) ist eine komplexe Krankheit mit mehreren Ätiologien und variablen Symptomen, mit Augenoberflächenentzündung als schlüsselpathophysiologischen Schritt. Trotz der Fortschritte in unserem Verständnis von DED bleiben erhebliche Wissenslücken bestehen. Die Fortschritte sind zum Teil aufgrund des Mangels an informativen Tiermodellen begrenzt. Die Autoren berichteten vor kurzem über eine Methode der DED induziert durch Injektion aller Orbital-Tränendrüse (LG) Gewebe mit dem Lektin Concanavalin A. Hier berichten wir über ein neuartiges Modell wässrig-mangelhafter DED, das auf der chirurgischen Resektion aller orbitalen LG-Gewebe (Dacryoadenektomie) basiert. Beide Methoden verwenden Kaninchen wegen ihrer Ähnlichkeit mit menschlichen Augen in Bezug auf die Größe und Struktur der Augenoberfläche. Eine Woche nach der Entfernung der nictitating Membran, die Orbital überlegenE LG wurde chirurgisch unter Narkose entfernt, gefolgt von der Entfernung der palpebralen überlegenen LG, und schließlich Entfernung der unteren LG. Dacryoadenektomie induzierte schwere DED, durch eine deutliche Reduzierung des Reißabbruchs und des Reißtests des Schirmers und deutlich erhöhte Tränenosmolarität und Rosenbengalenfärbung. Dacryoadenektomie-induzierte DED dauerte mindestens acht Wochen. Es gab keine Komplikationen und Tiere tolerierten das Verfahren gut. Die Technik kann relativ einfach von Personen mit ausreichender chirurgischer Erfahrung und Wertschätzung der relevanten Kaninchenanatomie gemeistert werden. Da dieses Modell die Merkmale des menschlichen wässrig-mangelhaften DED rekapituliert, eignet es sich für Studien der Okularoberflächenhomöostase, DED, und Kandidatentherapeutika.
Einleitung
Für den Schutz der Augenoberfläche und für die Aufrechterhaltung der optischen Eigenschaften der Hornhaut sind Risse erforderlich. Sie bestehen aus drei Schichten: einer inneren Mucin-Beschichtung, einer mittleren wässrigen Komponente und einer Lipid-Overlay1. Die Mucinschicht wird überwiegend in Kelchenzellen der Bindehaut, der wässrigen Komponente überwiegend in den Tränendrüsen (LGs) und der Lipidschicht überwiegend in den Meibomschen Drüsen1,2produziert. Die Orbital-LGs sind die Hauptquelle für die wässrige Komponente von Tränen und für viele der Proteine, die die Oberfläche vor bakteriellem Angriff schützen3. Augenoberflächenerkrankungen treten auf, wenn die wässrige Tränenproduktion unter einem kritischen Niveau verringert wird, wodurch die epitheliale Oberfläche des Auges der wässrigen Komponente und der entscheidenden Tränenbestandteile, einschließlich Wachstumsfaktoren, Lysozym und Lactoferrin, beraubt werden. In Fällen einer verminderten Tränenproduktion durch die LGs werden das Bindehaut- und Hornhautgewebe angepasst, um die veränderte Umwelt zu kompensieren.
Das Verständnis des Beitrags der Tränenkomponente, der sich aus den Orbital-LGs und den Kompensatoriumsmechanismen der Augenoberfläche ergibt, wenn dies fehlt, beeinflusst unsere Einschätzung der Physiologie und Pathophysiologie des vorderen Segments des Auges und, allgemeiner, von Gesundheit und Krankheit auf dem ganzen Globus. Der experimentelle Ansatz zu diesen Fragen erfordert ein informatives Tiermodell. Infolgedessen haben mehrere Gruppen versucht, Tiermodelle zu entwickeln, in denen die Orbital-LGs entfernt werden, wodurch die Beurteilung der Rolle von Tränen bei der Augengesundheit erleichtert wurde. Ein solches Modell wurde vor kurzem für die Maus4gemeldet. Das Kaninchen bietet jedoch viele deutliche Vorteile gegenüber Nagetiermodellen, einschließlich ähnlicher anatomischer und histologischer Strukturen des LG, und vielleicht noch wichtiger, ähnliche Größe und Oberfläche der Hornhaut und des Bindehautgewebes im Vergleich zu ihren menschlichen Pendants3.
Die Entstehung von wässrigen Mangel trockenen Augenkrankheit (DED) durch chirurgische Resektion von LG-Gewebe bei Kaninchen ist nicht neu. Zahlreiche Berichte beschreiben die Resektion von LG-Geweben mit unterschiedlichem Erfolg, die sich in variablen Veränderungen in der Tränenproduktion widerspiegeln, gemessen durch den Schirmer-Tränentest5,6,7,8. Ein gründliches Verständnis der relevanten Anatomie des Kaninchens und Klarheit über die anatomische Terminologie sind sehr hilfreich bei der Reproduktion dieser Methode. Nachfolgend finden Sie einen ausführlichen Überblick über beides.
Anatomie der Tränendrüsen
Das Kaninchen hat zwei Orbital-LGs: das größere unterlegene LG (ILG) und das kleinere überlegene LG (SLG; Abbildung 1). Die ILG erstreckt sich entlang des unteren und hinteren Aspekts des Orbitalrands. Mit Ausnahme der variablen Größe hat der vordere Teil der ILG ein ziemlich einheitliches bauchiges Aussehen, das als Protuberance in der Haut unter dem Globus gesehen werden kann (Abbildung 2). Aufgrund seines charakteristischen Aussehens in Bezug auf den Rest der Drüse wird es als "Kopf" der ILG bezeichnet. Ein Teil des Kopfes wickelt sich um und liegt auf der Außenfläche des zygomatischen Knochens. Dies dient als nützliches Meilenstein in der Ultraschall-Biomikroskopie, um Injektionen in die ILG zu leiten. Der Rest des Kopfes liegt mehr medial9 in der Umlaufbahn.
Aufgrund des charakteristischen Aussehens des verbleibenden Teils der ILG, der lang und dünn ist, wird dieses Segment als "Schwanz" bezeichnet. Der Schwanz verläuft entlang des unteren Orbitalrands, vom Kopf der ILG bis zum Orbitalrand, wo er mit variabler Anatomie am unteren und hinteren Orbitalrand endet (Abbildung 3A). Der Schwanz liegt tief (medial) bis zum zygomatischen Knochen, der den größten Teil seines Verlaufs durch ein Faszienband vom Orbitalinhalt getrennt ist, bis er den hinteren Rand der Umlaufbahn erreicht, wo er sich wieder über die äußere Oberfläche des zygomatischen Knochens erstreckt. Die ILG erhält ihre Blutversorgung aus Zweigen der Halsschlagader.
Die SLG besteht aus zwei Komponenten, die dem Menschen analog entsprechen. Eine davon ist die palpebrale Überlegene LG (PSLG), die sich im oberen hinteren Augenlid medial zur Tarsalplatte befindet. Es erscheint bauchig in der Natur und hat zahlreiche Punktionsöffnungen, die wässrige Tränenflüssigkeit ableiten, die leichter zu sehen ist, wenn sie mit 2% Fluorescein bedeckt ist (Abbildung 3B).
Die zweite ist die Orbital-Superior LG (OSLG), die sich in einer medialen Position in der oberen Umlaufbahn befindet (Abbildung 3C). Aufgrund seiner Position in der Nähe der Mittellinie des Schädels war es unmöglich, ihn mit externen chirurgischen Ansätzen aus der zeitlichen oder unteren Umlaufbahn erfolgreich zu identifizieren. In frischen Nekropsieproben oder chirurgischen Fällen kann diese Drüse durch die hintere Inzisur in der dorsalen Oberfläche des Schädels eingefahren werden, wenn sanfter Medialdruck auf den Globus ausgeübt wird. Der Prolaps dieses Drüsengewebes kann mit Ultraschallbiomikroskopie dokumentiert werden.
PSLG und OSLG sind zusammenhängende Strukturen. Die OSLG ist eine tubuloalveolare Struktur, deren duktale Architektur sich in den Hauptausscheidungskanal verschzweiigt. Dieser Kanal verläuft unter dem supraorbitalen Grat und verläuft in den oberen Deckelgeweben, die im PSLG enden. Entlang des Ausscheidungskanals wurde Drüsengewebe, das mit den ursprünglichen Beschreibungen von Davis übereinstimmt, identifiziert10 (Abbildung 3D).
Ein Hinweis zur Terminologie
Ausgezeichnete und umfassende anatomische Beschreibungen verwenden auch unterschiedliche Terminologie. Die klassische Orbitalanatomie von Davis definiert nur ein oberes und unteres LG10. Seine Beschreibung des oberen LG beschreibt jedoch deutlich die Hier genauer definierten Teile als PSLG und OSLG, während seine Beschreibung des unteren LG die hier als Kopf und Schwanz der ILG definierten Teile beschreibt. Ein neuerer und gründlicher anatomischer Atlas11 definiert diese Gewebe als zygomatische Drüse und das Zubehör LG. Der Begriff "Lacrimaldrübe" wird hier verwendet, um die oben genannten PSLG und OSLG zu umfassen. Diese Terminologie eignet sich besser für die Reproduktion dieser Methode ohne unnötige Verwechslungen.
Protokoll
Alle Wirbeltieruntersuchungen wurden in Übereinstimmung mit allen einschlägigen regulatorischen und institutionellen Richtlinien abgeschlossen. Alle Studien wurden vom Institutional Review Board der Stony Brook University genehmigt und in Übereinstimmung mit der Erklärung der Association for Research in Vision and Ophthalmology (ARVO) für die Verwendung von Tieren in der Augen- und Sehforschung durchgeführt.
1. Tiere und Gehäuse
- Verwenden Sie Neuseeländische Weiße (NZW) Kaninchen mit einem Gewicht von 2 bis 3 kg.
- Hauskaninchen einzeln in einer streng kontrollierten Umgebung: Temperatur (65 x 5 °F), Luftfeuchtigkeit (45 x 5 %) und Beleuchtung (12 h Ein-/Ausschaltzyklus).
HINWEIS: Aufgrund aggressiver Verhaltensweisen, die häufig zwischen Kaninchen, die gruppenuntergebracht sind, gezeigt werden, halten Tiere in einzelnen Käfigen, um unbeabsichtigte Augenverletzungen zu verhindern. - Geben Sie Kaninchen unbegrenzten Zugang zu Standard-Kaninchen-Chow und Wasser.
- Bieten Sie keine anderen nahrungsbedingten Anreicherungen, um unbeabsichtigte Vitamin-A-Supplementierung zu verhindern, die trockenes Auge beeinflussen könnte.
- Akklimatisieren Sie Kaninchen mindestens zwei Wochen vor der Aufzeichnung von DED-Parametern.
2. Entfernung der nictitierenden Membran
HINWEIS: Der Einfachheit halber wird die Technik für das rechte Auge unten beschrieben. Führen Sie dieses Verfahren auf dem linken Auge auf identische Weise aus.
- Entfernen Sie die nictitating Membran bilateral während der Akklimatisierungszeit (in der Regel die erste Woche).
- Kaninchen in eine entsprechend große Rückhaltetasche geben.
- Mit einer 1-c-Meter-Spritze und einer 26 G-Nadel, um das Kaninchen zu beruhigen, wird eine subkutane Injektion von Acepromazin (1 mg/kg) über die Schultern verabreicht. Der Endpunkt für diese milde Sedierung ist, wenn das Tier eine entspannte Kopfposition ohne normale Scanbewegungen beibehält und seine Ohren nicht mehr ganz aufrecht sind.
- Mit einer Mikropipette 25 l konservierungsmittelfreies Lidocain (1%) auf das Auge. Legen Sie einen Drahtdeckel-Spekulum zwischen die Augenlider ein.
- Greifen Sie die nictitating Membran an ihrer Spitze mit 0,3 Zangen (oder gleichwertig) und ziehen Sie sie über die Hornhautoberfläche. Injizieren Sie 1% Lidocain mit 1:100.000 Adrenalin in den subkonjunktivalen Raum der nictitierenden Membran mit einer 26 G Nadel. Injizieren Sie ca. 0,3 ml, um einen bescheidenen Bleb über der nictitierenden Membran zu bilden. Die Injektionsvolumina über 1 ml liegen für Kaninchen weit innerhalb eines sicheren Dosisbereichs (2 x 4 mg/kg).
- Entfernen Sie das Drahtspekulum. Warten Sie ca. 5 min, bis das Lidocain und Epinephrin wirksam werden. Während dieser Zeit, führen Sie das gleiche Verfahren in der anderen Auge.
- Ersetzen Sie das Drahtdeckel-Spekulum. Greifen und verlängern Sie die nictitating Membran über die Hornhautoberfläche mit 0,3 Zangen. Schneiden Sie die Membran an ihrer Basis mit tenotomy Schere oder gleichwertig.
HINWEIS: Blutungen sind in der Regel minimal, aber halten Sie eine Hochtemperatur-Batterie-Kautery-Einheit in der Nähe und verwenden Sie bei Bedarf, um Blutungen zu minimieren. Direkter Druck über die Schnittbasis der nictitating Membran kann auch verwendet werden, um kleine Blutungen zu stoppen, wenn es auftritt. - Entfernen Sie den Drahtdeckel speculum. Topische Antibiotikasalbe (Neomycin, Polymyxin, Bacitracin und Hydrocortison) über die Hornhautoberfläche legen.
- Führen Sie ein identisches Verfahren wie das Andere Auge durch, wie im Protokoll angegeben.
- Legen Sie die Tiere wieder in einzelne Käfige und lassen Sie sie mindestens eine Woche lang heilen, oder bis die Bindehautoberfläche aus klinischer Sicht vollständig geheilt ist, bevor Sie weitere Tests oder Interventionen durchführen.
HINWEIS: Die vollständige klinische Heilung wird durch das Fehlen von Schwellungen, Injektionen oder Entladungen von den Bindehautoberflächen angezeigt. Tiere sollten ihre Augen normal offen halten, ohne das Vorhandensein von schützender Ptosis.
3. Messung der Parameter des trockenen Auges und Entnahme von Reißproben
- Messen Sie die folgenden DED-Parameter, je nach Versuchsprotokoll: Tränenosmolarität, Tränenbruchzeit, Schirmers Tränentest und Rosenbengalenfärbung. Führen Sie sie wie zuvor beschrieben12, mit einem Team von mindestens zwei Ermittlern.
HINWEIS: Ein Team von mindestens zwei Forschern ermöglicht die effiziente Messung größerer Gruppen von Tieren (6 oder mehr) um die gleiche Uhrzeit und verhindert so, dass mögliche zirkadiane Variationen die Ergebnisse beeinflussen.
4. Chirurgische Präparation und Anästhesie
- Leicht besungene Tiere, die in einen Rückhaltebeutel mit subkutanem Acepromazin wie oben (1 mg/kg) gelegt werden.
- Entfernen Sie alle Fell auf dem Gesicht und dorsale Oberfläche des Schädels, um die chirurgischen Sehenswürdigkeiten zu visualisieren.
- Schneidfell mit Schnittscheren, die restliches feines Fell ca. 1 mm lang lassen(Abbildung 4A, links).
- Entfernen Sie alle Restfelle mit milder Enthaarungscreme nach den Anweisungen des Herstellers(Abbildung 4A, rechts).
- Markieren Sie chirurgische Schnittstellen mit einem chirurgischen Stift.
- Identifizieren Sie die Einschnittstelle über der hinteren Inzisur, indem Sie medialen Druck auf den Globus ausüben, wodurch sich eine kleine Wölbung in der Haut über die hintere Inzisur des Prolaps der OSLG entwickelt.
- Machen Sie eine lineare 2 cm Marke in vorderer/posteriorer Richtung auf der Haut über der dorsalen Oberfläche des Schädels direkt über dieser Stelle mit einem chirurgischen Markierungsstift.
- Bei der Planung des Schnittes zur Entfernung der ILG markieren Sie eine lange, kurvenlineare Linie um das Auge (1 cm vom unteren und zeitlichen Deckelrand), die sich von der hinteren (zeitlichen) Umlaufbahn bis zum vorderen (medialen) Canthus erstreckt. Lassen Sie die Markierung entlang der hinteren Umlaufbahn bis zur Ebene des medialen Canthus oder einfach besser als dies(Abbildung 4B) ausdehnen. In einigen Abschnitten werden die Einschnitte zum Entfernen der OSLG und der ILG angeschlossen.
HINWEIS: Markieren Sie bei einer bilateralen Operation beide Umlaufbahnen zu diesem Zeitpunkt.
- Schneiden Sie ein 2 bis 3 cm breites Pflaster mit Scheren über die seitliche Oberfläche jedes Oberschenkels, um die Platzierung einer monopolaren Kauteryplatte zu ermöglichen.
- Tragen Sie Ultraschallgel auf, um einen guten elektrischen Kontakt mit der monopolaren Kauteryplatte zu gewährleisten.
- Legen Sie einen 25 G intravenösen (IV) Katheter in eine der Randvenen des Ohres, um Medikamente oder Flüssigkeiten zu verabreichen, falls erforderlich.
- Subkutanes Xylazin (1 mg/kg) und IV Ketamin (15 mg/kg) zur Erstinduktion der Anästhesie (über den IV-Zugang) geben.
HINWEIS: Wenn das Kaninchen vorher mit Acepromazin sediert wird, das ausreicht, um den in Schritt 2.3 beschriebenen Endpunkt beizubehalten, verwenden Sie als Alternative die Gasmaskensedierung mit Isofluran. - Legen Sie eine Kehlkopfmaske An Ort und Stelle mit einem elastischen Band oder Saite, um die Atemwege zu sichern und zu erhalten.
- Schließen Sie die Maske mit einem Sauerstoffdurchfluss von 1 l/min an die Anästhesiemaschine an.
- Stellen Sie das Isofluran zunächst auf 5% und reduzieren Sie dann, wie toleriert, basierend auf dem Niveau der Tiersedierung.
- Halten Sie Isofluran bis zum endgültigen Wundverschluss bei oder über 2 % auf.
HINWEIS: Bewerten Sie den Sedationsgrad, indem Sie die Atemfrequenz und die Bewegungen als Reaktion auf chirurgische oder schmerzhafte Reize überwachen. Erhöhen Sie die Tiefe der Anästhesie, wenn die Atemfrequenz über 10 Atemzüge pro Minute steigt, wenn das Kaninchen beginnt, auf dem Atemwegsbeherder zu kauen, oder wenn Bewegungen als Reaktion auf schmerzhafte Reize beobachtet werden.
- Überwachen Sie Pulssoximetrie, Kapnographie, Blutdruck, rektale Körpertemperatur und Herzfrequenz mit einem Multiparameter-Überwachungsgerät oder anderen geeigneten Geräten.
- Überwachen Sie die Vitalstoffe während des Eingriffs kontinuierlich und zeichnen Sie alle 10 bis 15 min auf.
- Positionieren Sie das Kaninchen auf dem OP-Tisch (OR) über einem Heizkissen, um Unterkühlung zu verhindern. Neigen Sie den Tisch in einer umgekehrten Trendelenburg-Position bei ca. 30°, um Blutungen zu minimieren.
- Bereiten Sie den Operationsbereich mit einer Povidon-Jod-Lösung auf halbfest mit sterilem Wasser verdünnt und drapiert, um ein steriles Feld zu erhalten.
5. Vollständige chirurgische Dakryoadenektomie
HINWEIS: Die vollständige chirurgische Dakryoadenektomie, wie hier beschrieben, wurde mit 0,3 Gewebezangen, Tenotomiescheren, nicht zahnförmigen Gewebezangen und Scheren durchgeführt. Diese Instrumente können mit ähnlichen Instrumenten ausgetauscht werden, die die gleiche Funktion auf der Grundlage der Vorliebe des Chirurgen erfüllen.
- Entfernen Sie zuerst die OSLG.
- Infiltrieren Sie die Einschnittstellen (chirurgische Markierung von Stiftlinien und oberer hinterer Deckel) mit einer 50:50 Mischung aus 2% Lidocain mit 1:100.000 Adrenalin und 0,5% Bupivacaine mit einer 5-ccm-Spritze mit einer 30 G Nadel(Abbildung 5A).
HINWEIS: Spritze und Nadelgröße sind nicht entscheidend. - Verwenden Sie eine Colorado-Nadel, die mit einer elektrochirurgischen Einheit verbunden ist, um die Hauteinschnitte entlang der chirurgischen Markierungen zu machen. Die Einstellungen können je nach klinischem Ansprechen variieren und liegen in der Regel zwischen 10 und 15 Einheiten für Schnitt und Gerinnung(Abbildung 5B).
- Wenden Sie gegensätzliche Spannung über den Hautschnitt an, um das Gewebe zu trennen und die darunter liegenden Frontoscutularis Muskelfasern freizulegen.
- Wenden Sie medialen Druck auf den Globus an, um die Visualisierung des OSLG zu unterstützen, das als wölbendes Gewebe angesehen wird, das sich nur medial oder tief auf die Frontoscutularis-Muskelfasern befindet. Wenn nötig, bewegen Sie diese Muskelfasern zur Seite, um die zugrunde liegende Inziversicherung freizulegen.
- Mit Zahnzangen (0,3) und Kapsulotomiescheren die faserige Kapsel über der OSLG sanft zurückziehen und schneiden. Die OSLG hat in der Regel eine blasse Bräunchenfarbe (Abbildung 5C).
- Mit verzahnten oder nicht verzahnten Zangen greifen Sie das OSLG-Drüsengewebe und ziehen Es vorsichtig durch die überlegene Inziversicherung mit einer "Hand-over-Hand"-Technik heraus. Schneiden Sie kleine, faserige Bänder mit einer Capsulotomieschere, um die Drüse von ihrer Position im Orbit zu befreien (Abbildung 5D).
HINWEIS: Wenn das OSLG-Drüsengewebe entfernt wird, beginnt es sich zu einer großen röhrenartigen Struktur (Hauptausscheidungskanal) zusammenzuschließen. - Wenn die Drüse so vollständig wie möglich entfernt wurde, verwenden Sie großzügige Kautery mit der Colorado-Nadel, um Gewebe-Zeichen zu erstellen, die Drüse innerhalb der Incisure so tief wie möglich zu beschnitten. Dies wird später als Konfirmationsdenkmal während der Entfernung der PSLG dienen.
- Infiltrieren Sie die Einschnittstellen (chirurgische Markierung von Stiftlinien und oberer hinterer Deckel) mit einer 50:50 Mischung aus 2% Lidocain mit 1:100.000 Adrenalin und 0,5% Bupivacaine mit einer 5-ccm-Spritze mit einer 30 G Nadel(Abbildung 5A).
- Entfernen Sie die PSLG.
- Evert das obere Augenlid mit einem Baumwolle-Gekippt Applikator. Das bauchige Ende der PSLG ist in der Regel gut sichtbar.
HINWEIS: Bei einigen anatomischen Sezierungen kann es möglich sein, den Hauptausscheidungskanal als blasse lineare Struktur von etwa 1 oder 2 mm Breite zu visualisieren. - Nehmen Sie die PSLG mit Zahnzangen (0,3) ein und ziehen Sie sie von der Augenlidoberfläche zurück, während Sie die Capsulotomieschere verwenden, um ihre Basis zu schneiden, die sie vom darunter liegenden Tarsus trennt (Abbildung 6A).
- Kontrollieren Sie moderate Blutungen mit der monopolaren Kauterie.
- Tragen Sie kontinuierliche Traktion auf das abgetrennte Gewebe auf, um eine Gewebeebene für die Zerlegung aufrechtzuerhalten. Dadurch kann auch der Hauptausscheidungskanal des SLG entfernt werden (Abbildung 6B).
HINWEIS: Wenn die Sezierung durchgeführt wird, wird sie in der Regel zum oberen Orbitalrand vorrücken, wo es möglich ist, die Kautery-Markierungen zu sehen, die bei der Entfernung des überlegeneren und medial gelegenen OSLG zurückgelassen wurden.
- Evert das obere Augenlid mit einem Baumwolle-Gekippt Applikator. Das bauchige Ende der PSLG ist in der Regel gut sichtbar.
- Resect die ILG.
- Lassen Sie mindestens 5 min für das Lokalanästhetikum wirksam werden.
- Incise die Haut, die Depressor Muskel der unteren Palpebra, die zygomamatischenolabialen Teil des zygomatischen Muskels, und Orbicularis Muskel mit der Colorado Mikrodissektion Nadel und separat wie für die OSLG in Abschnitt 5.1.
- Bewahren Sie die Hämostase mit der monopolaren Kautery.
- Wenn der Schnitt tiefer durch die Hautmarkierung getragen wird, suchen Sie nach dem Glanz einer Faszienebene über dem zygomatischen Knochen oder einem oberflächlichen Teil des Masseermuskels. An diesem Punkt, halten Sie die Gewebeebene und tragen Sie es überlegen in Richtung der Orbitalfelge mit der Colorado-Nadel zum Schneiden (Abbildung 7A).
HINWEIS: Um die ILG zu identifizieren, ist es am einfachsten, diesen Teil der Sezierung über dem Kopf der ILG durchzuführen, der typischerweise schlechter als der vordere Limbus des Auges ist. - Nach der Identifizierung und Einschneidung der Kapsel, die die ILG umgibt, identifizieren Sie das Tangewebe der ILG. Nur der vordere Teil des ILG-Kopfes ist sichtbar (Abbildung 7B). Allerdings kann der Kopf medial verfolgt werden, wie er unter dem zygomatischen Bogen geht und in den Schwanz übergeht (Abbildung 7C).
- Verwenden Sie tenotomy Schere, um das Orbitalseptum entlang der unteren Rand zu schneiden, die den hinteren Teil des ILG-Schwanzes freilegt. Sobald die Gewebeebene identifiziert ist, verlängern Sie die Sezieren nach tränz entlang der gesamten Schnittlinie (Abbildung 7D).
HINWEIS: Der Kanal der ILG durchläuft das untere faserige Bindegewebe, um in den unteren Bindemittelraum im zeitlichen Aspekt des Deckels einzudringen. Am hinteren Rand kann der Schwanz der ILG unterschiedliche anatomische Konfigurationen aufweisen. Manchmal endet es schlechter als der hintere (laterale) Canthus, während es sich in anderen Abschnitten überlegener um die zeitliche Umlaufbahn erstreckt. - Achten Sie auf extreme Vorsicht, um unbeabsichtigte Schäden an der Blutversorgung zu verhindern, die die ILG von Zweigen der Halsschlagader erhält. Die Blutversorgung kann während dieses Teils der Zerlegung gesehen werden (Abbildung 7E).
- In Fällen, in denen der Schwanz unter dem hinteren (seitlichen) Canthus endet, kann es notwendig sein, den zeitlichen Teil des frontoscutularmuskels zu zerlegen, um den Schwanz der ILG, der entlang des zygomatischen Knochens liegt, freizulegen.
- Nachdem die gesamte ILG isoliert und freigelegt wurde, entfernen Sie sie. Aufgrund seiner großen Größe ist es oft vorzuziehen, die Drüse mit einer Schere zu halbieren und den Kopf getrennt vom Schwanz zu entfernen.
- Gehen Sie sehr vorsichtig vor, wenn Sie den Kopf der ILG entfernen, da sie unmittelbar neben einer großen venösen Sinus im Orbit liegt. Obwohl Blutungen aus dieser Struktur während der chirurgischen Resektionen nicht aufgetreten sind, haben reichlich hämostatische Hilfsmittel vorhanden, um dieses Risiko zu mindern.
- Nach der Entfernung des gesamten Drüsengewebes, schließen Sie die tiefe Bindegewebsebene mit mehreren unterbrochenen 5-0 Ethylenterephthalat Nähte. Schließen Sie die oberflächlichen Muskeln und die Haut mit einem laufenden 6-0 Polyglactin 910 Naht (Abbildung 7F) mit 0,3 Gewebezangen und einem Nadeltreiber.
6. Nachverfahrenspflege
- Die Tiere und die chirurgischen Stellen mit sterilem Wasser bereinigen.
- Wenden Sie topisches ophthalmologisches Antibiotikum und Steroidsalbe (Neomycin, Polymyxin, Bacitracin und Hydrocortison) auf die Schnitte an. Setzen Sie diese Anwendung zweimal täglich für 2 Tage fort.
- Geben Sie eine subkutane Injektion von 20 ml normaler Saline über die Schulterblätter mit einer 26 G Nadel.
- Subkutanes Buprenorphin 0,01 mg/kg oder Ketoprofen 3 mg/kg zur Schmerzkontrolle mit einer 1-c-Spritze und einer 30 G-Nadel.
HINWEIS: Tiere sollten innerhalb von 1 bis 2 Tagen zu ihrer normalen Nahrungsaufnahme und -aktivitäten zurückkehren. Kaninchen sollten mindestens wöchentlich auf klinische Anzeichen einer Infektion untersucht werden, wie durch fortschreitende Schwellung, Schmerzen, Erythem, Kalorien oder eitrige Entladung über die Einschnittstellen belegt. Tiere müssen auch beobachtet werden, um sicherzustellen, dass sie nicht beginnen, die Schnittstellen / Nahtlinien zu kratzen. Das Trimmen aller Krallen vor der Dakryoadenektomie kann in dieser Hinsicht hilfreich sein. Wenn Kratzer an den Schnittlinien beobachtet werden, können Standard-Schutzhalsbänder verwendet werden, um Selbstverletzungen zu verhindern. - Umkehren Sie die Anästhesie.
- Entfernen Sie den Atemwegsbetreuer, nachdem das Tier auf Reize reagiert und beginnt, spontanes Kauen zu zeigen, aber bevor der Atemwegsbetreuer beschädigt werden kann.
- Überwachen Sie die Tiere für ca. 1 x 2 h oder bis sie sich vollständig von der Anästhesie erholt haben, wie eine spontane Bewegung in ihren Käfigen zeigt.
- Bewerten Sie Tiere auf Schmerzen und behandeln Sie sie angemessen.
- Erlauben Sie Tieren, sich für mindestens 1 Woche nach der Operation zu erholen, bevor Sie klinische Maßnahmen von DED treffen.
Ergebnisse
Die hier beschriebene vollständige Dakryoadenektomie wurde an 8 Tieren durchgeführt. Es erfordert ein moderates Maß an chirurgischer Fähigkeit. Die chirurgische Zeit betrug durchschnittlich etwa 2,2 h für bilaterale Operationen, mit Ausnahme der Entfernung der nictitierenden Membran, die separat durchgeführt wurde und <10 Minuten benötigte. Es gab keine Todesfälle oder intraoperativen Komplikationen und kein Kaninchen benötigte eine andere hämostatische Hilfe als bescheidene Kautery.
Unser chirurgischer Ansatz induzierte erfolgreich trockenes Auge in allen Augen. Dies wurde durch ein Panel von klinischen und Labormarkern von DED bestätigt (Tabelle 1). Während der 8 Wochen der Beobachtung wurde die durchschnittliche TBUT um mehr als 75% der präoperativen Werte unterdrückt (p < 0.0001 für alle Zeitpunkte). In ähnlicher Weise ging der Reißtest des Schirmers um etwa 50 % zurück, so dass er in den 8 Wochen der Beobachtung blieb; sie zeigte während der Nachbeobachtungszeit keinen Trend zur Erholung. Postoperativ zeigte die Tränenosmolarität einen Anstieg um 10 %, der mit DED übereinstimmte und mindestens 8 Wochen postoperativ aufrechterhalten wurde. Rose bengalische Färbung der Hornhaut nahm ebenfalls zu und zeigte während der 8 Wochen der Nachbeobachtung keine Anzeichen einer Erholung (Abbildung 8). Alle Augen, die einer vollständigen Dakryoadenektomie unterzogen wurden, zeigten eine deutliche Reduktion der Kelchzellzahlen und epitheliale Veränderungen im Einklang mit dem trockenen Auge (konjunktivarische Abformzytologie).

Abbildung 1: Kaninchen-Tränendrüsenanatomie (rechtes Auge). Die Orbital-Superior-Tränendrüse (OSLG) besteht aus einem größeren Orbitalteil und einer kleineren palpebralen Komponente. Die größere minderwertige Tränendrüse (ILG) besteht aus den vorderen/Kopf- und hinteren/schwanzischen Teilen. Koordinatenachsen zeigen die Terminologie an, die für alle Imtext verwendeten Orientierungsbeschreibungen verwendet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
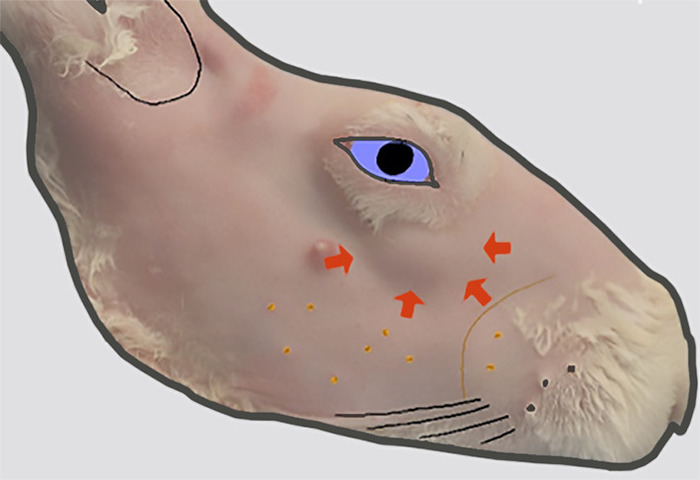
Abbildung 2: Lage des ILG-Leiters. Die seitliche Ansicht der rechten Fläche nach dem Entfernen von Fell. Eine Wölbung in der Hautkontur (angezeigt durch dicke Pfeile), die der vorderen Umlaufbahn unterlegen ist, zeigt die Position des Kopfes der ILG an, der an dieser Stelle auf der Außenfläche des zygomatischen Knochens liegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
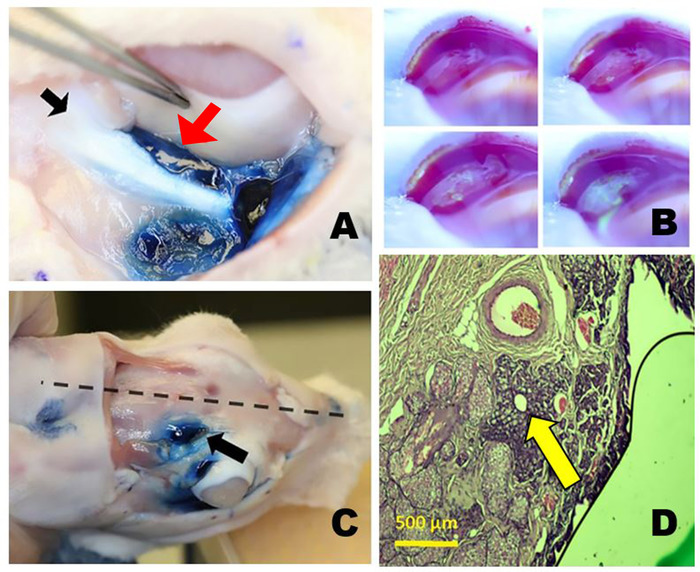
Abbildung 3: Die orbitalen Tränendrüsen. (A) Die rechte untere Tränendrüse (ILG) nach der Färbung mit Evans blauer Farbstoff zeigt die Nähe des Schwanzes der ILG (roter Pfeil) nur medial zum zygomatischen Knochen (schwarzer Pfeil) und niedriger als der Globus. (B) Tränenproduktion aus der palpebralen überlegenen Tränendrüse (PSLG). Zeitrafferfotos, die nach topischer Anwendung von 2% Fluorescein aufgenommen wurden. Wässrige Flüssigkeit, die aus dem PSLG ausgeht, verdünnt den zunächst dunkelblauen oder schwarzen Fluoresceinfarbstoff und verwandelt ihn hellgelb grün (ähnlich wie Seidel-Tests). (C) Position des Orbital-SLG (OSLG) im Kaninchenschädel, der nahe der Mittellinie des Schädels (gepunktete Linie) innerhalb der hinteren Inzisur (Pfeil) liegt. Evans blauer Farbstoff wurde in die OSLG und palpebral überlegene Tränendrüse injiziert. (D) Histologie-Abschnitt durch den Hauptausscheidungskanal der OSLG umgeben von einer kleinen Menge drüsigen Gewebe (Pfeil) ist in diesem histopathologischen Querschnitt mit Hämatoxylin und Eosinfarbstoffen durch den hinteren (zeitlichen) Aspekt des oberen rechten Augenlids gegeben gesehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
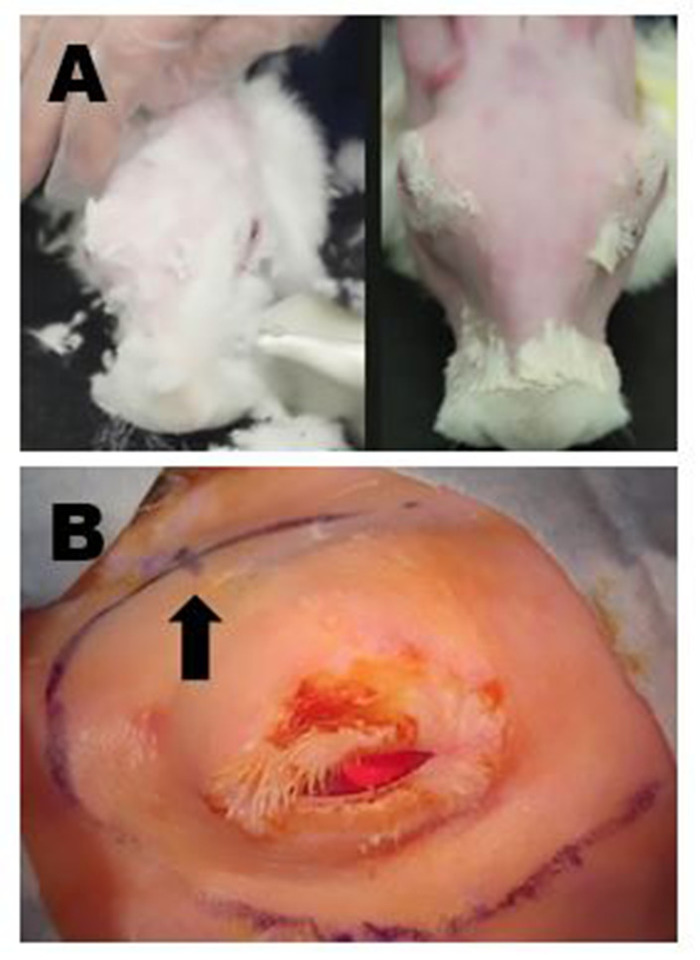
Abbildung 4: Chirurgische Standortvorbereitung. (A) Oberes linkes Panel: Entfernen von langem Fell mit Scheren. Alle restleichten feinen Felle werden anschließend mit einer milden Enthaarungscreme entfernt. Oberes rechtes Panel: Endgültiges Erscheinungsbild nach vollständiger Fellentfernung, die eine chirurgische Markierung und einen hochwertigen Ultraschall der ILG ermöglicht. (B) Es werden geeignete chirurgische Markierungen des rechten periorbitalen Bereichs angezeigt; In diesem Beispiel wurden die Einschnitte zum Entfernen der OSLG und ILG verbunden, um einen langen kurvenlinearen Schnitt zu erstellen. Die Position der hinteren Inzisur wird durch eine kleine Hashmarkierung auf der kurvenlinearen Schnittstelle (Pfeil) angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
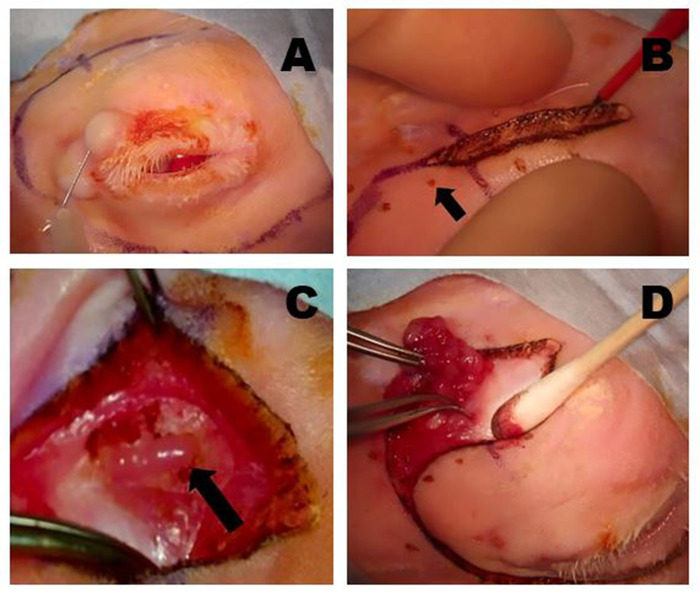
Abbildung 5: Entfernen der OSLG. (A) Chirurgische Stellen werden mit Anästhetikum mit einer 50:50-Kombination von 2% Lidocain mit 1:100.000 Adrenalin und 0,5% Bupivacain infiltriert, die in den oberen Deckel und entlang der Inzisionslinien injiziert wird, um Beschwerden während des Verfahrens zu minimieren. (B) Eine Colorado Mikrodissektion Nadel wird verwendet, um die Haut und oberflächliche Muskelschichten entlang der vormarkierten chirurgischen Schnittstellen zu schneiden. Sanfte Traktion über die Wunde wird angewendet, um die Sezierebene zu erstellen. Die kleinen punktgenauen Verbrennungen (Pfeil) wurden mit der Colorado-Nadel an äquidistanten Punkten entlang der Schnittlinie gemacht, um das Gewebe während des Wundverschlusses optimal neu auszurichten. (C) Die OSLG wird exponiert, nachdem Gewebe, die die hintere Inzisur überlagern, mobilisiert wurden (Pfeil). Die Kapsel der Drüse wurde eingeschnitten. Die OSLG kann durch medialen Druck auf den Globus, der ihre Entfernung erleichtert, vorgeführt werden. (D) Zangen werden verwendet, um die OSLG einzubinden und sie vorsichtig aus ihrer tieferen Position innerhalb der Umlaufbahn durch die hintere Inziation zu entfernen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
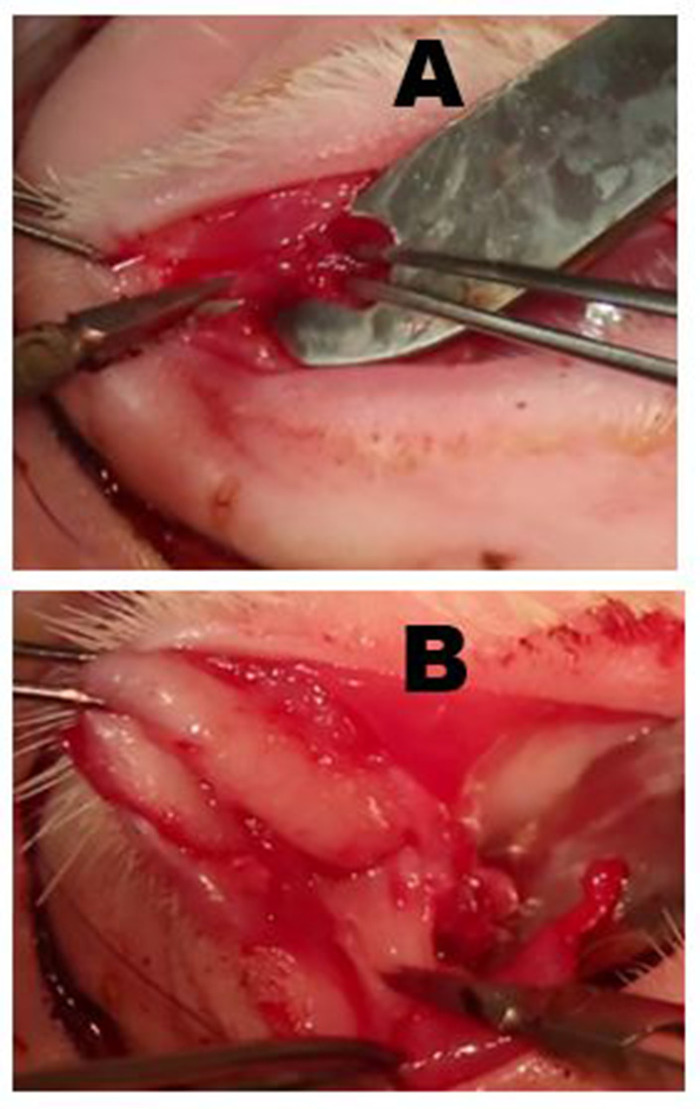
Abbildung 6: Entfernung der palpebralen überlegenen Tränendrüse (PSLG) und des Ausscheidungskanals. (A) Nach der Eversion des oberen Augenlids wird der bauchige Teil des PSLG mit Zangen betätigt und mit einer Schere vom Tarsus abgetrennt. Die Traktion, die auf das PSLG mit Zangen aufgebracht wird, ist entscheidend für die Aufrechterhaltung der chirurgischen Ebene. (B) Die Zerlegung des PSLG und des Haupt-Tränenkanals wird überlegen in Richtung Orbitalrand mit scharfer Sezierung und kontinuierlicher Traktion an der Drüse und dem Leitungsgewebe getragen, um die entsprechende chirurgische Ebene aufrechtzuerhalten. Die Sezierung sollte bis zu dem Punkt erfolgen, an dem die OSLG entfernt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
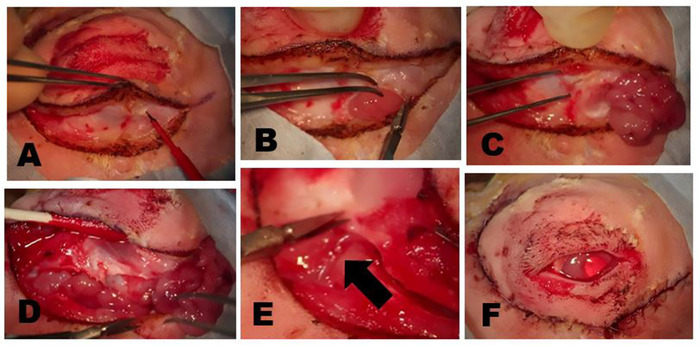
Abbildung 7: Entfernung der ILG. (A) Die Haut und der oberflächliche Muskel werden eingeschnitten, bis die Faszienebene über dem zygomatischen Knochen oder einem oberflächlichen Teil des Masseermuskels erreicht ist. Der Kopf der ILG ist in der Regel deutlich als eine kleine Wölbung unter dem vorderen Limbus zu erkennen. (B) Die Faserkapsel der ILG ist mit einer Schere eingeschnitten, die die ILG freilegt. Sobald die Kapsel eingeschnitten ist, können die tieferen Teile der Drüse leicht entfernt werden. (C) Der äußerlichste Teil des ILG-Kopfes, der auf dem zygomatischen Knochen liegt, wurde vorderlich mit dem zugrunde liegenden zygomatischen Knochen reflektiert. (D) Der Schnitt des Orbitalseptums entlang des unteren Rands legt den Schwanz der ILG frei. (E) Ein Ast der äußeren Halsschlagader speist den Schwanz der ILG (Pfeil). (F) Aussehen nach dem Verschluss von Hautschnitten nach vollständiger Dakryoadenektomie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Rose Bengal Färbung der Hornhautoberfläche. Externes Foto mit auffälliger Färbung, am bemerkenswertesten auf dem Nasenquadranten. Alle Augen, die sich einer vollständigen Dakryoadenektomie unterziehen, entwickelten ähnliche Veränderungen, die sich nach einer Woche nach der Operation zeigten und mindestens 6 Wochen anhielten. Bemerkenswert ist, dass der Lichtreflex des Ringblitzes Verzerrungen von einer trockenen Augenoberfläche zeigt, die zeigen, wie trockenes Auge das Sehvermögen beeinträchtigen kann. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Dakryoadenektomie | ||
| Mittelwert - SEM; n = 16 Augen | ||
| Basislinie | Woche 2 | |
| Tränenbruchzeit, s | 60,0 x 0,0 | 4,5 x 1,2 |
| p < 0,0001 | ||
| Tränenosmolarität, mOsm | 291,2 € 3,7 | 315,3 € 5,5 |
| p = 0,001 | ||
| Schirmer-Reißtest, mm | 18,3 x 1,3 | 10,5 x 1,6 |
| p = 0,0006 | ||
| Rosenbengalen, modifizierte NEI-Partitur | 0,0 x 0,0 | 4,28 x 0,6 |
| p < 0,0001 | ||
| Betrieben vs. Ausgangsbasis: Dakryoadenektomie: TBUT, p < 0.0001; Tränenosmolarität, p < 0,001; Schirmer-Reißtest, p < 0.0006); und Rosenbengalen. | ||
Tabelle 1: Trockene Augenparameter in der postoperativen Woche 2.
Diskussion
DED wird in zwei Hauptgruppen eingeteilt, die auf der Wirkung auf die Stabilität des Tränenfilms basieren: wässrige Mangelmittel (verringerte Produktion der wässrigen Komponente des Tränenfilms; 20% dED) und Verdunstung (erhöhte Verdunstung des Tränenfilms; 50% des DED). Etwa 30% der DED-Patienten weisen Aufweise auf beides auf (gemischte DED). Entzündung ist der Kernmechanismus von DED, zu dem seine verschiedenen Ätiologien konvergieren13,14. Unsere Methode modelliert wässrige DED.
Wie bereits erwähnt, sind wichtige erste Schritte bei der Reproduktion unserer Methode eine Aufwertung der Feinheiten der Anatomie der Orbital-Tränendrüsen (LGs) des Kaninchens und die Vermeidung von Verwechslungen durch abwechslungsreiche und manchmal widersprüchliche anatomische Terminologie. Der anatomische Atlas von Popesko et al.11 ist äußerst gründlich. Für diejenigen, die sich mit der Anatomie des Kaninchens weniger wohl fühlen, bietet die Sezieren von Nekropsieproben eine einfache Vertrautheit mit diesen Strukturen und unterstützt ihre chirurgische Entfernung bei lebenden Exemplaren.
Kritische Ratschläge zur Tierhaltung und -akklimatisierung finden Sie in unserer Begleitpublikation12. Derselbe Artikel enthält auch nützliche Kommentare für die Analyse der Parameter von DED in beiden Methoden verwendet.
Im Gegensatz zur vorherigen Methode12erfordert diese aufgrund des Umfangs und der invasiveren Natur der Techniken, die zum Entfernen der LGs erforderlich sind, ein höheres Maß an chirurgischer Kompetenz. Das größte Risiko während dieser Resektionen sind katastrophale Blutungen, die durch die Verletzung großer Gefäße verursacht werden, die sich in unmittelbarer Nähe zu den LGs befinden, wie z. B. Zweige der Halsschlagader. Dies wird vermieden, indem jedes LG und seine Ränder innerhalb des chirurgischen Bereichs angemessen visualisiert werden. Schließlich könnte eine übereifrige Entfernung der nictitierenden Membran zum Prolaps der Harderischen Drüse führen, was die Bewertung von Tränenfilmen stören kann.
Es sollte darauf geachtet werden, die Menge der Bindeunterbrechung mit der Entfernung der PSLG zu minimieren, einem neuartigen Aspekt unserer Methode, der die Reproduzierbarkeit verbessert und die Schwere von DED erhöht. Es ist überraschend einfach, die Sezierebene zu bestimmen und sie zurück zum überlegenen Orbitalrücken zu tragen, solange die Traktion auf das Gewebe angewendet wird. Es ist beruhigend, die Kauter-Markierungen aus dem Abschneiden der OSLG sehen zu können; sie bestätigen die vollständige Entfernung des Hauptausscheidungskanals der Drüse.
Auch die vollständige Abschaffung der ILG stellt Herausforderungen dar. Isolieren Sie zuerst den Kopf der Drüse, da dies der einfachste Teil ist, der visualisiert werden kann. Der gesamte Kopf des Drüsengewebes trennt sich leicht von den umgebenden Geweben; Jedoch muss eine gewisse Sorgfalt verwendet werden, um Schäden an der großen venösen Sinus zu verhindern, die medial an der Spitze der ILG liegt. Der Schwanz der ILG kann dann zurückverfolgt werden, wenn er unter dem zygomatischen Knochen verläuft. Der Großteil des Schwanzes ist leicht zu isolieren. Der hintere Aspekt des Schwanzes kann sich jedoch aufgrund der variablen Anatomie und der Nähe zu einem mittelgroßen Zweig des Karotis als anspruchsvoller erweisen. Eine sorgfältige Zerlegung sollte es ermöglichen, alle Ränder der ILG klar zu erkennen, was ihre vollständige Entfernung erleichtert. Der Prüfer sollte bereit sein, die Sezieren besser in Denkankörpern zu tragen, wenn der Schwanz der Drüse unter dem seitlichen Canthus endet, wie in der früheren Diskussion über die Anatomie der Tränendrüsen erläutert. Bemerkenswert ist, dass die Autoren nie in der Lage waren, einen Teil der OSLG zu identifizieren, wenn sie die ILG durch einen kurvigen Schnitt entlang des zeitlichen und unteren Globus sezieren. Obwohl dies technisch möglich sein mag, birgt dieser chirurgische Ansatz ein zu hohes Risiko für schwere Blutungen. Die Annäherung an die OSLG durch die hintere Inziversicherung erweist sich als viel sicherer.
Der Ausscheidungskanal der ILG kann durch die untere Faszienebene eindringen, während er in den unteren Bindehautfornix gelangt. Gelegentlich sind hier auch kleine Lobulen aus drüsen erscheinendem Gewebe zu sehen und können sorgfältig entfernt werden.
Es ist sehr hilfreich, die Reihenfolge der LG-Resektion, wie hier vorgestellt, beizubehalten. Wenn die ILG zuerst entfernt wird, wird die Isolierung der OSLG technisch viel schwieriger. Der Hauptgrund ist, dass die OSLG nach der Entfernung der ILG nicht einfach zu überführen und dadurch identifiziert werden kann.
Ein wesentlicher Vorteil unseres Modells ist, dass es "modular" sein kann. Mit anderen Worten, der Grad der DED durch Dakryoadenektomie induziert kann kalibriert werden, um experimentellen Bedürfnissen zu dienen. Zum Beispiel würde eine Resektion aller LGs maximal DED verursachen, aber eine Resektion nur der SLG würde die mildeste Form von DED verursachen und eine Resektion nur der ILG würde eine Krankheit mittleren Schweregrads verursachen.
Unser Ansatz, der das ausgeprägte pathophysiologische Ereignis der reduzierten Tränenproduktion rekapituliert, bietet zusätzliche Vorteile gegenüber bereits gemeldeten Methoden. Kurz gesagt, kein anderes chirurgisches Modell eliminiert Tränenproduktion durch alle Orbital LGs5,6,7,15,16; einschließlich parasympathischer Denervation der LGs17und pharmakologische Unterdrückung der Tränenproduktion18,19, wobei die beiden letztgenannten ihre Off-Target-Effekte als signifikante Störfaktoren haben. Schließlich minimiert dieses Modell die Haupt-Untersuchungs-abhängige Voreingenommenheit, nämlich die unvollständige Resektion der LGs, da die chirurgische Technik ihre vollständige Visualisierung ermöglicht; dies wird durch die Tatsache unterstützt, dass keine Hämostase, außer Kauterie, erforderlich ist.
Der Prüfer sollte sich bewusst sein, dass eine vollständige Resektion aller Orbital-LGs nicht zu völligem Fehlen von Rissen führt, und zum Beispiel sollten Schirmers Tränentestwerte, die sich Null nähern, nicht erwartet werden. Dies ist auf die Tatsache zurückzuführen, dass es immer andere Quellen von Tränenflüssigkeit wie die Zubehör-LGs von Wolfring und Krause und Plasmaleckage aus Bindekondenkgefäßen20,21,22. Vom experimentellen Standpunkt aus sollte dies als ein positiver Aspekt der Methode betrachtet werden, da es die Augenoberfläche aufrechterhält; vollständige Xerophthalmie würde die Hornhaut völlig zerstören und die Nützlichkeit des Modells negieren. Darüber hinaus bietet dieses Modell in seiner aktuellen Ausführungsform eine ausgezeichnete Gelegenheit, solche Kompensationsmechanismen und den Flüssigkeitstransport über diese kleineren Fächer zu untersuchen.
Zusammenfassend sind hier die Besonderheiten einer neuartigen und vielseitigen Methode zur Induktion wässrig-mangelhafter DED, die sich für das Studium der Tränenphysiologie, die Pathogenese von DED und die Untersuchung von therapeutischen Wirkstoffen eignet, die für diese Indikation entwickelt werden.
Offenlegungen
Die Autoren erklären keine konkurrierenden Interessen außer BR, die eine Beteiligung an Medicon Pharmaceuticals, Inc. und Apis Therapeutics, LLC hat; und LH, ein Mitarbeiter von Medicon Pharmaceuticals, Inc. mit einer Beteiligung an Apis Therapeutics, LLC.
Danksagungen
Wir würdigen die finanzielle Unterstützung durch ein Targeted Research Opportunities Stipendium der Stony Brook University School of Medicine und ein Forschungsstipendium von Medicon Pharmaceuticals, Inc., Setauket, NY. Wir danken Michele McTernan für die redaktionelle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| acepromazine, Aceproinj | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| anesthesia vaporizer | VetEquip, Pleasanton, CA | Item # 911103 | Protocol 4.8 |
| animal restraining bag | Henry Schein Animal Health, Dublin, OH | Jorvet J0170 | Use appropriately sized bag. |
| bupivacaine, 0.5% | Hospira Inc, Lake Forest IL | NDC: 0409-1162-02 | Mixed 50:50 with 2% lidocaine with 1:100,000 epinephrine for infiltration of incision sites, protocol 5.1 |
| buprenorphine | Henry Schein Animal Health, Dublin, OH | 0.01 mg/kg, for postprocedural care, 6.1.4 | |
| cautery unit, high-temperature, battery-powered | Medline Industries Inc, Northfield, IL | REF ESCT001 | Keep on hand in case of bleeding, protocol 2.7 |
| clipper, Wahl Mini Arco | Henry Schein Animal Health, Dublin, OH | No. 022573 | Cordless shears for fur removal, protocol 4.2 |
| Colorado needle | Stryker Craniomaxillofacial, Kalamazoo, MI | N103A | Use with electrosurgical unit to make incisions, protocol 5.1 & 5.3 |
| electrosurgical unit with monopolar cautery plate | Valleylab, Boulder, CO | Force FXc | Use with electrosurgical unit to make incisions, protocol 5.1 & 5.3 |
| fluorescein, Ak-Fluor 10% | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT, measurement of dry eye parameters, protocol 3.1 |
| foceps, curved dressing | Bausch and Lomb (Storz), Bridgewater, NJ | Storz E1406 | delicate serrated dressing forceps |
| forceps, 0.3 | Bausch and Lomb (Storz), Bridgewater, NJ | ET6319 | For removal of nictating membrane, protocol 2.5 |
| forceps, Bishop Harmon | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Use toothed forceps for dacryoadenectomy, protocol 5.1 & 5.2 |
| hair remover lotion, Nair | Widely available | Softening Baby oil | Dipilitory cream for sensitive skin, protocol 4.2 |
| isoflurane | Henry Schein Animal Health, Dublin, OH | 29405 | Possible alternative sedation, protocol 4.7 |
| IV catheter, Terumo Surflo ETFE 24-gauge | Terumo, Tokyo, Japan; available from Fisher Sci., VWR, McKesson, etc. | SR-OX2419CA | 25-gauge for smaller rabbits; protocol 4.6 |
| ketamine | Henry Schein Animal Health, Dublin, OH | NDC 11695-0701-1; NADA 200-055 | 15 mg/kg, protocol 4.7 |
| ketoprofen | Hospira, Inc., Lake Forest, IL | 3 mg/kg, for postprocedural care, 6.1.4 | |
| laryngeal mask airway | Docsinnovent Ltd, London, UK | Vgel R3 | Protocol 4.8 |
| lid speculum, wire | Bausch and Lomb (Storz), Bridgewater, NJ | Barraquer SUH01 | For removal of nictating membrane, protocol 2.4 |
| lidocaine 2% with epinephrine 1:100,000; 50:50 mixture | Hospira Inc, Lake Forest IL | NDC 0409-3182-02 | Pre-treat before removal of nictating membranes, protocol 2.4 |
| lidocaine, preservative-free | Sigma-Aldrich, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent, for application to eye, protocol 2.4 |
| micropipette | Eppendorf | Research Plus 100 uL | For application of preservative-free lidocaine to eye, protocol 2.4 |
| micropipette tips | World Wide Medical Products | 41071052 | For application of preservative-free lidocaine to eye, protocol 2.4 |
| monitoring device, multi-parameter | SurgiVet, Waukesha, WI | V9201 | For monitoring of vitals, protocol 4.9 |
| needle, 26-gauge | BD, Franklin Lakes, NJ | REF 305115 | For injection of lidocaine/epinephrine, protocol 2.3 & 2.5 |
| needle, 30-gauge | BD, Franklin Lakes, NJ | REF 305106 | For infiltration of incision sites; syringe and needle size are not critical, protocol 5.1 |
| osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity measurement of dry eye parameters, protocol 3.1 |
| osmometer, TearLab | TearLab Corp., San Diego, CA | Model#200000W REV A | Measure tear osmolarity, measurement of dry eye parameters, protocol 3.1 |
| povidone-iodine solution | Medline Industries Inc, Northfield, IL | PVP Prep Solution, NDC: 53329-939-04, REF MDS 093944 | To maintain sterile field, protocol 4.11 |
| rabbit, New Zealand White | Charles River Labs, Waltham, MA (NZW) | 2-3 kg | Research animals |
| Rose bengal stain | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, for staining the ocular surface, measurement of dry eye parameters, protocol 3.1 |
| saline, normal | B. Braun Medical, Irvine, CA | REF R5200-01 | For postprocedural care, protocol 6.1.3 |
| Schirmer Tear Test strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production, measurement of dry eye parameters, protocol 3.1 |
| scissors, Vannas | McKesson Medical-Surgical, San Francisco, CA | Miltex 2-130 | Capsulotomy scissors for dacryoadenectomy, protocol 5.1 & 5.2 |
| scissors, Westcott tenotomy | McKesson Medical-Surgical, San Francisco, CA | Miltex 18-1480 | For removal of nictating membrane, protocol 2.7 |
| sedation gas mask | DRE Veterinary, Louisville, KY | #1381 | Possible alternative sedation, protocol 4.7 |
| surgical marking pen | Medical Action Industries, Arden, ND | REF 115 | Protocol 4.2 |
| sutures, 5-0 Mersilene | Ethicon US, LLC | Ethylene terephthalate sutures, used for deep connective tissue closure, protocol 5.3.11 | |
| sutures, Vicryl 6-0 | Ethicon US, LLC | Polyglactin 910 sutures, used for superficial muscle and skin closure, protocol 5.3.11 | |
| syringe, 1 cc | BD, Franklin Lakes, NJ | ref 309659 | For injection of lidocaine/epinephrine, protocol 2.3 & 2.5 |
| syringe, 5 cc | BD, Franklin Lakes, NJ | REF 309603 | For infiltration of incision sites; syringe and needle size are not critical, protocol 5.1 |
| tissue forceps, 0.8mm Graefe | Roboz Surgical Store, Gaithersburg, MD | RS-5150 | Curved Weck forceps |
| topical antibiotic ointment (neomycin, polymyxin, bacitracin, and hydrocortisone) | Bausch and Lomb, Tampa, FL | NDC 24208-785-55 | Applied after removal of nictating membrane, protocol 2.8, and for postprocedural care, protocol 6.1.2 |
| ultrasound gel | Parker Laboratories, Inc., Fairfield, NJ | Aquasonic 100 | To ensure electrical contact with monopolar cautery plate, protocol 4.5 |
| xylazine | Henry Schein Animal Health, Dublin, OH | NADA: 139-236 | 1 mg/kg, protocol 4.7 |
Referenzen
- Gillan, W. D. H. Tear biochemistry: A review. South African Optometrist. 69 (2), 100-106 (2010).
- Conrady, C. D., Joos, Z. P., Patel, B. C. Review: The Lacrimal Gland and Its Role in Dry Eye. Journal of Ophthalmology. 2016, 7542929 (2016).
- Schechter, J. E., Warren, D. W., Mircheff, A. K. A lacrimal gland is a lacrimal gland, but rodents' and rabbits' are not human. Ocular Surface. 8 (3), 111-134 (2010).
- Shinomiya, K., Ueta, M., Kinoshita, S. A new dry eye mouse model produced by exorbital and intraorbital lacrimal gland excision. Scientific Reports. 8 (1), 1483 (2018).
- Bhattacharya, D., et al. Tear Production After Bilateral Main Lacrimal Gland Resection in Rabbits. Investigative Ophthalmology and Visual Science. 56 (13), 7774-7783 (2015).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Li, N., et al. Establishment of the mild, moderate and severe dry eye models using three methods in rabbits. BioMed Central Ophthalmology. 13, 50 (2013).
- Honkanen, R., et al. A New Rabbit Model of Chronic Dry Eye Disease Induced by Complete Surgical Dacryoadenectomy. Current Eye Research. , 1-10 (2019).
- Nisha, S., Deepak, K. An Insight Into Ophthalmic Drug Delivery System. International Journal of Pharmaceutical Studies and Research. 3 (2), 9-13 (2012).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, (1929).
- Popesko, P., Rajitova, V., Horak, J. Rabbit - Guinea Pig. A Colour Atlas of the Anatomy of Small Laboratory Animals. 1, (1992).
- Honkanen, R. A., Huang, L., Rigas, B. A rabbit model of aqueous-deficient dry eye disease induced by concanavalin A injection into the lacrimal glands: Application to drug efficacy studies. Journal of Visualized Experiments. , e59631 (2019).
- Wei, Y., Asbell, P. A. The core mechanism of dry eye disease is inflammation. Eye & Contact Lens. 40 (4), 248-256 (2014).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology and Visual Science. 28 (2), 225-228 (1987).
- Odaka, A., et al. Efficacy of retinol palmitate eye drops for dry eye in rabbits with lacrimal gland resection. Clinical Ophthalmology. 6, 1585-1593 (2012).
- Toshida, H., Nguyen, D. H., Beuerman, R. W., Murakami, A. Evaluation of novel dry eye model: preganglionic parasympathetic denervation in rabbit. Investigative Ophthalmology and Visual Science. 48 (10), 4468-4475 (2007).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology and Visual Science. 49 (5), 1850-1856 (2008).
- Shiue, M. H., et al. Pharmacological modulation of fluid secretion in the pigmented rabbit conjunctiva. Life Science. 66 (7), 105 (2000).
- Li, Y., et al. Rabbit conjunctival epithelium transports fluid, and P2Y2(2) receptor agonists stimulate Cl(-) and fluid secretion. American Journal of Physiology: Cell Physiology. 281 (2), C595-C602 (2001).
- Dartt, D. A. Regulation of mucin and fluid secretion by conjunctival epithelial cells. Progress in Retinal and Eye Research. 21 (6), 555-576 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten