Method Article
토끼의 완전한 다크레오아데네절제술을 이용한 중증 안구건조증 모델 구축
요약
토끼에 있는 만성 안구 건조병을 외과로 모든 궤도 해구땀샘을 제거하여 유도하기 위하여 새로운 접근이 제시됩니다. 이전에 보고된 것과 는 구별되는 이 방법은 눈물 생리학 및 병리생리학 및 안구 치료제를 연구하는 데 적합한 수성 결핍 안구 건조증의 안정적이고 재현 가능한 모델을 생성합니다.
초록
안구 건조증(DED)은 안구 표면 염증을 주요 병리학 단계로 두는 다발성 병인과 가변 증상을 갖는 복잡한 질환입니다. DED에 대한 이해가 발전했음에도 불구하고 상당한 지식 격차가 남아 있습니다. 유익한 동물 모델의 부족으로 인해 발전은 부분적으로 제한됩니다. 저자는 최근 렉틴 concanavalin A와 모든 궤도 해경 동맥 (LG) 조직을 주입하여 유도 DED의 방법에 보고했다. 여기에서, 우리는 모든 궤도 LG (dacryoadenectomy) 조직의 외과 절제술에 기초하여 수성 결핍 DED의 새로운 모델을보고합니다. 두 방법 모두 안구 표면의 크기와 구조면에서 인간의 눈과 유사하기 때문에 토끼를 사용합니다. 틈새 막의 제거 후 1 주일, 궤도 우수한 LG는 마취하에 외과적으로 제거된 후, palpebral 우수한 LG의 제거에 선행되고, 마지막으로 열등한 LG. Dacryoadenectomy의 제거는 가혹한 DED를 유도했습니다, 에 의해 입증되었습니다 눈물 이별 시간 테스트와 Schirmer의 눈물 테스트에 현저한 감소, 크게 눈물 삼투압을 증가하고 상승 벵골 염색. Dacryoadenectomy 유도 DED는 적어도 8 주 지속되었습니다. 합병증이 없었고 동물들은 수술을 잘 용인했습니다. 이 기술은 적절한 수술 경험과 관련 토끼 해부학의 감사를 가진 사람들에 의해 상대적으로 쉽게 마스터 할 수 있습니다. 이 모델은 인간의 수성 결핍 DED의 특징을 되풀이하기 때문에 안구 표면 항상성, DED 및 후보 치료제의 연구에 적합합니다.
서문
눈물은 안구 표면의 보호와 각막의 광학적 특성유지를 위해 필요합니다. 그들은 세 층으로 구성: 내부 뮤신 코팅, 중간 수성 구성 요소, 그리고 지질 오버레이1. 뮤신층은 주로 결막의 잔세포에서 생산되며, 수성 성분은 주로 폐동맥(LGs)에서, 및 지질층은 주로 메이보미안 땀샘1,2에서생산된다. 궤도 LGs는 눈물의 수성 성분과 세균 공격으로부터 표면을 보호하는 많은 단백질의 주요공급원입니다 3. 안구 표면 질환은 수성 눈물 생산이 임계 수준 이하로 감소할 때 이어지며, 수성 성분의 눈상 표면과 성장 인자, 리소자임 및 락토페린을 포함한 중요한 눈물 성분을 박탈합니다. LGs에 의해 감소 된 눈물 생산의 경우, 결막 과 각막 조직은 변경 된 환경을 보상하기 위해 적응을 받아야.
이것이 결여될 때 궤도 LGs및 안구 표면의 보상 기계장치에서 파생된 눈물 성분의 기여를 이해하는 것은 눈의 전방 세그먼트의 생리학 그리고 병리생리학의 우리의 감사에 영향을 미치고, 더 넓게는, 전 세계에 있는 건강과 질병의. 이러한 문제에 대한 실험적 접근법은 유익한 동물 모델이 필요합니다. 따라서, 몇몇 단은 궤도 LGs가 제거되는 동물 모형을 개발하는 것을 시도했습니다, 그로 인하여 안구 건강에 있는 눈물의 역할의 평가를 촉진하. 이러한 모델 중 하나는 최근에 마우스4에대해 보고되었습니다. 토끼는, 그러나, LG의 유사한 해부학 및 조직학 구조를 포함하는 설치류 모형에 비해 많은 명백한 이점을, 그리고 아마도 더 중요한 것은, 그들의 인간 대응에 비교될 때 각막 및 결막 조직의 유사한 크기 및 표면적이3.
토끼에서 LG 조직의 외과 절제술에 의한 수성 결핍 안구 건조 증 (DED)의 생성은 새로운 것이 아닙니다. 수많은 보고서는 Schirmer의눈물 테스트5,6,7,8에의해 측정 눈물 생산의 가변 변화에 반영 다양한 성공을 가진 LG 조직의 절제술을 설명합니다. 토끼의 관련 해부학의 철저한 이해와 해부학 용어에 대한 명확성은이 방법을 재현하는 데 매우 도움이됩니다. 이 두 가지에 대한 철저한 개요는 아래에 제공됩니다.
배분 해부학
토끼는 두 개의 궤도 LG를 가지고 : 더 큰 열등 LG (ILG)와 작은 우수한 LG (SLG; 그림 1). ILG는 궤도 림의 열등하고 후방 측면을 따라 확장됩니다. 가변 크기를 제외하고, ILG의 전방 부분은 상당히 균일한 구근 외관을 가지며, 이는 지구아래의 피부에서 protuberance로 볼 수있다(그림 2). 선의 나머지 부분과 관련하여 특징적인 외관 때문에 ILG의 "머리"라고합니다. 머리의 일부가 감싸고 zygomatic 뼈의 외부 표면에 놓여 있습니다. 이것은 ILG로 주사를 인도하는 초음파 생체 현미경 검사법에 유용한 랜드마크역할을 합니다. 머리의 나머지 는 궤도에 더 내측 9상주체.
길고 얇은 ILG의 나머지 부분의 특성 모양으로 인해이 세그먼트를 "꼬리"라고합니다. 꼬리는 열등한 궤도 림을 따라, ILG의 머리에서 궤도 림까지, 열등한 궤도 림과 후방 궤도 림에서 가변 해부학으로 종결됩니다(그림3A). 꼬리는 궤도의 후방 가장자리에 도달할 때까지 대부분의 코스에 대한 근막 밴드에 의해 궤도 내용물에서 분리된 zygomatic 골격에 깊은(내측) 자리잡고 있으며, 이 골격은 다시 한 번 zygomatic 골격의 외부 표면 위로 확장됩니다. ILG는 경동맥의 가지로부터 혈액 공급을 받습니다.
SLG에는 인간과 유사한 두 가지 구성 요소가 있습니다. 하나는 타살 플레이트의 상부 후방 눈꺼풀 내측에 상주하는 palpebral 우수한 LG (PSLG)입니다. 그것은 자연에서 구근 나타나고 2% 불광으로 덮일 때 더 쉽게 볼 수 있는 수성 눈물 액체를 배수하는 수많은 반점 구멍이 있습니다(그림 3B).
두 번째는 우수한 궤도에서 내측 위치에 거주하는 궤도 우수 LG(OSLG)입니다(그림3C). 두개골의 중간선 근처의 위치로 인해 시간적 또는 열등한 궤도에서 외부 외과 적 접근법을 사용하여 성공적으로 식별하는 것은 불가능했습니다. 신선한 부검 샘플 또는 수술 사례에서, 이 동맥은 부드러운 내측 압력이 지구상에 가해질 때 두개골의 등쪽 표면에 위치한 후방 자위를 통해 탈출 될 수 있습니다. 이 선 조직의 탈출은 초음파 생체 현미경검사법으로 문서화 될 수 있습니다.
PSLG와 OSLG는 연속된 구조입니다. OSLG는 덕트 건축이 주요 배설 덕트에 결합된 튜울로알베올라 구조입니다. 이 덕트는 초궤도 능선 아래를 통과하고 PSLG에서 종단하는 상부 뚜껑 조직에서 실행됩니다. 배설 덕트를 따라, 데이비스의 본래 설명과 일치하는 선 조직은10(도 3D)으로확인되었다.
용어에 대한 참고 사항
우수하고 포괄적 인 해부학 설명뿐만 아니라 다양한 용어를 사용합니다. 데이비스에 의해 고전적인 궤도 해부학은 상부 및 하부 LG10을정의합니다. 그러나, 상부 LG에 대한 그의 설명은 명확하게 더 구체적으로 PSLG와 OSLG로 여기에 정의 된 부분을 자세히 설명, 낮은 LG에 대한 그의 설명은 ILG의 머리와 꼬리로 여기에 정의 된 부분을 자세히 설명하면서. 보다 최근의 철저한 해부학 적 아틀라스(11)는 zygomatic 동맥과 액세서리 LG로 이러한 조직을 정의합니다. 용어 "상구선"은 전술한 PSLG 및 OSLG를 포함하기 위해 여기에서 사용된다. 이 용어는 과도한 혼동없이이 방법을 재현하는 데 더 적합합니다.
프로토콜
모든 척추동물 연구는 모든 관련 규제 및 기관 지침을 준수하고 준수하여 완료되었습니다. 모든 연구는 스토니 브룩 대학의 기관 검토 위원회에 의해 승인되었고 안과 및 시력 연구에서 동물의 사용에 대한 비전 및 안과 연구 협회 (ARVO) 성명서에 따라 수행되었습니다.
1. 동물 및 주택
- 무게가 2-3kg인 뉴질랜드 화이트(NZW) 토끼를 사용하십시오.
- 집 토끼는 엄격하게 통제 된 환경에서 개별적으로 : 온도 (65 ± 5 ° F), 습도 (45 ± 5 %), 조명 (12 시간 온 / 오프 사이클).
참고: 그룹 하우스에 있는 토끼 사이에 종종 나타나는 공격적인 행동으로 인해 의도하지 않은 안구 손상을 방지하기 위해 동물을 개별 케이지에 보관하십시오. - 표준 토끼 차우와 물에 토끼 무제한 액세스를 제공합니다.
- 안구 건조에 영향을 미칠 수 있는 부주의한 비타민 A 보충제를 방지하기 위해 다른 식이 농축물을 제공하지 마십시오.
- DED 매개 변수를 기록하기 전에 적어도 2 주 동안 토끼를 적응시킴.
2. 틈새 막의 제거
참고: 단순화를 위해 오른쪽 눈의 기법이 아래에 설명되어 있습니다. 왼쪽 눈의 이 절차를 동일한 방식으로 완료하십시오.
- 적응 기간 (일반적으로 첫 주) 동안 틈새 멤브레인을 양측으로 제거하십시오.
- 적절한 크기의 제지 백에 토끼를 넣습니다.
- 토끼를 진정시키기 위해 1 cc 주사기와 26 G 바늘을 사용하여 어깨에 아세프로마진 (1 mg /kg)의 피하 주사를 투여하십시오. 이 온화한 진정제의 종점은 동물이 정상적인 스캐닝 움직임없이 편안한 머리 위치를 유지하고 귀가 더 이상 완전히 똑바로 서 있지 않는 경우입니다.
- 마이크로파이펫을 사용하여 방부제 프리 리도카인 25 μL(1%)를 바르고 있습니다. 눈에. 눈꺼풀 사이에 와이어 뚜껑 스페큘럼을 삽입합니다.
- 0.3 포셉 (또는 동등한)으로 정점에 있는 틈새 멤브레인을 잡고 각막 표면 위로 당깁니다. 1% 리도카인을 1:100,000 에피네프린으로 26G 바늘을 사용하여 틈새 멤브레인의 결막 의 결막 내공간에 주입하십시오. 약 0.3 mL를 주입하여 틈새 멤브레인 위에 적당한 크기의 bleb를 형성하십시오. 1 mL 이상의 주사 량은 토끼 (2-4 mg /kg)에 대한 안전한 용량 범위 내에 있습니다.
- 와이어 스페큘럼을 제거합니다. 리도카인과 에피네프린이 효력을 발휘할 때까지 약 5분 정도 기다립니다. 이 시간 동안 동료 눈에서 동일한 절차를 수행하십시오.
- 와이어 뚜껑 스펙큘럼을 교체합니다. 0.3 집게를 사용하여 각막 표면 을 통해 틈새 멤브레인을 잡고 확장합니다. 테노토미 가위 또는 이에 상응하는 막으로 멤브레인을 잘라냅니다.
참고: 출혈은 보통 최소화되지만, 고온 배터리 소작 유닛을 근처에 두고 필요에 따라 출혈을 최소화하십시오. 틈새 막의 절단 베이스에 대한 직접 압력은 발생하는 경우 작은 출혈을 중지하는 데 사용할 수 있습니다. - 와이어 뚜껑 을 제거합니다. 국소 항생제 연고 (네오마이신, 폴리마이신, 바시트라신 및 하이드로 코르티손)를 각막 표면에 놓습니다.
- 프로토콜에 의해 표시된 대로 동료 눈과 동일한 절차를 수행합니다.
- 동물을 개별 케이지에 다시 놓고 적어도 1 주일 동안 또는 결막 표면이 임상 적 관점에서 완전히 치유 될 때까지 추가 실험이나 개입을 수행하기 전에 치유 할 수 있습니다.
참고 : 완전한 임상 치유는 결막 표면에서 붓기, 주사 또는 배출이 결여되어 있는 것으로 나타났습니다. 동물은 보호 성 피조물의 존재없이, 정상적으로 눈을 열어 두어야한다.
3. 안구 건조 매개 변수 측정 및 눈물 샘플 수집
- 다음 DED 매개 변수를 실험 프로토콜에 적합하게 측정합니다: 눈물 삼투압, 눈물 분열 시간, Schirmer의 눈물 테스트 및 장미 벵골 염색. 앞에서 설명한대로 수행 12, 적어도 두 명의 조사자로 구성된 팀과 함께 수행합니다.
참고: 적어도 2명의 조사자의 팀은 동물의 더 큰 단의 능률적인 측정을 허용합니다 (6 이상) 같은 시계 시간 의 주위에 그 것에서 가능한 circadian 변이 결과에 영향을 미치는 것을 방지하.
4. 외과 준비 및 마취
- 위와 같이 피하 아세프로마진 (1 mg/kg)과 함께 절제 가방에 넣은 동물을 가볍게 진정시금으로 보관하십시오.
- 외과 랜드 마크를 시각화하기 위해 두개골의 얼굴과 등도 표면에있는 모든 모피를 제거합니다.
- 길이 약 1mm(그림 4A, 왼쪽)에 잔류 미세 모피를 떠나 절단 가위와 모피를 손질.
- 제조업체의 지침에 따라 순한 제모 크림을 사용하여 모든 잔류 모피를 제거하십시오(그림 4A, 오른쪽).
- 수술 용 펜으로 수술 절개 부위를 표시하십시오.
- OSLG의 탈출에서 후방 을 통해 피부에서 개발하는 작은 부푼 것을 일으키는 원인이 되는 세계에 내측 압력을 가하여 후방 incisure를 통해 절개 부위를 확인하십시오.
- 수술 마킹 펜으로 두개골의 등쪽 표면 위에 피부의 전방 / 후방 방향으로 선형 2cm 마크를 직접 확인하십시오.
- ILG의 제거를 위한 절개를 계획할 때, 후방(측두력) 궤도에서 전방(내측) 캔트까지 연장되는 눈 주위의 길고 곡선선(열등하고 측두엽 뚜껑 마진에서 1cm)을 표시한다. 마킹이 후방 궤도를 따라 내측 캔의 레벨로 확장되도록 하거나 이보다 더 우수하게만듭니다(그림 4B). 일부 해부에서는 OSLG와 ILG를 제거하는 절개가 연결됩니다.
참고: 양측 수술을 할 때, 이 때 두 궤도를 모두 표시하십시오.
- 모피 의 패치를 트림 2 받는 이3 cm 폭 각 허벅지의 측면 표면에 가위 와 단극 소작 접시의 배치를 허용.
- 단극 소작 판과 좋은 전기 접촉을 보장하기 위해 초음파 젤을 적용합니다.
- 필요한 경우 약물이나 체액을 관리하기 위해 귀의 한계 정맥 중 하나에 25 G 정맥 (IV) 카테터를 놓습니다.
- 마취의 초기 유도를 위해 피하 자일라진 (1 mg /kg)과 IV 케타민 (15 mg / kg)을 제공합니다 (IV 액세스를 통해).
참고: 토끼가 2.3단계에서 설명한 종점을 유지하기에 충분한 아세프로마진으로 미리 진정되는 경우, 이소플루란과 함께 방독면을 사용하십시오. - 기도를 고정하고 유지하기 위해 탄성 밴드 또는 끈을 사용하여 제자리에 개최 후두 마스크 기도를 배치합니다.
- 1 L / min로 설정 된 산소 흐름으로 마취 기계에 마스크를 연결하십시오.
- 처음에는 이소플루란을 5%로 설정한 다음 동물 진정 의 수준에 따라 허용되는 것으로 줄입니다.
- 최종 상처가 닫일 때까지 2% 이상이면 이소플루란을 유지하십시오.
참고: 외과적 또는 고통스러운 자극에 반응하여 호흡률과 움직임을 모니터링하여 감미의 수준을 평가합니다. 호흡률이 분당 10 호흡 이상 증가하거나, 토끼가 기도 유지 제에서 츄를 하기 시작하면, 또는 고통스러운 자극에 반응하여 어떤 움직임이 관찰되면 마취의 깊이를 증가시킵니다.
- 다중 파라미터 모니터링 장치 또는 기타 적절한 장치를 사용하여 맥박 산소 측정, 카포그래피, 혈압, 직장 체온 및 심박수를 모니터링합니다.
- 시술 중에 바이탈을 지속적으로 모니터링하고 10-15분마다 기록하십시오.
- 저체온증을 방지하기 위해 가열 패드 위에 수술실 (OR) 테이블에 토끼를 놓습니다. 출혈을 최소화하기 위해 테이블을 역방향 Trendelenburg 위치로 약 30°로 기울입니다.
- 멸균 장을 유지하기 위해 멸균 수와 드레이프반 강도로 희석 된 포비도 요오드 용액으로 수술 부위를 준비하십시오.
5. 완전한 외과 dacryoadenectomy
참고: 본명 설명된 바와 같이 완전한 외과 적 대명사 절제술은 0.3 조직 집게, 적절제술 가위, 비톱 조직 집게 및 가위를 사용하여 수행되었습니다. 이 기기는 외과 의사의 선호도에 따라 동일한 기능을 수행하는 유사한 기기와 교환 할 수 있습니다.
- 먼저 OSLG를 제거합니다.
- 절개 부위(외과마킹 펜 라인 및 상부 후방 뚜껑)를 1:100,000 에피네프린과 0.5% 부피바카인을 30 G 바늘로 5cc 주사기를 사용하여 2% 리도카인의 50:50 혼합물로침투(그림 5A).
참고: 주사기와 바늘 크기는 중요하지 않습니다. - 외과 용 장치에 연결된 콜로라도 바늘을 사용하여 수술 표시를 따라 피부 절개를 합니다. 설정은 임상 반응에 따라 달라질 수 있으며 전형적으로 절단 및 응고 모두에 대해 10 내지 15 단위 사이이다(도5B).
- 조직을 분리하고 근본적인 전두엽 근육 섬유를 노출하기 위해 피부 절개에 걸쳐 반대 장력을 적용합니다.
- OSLG의 시각화를 돕기 위해 세계에 내측 압력을 적용, 단지 내측 또는 전방 근육 섬유에 깊은 위치한 불룩한 조직으로 볼. 필요한 경우, 기본 incisure를 노출 하기 위해 측면에 이러한 근육 섬유를 이동.
- 톱니 집게 (0.3) 및 capsulotomy 가위로, 부드럽게 후퇴하고 OSLG 위에 섬유 캡슐을 잘라. OSLG는 일반적으로 옅은 황갈색을 가합니다(그림5C).
- 톱니 또는 톱니가 없는 집게를 사용하여 OSLG 글랜드 조직을 잡고 "핸드 오버 핸드" 기술을 사용하여 우수한 소구를 통해 부드럽게 꺼냅니다. 작은 잘라, capsulotomy 가위를 사용하여 섬유 밴드는 궤도에서 그 위치에서 동맥을 해제(그림 5D).
참고 : OSLG 선 조직이 제거되면 큰 튜브 와 같은 구조 (주요 배설 덕트)로 합쳐지기 시작합니다. - 선이 가능한 한 완전히 제거되면 콜로라도 바늘로 넉넉한 소작을 사용하여 조직 char를 만들고 가능한 한 깊이 인자 내에서 동맥을 잘립니다. 이것은 나중에 PSLG를 제거하는 동안 확인 랜드 마크 역할을합니다.
- 절개 부위(외과마킹 펜 라인 및 상부 후방 뚜껑)를 1:100,000 에피네프린과 0.5% 부피바카인을 30 G 바늘로 5cc 주사기를 사용하여 2% 리도카인의 50:50 혼합물로침투(그림 5A).
- PSLG를 제거합니다.
- 면 팁 어플리케이터를 사용하여 위 눈꺼풀을 에버트. PSLG의 구근 끝은 일반적으로 쉽게 볼 수 있습니다.
참고: 일부 해부학적 해부에서는 주 배설 덕트를 약 1 또는 2mm 너비의 창백한 선형 구조로 시각화할 수 있습니다. - 톱니 집게 (0.3)와 PSLG를 결합하고 기본 타르수에서 분리하는 그것의 기지 주위를 절단하는 capsulotomy 가위를 사용하는 동안 눈꺼풀 표면에서 철회(그림 6A).
- 단극 소작으로 적당한 출혈을 제어하십시오.
- 해부를위한 조직 평면을 유지하기 위해 분리 된 조직에 지속적인 견인을 적용하십시오. 이렇게 하면 SLG의 주 배설 덕트도 제거될 수있습니다(그림 6B).
참고 : 해부가 수행됨에 따라, 일반적으로 우수한 궤도 림으로 진행되어 보다 우수하고 중간 위치한 OSLG의 제거에서 남겨진 소작 을 볼 수 있습니다.
- 면 팁 어플리케이터를 사용하여 위 눈꺼풀을 에버트. PSLG의 구근 끝은 일반적으로 쉽게 볼 수 있습니다.
- ILG를 절제하십시오.
- 국소 마취가 효력을 발휘할 수 있도록 적어도 5 분 정도 두십시오.
- 피부, 열등한 palpebra의 우울근육, zygomatic 근육의 zygomaticolabial 부분, 및 콜로라도 미세 분해 바늘로 orbicularis 근육을 절개하고 섹션 5.1의 OSLG에 관해서는 분리.
- 단극 소작으로 지혈을 유지하십시오.
- 절개가 피부 표시를 통해 더 깊게 운반될 때, 매세 근육의 zygomatic 뼈 또는 피상적인 부분에 매혹적인 면의 광택을 찾아보십시오. 이 시점에서, 조직 평면을 유지하고 절단을 위한 콜로라도 바늘을 사용하여 궤도 림쪽으로 우월하게 운반한다(도7A).
참고 : ILG를 식별하기 위해, 일반적으로 눈의 전방 사지열등 ILG의 머리에 해부의이 부분을 수행하는 것이 가장 쉽습니다. - ILG를 둘러싼 캡슐을 식별하고 절개한 후, ILG의 황갈색 조직을 확인한다. ILG 헤드의 전방 부분만 표시됩니다(그림7B). 그러나, 머리는 zygomatic 아치 아래 를 통과하고 꼬리로 전환으로 내측으로 따를 수있다(그림 7C).
- ILG 꼬리의 더 후방 부분을 노출 열등 한 림을 따라 궤도 중격을 잘라 tenotomy 가위를 사용합니다. 조직 평면이 확인되면, 전체 절개 라인을 따라 후부 후방을 확장합니다(그림 7D).
참고 : ILG의 덕트는 뚜껑의 측두면에서 열등한 결막 공간을 입력하기 위해 하부 섬유 결합 조직을 통과합니다. 후방 테두리에서, ILG의 꼬리는 다양한 해부학 적 구성을 가질 수있다. 때때로 그것은 후방 (측면) 캔따라서 열등 종료, 다른 해부에서 그것은 시간 궤도 주위에 더 우월하게 확장하는 동안. - ILG가 경동맥의 가지에서 받는 혈액 공급에 의도하지 않은 손상을 방지하기 위해 극도의 주의를 기울이면 됩니다. 혈액 공급은 해부의 이 부분 도중 볼 수 있습니다(그림 7E).
- 꼬리가 후방 (측면) 캔에서 종료되는 경우, zygomatic 뼈를 따라 놓여있는 ILG의 꼬리를 노출하기 위해 전방 근육의 측두엽 부분을 이분화해야 할 수도 있습니다.
- 전체 ILG가 분리되고 노출된 후에는 제거합니다. 큰 크기 로 인해 가위로 땀샘을 반으로 자르고 머리를 꼬리에서 따로 제거하는 것이 바람직합니다.
- ILG의 머리를 제거 할 때 매우 신중하게 진행하여 궤도에있는 큰 정맥 부비동에 바로 인접해 있습니다. 외과 절제술 도중 이 구조물에서 출혈이 일어나지 않았더라도, 이 리스크를 완화하기 위하여 충분한 지혈보조장치가 있습니다.
- 모든 선 조직을 제거 한 후, 여러 중단 된 5-0 에틸렌 테레프탈레이트 봉합사를 사용하여 깊은 결합 조직 평면을 닫습니다. 0.3 조직 집게와 바늘 드라이버를 사용하여 6-0 폴리글락틴 910 봉합사(도 7F)를실행하여 표면 근육과 피부를 닫습니다.
6. 사후 경도 치료
- 동물을 언레이프하고 멸균 수로 수술 부위를 정화하십시오.
- 국소 안과 항생제와 스테로이드 연고 (네오마이신, 폴리믹신, 바시트라신 및 하이드로 코르티손)를 절개부위에 바르고 있습니다. 2 일 동안 하루에 두 번이 응용 프로그램을 계속합니다.
- 26G 바늘을 사용하여 견갑골 위에 20 mL 일반 식염수의 피하 주입을 제공합니다.
- 피하 부프레노르핀 0.01 mg/kg 또는 케토프로펜 3 mg/kg을 1 cc 주사기와 30G 바늘을 사용하여 통증 조절을 하십시오.
참고: 동물은 1-2일 이내에 정상적인 식이 섭취와 활동으로 돌아가야 합니다. 토끼는 절개 부위에 걸쳐 진보적 인 붓기, 통증, 홍반, 칼로리 또는 화농성 분비물에서 입증 된 감염의 임상 징후를 위해 적어도 매주 평가되어야합니다. 동물은 또한 절개 부위 / 봉합사 라인을 긁히기 시작하지 않도록 관찰해야합니다. dacryoadenectomy 이전에 모든 발톱을 손질하는 것은이 점에서 도움이 될 수 있습니다. 절개 라인을 긁는 것이 관찰되면 표준 보호 칼라를 사용하여 자가 손상을 방지 할 수 있습니다. - 마취를 반전.
- 동물이 자극에 반응하고 자발적인 츄잉을 보이기 시작한 후 기도 유지보수를 제거하지만 기도 유지제가 손상되기 전에 제거합니다.
- 동물을 약 1-2시간 동안 또는 케이지에서 자발적인 움직임으로 입증된 마취에서 완전히 회복될 때까지 모니터링합니다.
- 동물의 통증을 평가하고 적절히 치료하십시오.
- 동물이 DED의 임상 조치를 하기 전에 수술 후 적어도 1 주 동안 회복할 수 있도록 하십시오.
결과
여기에 기술된 완전한 다크라오아데네토미 법은 8마리의 동물에 대해 수행되었다. 그것은 수술 기술의 적당한 정도를 요구합니다. 수술 시간은 양측 수술에 대해 평균 2.2 시간, 틈새 멤브레인의 제거를 제외하고, 이는 별도로 수행하고 필요 <10 분. 사망자 나 수술 중 합병증이 없었으며 토끼는 겸손한 소작 이외의 지혈 보조를 필요로하지 않았습니다.
우리의 외과 적 접근 방식은 모든 눈의 안구 건조를 성공적으로 유도했습니다. 이는 DED의 임상 및 실험실 마커패널에 의해확인되었다(표 1). 관찰의 8 주 동안, 평균 TBUT는 수술 전 수준의 75 % 이상 (p < 모든 시간 포인트에 대한 0.0001)에 의해 억제되었다. 유사하, Schirmer의 눈물 테스트에 의해 감소 50%, 관찰의 8 주 동안 그렇게 남아; 그것은 후속 기간 동안 회복에 대한 추세를 보여주지 않았다. 수술 후, 눈물 삼투압은 DED와 일치하는 10 % 증가를 보였으며, 수술 후 적어도 8 주 동안 지속되었습니다. 각막의 장미 벵골 염색도 증가하고 후속의 8 주 동안 회복의 흔적을 보여주지 않았다(그림 8). 완전한 dacryoadenectomy를 겪고 있는 모든 눈은 안구 건조와 일치하는 잔 세포 수 및 상피 변화에 있는 현저한 감소를 보여주었습니다 (결막 인상 세포학).

그림 1: 토끼 상형 동맥 해부학 (오른쪽 눈). 궤도 우수한 상구선 (OSLG)는 더 큰 궤도 부분 및 더 작은 palpebral 분대로 이루어져 있습니다. 더 큰 열등한 상구선 (ILG)는 전방/머리 및 후방/꼬리 부분으로 구성됩니다. 좌표축은 텍스트 내에서 사용되는 모든 방향 설명에 사용되는 용어를 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
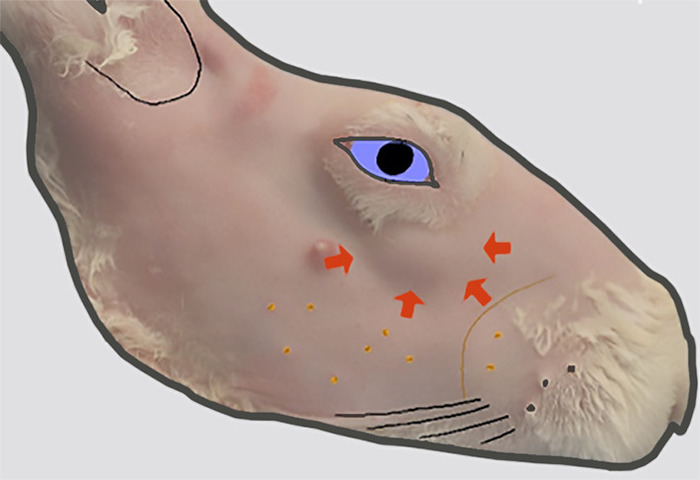
그림 2: ILG 의 머리 위치입니다. 털을 제거한 후 오른쪽 얼굴의 측면 도면입니다. 피부 윤곽선(두꺼운 화살표로 표시)의 부푼 부분(두꺼운 화살표로 표시)은 이 위치에서 zygomatic 골격의 외부 표면에 있는 ILG의 머리 위치를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
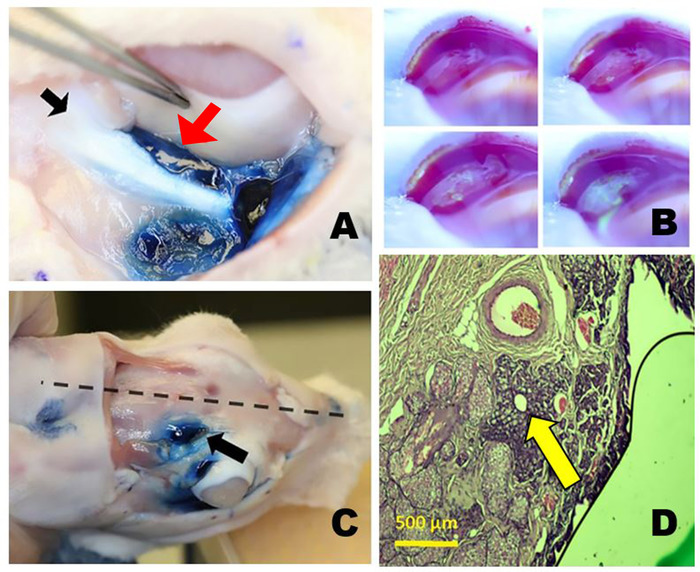
그림 3: 궤도 상하 땀샘. (A)오른쪽 열등한 물상 동맥 (ILG) 에반스 블루 염료로 염색 한 후 ILG (빨간 화살표)의 꼬리의 근접성을 보여주는 단지 zygomatic 뼈 (검은 색 화살표)에 내측하고 지구보다 열등하다. (B)팔피브랄 우수 눈물샘(PSLG)으로부터의 눈물 생산. 2 % 플루오레세인의 국소 적용 후 찍은 시간 경과 사진. PSLG에서 방출되는 수액은 초기에 진한 청색 또는 검은색 플루오레세인 염료를 희석하여 밝은 노란색으로 변합니다(세이델 테스트와 유사). (C)토끼 두개골의 궤도 SLG (OSLG)의 위치, 후방 incisure (화살표) 내에서 두개골의 중간 선 (점선)에 가까운 거짓말. 에반스 블루 염료는 OSLG 및 palpebral 우수한 물상 동맥에 주입되었다. (D)OSLG의 주요 배설 덕트를 통해 소량의 선 조직(arrow)으로 둘러싸인 조직병리학적 단면에서 헤마톡실린 및 에오신 염료로 염색된 이 조직병리학적 단면에서 우측 눈꺼풀의 후방(temporal) 양상을 통해 채취된 것으로 볼 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
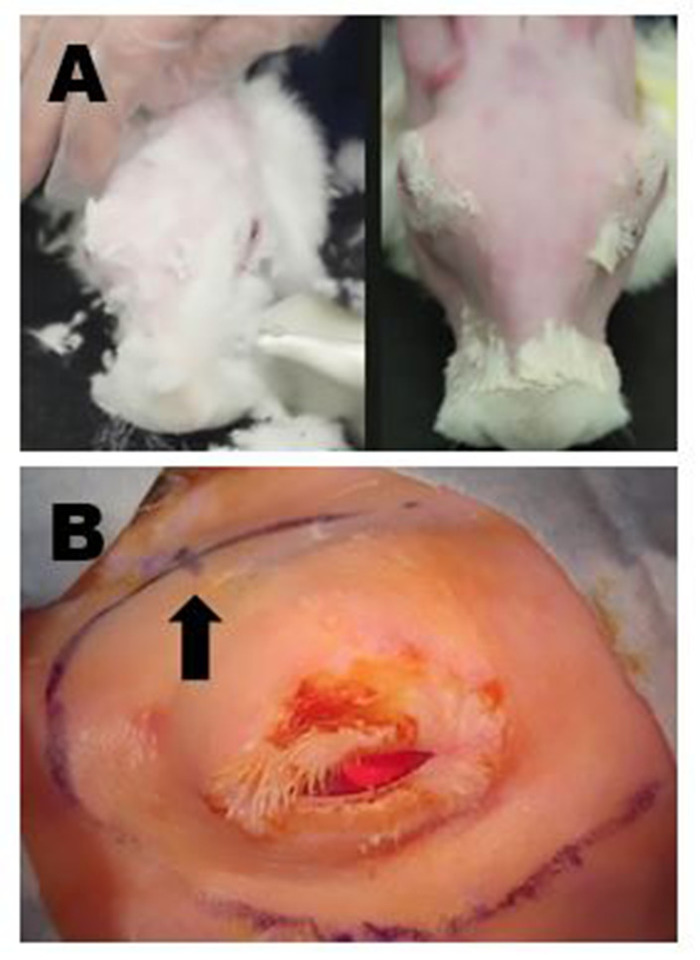
그림 4: 수술 부위 준비. (A)왼쪽 위 패널: 가위가 있는 긴 털 제거. 모든 잔류 미세 모피는 이후에 온화한 제모 크림으로 제거됩니다. 오른쪽 위 패널: 수술 마킹 및 ILG의 고품질 초음파를 수행 할 수있는 완전한 모피 제거 후 최종 외관. (b)우측 경피영역의 적절한 외과적 표시가 도시되어; 이 예에서 OSLG 및 ILG를 제거하는 절개는 하나의 긴 곡선 절개를 만들기 위해 연결되었습니다. 후방 절개의 위치는 곡선 절개 부위 마킹(화살표)에 작은 해시 표시로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
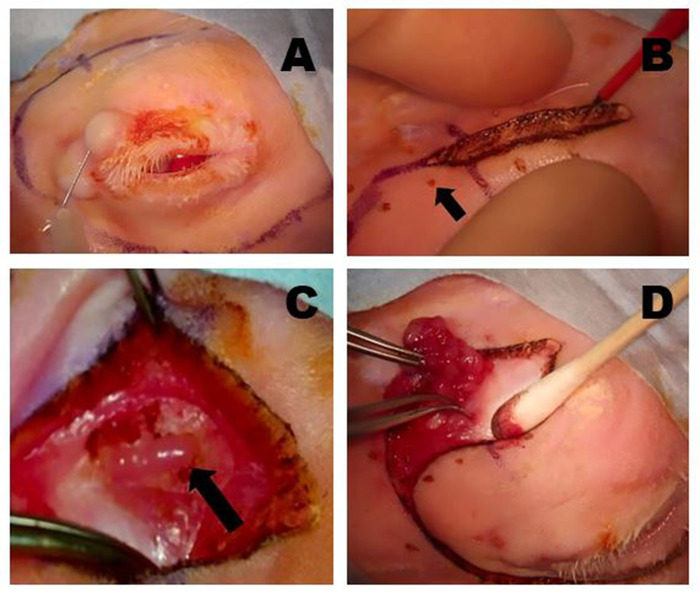
그림 5: OSLG 제거. (A)수술 부위는 1:100,000 에피네프린과 0.5 % 부피바카인과 2 % 리도카인의 50 :50 조합을 사용하여 마취제를 사용하여 삽입되며, 이는 수술 중 불편함을 최소화하기 위해 상부 뚜껑과 절개 라인을 따라 주입됩니다. (B)콜로라도 미세 해부 바늘은 미리 표시된 수술 절개 부위를 따라 피부 및 표면 근육 층을 절개하는 데 사용된다. 상처에 걸쳐 부드러운 견인은 해부를 만드는 데 도움이 적용된다. 작은 핀포인트 화상 (화살표)은 상처 폐쇄 동안 조직을 최적으로 재정렬 할 수 있도록 절개 선을 따라 등거리 지점에서 콜로라도 바늘로 만들어졌습니다. (C)OSLG는 후방 을 덮어 조직 이후에 노출된 후 후방 에 이니시(arrow)가 동원되었다. 땀샘의 캡슐이 절개되었습니다. OSLG는 제거를 용이하게 하는 전 세계에 내측 압력을 가하여 탈출할 수 있습니다. (D)집게는 OSLG를 교전하고 후방 을 통해 궤도 내의 깊은 위치에서 부드럽게 제거하는 데 사용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
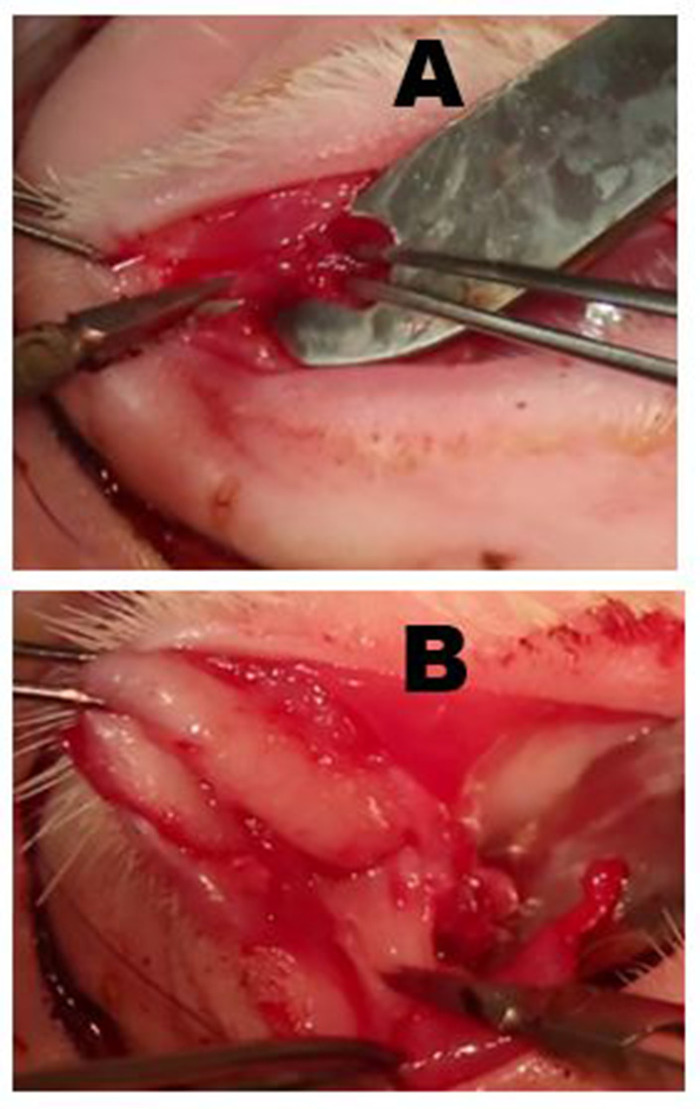
그림 6: palpebral 우수한 상구선 (PSLG) 및 배설 덕트의 제거. (A)위 눈꺼풀의 전조 후, PSLG의 구근 부분은 집게에 관여하고 가위를 사용하여 타르서를 해부한다. 집게가 있는 PSLG에 적용된 견인력은 수술 평면을 유지하는 데 매우 중요합니다. (B)PSLG및 주 눈물 덕트의 해부는 적절한 수술 평면을 유지하기 위해 선 및 덕트 조직에 날카로운 해부및 지속적인 견인을 사용하여 궤도 림쪽으로 우월하게 운반된다. 해부는 OSLG가 제거된 지점으로 진행되어야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
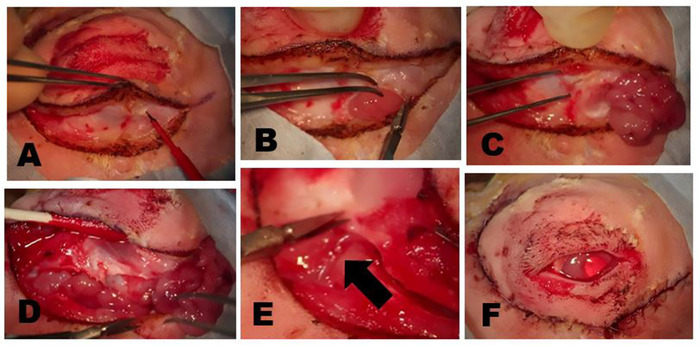
그림 7: ILG 제거. (A)피부와 피상적 근육은 매스터 근육의 zygomatic 뼈 또는 피상적 인 부분을 덮어 근막 평면까지 절개된다. ILG의 머리는 일반적으로 전방 사지 아래에 있는 작은 부푼 것으로 명확하게 알 수 있습니다. (B)ILG의 섬유질 캡슐은 ILG를 노출하는 가위로 절개된다. 캡슐이 절개되면, 땀샘의 깊은 부분을 쉽게 제거 할 수 있습니다. (C)zygomatic 뼈에 놓여있는 ILG 머리의 가장 외부 부분이 노출되고 근본적인 zygomatic 뼈를 보여주는 전방에 반사되었습니다. (D)열등한 림을 따라 궤도 중격의 절개는 ILG의 꼬리를 노출시다. (E)외부 경동맥의 가지가 ILG(화살표)의 꼬리를 공급한다. (F)완전한 다크레오아데네절제술 후 피부 절개 후 의외로 보이는 모습. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 각막 표면의 장미 벵골 염색. 눈에 띄는 염색을 보여주는 외부 사진, 비강 사분면에 가장 주목할만한. 완전한 dacryoadenectomy를 겪고 있는 모든 눈은 수술 후에 1 주에 의해 명백하게 되고 적어도 6 주 동안 지속되는 유사한 변경을 개발했습니다. 참고로, 링 플래시의 가벼운 반사는 건조한 안구 표면의 왜곡을 보여 주며 안구 건조가 시력에 악영향을 미칠 수 있는 방법을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 다크레오아데넥절제술 | ||
| 평균 ± SEM; n = 눈 16개 | ||
| 기준선 | 2주차 | |
| 눈물 이별 시간, s | 60.0 ± 0.0 | 4.5 ± 1.2 |
| p< 0.0001 | ||
| 눈물 삼투압, 모즘 | 291.2 ± 3.7 | 315.3 ± 5.5 |
| p = 0.001 | ||
| 쉬르머 눈물 테스트, mm | 18.3 ± 1.3 | 10.5 ± 1.6 |
| p = 0.0006 | ||
| 로즈 벵골, 수정 NEI 점수 | 0.0 ± 0.0 | 4.28 ± 0.6 |
| p< 0.0001 | ||
| 작동 vs. 기준선: Dacryoadenectomy: TBUT, p & 0.0001; 눈물 삼투압, p & 0.001; 쉬르머 눈물 테스트, p < 0.0006); 그리고 장미 벵골. | ||
표 1: 수술 후 2주차에 대한 안구 건조 파라미터.
토론
DED는 눈물 막 안정성에 미치는 영향에 따라 두 가지 주요 그룹으로 분류됩니다 : 수성 결핍 (눈물 막의 수성 성분의 생산 감소, ~ 20 %의 DED) 및 증발 (눈물 필름의 증발 증가, ~ 50 %의 DED). DED 환자의 대략 30%는 둘 다의 증거를 보여줍니다 (혼합 DED). 염증은 DED의 다양한 병인이 수렴되는 핵심 메커니즘인13,14. 우리의 방법은 수성 결핍 DED를 모델합니다.
앞서 언급했듯이, 우리의 방법을 재현하는 중요한 첫 번째 단계는 토끼의 궤도 배땀샘 (LGs)의 해부학의 미세 한 점에 대한 감사이며 다양하고 때로는 상충하는 해부학 용어에 의한 혼란을 피하는 것입니다. 교황 등의 해부학 아틀라스 외11매우 철저하다. 토끼의 해부학에 덜 익숙한 사람들을 위해, 부검 표본의 해부는 이러한 구조에 쉽게 친숙을 제공하고 살아있는 표본에서 자신의 수술 제거를 돕습니다.
동물 수용 및 적응에 대한 중요한 조언은 동반자 간행물12에주어졌습니다. 동일한 문서에서는 두 방법 모두에 사용되는 DED의 매개 변수를 검색하는 데 유용한 주석도 제공합니다.
이전 방법(12)과는달리,이 때문에 LGs를 제거하는 데 필요한 기술의 범위와 더 침략적 인 특성의 수술 기술의 높은 수준을 필요로한다. 이 절제술 도중 가장 큰 리스크는 경동맥의 가지와 같은 LGs에 가까운 주요 혈관을 상해에 기인한 치명적인 출혈입니다. 이것은 각 LG와 수술 분야 내에서 의 여백을 적절하게 시각화하여 피할 수 있습니다. 마지막으로, nicitating 막의 지나치게 제거는 눈물 필름 평가를 방해할 수 있는 Harderian 동맥의 탈출으로 이끌어 낼 수 있었습니다.
재현성을 향상시키고 DED의 심각성을 향상시키는 새로운 측면인 PSLG를 제거하여 결막 중단의 양을 최소화하기 위해 주의를 기울여야 합니다. 견인이 조직에 적용되는 한 해부 평면을 설정하고 우수한 궤도 능선으로 다시 운반하는 것은 놀라 울 정도로 쉽습니다. OSLG의 잘림에서 소작 자국을 볼 수 있다는 것은 안심입니다. 그들은 선의 주요 배설 덕트의 완전한 제거를 확인합니다.
ILG를 완전히 제거하면 도전과제도 제시됩니다. 이것은 시각화하는 가장 쉬운 부분이기 때문에 먼저 선의 머리를 분리하십시오. 선 조직의 전체 머리는 주변 조직에서 쉽게 분리; 그러나, 일부 주의 는 ILG의 머리에 내측 거짓말 큰 정맥 부비동에 손상을 방지하기 위해 사용해야합니다. ILG의 꼬리는 zygomatic 뼈 아래를 통과할 때 다시 따를 수 있습니다. 꼬리의 대부분은 쉽게 분리할 수 있습니다. 그러나, 꼬리의 가장 후방 측면 때문에 가변 해부학 및 경동맥의 중간 크기의 지점에 그것의 근접더 도전을 증명할 수 있습니다. 신중한 해부는 ILG의 모든 여백을 명확하게 볼 수 있도록하여 완전한 제거를 용이하게합니다. 조사관은 물비 선의 해부학의 이전 토론에서 설명 한 바와 같이, 삼선의 꼬리가 측면 칸투스에서 끝나는 경우에 더 우월하게 해부를 수행 할 준비가되어 있어야합니다. 참고로, 저자는 시간적 및 열등한 지구를 따라 곡선 절개를 통해 ILG를 해부 할 때 OSLG의 어떤 부분을 식별 할 수 없었습니다. 이 기술적으로 가능 할 수 있지만, 그 수술 접근은 심각한 출혈에 대한 너무 높은 위험을 운반. 후방 자위를 통해 OSLG에 접근하는 것은 훨씬 더 안전하다는 것을 증명합니다.
ILG의 배설 덕트는 하부 결막 포닉스로 통과할 때 열등한 근막면을 관통하는 것을 볼 수 있습니다. 때때로, 선 나타나는 조직의 작은 소엽뿐만 아니라 여기에서 볼 수 있으며 신중하게 제거 할 수 있습니다.
여기에 제시 된 바와 같이 LG 절제술의 순서를 유지하는 것이 매우 도움이됩니다. ILG를 먼저 제거하면 OSLG의 격리가 기술적으로 훨씬 더 어려워집니다. 주된 이유는 ILG를 제거 한 후 OSLG가 쉽게 탈출되어 식별 될 수 없기 때문입니다.
우리 모델의 중요한 장점은 "모듈식"이 될 수 있다는 것입니다. 즉, dacryoadenectomy에 의해 유도된 DED의 정도는 실험적 요구를 충족시키기 위해 보정될 수 있다. 예를 들어, 모든 LG의 절제술은 최대 DED를 유발하지만, SLG만의 절제는 가장 온화한 형태의 DED를 유발하고 ILG만이 중간 중증도의 질병을 생성할 것이다.
감소된 눈물 생산의 명백한 병리생리학적 사건을 되풀이하는 우리의 접근은 이미 보고된 방법에 비해 추가적인 이점을 제공합니다. 간략하게, 다른 수술 모델은 모든 궤도LGs에의해 눈물 생산을 제거5,6,7,15,16; LGs17의부교감 억제, 및 눈물 생산의 약리학적 억제를 포함18,19,후자의 두 상당한 confounders로 그들의 오프 대상 효과. 마지막으로,이 모델은 수술 기술이 완전한 시각화를 제공하기 때문에 주요 조사자 의존적 편향, 즉 LGs의 불완전한 절제술을 최소화합니다. 이것은 소작 이외의 지혈이 필요하지 않다는 사실에 의해 도움이됩니다.
조사관은 모든 궤도 LG의 완전한 절제술이 눈물의 완전한 부재를 생성하지 않는다는 것을 인식해야하며, 예를 들어, 0에 접근 하는 Schirmer의 눈물 테스트 값을 예상해서는 안됩니다. 이는 울프링과 크라우스의 부속품 LGs와 같은 눈물액의 다른 공급원이 항상 있고 결막혈관(20,21,22)으로부터의플라즈마 누설이 항상 존재하기 때문이다. 실험적 관점에서 볼 때, 이것은 안구 표면을 유지하므로 방법의 긍정적 인 측면으로 간주되어야한다; 완전한 xerophthalmia는 완전히 모델의 유용성을 부정 각막을 파괴 할 것이다. 또한, 현재 의 실시 예에서,이 모델은 이러한 작은 구획에 걸쳐 이러한 보상 메커니즘 및 유체 수송을 연구 할 수있는 좋은 기회를 제공합니다.
결론적으로, 여기에 제시된 눈물 생리학, DED의 병인 및 이 표시를 위해 개발되고 있는 치료제의 연구 결과에 빌려주는 수성 결핍 DED를 유도하는 참신하고 다재다능한 방법의 세부사항입니다.
공개
저자는 메디슨 제약, Inc. 및 Apis Therapeutics, LLC에서 지분 지위를 가진 BR을 제외하고는 경쟁 이익을 선언하지 않습니다. 그리고 LH, 메디콘 제약의 직원, 아피스 치료, LLC의 지분 위치와 Inc..
감사의 말
우리는 스토니 브룩 대학 의과 대학의 표적 연구 기회 보조금과 메디클론 제약, Inc., 세타우켓, NY에서 연구 보조금에서 재정 지원을 인정합니다. 우리는 편집 지원을 위한 미셸 맥테넌에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| acepromazine, Aceproinj | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| anesthesia vaporizer | VetEquip, Pleasanton, CA | Item # 911103 | Protocol 4.8 |
| animal restraining bag | Henry Schein Animal Health, Dublin, OH | Jorvet J0170 | Use appropriately sized bag. |
| bupivacaine, 0.5% | Hospira Inc, Lake Forest IL | NDC: 0409-1162-02 | Mixed 50:50 with 2% lidocaine with 1:100,000 epinephrine for infiltration of incision sites, protocol 5.1 |
| buprenorphine | Henry Schein Animal Health, Dublin, OH | 0.01 mg/kg, for postprocedural care, 6.1.4 | |
| cautery unit, high-temperature, battery-powered | Medline Industries Inc, Northfield, IL | REF ESCT001 | Keep on hand in case of bleeding, protocol 2.7 |
| clipper, Wahl Mini Arco | Henry Schein Animal Health, Dublin, OH | No. 022573 | Cordless shears for fur removal, protocol 4.2 |
| Colorado needle | Stryker Craniomaxillofacial, Kalamazoo, MI | N103A | Use with electrosurgical unit to make incisions, protocol 5.1 & 5.3 |
| electrosurgical unit with monopolar cautery plate | Valleylab, Boulder, CO | Force FXc | Use with electrosurgical unit to make incisions, protocol 5.1 & 5.3 |
| fluorescein, Ak-Fluor 10% | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT, measurement of dry eye parameters, protocol 3.1 |
| foceps, curved dressing | Bausch and Lomb (Storz), Bridgewater, NJ | Storz E1406 | delicate serrated dressing forceps |
| forceps, 0.3 | Bausch and Lomb (Storz), Bridgewater, NJ | ET6319 | For removal of nictating membrane, protocol 2.5 |
| forceps, Bishop Harmon | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Use toothed forceps for dacryoadenectomy, protocol 5.1 & 5.2 |
| hair remover lotion, Nair | Widely available | Softening Baby oil | Dipilitory cream for sensitive skin, protocol 4.2 |
| isoflurane | Henry Schein Animal Health, Dublin, OH | 29405 | Possible alternative sedation, protocol 4.7 |
| IV catheter, Terumo Surflo ETFE 24-gauge | Terumo, Tokyo, Japan; available from Fisher Sci., VWR, McKesson, etc. | SR-OX2419CA | 25-gauge for smaller rabbits; protocol 4.6 |
| ketamine | Henry Schein Animal Health, Dublin, OH | NDC 11695-0701-1; NADA 200-055 | 15 mg/kg, protocol 4.7 |
| ketoprofen | Hospira, Inc., Lake Forest, IL | 3 mg/kg, for postprocedural care, 6.1.4 | |
| laryngeal mask airway | Docsinnovent Ltd, London, UK | Vgel R3 | Protocol 4.8 |
| lid speculum, wire | Bausch and Lomb (Storz), Bridgewater, NJ | Barraquer SUH01 | For removal of nictating membrane, protocol 2.4 |
| lidocaine 2% with epinephrine 1:100,000; 50:50 mixture | Hospira Inc, Lake Forest IL | NDC 0409-3182-02 | Pre-treat before removal of nictating membranes, protocol 2.4 |
| lidocaine, preservative-free | Sigma-Aldrich, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent, for application to eye, protocol 2.4 |
| micropipette | Eppendorf | Research Plus 100 uL | For application of preservative-free lidocaine to eye, protocol 2.4 |
| micropipette tips | World Wide Medical Products | 41071052 | For application of preservative-free lidocaine to eye, protocol 2.4 |
| monitoring device, multi-parameter | SurgiVet, Waukesha, WI | V9201 | For monitoring of vitals, protocol 4.9 |
| needle, 26-gauge | BD, Franklin Lakes, NJ | REF 305115 | For injection of lidocaine/epinephrine, protocol 2.3 & 2.5 |
| needle, 30-gauge | BD, Franklin Lakes, NJ | REF 305106 | For infiltration of incision sites; syringe and needle size are not critical, protocol 5.1 |
| osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity measurement of dry eye parameters, protocol 3.1 |
| osmometer, TearLab | TearLab Corp., San Diego, CA | Model#200000W REV A | Measure tear osmolarity, measurement of dry eye parameters, protocol 3.1 |
| povidone-iodine solution | Medline Industries Inc, Northfield, IL | PVP Prep Solution, NDC: 53329-939-04, REF MDS 093944 | To maintain sterile field, protocol 4.11 |
| rabbit, New Zealand White | Charles River Labs, Waltham, MA (NZW) | 2-3 kg | Research animals |
| Rose bengal stain | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, for staining the ocular surface, measurement of dry eye parameters, protocol 3.1 |
| saline, normal | B. Braun Medical, Irvine, CA | REF R5200-01 | For postprocedural care, protocol 6.1.3 |
| Schirmer Tear Test strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production, measurement of dry eye parameters, protocol 3.1 |
| scissors, Vannas | McKesson Medical-Surgical, San Francisco, CA | Miltex 2-130 | Capsulotomy scissors for dacryoadenectomy, protocol 5.1 & 5.2 |
| scissors, Westcott tenotomy | McKesson Medical-Surgical, San Francisco, CA | Miltex 18-1480 | For removal of nictating membrane, protocol 2.7 |
| sedation gas mask | DRE Veterinary, Louisville, KY | #1381 | Possible alternative sedation, protocol 4.7 |
| surgical marking pen | Medical Action Industries, Arden, ND | REF 115 | Protocol 4.2 |
| sutures, 5-0 Mersilene | Ethicon US, LLC | Ethylene terephthalate sutures, used for deep connective tissue closure, protocol 5.3.11 | |
| sutures, Vicryl 6-0 | Ethicon US, LLC | Polyglactin 910 sutures, used for superficial muscle and skin closure, protocol 5.3.11 | |
| syringe, 1 cc | BD, Franklin Lakes, NJ | ref 309659 | For injection of lidocaine/epinephrine, protocol 2.3 & 2.5 |
| syringe, 5 cc | BD, Franklin Lakes, NJ | REF 309603 | For infiltration of incision sites; syringe and needle size are not critical, protocol 5.1 |
| tissue forceps, 0.8mm Graefe | Roboz Surgical Store, Gaithersburg, MD | RS-5150 | Curved Weck forceps |
| topical antibiotic ointment (neomycin, polymyxin, bacitracin, and hydrocortisone) | Bausch and Lomb, Tampa, FL | NDC 24208-785-55 | Applied after removal of nictating membrane, protocol 2.8, and for postprocedural care, protocol 6.1.2 |
| ultrasound gel | Parker Laboratories, Inc., Fairfield, NJ | Aquasonic 100 | To ensure electrical contact with monopolar cautery plate, protocol 4.5 |
| xylazine | Henry Schein Animal Health, Dublin, OH | NADA: 139-236 | 1 mg/kg, protocol 4.7 |
참고문헌
- Gillan, W. D. H. Tear biochemistry: A review. South African Optometrist. 69 (2), 100-106 (2010).
- Conrady, C. D., Joos, Z. P., Patel, B. C. Review: The Lacrimal Gland and Its Role in Dry Eye. Journal of Ophthalmology. 2016, 7542929 (2016).
- Schechter, J. E., Warren, D. W., Mircheff, A. K. A lacrimal gland is a lacrimal gland, but rodents' and rabbits' are not human. Ocular Surface. 8 (3), 111-134 (2010).
- Shinomiya, K., Ueta, M., Kinoshita, S. A new dry eye mouse model produced by exorbital and intraorbital lacrimal gland excision. Scientific Reports. 8 (1), 1483 (2018).
- Bhattacharya, D., et al. Tear Production After Bilateral Main Lacrimal Gland Resection in Rabbits. Investigative Ophthalmology and Visual Science. 56 (13), 7774-7783 (2015).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Li, N., et al. Establishment of the mild, moderate and severe dry eye models using three methods in rabbits. BioMed Central Ophthalmology. 13, 50 (2013).
- Honkanen, R., et al. A New Rabbit Model of Chronic Dry Eye Disease Induced by Complete Surgical Dacryoadenectomy. Current Eye Research. , 1-10 (2019).
- Nisha, S., Deepak, K. An Insight Into Ophthalmic Drug Delivery System. International Journal of Pharmaceutical Studies and Research. 3 (2), 9-13 (2012).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, (1929).
- Popesko, P., Rajitova, V., Horak, J. Rabbit - Guinea Pig. A Colour Atlas of the Anatomy of Small Laboratory Animals. 1, (1992).
- Honkanen, R. A., Huang, L., Rigas, B. A rabbit model of aqueous-deficient dry eye disease induced by concanavalin A injection into the lacrimal glands: Application to drug efficacy studies. Journal of Visualized Experiments. , e59631 (2019).
- Wei, Y., Asbell, P. A. The core mechanism of dry eye disease is inflammation. Eye & Contact Lens. 40 (4), 248-256 (2014).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology and Visual Science. 28 (2), 225-228 (1987).
- Odaka, A., et al. Efficacy of retinol palmitate eye drops for dry eye in rabbits with lacrimal gland resection. Clinical Ophthalmology. 6, 1585-1593 (2012).
- Toshida, H., Nguyen, D. H., Beuerman, R. W., Murakami, A. Evaluation of novel dry eye model: preganglionic parasympathetic denervation in rabbit. Investigative Ophthalmology and Visual Science. 48 (10), 4468-4475 (2007).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology and Visual Science. 49 (5), 1850-1856 (2008).
- Shiue, M. H., et al. Pharmacological modulation of fluid secretion in the pigmented rabbit conjunctiva. Life Science. 66 (7), 105 (2000).
- Li, Y., et al. Rabbit conjunctival epithelium transports fluid, and P2Y2(2) receptor agonists stimulate Cl(-) and fluid secretion. American Journal of Physiology: Cell Physiology. 281 (2), C595-C602 (2001).
- Dartt, D. A. Regulation of mucin and fluid secretion by conjunctival epithelial cells. Progress in Retinal and Eye Research. 21 (6), 555-576 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유