Method Article
利用有机体培养评价小鼠前列腺皮细胞的分化能力
* 这些作者具有相同的贡献
摘要
小鼠前列腺器官代表一个有前途的环境来评估调节分化的机制。本文介绍了一种建立前列腺有机体的改进方法,并介绍了(1)从有机体中收集蛋白质易脂物的方法,以及(2)全贴联显显微镜的修复和染色有机体。
摘要
前列腺上皮主要由基底细胞和发光细胞组成。体内系系追踪已用于定义小鼠前列腺基底和发光细胞在发育、组织再生和转化过程中的分化能力。然而,使用系界线追踪方法评估前列腺上皮分化能力的细胞内向和外在调节器通常需要广泛的育种,并且可能成本高昂。在前列腺器官测定中,基底细胞和发光细胞在活体前产生前列腺上皮。重要的是,初级上皮细胞可以从任何遗传背景的小鼠或经过任意数量的小分子治疗的小鼠中分离出来,在电镀到三维(3D)培养中。7-10 天后生成足够的材料用于评估分化能力。通过西印体对(1)蛋白质进行分析的基基衍生物和发光衍生有机物的收集,以及(2)通过全装共聚焦显微镜对完整有机体进行免疫组织化学分析,使研究人员能够评估体外分化前列腺上皮细胞的能力。当结合使用时,这两种方法提供有关前列腺基础细胞和发光细胞在基因或药理操作方面的分化能力的补充信息。
引言
基础细胞和发光细胞构成前列腺上皮1的大部分。血统追踪研究表明,这些细胞类型主要是由成年小鼠2中不同的祖细胞自我维持;然而,在包括发育3、4、组织再生5、炎症6、7和前列腺癌起始2、8在内的几种情况下,观察到了与基基祖子的亮度分化。此外,新兴数据支持多能发光后代的存在以及发光承诺的祖子9。在转移性前列腺癌中,从AR依赖性发光系向具有基础和神经内分泌特征的AR-无差别系分化代表一种日益被重视的对雄激素通路抑制剂10、11、12的抗药性机制。因此,由于分化涉及正常生理学、癌症启动和治疗阻力,阐明前列腺上皮细胞分化的关键分子调节剂至关重要。
小鼠前列腺器官模型已成为研究前列腺上皮细胞分化的优雅前体环境9,13,14。在此测定中,单个上皮细胞被镀成3D矩阵,在1周内生成包含基底细胞和发光细胞的腺体结构。虽然现有的将细胞电镀成有机体培养的方法可以用来有效地生成有机体,但这些方法需要进一步优化14。与培养前列腺有机体相关的显著挑战包括:(1) 从分析中排除在 Matrigel(基质凝胶)下方形成的二维 (2D) 菌落,(2) 在介质变化期间保持基质凝胶的完整性,以及 (3) 准确计数有机体。本文概述了从从小鼠前列腺分离的上皮细胞生成器官的方法。所述方法要求涂覆含有聚物(2-羟基乙二醇甲酸酯)(Poly-HEMA),以防止2D菌落的发生。此外,细胞被镀成基质凝胶环,而不是基质凝胶盘,这使得改变介质和计数器官不那么具有挑战性。这些技术使研究人员能够更轻松地研究在器官形成之前或过程中引入的基因改变或小分子如何改变关键过程,如分化。
通过全座共聚焦显微镜采集用于西印或免疫组织化学分析的前列腺器官,可以为分化13提供有价值的力学见解,但缺乏为此类技术制备有机体的协议。本手稿描述了收集有机物的方法 (1) 收集蛋白质莱沙,或 (2) 固定和染色,用于共聚焦显微镜。重要的是,与现有方法相比,所述用于固定和染色前列腺器官的方法得到了很大的改进。虽然这些依赖于切片有机体15,本手稿中描述的方法使用完整的有机体,这有助于防止样品制备过程中的器官损伤。当结合使用时,西印体和共聚焦显微镜可以为对分化的分子调节器提供有价值的见解。或者,这些方法可用于建模其他过程,如开发和转换。
研究方案
此处描述的所有方法均已获得加州大学洛杉矶分校机构审查委员会的批准。
注:图 1提供了说明本文中所述方法的示意图。
1. 使用荧光激活细胞分拣 (FACS) 隔离小鼠基础细胞和明心前列腺皮质细胞 – 时间:30 分钟
注:在黑暗中执行步骤 1.3-1.5。
- 如劳森等人16所述,从小鼠前列腺总分离细胞分离后,将细胞转移到FACS管中,并在100μL分离介质中重新悬浮0.1-5 x 106细胞(表1)。
- 添加以下直接结合的原抗体的适当体积:CD45、CD31、Ter-119、EpCAM和CD49f。
- 在冰上孵育,不受光线照射,20分钟。
注:建议将总分离细胞的10%用于未染色和单染色对照。这些控制装置是设置正确的补偿和电压排序所必需的。 - 将1mL解毒培养基加入每个样品,加入分离剂鸡尾酒。在室温(RT)下,在800 x g下通过离心将细胞进行5分钟的离心,然后通过吸气去除上清液。
- 以适当的体积(每 1 x 106细胞 250 μL)分离介质中重新悬浮含有 1 μg/mL 4',6-二酰胺-2-苯林多尔 (DAPI) 的分离介质。继续进入 FACS。流细胞学图显示分离小鼠基底和发光前列腺上皮细胞图如图2所示。
2. 将排序的前列腺皮质细胞电镀到原小鼠有机体培养物中 • TIMING:2-3 H(不包括聚血 MRMa 涂层板制备)
注:板涂有 Poly-HEMA,以防止在基质凝胶下方的井表面形成 2D 菌落。在将已分拣的基底或发光前列腺上皮细胞电镀到小鼠器官培养物中前1天制备聚血-HEMA涂层板。在步骤2.1之前在冰2h上解冻1 mL减量因子基质凝胶,以下简称基质凝胶。Y-27632(ROCK抑制剂)应在步骤2.1之前添加到小鼠有机体介质中。在冰上执行步骤 2.1-2.8。
- 在5mL圆底管中,在4°C下通过800 x g离心5分钟,将细胞吸出上清液。
- 在小鼠有机物介质的500μL中清洗细胞颗粒(表2)14。
- 在4°C下,在800 x g下通过离心将细胞进行5分钟的离心,然后吸出上清液。
- 在细胞密度为1,000细胞/μL时在小鼠有机体介质中重新悬浮。
- 要制备主混合物,将悬浮在小鼠有机体介质中的上皮细胞与基质凝胶混合,以生成包含25%细胞/培养基和75%基质凝胶的最终混合物。基底细胞通常以100-2,000个细胞/80μL的浓度进行镀层,而发光细胞的镀值通常为2,000-10,000细胞/80μL。镀层电池的密度因预期材料收集日以及所需的下游应用而异。
注:在主混合准备前 5 分钟,冷却适当尺寸的管子,以进行预期的主混合体积。为确保基质凝胶在搬运时不会变硬,在将基质凝胶转移到新管之前,通过移液3-4次移液使移液器尖端冷却至关重要。 - 在24孔板每孔加入80μL的基质凝胶/细胞混合物。建议将液滴移至井壁的下半部分,同时避免直接接触 Poly-HEMA 涂层。加入基质凝胶后,旋转板,使基质凝胶/细胞混合物在井缘周围形成环。
- 将 24 孔板放入 37°C 5% CO2培养箱右侧向上 10 分钟,使基质凝胶部分硬化。
注:将 24 孔板放入培养箱后,立即开始在 37°C 下加热小鼠有机体介质。 - 孵育10分钟后,将24孔板倒置翻转,再孵育50分钟,使基质凝胶完全硬化。
- 在每个井的中心加入350 μL的预加热小鼠有机体介质。
注:为了保持基质凝胶的完整性,在添加介质时避免基质凝胶环至关重要。 - 加入介质后,将 24 孔板返回到 37°C 5% CO2培养箱。
3. 补充小鼠有机体介质 • 定时:每 24 孔板 10-15 分钟
注:应每 48 小时更换一次新介质。在每个介质更换之前,预热鼠标有机体介质。没有必要在用于补充的介质中添加 ROCK 抑制剂。
- 以 45° 角倾斜 24 孔板,并使用 p1000 移液器从每个孔的中心轻轻取下现有介质,同时避免基质凝胶环。
- 如步骤 2.9 中那样,添加 350 μL 的预加热小鼠有机体介质。建议在培养超过5天的有机体中加入更大的介质(高达1 mL),以防止关键营养素和生长因子迅速耗尽。
4. 从前列腺有机物中提取蛋白质莱酸,用于西斑分析 – TIMING: 2.5-4 H
注:在收集用于蛋白质赖萨拔脱的有机物之前,准备并预温含无脂介质(表1)。
- 从每个介质以及步骤 3.1 中删除介质。
- 为了收集有机物,通过将1 mL的含乳液介质直接移至基体凝胶环上,直到整个环脱落,并转移到1.5 mL微离心管中反复爆炸。
注:避免直接接触聚氨酯涂层油井至关重要。直接接触可能导致收集的材料受到Poly-HEMA的污染,从而对细胞生存产生负面影响。 - 将1.5 mL微离心管放入37°C 5%CO2培养箱30分钟至1小时,以便通过消沉完全消化基质凝胶。
- 在RT处,在800 x g下离心5分钟,并使用微移液器去除上清液。
- 将磷酸盐缓冲盐水 (PBS) 添加到有机物颗粒中,然后轻轻轻拂重新悬浮。
注:未能充分重新悬浮有机物颗粒可能会导致有机体材料与残留脱胶或基质凝胶的污染。 - 在RT处,在800 x g下通过离心将有机物进行5分钟的离心,并使用微移液器去除上清液。
- 通过将每个管放入含有干冰和甲醇的溶液中,快速冻结有机物颗粒。将管子储存在-80°C,直到将来使用。或者,在步骤4.6之后立即提取蛋白质解物。
- 每10μL包装细胞体积,将有机物颗粒悬浮在100μL的蛋白质赖沙缓冲液中(表1)。轻拂以重新挂起。
注:如果在快速冷冻后恢复,请确保在从-80°C中取出样品之前解冻蛋白质解液缓冲液,因为必须立即将解液缓冲液添加到样品中,以防止磷酸酶和蛋白酶活性。 - 在冰上孵育蛋白质解液缓冲液中的样品至少45分钟。
注:建议在冰上孵育前进行声波,以提高核蛋白回收效率;但是,不需要声波。如果未执行声波,则继续执行步骤 4.10。- 要声波,将管子浸入湿冰中,并轻轻地将声波分离器的尖端施加到微离心管的外侧。在 20 kHz 下为 40 s 的声波。
- 按照既定的协议进入西方污点。
5. 修复和染色前列腺器官,用于全装共聚焦显微镜的免疫组织化学分析
-
从24孔板收集前列腺器官 – TIMING:45-60分钟
注:当收集前列腺器官进行共聚焦显微镜时,为了保持其结构,小心处理它们是至关重要的。下面的收集协议旨在减少隔离期间有机体结构的中断。- 从每个介质以及步骤 3.1 中删除介质。
- 在37°C 5%CO2培养箱中,用500μL的含脂介质(表1)孵育30分钟,以消化基质凝胶。
- 在微离心管中收集消化的有机体悬浮液,在RT处通过800 x g离心对有机体进行3分钟的颗粒,去除上清液。
-
前列腺器官全装免疫荧光染色 • TIMING:3-4 天(1-5 小时/天)
- 在PBS中加入500μL的4%的甲醛,在RT下孵育2小时,轻轻摇动。
- 在RT处,在800 x g下通过离心将有机物进行3分钟,去除上清液,用1mL的PBS清洗颗粒15分钟,轻轻摇动。
- 像步骤 5.2.2 中那样清洗颗粒,额外洗涤两次。
- 在RT处通过800 x g离心将有机物进行3分钟的离心,并去除上清液。在阻断溶液中加入1微克/mL DAPI (表1)。在 RT 孵育 2 小时,或在 4°C 下孵育 2 小时,轻轻摇动。
- 在RT处通过800 x g离心将有机物进行3分钟的离心,并去除上清液。加入原抗体(兔抗p63,小鼠抗细胞角蛋白8)在阻断溶液中,在4°C孵育过夜,轻轻摇动。
- 在RT处通过800 x g离心将有机物进行3分钟的离心,并去除上清液。用 1 mL 的 PBS 清洗颗粒 15 分钟,轻轻摇动。
- 像步骤 5.2.6 中那样清洗颗粒,额外洗涤两次。
- 在RT处通过800 x g离心将有机物进行3分钟的离心,并去除上清液。加入二级抗体(山羊抗兔子IgG-AlexaFluor 594,山羊抗小鼠IgG-Alexa氟488)在阻断溶液中,并在4°C孵育过夜,轻轻摇动。
- 在RT处,在800 x g下通过离心将有机物进行3分钟,去除上清液,用1mL的PBS清洗颗粒15分钟,轻轻摇动。
- 像步骤 5.2.9 中那样清洗颗粒,额外洗涤两次。
6. 用于全安装共聚焦显微镜的染色前列腺器官的组织清除和安装 • TIMING: 7 H
- 在RT处通过800 x g离心将有机物进行3分钟的离心,并去除上清液。
- 在 PBS 中加入 1 mL 的 30% 蔗糖,加入 1% Triton X-100,在 RT 孵育 2 小时,轻轻摇动。
- 在RT处通过800 x g离心将有机物进行3分钟的离心,并去除上清液。
- 在 PBS 中加入 1 mL 的 45% 蔗糖,加入 1% Triton X-100,在 RT 孵育 2 小时,轻轻摇动。
- 在RT处通过800 x g离心将有机物进行3分钟的离心,并去除上清液。
- 在 PBS 中加入 1 mL 的 60% 蔗糖,加入 1% Triton X-100,在 RT 孵育 2 小时,轻轻摇动。
- 在RT处通过800 x g离心3分钟,去除95%的上清液,将有机物颗粒。
注:随着蔗糖浓度升高,颗粒会变得更松。建议在紫外线下观察DAPI染色的有机物,以确认它们在去除上清液时没有丢失。 - 将剩余悬架的10-20 μL液滴转移到室盖玻片,然后进行共聚焦显微镜。
注:盖玻片碎片可以放置在滴的两侧,用作垫片(图4C)。这些防止有机物折叠时,盖玻片被放置在滴。
结果
前列腺上皮细胞被镀入小鼠器官培养物中,形成有机体,在准备进行下游分析之前收获(图1)。
使用FACS分离基底细胞和发光体上皮细胞。排除DAPI+细胞和消耗林+细胞(CD45,CD31,Ter119)后,基底细胞和发光细胞根据EpCAM和CD49f的差分表达进行区分(图2)。所述将前列腺基底和发光细胞板入有机体培养的方法包括:(1)将电镀细胞放入基质凝胶环,(2)用Poly-HEMA涂布孔。电镀成环之前在阿加瓦尔等人9中描述过。利用这种方法(图3A)使研究人员在补充介质时更容易避免基质凝胶(步骤3),并且通过遵循井的周长更容易地计算器官。用Poly-HEMA涂布井已被证明可以防止视网膜器官形成2D菌群17;然而,这种方法尚未在前列腺器官模型中使用。重要的是,用Poly-HEMA涂布井(表3)消除了2D菌落的发生,而不会干扰有机体的形成(图3B)。这些修改扩展了前列腺器官测定的能力。
基底细胞和发光细胞形成具有独特形态的器官(图4A)。虽然大多数基基衍生的有机物在培养7天后大小相似(100-300 μm直径),但发光衍生的有机体表现出显著的异质性(30-450 μm直径)。此外,大多数基基衍生的有机物含有由多层上皮包围的流明(图4A,上图),而发光衍生的有机体在形态上范围从空心到固体,单层上皮到固体,具有多层的细胞线,不管网(图4A,底部)。上述用于准备用于下游分析的有机物的方法(步骤 4、5)用于调查这些类称差异是否反映了系系标记表达式的差异。西方污点分析表明,基底和发光器官体保留与基底和发光原细胞相关的特征。基底衍生的有机物表示基底标记细胞角素5(K5)的较高水平,而发光衍生的有机体表示更高水平的发光标记细胞角蛋白8(K8)(图4B)。在散装人群的基底和发光衍生有机体中检测到基底和发光标记,可能暗示分化(图4B)。
我们寻求在基源器官中描述系谱标记表达,并通过染色完好的有机物和执行共聚焦显微镜来确定形态上截然不同的发光衍生有机体是否表现出标记表达的差异(图4D)。基底衍生的有机物包含多层上皮,外层表示基底标记p63的高水平和亮度标记K8(p63 hi,K8中)的中度水平,内层没有可检测的p63水平和K8(p63lo,K8hi)(图4D,顶部)。虽然单层发光衍生有机体中的所有细胞都为K8染色正,但只有选择的细胞含有核p63(图4D,底部)。这些数据验证了采集方法,并准备了有机体,供西方印版或共聚焦显微镜进行分析,从而扩展了有机体测定研究关键细胞过程(包括分化)的能力。
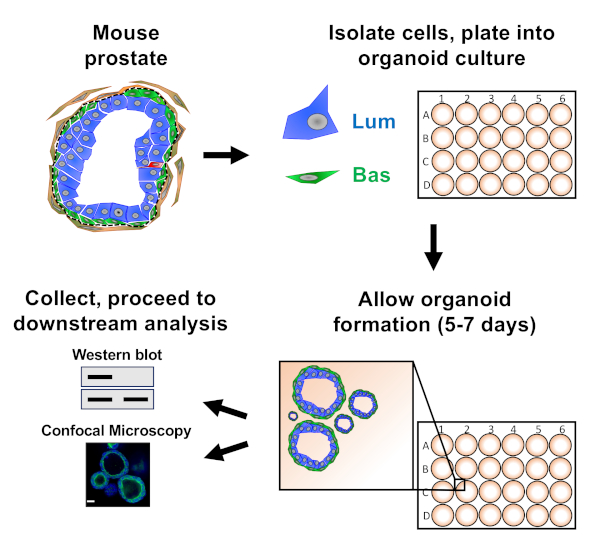
图1:原理图说明工作流程,用于生成前列腺器官,用于收集和分析。小鼠前列腺完全分离,基底和明灯前列腺上皮细胞通过荧光激活细胞分拣通过既定的协议18、19进行分离。悬浮在小鼠有机物培养基和基质凝胶混合物中的基底或发光细胞被镀成基质凝胶环。经过5至7天的培养后,有机物被收获,由西印体或共聚焦显微镜进行分析。请点击此处查看此图的较大版本。
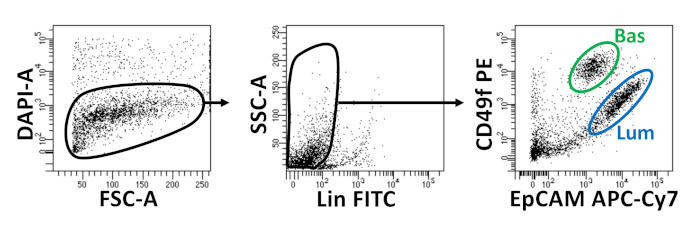
图2:使用荧光活性细胞分类(FACS)分离小鼠基底细胞和发光前列腺上皮细胞。在FACS之前,从小鼠前列腺分离的细胞被染色,以区分活细胞和死细胞和表面抗体,以区分基底细胞和发光细胞。左侧 = 在 DAPI-单元格上封闭。FSC-A = 正向散射。中心 = 门在林细胞(CD45lo,CD31lo,Ter119lo) 。SSC-A = 侧散射。右 = 基底细胞 (Bas) (EpCAMHi, CD49fhi), 亮度细胞 (Lum) (EpCAMHi, CD49f中部 )。请点击此处查看此图的较大版本。
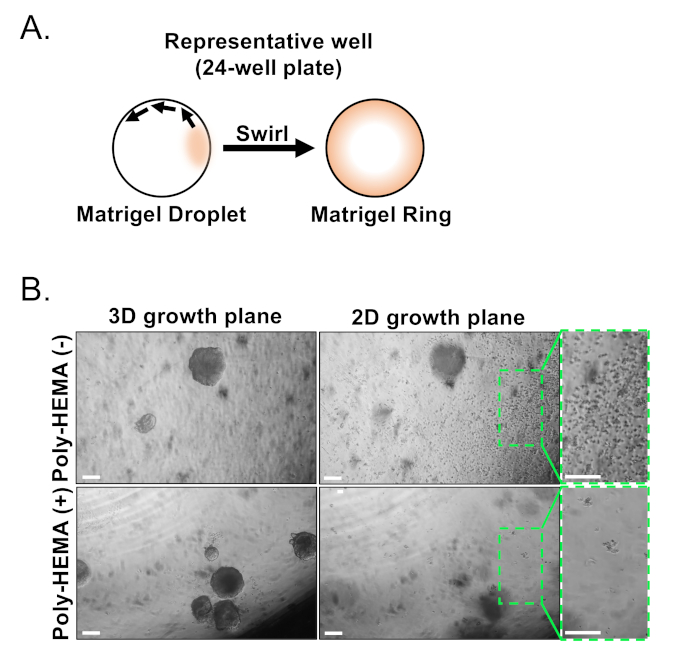
图3:小鼠前列腺器官的建立。(A) 在24孔板的井中生成基质凝胶环的原理说明方法。(B) 有机体(3D生长平面)和二维菌落(2D生长平面)的代表相对比图像在将前列腺上皮细胞电镀为未涂层(Poly-HEMA(-)或涂层(Poly-HEMA(+))24孔板7天后形成。2D 增长平面内的盒装区域在右侧被放大。比例尺 = 200 μm。请点击此处查看此图的较大版本。
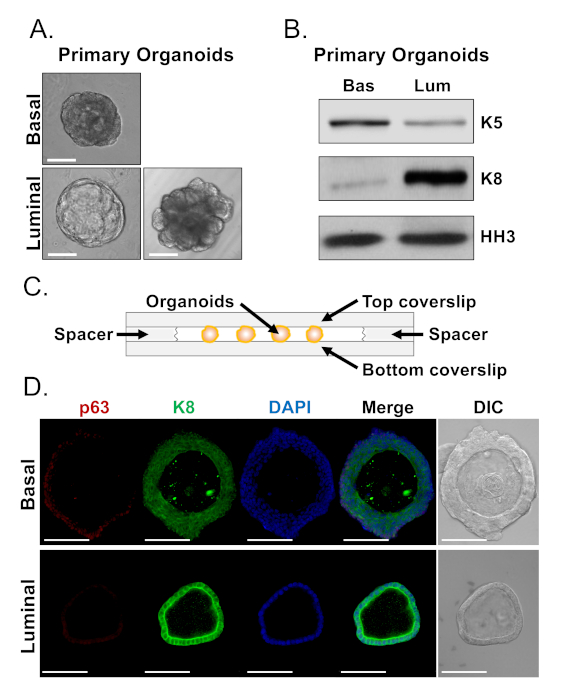
图4:西印和全贴子对前列腺器官的谱系标记表达的分析。(A) 在培养7天后,基基衍生物(上)和发光(底部)有机物的代表性相对比图像。刻度条 = 100 μm (B) 基底衍生物 (Bas) 和亮度衍生物 (Lum) 有机体在培养 5 天后的西方污点分析。基基标记物、细胞角蛋白 5 (K5) 和发光标记物、细胞角蛋白 8 (K8) 和载量控制(组蛋白 H3 )的染色。(C) 用垫片说明室盖玻片的原理图。(D) 基基衍生(上)和发光(底部)有机体在培养7天后的代表性差分干扰对比度(DIC)和免疫荧光图像。分别染色 p63(红色)、K8(绿色)和 DAPI(蓝色)。比例尺 = 100 μm。请点击此处查看此图的较大版本。
| 食谱 | |
| 含散散酶的介质 | 1 mg/mL 消酶 = 10 μM ROCK 抑制剂,在高级 DMEM F12 中。使用 0.22 μm 过滤器进行过滤灭菌。 |
| 分离介质 | 10% FBS = 1x 青霉素-链霉素,在 RPMI 1640 中。使用 0.22 μm 过滤器进行过滤灭菌。 |
| 蛋白质莱沙缓冲液 | RIPA缓冲液 + 磷酸酶抑制剂 + 蛋白酶抑制剂 |
| 阻塞解决方案 | PBS 中的 10% FBS,0.2% Triton X-100 |
表1:关键解决方案的编制说明。
| 组件 | 浓度 |
| B-27 | 1x (从 50x 浓缩物稀释) |
| 谷胱甘肽 | 1x (从 100x 浓缩液稀释) |
| N-乙酰-L-半胱氨酸 | 1.25 mM |
| 诺莫辛 | 50 μg/mL |
| 重组人类EGF,无动物 | 50 纳克/升 |
| 重组人诺金 | 100 纳克/升 |
| R-spondin 1条件介质 | 10% 调节介质 |
| A83-01 | 200 nM |
| Dht | 1 nM |
| Y-27632 二盐(ROCK 抑制剂) | 10 μM |
| 高级 DMEM/F-12 | 基本介质 |
| R-spondin 1条件介质的生成,如德罗斯特等人13所述。添加所有组件后,使用 0.22 μm 过滤器过滤灭菌小鼠有机体介质。ROCK抑制剂仅在培养和有机物的传递过程中添加。 | |
表2:小鼠有机体培养物制备说明。
| 制备聚海马涂层板的协议 | |
| 1 | 将 0.25 g 聚赫马加到 50 mL 98% EtOH 中。在摇摇器上以 37 °C 溶解聚氨酯- HEMA。此过程至少需要 4 小时。 |
| 2 | 使用 0.22 μm 过滤器对聚-HEMA 进行过滤灭菌。 |
| 3 | 每孔24孔板加入200μl的Poly-HEMA溶液。 |
| 4 | 加入 Poly-HEMA 后,从 24 孔板中取出盖子,使溶液在一夜之间蒸发。 |
| 5 | 用 PBS 清洗每口井两次,并确保在最终洗涤后储存前完全干燥。注:在洗涤过程中破坏Poly-HEMA涂层有助于将上皮细胞电镀成有机体培养体后二维生长。为防止损坏聚-HEMA 涂层井,请避免在清洗时直接接触移液器尖端。除非通过移液器尖端刮掉聚海马,否则聚氨酯涂层油井的完整性将保持不变。 |
| 6 | 聚海马涂层板可在4°C下储存长达两周。注:在储存前将板包装在副薄膜中可降低污染风险。 |
表3:聚海马涂层板的制备协议。
讨论
前列腺上皮细胞分化已牵连于正常前列腺生物学2,3,4,5,6,7和疾病生物学8,10,11,12;但是,此过程的主调节器仍未定义。识别前列腺上皮细胞分化的关键调节器非常困难,部分原因是缺乏完善的环境来建模它。虽然2D单层培养法可以用来模拟分化11,12,但这个背景无法概括复杂的前列腺微环境。此外,在体内环境中,对分化进行建模并不适合机械研究,因为它们很难操纵。因此,识别一个易于操作,但生理相关背景,研究分化是至关重要的。
前列腺器官模型代表一个优雅的前体环境,其中基底到发光分化报告发生。建立前列腺器官的方法已经建立良好14;但是,需要进一步优化这些方法。此外,收获和准备前列腺器官分析的方法没有明确描述。本文介绍了一种从小鼠前列腺分离到器官培养中分离的板前列腺上皮细胞的方法。这种方法使研究人员能够(1)防止在有机体形成期间发生2D菌落,(2)降低在介质补充过程中对基质凝胶的干扰风险,以及(3)更有效地计数有机体。此外,本手稿概述了用于制备西方印斑分析或全安装共聚焦显微镜的有机物的方法。重要的是,用于制备共聚焦显微镜的有机体的方法在持续时间内保持有机体的完整结构,从而减少图像采集前的器官损伤。总之,所述方法扩展了前列腺器官测定的能力。
值得注意的是,基底细胞和发光细胞的器官形成能力可以通过用于分离各自种群的方法和培养条件来改变。该测定中使用的有机体培养条件首先由卡特豪斯等人13描述。而卡特豪斯等人报告说,基底细胞具有较高的器官形成能力(15%)比发光细胞(1%)13,Chua等人,使用不同的分离方法和培养条件,报告发光细胞(0.2-0.3%)具有比基底细胞(0.03%)更高的器官形成能力20。总体而言,由卡特豪斯等人描述的方法导致基底细胞和发光细胞的有机体形成率较高,可能反映了用于分离基底细胞和发光细胞13的方法的差异,而不是偏向于从发光细胞形成有机体的培养条件。目前还不清楚本手稿中描述的协议是否有利于从多能发光祖(或承诺-发光前代)的发光器官形成9。虽然及时且成本高昂,但体内系谱追踪研究可用于验证与在有机体测定中阐明的独特的前列腺上皮谱相关的祖体特征。
发育、分化和转化等过程不仅与前列腺生物学相关,而且与包括脑、肺、肠、胰腺和肝脏在内的其他组织的生物学相关。所述方法有助于利用有机体模型来研究这些过程,不仅在前列腺,而且在广泛的组织。
披露声明
作者没有什么可透露的。
致谢
PDC 和 JMG 由露丝·基尔施斯坦国家研究服务奖 GM007185 提供支持。JAD由美国国家卫生研究院国家普通医学研究所(R25GM055052)资助,授予T.哈森和索尔·马丁内斯奖学金。ASG由斯皮策家庭基金会基金和吉尔基金会提供支持。这项工作得到了美国癌症协会(RSG-17-068-01-TBG)、国防部(W81XWH-13-1-0470)、玛格丽特E的支持。早期医学研究信托基金、NIH/NCI(P50CA092131/UCLA 前列腺癌 SPORE)、玫瑰山基金会,以及加州大学洛杉矶分校琼森综合癌症中心、广泛干细胞研究中心、临床和转化科学研究所以及泌尿肿瘤学研究所的支持。
材料
| Name | Company | Catalog Number | Comments |
| µ-Dish 35 mm, high | ibidi | 81156 | |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 50-980-487 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | D1306 | |
| A83-01 | Tocris | 2939 | |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634010 | |
| APC/Cy7 anti-mouse CD326 (Ep-CAM) Antibody, 100 μg | BioLegend | 118218 | |
| B-27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| Complete Protease Inhibitor Cocktail | Sigma | 11836145001 | |
| (DiHydro)testosterone (5α-Androstan-17β-ol-3-one) | Sigma | A-8380 | |
| Dispase II, Powder | Thermo Fisher Scientific | 17-105-041 | |
| Fetal Bovine Serum (FBS) | Sigma | F8667 | |
| FITC anti-mouse CD31 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 102405 | |
| FITC anti-mouse CD45 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 103107 | |
| FITC anti-mouse TER-119/Erythroid Cells Antibody (0.5 mg/mL, 50 μg) | BioLegend | 116205 | |
| Goat anti-mouse IgG-Alexa Fluor 488 | Invitrogen | A28175 | |
| Goat anti-rabbit IgG-Alexa Fluor 594 | Invitrogen | A11012 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Halt Phosphatase Inhibitor | Thermo Fisher Scientific | 78428 | |
| Matrigel GFR Membrane Matrix | Corning | CB-40230C | |
| Mouse anti-cytokeratin 8 | BioLegend | 904804 | |
| N-acetyl-L-cysteine | Sigma | A9165 | |
| Normocin | Thermo Fisher Scientific | ant-nr-1 | |
| PE anti-human/mouse CD49f Antibody | BioLegend | 313612 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15-140-122 | |
| Poly(2-hydroxyethyl methacrylate) (Poly-HEMA) | Sigma | P3932-25G | |
| Rabbit anti-p63 | BioLegend | 619002 | |
| Radioimmunoprecipitation assay (RIPA) | Thermo Fisher Scientific | PI89901 | |
| Recombinant Human EGF, Animal-Free | PeproTech | AF-100-15 | |
| Recombinant Human Noggin | PeproTech | 120-10C | |
| RPMI 1640 Medium, HEPES (cs of 10) | Thermo Fisher Scientific | 22400105 | |
| Sonic Dismembrator | Thermo Fisher Scientific | FB120 | |
| Sucrose | Sigma | S0389-500G | |
| Triton X-100 | Sigma | X100-5ML | |
| Y-27632 dihydrochloride (ROCK inhibitor) | Selleck Chemical | S1049-50MG |
参考文献
- Kwon, O. J., Xin, L. Prostate epithelial stem and progenitor cells. American Journal of Clinical and Experimental Urology. 2 (3), 209-218 (2014).
- Choi, N., Zhang, B., Zhang, L., Ittmann, M., Xin, L. Adult Murine Prostate Basal and Luminal Cells Are Self-Sustained Lineages that Can Both Serve as Targets for Prostate Cancer Initiation. Cancer Cell. 21 (2), 253-265 (2012).
- Ousset, M., Van Keymeulen, A., et al. Multipotent and unipotent progenitors contribute to prostate postnatal development. Nature Cell Biology. 14 (11), 1131-1138 (2012).
- Wang, J., et al. Symmetrical and asymmetrical division analysis provides evidence for a hierarchy of prostate epithelial cell lineages. Nature Communications. 5, 1-13 (2014).
- Wang, Z. A., Mitrofanova, A., et al. Lineage analysis of basal epithelial cells reveals their unexpected plasticity and supports a cell-of-origin model for prostate cancer heterogeneity. Nature Cell Biology. 15 (3), 274-283 (2013).
- Kwon, O. J., Zhang, B., Zhang, L., Xin, L. High fat diet promotes prostatic basal-to-luminal differentiation and accelerates initiation of prostate epithelial hyperplasia originated from basal cells. Stem Cell Research. 16 (3), 682-691 (2016).
- Kwon, O. J., Zhang, L., Ittmann, M. M., Xin, L. Prostatic inflammation enhances basal-to-luminal differentiation and accelerates initiation of prostate cancer with a basal cell origin. Proceedings of the National Academy of Sciences. 192 (3), 997-999 (2014).
- Stoyanova, T., et al. Prostate cancer originating in basal cells progresses to adenocarcinoma propagated by luminal-like cells. Proceedings of the National Academy of Sciences. 110 (50), 20111-20116 (2013).
- Agarwal, S., Hynes, P. G., et al. Identification of Different Classes of Luminal Progenitor Cells within Prostate Tumors. Cell Reports. 13 (10), 2147-2158 (2015).
- Ku, S. Y., et al. Rb1 and Trp53 cooperate to suppress prostate cancer lineage plasticity, metastasis, and antiandrogen resistance. Science. 355 (6320), 78-83 (2017).
- Mu, P., et al. SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science. 355 (6320), 84-88 (2017).
- Bishop, J. L., et al. The Master Neural Transcription Factor BRN2 Is an Androgen Receptor-Suppressed Driver of Neuroendocrine Differentiation in Prostate Cancer. Cancer Discovery. 7 (1), 54-71 (2016).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Drost, J., Karthaus, W. R., et al. Organoid culture systems for prostate epithelial and cancer tissue. Nature Protocols. 11 (2), 347-358 (2016).
- McCray, T., Richards, Z., Marsili, J., Prins, G. S., Nonn, L. Handling and Assessment of Human Primary Prostate Organoid Culture. Journal of Visualized Experiments. (143), e59051(2019).
- Lawson, D. A., Xin, L., Lukacs, R. U., Cheng, D., Witte, O. N. Isolation and functional characterization of murine prostate stem cells. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 181-186 (2007).
- Chen, H. Y., Kaya, K. D., Dong, L., Swaroop, A. Three-dimensional retinal organoids from mouse pluripotent stem cells mimic in vivo development with enhanced stratification and rod photoreceptor differentiation. Molecular vision. 22, 1077-1094 (2016).
- Liu, X., et al. Low CD38 Identifies Progenitor-like Inflammation-Associated Luminal Cells that Can Initiate Human Prostate Cancer and Predict Poor Outcome. Cell Reports. 17 (10), 2596-2606 (2016).
- Lukacs, R. U., Goldstein, A. S., Lawson, D. A., Cheng, D., Witte, O. N. Isolation, cultivation and characterization of adult murine prostate stem cells. Nature protocols. 5 (4), 702-713 (2010).
- Chua, C. W., Shibata, M., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nature Cell Biology. 16 (10), 951-961 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。