Method Article
オルガノイド培養を用いたマウス前立腺上皮細胞の分化能力の評価
* これらの著者は同等に貢献しました
要約
マウス前立腺オルガノイドは、分化を調節するメカニズムを評価する有望な文脈を表す。本論文では、前立腺オルガノイドを確立するための改善されたアプローチについて述べ、(1)オルガノイドからタンパク質リサートを採取する方法、および(2)全マウント共焦点顕微鏡のためのオルガノイドを修正および染色する方法を紹介する。
要約
前立腺上皮は、主に基底および発光細胞から構成される。生体内系統トレースは、発達、組織再生および形質転換時のマウス前立腺基底および発光細胞の分化能力を定義するために利用されている。しかしながら、系統トレースアプローチを用いて前立腺上皮分化能の細胞固有および外因性調節剤を評価するには、多くの場合、広範な繁殖が必要であり、コストが高くなる可能性があります。前立腺オルガノイドアッセイでは、基底細胞および発光細胞は前立腺上皮ex生体内を生成する。重要なことに、原発性上皮細胞は、任意の遺伝的背景のマウスまたは任意の数の小分子で処理されたマウスから単離することができ、その後、3次元(3D)培養物にめっきする。分化能力の評価のための十分な材料は、7〜10日後に生成されます。ウエスタンブロットによる(1)タンパク質分析のための基底由来および発光由来オルガノイドの収集と(2)全マウント共焦点顕微鏡による無傷のオルガノイドの免疫組織化学分析により、研究者はex vivo分化を評価することができる前立腺上皮細胞の容量。組み合わせて使用する場合、これら2つのアプローチは、遺伝的または薬理学的操作に応答して前立腺基底および明るい細胞の分化能力に関する相補的な情報を提供する。
概要
基底および発光細胞は、前立腺上皮1の大部分を含む。系統トレース研究は、これらの細胞型が主に成体マウス2の異なる前駆体によって自己支持されることを明らかにした。しかしながら、基底前駆者との発光分化は、発達3、4、組織再生5、炎症6、7および前立腺癌開始2、8を含むいくつかの文脈で観察されている。さらに、新しいデータは、多能性発光前駆体および発光コミット前駆体9の存在を支持する。転移性前立腺癌において、AR依存性の明るい系統から基底および神経内分泌特徴を有するAR無関心系統への分化は、アンドロゲン経路阻害剤10、11、12に対する耐性のますます高く評価されるメカニズムを表す。従って、分化が正常な生理学に関与するように、癌の開始および治療に対する耐性は、前立腺上皮細胞分化の主要な分子調節剤を解明することが重要である。
マウス前立腺オルガノイドモデルは、前立腺上皮細胞分化9、13、14を研究するためのエレガントなex vivoコンテキストとして出現した。このアッセイでは、個々の上皮細胞が3Dマトリックスにめっきされ、1週間以内に基底細胞と発光細胞の両方を含む腺構造を生成します。セルをオルガノイド培養にめっきする既存のアプローチは、オルガノイドを効率的に生成するために使用することができるが、これらのアプローチは、さらなる最適化14を必要とする。前立腺オルガノイドの培養に関連する顕著な課題は、(1)分析からマトリゲル(マトリックスゲル)の下に形成される2次元(2D)コロニーを除く、(2)媒体変化時のマトリックスゲルの完全性を維持すること、および(3)オルガノイドを正確にカウントすることを含む。本論文では、マウス前立腺から単離された上皮細胞からオルガノイドを生成するアプローチについて概説する。記載されたアプローチは、2Dコロニーの発生を防ぐためにポリ(2-ヒドロキシエチルメタクリレート)(ポリHEMA)でプレートをコーティングする必要があります。さらに、細胞はマトリックスゲルディスクではなくマトリックスゲルリングにめっきされるため、メディアの交換やオルガノイドのカウントが難しくなります。これらの技術により、研究者は、オルガノイド形成が分化などの重要なプロセスをどのように変化させるか、またはその過程で導入された遺伝子改変や小分子をより簡単に調査することができます。
全マウント共焦点顕微鏡によるウェスタンブロットまたは免疫組織化学分析のための前立腺オルガノイドの収穫は、分化13に対する貴重な機械的洞察を提供することができ、しかもそのような技術のためのオルガノイドを調製するための確立されたプロトコルが欠けている。この原稿は、(1)タンパク質リサートのコレクション、または(2)共焦点顕微鏡のための固定および染色のためのオルガノイドを収穫するアプローチについて説明する。重要なことに、前立腺オルガノイドの固定および染色のために記載されたアプローチは、既存の方法に関連してかなり改善される。これらは断面オルガノイド15に依存しているが、この原稿に記載されている方法は、サンプル調製中にオルガノイド損傷から保護するのに役立つ無傷のオルガノイドを利用する。ウェスタンブロットと共焦点顕微鏡を組み合わせて使用すると、分化の分子レギュレータに貴重な洞察を提供することができます。または、これらのアプローチを使用して、開発や変換などの他のプロセスをモデル化することもできます。
プロトコル
ここで説明するすべての方法は、カリフォルニア大学ロサンゼルス校の機関審査委員会によって承認されています。
注:このホワイト ペーパーに記載されているアプローチを示す概略図を図 1に示します。
1. 蛍光活性化細胞選別(FACS)を用いたマウス基底細胞および発光前立腺上皮細胞の単離 — タイミング:30分
注:暗闇の中でステップ1.3~1.5を実行します。
- Lawson et al.16に記載の全マウス前立腺から細胞を解離した後、細胞をFACSチューブに移し、解離媒体の100μLで0.1〜5x106細胞を再中断する(表1)。
- CD45、CD31、Ter-119、EpCAM、CD49fの直接共役一次抗体の適切な体積を追加します。
- 氷の上で20分間、光から保護されます。
注:未染色および単染色されたコントロールには、全解解除細胞の10%を利用することをお勧めします。これらのコントロールは、ソートのための正しい補正と電圧を設定するために必要です。 - 各サンプルに解離媒体を1mL添加して抗体カクテルをクエンチする。室温(RT)で5分間800xgで遠心分離して細胞をペレットし、吸引して上清を除去する。
- 1μg/mL 4',6-ジアミディノ-2-フェニリンドール(DAPI)を含む解離媒体の適切なボリューム(1 x 106細胞あたり250°L)で細胞を再サスペンドします。FACS に進みます。マウス基底および明るい前立腺上皮細胞の単離を示すフローサイトメトリープロットを図2に示す。
2. めっき前立腺上皮細胞を原発マウスオルガノイド培養に — TIMING: 2-3 H (ポリHEMA被覆プレート調製を除く)
注:プレートは、マトリックスゲルの下の井戸の表面に2Dコロニー形成を防ぐためにポリヘマでコーティングされています。ポリHEMAコーティングプレートを1日前に調製し、マウスオルガノイド培養に基底または発光前立腺上皮細胞をめっきする。還元成長因子マトリックスゲルの1mLアリコートを解凍し、続後、マトリックスゲルと呼び、ステップ2.1の前に氷2時間上に。Y-27632(ROCK阻害剤)は、ステップ2.1の直前にマウスオルガノイドメディアに添加する必要があります。氷上でステップ2.1~2.8を実行します。
- 細胞を5mL丸底チューブにペレットし、800 x gで遠心分離し、4°Cで5分間、上清を吸引する。
- マウスオルガノイドメディアの500μLで細胞ペレットを洗浄する(表2)14.
- 細胞を800xgで遠心分離して4°Cで5分間ペレット化し、上清を吸引する。
- 1,000細胞/μLの細胞密度でマウスオルガノイドメディアに再サスペンド。
- マスターミックスを調製するには、マウスオルガノイド媒体に懸濁した上皮細胞をマトリックスゲルと混合し、25%の細胞/媒体および75%マトリックスゲルを含む最終混合物を生成する。基底細胞は通常、100〜2,000細胞/80°Lの濃度でめっきされ、一方、発光細胞は通常2,000〜10,000細胞/80°Lの濃度でめっきされる。めっきされた細胞の密度は、予想される材料収集の日、および所望の下流用途によって異なります。
注:マスターミックス調製の前に、予想されるマスターミックスボリューム5分のために適切なサイズのチューブを冷やします。マトリックスゲルが取り扱い中に硬化しないようにするには、マトリックスゲルを新しいチューブに移す前に3~4回ピペットチップをピペットで冷やしておく必要があります。 - 24ウェルプレートのウェルあたり80°Lのマトリックスゲル/セル混合物を加えます。ポリHEMAコーティングとの直接接触を避けながら、井戸の壁の下半分に液滴を配管することをお勧めします。マトリックスゲルを加えた後、プレートを旋回してマトリックスゲル/セル混合物がウェルの縁の周りに環を形成できるようにします。
- 24ウェルプレートを37°C 5%CO2インキュベーターの右側に10分間上に置き、マトリックスゲルが部分的に硬化できるようにします。
注:インキュベーターに24ウェルプレートを入れてすぐ37°Cでマウスオルガノイドメディアの温めを開始します。 - 10分間インキュベートした後、24ウェルプレートを逆さまに反転し、さらに50分間インキュベートしてマトリックスゲルを完全に硬化させます。
- 350 μL の事前温めマウス オルガノイド メディアを各ウェルの中心にドロップワイズして追加します。
注:マトリックスゲルの完全性を維持するためには、媒体を加えながらマトリックスゲルリングを避けるのが重要である。 - メディアを加えた後、24ウェルプレートを37°C 5%CO2インキュベーターに戻します。
3. マウスオルガノイドメディアの補充 — タイミング: 10-15 分/24ウェルプレート
注:既存のメディアは、48 時間ごとに新しいメディアに置き換える必要があります。各メディアが変化する前に、事前に暖かいマウスオルガノイドメディア。補充に使用する媒体にROCK阻害剤を添加する必要はない。
- 24ウェルプレートを45°の角度で傾け、マトリックスゲルリングを避けながら、p1000ピペットを使用して各ウェルの中心から既存のメディアをゆっくりと取り外します。
- ステップ2.9のように、350 μLの事前温めマウスオルガノイドメディアを追加します。主要な栄養素と成長因子の急速な枯渇を防ぐために、5日以上培養したオルガノイドに大量の媒体(最大1mL)を加えることをお勧めします。
4. ウェスタンブロット分析のための前立腺オルガノイドからのタンパク質溶解物の抽出 — タイミング: 2.5-4 H
注:タンパク質リサート抽出のためのオルガノイドを収集する前に、調製および事前温かいディスパーゼ含有媒体(表1)。
- 手順 3.1 と同様に、各メディアからメディアを取り外します。
- オルガノイドを収集するには、1mLのディスパーゼ含有媒体を直接マトリックスゲルリングにピネリングしてマトリックスゲルを繰り返しブラストし、リング全体が外れるまでマトリックスゲルリングに移し、1.5mLマイクロ遠心管に移す。
注:ポリHEMAコーティングされた井戸との直接接触を避けることは重要です。直接接触すると、Poly-HEMAによる収集された材料の汚染を引き起こし、細胞の生存に悪影響を及ぼす可能性があります。 - 1.5 mLマイクロ遠心管を37°C5%CO2インキュベーターに30分間1時間置き、マトリックスゲルをディスパゼで完全に消化できるようにします。
- ペレットオルガノイドはRTで5分間800 x gで遠心分離し、マイクロピペットを用いて上清を除去する。
- リン酸緩衝生理食塩糸(PBS)をオルガノイドペレットに加え、軽くフリックして再サスペンドします。
注:オルガノイドペレットを十分に再中断しないと、残留ディスパーゼまたはマトリックスゲルを有するオルガノイド物質の汚染をもたらし得る。 - RTで5分間800 x gで遠心分離してオルガノイドをペレットし、マイクロピペットを使用して上清を除去する。
- 各チューブをドライアイスとメタノールを含む溶液に入れてオルガノイドペレットを速く凍結します。将来の使用が-80°Cになるまでチューブを保管してください。あるいは、ステップ4.6の直後にタンパク質リサートを抽出する。
- オルガロイドペレットを100μLのタンパク質リシス緩衝液(表1)で、パックされた細胞体積10μLあたり再分散させる。フリックして再サスペンドします。
注:速凍結後に再開する場合は、リンスファターゼおよびプロテアーゼ活性を防ぐために、リシスバッファーを直ちにサンプルに添加する必要があるため、-80°Cからサンプルを除去する前にタンパク質リシスバッファーを解凍してください。 - 少なくとも45分間氷上のタンパク質リシスバッファー内のサンプルをインキュベートする。
注:核タンパク質回収の効率を高めるために、氷上でインキュベーションする前に超音波処理することをお勧めします。しかし、超音波処理は必要ありません。超音波処理が行われない場合は、ステップ 4.10 に進みます。- 超音波処理するには、湿った氷の中にチューブを沈め、静かにマイクロ遠心管の外側にソニックディスムブラタの先端を適用します。20 kHzで40 sの超音波処理。
- 確立されたプロトコルに従ってウェスタンブロットに進みます。
5. 全実装共焦点顕微鏡による免疫組織化学分析のための前立腺オルガノイドの固定と染色
-
24ウェルプレートから前立腺オルガノイドを収集 — タイミング:45-60分
注:共焦点顕微鏡のために処理する前立腺オルガノイドを収集する場合、その構造を維持するために注意してそれらを処理することが重要です。以下の収集プロトコルは、単離時のオルガノイド構造の破壊を低減するように設計されています。- 手順 3.1 と同様に、各メディアからメディアを取り外します。
- マトリックスゲルを消化し、500μLのディスパーゼ含有媒体(表1)を37°C 5%CO2インキュベーターで30分間インキュベートします。
- 消化されたオルガノイド懸濁液をマイクロ遠心管に集め、RTで3分間800 x gで遠心分離してオルガノイドをペレット化します。
-
前立腺オルガノイドの全実装免疫蛍光染色 — タイミング: 3-4日 (1-5 時間/日)
- PBSに4%パラホルムアルデヒドの500 μLを加え、穏やかな振るみでRTで2時間インキュベートします。
- RTで800 x gで遠心分離してオルガノイドをペレットし、上清を取り除き、1mLのPBSでペレットを1mLのPBSで15分間穏やかに振る。
- ステップ5.2.2のようにペレットを2回洗います。
- RTで3分間800 x gで遠心分離してオルガノイドをペレットし、上清を除去する。ブロッキングソリューションに1μg/mL DAPIを追加します(表1)。RTで2時間、または4°Cで穏やかな振とうで一晩インキュベートする。
- RTで3分間800 x gで遠心分離してオルガノイドをペレットし、上清を除去する。一次抗体(ウサギ抗p63、マウス抗サイトケラチン8)をブロッキング溶液に添加し、穏やかな振とうで4°Cで一晩インキュベートする。
- RTで3分間800 x gで遠心分離してオルガノイドをペレットし、上清を除去する。穏やかな振り振りで15分間PBSの1 mLでペレットを洗浄します。
- ステップ5.2.6のようにペレットを2回洗います。
- RTで3分間800 x gで遠心分離してオルガノイドをペレットし、上清を除去する。二次抗体(ヤギ抗ウサギIgG-Alexa Fluor 594、ヤギ抗マウスIgG-Alexa Fluor 488)をブロッキング溶液に添加し、穏やかな振とうで4°Cで一晩インキュベートする。
- RTで800 x gで遠心分離してオルガノイドをペレットし、上清を取り除き、1mLのPBSでペレットを1mLのPBSで15分間穏やかに振る。
- ステップ5.2.9のようにペレットを2回洗います。
6. 全実装共焦点顕微鏡用染色前立腺オルガノイドの組織開失と取り付け — TIMING: 7 H
- RTで3分間800 x gで遠心分離してオルガノイドをペレットし、上清を除去する。
- 1%トリトンX-100でPBSに30%スクロースの1 mLを追加し、穏やかな振り振りでRTで2時間インキュベートします。
- RTで3分間800 x gで遠心分離してオルガノイドをペレットし、上清を除去する。
- 1%トリトンX-100でPBSに45%スクロースの1 mLを追加し、穏やかな振り振りでRTで2時間インキュベートします。
- RTで3分間800 x gで遠心分離してオルガノイドをペレットし、上清を除去する。
- 1%トリトンX-100でPBSに60%スクロースの1 mLを追加し、穏やかな振り振りでRTで2時間インキュベートします。
- RTで3分間800 x gで遠心分離してオルガノイドをペレットし、上清の95%を除去する。
注:スクロースの濃度が高くなるにつれてペレットが緩くなる。UV光の下でDAPI染色オルガノイドを観察し、上清の除去中に失われていなかったことを確認することをお勧めします。 - 残りの懸濁液の10~20°Lの液滴をチャンバ入カバースリップに移し、共焦点顕微鏡に進みます。
注:カバースリップフラグメントは、スペーサーとして使用する液滴の両側に配置できます(図4C)。これらは、カバースリップが液滴の上に置かれたときにオルガノイドが崩壊するのを防ぎます。
結果
前立腺上皮細胞は、下流分析の準備の前に収穫されるオルガノイドを形成するマウスオルガノイド培養物にめっきされる(図1)。
基底および発光上皮細胞は、FACSを用いて単離される。DAPI+細胞を除外し、Lin+細胞(CD45、CD31、Ter119)を枯渇させた後、基底細胞と発光細胞はEpCAMとCD49fの微分発現に基づいて区別される(図2)。前立腺基底細胞と発光細胞をオルガノイド培養にプレート化するアプローチには、(1)めっき細胞をマトリックスゲルリングに、(2)ポリHEMAでウェルドをコーティングする必要があります。環へのめっきは、以前にAgarwal et al9で説明されています。このアプローチ(図3A)を利用することで、研究者は媒体を補充しながらマトリックスゲルをより簡単に回避し(ステップ3)、井戸の円周に従うことによってオルガノイドをより容易に数えることを可能にする。ポリHEMAによるコーティングウェルは、網膜オルガノイド17における2Dコロニー形成を防止することが示されている。しかしながら、このアプローチは前立腺オルガノイドモデルでは利用されていない。重要なことに、ポリHEMA(表3)によるコーティングウェルは、オルガノイド形成を妨げることなく2Dコロニーの発生を排除する(図3B)。これらの修飾は前立腺オルガノイドアッセイの能力を拡大する。
基底細胞と発光細胞は、異なる形態を持つオルガノイドを形成する(図4A)。ほとんどの基底由来オルガノイドは、培養後7日後のサイズ(直径100~300μm)が似ていますが、発光由来オルガノイドは有意な不均一性(直径30~450μm)を示します。さらに、ほとんどの基底由来オルガノイドには、多層上皮に囲まれたルーメン(図4A、上)が含まれているのに対し、ルミナル由来のオルガノイドは中空から形態の範囲であり、単層上皮は固体に、多層コードは運河化しない細胞を有する(図4A、底部)。下流解析用のオルガノイドを調製するために上述したアプローチ(ステップ4、5)は、これらの表現型の違いが系統マーカー発現の違いを反映しているかどうかを調べるために用いた。ウェスタンブロット分析は、基底および発光由来のオルガノイドが基底および発光一次細胞に関連する特徴を保持することを明らかにした。基底由来オルガノイドは、基底マーカーサイトケラチン5(K5)のより高いレベルを発現し、一方、ルミナル由来オルガノイドは、発光マーカーサイトケラチン8のより高いレベルを発現する(図4B)。基底マーカーと発光マーカーの両方がバルク集団の基底および発光由来オルガノイドで検出され、おそらく分化を示唆している(図4B)。
基底由来オルガノイドにおける系統マーカー発現を特徴付け、無傷のオルガノイドを染色し共焦点顕微鏡を行うことにより、形態学的に異なる発光由来オルガノイドがマーカー発現に差異を示すかどうかを判断しようとした(図4D)。基底由来オルガノイドは、基底マーカーp63の高レベルと発光マーカーK8の中程度のレベルを表す外層を有する多層上皮を含み、p63の検出可能なレベルと高レベルのK8(p63lo、K8hi)(図4D、トップ)を検出できない内層を含んでいた。単層発光由来オルガノイドのすべての細胞がK8に対して陽性染色されたのに対し、選択した細胞のみが核p63を含んでいた(図4D、底部)。これらのデータは、ウェスタンブロットまたは共焦点顕微鏡による分析のためのオルガノイドを収穫し、調製するアプローチを検証し、それによって分化を含む主要な細胞プロセスを研究するためにオルガノイドアッセイの能力を拡大する。
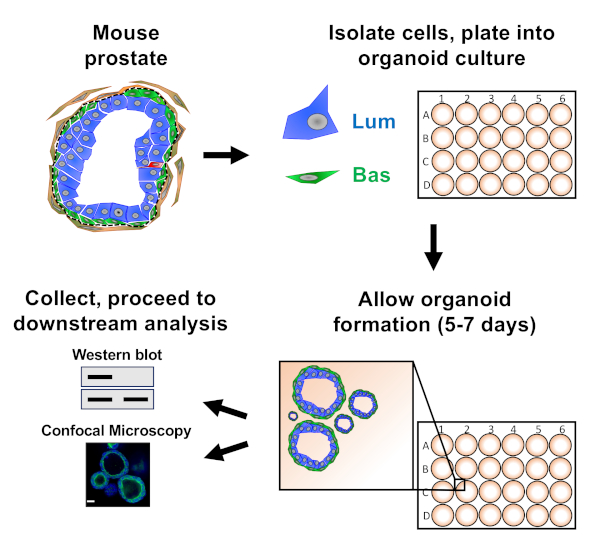
図1:収集および分析のための前立腺オルガノイドを生成するワークフローを示す概略図。全マウス前立腺は解離し、基底および発光前立腺上皮細胞は、確立されたプロトコル18、19を介して蛍光活性化細胞選別によって単離される。マウスオルガノイドメディアとマトリックスゲルの混合物中に懸濁した基底または発光細胞は、マトリックスゲルリングにめっきされる。培養5~7日後、オルガノイドはウェスタンブロットまたは共焦点顕微鏡による分析のために採取される。この図の大きなバージョンを表示するには、ここをクリックしてください。
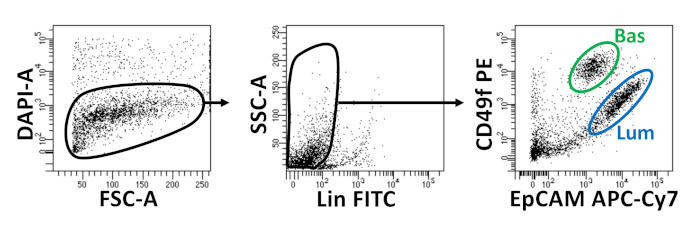
図2:蛍光活性化細胞選別(FACS)を用いたマウス基底および発光前立腺上皮細胞の単離。マウス前立腺からの解離細胞は、DAPIで染色され、死細胞と生細胞、および表面抗体と区別し、FACSの前に基底細胞と発光細胞を区別する。左 = DAPI- セルのゲート。FSC-A = 前方散乱。中心 = リン上のゲート-セル (CD45lo, CD31lo, Ter119lo)SSC-A = 横散乱。右 = 基底細胞 (Bas) (EpCAMこんにちは, CD49fこんにちは),ルミナルセル (Lum) (EpCAMこんにちは, CD49fミッド).この図の大きなバージョンを表示するには、ここをクリックしてください。
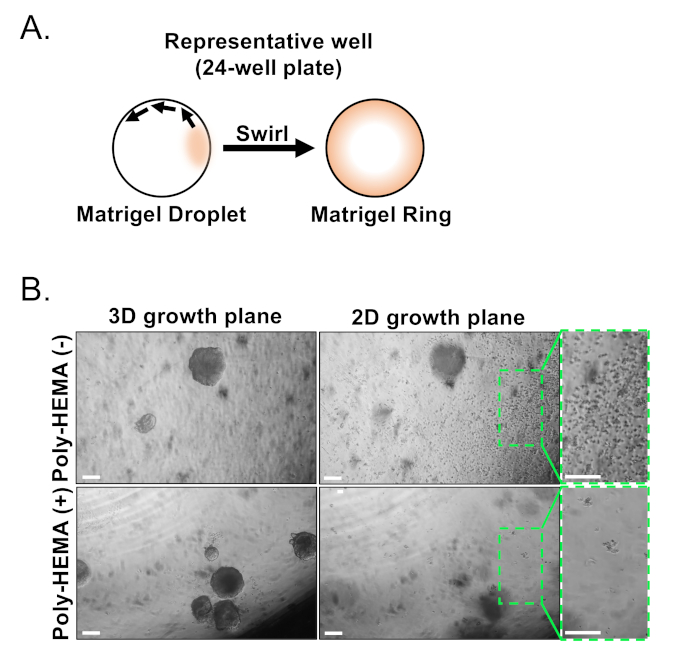
図3:マウス前立腺オルガノイドの確立(A)24ウェルプレートのウェルにマトリックスゲルリングを生成するアプローチを示す模式図。(B)オルガノイド(3D成長面)および2次元コロニー(2次元成長面)の代表的な位相コントラスト画像は、前立腺上皮細胞を未被覆(Poly-HEMA(-))にめっきした7日後に形成され、または被覆(ポリHEMA(+))24ウェルプレート。2D成長面内のボックス化された領域は、右側に拡大されます。スケールバー = 200μm.ここをクリックすると、この図の大きなバージョンが表示されます。
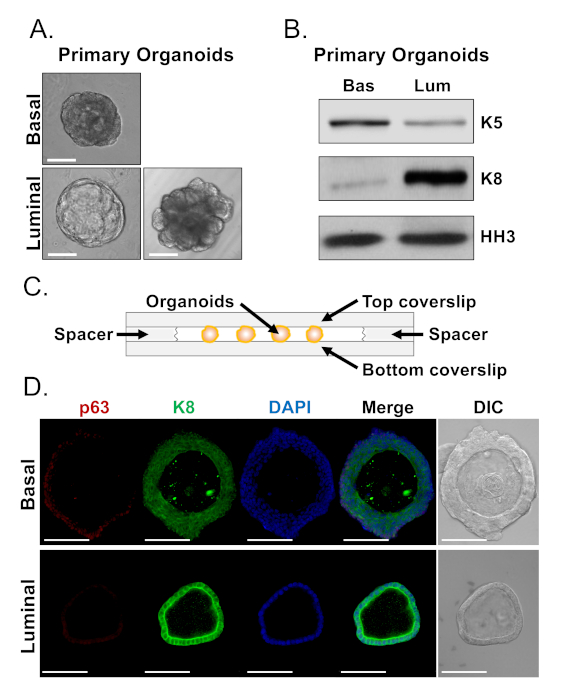
図4:ウェスタンブロットと全マウント共焦点顕微鏡による前立腺オルガノイドにおける系統マーカー発現の解析(A)代表的な相は、7日間培養した後の基底由来(上)、および発光由来(下)オルガノイドの画像を対比した。スケールバー = 100μm. (B) 培養5日後の基底由来(Bas)および発光由来(Lum)オルガノイドのウェスタンブロット分析。基底マーカーに対する染色は、サイトケラチン5(K5)、及び発光マーカーと、サイトケラチン8(K8)、及びローディング制御と、ヒストンH3(HH3)である。(C)スペーサー付きチャンバーカバースリップを示す模式図(D)代表的な微分干渉コントラスト(DIC)および7日間培養後の基底由来(上)および発光由来(下)オルガノイドの免疫蛍光画像。p63(赤)、K8(緑)およびDAPI(青)の染色を個別にマージした。スケールバー = 100μm.ここをクリックすると、この図の大きなバージョンが表示されます。
| レシピ | |
| ディスパーゼ含有媒体 | 1 mg/mL ディスパーゼ + 10 μM ROCK 阻害剤進行 DMEM F12.0.22μmフィルターを使用して殺菌するフィルター。 |
| 解離媒体 | RPMI 1640の10%FBS+1xペニシリン-ストレプトマイシン。0.22μmフィルターを使用して殺菌するフィルター。 |
| タンパク質リシスバッファー | RIPA緩衝液 +ホスファターゼ阻害剤+プロテアーゼ阻害剤 |
| ブロッキングソリューション | 0.2% トリトン X-100 の PBS の 10% FBS |
表 1: 主要なソリューションの準備手順
| コンポーネント | 濃度 |
| B-27 (潜水艦) | 1x(50x濃縮物から希釈) |
| グルタマックス | 1x(100x濃縮物から希釈) |
| N-アセチル-L-システイン | 1.25 mM |
| ノルモシン | 50グラム/mL |
| 組換えヒトEGF、無動物 | 50 ng/mL |
| 組換えヒトノギン | 100 ng/mL |
| R-スポンディン 1コンディショニングメディア | 10% 条件付きメディア |
| A83-01 | 200 nM |
| Dht | 1 nM |
| Y-27632 二塩酸塩(ROCK阻害剤) | 10μM |
| 高度なDMEM/F-12 | 基本メディア |
| R-スポンジン1条件媒体は、ドロスト、他の13に記載されているように生成される。すべてのコンポーネントを添加した後、0.22μmフィルタを使用してマウスオルガノイドメディアを殺菌します。ROCK阻害剤は、オルガノイドの培養および通過の間にのみ添加される。 | |
表2:マウスオルガノイドメディアの調製手順
| ポリHEMAコーティングプレートを調製するためのプロトコル | |
| 1 | 0.25 g ポリヘマを 50 mL 98% EtOH に加えます。シェーカーでポリヘマを37°Cで溶解します。このプロセスには少なくとも 4 時間かかります。 |
| 2 | フィルターは0.22μmフィルターを使用してポリ-HEMAを殺菌する。 |
| 3 | 24ウェルプレートのウェルあたり200°LのポリHEMA溶液を追加します。 |
| 4 | Poly-HEMAを追加した後、24ウェルプレートから蓋を取り外し、溶液が一晩蒸発するようにします。 |
| 5 | PBSでそれぞれを2回よく洗い、最終洗浄後に保管する前に井戸が完全に乾燥していることを確認してください。注:洗浄中にポリHEMAコーティングを中断すると、上皮細胞をオルガノイド培養にめっきした際に2次元成長に寄与する可能性があります。ポリHEMAコーティングされた井戸の損傷を防ぐために、洗濯中にピペット先端に直接接触しないようにしてください。ポリHEMAコーティングされた井戸の完全性は、ポリHEMAがピペット先端によって削り取られなければそのまま残ります。 |
| 6 | ポリHEMAコーティングされた版は2週間まで4 °Cで貯えることができる。メモ:保管前にパラフィルムにプレートをラッピングすると、汚染のリスクが軽減されます。 |
表3:ポリHEMAコーティングプレートの調製のためのプロトコル。
ディスカッション
前立腺上皮細胞分化は、正常前立腺生物学2、3、4、5、6、7および疾患生物学8、10、11、12の両方に関与している。ただし、このプロセスのマスターレギュレータは未定義のままです。前立腺上皮細胞分化の主要な調節装置を同定することは、それをモデル化するための確立された文脈がないため、部分的に困難であった。2D単層培養は分化11、12をモデル化するために使用することができるが、この文脈は複雑な前立腺微小環境を再現することができない。さらに、モデルの差別化に対する生体内の文脈では、操作に挑戦しているので、機械的な研究に適していません。したがって、操作しやすい、しかも生理的に関連する文脈の同定は、分化を研究することが重要である。
前立腺オルガノイドモデルは、発光分化に基底が起こることが報告されているエレガントなex vivoコンテキストを表す。前立腺オルガノイドを確立する方法は十分に確立されている14;ただし、これらのメソッドをさらに最適化する必要があります。さらに、分析のために前立腺オルガノイドを収穫し、調製するアプローチは明確に説明されていない。本論文では、マウス前立腺からオルガノイド培養に分離した前立腺上皮細胞をプレート化するアプローチについて述べた。このアプローチにより、研究者は(1)オルガノイド形成中の2Dコロニーの発生を防止し、(2)媒体補充中にマトリックスゲルに破壊されるリスクを低減し、(3)オルガノイドをより効果的にカウントすることができます。さらに、この原稿は、ウェスタンブロット分析、または全マウント共焦点顕微鏡の準備のためのオルガノイドを収穫するためのアプローチを概説する。重要なことに、共焦点顕微鏡用のオルガノイドを調製するために利用されるアプローチは、その持続時間を通じてオルガノイドの無傷の構造を維持し、画像取得前のオルガノイド損傷を減少させる。全体として、説明されたアプローチは、前立腺オルガノイドアッセイの能力を拡大する。
特に、基底細胞および発光細胞のオルガノイド形成能は、それぞれの集団を単離するために使用される方法および培養条件の両方によって変化させることができる。このアッセイに用いられるオルガノイド培養条件は、まずカルトハウスら13で説明した。一方、カルトハウスらは基底細胞がより高いオルガノイド形成能力を有すると報告している(15%)発光細胞(1%)13より、Chuaら、明確な単離方法および培養条件を用いて、発光細胞(0.2-0.3%)基底細胞よりも高いオルガノイド形成能を有する (0.03%)20.全体的に、Karthausらによって記述される方法は、基底細胞および発光細胞の両方に対してより高いオルガノイド形成率をもたらし、基底細胞および発光細胞13を単離するために使用されるアプローチの違いを反映する可能性が高く、発光細胞からのオルガノイド形成に対して偏る培養条件とは対照的である。この原稿に記載されているプロトコルが、多能性ルミネタール前駆体からの発光オルガノイド形成を支持するか、またはコミットされた発光前駆体9を支持するかは不明である。タイムリーでコストがかかりつながらも、生体内の系統トレース研究は、オルガノイドアッセイで解明された別個の前立腺上皮系統に関連する前駆体特徴を検証するために使用することができる。
発達、分化、形質転換などのプロセスは、前立腺生物学だけでなく、脳、肺、腸、膵臓、肝臓などの他の組織の生物学にも関連しています。記載された方法は、前立腺だけでなく、組織の広い範囲でこれらのプロセスを研究するためにオルガノイドモデルの利用を容易にする。
開示事項
著者たちは何も開示する必要はない。
謝辞
PDCおよびJMGはルース・L・キルシュシュタイン国立研究サービス賞GM007185によってサポートされています。JADは、国立衛生研究所総合医学研究所(R25GM055052)がT.ハッソンとソール・マルティネス奨学金に授与しています。ASGはスピッツァーファミリー財団基金とギル・エンダウメントの支援を受けています。この作品は、アメリカ癌学会(RSG-17-068-01-TBG)、国防総省(W81XWH-13-1-0470)、マーガレットEによってサポートされました。早期医学研究信託、NIH/NCI(前立腺癌におけるP50CA092131/UCLA SPORE)、ローズヒルズ財団、UCLAのジョンソン総合がんセンター、広い幹細胞研究センター、臨床翻訳科学研究所、泌尿器科腫瘍学研究所からの支援。
資料
| Name | Company | Catalog Number | Comments |
| µ-Dish 35 mm, high | ibidi | 81156 | |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 50-980-487 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | D1306 | |
| A83-01 | Tocris | 2939 | |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634010 | |
| APC/Cy7 anti-mouse CD326 (Ep-CAM) Antibody, 100 μg | BioLegend | 118218 | |
| B-27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| Complete Protease Inhibitor Cocktail | Sigma | 11836145001 | |
| (DiHydro)testosterone (5α-Androstan-17β-ol-3-one) | Sigma | A-8380 | |
| Dispase II, Powder | Thermo Fisher Scientific | 17-105-041 | |
| Fetal Bovine Serum (FBS) | Sigma | F8667 | |
| FITC anti-mouse CD31 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 102405 | |
| FITC anti-mouse CD45 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 103107 | |
| FITC anti-mouse TER-119/Erythroid Cells Antibody (0.5 mg/mL, 50 μg) | BioLegend | 116205 | |
| Goat anti-mouse IgG-Alexa Fluor 488 | Invitrogen | A28175 | |
| Goat anti-rabbit IgG-Alexa Fluor 594 | Invitrogen | A11012 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Halt Phosphatase Inhibitor | Thermo Fisher Scientific | 78428 | |
| Matrigel GFR Membrane Matrix | Corning | CB-40230C | |
| Mouse anti-cytokeratin 8 | BioLegend | 904804 | |
| N-acetyl-L-cysteine | Sigma | A9165 | |
| Normocin | Thermo Fisher Scientific | ant-nr-1 | |
| PE anti-human/mouse CD49f Antibody | BioLegend | 313612 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15-140-122 | |
| Poly(2-hydroxyethyl methacrylate) (Poly-HEMA) | Sigma | P3932-25G | |
| Rabbit anti-p63 | BioLegend | 619002 | |
| Radioimmunoprecipitation assay (RIPA) | Thermo Fisher Scientific | PI89901 | |
| Recombinant Human EGF, Animal-Free | PeproTech | AF-100-15 | |
| Recombinant Human Noggin | PeproTech | 120-10C | |
| RPMI 1640 Medium, HEPES (cs of 10) | Thermo Fisher Scientific | 22400105 | |
| Sonic Dismembrator | Thermo Fisher Scientific | FB120 | |
| Sucrose | Sigma | S0389-500G | |
| Triton X-100 | Sigma | X100-5ML | |
| Y-27632 dihydrochloride (ROCK inhibitor) | Selleck Chemical | S1049-50MG |
参考文献
- Kwon, O. J., Xin, L. Prostate epithelial stem and progenitor cells. American Journal of Clinical and Experimental Urology. 2 (3), 209-218 (2014).
- Choi, N., Zhang, B., Zhang, L., Ittmann, M., Xin, L. Adult Murine Prostate Basal and Luminal Cells Are Self-Sustained Lineages that Can Both Serve as Targets for Prostate Cancer Initiation. Cancer Cell. 21 (2), 253-265 (2012).
- Ousset, M., Van Keymeulen, A., et al. Multipotent and unipotent progenitors contribute to prostate postnatal development. Nature Cell Biology. 14 (11), 1131-1138 (2012).
- Wang, J., et al. Symmetrical and asymmetrical division analysis provides evidence for a hierarchy of prostate epithelial cell lineages. Nature Communications. 5, 1-13 (2014).
- Wang, Z. A., Mitrofanova, A., et al. Lineage analysis of basal epithelial cells reveals their unexpected plasticity and supports a cell-of-origin model for prostate cancer heterogeneity. Nature Cell Biology. 15 (3), 274-283 (2013).
- Kwon, O. J., Zhang, B., Zhang, L., Xin, L. High fat diet promotes prostatic basal-to-luminal differentiation and accelerates initiation of prostate epithelial hyperplasia originated from basal cells. Stem Cell Research. 16 (3), 682-691 (2016).
- Kwon, O. J., Zhang, L., Ittmann, M. M., Xin, L. Prostatic inflammation enhances basal-to-luminal differentiation and accelerates initiation of prostate cancer with a basal cell origin. Proceedings of the National Academy of Sciences. 192 (3), 997-999 (2014).
- Stoyanova, T., et al. Prostate cancer originating in basal cells progresses to adenocarcinoma propagated by luminal-like cells. Proceedings of the National Academy of Sciences. 110 (50), 20111-20116 (2013).
- Agarwal, S., Hynes, P. G., et al. Identification of Different Classes of Luminal Progenitor Cells within Prostate Tumors. Cell Reports. 13 (10), 2147-2158 (2015).
- Ku, S. Y., et al. Rb1 and Trp53 cooperate to suppress prostate cancer lineage plasticity, metastasis, and antiandrogen resistance. Science. 355 (6320), 78-83 (2017).
- Mu, P., et al. SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science. 355 (6320), 84-88 (2017).
- Bishop, J. L., et al. The Master Neural Transcription Factor BRN2 Is an Androgen Receptor-Suppressed Driver of Neuroendocrine Differentiation in Prostate Cancer. Cancer Discovery. 7 (1), 54-71 (2016).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Drost, J., Karthaus, W. R., et al. Organoid culture systems for prostate epithelial and cancer tissue. Nature Protocols. 11 (2), 347-358 (2016).
- McCray, T., Richards, Z., Marsili, J., Prins, G. S., Nonn, L. Handling and Assessment of Human Primary Prostate Organoid Culture. Journal of Visualized Experiments. (143), e59051(2019).
- Lawson, D. A., Xin, L., Lukacs, R. U., Cheng, D., Witte, O. N. Isolation and functional characterization of murine prostate stem cells. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 181-186 (2007).
- Chen, H. Y., Kaya, K. D., Dong, L., Swaroop, A. Three-dimensional retinal organoids from mouse pluripotent stem cells mimic in vivo development with enhanced stratification and rod photoreceptor differentiation. Molecular vision. 22, 1077-1094 (2016).
- Liu, X., et al. Low CD38 Identifies Progenitor-like Inflammation-Associated Luminal Cells that Can Initiate Human Prostate Cancer and Predict Poor Outcome. Cell Reports. 17 (10), 2596-2606 (2016).
- Lukacs, R. U., Goldstein, A. S., Lawson, D. A., Cheng, D., Witte, O. N. Isolation, cultivation and characterization of adult murine prostate stem cells. Nature protocols. 5 (4), 702-713 (2010).
- Chua, C. W., Shibata, M., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nature Cell Biology. 16 (10), 951-961 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved