Method Article
测量个体果蝇黑色素气器酒精镇分时间的高通量方法
摘要
目前测量果蝇酒精敏感性的方法旨在测试苍蝇群。我们提出了一种简单、低成本、高通量的测定,用于评估大量单蝇的酒精镇镇敏感性。该方法不需要专用工具,可在任何实验室使用常用材料进行。
摘要
果蝇黑色素气仪为研究酒精敏感性的遗传基础提供了一个很好的模型。与对人类的研究相比,果蝇模型允许严格控制遗传背景,在不受监管限制和相对较低的成本的情况下,几乎无限数量的同一基因型个体可以在不受监管限制和相对较低的成本的情况下迅速饲养。接触乙醇的苍蝇经历类似于人类酒精中毒的生理和行为变化,包括丧失姿势控制、镇镇和耐受性。在这里,我们描述了一种简单、低成本、高通量测定,用于评估大量单蝇的酒精镇镇敏感性。该测定基于在24孔细胞培养板中引入的单个苍蝇的视频记录,这种培养板能够同步启动酒精暴露。该系统使一个人能够在8小时的工作时间内收集多达2,000只苍蝇的单个乙醇镇化数据。原则上,可以扩大该测定的范围,以评估暴露于任何挥发性物质的影响,并用于测量挥发物急性毒性对其他昆虫,包括其他苍蝇物种的影响。
引言
国家酒精滥用和酒精中毒研究所报告说,2015年,被指定为"酒精使用障碍"的过度饮酒影响了美国约1 600万人。酒精滥用引起广泛的不良生理影响,是美国的主要死亡原因。在人类中,敏感性降低或对酒精反应水平低,具有很强的遗传成分,并且与患酒精使用障碍的风险较高1,1,2,3,4。2,3,4由于人口混合、不同的发育史和环境暴露,以及依靠自报问卷来量化与酒精相关的表型,因此对人类种群的遗传风险研究具有挑战性,这些表型往往与其他神经精神病条件混淆。
果蝇黑色素加斯特提供了一个优秀的模型,以研究酒精敏感性的遗传基础5,5,6,7,8。,7,8果蝇模型允许严格控制遗传背景,在不受监管限制和相对较低的成本的情况下,几乎无限数量的同一基因型个体可以在控制良好的环境条件下迅速饲养。除了公开提供的突变和RNAi系,针对基因组中的大多数基因,果蝇黑色素基因参考小组(DGRP),一个人口205近亲野生派生线与完整的基因组序列,已经使全基因组关联研究9,10。109这些研究已经确定了与发育时间和生存能力对发育时间的影响有关的遗传网络11,12。,12基本生物过程的进化保护使得通过将人类正交器叠加到其飞行对应物上来得出转化推理。
接触乙醇的苍蝇经历类似于人类酒精中毒的生理和行为变化,包括丧失姿势控制8、镇化以及耐受性13、14、15。14,1513酒精诱导镇平在果蝇可以量化使用测光仪。这些是122厘米长的垂直玻璃柱,带有倾斜的网状隔板,苍蝇可以附着16、17、18。,17,18在柱的顶部引入至少50只苍蝇(性别可以单独分析),并暴露于乙醇蒸气中。失去姿势控制的苍蝇会从柱子上掉下来,每隔1分钟收集一次。平均洗脱时间是衡量酒精中毒的敏感性的尺度。当苍蝇在第一次接触后第二次接触酒精时,它们就会产生耐受性,从平均洗脱时间13、15、19、20,19,的变化中可以明显看出。13,20而测值仪测定结果已导致基因、遗传网络和细胞通路的识别,这些基因、遗传网络和细胞通路与酒精镇定敏感性和耐受性12、13、14、21,14,的发展有关,而该测定是耗时的、低通量的,对测量单蝇的酒精敏感性无效。12,21
替代乙醇镇静测定,不需要精心设计的测压仪设置允许更方便的测量,但仍然有限的吞吐量,一般需要分析苍蝇群,而不是个人21,22,23,24,25。21,22,23,24,25评估单只苍蝇会最大限度地减少因群体互动(如社会行为引起的相互作用)而产生混淆效应的可能性。在这里,我们提出了一种简单、低成本、高通量的测定,用于评估大量单蝇的酒精镇镇敏感性。
研究方案
1. 测试装置的建造
- 通过追踪纸板上的板材并切出指定区域,创建一个 24 孔细胞培养板大小的纸板模板。
- 使用步骤 1.1 中的纸板模板切割一块细胞培养板大小的小昆虫屏幕网格。
- 使用热胶枪在板顶周周围放置一小行热胶,并将网网贴在开井顶部,准备一个 24 孔的细胞培养板。
- 使用热胶枪将木工艺棒固定在同一细胞培养板的三面上。修改后的细胞培养板现在应类似于图1A所示的板图和图2所示的实验设置。
注:准备至少和拍摄室一样多的细胞培养板(见下文)。
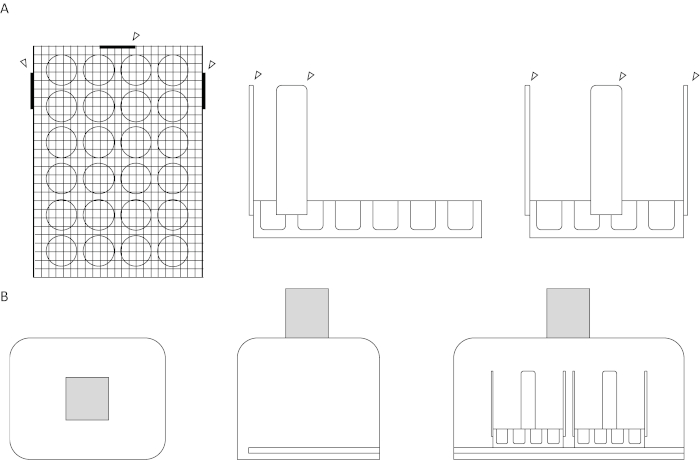
图1:测试装置和拍摄室图。(A) 上图。分别显示测试装置的顶部、侧面和正面视图。屏幕网格平放在 24 孔细胞培养板的顶部。以箭头为代表的木船杆与三个相邻的侧面相连,用于稳定性和对齐辅助,两根在井板的一侧,有六口井,一根在板的侧面,有四口井。所有附件都热粘在设备上。(B) 下图。分别显示测定设置的顶部、侧面和正面视图。在盒子的右侧切割一个狭缝,从盖子的开口到开口的背面,从狭缝水平的底部到内表面。盒子顶部的孔与地面平行,居中,可实现最大的视频曝光。带影框表示摄像机。请点击此处查看此图形的较大版本。

图2:测定系统的照片。摄像机放置在聚苯乙烯室的顶部,镜头插入切口孔中,如图 1B的图所示。两组经过修改的 24 孔细胞培养板位于一个照明垫的顶部,该垫插入到造型室侧面的缝隙中。请点击此处查看此图形的较大版本。
2. 建造拍摄室
- 通过在聚苯乙烯盒侧面切割摄像机镜头大小的孔,创建拍摄室。在聚苯乙烯盒的另一侧切割照明垫的宽度。拍摄室应类似于图1B和图2所示的拍摄室。
- 通过将照明垫插入狭缝并将摄像机定位到照明垫上方的镜头孔中,准备拍摄室使用。
- 将所有材料放置,并在受控环境中执行所有后续测试,最好是湿度约为 30%、25°C 温度、均匀气流和噪音低于 65 分贝的行为室。
3. 准备测试装置和苍蝇
- 移液器 1 mL 100% 乙醇通过网网进入每个井。
- 用一块奶酪布擦干网。
- 使用步骤 1.1 中创建的纸板模板,切割两块细胞培养板的尺寸。将它们放在步骤 3.2 中含有乙醇的改性细胞培养板的干网顶部。
- 通过在步骤 1.1 中创建的纸板模板周围进行跟踪,并在其中一个短边上将跟踪区域扩大 1⁄2 厘米,创建一小块薄而灵活的塑料切割板。从薄而灵活的塑料切割板中切出扩展的跟踪区域。切割后,确保塑料仍适合测试装置上的三根木工艺棒,但将一端悬挂 1⁄2 厘米。
- (可选)如果需要创建吸气器,请先将 P1000 移液器尖端切成两半,组装如图3所示的吸气器。将直径较大的件插入约 30 厘米柔性管的一端,作为喉舌。

图3:一个苍蝇吸气器,其中苍蝇被收集与柔性管和宽孔血清移液器与棉纱布塞块可互换的喉舌。操作员可以在不麻醉的情况下将一只苍蝇吸进移液器进行转移。请点击此处查看此图形的较大版本。
- (可选)要完成吸气器组件,请用纱布盖住 10 厘米的血清移液器的宽端,以防止苍蝇进入管道,然后将移液器首先插入管道的打开端,作为飞室。吸气器应类似于图 3所示。
- 使用吸气器(图3,步骤3.5和3.6),每口吸进一个单独的24孔细胞培养板。使用柔性塑料覆盖任何含有以前吸气苍蝇的油井。记录每只苍蝇的井位和任何相关的基因型或表型信息。
- 将柔性塑料冲洗,将包含苍蝇的细胞培养板顶部保持,以防止它们逃逸,并将板与乙醇一起反转到改性细胞培养板的顶部。柔性塑料片应放在奶酪布片上。使用工艺棒对齐包含苍蝇的倒置细胞培养板,确保每个孔与含有苍蝇的每个孔对齐。
- 实验设置应类似于图2。
4. 测试苍蝇
- 确保照明垫以全亮度亮起,以实现最大的视觉对比度。使用摄像机开始录制。
- 要将苍蝇暴露在乙醇中,请小心地将塑料从井板和测试装置之间取出,注意不要脱掉奶酪布。
- 一旦所有苍蝇都失去姿势控制,终止视频录制。一旦怀疑所有苍蝇都失去了姿势控制,就牢牢地敲击板的中心,以确保所有苍蝇完全失去姿势控制。如果有移动,请继续记录。继续定期点击(每 1⁄2 分钟一次),直到没有移动。
- (可选)要快速恢复苍蝇,请仅从测试装置中取出顶板,露出躺在奶酪布上的镇静苍蝇。吸气单个苍蝇进入选定的容器进行回收。
- 将改性细胞培养板中的乙醇更换为每小时至少1倍的新鲜100%乙醇,以控制乙醇的蒸发和加湿,并在整个测定过程中保持乙醇的一致暴露。用奶酪布擦干网。
- 根据需要对尽可能多的样本重复上述步骤。
注:为了达到最高吞吐量,在视频录制期间将下一轮苍蝇吸入新的细胞培养板。协议可以在这里暂停,因为视频录制可以稍后查看。
5. 确定苍蝇镇定时间
- 通过观看视频录制,记录每个飞行的镇流时间。镇定时间的定义是苍蝇失去完全的姿势控制和运动能力的时刻。建议反向观看影片,并记录苍蝇开始移动的时间,以确保准确性。
结果
两个24孔微化板可以同时生成数据,48个单独的苍蝇在短短10分钟内。表1列出了48个单独苍蝇,男性和女性分别,两个DGRP线对接触酒精和活力的不同的敏感性的测量值13。线RAL_555的苍蝇比线RAL_177敏感(图4,表2;p< 0.0001,ANOVA)。RAL_177的男性和女性没有性畸形效应(图4,表2;p> 0.1,ANOVA),而线RAL_555的女性对乙醇接触的敏感性低于男性(图4,表2;p<0.006,ANOVA)。可以同时测量的大量苍蝇,以及同时测量性别和不同线条的能力,可以通过减少环境变化引起的误差来提高精度。
| A. | 乙醇镇化时间 | B。 | 乙醇镇化时间 | ||||||||||
| 女性 | 男性 | 女性 | 男性 | ||||||||||
| 414 | 365 | 477 | 423 | 568 | 309 | 937 | 742 | 622 | 460 | 331 | 498 | ||
| 201 | 384 | 498 | 411 | 523 | 626 | 791 | 619 | 197 | 467 | 455 | 562 | ||
| 228 | 364 | 333 | 440 | 403 | 267 | 504 | 744 | 513 | 570 | 582 | 506 | ||
| 440 | 416 | 404 | 408 | 422 | 384 | 970 | 540 | 369 | 865 | 533 | 492 | ||
| 888 | 283 | 285 | 322 | 369 | 287 | 595 | 550 | 606 | 392 | 544 | 345 | ||
| 1079 | 519 | 315 | 393 | 376 | 284 | 418 | 709 | 553 | 308 | 477 | 388 | ||
| 718 | 287 | 432 | 275 | 206 | 411 | 366 | 564 | 558 | 385 | 576 | 377 | ||
| 598 | 337 | 398 | 279 | 631 | 372 | 437 | 692 | 578 | 460 | 511 | 412 | ||
| 241 | 398 | 364 | 347 | 374 | 808 | 665 | 729 | 484 | 532 | 425 | 354 | ||
| 229 | 423 | 534 | 386 | 396 | 628 | 312 | 576 | 305 | 334 | 531 | 506 | ||
| 388 | 488 | 451 | 523 | 322 | 533 | 682 | 638 | 420 | 560 | 548 | 379 | ||
| 252 | 529 | 375 | 427 | 330 | 540 | 1045 | 741 | 708 | 832 | 509 | 472 | ||
| 674 | 401 | 303 | 401 | 307 | 311 | 394 | 675 | 381 | 477 | 449 | 784 | ||
| 303 | 453 | 351 | 429 | 525 | 262 | 540 | 690 | 520 | 556 | 495 | 226 | ||
| 258 | 483 | 302 | 389 | 562 | 319 | 356 | 615 | 336 | 454 | 524 | 590 | ||
| 346 | 426 | 385 | 416 | 596 | 287 | 626 | 678 | 840 | 634 | 677 | 509 | ||
表1:RAL_177和(B)RAL_555的个别苍蝇的乙醇镇化时间(s)的测量值(n = 48)。.另请参阅表2,图4。
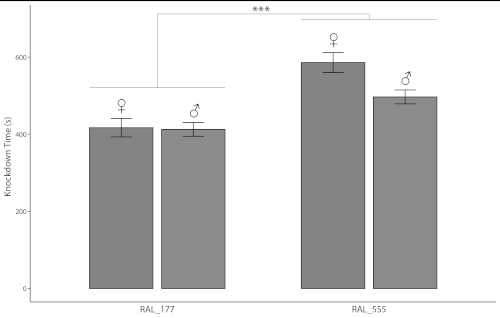
图 4:dGRP 线RAL_177和RAL_555的酒精镇镇化时间。条形表示值,误差条 SEM (n = 48)。RAL_177苍蝇的镇子时间小于RAL_55苍蝇的镇子时间(p < 0.0001,ANOVA)。表 1中指示各个数据点。案文和表2中还指明了性别和行之间的其他统计显著差异。请点击此处查看此图形的较大版本。
| 分析 | 变异源 | Df | SS | F 值 | P 值 |
| 完整模型池 | 线 | 1 | 769627 | 34.869 | <0.0001 |
| 性 | 1 | 105001 | 4.757 | 0.0304 | |
| 线 x 性别 | 1 | 86021 | 3.897 | 0.0498 | |
| 错误 | 188 | 4149491 | |||
| 减少模型女性 | 线 | 1 | 685126 | 23.58 | <0.0001 |
| 错误 | 94 | 2730718 | |||
| 减少模型男性 | 线 | 1 | 170522 | 11.3 | 0.0011 |
| 错误 | 94 | 1418774 | |||
| 减少模型RAL_177 | 性 | 1 | 473 | 0.023 | 0.8800 |
| 错误 | 94 | 1943741 | |||
| 减少模型RAL_555 | 性 | 1 | 190549 | 8.12 | 0.0054 |
| 错误 | 94 | 2205751 | |||
表2:性别和DGRP线镇平时间差异分析。使用的模型为Y = = = + L = S = L = LxS =,其中=是总体平均值,L是 DGRP 线的固定效果(RAL_177,RAL_555),S 是性别(男性、女性)的固定效果,LxS是交互术语(固定),α是误差项。 S模型Y = = = L = 和 Y = = = S =用于减小的模型。 S线,性别和线 x 性别互动术语都具有重要意义的完整模型在 +< 0.05。按性别和 DGRP 线RAL_555减少的模型在 < 0.01 也显著。另请参阅表 1,图 4。df = 自由度,SS = 类型 I 平方和数。
讨论
在这里,我们提出了一种简单、廉价、高通量的方法,用于评估由于果蝇醇丙醇的乙醇暴露引起的镇理时间。与许多当前需要组分析的方法不同,此测定使单个人员能够在 8 小时工作时间内收集 2,000 条苍蝇的单个镇节时间数据。我们发现,一个人可以得分48苍蝇的镇定时间在大约5分钟。以这个速度,2000只苍蝇可以在大约4小时内得分,但稍后可以进行评分。通过我们的测定,大多数苍蝇的镇水时间从5-15分钟到1mL的100%乙醇。乙醇浓度降低或输送量变小将导致镇化时间延长。
现时评估镇流时间的方法,需要测试大量苍蝇,而无须,轻易对单位15、16、17、18、19、20、21、22、23、24、25、26,16,17,18,19,20,21进行测量。22,23,24,25,26许多目前的镇静和敏感性测定依赖于ST50 22,23,24,该时间点50%的苍蝇由于乙醇暴露而镇静。22,23,24虽然获得ST50的苍蝇组不是开发这种测定的主要动机,但与目前的方法相比,录像的效用更高,因为录音可用于确定单独测试的苍蝇群的ST50,并测量满足给定标准的苍蝇的百分比(例如,姿势控制损失)。应当指出,这种视频分析需要更多的时间。
与当前的测光仪测定不同,我们描述的方法不需要专门的工具来设置,并且可以使用常用材料在任何实验室中执行。使用这种方法,我们获得了可靠和一致的镇定时间为个别苍蝇。原则上,可以延长测定范围,以评估接触任何挥发性物质的影响。该测定还可用于测量挥发物急性毒性对其他昆虫,包括其他苍蝇物种的影响。单个镇定时间数据可用于评估总体(如 DGRP)中的符号变化程度。
我们使用小昆虫网,以防止直接接触乙醇溶液,同时允许足够的乙醇蒸气到达苍蝇。屏幕网格顶部的白色奶酪布层提供苍蝇和下面表面之间的视觉对比,并确保苍蝇不会被捕获到屏幕网格中,这可能导致模棱两可的姿势控制损失确定。对水和空气多孔的商用膜结果不一致,对乙醇蒸气的穿透性不足。我们故意使用小昆虫网,因为它是一种均匀多孔材料,能最大限度地减少由于井内飞行位置造成的乙醇暴露变化。可以根据现有材料修改该协议,尽管我们建议使用受控行为室,在苍蝇附近获得 90%-100% 乙醇,并均匀接触乙醇。
细胞培养板内的飞点位置应在复制之间随机化,以避免位置偏置。对于需要在多日内使用这种测定,因此受环境变化影响测定结果(例如,气压变化)影响的大型实验,我们强烈建议每天在同一时间测试苍蝇,并在数日内和几天内随机进行,特别是当不同的线条和/或性别相互比较时。
我们开发的方法最适合测量急性酒精暴露的影响,但不适合获取消费数据或模拟成瘾。然而,从该测定中获得的酒精镇定敏感性数据可以与其他与酒精相关的表型测量相结合。该系统的一个限制是标准细胞培养板的垂直高度允许垂直飞行运动,无法通过视频轻松跟踪,以便详细评估整体活动或运动。但是,此限制不影响镇定时间的准确评估。当使用不同基因型的苍蝇(例如,在DGRP衍生的外种种群28),这种测定还允许检索单个苍蝇收集具有对比表型的苍蝇池,用于批量DNA测序和极端QTL映射29,30。,30总体而言,这种测定允许快速、廉价地收集大量单蝇的酒精镇镇化数据。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家卫生研究院向TFCM和RRHA提供的DA041613和GM128974赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| 24-well Cell Culture Plates | Corning | 3526 | Flat-bottomed; will house flies throughout assay |
| Aspirator | |||
| Cheesecloth | Genesee Scientific | 53-100 | Widely available. |
| Ethanol | Decon Labs | V1001 | Widely available. |
| Flexible Plastic Cutting Board (Plate Cover) | Walmart | 550098612 | Any flat plastic that can slide easily and cover a 24-well plate completely. Flexible plastic cutting board works well. |
| Gauze (for aspirator) | Honeywell North | 67622 | Widely available. |
| Illumination Pad | Amazon (AGPtek) | ASIN B00YA9GP0G | Any light pad to provide contrast is suitable. |
| Jumbo Craft Sticks | Michaels | 10334892 | Any craft stick at least 7 cm long is suitable. |
| P1000 Pipette Tip (for aspirator) | Genesee Scientific | 24-165RL | Any P1000 pipette tip is suitable. |
| Serological Pipette (for aspirator) | Genesee Scientific | 12-104 | |
| Small Insect Screen Mesh | Lowe's (Saint-Gobain ADFORS) | 89322 | Any small insect screen mesh is suitable. |
| Testing Chamber | Interior space dimension big enough to encompass light pad. Can be constructed from a polystyrene box. | ||
| Tygon Tubing (for aspirator) | Grainger | 9CUG7 | Widely available. |
| Video Camera | Canon | 1959C001AA | Any video camera is suitable. |
参考文献
- Heath, A. C., et al. Genetic differences in alcohol sensitivity and the inheritance of alcoholism risk. Psychological Medicine. 29 (5), 1069-1081 (1999).
- Schuckit, M. A., Smith, T. L. The relationships of a family history of alcohol dependence, a low level of response to alcohol and six domains of life functioning to the development of alcohol use disorders. Journal of Studies on Alcohol. 61 (6), 827-835 (2000).
- Trim, R. S., Schuckit, M. A., Smith, T. L. The relationships of the level of response to alcohol and additional characteristics to alcohol use disorders across adulthood: a discrete-time survival analysis. Alcoholism: Clinical and Experimental Research. 33 (9), 1562-1570 (2009).
- Schuckit, M. A., Smith, T. L. Onset and course of alcoholism over 25 years in middle class men. Drug and Alcohol Dependence. 113 (1), 21-28 (2011).
- Morozova, T. V., Mackay, T. F. C., Anholt, R. R. H. Genetics and genomics of alcohol sensitivity. Molecular Genetics and Genomics. 289 (3), 253-269 (2014).
- Heberlein, U., Wolf, F. W., Rothenfluh, A., Guarnieri, D. J. Molecular genetic analysis of ethanol intoxication in Drosophila melanogaster. Integrative and Comparative Biology. 44 (4), 269-274 (2004).
- Engel, G. L., Taber, K., Vinton, E., Crocker, A. J. Studying alcohol use disorder using Drosophila melanogaster in the era of 'Big Data'. Behavioral and Brain Functions. 15 (1), 7 (2019).
- Singh, C. M., Heberlein, U. Genetic control of acute ethanol-induced behaviors in Drosophila. Alcoholism: Clinical and Experimental Research. 24 (8), 1127-1136 (2000).
- Mackay, T. F. C., et al. The Drosophila melanogaster Genetic Reference Panel. Nature. 482 (7384), 173-178 (2012).
- Huang, W., et al. Natural variation in genome architecture among 205 Drosophila melanogaster Genetic Reference Panel lines. Genome Research. 24 (7), 1193-1208 (2014).
- Morozova, T. V., et al. A Cyclin E centered genetic network contributes to alcohol-induced variation in Drosophila development. G3. 8 (8), 2643-2653 (2018).
- Morozova, T. V., et al. Polymorphisms in early neurodevelopmental genes affect natural variation in alcohol sensitivity in adult drosophila. BMC Genomics. 16, 865 (2015).
- Scholz, H., Ramond, J., Singh, C. M., Heberlein, U. Functional ethanol tolerance in Drosophila. Neuron. 28 (1), 261-271 (2000).
- Berger, K. H., Heberlein, U., Moore, M. S. Rapid and chronic: two distinct forms of ethanol tolerance in Drosophila. Alcoholism: Clinical and Experimental Research. 28 (10), 1469-1480 (2004).
- Morozova, T. V., Anholt, R. R. H., Mackay, T. F. C. Transcriptional response to alcohol exposure in Drosophila melanogaster. Genome Biology. 7 (10), 95 (2006).
- Weber, K. E. An apparatus for measurement of resistance to gas-phase agents. Drosophila Information Service. 67, 91-93 (1988).
- Weber, K. E., Diggins, L. T. Increased selection response in larger populations. II. Selection for ethanol vapor resistance in Drosophila melanogaster at two population sizes. Genetics. 125 (3), 585-597 (1990).
- Cohan, F. M., Graf, J. D. Latitudinal cline in Drosophila melanogaster for knockdown resistance to ethanol fumes and for rates of response to selection for further resistance. Evolution. 39 (2), 278-293 (1985).
- Scholz, H., Franz, M., Heberlein, U. The hangover gene defines a stress pathway required for ethanol tolerance development. Nature. 436 (7052), 845-847 (2005).
- Morozova, T. V., Anholt, R. R. H., Mackay, T. F. C. Phenotypic and transcriptional response to selection for alcohol sensitivity in Drosophila melanogaster. Genome Biology. 8 (10), 231 (2007).
- Morozova, T. V., et al. Alcohol sensitivity in Drosophila: Translational potential of systems genetics. Genetics. 83, 733-745 (2009).
- Bhandari, P., Kendler, K. S., Bettinger, J. C., Davies, A. G., Grotewiel, M. An assay for evoked locomotor behavior in Drosophila reveals a role for integrins in ethanol sensitivity and rapid ethanol tolerance. Alcoholism: Clinical and Experimental Research. 33 (10), 1794-1805 (2009).
- Sandhu, S., Kollah, A. P., Lewellyn, L., Chan, R. F., Grotewiel, M. An inexpensive, scalable behavioral assay for measuring ethanol sedation sensitivity and rapid tolerance in Drosophila. Journal of Visualized Experiments. (98), e52676 (2015).
- Urizar, N. L., Yang, Z., Edenberg, H. J., Davis, R. L. Drosophila homer is required in a small set of neurons including the ellipsoid body for normal ethanol sensitivity and tolerance. The Journal of Neuroscience. 27 (17), 4541-4551 (2007).
- Wolf, F. W., Rodan, A. R., Tsai, L. T., Heberlein, U. High-resolution analysis of ethanol-induced locomotor stimulation in Drosophila. The Journal of Neuroscience. 22 (24), 11035-11044 (2002).
- Cohan, F. M., Hoffmann, A. A. Genetic divergence under uniform selection. II. Different responses to selection for knockdown resistance to ethanol among Drosophila melanogaster populations and their replicate lines. Genetics. 114 (1), 145-164 (1986).
- Pohl, J. B., et al. Circadian genes differentially affect tolerance to ethanol in Drosophila. Alcoholism: Clinical and Experimental Research. 37 (11), 1862-1871 (2013).
- Huang, W., et al. Epistasis dominates the genetic architecture of Drosophila quantitative traits. Proceedings of the National Academy of Sciences of the United States of America. 109, 15553-15559 (2012).
- Ehrenreich, I. M., et al. Dissection of genetically complex traits with extremely large pools of yeast segregants. Nature. 464 (7291), 1039-1042 (2010).
- Anholt, R. R. H., Mackay, T. F. C. The road less traveled: From genotype to phenotype in flies and humans. Mammalian Genome. 29, 5-23 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。