Method Article
Hochdurchsatzmethode zur Messung der Alkoholsedationszeit einzelner Drosophila melanogaster
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Aktuelle Methoden zur Messung der Alkoholempfindlichkeit in Drosophila wurden entwickelt, um Gruppen von Fliegen zu testen. Wir präsentieren einen einfachen, kostengünstigen, hochdurchsatzhohen Test zur Beurteilung der Alkoholsedationsempfindlichkeit bei einer großen Anzahl von Einzelfliegen. Das Verfahren erfordert keine speziellen Werkzeuge und kann in jedem Labor mit gängigen Materialien durchgeführt werden.
Zusammenfassung
Drosophila melanogaster bietet ein ausgezeichnetes Modell, um die genetischen Grundlagen der Alkoholempfindlichkeit zu untersuchen. Im Gegensatz zu Studien an menschlichen Populationen ermöglicht das Drosophila-Modell eine strenge Kontrolle des genetischen Hintergrunds, und praktisch unbegrenzte Anzahl von Individuen desselben Genotyps kann ohne regulatorische Einschränkungen und zu relativ niedrigen Kosten schnell unter gut kontrollierten Umweltbedingungen aufgezogen werden. Fliegen, die Ethanol ausgesetzt sind, unterliegen physiologischen und Verhaltensänderungen, die einer Vergiftung des menschlichen Alkohols ähneln, einschließlich verluster Haltungskontrolle, Sedierung und Entwicklung von Toleranz. Hier beschreiben wir einen einfachen, kostengünstigen, hochdurchsatzhohen Test zur Beurteilung der Alkoholsedationsempfindlichkeit bei einer großen Anzahl von Einzelfliegen. Der Test basiert auf Videoaufnahmen von Einzelfliegen, die ohne Anästhesie in 24-Well-Zellkulturplatten in einem Setup eingeführt wurden, das eine synchrone Initiierung der Alkoholexposition ermöglicht. Das System ermöglicht es einer einzelnen Person, einzelne Ethanol-Sedierungsdaten auf bis zu 2.000 Fliegen innerhalb einer 8-Stunden-Arbeitszeit zu sammeln. Der Test kann grundsätzlich erweitert werden, um die Auswirkungen der Exposition gegenüber flüchtigen Stoffen zu bewerten und zur Messung der Auswirkungen der akuten Toxizität flüchtiger Stoffe auf andere Insekten, einschließlich anderer Fliegenarten, anzuwenden.
Einleitung
Das National Institute on Alcohol Abuse and Alcoholism berichtet, dass im Jahr 2015 ein übermäßiger Alkoholkonsum, der als "Alkoholkonsumstörung" bezeichnet wurde, schätzungsweise 16 Millionen Menschen in den Vereinigten Staaten betroffen war. Alkoholmissbrauch verursacht eine breite Palette von schädlichen physiologischen Auswirkungen und ist eine der Hauptursachen für den Tod in den USA. Beim Menschen, verminderte Empfindlichkeit, oder eine geringe Reaktion auf Alkohol, hat eine starke genetische Komponente und ist mit einem höheren Risiko der Entwicklung von AlkoholkonsumStörungen1,2,3,4verbunden. Genetische Risikostudien an menschlichen Populationen sind aufgrund der Beimischung von Bevölkerungsgruppen, unterschiedlicher Entwicklungshistorie und Umweltexpositionen und der Abhängigkeit von selbst gemeldeten Fragebögen zur Quantifizierung alkoholbedingter Phänotypen, die oft mit anderen neuropsychiatrischen Erkrankungen verwirrt sind, eine Herausforderung.
Drosophila melanogaster bietet ein ausgezeichnetes Modell, um die genetischen Grundlagen der Alkoholempfindlichkeit5,6,7,8zu studieren. Das Drosophila-Modell ermöglicht eine strenge Kontrolle des genetischen Hintergrunds, und praktisch unbegrenzte Anzahl von Individuen desselben Genotyps kann ohne regulatorische Einschränkungen und zu relativ niedrigen Kosten schnell unter gut kontrollierten Umweltbedingungen aufgezogen werden. Zusätzlich zu den öffentlich zugänglichen Mutationen und RNAi-Linien, die auf die Mehrheit der Gene im Genom abzielen, hat die Verfügbarkeit des Drosophila melanogaster Genetic Reference Panel (DGRP), einer Population von 205 inzuchtwilden Linien mit vollständigen Genomsequenzen, genomweite Assoziationsstudien9,10ermöglicht. Solche Studien haben genetische Netzwerke identifiziert, die mit Auswirkungen auf die Entwicklungszeit und die Lebensfähigkeit auf die Entwicklungsexposition gegenüber Ethanol11,12verbunden sind. Die evolutionäre Konservierung grundlegender biologischer Prozesse ermöglicht es, translationale Schlussfolgerungen zu ziehen, indem menschliche Orthologs auf ihre Fliegen-Gegenstücke überlagert werden.
Fliegen, die Ethanol ausgesetzt sind, unterliegen physiologischen und Verhaltensänderungen, die einer Vergiftung des menschlichen Alkohols ähneln, einschließlich verluster Haltungskontrolle8, Sedierung und Entwicklung der Toleranz13,14,15. Alkoholinduzierte Sedierung bei Drosophila kann mit Inebriometern quantifiziert werden. Dies sind 122 cm lange vertikale Glassäulen mit schrägen Netztrennwänden, an denen Fliegen16,,17,,18befestigen können. Eine Gruppe von mindestens 50 Fliegen (Geschlechter können separat analysiert werden) werden oben in der Säule eingeführt und Ethanoldämpfen ausgesetzt. Fliegen, die die Haltungskontrolle verlieren, fallen durch die Säule und werden in 1 min Abständen gesammelt. Die mittlere Elutionszeit dient als Maß für die Empfindlichkeit gegenüber Alkoholvergiftung. Wenn Fliegen ein zweites Mal Alkohol ausgesetzt sind, nachdem sie sich von der ersten Exposition erholt haben, können sie Toleranz entwickeln, wie aus einer Verschiebung der mittleren Elutionszeit13,15,19,20zu erkennen ist. Während Inebriometer-Assays zur Identifizierung von Genen, genetischen Netzwerken und zellulären Wegen im Zusammenhang mit der Alkoholsedationsempfindlichkeit und der Entwicklung der Toleranz12,13,14,21geführt haben, ist der Assay zeitaufwändig, durchdrläsam und unwirksam für die Messung der Alkoholempfindlichkeit bei einzelnen Fliegen.
Alternative Ethanol-Sedierungs-Assays, die nicht die aufwendige Inebriometer-Einrichtung erfordern, ermöglichen bequemere Messungen, sind aber immer noch begrenzt im Durchsatz und erfordern in der Regel Analysen von Gruppen von Fliegen anstelle von Individuen21,22,23,24,25. Die Bewertung einzelner Fliegen minimiert das Potenzial für verwirrende Effekte aufgrund von Gruppeninteraktionen, z. B. solche, die sich aus sozialen Verhaltensweisen ergeben. Hier präsentieren wir einen einfachen, kostengünstigen, hochdurchsatzhohen Test zur Beurteilung der Alkoholsedationsempfindlichkeit bei einer großen Anzahl von Einzelfliegen.
Protokoll
1. Bau des Prüfgeräts
- Erstellen Sie eine Pappschablone in der Größe einer 24-Well-Zellkulturplatte, indem Sie die Platte auf Karton verfolgen und den dafür vorgesehenen Bereich ausschneiden.
- Schneiden Sie ein Stück kleine Insektensiebe Mesh die Größe der Zellkulturplatte mit der Pappvorlage aus Schritt 1.1.
- Bereiten Sie eine 24-Well-Zellkulturplatte vor, indem Sie eine kleine Linie von Heißkleber um den Umfang der Oberseite der Platte mit einer Heißklebepistole platzieren und das Siebgitter auf den offenen Brunnen anbringen.
- Sichern Sie einen hölzernen Handwerksstab an jeder der drei Seiten derselben Zellkulturplatte ab Schritt 1.3 mit einer Heißklebepistole. Die modifizierte Zellkulturplatte sollte nun dem Innisationsdiagramm in Abbildung 1A und dem in Abbildung 2dargestellten Versuchsaufbau ähneln.
HINWEIS: Bereiten Sie mindestens so viele Zellkulturplatten vor, wie in die Filmkammern passen (siehe unten).
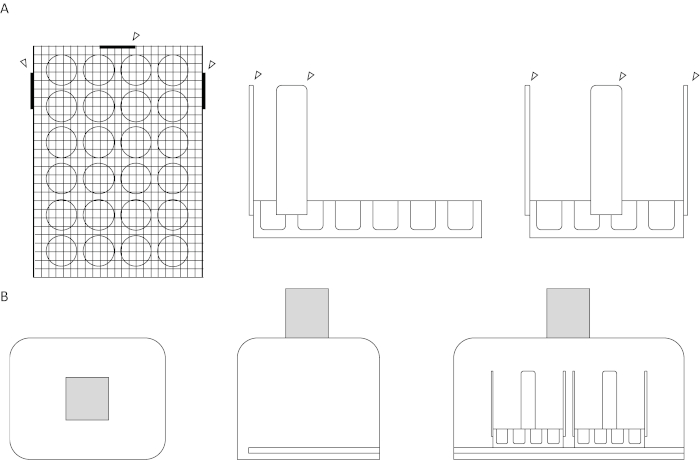
Abbildung 1: Diagramm des Prüfgeräts und der Filmkammer. (A) Obere Diagramme. Die Obere, Die Seiten- und die Vorderansicht des Prüfgeräts werden angezeigt. Ein Siebgitter gittert flach auf einer 24-Well-Zellkulturplatte. Die hölzernen Bastelstäbe, dargestellt durch die Pfeilspitzen, sind an drei angrenzenden Seiten zur Stabilität und Ausrichtungshilfe befestigt, zwei an der Seite der Brunnenplatte mit sechs Brunnen und einer an der Seite der Platte mit vier Brunnen. Alle Anbaugeräte sind heiß auf das Gerät geklebt. (B) Untere Diagramme. Die obere, seitliche und vordere Ansicht des Assay-Setups werden angezeigt. Ein Schlitz wird in der rechten Seite des Kastens geschnitten, von der Öffnung für den Deckel bis zur Rückseite der Öffnung, mit der Unterseite der Schlitzebene zur innen. Das Loch auf der Oberseite der Box, die Oberfläche parallel zum Boden, ist für maximale Videobelichtung zentriert. Das schattierte Feld stellt die Videokamera dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Foto des Assay-Systems. Die Videokamera wird auf der Oberseite der Polystyrolkammer platziert, wobei das Objektiv in das Ausgeschnittene Loch eingefügt wird, dargestellt in den Diagrammen von Abbildung 1B. Zwei Sätze modifizierter 24-Well-Zellkulturplatten ruhen auf einem Beleuchtungspad, das in einen Schlitz durch die Seite der Kammer eingefügt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Bau der Filmkammer
- Erstellen Sie eine Filmkammer, indem Sie ein Loch von der Größe der Videokameralinse an der Seite einer Polystyrol-Box schneiden. Schneiden Sie einen zusätzlichen Schlitz die Breite des Beleuchtungspads in der gegenüberliegenden Seite der Polystyrol-Box. Die Filmkammer sollte der in Abbildung 1B und Abbildung 2dargestellten Filmkammer ähneln.
- Bereiten Sie die Filmkammer für den Einsatz vor, indem Sie das Beleuchtungspad in den Schlitz einlegen und die Kamera im Linsenloch über dem Beleuchtungspad positionieren.
- Platzieren Sie alle Materialien und führen Sie alle nachfolgenden Prüfungen in einer kontrollierten Umgebung durch, vorzugsweise eine Verhaltenskammer mit ca. 30 % Luftfeuchtigkeit, 25 °C Temperatur, gleichmäßigem Luftstrom und Geräuschpegeln unter 65 dB.
3. Vorbereitung des Prüfgeräts und der Fliegen
- Pipette 1 ml 100% Ethanol durch das Siebgitter in jeden Brunnen.
- Trocknen Sie das Siebgitter mit einem Stück Käsetuch.
- Schneiden Sie zwei Stücke Käsetuch die Abmessungen der Zellkulturplatte mit der Pappvorlage in Schritt 1.1 erstellt. Legen Sie sie auf das Trockensiebnetz der modifizierten Zellkulturplatte, die Ethanol aus Schritt 3.2 enthält.
- Erstellen Sie ein kleines Stück dünnes, flexibles Kunststoff-Schneidebrett, indem Sie die in Schritt 1.1 erstellte Kartonschablone als allgemeine Führung umverfolgen und den zurückverfolgten Bereich auf einer der kurzen Seiten um 1–2 cm erweitern. Schneiden Sie den erweiterten Spurenbereich aus dem dünnen, flexiblen Kunststoff-Schneidebrett. Achten Sie nach dem Schneiden darauf, dass der Kunststoff noch zwischen die drei hölzernen Bastelstäbe auf dem Prüfgerät passt, aber um 1–2 cm an einem Ende hängt.
- (Optional) Wenn ein Aspirator erstellt werden muss, montieren Sie einen Aspirator wie in Abbildung 3, indem Sie zuerst eine P1000 Pipettenspitze halbieren. Legen Sie das Stück mit größerem Durchmesser in ein Ende eines 30 cm langen Stücks flexibler Schläuche ein, um als Mundstück zu dienen.

Abbildung 3: Ein Fliegensauger, bei dem Fliegen mit einem austauschbaren Mundstück gesammelt werden, das an flexiblen Schläuchen befestigt ist, und einer breiten serologischen Pipette mit einem Wattestäbchenstopper. Der Bediener kann eine einzelne Fliege in die Pipette für den Transfer ohne Anästhesie aspirieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- (Optional) Um die Aspirator-Montage zu vervollständigen, decken Sie das breite Ende einer 10 cm großen serologischen Pipette mit Gaze ab, um zu verhindern, dass Fliegen in den Schlauch gelangen, und legen Sie die Pipette, Gaze zuerst, in das offene Ende des Schlauches ein, um als Fliegenkammer zu dienen. Der Aspirator sollte dem in Abbildung 3dargestellten ähneln.
- Mit einem Aspirator(Abbildung 3, Schritte 3.5 und 3.6) aspirieren Sie eine Fliege pro Well in eine separate 24-Well-Zellkulturplatte. Verwenden Sie den flexiblen Kunststoff, um alle Brunnen zu bedecken, die zuvor angesaugte Fliegen enthalten. Zeichnen Sie die Brunnenposition und alle relevanten Genotyp- oder Phänotypinformationen jeder Fliege auf.
- Halten Sie den flexiblen Kunststoff bündig mit der Oberseite der Zellkulturplatte, die die Fliegen enthält, um ihr Entweichen zu verhindern, und invertieren Sie die Platte auf die Oberseite der modifizierten Zellkulturplatte mit dem Ethanol. Das Blatt aus flexiblem Kunststoff sollte auf den Blättern aus Käsetuch ruhen. Richten Sie die invertierte Zellkulturplatte mit Fliegen mit den Craft-Sticks aus, um sicherzustellen, dass jeder Brunnen mit Ethanol ausgerichtet ist, der eine Fliege enthält.
- Der Versuchsaufbau sollte Abbildung 2ähneln.
4. Testen der Fliegen
- Stellen Sie sicher, dass das Beleuchtungspad bei voller Helligkeit leuchtet, um einen maximalen visuellen Kontrast zu erreichen. Starten Sie die Aufnahme mit der Videokamera.
- Um die Fliegen Ethanol auszusetzen, entfernen Sie vorsichtig den Kunststoff zwischen der Brunnenplatte und dem Prüfgerät, wobei Darauf zu achten ist, dass das Käsetuch nicht verdrängt wird.
- Beenden Sie die Videoaufzeichnung, sobald alle Fliegen die Haltungskontrolle verloren haben. Sobald der Verdacht besteht, dass alle Fliegen die Haltungskontrolle verloren haben, tippen Sie fest in die Mitte der Platte, um sicherzustellen, dass alle Fliegen die Haltungskontrolle vollständig verlieren. Wenn Bewegung vorhanden ist, fahren Sie mit der Aufzeichnung fort. Tippen Sie in regelmäßigen Abständen (alle 1–2 min), bis keine Bewegung auftritt.
- (Optional) Um die Fliegen schnell zu bergen, entfernen Sie nur die obere Platte aus dem Prüfgerät und zeigen sedierte Fliegen, die auf dem Käsetuch ruhen. Aspirieren Sie einzelne Fliegt in ausgewählten Behältern für die Erholung.
- Ersetzen Sie das Ethanol in den modifizierten Zellkulturplatten durch 1 ml frisches 100% Ethanol mindestens 1x pro Stunde, um die Verdunstung und Befeuchtung des Ethanols zu kontrollieren und eine konsistente Ethanol-Exposition während des gesamten Asses zu erhalten. Trocknen Sie das Siebgitter mit Käsetuch.
- Wiederholen Sie dies für beliebig viele Proben.
HINWEIS: Für höchsten Durchsatz, aspirieren Sie die nächste Runde von Fliegen in neue Zellkulturplatten während der Videoaufnahme. Das Protokoll kann hier angehalten werden, da die Videoaufzeichnung später überprüft werden kann.
5. Bestimmung der Fliegensedationszeit
- Zeichnen Sie die Sedierungszeit für jede einzelne Fliege auf, indem Sie sich die Videoaufzeichnung ansehen. Sedierungszeit ist definiert als der Moment, in dem eine Fliege die vollständige Haltungskontrolle und Bewegungsfähigkeit verliert. Es wird empfohlen, den Film rückwärts zu sehen und die Zeit aufzuzeichnen, die die Fliege zu bewegen beginnt, um die Genauigkeit zu gewährleisten.
Ergebnisse
Zwei 24-Well-Mikrotiterplatten könnten Daten gleichzeitig auf 48 Einzelfliegen innerhalb von nur 10 min erzeugen. Tabelle 1 listet Messungen der Ethanolsedationszeiten für 48 einzelne Fliegen, Männchen und Weibchen getrennt, von zwei DGRP-Linien mit unterschiedlichen Empfindlichkeiten gegenüber Alkoholexposition bei Entwicklungszeit und Lebensfähigkeit13auf. Linienfliegen RAL_555 waren weniger empfindlich als RAL_177 (Abbildung 4, Tabelle 2; p < 0.0001, ANOVA). Männer und Frauen RAL_177 zeigten keine sexuell dimorphe Wirkung (Abbildung 4, Tabelle 2; p > 0,1, ANOVA), während Frauen der RAL_555 weniger empfindlich auf Ethanol-Exposition reagierten als die Männchen(Abbildung 4, Tabelle 2; p < 0,006, ANOVA). Die große Anzahl von Fliegen, die gleichzeitig gemessen werden können, und die Fähigkeit, Geschlechter und verschiedene Linien gleichzeitig zu messen, können die Genauigkeit erhöhen, indem Fehler aufgrund von Umgebungsschwankungen reduziert werden.
| Eine. | Ethanol-Sedierungszeit (s) | B. | Ethanol-Sedierungszeit (s) | ||||||||||
| Frauen | Männer | Frauen | Männer | ||||||||||
| 414 | 365 | 477 | 423 | 568 | 309 | 937 | 742 | 622 | 460 | 331 | 498 | ||
| 201 | 384 | 498 | 411 | 523 | 626 | 791 | 619 | 197 | 467 | 455 | 562 | ||
| 228 | 364 | 333 | 440 | 403 | 267 | 504 | 744 | 513 | 570 | 582 | 506 | ||
| 440 | 416 | 404 | 408 | 422 | 384 | 970 | 540 | 369 | 865 | 533 | 492 | ||
| 888 | 283 | 285 | 322 | 369 | 287 | 595 | 550 | 606 | 392 | 544 | 345 | ||
| 1079 | 519 | 315 | 393 | 376 | 284 | 418 | 709 | 553 | 308 | 477 | 388 | ||
| 718 | 287 | 432 | 275 | 206 | 411 | 366 | 564 | 558 | 385 | 576 | 377 | ||
| 598 | 337 | 398 | 279 | 631 | 372 | 437 | 692 | 578 | 460 | 511 | 412 | ||
| 241 | 398 | 364 | 347 | 374 | 808 | 665 | 729 | 484 | 532 | 425 | 354 | ||
| 229 | 423 | 534 | 386 | 396 | 628 | 312 | 576 | 305 | 334 | 531 | 506 | ||
| 388 | 488 | 451 | 523 | 322 | 533 | 682 | 638 | 420 | 560 | 548 | 379 | ||
| 252 | 529 | 375 | 427 | 330 | 540 | 1045 | 741 | 708 | 832 | 509 | 472 | ||
| 674 | 401 | 303 | 401 | 307 | 311 | 394 | 675 | 381 | 477 | 449 | 784 | ||
| 303 | 453 | 351 | 429 | 525 | 262 | 540 | 690 | 520 | 556 | 495 | 226 | ||
| 258 | 483 | 302 | 389 | 562 | 319 | 356 | 615 | 336 | 454 | 524 | 590 | ||
| 346 | 426 | 385 | 416 | 596 | 287 | 626 | 678 | 840 | 634 | 677 | 509 | ||
Tabelle 1: Messungen der Ethanolsedationszeiten (s) einzelner Fliegen der (A) DGRP-Linien RAL_177 und (B) RAL_555 für getrennte Geschlechter ( n =48). Siehe auch Tabelle 2, Abbildung 4.
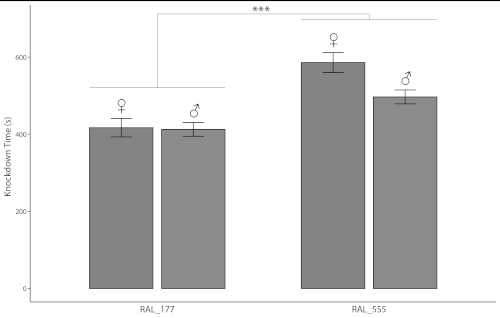
Abbildung 4: Alkoholsedationszeiten der DGRP-Linien RAL_177 und RAL_555. Die Balken stellen Mittelwerte und die Fehlerbalken SEM (n = 48) dar. Die Sedierungszeiten für RAL_177 Fliegen waren geringer als die für RAL_55 Fliegen (p < 0.0001, ANOVA). Die einzelnen Datenpunkte sind in Tabelle 1angegeben. Weitere statistisch signifikante Unterschiede zwischen Geschlechtern und Linien sind im Text und in Tabelle 2angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Analyse | Quelle der Variation | Df | Ss | F-Wert | P-Wert |
| Vollständiges Modell gepoolt | Linie | 1 | 769627 | 34.869 | <0,0001 |
| Sex | 1 | 105001 | 4.757 | 0.0304 | |
| Linie x Sex | 1 | 86021 | 3.897 | 0.0498 | |
| Fehler | 188 | 4149491 | |||
| Reduzierte Modellweibchen | Linie | 1 | 685126 | 23.58 | <0,0001 |
| Fehler | 94 | 2730718 | |||
| Reduzierte ModellMännchen | Linie | 1 | 170522 | 11.3 | 0.0011 |
| Fehler | 94 | 1418774 | |||
| Reduzierte Modell-RAL_177 | Sex | 1 | 473 | 0.023 | 0.8800 |
| Fehler | 94 | 1943741 | |||
| Reduzierte Modell-RAL_555 | Sex | 1 | 190549 | 8.12 | 0.0054 |
| Fehler | 94 | 2205751 | |||
Tabelle 2: Analyse der Varianz der Sedierungszeit über Geschlecht und DGRP-Linie hinweg. Das verwendete Modell war Y = L + S + LxS + ,wobei der Gesamtmittelwert , L ist der feste Effekt der DGRP-Linie (RAL_177, RAL_555), S ist die feste Wirkung des Geschlechts (männlich, weiblich), LxS ist der Wechselwirkungsterm (fest), und - ist der Fehlerbegriff. Für die reduzierten Modelle wurden die Modelle Y = L + B und Y = S + S + B verwendet. L Die Linie, Sex und der Begriff "Linie x Sex"- und -Interaktionsterm waren im vollständigen Modell bei .lt; 0.05 signifikant. Reduzierte Modelle nach Geschlecht und DGRP-RAL_555 waren ebenfalls signifikant bei 0,01 . Siehe auch Tabelle 1, Abbildung 4. df = Freiheitsgrade, SS = Typ I Summen der Quadrate.
Diskussion
Hier präsentieren wir eine einfache, kostengünstige und hochdurchsatzhohe Methode zur Beurteilung der Sedierungszeit aufgrund der Ethanol-Exposition in Drosophila melanogaster. Im Gegensatz zu vielen aktuellen Methoden, die Gruppenanalysen erfordern, ermöglicht dieser Assay einer einzelnen Person, einzelne Sedierungszeitdaten für 2.000 Fliegen innerhalb eines 8-Stunden-Arbeitszeitraums zu sammeln. Wir fanden heraus, dass eine einzelne Person 48 Fliegen für sedierungszeit in ca. 5 min punkten kann. Bei dieser Geschwindigkeit können 2.000 Fliegen in ca. 4 h erzielt werden, obwohl die Punktzahl später durchgeführt werden kann. Mit unserem Test reicht die aufgezeichnete Sedierungszeit für die meisten Fliegen zwischen 5 und 15 min bei einer Exposition von 1 ml 100% Ethanol. Geringere Ethanolkonzentrationen oder geringere Fördermengen führen zu längeren Sedierungszeiten.
Aktuelle Methoden zur Beurteilung der Sedierungszeit erfordern das Testen einer großen Anzahl von Fliegen, ohne Messungen an einzelnen Individuen15,16,17,18,19,20,21,22,23,24,25,26. Viele aktuelle Sedierungs- und Sensitivitätstests basieren auf ST5022,23,24, dem Zeitpunkt, an dem 50% der Fliegen als Folge der Ethanol-Exposition sediert werden. Obwohl die Erlangung des ST50 für Gruppen von Fliegen nicht die primäre Motivation für die Entwicklung dieses Tests war, zeigen die Videoaufzeichnungen einen höheren Nutzen im Vergleich zu aktuellen Methoden, da die Aufnahmen verwendet werden können, um den ST50 für Gruppen von einzeln getesteten Fliegen zu ermitteln und den Prozentsatz von Fliegen zu messen, die ein bestimmtes Kriterium erfüllen (z. B. Verlust der Haltungskontrolle) zu einem beliebigen Zeitpunkt. Es sei darauf hingewiesen, dass solche Videoanalysen zusätzliche Zeit in Anspruch erfordern würden.
Im Gegensatz zu aktuellen Inebriometer-Assays erfordert die von uns beschriebene Methode keine speziellen Werkzeuge zum Einrichten und kann in jedem Labor mit gängigen Materialien durchgeführt werden. Mit dieser Methode haben wir zuverlässige und konsistente Sedierungszeiten für einzelne Fliegen erhalten. Der Assay kann grundsätzlich erweitert werden, um die Auswirkungen der Exposition gegenüber flüchtigen Stoffen zu bewerten. Der Test kann auch angewendet werden, um die Auswirkungen der akuten Toxizität von flüchtigen Stoffen auf andere Insekten, einschließlich anderer Fliegenarten, zu messen. Individuelle Sedierungszeitdaten können verwendet werden, um das Ausmaß der phänotischen Variation innerhalb einer Bevölkerung, wie z. B. der DGRP, zu bewerten.
Wir verwendeten kleine Insektenschutzgitter, um den direkten Kontakt mit der Ethanollösung zu verhindern und gleichzeitig ausreichende Mengen an Ethanoldämpfen zu ermöglichen, um die Fliege zu erreichen. Die Schicht aus weißem Käsetuch auf dem Siebnetz sorgt für einen visuellen Kontrast zwischen der Fliege und der darunter liegenden Oberfläche und sorgt dafür, dass Fliegen nicht im Siebnetz gefangen werden, was zu einer mehrdeutigen Bestimmung des Verlusts der Haltungskontrolle führen könnte. Kommerziell erhältliche Membranen, die porös zu Wasser und Luft sind, lieferten inkonsistente Ergebnisse und waren nicht ausreichend durchdrungen für Ethanoldämpfe. Wir haben absichtlich ein kleines Insektensiebenetz verwendet, weil es ein gleichmäßig poröses Material ist, das Schwankungen in der Ethanol-Exposition als Folge der Fliegenposition innerhalb eines Brunnens minimiert. Änderungen an diesem Protokoll können auf der Grundlage verfügbarer Materialien vorgenommen werden, obwohl wir eine kontrollierte Verhaltenskammer, Zugang zu 90 % bis 100 % Ethanol in der Nähe der Fliege und eine gleichmäßige Ethanolexposition empfehlen.
Die Fly-Position innerhalb der Zellkulturplatten sollte zwischen Replikationen randomisiert werden, um Positionsverzerrungen zu vermeiden. Für größere Experimente, die die Verwendung dieses Tests über mehrere Tage erfordern und daher Umweltschwankungen unterliegen, die die Assay-Ergebnisse beeinflussen könnten (z. B. Veränderungen des Barometrischen Drucks)27, empfehlen wir dringend, fliegen jeden Tag zur gleichen Zeit zu testen und sowohl innerhalb als auch über Tage hinweg randomisiert zu werden, insbesondere wenn unterschiedliche Linien und/oder Geschlechter miteinander verglichen werden sollen.
Die von uns entwickelte Methode eignet sich am besten zur Messung der Wirkung akuter Alkoholexposition, ist aber nicht geeignet, um Konsumdaten zu erhalten oder Sucht zu modellieren. Die aus diesem Test gewonnenen Daten zur Alkoholsedationsempfindlichkeit können jedoch mit anderen Messgrößen alkoholbedingter Phänotypen integriert werden. Eine Einschränkung des Systems besteht darin, dass die vertikale Höhe von Standard-Zellkulturplatten vertikale Fliegenbewegungen ermöglicht, die nicht ohne weiteres per Video für eine detaillierte Bewertung der Gesamtaktivität oder Fortbewegung nachverfolgt werden können. Diese Beschränkung hat jedoch keinen Einfluss auf die genaue Beurteilung der Sedierungszeit. Bei der Verwendung von Fliegen verschiedener Genotypen (z.B. in DGRP-abgeleiteten Outbred-Populationen28) ermöglicht dieser Test auch das Abrufen einzelner Fliegen, um Fliegenpools mit kontrastierenden Phänotypen für die Massen-DNA-Sequenzierung und extreme QTL-Mapping29,30zu sammeln. Insgesamt ermöglicht dieser Test eine schnelle, kostengünstige Sammlung von Alkoholsedationsdaten auf einer großen Anzahl von Einzelfliegen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch die Stipendien DA041613 und GM128974 von den National Institutes of Health an TFCM und RRHA unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 24-well Cell Culture Plates | Corning | 3526 | Flat-bottomed; will house flies throughout assay |
| Aspirator | |||
| Cheesecloth | Genesee Scientific | 53-100 | Widely available. |
| Ethanol | Decon Labs | V1001 | Widely available. |
| Flexible Plastic Cutting Board (Plate Cover) | Walmart | 550098612 | Any flat plastic that can slide easily and cover a 24-well plate completely. Flexible plastic cutting board works well. |
| Gauze (for aspirator) | Honeywell North | 67622 | Widely available. |
| Illumination Pad | Amazon (AGPtek) | ASIN B00YA9GP0G | Any light pad to provide contrast is suitable. |
| Jumbo Craft Sticks | Michaels | 10334892 | Any craft stick at least 7 cm long is suitable. |
| P1000 Pipette Tip (for aspirator) | Genesee Scientific | 24-165RL | Any P1000 pipette tip is suitable. |
| Serological Pipette (for aspirator) | Genesee Scientific | 12-104 | |
| Small Insect Screen Mesh | Lowe's (Saint-Gobain ADFORS) | 89322 | Any small insect screen mesh is suitable. |
| Testing Chamber | Interior space dimension big enough to encompass light pad. Can be constructed from a polystyrene box. | ||
| Tygon Tubing (for aspirator) | Grainger | 9CUG7 | Widely available. |
| Video Camera | Canon | 1959C001AA | Any video camera is suitable. |
Referenzen
- Heath, A. C., et al. Genetic differences in alcohol sensitivity and the inheritance of alcoholism risk. Psychological Medicine. 29 (5), 1069-1081 (1999).
- Schuckit, M. A., Smith, T. L. The relationships of a family history of alcohol dependence, a low level of response to alcohol and six domains of life functioning to the development of alcohol use disorders. Journal of Studies on Alcohol. 61 (6), 827-835 (2000).
- Trim, R. S., Schuckit, M. A., Smith, T. L. The relationships of the level of response to alcohol and additional characteristics to alcohol use disorders across adulthood: a discrete-time survival analysis. Alcoholism: Clinical and Experimental Research. 33 (9), 1562-1570 (2009).
- Schuckit, M. A., Smith, T. L. Onset and course of alcoholism over 25 years in middle class men. Drug and Alcohol Dependence. 113 (1), 21-28 (2011).
- Morozova, T. V., Mackay, T. F. C., Anholt, R. R. H. Genetics and genomics of alcohol sensitivity. Molecular Genetics and Genomics. 289 (3), 253-269 (2014).
- Heberlein, U., Wolf, F. W., Rothenfluh, A., Guarnieri, D. J. Molecular genetic analysis of ethanol intoxication in Drosophila melanogaster. Integrative and Comparative Biology. 44 (4), 269-274 (2004).
- Engel, G. L., Taber, K., Vinton, E., Crocker, A. J. Studying alcohol use disorder using Drosophila melanogaster in the era of 'Big Data'. Behavioral and Brain Functions. 15 (1), 7 (2019).
- Singh, C. M., Heberlein, U. Genetic control of acute ethanol-induced behaviors in Drosophila. Alcoholism: Clinical and Experimental Research. 24 (8), 1127-1136 (2000).
- Mackay, T. F. C., et al. The Drosophila melanogaster Genetic Reference Panel. Nature. 482 (7384), 173-178 (2012).
- Huang, W., et al. Natural variation in genome architecture among 205 Drosophila melanogaster Genetic Reference Panel lines. Genome Research. 24 (7), 1193-1208 (2014).
- Morozova, T. V., et al. A Cyclin E centered genetic network contributes to alcohol-induced variation in Drosophila development. G3. 8 (8), 2643-2653 (2018).
- Morozova, T. V., et al. Polymorphisms in early neurodevelopmental genes affect natural variation in alcohol sensitivity in adult drosophila. BMC Genomics. 16, 865 (2015).
- Scholz, H., Ramond, J., Singh, C. M., Heberlein, U. Functional ethanol tolerance in Drosophila. Neuron. 28 (1), 261-271 (2000).
- Berger, K. H., Heberlein, U., Moore, M. S. Rapid and chronic: two distinct forms of ethanol tolerance in Drosophila. Alcoholism: Clinical and Experimental Research. 28 (10), 1469-1480 (2004).
- Morozova, T. V., Anholt, R. R. H., Mackay, T. F. C. Transcriptional response to alcohol exposure in Drosophila melanogaster. Genome Biology. 7 (10), 95 (2006).
- Weber, K. E. An apparatus for measurement of resistance to gas-phase agents. Drosophila Information Service. 67, 91-93 (1988).
- Weber, K. E., Diggins, L. T. Increased selection response in larger populations. II. Selection for ethanol vapor resistance in Drosophila melanogaster at two population sizes. Genetics. 125 (3), 585-597 (1990).
- Cohan, F. M., Graf, J. D. Latitudinal cline in Drosophila melanogaster for knockdown resistance to ethanol fumes and for rates of response to selection for further resistance. Evolution. 39 (2), 278-293 (1985).
- Scholz, H., Franz, M., Heberlein, U. The hangover gene defines a stress pathway required for ethanol tolerance development. Nature. 436 (7052), 845-847 (2005).
- Morozova, T. V., Anholt, R. R. H., Mackay, T. F. C. Phenotypic and transcriptional response to selection for alcohol sensitivity in Drosophila melanogaster. Genome Biology. 8 (10), 231 (2007).
- Morozova, T. V., et al. Alcohol sensitivity in Drosophila: Translational potential of systems genetics. Genetics. 83, 733-745 (2009).
- Bhandari, P., Kendler, K. S., Bettinger, J. C., Davies, A. G., Grotewiel, M. An assay for evoked locomotor behavior in Drosophila reveals a role for integrins in ethanol sensitivity and rapid ethanol tolerance. Alcoholism: Clinical and Experimental Research. 33 (10), 1794-1805 (2009).
- Sandhu, S., Kollah, A. P., Lewellyn, L., Chan, R. F., Grotewiel, M. An inexpensive, scalable behavioral assay for measuring ethanol sedation sensitivity and rapid tolerance in Drosophila. Journal of Visualized Experiments. (98), e52676 (2015).
- Urizar, N. L., Yang, Z., Edenberg, H. J., Davis, R. L. Drosophila homer is required in a small set of neurons including the ellipsoid body for normal ethanol sensitivity and tolerance. The Journal of Neuroscience. 27 (17), 4541-4551 (2007).
- Wolf, F. W., Rodan, A. R., Tsai, L. T., Heberlein, U. High-resolution analysis of ethanol-induced locomotor stimulation in Drosophila. The Journal of Neuroscience. 22 (24), 11035-11044 (2002).
- Cohan, F. M., Hoffmann, A. A. Genetic divergence under uniform selection. II. Different responses to selection for knockdown resistance to ethanol among Drosophila melanogaster populations and their replicate lines. Genetics. 114 (1), 145-164 (1986).
- Pohl, J. B., et al. Circadian genes differentially affect tolerance to ethanol in Drosophila. Alcoholism: Clinical and Experimental Research. 37 (11), 1862-1871 (2013).
- Huang, W., et al. Epistasis dominates the genetic architecture of Drosophila quantitative traits. Proceedings of the National Academy of Sciences of the United States of America. 109, 15553-15559 (2012).
- Ehrenreich, I. M., et al. Dissection of genetically complex traits with extremely large pools of yeast segregants. Nature. 464 (7291), 1039-1042 (2010).
- Anholt, R. R. H., Mackay, T. F. C. The road less traveled: From genotype to phenotype in flies and humans. Mammalian Genome. 29, 5-23 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten