Method Article
Méthode à haut débit pour mesurer le temps de sédation de l’alcool du mélanogaster individuel de Drosophila
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les méthodes actuelles pour mesurer la sensibilité à l’alcool à Drosophila sont conçues pour tester des groupes de mouches. Nous présentons un simple, faible coût, l’essai à haut débit pour évaluer la sensibilité à la sédation de l’alcool dans un grand nombre de mouches simples. La méthode ne nécessite pas d’outils spécialisés et peut être effectuée en laboratoire à l’aide de matériaux communs.
Résumé
Drosophila melanogaster fournit un excellent modèle pour étudier les fondements génétiques de la sensibilité à l’alcool. Contrairement aux études menées dans les populations humaines, le modèle Drosophila permet un contrôle strict sur le contexte génétique, et un nombre pratiquement illimité d’individus d’un même génotype peuvent être élevés rapidement dans des conditions environnementales bien contrôlées sans restrictions réglementaires et à un coût relativement faible. Les mouches exposées à l’éthanol subissent des changements physiologiques et comportementaux qui ressemblent à l’intoxication humaine à l’alcool, y compris la perte de contrôle postural, la sédation et le développement de la tolérance. Ici, nous décrivons un simple, faible coût, à haut débit d’essai pour évaluer la sensibilité à la sédation de l’alcool dans un grand nombre de mouches simples. L’essai est basé sur l’enregistrement vidéo de mouches simples introduites sans anesthésie dans des plaques de culture cellulaire de 24 puits dans une configuration qui permet l’initiation synchrone de l’exposition à l’alcool. Le système permet à une seule personne de recueillir des données individuelles de sédation de l’éthanol sur pas moins de 2 000 mouches au cours d’une période de travail de 8 h. L’essai peut, en principe, être étendu pour évaluer les effets de l’exposition à toute substance volatile et appliqué pour mesurer les effets de la toxicité aigue des substances volatiles sur d’autres insectes, y compris d’autres espèces de mouches.
Introduction
Le National Institute on Alcohol Abuse and Alcoholism rapporte qu’en 2015, la consommation excessive d’alcool, désignée comme un « trouble de consommation d’alcool », a touché environ 16 millions de personnes aux États-Unis. L’abus d’alcool cause un large éventail d’effets physiologiques indésirables et est une cause majeure de décès aux États-Unis. Chez l’homme, une diminution de la sensibilité, ou un faible niveau de réponse à l’alcool, a une forte composante génétique et est associée à un risque plus élevé de développer des troubles de consommation d’alcool1,2,3,4. Les études sur les risques génétiques sur les populations humaines sont difficiles en raison de l’admixture de la population, des antécédents de développement divers et des expositions environnementales, et de la dépendance à l’égard des questionnaires autodéclarés pour quantifier les phénotypes liés à l’alcool, qui sont souvent confondus avec d’autres affections neuropsychiatriques.
Drosophila melanogaster fournit un excellent modèle pour étudier les fondements génétiques de la sensibilité à l’alcool5,6,7,8. Le modèle Drosophila permet un contrôle strict sur les antécédents génétiques, et un nombre pratiquement illimité d’individus du même génotype peuvent être élevés rapidement dans des conditions environnementales bien contrôlées sans restrictions réglementaires et à un coût relativement faible. En plus des mutations accessibles au public et des lignées d’ARNi qui ciblent la majorité des gènes du génome, la disponibilité du Drosophila melanogaster Genetic Reference Panel (DGRP), une population de 205 lignées d’origine sauvage consanguines avec des séquences complètes du génome, a permis des études d’association à l’échelle du génome9,10. De telles études ont identifié des réseaux génétiques associés aux effets sur le temps de développement et la viabilité lors de l’exposition au développement à l’éthanol11,12. La conservation évolutive des processus biologiques fondamentaux permet de tirer des inférences translationnelles en superposant des orthologues humains sur leurs homologues à la mouche.
Les mouches exposées à l’éthanol subissent des changements physiologiques et comportementaux qui ressemblent à l’intoxication humaine à l’alcool, y compris la perte de contrôle postural8, la sédation et le développement de la tolérance13,14,15. La sédation induite par l’alcool dans Drosophila peut être quantifiée à l’aide d’inebriomètres. Ce sont 122 cm de long colonnes de verre vertical avec cloisons en maille inclinées à laquelle les mouches peuvent attacher16,17,18. Un groupe d’au moins 50 mouches (les sexes peuvent être analysés séparément) sont introduits en haut de la colonne et exposés à des vapeurs d’éthanol. Les mouches qui perdent le contrôle postural tombent à travers la colonne et sont collectées à intervalles de 1 min. Le temps d’elution moyen sert de mesure de sensibilité à l’intoxication alcoolique. Lorsque les mouches sont exposées à l’alcool une deuxième fois après avoir récupéré de la première exposition, ils peuvent développer une tolérance, comme évident d’un changement dans le temps d’elution moyenne13,15,19,20. Alors que les essais d’inesbriomètre ont conduit à l’identification des gènes, des réseaux génétiques et des voies cellulaires associés à la sensibilité à la sédation de l’alcool et au développement de la tolérance12,13,14,21, l’essai prend du temps, faible débit, et inefficace pour mesurer la sensibilité à l’alcool chez les mouches simples.
Les essais alternatifs de sédation de l’éthanol qui ne nécessitent pas la mise en place d’inesbriomètre élaboré permettent des mesures plus pratiques mais sont encore limités dans le débit et exigent généralement des analyses de groupes de mouches plutôt que d’individus21,22,23,24,25. L’évaluation des mouches individuelles minimise le risque d’effets de confusion en raison des interactions de groupe, telles que celles découlant de comportements sociaux. Ici, nous présentons un simple, faible coût, à haut débit d’essai pour évaluer la sensibilité à la sédation de l’alcool dans un grand nombre de mouches simples.
Protocole
1. Construction de l’appareil d’essai
- Créez un modèle en carton de la taille d’une plaque de culture cellulaire de 24 puits en traçant autour de l’assiette sur du carton et en coupant la zone désignée.
- Couper un morceau de petit échantillon d’insecte en maille de la taille de la plaque de culture cellulaire à l’aide du modèle en carton de l’étape 1.1.
- Préparer une plaque de culture cellulaire de 24 puits en plaçant une petite ligne de colle chaude autour du périmètre du haut de la plaque à l’aide d’un pistolet à colle chaude et en apposant le maillage de l’écran sur le dessus des puits ouverts.
- Fixez un bâton d’embarcation en bois à chacun des trois côtés de la même plaque de culture cellulaire de l’étape 1.3 à l’aide d’un pistolet à colle chaude. La plaque de culture cellulaire modifiée devrait maintenant ressembler au diagramme de plaque indiqué dans la figure 1A et à la configuration expérimentale indiquée dans la figure 2.
REMARQUE : Préparez au moins autant de plaques de culture cellulaire que dans les salles de tournage (voir ci-dessous).
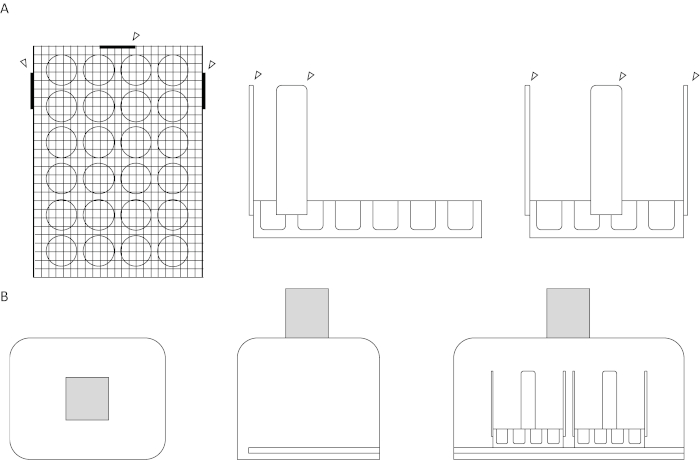
Figure 1 : Diagramme de l’appareil d’essai et de la chambre de tournage. (A) Diagrammes supérieurs. Les vues supérieures, latérales et avant de l’appareil d’essai sont affichées, respectivement. Un maillage d’écran pose à plat sur le dessus d’une plaque de culture cellulaire de 24 puits. Les bâtons d’embarcation en bois, représentés par les pointes de flèche, sont fixés à trois côtés adjacents pour la stabilité et l’alignement, deux sur le côté de la plaque de puits avec six puits et un sur le côté de la plaque avec quatre puits. Toutes les pièces jointes sont collées à chaud sur l’appareil. (B) Diagrammes inférieurs. Les vues en haut, sur le côté et devant la configuration d’essai sont montrées, respectivement. Une fente est coupée sur le côté droit de la boîte, de l’ouverture pour le couvercle à l’arrière de l’ouverture, avec le bas du niveau de fente à la surface intérieure. Le trou sur le dessus de la boîte, la surface parallèle au sol, est centré pour une exposition vidéo maximale. La boîte ombragée représente la caméra vidéo. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : Photographie du système d’analyse. La caméra vidéo est placée sur la chambre en polystyrène, avec l’objectif inséré dans le trou découpé, illustré dans les diagrammes de la figure 1B. Deux ensembles de plaques modifiées de culture cellulaire de 24 puits reposent sur un coussin d’éclairage qui est inséré dans une fente à travers le côté de la chambre. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
2. Construction de la salle de tournage
- Créez une chambre de tournage en coupant un trou de la taille de l’objectif de la caméra vidéo sur le côté d’une boîte en polystyrène. Couper une fente supplémentaire de la largeur de la garniture d’éclairage dans le côté opposé de la boîte en polystyrène. La salle de tournage devrait ressembler à la salle de tournage montrée dans la figure 1B et la figure 2.
- Préparer la chambre de tournage pour une utilisation en insérant le coussin d’éclairage dans la fente et en positionnant la caméra dans le trou de l’objectif au-dessus de la garniture d’éclairage.
- Placez tous les matériaux et effectuez tous les essais ultérieurs dans un environnement contrôlé, de préférence une chambre comportementale avec environ 30% d’humidité, une température de 25 oC, un écoulement d’air uniforme et des niveaux de bruit inférieurs à 65 dB.
3. Préparation de l’appareil d’essai et des mouches
- Pipette 1 mL d’éthanol à 100% à travers le maillage d’écran dans chaque puits.
- Sécher le maillage d’écran avec un morceau de tissu à fromage.
- Couper deux morceaux de tissu à fromage les dimensions de la plaque de culture cellulaire à l’aide du modèle en carton créé dans l’étape 1.1. Placez-les sur le maille d’écran sec de la plaque de culture cellulaire modifiée contenant de l’éthanol de l’étape 3.2.
- Créez un petit morceau de planche à découper en plastique mince et flexible en traçant autour du modèle en carton créé à l’étape 1.1 en tant que guide général et en élargissant la zone tracée de 1 à 2 cm sur l’un des côtés courts. Découpez la zone tracée élargie de la planche à découper en plastique mince et flexible. Après la coupe, assurez-vous que le plastique s’adapte toujours entre les trois bâtons d’embarcation en bois sur l’appareil d’essai, mais pend d’une extrémité par 1-2 cm.
- (Facultatif) Si un aspirateur doit être créé, assemblez un aspirateur comme celui indiqué dans la figure 3 en coupant d’abord une pointe de pipette P1000 en deux. Insérez la pièce d’un diamètre plus grand dans une extrémité d’un morceau de tubes flexibles de 30 cm pour servir d’embout buccal.

Figure 3 : Un aspirateur à mouches dans lequel les mouches sont collectées avec un embout buccal interchangeable attaché à des tubes flexibles et une pipette sérologique large avec un bouchon de gaze de coton. L’opérateur peut aspirer une seule mouche dans la pipette pour le transfert sans anesthésie. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
- (Facultatif) Pour compléter l’assemblage de l’aspirateur, couvrir l’extrémité large d’un morceau de 10 cm de pipette sérologique avec de la gaze pour empêcher les mouches d’entrer dans le tube et insérer la pipette, gaze d’abord, dans l’extrémité ouverte de la tuyauterie pour servir de chambre à mouche. L’aspirateur doit ressembler à celui indiqué dans la figure 3.
- À l’aide d’un aspirateur(figure 3, étapes 3.5 et 3.6), aspirez une mouche par puits dans une plaque séparée de culture cellulaire de 24 puits. Utilisez le plastique flexible pour couvrir tous les puits contenant des mouches auparavant aspirées. Enregistrez la position du puits et toute information pertinente sur le génotype ou le phénotype de chaque mouche.
- Tenez la couleur de plastique flexible avec le dessus de la plaque de culture cellulaire contenant les mouches pour empêcher leur évasion et inverser la plaque sur le dessus de la plaque de culture cellulaire modifiée avec l’éthanol. La feuille de plastique flexible doit reposer sur les feuilles de tissu à fromage. Alignez la plaque de culture cellulaire inversée contenant des mouches à l’aide des bâtons d’embarcation pour s’assurer que chaque puits avec de l’éthanol s’aligne avec chaque puits contenant une mouche.
- La configuration expérimentale devrait ressembler à la figure 2.
4. Tester les mouches
- Assurez-vous que le coussin d’éclairage est allumé à pleine luminosité pour un contraste visuel maximal. Commencez à enregistrer avec la caméra vidéo.
- Pour exposer les mouches à l’éthanol, retirez soigneusement le plastique entre la plaque de puits et l’appareil d’essai, en prenant soin de ne pas déloger la toile de fromage.
- Terminez l’enregistrement vidéo une fois que toutes les mouches ont perdu le contrôle postural. Une fois qu’il est suspecté que toutes les mouches ont perdu le contrôle postural, appuyez fermement au centre de la plaque pour s’assurer que toutes les mouches ont une perte complète de contrôle postural. S’il y a du mouvement, continuez à enregistrer. Continuer à taper périodiquement (toutes les 1 à 2 minutes) jusqu’à ce qu’il n’y ait pas de mouvement.
- (Facultatif) Pour récupérer rapidement les mouches, retirez seulement la plaque supérieure de l’appareil d’essai, révélant des mouches sédées reposant sur la toile de fromage. Aspirer les mouches individuelles dans les conteneurs choisis pour la récupération.
- Remplacer l’éthanol dans les plaques de culture cellulaire modifiées par 1 ml d’éthanol frais à 100 % à au moins 1x toutes les heures pour contrôler l’évaporation et l’humidification de l’éthanol et maintenir une exposition constante à l’éthanol tout au long du test. Sécher le maillage d’écran avec du tissu à fromage.
- Répétez l’opération pour autant d’échantillons que désiré.
REMARQUE : Pour le débit le plus élevé, aspirez la prochaine série de mouches dans de nouvelles plaques de culture cellulaire pendant l’enregistrement vidéo. Le protocole peut être mis en pause ici, car l’enregistrement vidéo peut être examiné plus tard.
5. Détermination du temps de sédation des mouches
- Enregistrez le temps de sédation pour chaque mouche individuelle en regardant l’enregistrement vidéo. Le temps de sédation est défini comme le moment où une mouche perd le contrôle postural complet et la capacité locomotrice. Il est recommandé de regarder le film à l’envers et d’enregistrer le temps que la mouche commence à se déplacer pour assurer la précision.
Résultats
Deux plaques de microtitres de 24 puits pourraient générer des données simultanément sur 48 mouches individuelles en aussi peu que 10 min. Le tableau 1 énumère les mesures des temps de sédation de l’éthanol pour 48 mouches, mâles et femelles individuels séparément, de deux lignes DGRP ayant des sensibilités différentes à l’exposition à l’alcool pendant le temps de développement et la viabilité13. Les mouches de la ligne RAL_555 étaient moins sensibles que les RAL_177 de ligne(figure 4, tableau 2; p 'lt; 0.0001, ANOVA). Les hommes et les femmes de RAL_177 n’ont montré aucun effet sexuellement dimorphique(figure 4, tableau 2; p 'gt; 0.1, ANOVA), tandis que les femelles de ligne RAL_555 étaient moins sensibles à l’exposition à l’éthanol que les mâles(figure 4, tableau 2; p 'lt; 0.006, ANOVA). Le grand nombre de mouches qui peuvent être mesurées simultanément et la capacité de mesurer les sexes et les différentes lignes simultanément peuvent augmenter la précision en réduisant l’erreur due à la variation de l’environnement.
| Un. | Temps d’éthèse (s) | B. | Temps d’éthèse (s) | ||||||||||
| Femelles | Mâles | Femelles | Mâles | ||||||||||
| 414 | 365 | 477 | 423 | 568 | 309 | 937 | 742 | 622 | 460 | 331 | 498 | ||
| 201 | 384 | 498 | 411 | 523 | 626 | 791 | 619 | 197 | 467 | 455 | 562 | ||
| 228 | 364 | 333 | 440 | 403 | 267 | 504 | 744 | 513 | 570 | 582 | 506 | ||
| 440 | 416 | 404 | 408 | 422 | 384 | 970 | 540 | 369 | 865 | 533 | 492 | ||
| 888 | 283 | 285 | 322 | 369 | 287 | 595 | 550 | 606 | 392 | 544 | 345 | ||
| 1079 | 519 | 315 | 393 | 376 | 284 | 418 | 709 | 553 | 308 | 477 | 388 | ||
| 718 | 287 | 432 | 275 | 206 | 411 | 366 | 564 | 558 | 385 | 576 | 377 | ||
| 598 | 337 | 398 | 279 | 631 | 372 | 437 | 692 | 578 | 460 | 511 | 412 | ||
| 241 | 398 | 364 | 347 | 374 | 808 | 665 | 729 | 484 | 532 | 425 | 354 | ||
| 229 | 423 | 534 | 386 | 396 | 628 | 312 | 576 | 305 | 334 | 531 | 506 | ||
| 388 | 488 | 451 | 523 | 322 | 533 | 682 | 638 | 420 | 560 | 548 | 379 | ||
| 252 | 529 | 375 | 427 | 330 | 540 | 1045 | 741 | 708 | 832 | 509 | 472 | ||
| 674 | 401 | 303 | 401 | 307 | 311 | 394 | 675 | 381 | 477 | 449 | 784 | ||
| 303 | 453 | 351 | 429 | 525 | 262 | 540 | 690 | 520 | 556 | 495 | 226 | ||
| 258 | 483 | 302 | 389 | 562 | 319 | 356 | 615 | 336 | 454 | 524 | 590 | ||
| 346 | 426 | 385 | 416 | 596 | 287 | 626 | 678 | 840 | 634 | 677 | 509 | ||
Tableau 1 : Mesures des temps de sédation de l’éthanol (s) des mouches individuelles des lignes de DGRP A( RAL_177 et (B) RAL_555 pour les sexes séparés (n - 48). Voir aussi le tableau 2, figure 4.
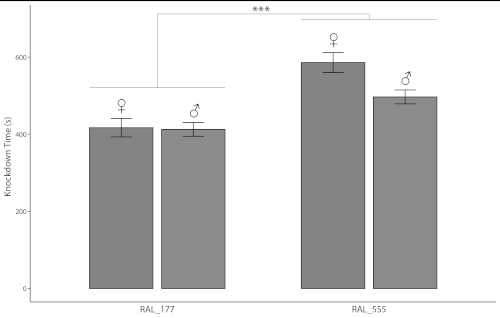
Figure 4 : Les temps de sédation de l’alcool des lignes DGRP RAL_177 et RAL_555. Les barres représentent des moyens et l’erreur barre SEM (n 48). Les temps de sédation des mouches RAL_177 étaient inférieurs à ceux des mouches RAL_55 (p-lt; 0,0001, ANOVA). Les points de données individuels sont indiqués dans le tableau 1. D’autres différences statistiquement significatives entre les sexes et les lignées sont indiquées dans le texte et dans le tableau 2. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| Analyse | Source de variation | Df | Ss | Valeur F | Valeur P |
| Modèle complet mis en commun | Ligne | 1 | 769627 | 34.869 | -lt;0.0001 |
| Sexe | 1 | 105001 | 4.757 | 0.0304 | |
| Ligne x Sexe | 1 | 86021 | 3.897 | 0.0498 | |
| Erreur | 188 | 4149491 | |||
| Femmes modèles réduites | Ligne | 1 | 685126 | 23.58 | -lt;0.0001 |
| Erreur | 94 | 2730718 | |||
| Réduit Modèles Mâles | Ligne | 1 | 170522 | 11.3 | 0.0011 |
| Erreur | 94 | 1418774 | |||
| RAL_177 de modèle réduit | Sexe | 1 | 473 | 0.023 | 0.8800 |
| Erreur | 94 | 1943741 | |||
| RAL_555 de modèle réduit | Sexe | 1 | 190549 | 8.12 | 0.0054 |
| Erreur | 94 | 2205751 | |||
Tableau 2: Analyses de variance pour le temps de sédation à travers le sexe et la ligne DGRP. Le modèle utilisé était Y ' L 'L 'L xS ',où 'est la moyenne globale, L est l’effet fixe de la ligne DGRP (RAL_177, RAL_555), S est l’effet fixe du sexe (homme, femme), LxS est le terme d’interaction (fixe), et est la durée d’erreur. L Les modèles Y et L et Y µ ont été S utilisés pour les modèles réduits. L Line, Sex, et le terme d’interaction Line x Sex étaient tous significatifs dans le modèle complet à l'1,05. Les modèles réduits par sexe et la ligne DGRP RAL_555 étaient également significatifs à 0,01 . Voir aussi le tableau 1, figure 4. df degrés de liberté, SS - Type I Sums of Squares.
Discussion
Ici, nous présentons une méthode simple, peu coûteuse, et à haut débit pour évaluer le temps de sédation dû à l’exposition à l’éthanol dans Drosophila melanogaster. Contrairement à de nombreuses méthodes actuelles, qui nécessitent des analyses de groupe, cet essai permet à une seule personne de recueillir des données individuelles sur le temps de sédation pour 2 000 mouches dans une période de travail de 8 h. Nous avons constaté qu’une seule personne peut marquer 48 mouches pour le temps de sédation en environ 5 minutes. À ce rythme, 2 000 mouches peuvent être notées en environ 4 h, bien que la notation puisse être effectuée plus tard. Avec notre essai, le temps de sédation enregistré pour la plupart des mouches varie de 5 à 15 min à une exposition à 1 ml d’éthanol de 100 %. Des concentrations plus faibles d’éthanol ou de volumes de livraison plus faibles entraîneront des temps de sédation plus longs.
Les méthodes actuelles d’évaluation du temps de sédation nécessitent de tester un grand nombre de mouches sans permettre facilement des mesures sur les individusindividuels 15,16,17,18,19,20,21,22,23,24,25,26. Beaucoup de sédation et d’analyses de sensibilité actuelles reposent sur ST5022,23,24, le point de temps auquel 50% des mouches sont sous sédatifs à la suite de l’exposition à l’éthanol. Bien que l’obtention du ST50 pour les groupes de mouches n’ait pas été la principale motivation pour développer cet essai, les enregistrements vidéo démontrent une utilité plus élevée par rapport aux méthodes actuelles, car les enregistrements peuvent être utilisés pour déterminer le ST50 pour les groupes de mouches testées individuellement et pour mesurer le pourcentage de mouches qui satisfont à un critère donné (p. ex., perte de contrôle postural) à tout moment. Il convient de noter que de telles analyses vidéo nécessiteraient plus de temps.
Contrairement aux essais actuels d’inesbriomètre, la méthode que nous décrivons ne nécessite pas d’outils spécialisés pour être mis en place et peut être effectuée dans n’importe quel laboratoire à l’aide de matériaux communs. En utilisant cette méthode, nous avons obtenu des temps de sédation fiables et cohérents pour les mouches individuelles. L’essai peut, en principe, être étendu pour évaluer les effets de l’exposition à toute substance volatile. L’essai peut également être appliqué pour mesurer les effets de la toxicité aigue des substances volatiles sur d’autres insectes, y compris d’autres espèces de mouches. Les données individuelles sur le temps de sédation peuvent être utilisées pour évaluer l’étendue de la variation phénotypique au sein d’une population, comme la DGRP.
Nous avons utilisé de petits moustailles d’écran d’insecte pour empêcher le contact direct avec la solution d’éthanol tout en permettant des quantités suffisantes de vapeurs d’éthanol pour atteindre la mouche. La couche de tissu à fromage blanc sur le dessus de la maille d’écran fournit un contraste visuel entre la mouche et la surface ci-dessous et garantit que les mouches ne sont pas pris dans le maillage d’écran, ce qui pourrait conduire à une détermination ambigue de la perte de contrôle postural. Les membranes disponibles dans le commerce qui sont poreuses pour l’eau et l’air ont donné des résultats incohérents et étaient insuffisamment pénétensibles aux vapeurs d’éthanol. Nous avons intentionnellement utilisé de petits maillages d’écran d’insecte parce qu’il s’agit d’un matériau uniformément poreux qui minimise la variation de l’exposition à l’éthanol en raison de la position de mouche dans un puits. Des modifications peuvent être apportées à ce protocole en fonction des matériaux disponibles, bien que nous recommandons une chambre comportementale contrôlée, l’accès à 90 % à 100 % d’éthanol près de la mouche, et une exposition uniforme à l’éthanol.
La position de mouche dans les plaques de culture cellulaire doit être randomisée entre les répliques pour éviter le biais positionnel. Pour les expériences plus grandes qui nécessitent l’utilisation de cet essai sur plusieurs jours et sont donc soumis à des variations environnementales qui pourraient influencer les résultats d’analyse (par exemple, les changements de pression barométrique)27, nous recommandons fortement que les mouches soient testées à la même heure chaque jour et randomisées à la fois en quelques jours, surtout si différentes lignes et /ou sexes doivent être comparés les uns aux autres.
La méthode que nous avons mise au point est la mieux adaptée pour mesurer l’effet de l’exposition aigue à l’alcool, mais elle n’est pas adaptée à l’obtention de données sur la consommation ou à la modélisation de la dépendance. Les données sur la sensibilité à la sédation de l’alcool obtenues à partir de cet essai peuvent cependant être intégrées à d’autres mesures des phénotypes liés à l’alcool. Une limitation du système est que la hauteur verticale des plaques de culture cellulaire standard permet un mouvement vertical de mouche qui ne peut pas être facilement suivi par vidéo pour une évaluation détaillée de l’activité globale ou de la locomotion. Toutefois, cette limitation n’affecte pas l’évaluation précise du temps de sédation. Lors de l’utilisation de mouches de différents génotypes (par exemple, dans les populations de race dérivée de la DGRP28), cet essai permet également la récupération de mouches individuelles pour recueillir des bassins de mouches avec des phénotypes contrastés pour le séquençage de l’ADN en vrac et la cartographie QTL extrême29,30. Dans l’ensemble, cet essai permet une collecte rapide et peu coûteuse de données sur la sédation de l’alcool sur un grand nombre de mouches individuelles.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des subventions DA041613 et GM128974 des National Institutes of Health au TFCM et à la RRHA.
matériels
| Name | Company | Catalog Number | Comments |
| 24-well Cell Culture Plates | Corning | 3526 | Flat-bottomed; will house flies throughout assay |
| Aspirator | |||
| Cheesecloth | Genesee Scientific | 53-100 | Widely available. |
| Ethanol | Decon Labs | V1001 | Widely available. |
| Flexible Plastic Cutting Board (Plate Cover) | Walmart | 550098612 | Any flat plastic that can slide easily and cover a 24-well plate completely. Flexible plastic cutting board works well. |
| Gauze (for aspirator) | Honeywell North | 67622 | Widely available. |
| Illumination Pad | Amazon (AGPtek) | ASIN B00YA9GP0G | Any light pad to provide contrast is suitable. |
| Jumbo Craft Sticks | Michaels | 10334892 | Any craft stick at least 7 cm long is suitable. |
| P1000 Pipette Tip (for aspirator) | Genesee Scientific | 24-165RL | Any P1000 pipette tip is suitable. |
| Serological Pipette (for aspirator) | Genesee Scientific | 12-104 | |
| Small Insect Screen Mesh | Lowe's (Saint-Gobain ADFORS) | 89322 | Any small insect screen mesh is suitable. |
| Testing Chamber | Interior space dimension big enough to encompass light pad. Can be constructed from a polystyrene box. | ||
| Tygon Tubing (for aspirator) | Grainger | 9CUG7 | Widely available. |
| Video Camera | Canon | 1959C001AA | Any video camera is suitable. |
Références
- Heath, A. C., et al. Genetic differences in alcohol sensitivity and the inheritance of alcoholism risk. Psychological Medicine. 29 (5), 1069-1081 (1999).
- Schuckit, M. A., Smith, T. L. The relationships of a family history of alcohol dependence, a low level of response to alcohol and six domains of life functioning to the development of alcohol use disorders. Journal of Studies on Alcohol. 61 (6), 827-835 (2000).
- Trim, R. S., Schuckit, M. A., Smith, T. L. The relationships of the level of response to alcohol and additional characteristics to alcohol use disorders across adulthood: a discrete-time survival analysis. Alcoholism: Clinical and Experimental Research. 33 (9), 1562-1570 (2009).
- Schuckit, M. A., Smith, T. L. Onset and course of alcoholism over 25 years in middle class men. Drug and Alcohol Dependence. 113 (1), 21-28 (2011).
- Morozova, T. V., Mackay, T. F. C., Anholt, R. R. H. Genetics and genomics of alcohol sensitivity. Molecular Genetics and Genomics. 289 (3), 253-269 (2014).
- Heberlein, U., Wolf, F. W., Rothenfluh, A., Guarnieri, D. J. Molecular genetic analysis of ethanol intoxication in Drosophila melanogaster. Integrative and Comparative Biology. 44 (4), 269-274 (2004).
- Engel, G. L., Taber, K., Vinton, E., Crocker, A. J. Studying alcohol use disorder using Drosophila melanogaster in the era of 'Big Data'. Behavioral and Brain Functions. 15 (1), 7 (2019).
- Singh, C. M., Heberlein, U. Genetic control of acute ethanol-induced behaviors in Drosophila. Alcoholism: Clinical and Experimental Research. 24 (8), 1127-1136 (2000).
- Mackay, T. F. C., et al. The Drosophila melanogaster Genetic Reference Panel. Nature. 482 (7384), 173-178 (2012).
- Huang, W., et al. Natural variation in genome architecture among 205 Drosophila melanogaster Genetic Reference Panel lines. Genome Research. 24 (7), 1193-1208 (2014).
- Morozova, T. V., et al. A Cyclin E centered genetic network contributes to alcohol-induced variation in Drosophila development. G3. 8 (8), 2643-2653 (2018).
- Morozova, T. V., et al. Polymorphisms in early neurodevelopmental genes affect natural variation in alcohol sensitivity in adult drosophila. BMC Genomics. 16, 865 (2015).
- Scholz, H., Ramond, J., Singh, C. M., Heberlein, U. Functional ethanol tolerance in Drosophila. Neuron. 28 (1), 261-271 (2000).
- Berger, K. H., Heberlein, U., Moore, M. S. Rapid and chronic: two distinct forms of ethanol tolerance in Drosophila. Alcoholism: Clinical and Experimental Research. 28 (10), 1469-1480 (2004).
- Morozova, T. V., Anholt, R. R. H., Mackay, T. F. C. Transcriptional response to alcohol exposure in Drosophila melanogaster. Genome Biology. 7 (10), 95 (2006).
- Weber, K. E. An apparatus for measurement of resistance to gas-phase agents. Drosophila Information Service. 67, 91-93 (1988).
- Weber, K. E., Diggins, L. T. Increased selection response in larger populations. II. Selection for ethanol vapor resistance in Drosophila melanogaster at two population sizes. Genetics. 125 (3), 585-597 (1990).
- Cohan, F. M., Graf, J. D. Latitudinal cline in Drosophila melanogaster for knockdown resistance to ethanol fumes and for rates of response to selection for further resistance. Evolution. 39 (2), 278-293 (1985).
- Scholz, H., Franz, M., Heberlein, U. The hangover gene defines a stress pathway required for ethanol tolerance development. Nature. 436 (7052), 845-847 (2005).
- Morozova, T. V., Anholt, R. R. H., Mackay, T. F. C. Phenotypic and transcriptional response to selection for alcohol sensitivity in Drosophila melanogaster. Genome Biology. 8 (10), 231 (2007).
- Morozova, T. V., et al. Alcohol sensitivity in Drosophila: Translational potential of systems genetics. Genetics. 83, 733-745 (2009).
- Bhandari, P., Kendler, K. S., Bettinger, J. C., Davies, A. G., Grotewiel, M. An assay for evoked locomotor behavior in Drosophila reveals a role for integrins in ethanol sensitivity and rapid ethanol tolerance. Alcoholism: Clinical and Experimental Research. 33 (10), 1794-1805 (2009).
- Sandhu, S., Kollah, A. P., Lewellyn, L., Chan, R. F., Grotewiel, M. An inexpensive, scalable behavioral assay for measuring ethanol sedation sensitivity and rapid tolerance in Drosophila. Journal of Visualized Experiments. (98), e52676 (2015).
- Urizar, N. L., Yang, Z., Edenberg, H. J., Davis, R. L. Drosophila homer is required in a small set of neurons including the ellipsoid body for normal ethanol sensitivity and tolerance. The Journal of Neuroscience. 27 (17), 4541-4551 (2007).
- Wolf, F. W., Rodan, A. R., Tsai, L. T., Heberlein, U. High-resolution analysis of ethanol-induced locomotor stimulation in Drosophila. The Journal of Neuroscience. 22 (24), 11035-11044 (2002).
- Cohan, F. M., Hoffmann, A. A. Genetic divergence under uniform selection. II. Different responses to selection for knockdown resistance to ethanol among Drosophila melanogaster populations and their replicate lines. Genetics. 114 (1), 145-164 (1986).
- Pohl, J. B., et al. Circadian genes differentially affect tolerance to ethanol in Drosophila. Alcoholism: Clinical and Experimental Research. 37 (11), 1862-1871 (2013).
- Huang, W., et al. Epistasis dominates the genetic architecture of Drosophila quantitative traits. Proceedings of the National Academy of Sciences of the United States of America. 109, 15553-15559 (2012).
- Ehrenreich, I. M., et al. Dissection of genetically complex traits with extremely large pools of yeast segregants. Nature. 464 (7291), 1039-1042 (2010).
- Anholt, R. R. H., Mackay, T. F. C. The road less traveled: From genotype to phenotype in flies and humans. Mammalian Genome. 29, 5-23 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon