Method Article
从多个中枢神经系统区域解剖和分离小鼠神经胶质细胞
摘要
在这里,我们提出了一种从小鼠CNS体外分离多个神经胶质细胞群的方案。该方法允许分离区域小胶质细胞、少突胶质细胞前体细胞和星形胶质细胞,以研究每种细胞在各种培养系统中的表型。
摘要
这里介绍的方法展示了从小鼠新生儿中解剖中枢神经系统(CNS)的四个不同区域的实验室程序,以分离神经胶质亚群。该程序的目的是从皮质、小脑、脑干和脊髓组织中解离小胶质细胞、少突胶质细胞祖细胞 (OPC) 和星形胶质细胞,以促进进一步的体外分析。CNS区域分离程序允许确定多个细胞培养系统中胶质细胞之间的区域异质性。进行快速中枢神经系统区域分离,然后机械去除脑膜以防止脑膜细胞污染神经胶质细胞。该协议将温和的组织解离和铺在指定的基质上,旨在保持细胞的完整性和粘附性。从多个CNS区域分离混合胶质细胞可以全面分析潜在的异质性胶质细胞,同时最大限度地利用单个实验动物。此外,在区域组织解离后,混合胶质细胞进一步分为多种细胞类型,包括小胶质细胞、OPC 和星形胶质细胞,用于单细胞类型、细胞培养板插入物或共培养系统。总体而言,所展示的技术为从小鼠新生儿中仔细解剖四个单独的CNS区域提供了广泛的适用性的综合方案,并包括分离三种个体胶质细胞类型的方法,以检查任意数量的体外细胞培养系统或测定中的区域异质性。
引言
神经胶质细胞是中枢神经系统正常神经元功能所必需的。它们由三个主要的亚群组成,星形胶质细胞、少突胶质细胞和小胶质细胞,每个亚群都有不同但不可或缺的作用1。如果没有适当的神经胶质细胞多样性和活性,神经元功能将受到严重影响,导致中枢神经系统损伤。神经胶质细胞能够影响神经传递,每种细胞类型都以独特的方式影响神经传递。大脑中的神经胶质细胞具有相互之间以及与神经元细胞交流的能力,以促进适当的中枢神经系统功能2。少突胶质细胞通过形成髓鞘来提高电传输速度,这促进了Ranvier节点处离子通道的聚集,Ranvier是神经元动作电位产生3的部位。小胶质细胞通过监测突触传递和损伤后"重新布线"神经元连接,对突触的修剪至关重要4.此外,小胶质细胞是中枢神经系统最丰富的常驻免疫细胞,是宿主防御病原体的主要形式5。星形胶质细胞可以通过改变细胞外钾6的浓度来调节神经元之间的突触传递。它们在控制局部血流7,释放和吸收神经调节元件8方面也起作用,并在血脑屏障维持中发挥关键作用9。因此,每种神经胶质亚型对中枢神经系统功能至关重要,因为任何类型的缺陷长期以来都与多种病理状态有关,包括精神疾病、癫痫和神经退行性疾病10。
中枢神经系统病理生物学研究的最大障碍是无法在其微环境生态位的背景下研究人类细胞。人活检组织大多是在死后收集的,细胞在提取和加工过程中很容易受损或丢失。此外,在不从肿瘤中获得永生化细胞系的情况下,保持人体细胞在任何体外存活和存活都是一个挑战,此时它们不再准确反映其正常的生理特性11,12。此外,单个神经胶质细胞类型13,14,15之间存在大量的区域异质性,并且几乎不可能从单个患者获得区域CNS样本。因此,有必要开发替代模型来研究区域胶质细胞在特定CNS疾病中的贡献。
在这里,我们描述了一种体外系统,该系统使用多个神经胶质亚群的小鼠CNS区域特异性分离,允许操纵和定量小胶质细胞,少突胶质细胞前体细胞(OPC),其产生成熟的少突胶质细胞和星形胶质细胞。每个群体都可以独立分离并接受各种实验技术,包括药物或分子处理,免疫细胞化学,蛋白质/ RNA提取和分析以及其他共培养系统,具体取决于实验需要。此外,这种分离技术产生高细胞数量,允许以高通量方式表征和研究每个神经胶质群体。它还能够以受控方式研究中枢神经系统细胞分化、生长和增殖,以响应各种微环境刺激,以避免体内环境中通常存在的混杂因素。最后,这种细胞分离技术有助于操纵不同CNS区域内的神经胶质细胞群,以研究区域胶质细胞如何相互作用并对不同的刺激做出反应,从而实现精确性和可重复性。
研究方案
注意:所有动物研究均由克利夫兰诊所勒纳研究所机构动物护理和使用委员会授权和批准。
1. 准备解剖用培养基和用品
注意: 表1中提供了所有缓冲液和培养基配方。该程序在无菌条件下在指定的生物安全柜的组织培养物中进行。
- 制备无菌过滤混合胶质培养基(MGM)。这可以在前一天完成并储存在4°C。
- 用无菌H2O以1:100浓度稀释纤连蛋白。稀释纤连蛋白的体积将取决于用于实验的幼崽数量和CNS区域。将一个 T25 烧瓶用于 1 个皮质,一个 T25 烧瓶用于 2-4 个小脑,一个 T25 烧瓶用于 2-4 个脑干,一个 T25 烧瓶用于 2-4 条脊髓。
注意:使用上面列出的标准合并来自同一区域的组织将允许充分的解离,而不会改变下面描述的方案。组合比步骤1.2中描述的更多的组织将需要进一步优化解离试剂浓度。 - 在室温下将3mL稀释的纤连蛋白移液到T25烧瓶中,静置2分钟。
- 吸出纤连蛋白,让烧瓶干燥过夜,烧瓶盖松开。
2.皮质、小脑、脑干和脊髓夹层
注意:此过程可以在台式上完成,并且需要解剖镜。在手术的所有步骤中使用严格的无菌技术,并尽量减少组织暴露于室内空气。在解剖过程中,将所有培养基放在冰上冷却,以确保最大程度的组织保存。或者,该程序可以在允许使用内部解剖镜的罩中完成。
- 用70%乙醇擦拭所有区域。
- 将 10 mL PBS/抗生素溶液 (PAS) 移液到 10 cm 培养皿中。为每只要解剖的幼崽准备一个培养皿。放在冰上以保持溶液冷却。
- 在消毒的组织培养罩中,将 9 mL DMEM(不含添加剂)移液到 4 个独立的 15 mL 锥形管中,每个 CNS 区域一个,更换管盖,然后放在冰上。将装有管子的冰桶放置在距解剖镜一定距离的地方。
- 将步骤2.2中制备的10cm培养皿置于消毒解剖镜台上。
- 根据机构协议麻醉和安乐死小鼠幼崽,并通过用锋利的剪刀快速斩首去除头部。
注意:出生后日(P)使用3-5只幼崽。年龄较大的幼崽具有更发达的中枢神经系统,可能不是扩张神经胶质细胞的充分来源。年轻的幼崽(P)0-2可能会产生更多的胶质细胞,可以使用;然而,由于大小的原因,脊髓组织在这个年轻时很难解剖。 - 使用 70% 乙醇清洁幼犬的皮肤。
- 使用细剪刀,沿着动物头部的中线切割皮肤层,从尾部开始并移动嘴部,直到到达鼻子。避免深入颅骨,以避免任何组织损伤。
- 将头部向下倾斜,将皮肤层拉到颅骨的每一侧,然后用弹簧剪刀,沿着颅骨中线切开一个切口,从大孔开始,再次从尾部切到尾部。
- 用细尖镊子将头骨向左右两侧拉动,露出皮质、小脑和脑干。
- 暴露后,轻轻地将大脑从颅骨中取出,放入步骤2.2中制备的10厘米培养皿中。确保大脑保持完好无损,以保持解剖结构,并附着后脑。
- 使用细的弯曲镊子,镊子的尖端朝上,捏住小脑。取出脑膜,放入冰桶中指定的 15 mL 锥形管中。
- 确保脑干直接位于小脑腹侧,并且在切除小脑后可见。用细尖镊子将其取出,去除脑膜,然后放入冰桶中指定的 15 mL 锥形管中。
- 将中脑与皮质分离,去除皮质脑膜,并放入冰桶中的指定 15 mL 锥形管中。
- 要去除脊髓,将被斩首的小鼠幼崽置于仰卧位(面朝上躺着),切断的椎柱朝向研究者。
- 再次用70%乙醇喷洒。
- 沿着椎体的外侧,沿喙部到尾部方向,穿过肋骨,直到到达后肢。切割时,向后推内脏,直到椎柱可见。
- 沿着椎柱的每个侧侧切,直到将其隔离并放置在步骤2.2中制备的10厘米培养皿中。
- 腹侧朝上,使用细弹簧剪刀,交替切割每个椎骨的左右两侧,直到到达腰部区域以暴露脊髓组织。
- 在解剖显微镜下用细尖镊子轻轻取出脊髓和脑膜。放入冰桶中指定的 15 mL 锥形管中。
- 对每只幼崽重复步骤2.5.-2.19,结合来自同一区域的组织,以符合步骤1.2中概述的每个T25烧瓶的标准。
注意:尽可能完全去除脑膜。如果残留大量脑膜,脑膜细胞的成纤维细胞样表型将脱落并压倒细胞培养物。可以组合具有相同表型的多个脊髓以产生特定的细胞培养物。注意确保不会发生细胞过度拥挤,这可能导致神经胶质细胞凋亡和差异表型。
3. 组织解离
注意:以下所有程序均使用无菌技术和无菌材料在无菌组织培养指定的生物安全柜中进行。
- 向每 15 mL 9 mL DMEM 锥形管和组织中加入 1 mL 含有 0.53 mM EDTA 的 0.05% 胰蛋白酶,开始组织裂解。
注意:DMEM含有大量的氯化钙,可以作为胰蛋白酶的抑制剂。如果按照概述的步骤没有完成解离,可以使用不含钙或镁的汉克斯平衡盐溶液。胰蛋白酶消化后,可以通过添加胰蛋白酶抑制剂来中和酶,尽管钙应加回溶液中,因为它是DNase I的辅助因子,用于后续步骤。 - 用 10 mL 移液器研磨约 20 倍。
- 将细胞悬液转移到空的 50 mL 锥形管中。
- 将溶液在37°C,5%CO2 下孵育15分钟,8分钟后轻轻搅拌裂解物。
- 向每个试管中加入 5 mL MGM 和 200 μL (5 mg/mL) 脱氧核糖核酸酶 I,最终浓度为 50 μg/mL。
- 用 10 mL 移液管 10x 研磨每个裂解物。
- 让细胞悬液在室温下静置3分钟,以使未解离的组织沉淀在管的底部。
- 将细胞悬液转移到新的 50 mL 锥形管中,留下未解离的组织。
注意:上述裂解和研磨步骤显着限制了非解离组织的量。 - 在没有制动的情况下在4°C下以300× g 离心管3分钟。
- 吸出上清液并将剩余的细胞沉淀重悬于 5 mL MGM 中。
- 用 5 mL 移液管 20x 研磨沉淀。
- 将 5 mL 细胞悬液铺在包被的 T25 烧瓶上。
- 将细胞在37°C,5%CO2 下孵育,并在24小时后最初更换培养基以除去细胞碎片。
注意:某些协议建议在72小时后进行初始培养基更换。可能需要优化此步骤。 - 每48-72小时用MGM进行100%的培养基更换,直到细胞80%汇合(约5-7天)。
注意:在更换介质之前,所有介质必须加热至37°C。
4. 小胶质细胞分离
- 一旦混合的胶质培养物达到80%汇合度,通过拧紧盖子并用石蜡膜密封来准备用于摇动的烧瓶。
- 为了从混合胶质培养物中去除小胶质细胞,将烧瓶水平固定在37°C培养箱内的轨道振荡器上。以15× g 摇动烧瓶1小时。
- 取出培养基并将移液器移入 15 mL 锥形管中。用 3 mL 温热的 MGM 冲洗烧瓶两次,向 15 mL 锥形管中加入洗涤液。这些是小胶质细胞。
- 向培养瓶中加入 5 mL 温热、新鲜的 MGM。
- 用石蜡膜重新密封烧瓶,将烧瓶水平固定在摇床上,并在37°C下以15× g 摇动15小时,以从星形胶质细胞中分离OPC。
注意:此步骤可以在夜间完成,但15小时摇动时间至关重要,因为过多的时间可能导致细胞死亡。 - 离心步骤4.3中的上清液。在300× g 下3分钟,并根据标准方案16 培养小胶质细胞或用于生物测定。
5. 少突胶质细胞前体细胞分离
注意:在初始分离后电镀OPC时,必须将它们镀在聚-D-赖氨酸涂层表面(无菌板或盖玻片)上。在完成本节之前准备这些材料。
- 摇动15小时后,从烧瓶中取出上清液,并放在无菌100mm培养皿上。
- 将上清液在37°C,5%CO2 下孵育30分钟,15分钟后旋转以除去剩余的小胶质细胞,因为这些小胶质细胞会很快粘附在培养皿上。非组织培养处理的培养皿可用于此步骤。
- 去除非贴壁细胞上清液,计数,并在聚-D-赖氨酸包被的表面上进行平板。通常,7,500-10,000 OPC 镀/cm2。
- 在37°C,5%CO2 下孵育至少1小时(最多6小时),然后轻轻吸出95%的培养基,并缓慢加入温热的OPC培养基,将培养基移液到孔壁上以最大程度地减少OPC的破坏。每48小时更换一次培养基,直到细胞准备好使用。
注意:一次只更换一个孔至关重要。OPCs很敏感,对干燥条件尤其不耐受。在OPC培养基中添加PDGF-AA可以延迟OPC成熟为少突胶质细胞。如果实验重点是成熟的少突胶质细胞,则可以从培养基中排除该因子。
6.星形胶质细胞分离
- 摇匀15小时后,除去上清液,用温热的1x PBS冲洗烧瓶2次。
- 加入4mL含有0.53mM EDTA的0.05%胰蛋白酶,并在37°C,5%CO2 下孵育5分钟或直到细胞升高。为了确保星形胶质细胞已经抬起,请使用标准的宽视场显微镜观察它们。胰蛋白酶消化后星形胶质细胞将呈现球形。
- 星形胶质细胞分离后,垂直放置烧瓶并加入 4 mL MGM。研磨混合。
- 将星形胶质细胞移液到15mL锥形管中,以300× g 离心5分钟。
- 如步骤1.2所述,将星形胶质细胞重悬于星形胶质细胞培养基中,并在纤连蛋白包被的表面上进行平板。或用于生物测定。
注意:在第一次更换培养基期间可以添加20ng / mL鼠成纤维细胞生长因子,以帮助建立星形胶质细胞培养物。此外,标准明胶包衣可能是纤连蛋白的低成本替代品。
7. 使用免疫细胞化学鉴定和分离小胶质细胞、OPC、星形胶质细胞和成熟少突胶质细胞
- 一旦铺板细胞达到适当的汇合度,轻轻去除培养基并使用4%多聚甲醛(PFA)固定贴壁细胞10分钟。在生物安全柜中执行此步骤。
注意:吸液或添加溶液时,请轻轻按压移液以防止细胞脱落。 - 缓慢吸出PFA,然后用1x PBS洗涤细胞3次5分钟。
- 在 1x PBS 中使用 10% 血清和 0.1% Triton X-100 制备适当的封闭溶液。
注意:血清来源反映了产生二抗的宿主动物。例如,如果二抗是山羊抗兔,则适当的封闭血清是正常的山羊血清。同样,如果二抗是驴抗兔,阻断血清应该是正常的驴血清。 - 加入封闭溶液,直到细胞完全覆盖。在室温下块1小时。
- 制备抗体稀释剂溶液(9 mL 1x PBS、0.01 g 牛血清白蛋白、30 μL Triton X-100)。或者,抗体可以在步骤6.3中描述的封闭溶液中稀释。
- 在抗体稀释剂或封闭溶液中稀释针对以下物质的特异性一抗:
- 小胶质细胞:离子钙结合衔接分子 1 (Iba1),稀释度为 1:250 (2.4 μg/mL)。
- OPC:神经/神经胶质抗原 2 (NG2),稀释度为 1:200 (5 μg/mL)。
- 成熟少突胶质细胞:1:400稀释度的髓鞘碱性蛋白(MBP)(浓度取决于批次,可能需要优化)。
- 星形胶质细胞:1:400稀释度(0.25μg/mL)的神经胶质纤维酸性蛋白(GFAP)17。
注意:不要混合在同一物种中产生的一抗。
注意:GFAP将可靠地标记白质星形胶质细胞。对于灰质星形胶质细胞,可能需要使用替代标志物。
- 将一抗在4°C孵育过夜(最好轻轻搅拌)。
- 用1x PBS洗涤3次5分钟以去除一抗。
- 将细胞与适当的二抗以1:400稀释度在避光的抗体稀释剂或封闭溶液中孵育。
注意:二抗与荧光团偶联,荧光团可根据可用的显微镜参数互换。一旦应用了荧光二抗,请尽可能避光。 - 在室温下孵育二抗1小时,限制暴露在光线下。
- 用1x PBS洗涤3次5分钟以去除多余的二抗。
- 要标记细胞核,请使用 1:1,000 DAPI/PBS 溶液并在室温下在黑暗中孵育细胞 5 分钟。
- 用 1x PBS 在黑暗中清洗 3 次 5 分钟。
- 要安装,请涂抹封片剂,并在成像前在黑暗中干燥。
注意:安装的载玻片可以在室温下储存 2-3 天。对于长期储存,将载玻片移至4°C。 一周内的图像以获得最大信号。所有代表性图像均已在共聚焦显微镜上成像;但是,也建议使用倒置荧光显微镜。
结果
下面显示的代表性数据表明,IFNγ信号传导影响OPC分化和成熟。如果没有IFNγ受体(IFNγR)的存在,皮质OPCs不会轻易分化为成熟的髓鞘少突胶质细胞,这可以通过没有MBP染色来证明(图1)。由于少突胶质细胞和星形胶质细胞来源于共同的祖细胞,我们分析了标记星形胶质细胞的GFAP表达。我们发现IFNγR缺陷细胞强烈表达GFAP,表明它们可能正在采用星形胶质细胞表型,证实了早期的报道19。
在皮层、小脑、脑干和脊髓的星形胶质细胞中观察到的不同星形胶质细胞形态证明了中枢神经系统细胞区域异质性的其他证据(图 2)。值得注意的是,来自同一区域的星形胶质细胞也可能表现出形态学异质性,支持这种神经胶质亚型是高度动态的观点。细胞结构的差异提示功能多样性,因此分离神经胶质群体的能力对于在没有和存在微环境刺激的情况下研究表型反应是必要的。
少突胶质细胞对于神经元轴突的髓鞘形成至关重要,并且是适当的中枢神经系统修复和功能所必需的。OPC产生成熟的对应物,因此了解其分化能力背后的生物学至关重要。细胞因子信号传导显着影响干细胞和免疫细胞的行为。因此,重要的是要了解OPCs的区域反应如何变化对差异细胞因子刺激(图3),这可能会影响它们分化为成熟髓鞘少突胶质细胞的能力。
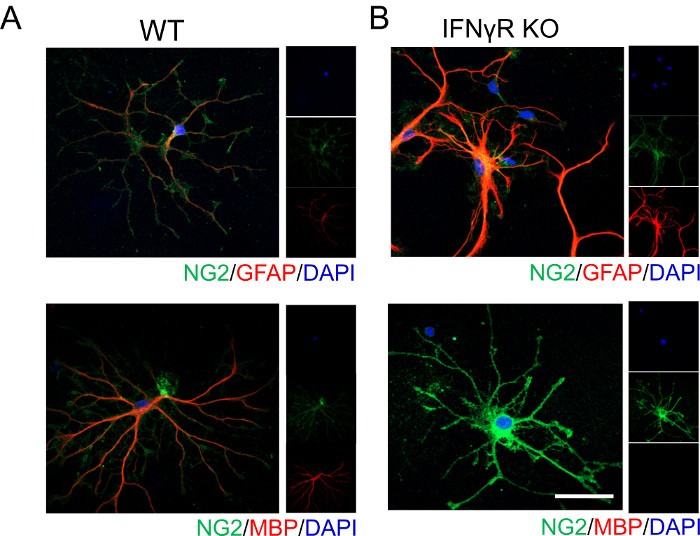
图1:代表性数据显示在外源性IFNγ存在下WT和IFNγR-/- 小鼠的OPC分化。按照上述程序从( A) WT和 (B) IFNγR-/- P4小鼠幼崽中分离皮质OPC。用1ng / mL IFNγ处理细胞48小时,然后固定并染色以描绘细胞分化。对OPCs进行NG2和GFAP标记,以鉴定那些采用星形胶质细胞表型的OPC。同样,OPCs也被标记为NG2和MBP,以鉴定那些分化为成熟少突胶质细胞的OPC。比例尺 = 20 μM。 请点击此处查看此图的大图。
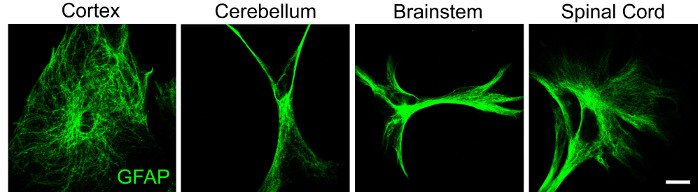
图2:显示星形胶质细胞形态区域异质性的代表性数据。 使用上述方案从P4小鼠幼崽中分离来自皮质,小脑,脑干和脊髓的星形胶质细胞,并在培养48小时后通过免疫细胞化学标记GFAP(绿色)。比例尺 = 20 μM。 请点击此处查看此图的大图。
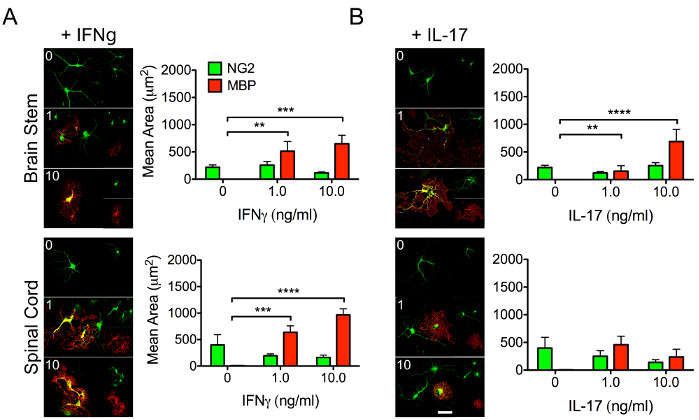
图3:代表性数据表明区域OPC对细胞因子的不同反应。 使用上述方案从P4小鼠幼崽的脑干和脊髓中分离OPC。用(A ) IFNγ或(B)白细胞介素(IL)-17的浓度增加(1-10ng / mL ) 处理细胞,以研究细胞因子对区域OPC分化为髓鞘少突胶质细胞的能力的差异影响。在用指定的细胞因子孵育48小时后,将OPCs固定并标记NG2(绿色)和MBP(红色)。比例尺 = 20 μM。数据表示 SEM ±平均值。 **, p < 0.01;, p < 0.001;, p < 0.0001 通过 2 路方差分析。 请点击此处查看此图的大图。
| PBS/抗生素溶液 (PAS): | ||
| 1.0毫升 | 100X 抗生素/抗真菌剂,含 10,000 单位/mL 青霉素和 10,000 mg/mL 链霉素 | |
| 25毫克/毫升 | 两性霉素B | |
| 99毫升 | 1X 公共广播电视 | |
| 混合胶质细胞培养基(米高梅) | ||
| 88毫升 | 1X DMEM(高葡萄糖,含L-谷氨酰胺,含丙酮酸) | |
| 10毫升 | 热灭活FBS | |
| 1.0毫升 | L-谷氨酰胺(100X) | |
| 1.0毫升 | 抗生素/抗真菌药 | |
| OPC 培养基(50 毫升) | ||
| 49毫升 | 神经基础培养基 | |
| 1.0毫升 | B27 补充剂 (50X) | |
| 10 纳克/毫升 | PDGF-AA | |
| 注意:PDGF-AA 是在每次更换介质之前新鲜添加的。 | ||
| 星形胶质细胞培养基(1升) | ||
| 764毫升 | 含有谷氨酰胺的厄尔盐的MEM | |
| 36毫升 | 葡萄糖(使用 100 mg/mL 储备液进行 20 mM 的最终浓缩) | |
| 100毫升 | 热灭活FBS | |
| 100毫升 | 热灭活马血清 | |
| 10毫升 | 谷氨酰胺(如果未包含在原液培养基中,请使用 200 mM 原液) | |
| 可选:10 ng/mL 重组小鼠表皮生长因子 | ||
| 注意:无菌过滤所有培养基并储存在 4°C 直至使用。 | ||
表1:缓冲液和培养基配方。
讨论
在该协议中,我们描述了从小鼠CNS中分离出三种主要的神经胶质细胞亚群:小胶质细胞,OPC和星形胶质细胞。神经退行性和神经炎症性中枢神经系统疾病研究的一个主要挫折是缺乏原代人类细胞和组织,特别是那些区域性和来自同一患者的细胞和组织。在大多数情况下,人类中枢神经系统细胞系来源于转化的永生化癌细胞,这些癌细胞可能无法准确表示其正常生理行为20,21,22。因此,需要替代方法来以受控方式研究CNS细胞表型。此外,神经胶质细胞群的多样性使得有必要研究每种亚型,既可以彼此独立,也可以在共培养条件下进行研究,以概括它们的细胞自主和非自主功能。神经胶质细胞在中枢神经系统中具有多种关键功能,包括神经元支持23,学习/认知24,25和CNS免疫反应26。因此,有必要在生理和病理背景下了解每个神经胶质亚群的分子和细胞功能。为了做到这一点,我们在这里提供了一种可靠的方法来提取和分离活的胶质细胞亚型。由于人类受试者研究的实际和伦理限制,动物模型是目前与人类神经胶质细胞生物学最相关的替代物。特别是,小鼠是理想的模式动物,因为它们的基因组可以纵和分析,以进一步剖析健康和疾病的特定分子机制。因此,成功去除和分离小鼠小胶质细胞、OPC 和星形胶质细胞是研究神经胶质细胞在生理、神经退行性或神经炎症性疾病期间功能的关键工具。
该协议可以优化以探索CNS细胞区域异质性。越来越明显的是,神经胶质细胞在形式和功能上表现出区域异质性。星形胶质细胞具有区域多样性,并且根据它们在CNS27中的位置而显示出不同的形态。此外,星形胶质细胞的密度及其有丝分裂指数可以定义解剖区域,支持区域星形胶质细胞异质性可能根据其在CNS28中的位置反映分子和功能差异的假设。小胶质细胞区域异质性也在积极研究中,尽管小胶质细胞多样性在中枢神经系统发展或行为中的潜在机制和功能后果目前尚不清楚。然而,已知成体小胶质细胞在细胞数量、细胞和亚细胞结构以及分子特征方面表现出多样性29。此外,多重质谱细胞术的最新进展进一步定义了小胶质细胞的区域异质性,分析了来自九个人类供体的五个不同CNS区域的细胞表型,允许对人小胶质细胞进行大规模免疫表型30。目前,这些方法还处于起步阶段,使动物研究成为研究中枢神经系统疾病发展中区域胶质细胞的可行解决方案。最后,最近在少突胶质细胞中也描述了区域异质性。对来自幼年和成体中枢神经系统 10 个区域的 5072 个单个细胞进行单细胞 RNA 测序,确定了不同分化阶段的 13 个不同的亚群31。重要的是,还发现随着少突胶质细胞从OPC成熟,它们的转录谱分化,其功能表型发生变化,突出了CNS31中的少突胶质细胞异质性。
因此,了解各种常驻CNS细胞在其不同的相邻神经元和其他神经胶质细胞的背景下的区域异质性可能为未来开发治疗神经炎症和神经退行性疾病的新疗法提供重要的理由。虽然该协议侧重于神经胶质亚群的提取,分离和鉴定,但它为检查其功能提供了一个方便的起点。此外,它可以与转基因小鼠模型进行调整和结合,以研究与神经胶质细胞生物学相关的遗传机制。它还可用于检查神经胶质细胞在共培养测定中相互响应。概述的步骤代表了一种经济高效且高通量的方法,用于提取和分离不同的CNS神经胶质细胞群,然后可以适应各种实验参数。应该指出的是;然而,这里描述的方法利用新生儿,因为髓鞘形成水平较低,增殖胶质细胞密度高。由于这些原因,与成年动物相比,从新生儿中分离出活的胶质细胞在技术上更可行。因此,在实验设计和数据解释过程中应考虑新生儿胶质细胞与成人胶质细胞的表型差异。
披露声明
作者有利益冲突需要披露。
致谢
我们感谢Morgan Psenicka的手稿编辑和讨论,感谢Grahame Kidd博士在图表格式方面的帮助。这项工作得到了NIAID K22 AI125466(JLW)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin and 0.53 mM EDTA | Gibco | 25300054 | Tissue dissociation |
| 12-Well Plates | Greiner Bio-One | 665 180 | Cell culture plate |
| 1X PBS pH 7.4 | Gibco | 10010031 | Standard reagent |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 15714-S | Fixative |
| 50 mL, 25 cm2 cell culture flask | Greiner Bio-One | 690 175 | Cell culture (T25) flask |
| Antibiotic-Antimycotic 100X | Gibco | 15240-096 | Media component |
| B-27 Supplement 50X | Gibco | 17504-044 | Media component |
| Bovine serum albumin | Sigma | A9647-50G | Antibody diluent |
| Confocal Microscope | Zeiss | LSM 800 | Confocal for imaging |
| DAPI | ThermoFisher | D1306 | Nuclear stain |
| DMEM (1X), high glucose with Na pyruvate | Gibco | 11995040 | Media component |
| Dnase I | Sigma | 10104159001 | Tissue dissociation |
| Fetal bovine serum heat inactivated | Gibco | A3840001 | Media component |
| Fibronectin from bovine plasma | Sigma | F1141-1MG | Cell adherent |
| Fine stitch Scissors | Sklar | 64-3260 | Dissection tools |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A11008 | Secondary staining antibody |
| Goat anti-rat IgG Alexa Fluor 555 | Invitrogen | A21434 | Secondary staining antibody |
| Hanks' Balanced Salt Solution (w/o Ca or Mg) | ThermoFisher | 14170120 | Tissue dissociation |
| L-glutamine, 200mM | Gibco | 20530081 | Media component |
| Murine epidermal growth factor | ThermoFisher | PMG8044 | Media component |
| Murine IFN-γ | Peprotech | 315-05-20UG | Media component |
| Murine PDGF-AA | Peprotech | 315-17 | Media component |
| Neurobasal | Gibco | 21103-049 | Media component |
| Normal goat serum | Sigma | G9023 | Blocking solution component |
| Operating Scissors | Surgi-OR | 95-272 | Dissection tools |
| Poly-D-Lysine 12 mm #1 German Glass Coverslip | Corning Biocoatt | 354086 | Cell adherent |
| Prolong Gold Antifade Reagent | Cell Signaling Technology | 9071S | Mounting Media |
| Rabbit anti-Iba1 | Wako | 019-19741 | Primary antibody |
| Rabbit anti-NG2 Chondroitin Proteoglycan | Millipore | ab5320 | Primary antibody |
| Rat anti-GFAP | ThermoFisher | 13-0300 | Primary antibody |
| Rat anti-myelin basic protein | Abcam | ab7349 | Primary antibody |
| Sharp Tip Scissors | Surgi-OR | 95-104 | Dissection tools |
| Stereo Microscope | Leica | S4 E Stereo Zoom Microscope | Microscope for dissection |
| Tissue Forceps | Sklar | 66-7644 | Dissection tools |
| Triton X-100 | Fisher Bioreagents | BP151-100 | Cell permabilization |
| Trypsin Inhibitor (from chicken egg white) | Sigma | 10109878001 | Tissue dissociation |
参考文献
- Fields, R. D., et al. Glial Biology in Learning and Cognition. The Neuroscientist. 20 (5), 426-431 (2014).
- Nuriya, M., Hirase, H. Involvement of astrocytes in neurovascular communication. Progress in Brain Research. 225, 41-62 (2016).
- Nave, K. A. Myelination and support of axonal integrity by glia. Nature. 468 (7321), 244-252 (2010).
- Wake, H., Moorhouse, A. J., Miyamoto, A., Nabekura, J. Microglia: actively surveying and shaping neuronal circuit structure and function. Trends in Neurosciences. 36 (4), 209-217 (2013).
- Kierdorf, K., Prinz, M. Microglia in steady state. The Journal of Clinical Investigation. 127 (9), 3201-3209 (2017).
- Hertz, L., Chen, Y. Importance of astrocytes for potassium ion (K(+)) homeostasis in brain and glial effects of K(+) and its transporters on learning. Neurosciences and Biobehavior Reviews. 71, 484-505 (2016).
- Gordon, G. R., Howarth, C., MacVicar, B. A. Bidirectional Control of Blood Flow by Astrocytes: A Role for Tissue Oxygen and Other Metabolic Factors. Advances in Experimental Medicine and Biology. 903, 209-219 (2016).
- Schneider, J., Karpf, J., Beckervordersandforth, R. Role of Astrocytes in the Neurogenic Niches. Methods Mol Biol. 1938, 19-33 (2019).
- Sharif, Y., et al. Blood brain barrier: A review of its anatomy and physiology in health and disease. Clinical Anatomy. 31 (6), 812-823 (2018).
- von Bernhardi, R., Eugenin-von Bernhardi, J., Flores, B., Eugenin Leon, J. Glial Cells and Integrity of the Nervous System. Advances in Experimental Medicine and Biology. 949, 1-24 (2016).
- Gordon, J., Amini, S., White, M. K. General overview of neuronal cell culture. Methods in Molecular Biology. 1078, 1-8 (2013).
- Spaethling, J. M., et al. Primary Cell Culture of Live Neurosurgically Resected Aged Adult Human Brain Cells and Single Cell Transcriptomics. Cell reports. 18 (3), 791-803 (2017).
- Bayraktar, O. A., Fuentealba, L. C., Alvarez-Buylla, A., Rowitch, D. H. Astrocyte development and heterogeneity. Cold Spring Harbor Perspectives in Biology. 7 (1), 020362 (2015).
- Liu, R., et al. Region-specific and stage-dependent regulation of Olig gene expression and oligodendrogenesis by Nkx6.1 homeodomain transcription factor. Development. 130 (25), 6221-6231 (2003).
- Tan, Y. L., Yuan, Y., Tian, L. Microglial regional heterogeneity and its role in the brain. Molecular Psychiatry. 25 (2), 351-367 (2020).
- Witting, A., Moller, T. Microglia cell culture: a primer for the novice. Methods in Molecular Biology. 758, 49-66 (2011).
- Williams, J. L., Patel, J. R., Daniels, B. P., Klein, R. S. Targeting CXCR7/ACKR3 as a therapeutic strategy to promote remyelination in the adult central nervous system. Journal of Experimental Medicine. 211 (5), 791-799 (2014).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Tanner, D. C., Cherry, J. D., Mayer-Proschel, M. Oligodendrocyte progenitors reversibly exit the cell cycle and give rise to astrocytes in response to interferon-gamma. Journal of Neuroscience. 31 (16), 6235-6246 (2011).
- Stansley, B., Post, J., Hensley, K. A comparative review of cell culture systems for the study of microglial biology in Alzheimer's disease. Journal of Neuroinflammation. 9 (1), 115 (2012).
- Spaethling, J. M., et al. Primary Cell Culture of Live Neurosurgically Resected Aged Adult Human Brain Cells and Single Cell Transcriptomics. Cell Reports. 18 (3), 791-803 (2017).
- Timmerman, R., Burm, S. M., Bajramovic, J. J. An Overview of in vitro Methods to Study Microglia. Frontiers in Cellular Neuroscience. 12 (242), (2018).
- Stevens, B. Glia: much more than the neuron's side-kick. Current Biology. 13 (12), 469-472 (2003).
- Fields, R. D., et al. Glial biology in learning and cognition. Neuroscientist. 20 (5), 426-431 (2014).
- Yamamuro, K., Kimoto, S., Rosen, K. M., Kishimoto, T., Makinodan, M. Potential primary roles of glial cells in the mechanisms of psychiatric disorders. Frontiers in Cellular Neuroscience. 9 (154), (2015).
- Hartenstein, V., Giangrande, A. Connecting the nervous and the immune systems in evolution. Communications Biology. 1 (1), 64 (2018).
- Emsley, J. G., Macklis, J. D. Astroglial heterogeneity closely reflects the neuronal-defined anatomy of the adult murine CNS. Neuron Glia Biology. 2 (3), 175-186 (2006).
- Chaboub, L. S., Deneen, B. Developmental Origins of Astrocyte Heterogeneity: The Final Frontier of CNS Development. Developmental Neuroscience. 34 (5), 379-388 (2012).
- Tan, Y. L., Yuan, Y., Tian, L. Microglial regional heterogeneity and its role in the brain. Molecular Psychiatry. 25 (2), 351-367 (2020).
- Bottcher, C., et al. Human microglia regional heterogeneity and phenotypes determined by multiplexed single-cell mass cytometry. Nature Neurosciences. 22 (1), 78-90 (2019).
- Marques, S., et al. Oligodendrocyte heterogeneity in the mouse juvenile and adult central nervous system. Science. 352 (6291), 1326-1329 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。