Method Article
דיסקציה ובידוד של מורין גליה ממספר אזורים במערכת העצבים המרכזית
In This Article
Summary
כאן אנו מציגים פרוטוקול לבידוד חוץ גופי של אוכלוסיות תאי גליה מרובות ממערכת CNS של עכבר. שיטה זו מאפשרת הפרדה של מיקרוגליה אזורית, תאים מבשרי אוליגודנדרוציטים ואסטרוציטים כדי לחקור את הפנוטיפים של כל אחד מהם במגוון מערכות תרבית.
Abstract
השיטות המוצגות כאן מדגימות נהלי מעבדה לנתיחה של ארבעה אזורים שונים במערכת העצבים המרכזית (CNS) מילודים מורין לבידוד תת-אוכלוסיות גליה. מטרת ההליך היא לנתק את תאי האב של מיקרוגליה, אוליגודנדרוציטים (OPCs) ואסטרוציטים מרקמת קליפת המוח, המוח הקטן, גזע המוח וחוט השדרה כדי להקל על ניתוח נוסף במבחנה. נהלי הבידוד של אזור CNS מאפשרים לקבוע הטרוגניות אזורית בקרב גליה במערכות מרובות של תרביות תאים. בידוד מהיר של אזור CNS מבוצע, ואחריו הסרה מכנית של קרום המוח כדי למנוע זיהום תאי קרום המוח של גליה. פרוטוקול זה משלב דיסוציאציה עדינה של רקמות וציפוי על מטריצה מוגדרת שנועדה לשמור על שלמות התא ודבקותו. בידוד גליה מעורבת מאזורי CNS מרובים מספק ניתוח מקיף של גליה הטרוגנית פוטנציאלית תוך מקסום השימוש בחיות ניסוי בודדות. בנוסף, לאחר דיסוציאציה של רקמה אזורית, גליה מעורבת מחולקת לסוגי תאים מרובים, כולל מיקרוגליה, OPCs ואסטרוציטים לשימוש בסוג תא בודד, בתוספות צלחת תרבית תאים או במערכות תרבית משותפת. בסך הכל, הטכניקות שהודגמו מספקות פרוטוקול מקיף של ישימות רחבה לניתוח זהיר של ארבעה אזורי CNS בודדים מילודים מורין וכוללות שיטות לבידוד של שלושה סוגי תאי גליה בודדים כדי לבחון הטרוגניות אזורית בכל מספר של מערכות תרביות תאים במבחנה או מבחנים.
Introduction
גליה נחוצה לתפקוד עצבי תקין במערכת העצבים המרכזית. הם מורכבים משלוש תת-אוכלוסיות עיקריות, אסטרוציטים, אוליגודנדרוציטים ומיקרוגליה, שלכל אחד מהם תפקיד שונה, אך הכרחי1. ללא המגוון והפעילות התקינה של תאי גליה, תפקוד תאי העצב ייפגע קשות, מה שיוביל לפגיעה במערכת העצבים המרכזית. גליה מסוגלים להשפיע על העברה עצבית, וכל סוג תא עושה זאת באופן ייחודי. לתאי גליה במוח יש את היכולת לתקשר בינם לבין עצמם, כמו גם עם תאים עצביים, על מנת להקל על תפקוד תקין של מערכת העצבים המרכזית2. אוליגודנדרוציטים מגבירים את מהירות ההעברה החשמלית באמצעות היווצרות נדן מיאלין, המאפשר את התקבצות תעלות היונים בצמתים של Ranvier, האתרים של פוטנציאל הפעולה העצבית דור3. מיקרוגליה הם קריטיים לגיזום של סינפסות על ידי ניטור העברה סינפטית ו"חיווט מחדש" של קשרים עצביים לאחר פציעה4. בנוסף, מיקרוגליה הם תאי החיסון המקומיים הנפוצים ביותר במערכת העצבים המרכזית, הפועלים כצורה העיקרית של הגנה על המארח מפני פתוגנים5. אסטרוציטים יכולים לווסת את ההעברה הסינפטית בין נוירונים על ידי שינוי הריכוז של אשלגן חוץ תאי6. יש להם גם תפקידים בשליטה על זרימת הדם המקומית7, שחרור וקליטה של אלמנטים נוירומודולטוריים8, ויש להם תפקיד מפתח בתחזוקת מחסום דם-מוח9. לפיכך, כל תת-סוג גליה הוא קריטי לתפקוד מערכת העצבים המרכזית, שכן פגמים בכל סוג נקשרו זה מכבר למגוון רחב של מצבים פתולוגיים, כולל מחלות פסיכיאטריות, אפילפסיה ומצבים נוירודגנרטיביים10.
המכשול הגדול ביותר בחקר הפתוביולוגיה של מערכת העצבים המרכזית הוא חוסר היכולת לחקור תאים אנושיים בהקשר של הנישה המיקרו-סביבתית שלהם. רקמת הביופסיה האנושית נאספת ביותר לאחר המוות ותאים יכולים בקלות להינזק או ללכת לאיבוד במהלך המיצוי והעיבוד. יתר על כן, זהו אתגר לשמור על תאים אנושיים חיים וברי קיימא במבחנה לאורך זמן מבלי לגזור קווי תאים אימורטליים מגידולים, ואז הם כבר לא משקפים במדויק את התכונות הפיזיולוגיות הרגילות שלהם11,12. בנוסף, קיימת כמות משמעותית של הטרוגניות אזורית בקרב סוגי תאי גליהבודדים 13,14,15, והשגת דגימות CNS אזוריות מחולים בודדים היא כמעט בלתי אפשרית. ככזה, יש צורך לפתח מודלים חלופיים כדי לחקור את התרומה של גליה אזורית בהפרעות CNS ספציפיות.
כאן אנו מתארים מערכת חוץ גופית המשתמשת בבידוד ספציפי לאזור CNS של עכברים של תת-אוכלוסיות גליה מרובות, המאפשרת מניפולציה וכימות של מיקרוגליה, תאים מבשרי אוליגודנדרוציטים (OPCs), אשר מולידים אוליגודנדרוציטים בוגרים, ואסטרוציטים. כל אוכלוסייה יכולה להיות מבודדת באופן עצמאי ונתונה למגוון רחב של טכניקות ניסיוניות, כולל טיפול בתרופות או במולקולות, אימונוציטוכימיה, מיצוי וניתוח חלבונים/רנ"א ומערכות אחרות של תרביות משותפות בהתאם לצורך הניסויי. בנוסף, טכניקת בידוד זו מניבה מספר תאים גבוה, ומאפשרת אפיון וחקירה של כל אוכלוסיית גליות באופן בעל תפוקה גבוהה. הוא גם מאפשר לחקור התמיינות של תאי CNS, גדילה ושגשוג בתגובה למגוון רחב של גירויים מיקרו-סביבתיים באופן מבוקר על מנת למנוע גורמים מבלבלים אשר בדרך כלל נוכחים בסביבה in vivo. לבסוף, טכניקת בידוד תאים זו מאפשרת מניפולציה של אוכלוסיות תאי גליה בתוך אזורי CNS שונים כדי לחקור כיצד גליה אזורית מתקשרת זו עם זו ומגיבה לגירויים משתנים, מה שמאפשר דיוק ושכפול.
Protocol
הערה: כל המחקרים בבעלי חיים אושרו ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של מכון המחקר קליבלנד קליניק לרנר.
1. הכן מדיה וחומרים מתכלים לנתיחה
הערה: כל מתכוני המאגר והמדיה מופיעים בטבלה 1. הליך זה נעשה בתנאים סטריליים בתרבית רקמה המיועדת לארון בטיחות ביולוגית.
- הכן מסנן סטרילי מדיה מעורבת גליה (MGM). זה יכול להיעשות יום קודם ולאחסן ב 4 °C (64 °F).
- לדלל פיברונקטין בריכוז 1:100 עם H2O סטרילי. נפח הפיברונקטין המדולל יהיה תלוי במספר הגורים ובאזור CNS המשמשים לניסוי. השתמש בבקבוק T25 אחד עבור קליפת המוח 1, בקבוק T25 אחד עבור 2-4 צרבלה, בקבוק T25 אחד עבור 2-4 גזעי מוח ובקבוק T25 אחד עבור 2-4 חוטי שדרה.
הערה: שילוב רקמה מאותו אזור תוך שימוש בקריטריונים המפורטים לעיל יאפשר דיסוציאציה מספקת מבלי לשנות את הפרוטוקול המתואר להלן. שילוב של יותר רקמות מהמתואר בשלב 1.2 ידרוש אופטימיזציה נוספת של ריכוזי מגיבי דיסוציאציה. - פיפטה 3 מ"ל של פיברונקטין מדולל לתוך צלוחיות T25 בטמפרטורת החדר ולאפשר לשבת במשך 2 דקות.
- שאפו את הפיברונקטין ותנו לצלוחיות להתייבש למשך הלילה עם מכסה בקבוקון משוחרר.
2. קליפת המוח, המוח הקטן, גזע המוח ודיסקציה של חוט השדרה
הערה: הליך זה יכול להיעשות על הספסל ודורש היקף דיסקציה. השתמש בטכניקה אספטית קפדנית לכל שלבי ההליך ומזער את חשיפת הרקמות לאוויר החדר. יש לשמור את כל המדיה מקוררת על הקרח במהלך הדיסקציה כדי להבטיח שימור מרבי של הרקמות. לחלופין, הליך זה יכול להיעשות במכסה מנוע המאפשר שימוש בהיקף דיסקציה פנימי.
- נגבו את כל האזורים עם 70% אתנול.
- מזרימים 10 מ"ל של PBS/תמיסת אנטיביוטיקה (PAS) לתוך צלחת פטרי בקוטר 10 ס"מ. הכינו צלחת פטרי אחת לכל גור לניתוח. מניחים על הקרח כדי לשמור על התמיסה מקוררת.
- במכסה רסיסי רקמה מחוטא, פיפטה 9 מ"ל של DMEM (ללא תוספים) לתוך 4 צינורות חרוטיים נפרדים של 15 מ"ל, אחד לכל אזור CNS, להחליף כובעי צינור, ולשים על קרח. הניחו דלי קרח עם צינורות במרחק נגיעה מהיקף הנתיחה.
- מניחים צלחת פטרי 10 ס"מ שהוכנה בשלב 2.2 על שלב היקף הדיסקציה החיטוי.
- הרדמה והרדמה של גור עכברים על פי פרוטוקול מוסדי והסרת הראש על ידי עריפה מהירה עם מספריים חדים.
הערה: לאחר הלידה (P) נעשה שימוש ב-3-5 גורים. לגורים בוגרים יש מערכת מפותחת יותר של מערכת העצבים המרכזית, וייתכן שהם אינם מהווים מקור הולם לתאי גליה מתרחבים. גורים צעירים יותר (P) 0-2 עשויים להניב מספר גבוה יותר של גליה וניתן להשתמש בהם; עם זאת, רקמת חוט השדרה קשה מאוד לנתח בגיל צעיר זה בשל גודל. - נקו את עור הגור באמצעות 70% אתנול.
- באמצעות מספריים עדינים, חותכים את השכבה העורית לאורך קו האמצע של ראש החיה, מתחילים באופן קאוודי ונעים רוסטרל, עד שמגיעים לחוטם. הימנע חיתוך עמוק לתוך הגולגולת כדי למנוע נזק לרקמות.
- זווית הראש כלפי מטה, משיכת שכבה עורית לכל צד של הגולגולת ושימוש במספריים קפיציים, ביצוע חתך לאורך קו האמצע של הגולגולת, החל מהפורמן מגנום, שוב חיתוך קאודל לרוסטרל.
- בעזרת מלקחיים עדינים, משכו את חצאי הגולגולת לצד ימין ושמאל, וחשפו את קליפת המוח, המוח הקטן וגזע המוח.
- לאחר החשיפה, הרימו בעדינות את המוח מתוך הגולגולת אל תוך צלחת פטרי בגודל 10 ס"מ שהוכנה בשלב 2.2. ודא שהמוח נשאר פגום כדי לשמר את המבנה האנטומי, כאשר המוח האחורי מחובר.
- באמצעות מלקחיים עדינים ומעוקלים כאשר נקודת המלקחיים פונה כלפי מעלה, צובטים את המוח הקטן. מוציאים את קרומי המוח ומניחים בצינור חרוטי ייעודי של 15 מ"ל בדלי קרח.
- ודא כי גזע המוח הוא גחון ישירות למוח הקטן והוא גלוי לאחר הסרת המוח הקטן. מוציאים אותו עם מלקחיים דקים, מסירים את קרומי המוח ומניחים בצינור חרוטי ייעודי של 15 מ"ל בדלי קרח.
- הפרידו את המוח האמצעי מקליפת המוח, הסירו את קרומי המוח הקורטיקליים והניחו בצינור חרוטי ייעודי של 15 מ"ל בדלי קרח.
- כדי להסיר את חוט השדרה, הניחו את גור העכברים הערוף בתנוחת שכיבה (שוכב עם הפנים כלפי מעלה) כאשר עמוד השדרה הכרות מורם לעבר החוקר.
- יש לרסס שוב ב-70% אתנול.
- חותכים לאורך הצדדים הצדדיים של עמוד השדרה, בכיוון רוסטרלי עד קאודלי, דרך כלוב הצלעות עד להגעה לגפיים האחוריות. תוך כדי חיתוך, דחפו לאחור את האיברים הפנימיים עד שעמוד השדרה נראה לעין.
- חותכים לאורך כל צד צדדי של עמוד השדרה עד שהוא מבודד ומניחים בצלחת פטרי בגודל 10 ס"מ שהוכנה בשלב 2.2.
- עם צד הגחון כלפי מעלה, באמצעות מספריים קפיציים עדינים, לסירוגין חיתוך הצד הימני והשמאלי של כל חוליה עד להגיע לאזור המותני כדי לחשוף את רקמת חוט השדרה.
- הסר בעדינות את חוט השדרה ואת קרום המוח עם מלקחיים עדינים מתחת למיקרוסקופ הניתוח. מניחים בצינור חרוטי ייעודי של 15 מ"ל בדלי קרח.
- חזור על שלבים 2.5.-2.19 עבור כל גור, תוך שילוב רקמה מאותו אזור כדי להתאים לקריטריונים המתוארים בשלב 1.2 עבור כל בקבוק T25 מוכן.
הערה: הסר את קרומי המוח באופן מלא ככל האפשר. אם תישאר כמות משמעותית של קרומי המוח, הפנוטיפ דמוי הפיברובלסטים של תאי קרום המוח יגדל ויכריע את תרבית התאים. ניתן לשלב מספר חוטי שדרה, בעלי פנוטיפ שווה, על מנת ליצור תרבית תאים מסוימת. הקפידו להבטיח כי צפיפות יתר של תאים לא מתרחשת, אשר עלול להוביל אפופטוזיס גליה ופנוטיפים דיפרנציאליים.
3. דיסוציאציה של רקמות
הערה: כל ההליכים הבאים מתבצעים בתרבית רקמה סטרילית המיועדת לארון בטיחות ביולוגית תוך שימוש בטכניקה אספטית ובחומרים סטריליים.
- הוסף 1 מ"ל של 0.05% טריפסין המכיל 0.53 mM EDTA לכל צינור חרוטי של 15 מ"ל של 9 מ"ל DMEM ורקמות כדי להתחיל תזה רקמות.
הערה: DMEM מכיל כמות גבוהה של סידן כלורי, אשר יכול לשמש כמעכב של טריפסין. אם הדיסוציאציה לא הושלמה בעקבות השלבים המתוארים, ניתן להשתמש בתמיסת המלח המאוזנת של הנקס ללא סידן או מגנזיום. לאחר טריפסיניזציה, ניתן לנטרל את האנזים על ידי הוספת מעכב טריפסין, אם כי יש להוסיף סידן בחזרה לתמיסה מכיוון שהוא קופקטור עבור DNase I, המשמש בשלבים הבאים. - טריטוראט עם פיפטה של 10 מ"ל בערך פי 20.
- העבר את מתלי התאים לצינורות חרוטיים ריקים של 50 מ"ל.
- לדגום את התמיסה ב 37 מעלות צלזיוס, 5% CO2 במשך 15 דקות, בעדינות תסיסה את lysates לאחר 8 דקות.
- הוסיפו 5 מ"ל של MGM ו-200 מיקרו-ל' (5 מ"ג/מ"ל) DNase I לכל צינור לקבלת ריכוז סופי של 50 מיקרוגרם/מ"ל.
- יש לשלש כל ליזאט עם פיפטה של 10 מ"ל פי 10.
- תנו למתלי התאים לשבת במשך 3 דקות בטמפרטורת החדר כדי לאפשר לרקמות שאינן מנותקות להתיישב בתחתית הצינורות.
- מעבירים את מתלי התאים לצינורות חרוטיים חדשים של 50 מ"ל, ומשאירים מאחור את הרקמה הלא מנותקת.
הערה: שלבי התזה והטריטורציה שתוארו לעיל מגבילים באופן משמעותי את כמות הרקמה הלא מנותקת. - צנטריפוגה את הצינורות ב 300 x g במשך 3 דקות ב 4 מעלות צלזיוס ללא בלם.
- לשאוף את supernatant ולהשעות את כדורי התא הנותרים ב 5 מ"ל של MGM.
- טריטורט את הכדור עם פיפטה 5 מ"ל 20x.
- צלחת את מתלי התאים 5 מ"ל על צלוחיות T25 מצופות.
- דגרו על התאים בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 ושנו את המדיה בתחילה לאחר 24 שעות כדי להסיר פסולת תאים.
הערה: פרוטוקולים מסוימים ממליצים על שינוי מדיה ראשוני לאחר 72 שעות. ייתכן שיהיה צורך באופטימיזציה של שלב זה. - בצע שינוי של 100% במדיה עם MGM כל 48-72 שעות עד שהתאים יהיו מחוברים ב-80% (כ-5-7 ימים).
הערה: יש לחמם את כל חומרי ההדפסה ל-37°C לפני שינוי המדיה.
4. בידוד מיקרוגליה
- לאחר שתרביות גליה מעורבות הגיעו למפגש של 80%, הכינו צלוחיות לניעור על ידי הידוק המכסים ואיטום עם סרט פרפין.
- כדי להסיר מיקרוגליה מתרביות גליה מעורבות, יש לאבטח צלוחיות אופקית על שייקר מסלולי בתוך אינקובטור של 37 מעלות צלזיוס. יש לנער צלוחיות במינון של 15 x גרם למשך שעה אחת.
- הסר מדיה ופיפטה לתוך צינור חרוטי 15 מ"ל. יש לשטוף צלוחיות פעמיים עם MGM חם של 3 מ"ל, ולהוסיף שטיפה לצינורות החרוטיים של 15 מ"ל. אלה הם המיקרוגליה.
- הוסיפו 5 מ"ל של MGM חם וטרי לצלוחיות התרבית.
- יש לאטום מחדש צלוחיות עם סרט פרפין, לאבטח צלוחיות אופקית על שייקר, ולנער בעוצמה של 15 x גרם בטמפרטורה של 37°C למשך 15 שעות להפרדת OPCs מאסטרוציטים.
הערה: ניתן לבצע שלב זה במהלך הלילה, אך זמן הניעור של 15 שעות הוא קריטי, שכן זמן עודף עלול לגרום למוות של תאים. - צנטריפוגה של הסופר-נטנט משלב 4.3. ב 300 x g במשך 3 דקות תרבית microglia על פי פרוטוקולים סטנדרטיים16 או להשתמש עבור בדיקה ביולוגית.
5. בידוד תאים מבשר אוליגודנדרוציטים
הערה: בעת ציפוי OPCs לאחר בידוד ראשוני, הם חייבים להיות מצופים על משטח מצופה poly-D-ליזין (צלחת סטרילית או כיסוי להחליק). הכן חומרים אלה לפני השלמת חלק זה.
- לאחר שייק של 15 שעות, מוציאים את הצלוחיות מהצלוחיות וצלחת על צלחת פטרי סטרילית בקוטר 100 מ"מ.
- לדגום את הסופרנטנט בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 למשך 30 דקות, תוך הסתחררות לאחר 15 דקות כדי להסיר את המיקרוגליה שנותרה, מכיוון שאלו ידבקו מהר מאוד בצלחת. ניתן להשתמש בצלחות פטרי שאינן מטופלות בתרבית רקמה בשלב זה.
- הסר סופרנטנט של תאים שאינם דבקים, ספור וצלחת על משטח מצופה פולי-D-ליזין. בדרך כלל, 7,500-10,000 OPCs הם מצופים/ס"מ2.
- דגירה ב-37 °C, 5% CO2 למשך שעה אחת לפחות (עד 6 שעות), ולאחר מכן שאפו בעדינות 95% מהמדיה, והוסיפו באיטיות מדיה חמה של OPC, תוך הנחת מדיה על דופן הבאר כדי למזער את ההפרעה של OPC. החלף מדיה כל 48 שעות עד שהתאים מוכנים לשימוש.
הערה: זה קריטי כי רק באר אחת משתנה בכל פעם. OPCs הם רגישים ואינם סובלניים במיוחד לתנאי יובש. התוספת של PDGF-AA במדיית OPC היא לעכב את הבשלת OPC לאוליגודנדרוציטים. גורם זה עשוי להיות מודר מהתקשורת התרבותית אם המוקד הניסויי הוא אוליגודנדרוציטים בוגרים.
6. בידוד אסטרוציטים
- לאחר 15 שעות של שייק, יש להסיר את הסופר-נטנט ולשטוף צלוחיות 2x עם PBS חם אחד.
- יש להוסיף 4 מ"ל של טריפסין 0.05% המכיל 0.53 mM EDTA ולדגירה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 למשך 5 דקות או עד שהתאים התרוממו. כדי להבטיח שהאסטרוציטים התרוממו, דמיינו אותם באמצעות מיקרוסקופ שדה רחב סטנדרטי. אסטרוציטים יופיעו כדוריים לאחר טריפסיניזציה.
- לאחר שהאסטרוציטים התנתקו, עמדו אנכית והוסיפו 4 מ"ל MGM. טריטוראט לערבוב.
- פיפטה אסטרוציטים לתוך צינור חרוטי 15 מ"ל, צנטריפוגה ב 300 x גרם במשך 5 דקות.
- יש לתלות אסטרוציטים במדיה של אסטרוציטים ובצלחת על פני שטח מצופים פיברונקטין כמתואר בשלב 1.2. או להשתמש לבדיקה ביולוגית.
הערה: ניתן להוסיף גורם גדילה של 20 ננוגרם/מ"ל מורין פיברובלסט במהלך שינוי המדיה הראשון כדי לסייע בביסוס תרבית האסטרוציטים. בנוסף, ציפוי ג'לטין סטנדרטי עשוי להיות חלופה זולה לפיברונקטין.
7. זיהוי ובידוד של מיקרוגליה, OPCs, אסטרוציטים ואוליגודנדרוציטים בוגרים באמצעות אימונוציטוכימיה
- לאחר שהתאים המצופים הגיעו למפגש המתאים, הסר בעדינות את המדיה ותקן תאים דבקים באמצעות 4% פרפורמלדהיד (PFA) למשך 10 דקות. בצע שלב זה בארון בטיחות ביולוגית.
הערה: בעת שאיפה או הוספה של תמיסות, פיפטה בלחץ עדין למניעת ניתוק התא. - שאפו באיטיות PFA ואז שטפו תאים פי 3 עם PBS אחד למשך 5 דקות.
- הכן תמיסת חסימה מתאימה באמצעות 10% סרום ו-0.1% Triton X-100 ב-PBS אחד.
הערה: מקור הסרום משקף את החיה המארחת שבה גדל הנוגדן המשני. לדוגמה, אם הנוגדן המשני הוא אנטי-ארנב עזים, סרום החסימה המתאים הוא סרום עיזים רגיל. כמו כן, אם הנוגדן המשני הוא חמור נגד ארנב, סרום החסימה צריך להיות סרום חמור רגיל. - הוסף פתרון חוסם עד שהתאים יכוסו לחלוטין. יש לחסום למשך שעה אחת בטמפרטורת החדר.
- הכן תמיסת נוגדנים מדוללת (9 מ"ל של 1x PBS, 0.01 גרם אלבומין בסרום בקר, 30 μL Triton X-100). לחלופין, ניתן לדלל נוגדנים בתמיסת החסימה המתוארת בשלב 6.3.
- דילול נוגדנים ראשוניים ספציפיים לדברים הבאים בנוגדן מדולל או בפתרון חוסם:
- מיקרוגליה: מולקולת מתאם סידן מיונן 1 (Iba1) בדילול של 1:250 (2.4 מיקרוגרם/מ"ל).
- OPCs: אנטיגן עצבי/גליאלי 2 (NG2) בדילול של 1:200 (5 מיקרוגרם/מ"ל).
- אוליגודנדרוציטים בוגרים: חלבון בסיסי של מיאלין (MBP) בדילול של 1:400 (הריכוז תלוי בהרבה וייתכן שיהיה צורך באופטימיזציה).
- אסטרוציטים: חלבון חומצי פיברילארי גליאלי (GFAP) בדילול של 1:400 (0.25 מיקרוגרם/מ"ל)17.
הערה: אין לערבב נוגדנים ראשוניים שגודלו באותו המין.
הערה: GFAP יתייג באופן אמין אסטרוציטים של חומר לבן. עבור אסטרוציטים של חומר אפור, ייתכן שיהיה צורך להשתמש בסמן חלופי.
- לדגור נוגדן ראשוני בלילה ב 4 מעלות צלזיוס (עם תסיסה עדינה עדיף).
- יש לשטוף 3x עם PBS אחד למשך 5 דקות כדי להסיר את הנוגדן העיקרי.
- דגירה של תאים עם נוגדנים משניים מתאימים בדילול של 1:400 בנוגדנים מדוללים או בתמיסת חסימה המוגנת מפני אור.
הערה: נוגדנים משניים מצומדים לפלואורופור אשר עשוי להיות מוחלף בהתאם לפרמטרים המיקרוסקופיים הזמינים. לאחר החלת נוגדנים משניים פלואורסצנטיים, יש להגן מפני אור ככל האפשר. - דגירה של נוגדן משני למשך שעה אחת בטמפרטורת החדר, המגבילה את החשיפה לאור.
- יש לשטוף 3 פעמים עם PBS אחד למשך 5 דקות כדי להסיר נוגדן משני עודף.
- כדי לסמן גרעינים, השתמש בתמיסת DAPI/PBS ביחס של 1:1,000 ודגירה של תאים למשך 5 דקות בטמפרטורת החדר בחושך.
- שטפו 3x עם PBS אחד למשך 5 דקות בחושך.
- להרכבה, יש למרוח מדיית הרכבה ולהניח לה להתייבש בחושך לפני ההדמיה.
הערה: ניתן לאחסן מגלשות מותקנות בטמפרטורת החדר למשך 2-3 ימים. לאחסון לטווח ארוך, העבר את השקופיות ל- 4 °C. תמונה תוך שבוע לקבלת אות מקסימלי. כל התמונות המייצגות צולמו במיקרוסקופ קונפוקלי; עם זאת, מומלץ גם מיקרוסקופים פלואורסצנטיים הפוכים.
תוצאות
נתונים מייצגים המוצגים להלן ממחישים כי איתות IFNγ משפיע על בידול OPC והבשלה. ללא נוכחות של קולטן IFNγ (IFNγR), OPCs בקליפת המוח אינם מתמיינים לאוליגודנדרוציטים מיאלינים בוגרים בקלות, מה שמעיד על היעדר צביעת MBP (איור 1). מאחר שאוליגודנדרוציטים ואסטרוציטים נגזרים מאב משותף, ניתחנו את ביטוי GFAP, המתייג אסטרוציטים. מצאנו שתאים עם מחסור ב-IFNγR מבטאים באופן חזק GFAP מה שמרמז על כך שייתכן שהם מאמצים פנוטיפ אסטרוציטי, מה שאישש דיווחים קודמים19.
עדות נוספת להטרוגניות אזורית בתאי CNS מוכחת על ידי מורפולוגיה משתנה של אסטרוציטים כפי שניתן לראות באסטרוציטים מקליפת המוח, המוח הקטן, גזע המוח וחוט השדרה (איור 2). יש לציין כי אסטרוציטים מאותו אזור עשויים גם להפגין הטרוגניות מורפולוגית, מה שתומך ברעיון שתת-סוג גליה זה הוא דינמי מאוד. ההבדלים בארכיטקטורה התאית מרמזים על גיוון תפקודי ולכן היכולת לבודד אוכלוסיות גליה נחוצה כדי לחקור תגובות פנוטיפיות בהיעדר ונוכחות של גירויים מיקרו-סביבתיים.
אוליגודנדרוציטים הם קריטיים למיאלינציה של אקסונים עצביים והם נחוצים לתיקון ותפקוד תקין של מערכת העצבים המרכזית. OPCs מולידים את עמיתיהם הבוגרים, מה שהופך את זה קריטי כדי להבין את הביולוגיה מאחורי היכולת שלהם להבדיל. איתות ציטוקינים משפיע באופן משמעותי על התנהגות תאי הגזע ומערכת החיסון. לכן, חשוב להבין כיצד תגובות אזוריות של OPCs עשויות להשתנות לגירוי ציטוקינים דיפרנציאלי (איור 3), מה שעשוי להשפיע על יכולתם להתמיין לאוליגודנדרוציטים מיאלינים בוגרים.
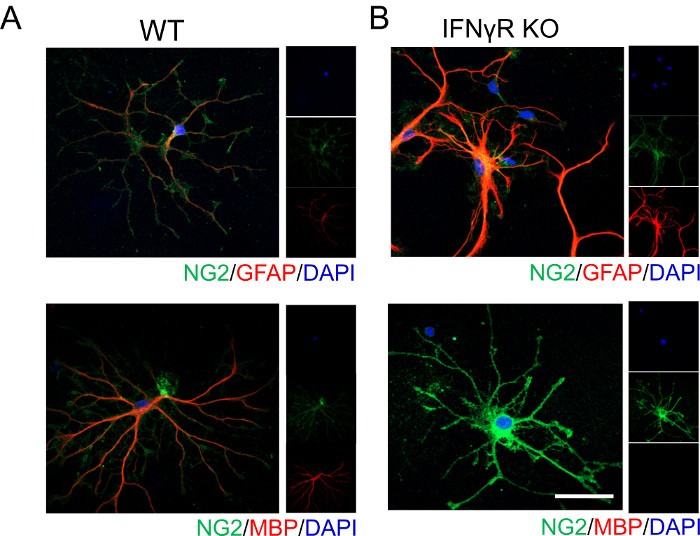
איור 1: נתונים מייצגים המראים התמיינות OPC בעכברי WT ו- IFNγR-/- בנוכחות IFNγ אקסוגני. OPCs קורטיקליים בודדו מ-( A ) WT ו- (B) גורי עכברים IFNγR-/- P4 בעקבות ההליך שתואר לעיל. התאים טופלו ב-1 ng/mL IFNγ במשך 48 שעות, ולאחר מכן תוקנו והוכתמו כדי להגדיר את התמיינות התאים. OPCs תויגו עבור NG2 ו- GFAP כדי לזהות את אלה שאימצו פנוטיפ אסטרוציטי. באופן דומה, OPCs סומנו גם עבור NG2 ו- MBP כדי לזהות את אלה שהתמידו לאוליגודנדרוציטים בוגרים. סרגל קנה מידה = 20 μM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
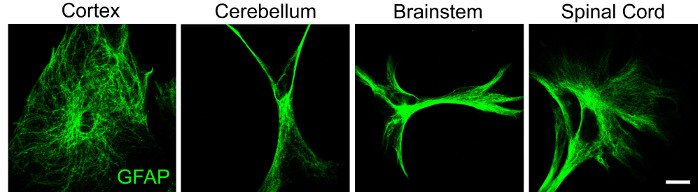
איור 2: נתונים מייצגים המדגימים הטרוגניות אזורית במורפולוגיה של אסטרוציטים. אסטרוציטים מקליפת המוח, המוח הקטן, גזע המוח וחוט השדרה בודדו מגורי עכברי P4 באמצעות הפרוטוקול שתואר לעיל וסומנו עבור GFAP (ירוק) על ידי אימונוציטוכימיה לאחר 48 שעות בתרבית. סרגל קנה מידה = 20 μM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
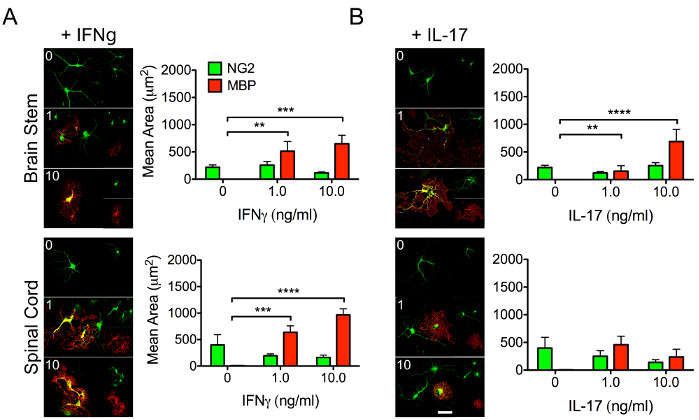
איור 3: נתונים מייצגים המדגימים תגובות דיפרנציאליות של OPCs אזוריים לציטוקינים. OPCs בודדו מגזע המוח ומחוט השדרה של גורי עכברי P4 באמצעות הפרוטוקול שתואר לעיל. התאים טופלו בריכוזים הולכים וגדלים (1-10 ננוגרם/מ"ל) של (A) IFNγ או (B) אינטרלוקין ( IL ) -17 על מנת לחקור את ההשפעה הדיפרנציאלית של ציטוקינים על יכולתם של OPCs אזוריים להתמיין לאוליגודנדרוציטים מיאלינים. לאחר דגירה של 48 שעות עם ציטוקינים מוגדרים, OPCs תוקנו וסומנו עבור NG2 (ירוק) ו- MBP (אדום). סרגל קנה מידה = 20 μM. נתונים מייצגים פירושו ± SEM. **, p < 0.01; עמ' < 0.001;, עמ' < 0.0001 על ידי ANOVA דו-כיווני., אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| PBS/פתרון אנטיביוטי (PAS): | ||
| 1.0 מ"ל | 100X אנטיביוטיקה/אנטי-מיקוטית המכילה 10,000 יחידות/מ"ל פניצילין ו-10,000 מ"ג/מ"ל סטרפטומיצין | |
| 25 מ"ג/מ"ל | אמפוטריצין B | |
| 99 מ"ל | 1X PBS | |
| מדיה גליה מעורבת (MGM) | ||
| 88 מ"ל | 1X DMEM (גלוקוז גבוה, עם L-גלוטמין, עם Na פירובט) | |
| 10 מ"ל | FBS מומת בחום | |
| 1.0 מ"ל | ל-גלוטמין (100X) | |
| 1.0 מ"ל | אנטיביוטיקה/אנטי-מיקוטי | |
| מדיה OPC (50 מ"ל) | ||
| 49 מ"ל | מדיה נוירובסלית | |
| 1.0 מ"ל | תוסף B27 (50X) | |
| 10 נ"ג/מ"ל | PDGF-AA | |
| הערה: PDGF-AA מתווסף טרי לפני כל שינוי מדיה. | ||
| אסטרוציטים מדיה (1 L) | ||
| 764 מ"ל | MEM עם מלחי ארל המכילים גלוטמין | |
| 36 מ"ל | גלוקוז (יש להשתמש במלאי של 100 מ"ג/מ"ל לריכוז סופי של 20 מ"מ) | |
| 100 מ"ל | FBS מומת בחום | |
| 100 מ"ל | סרום סוסים מומת בחום | |
| 10 מ"ל | גלוטמין (יש להשתמש במלאי של 200 מ"מ אם אינו כלול במדיום המלאי) | |
| אופציונלי: גורם גדילה רקומביננטי של עכבר רקומביננטי של 10 ננוגרם/מ"ל | ||
| הערה: יש לסנן סטרילית את כל חומרי ההדפסה ולאחסן בטמפרטורה של 4°C עד לשימוש. | ||
טבלה 1: מתכוני חיץ ומדיה.
Discussion
בפרוטוקול זה אנו מתארים את הבידוד של שלוש תת-אוכלוסיות תאי הגליה העיקריות ממערכת העצבים המרכזית של העכבר: מיקרוגליה, OPCs ואסטרוציטים. מכשלה מרכזית בחקר מחלות CNS ניווניות ונוירו-דלקתיות היא היעדר תאים ורקמות אנושיים ראשוניים, במיוחד אלה שהם אזוריים ומאותו חולה. ברוב המקרים, קווי תאי CNS אנושיים נגזרים מתאים סרטניים שעברו טרנספורמציה ואימורטליזציה אשר עשויים שלא להיות ייצוגים מדויקים של התנהגותם הפיזיולוגית הרגילה20,21,22. לפיכך, יש צורך בשיטות חלופיות כדי לחקור פנוטיפים של תאי CNS באופן מבוקר. יתר על כן, המגוון של אוכלוסיות תאי גליה נוירולוגיים מחייב לחקור כל תת-סוג הן באופן בלתי תלוי זה בזה, והן בתנאי תרבית משותפת על מנת לשחזר הן את תפקודי התא האוטונומיים והן את תפקודיהם הלא אוטונומיים. לתאי גליה יש מגוון רחב של תפקודים קריטיים במערכת העצבים המרכזית, החל מתמיכה עצבית23, למידה/קוגניציה 24,25, ותגובות אימונולוגיות של מערכת העצבים המרכזית26. ככזה, יש צורך להבין את הפונקציות המולקולריות והתאיות של כל תת-אוכלוסייה גלית בהקשר פיזיולוגי ופתולוגי. על מנת לעשות זאת, אנו מספקים כאן שיטה אמינה למיצוי ובידוד של תת-סוגים בני קיימא של גליה. בשל אילוצים מעשיים ואתיים במחקרם של בני אדם, מודלים של בעלי חיים הם כיום הפונדקאים הרלוונטיים ביותר לביולוגיה של תאי גליה אנושיים. בפרט, עכברים הם חיות מודל אידיאליות מכיוון שניתן לתמרן ולנתח את הגנום שלהם כדי לנתח עוד יותר מנגנונים מולקולריים מסוימים העומדים בבסיס בריאות ומחלות. לכן, הסרה והפרדה מוצלחת של מיקרוגליה מורין, OPCs ואסטרוציטים היא כלי מפתח לחקר התפקודים של גליה במהלך מצבים פיזיולוגיים, נוירודגנרטיביים או נוירו-דלקתיים.
פרוטוקול זה יכול להיות ממוטב כדי לחקור הטרוגניות אזורית של תאי CNS. זה הופך להיות ברור יותר ויותר כי glia להפגין הטרוגניות אזורית בצורה ובתפקוד. אסטרוציטים הם מגוונים אזורית ומציגים מורפולוגיה שונה בהתאם למיקומם בתוך CNS27. יתר על כן, צפיפות האסטרוציטים והאינדקס המיטוטי שלהם יכולים להגדיר אזורים אנטומיים, מה שתומך בהשערה שהטרוגניות של אסטרוציטים אזוריים עשויה לשקף הבדלים מולקולריים ותפקודיים בהתבסס על מיקומם בתוך CNS28. גם ההטרוגניות האזורית של מיקרוגליה נמצאת תחת חקירה פעילה, אם כי המנגנונים הבסיסיים וההשלכות התפקודיות של גיוון המיקרוגליה בפיתוח או בהתנהגות של CNS אינם ברורים בשלב זה. עם זאת, ידוע כי מיקרוגליה בוגרת מציגה גיוון במספר התא, במבנים התאיים והתת-תאיים, ובחתימות מולקולריות29. יתר על כן, ההתקדמות האחרונה בציטומטריה של מסה מרובבת הגדירה עוד יותר את ההטרוגניות האזורית של מיקרוגליה, תוך ניתוח פנוטיפ תאי מחמישה אזורי CNS שונים של תשעה תורמים אנושיים, מה שמאפשר אימונופנוטיפ בקנה מידה גדול של מיקרוגליה אנושית30. נכון לעכשיו, גישות כאלה נמצאות בשלבים המתהווים שלהן, מה שהופך את המחקרים בבעלי חיים לפתרון בר קיימא לחקר גליה אזורית בהתפתחות מחלות CNS. לבסוף, הטרוגניות אזורית תוארה לאחרונה גם באוליגודנדרוציטים. ריצוף RNA חד-תאי על 5072 תאים בודדים מ-10 אזורים של CNS צעירים ובוגרים זיהה 13 תת-אוכלוסיות שונות בשלבים שונים של התמיינות31. חשוב לציין כי ככל שהאוליגודנדרוציטים התבגרו מ-OPCs, פרופילי השעתוק שלהם התפצלו והפנוטיפים הפונקציונליים שלהם השתנו, מה שמדגיש את ההטרוגניות של אוליגודנדרוציטים בתוך CNS31.
לפיכך, הבנת ההטרוגניות האזורית של תאי CNS המתגוררים השונים בהקשר של תאי העצב השכנים המגוונים שלהם וגליה אחרת עשויה לספק רציונל חשוב לפיתוח עתידי של טיפולים חדשניים לטיפול בהפרעות נוירו-דלקתיות וניווניות של מערכת העצבים. בעוד שפרוטוקול זה מתמקד במיצוי, בידוד וזיהוי של תת-אוכלוסיות גליות, הוא מספק נקודת התחלה נוחה לבחינת תפקידן. יתר על כן, ניתן להתאים אותו ולשלב אותו עם מודלים של עכברים מהונדסים על מנת לחקור מנגנונים גנטיים הקשורים לביולוגיה של תאי גליה. ניתן להשתמש בו גם כדי לבחון את התגובות של תאי גליה זה לזה במבחני תרבית משותפת. הצעדים המתוארים מייצגים שיטה חסכונית ובעלת תפוקה גבוהה של חילוץ ובידוד אוכלוסיות גליות CNS שונות, אשר לאחר מכן ניתן להתאים למגוון רחב של פרמטרים ניסיוניים. יש לציין; עם זאת, השיטה המתוארת כאן משתמשת בילודים בשל הרמות הנמוכות יותר של מיאלינציה וצפיפות גבוהה של גליה מתפשטת. מסיבות אלה, מבחינה טכנית ניתן יותר לבודד גליה בת קיימא מילודים בהשוואה לבעלי חיים בוגרים. לפיכך, יש לקחת בחשבון את ההבדלים הפנוטיפיים בגליה ילודים בהשוואה לגליה בוגרת במהלך תכנון הניסוי ופענוח הנתונים.
Disclosures
למחברים יש ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים למורגן פסניקה על העריכה והדיון בכתב היד ולד"ר גרהאם קיד על הסיוע בעיצוב הדמויות. עבודה זו נתמכה על ידי NIAID K22 AI125466 (JLW).
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin and 0.53 mM EDTA | Gibco | 25300054 | Tissue dissociation |
| 12-Well Plates | Greiner Bio-One | 665 180 | Cell culture plate |
| 1X PBS pH 7.4 | Gibco | 10010031 | Standard reagent |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 15714-S | Fixative |
| 50 mL, 25 cm2 cell culture flask | Greiner Bio-One | 690 175 | Cell culture (T25) flask |
| Antibiotic-Antimycotic 100X | Gibco | 15240-096 | Media component |
| B-27 Supplement 50X | Gibco | 17504-044 | Media component |
| Bovine serum albumin | Sigma | A9647-50G | Antibody diluent |
| Confocal Microscope | Zeiss | LSM 800 | Confocal for imaging |
| DAPI | ThermoFisher | D1306 | Nuclear stain |
| DMEM (1X), high glucose with Na pyruvate | Gibco | 11995040 | Media component |
| Dnase I | Sigma | 10104159001 | Tissue dissociation |
| Fetal bovine serum heat inactivated | Gibco | A3840001 | Media component |
| Fibronectin from bovine plasma | Sigma | F1141-1MG | Cell adherent |
| Fine stitch Scissors | Sklar | 64-3260 | Dissection tools |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A11008 | Secondary staining antibody |
| Goat anti-rat IgG Alexa Fluor 555 | Invitrogen | A21434 | Secondary staining antibody |
| Hanks' Balanced Salt Solution (w/o Ca or Mg) | ThermoFisher | 14170120 | Tissue dissociation |
| L-glutamine, 200mM | Gibco | 20530081 | Media component |
| Murine epidermal growth factor | ThermoFisher | PMG8044 | Media component |
| Murine IFN-γ | Peprotech | 315-05-20UG | Media component |
| Murine PDGF-AA | Peprotech | 315-17 | Media component |
| Neurobasal | Gibco | 21103-049 | Media component |
| Normal goat serum | Sigma | G9023 | Blocking solution component |
| Operating Scissors | Surgi-OR | 95-272 | Dissection tools |
| Poly-D-Lysine 12 mm #1 German Glass Coverslip | Corning Biocoatt | 354086 | Cell adherent |
| Prolong Gold Antifade Reagent | Cell Signaling Technology | 9071S | Mounting Media |
| Rabbit anti-Iba1 | Wako | 019-19741 | Primary antibody |
| Rabbit anti-NG2 Chondroitin Proteoglycan | Millipore | ab5320 | Primary antibody |
| Rat anti-GFAP | ThermoFisher | 13-0300 | Primary antibody |
| Rat anti-myelin basic protein | Abcam | ab7349 | Primary antibody |
| Sharp Tip Scissors | Surgi-OR | 95-104 | Dissection tools |
| Stereo Microscope | Leica | S4 E Stereo Zoom Microscope | Microscope for dissection |
| Tissue Forceps | Sklar | 66-7644 | Dissection tools |
| Triton X-100 | Fisher Bioreagents | BP151-100 | Cell permabilization |
| Trypsin Inhibitor (from chicken egg white) | Sigma | 10109878001 | Tissue dissociation |
References
- Fields, R. D., et al. Glial Biology in Learning and Cognition. The Neuroscientist. 20 (5), 426-431 (2014).
- Nuriya, M., Hirase, H. Involvement of astrocytes in neurovascular communication. Progress in Brain Research. 225, 41-62 (2016).
- Nave, K. A. Myelination and support of axonal integrity by glia. Nature. 468 (7321), 244-252 (2010).
- Wake, H., Moorhouse, A. J., Miyamoto, A., Nabekura, J. Microglia: actively surveying and shaping neuronal circuit structure and function. Trends in Neurosciences. 36 (4), 209-217 (2013).
- Kierdorf, K., Prinz, M. Microglia in steady state. The Journal of Clinical Investigation. 127 (9), 3201-3209 (2017).
- Hertz, L., Chen, Y. Importance of astrocytes for potassium ion (K(+)) homeostasis in brain and glial effects of K(+) and its transporters on learning. Neurosciences and Biobehavior Reviews. 71, 484-505 (2016).
- Gordon, G. R., Howarth, C., MacVicar, B. A. Bidirectional Control of Blood Flow by Astrocytes: A Role for Tissue Oxygen and Other Metabolic Factors. Advances in Experimental Medicine and Biology. 903, 209-219 (2016).
- Schneider, J., Karpf, J., Beckervordersandforth, R. Role of Astrocytes in the Neurogenic Niches. Methods Mol Biol. 1938, 19-33 (2019).
- Sharif, Y., et al. Blood brain barrier: A review of its anatomy and physiology in health and disease. Clinical Anatomy. 31 (6), 812-823 (2018).
- von Bernhardi, R., Eugenin-von Bernhardi, J., Flores, B., Eugenin Leon, J. Glial Cells and Integrity of the Nervous System. Advances in Experimental Medicine and Biology. 949, 1-24 (2016).
- Gordon, J., Amini, S., White, M. K. General overview of neuronal cell culture. Methods in Molecular Biology. 1078, 1-8 (2013).
- Spaethling, J. M., et al. Primary Cell Culture of Live Neurosurgically Resected Aged Adult Human Brain Cells and Single Cell Transcriptomics. Cell reports. 18 (3), 791-803 (2017).
- Bayraktar, O. A., Fuentealba, L. C., Alvarez-Buylla, A., Rowitch, D. H. Astrocyte development and heterogeneity. Cold Spring Harbor Perspectives in Biology. 7 (1), 020362 (2015).
- Liu, R., et al. Region-specific and stage-dependent regulation of Olig gene expression and oligodendrogenesis by Nkx6.1 homeodomain transcription factor. Development. 130 (25), 6221-6231 (2003).
- Tan, Y. L., Yuan, Y., Tian, L. Microglial regional heterogeneity and its role in the brain. Molecular Psychiatry. 25 (2), 351-367 (2020).
- Witting, A., Moller, T. Microglia cell culture: a primer for the novice. Methods in Molecular Biology. 758, 49-66 (2011).
- Williams, J. L., Patel, J. R., Daniels, B. P., Klein, R. S. Targeting CXCR7/ACKR3 as a therapeutic strategy to promote remyelination in the adult central nervous system. Journal of Experimental Medicine. 211 (5), 791-799 (2014).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Tanner, D. C., Cherry, J. D., Mayer-Proschel, M. Oligodendrocyte progenitors reversibly exit the cell cycle and give rise to astrocytes in response to interferon-gamma. Journal of Neuroscience. 31 (16), 6235-6246 (2011).
- Stansley, B., Post, J., Hensley, K. A comparative review of cell culture systems for the study of microglial biology in Alzheimer's disease. Journal of Neuroinflammation. 9 (1), 115 (2012).
- Spaethling, J. M., et al. Primary Cell Culture of Live Neurosurgically Resected Aged Adult Human Brain Cells and Single Cell Transcriptomics. Cell Reports. 18 (3), 791-803 (2017).
- Timmerman, R., Burm, S. M., Bajramovic, J. J. An Overview of in vitro Methods to Study Microglia. Frontiers in Cellular Neuroscience. 12 (242), (2018).
- Stevens, B. Glia: much more than the neuron's side-kick. Current Biology. 13 (12), 469-472 (2003).
- Fields, R. D., et al. Glial biology in learning and cognition. Neuroscientist. 20 (5), 426-431 (2014).
- Yamamuro, K., Kimoto, S., Rosen, K. M., Kishimoto, T., Makinodan, M. Potential primary roles of glial cells in the mechanisms of psychiatric disorders. Frontiers in Cellular Neuroscience. 9 (154), (2015).
- Hartenstein, V., Giangrande, A. Connecting the nervous and the immune systems in evolution. Communications Biology. 1 (1), 64 (2018).
- Emsley, J. G., Macklis, J. D. Astroglial heterogeneity closely reflects the neuronal-defined anatomy of the adult murine CNS. Neuron Glia Biology. 2 (3), 175-186 (2006).
- Chaboub, L. S., Deneen, B. Developmental Origins of Astrocyte Heterogeneity: The Final Frontier of CNS Development. Developmental Neuroscience. 34 (5), 379-388 (2012).
- Tan, Y. L., Yuan, Y., Tian, L. Microglial regional heterogeneity and its role in the brain. Molecular Psychiatry. 25 (2), 351-367 (2020).
- Bottcher, C., et al. Human microglia regional heterogeneity and phenotypes determined by multiplexed single-cell mass cytometry. Nature Neurosciences. 22 (1), 78-90 (2019).
- Marques, S., et al. Oligodendrocyte heterogeneity in the mouse juvenile and adult central nervous system. Science. 352 (6291), 1326-1329 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved