Method Article
여러 중추 신경계 영역에서 쥐 아교 세포의 해부 및 분리
요약
여기에서는 마우스 CNS로부터 다중 신경교 세포 집단의 시험관 내 분리를 위한 프로토콜을 제시합니다. 이 방법을 사용하면 국소 미세아교세포, 희소돌기아교세포 전구체 세포 및 성상세포를 분리하여 다양한 배양 시스템에서 각각의 표현형을 연구할 수 있습니다.
초록
여기에 제시된 방법은 신경교 하위 집단의 분리를 위해 쥐 신생아로부터 중추 신경계 (CNS)의 4 가지 영역을 해부하는 실험실 절차를 보여줍니다. 이 절차의 목적은 시험관 내 분석을 용이하게하기 위해 피질, 소뇌, 뇌간 및 척수 조직에서 미세 아교 세포, 희소 돌기 아교 세포 전구 세포 (OPC) 및 성상 세포를 해리하는 것입니다. CNS 영역 분리 절차는 다중 세포 배양 시스템에서 신경교 세포 간의 국소 이질성을 결정할 수 있습니다. 신속한 CNS 영역 분리가 수행 된 후 신경교의 수막 세포 오염을 방지하기 위해 수막을 기계적으로 제거합니다. 이 프로토콜은 세포 무결성과 부착을 보존하도록 설계된 지정된 매트릭스에서 부드러운 조직 해리와 도금을 결합합니다. 여러 CNS 영역에서 혼합 아교세포를 분리하면 잠재적으로 이질적인 아교세포에 대한 포괄적인 분석을 제공하는 동시에 개별 실험 동물의 사용을 극대화할 수 있습니다. 또한 지역 조직의 해리 후 혼합 아교 세포는 단일 세포 유형, 세포 배양 플레이트 삽입물 또는 공동 배양 시스템에 사용하기 위해 미세 아교 세포, OPC 및 성상 세포를 포함한 여러 세포 유형으로 더 나뉩니다. 전반적으로, 입증된 기술은 쥐 신생아로부터 4개의 개별 CNS 영역을 주의 깊게 해부하기 위한 광범위한 적용 가능성의 포괄적인 프로토콜을 제공하며, 임의의 수의 시험관내 세포 배양 시스템 또는 분석에서 국소 이질성을 검사하기 위해 3개의 개별 신경교 세포 유형을 분리하는 방법을 포함합니다.
서문
아교 세포는 CNS에서 적절한 신경 기능에 필요합니다. 그들은 성상 세포, 희소 돌기 아교 세포 및 미세 아교 세포의 세 가지 주요 하위 집단으로 구성되며, 각각은 다르지만 필수 불가결 한 역할을합니다1. 적절한 신경교 세포 다양성과 활동이 없으면 신경 기능에 심각한 영향을 미쳐 CNS 손상을 유발합니다. glia는 신경 전달에 영향을 미칠 수 있으며 각 세포 유형은 고유 한 방식으로 영향을 미칩니다. 뇌의 신경교 세포는 적절한 CNS 기능을 촉진하기 위해 신경 세포뿐만 아니라 그들 사이에서도 의사 소통 할 수있는 능력을 가지고 있습니다2. 희소돌기아교세포는 수초의 형성을 통해 전기 전달 속도를 증가시켜 뉴런 활동 전위생성 3 부위인 Ranvier의 노드에서 이온 채널의 클러스터링을 용이하게 합니다. 미세아교세포는 시냅스 전달을 모니터링하고 손상 후 뉴런 연결을 "재배선"하여 시냅스 가지치기에 중요합니다4. 또한, 미세아교세포는 CNS의 가장 풍부한 상주 면역 세포이며, 병원체에 대한 숙주 방어의 주요 형태로작용합니다5. 성상 세포는 세포 외 칼륨6의 농도를 수정하여 뉴런 사이의 시냅스 전달을 조절할 수 있습니다. 그들은 또한 국소 혈류7를 조절하고, 신경 조절 요소8를 방출하고 흡수하며, 혈액-뇌 장벽 유지9에 중요한 역할을 합니다. 따라서, 각각의 신경교 아형은 CNS 기능에 중요한데, 이는 임의의 유형의 결함이 정신 질환, 간질 및 신경퇴행성 질환(10)을 포함하는 매우 다양한 병리학적 상태와 오랫동안 연관되어 왔기 때문이다.
CNS 병리학 연구에서 가장 큰 장애물은 미세 환경 틈새 시장의 맥락에서 인간 세포를 조사 할 수 없다는 것입니다. 인간 생검 조직은 대부분 사후에 수집되며 세포는 추출 및 가공 중에 쉽게 손상되거나 손실될 수 있습니다. 더욱이, 인간 세포를 종양으로부터 불멸화된 세포주를 유도하지 않고 시험관내에서 생존 및 생존 가능한 상태로 유지하는 것은 도전이며, 이 시점에서 인간 세포는 더 이상 정상적인 생리학적 특성을 정확하게 반영하지 않는다11,12. 또한, 개별 신경교 세포 유형13,14,15 사이에는 상당한 양의 국소 이질성이 존재하며, 개별 환자로부터 국소 CNS 샘플을 얻는 것은 거의 불가능합니다. 따라서 특정 CNS 장애에서 국소 아교 세포의 기여도를 연구하기위한 대체 모델을 개발할 필요가있다.
여기에서는 여러 신경교 아집단의 마우스 CNS 영역 특이적 분리를 사용하여 미세아교세포, 성숙한 희소돌기아교세포를 생성하는 희소돌기아교세포 전구세포(OPC) 및 성상세포의 조작 및 정량화를 허용하는 시험관 내 시스템을 설명합니다. 각 집단은 독립적으로 분리될 수 있으며 실험적 필요성에 따라 약물 또는 분자 처리, 면역세포화학, 단백질/RNA 추출 및 분석, 기타 공동 배양 시스템을 포함한 다양한 실험 기술을 적용할 수 있습니다. 또한 이 분리 기술은 높은 세포 수를 산출하여 높은 처리량 방식으로 각 신경교 집단의 특성화 및 조사를 가능하게 합니다. 또한 생체 내 환경에 일반적으로 존재하는 교란 요인을 피하기 위해 제어된 방식으로 다양한 미세환경 자극에 반응하여 CNS 세포 분화, 성장 및 증식을 연구할 수 있습니다. 마지막으로, 이 세포 분리 기술은 서로 다른 CNS 영역 내의 신경교 세포 집단의 조작을 용이하게 하여 국소 신경교가 서로 상호 작용하고 다양한 자극에 반응하는 방식을 조사하여 정밀도와 재현성을 허용합니다.
프로토콜
참고 : 모든 동물 연구는 클리블랜드 클리닉 러너 연구소 기관 동물 관리 및 사용위원회의 승인 및 승인을 받았습니다.
1. 해부용 배지 및 소모품 준비
참고: 모든 버퍼 및 미디어 레시피는 표 1에 나와 있습니다. 이 절차는 생물 안전 캐비닛으로 지정된 조직 배양에서 멸균 조건에서 수행됩니다.
- 필터 혼합 아교 세포 배지 (MGM)를 준비하고 멸균합니다. 이것은 전날 행해지고 4°C에서 저장될 수 있다.
- 피브로넥틴을 멸균 H2O로 1:100 농도로 희석하십시오. 희석된 피브로넥틴의 부피는 실험에 사용된 새끼의 수 및 CNS 영역에 따라 달라질 것이다. 1 개의 피질에 하나의 T25 플라스크, 2-4 개의 대뇌 용 T25 플라스크 1 개, 2-4 개의 뇌간에 T25 플라스크 1 개, 2-4 개의 척수에 T25 플라스크 1 개를 사용하십시오.
알림: 위에 나열된 기준을 사용하여 동일한 영역의 조직을 결합하면 아래에 설명된 프로토콜을 변경하지 않고도 적절한 해리가 가능합니다. 단계 1.2에 설명된 것보다 더 많은 조직을 결합하려면 해리 시약 농도의 추가 최적화가 필요합니다. - 실온에서 T25 플라스크에 희석된 피펫팅 피펫 3mL를 넣고 2분 동안 그대로 둡니다.
- 피브로넥틴을 흡인하고 플라스크 뚜껑을 느슨하게 하여 플라스크를 밤새 건조시킵니다.
2. 피질, 소뇌, 뇌간 및 척수 박리
알림: 이 절차는 벤치탑에서 수행할 수 있으며 해부 범위가 필요합니다. 절차의 모든 단계에 엄격한 무균 기술을 사용하고 실내 공기에 대한 조직 노출을 최소화하십시오. 최대 조직 보존을 보장하기 위해 해부 중에 모든 배지를 얼음 위에 식힌 상태로 유지하십시오. 또는이 절차는 내부 해부 범위를 사용할 수있는 후드에서 수행 할 수 있습니다.
- 70 % 에탄올로 모든 부위를 닦으십시오.
- 10cm 페트리 접시에 PBS/항생제 용액(PAS) 10mL를 피펫팅합니다. 해부 할 각 강아지에 대해 하나의 페트리 접시를 준비하십시오. 용액을 차갑게 유지하기 위해 얼음 위에 놓습니다.
- 소독된 조직 배양 후드에서 9mL의 DMEM(첨가제 없음)을 각 CNS 영역에 하나씩 4개의 개별 15mL 원뿔형 튜브에 피펫팅하고 튜브 캡을 교체하고 얼음 위에 놓습니다. 해부 범위에서 도달 할 수있는 거리 내에 튜브가있는 얼음 양동이를 놓습니다.
- 10단계에서 준비한 2.2cm 페트리 접시를 소독된 해부 범위 단계에 놓습니다.
- 제도적 프로토콜에 따라 마우스 강아지를 마취 및 안락사시키고 날카로운 가위로 신속한 참수로 머리를 제거합니다.
알림: 출생 후 일 (P) 3-5 마리의 새끼가 사용됩니다. 나이가 많은 새끼는 CNS가 더 발달되어 있으며 신경교 세포를 확장하는 적절한 공급원이 아닐 수 있습니다. 어린 새끼(P) 0-2는 더 많은 수의 신경교를 생성할 수 있으며 사용할 수 있습니다. 그러나 척수 조직은 크기 때문에이 어린 나이에 해부하기가 매우 어렵습니다. - 70 % 에탄올을 사용하여 강아지의 피부를 청소하십시오.
- 가는 가위를 사용하여 꼬리에서 시작하여 주둥이에 도달 할 때까지 주둥이를 움직여 동물의 머리 정중선을 따라 피부층을 자릅니다. 조직 손상을 피하기 위해 두개골을 깊게 자르지 마십시오.
- 머리를 아래로 기울이고 두개골의 양쪽으로 피부층을 당기고 스프링 가위를 사용하여 구멍 매그넘에서 시작하여 두개골 정중선을 따라 절개하고 다시 꼬리를 주둥이로 자릅니다.
- 끝이 가는 집게로 두개골 절반을 오른쪽과 왼쪽으로 당겨 피질, 소뇌 및 뇌간을 노출시킵니다.
- 노출되면 뇌를 두개골에서 부드럽게 들어 올려 10단계에서 준비한 2.2cm 페트리 접시에 넣습니다. 뒷뇌가 부착된 상태에서 해부학적 구조를 보존하기 위해 뇌가 손상되지 않았는지 확인합니다.
- 집게의 끝이 위쪽을 향하도록 가늘고 구부러진 끝 집게를 사용하여 소뇌를 꼬집습니다. 수막을 제거하고 얼음 양동이에 지정된 15mL 원뿔형 튜브에 넣습니다.
- 뇌간이 소뇌에 직접 복부에 있고 소뇌 제거 후 볼 수 있는지 확인하십시오. 끝이 가는 집게로 제거하고 수막을 제거한 다음 지정된 15mL 원추형 튜브에 얼음 양동이에 넣습니다.
- 중뇌를 피질에서 분리하고 피질 수막을 제거한 다음 얼음 양동이에 지정된 15mL 원추형 튜브에 넣습니다.
- 척수를 제거하려면 목이 잘린 마우스 강아지를 절단된 척추를 조사자 쪽으로 들어 올린 상태에서 앙와위 자세(얼굴을 위로 향하게 눕힘)에 놓습니다.
- 70 % 에탄올로 다시 분무하십시오.
- 척추의 측면을 따라 주둥이에서 꼬리 방향으로 흉곽을 통해 뒷다리에 도달 할 때까지 자릅니다. 절단하는 동안 척추가 보일 때까지 내부 장기를 뒤로 밉니다.
- 척추가 분리 될 때까지 척추의 각 측면을 따라 자르고 10 단계에서 준비한 2.2cm 페트리 접시에 넣습니다.
- 복부 쪽이 위로 향하도록 가위를 사용하여 요추 부위에 도달할 때까지 각 척추의 오른쪽과 왼쪽을 번갈아 절단하여 척수 조직을 노출시킵니다.
- 해부 현미경으로 끝이 가늘게 뾰족한 집게로 척수와 수막을 부드럽게 제거합니다. 얼음 양동이에 지정된 15mL 원뿔형 튜브에 넣습니다.
- 준비된 각 T2.5 플라스크에 대해 2.2.2단계에 설명된 기준에 맞게 동일한 영역의 조직을 결합하여 각 강아지에 대해 2.5.-2.19단계를 반복합니다.
알림: 수막을 가능한 한 완전히 제거하십시오. 상당한 양의 수막이 남아 있으면 수막 세포의 섬유 아세포 유사 표현형이 자라서 세포 배양을 압도합니다. 동일한 표현형의 여러 척수를 결합하여 특정 세포 배양을 생성 할 수 있습니다. 세포의 과밀이 발생하지 않도록주의하여 신경교 세포 사멸 및 차등 표현형을 유발할 수 있습니다.
3. 조직 해리
알림: 다음 절차는 모두 무균 기술과 멸균 물질을 사용하여 생물 안전 캐비닛으로 지정된 멸균 조직 배양에서 수행됩니다.
- 0.53mM EDTA를 함유하는 0.05% 트립신 1mL를 9mL DMEM 및 조직의 각 15mL 원뿔형 튜브에 추가하여 조직 용해를 시작합니다.
알림: DMEM에는 트립신 억제제로 작용할 수있는 다량의 염화칼슘이 포함되어 있습니다. 설명 된 단계에 따라 해리가 완료되지 않으면 칼슘이나 마그네슘이없는 행크스의 균형 잡힌 소금 용액을 사용할 수 있습니다. 트립신 화 후 효소는 트립신 억제제를 추가하여 중화 될 수 있지만 칼슘은 후속 단계에서 사용되는 DNase I의 보조 인자이므로 용액에 다시 첨가해야합니다. - 10mL 피펫으로 약 20배 분쇄합니다.
- 세포 현탁액을 빈 50mL 원뿔형 튜브로 옮깁니다.
- 용액을 37°C, 5%CO2 에서 15분 동안 인큐베이션하고, 8분 후에 용해물을 부드럽게 교반시킨다.
- 50μg/mL의 최종 농도를 위해 각 튜브에 5mL의 MGM 및 200μL(5mg/mL) DNase I을 추가합니다.
- 각 용해물을 10mL 피펫으로 10x 분쇄합니다.
- 세포 현탁액을 실온에서 3분 동안 그대로 두어 해리되지 않은 조직이 튜브 바닥에 침전되도록 합니다.
- 세포 현탁액을 새로운 50mL 원뿔형 튜브로 옮겨 해리되지 않은 조직을 남깁니다.
참고: 위에서 설명한 용해 및 분쇄 단계는 해리되지 않은 조직의 양을 크게 제한합니다. - 브레이크없이 300 x g 의 튜브를 4 ° C에서 3 분 동안 원심 분리합니다.
- 상청액을 흡인하고 나머지 세포 펠릿을 5mL의 MGM에 재현탁합니다.
- 5mL 피펫으로 펠릿을 20배 분쇄합니다.
- 코팅된 T25 플라스크에 5mL 세포 현탁액을 플레이팅합니다.
- 세포를 37°C, 5%CO2 에서 인큐베이션하고, 24시간 후에 초기에 배지를 교체하여 세포 파편을 제거하였다.
참고: 일부 프로토콜은 72시간 후에 초기 미디어를 교체할 것을 권장합니다. 이 단계의 최적화가 필요할 수 있습니다. - 세포가 100% 합류할 때까지(약 48-72일) MGM으로 80% 배지 교체를 수행합니다(약 5-7일).
참고: 미디어를 교체하기 전에 모든 미디어를 37°C로 예열해야 합니다.
4. 미세아교세포 분리
- 혼합 된 glia 배양이 80 % confluency에 도달하면 뚜껑을 조이고 파라핀 필름으로 밀봉하여 흔들 수있는 플라스크를 준비하십시오.
- 혼합 신경교 배양에서 미세아교세포를 제거하려면 플라스크를 37°C 인큐베이터 내부의 오비탈 셰이커에 수평으로 고정합니다. 플라스크를 15 x g 에서 1시간 동안 흔듭니다.
- 배지와 피펫을 15mL 코니컬 튜브에 넣습니다. 3mL의 따뜻한 MGM으로 플라스크를 두 번 헹구고 15mL 원뿔형 튜브에 세척을 추가합니다. 이들은 미세 아교 세포입니다.
- 배양 플라스크에 따뜻하고 신선한 MGM 5mL를 추가합니다.
- 플라스크를 파라핀 필름으로 다시 밀봉하고, 플라스크를 셰이커에 수평으로 고정하고, 성상세포에서 OPC를 분리하기 위해 37°C에서 15시간 동안 15 x g 로 흔듭니다.
알림: 이 단계는 밤새 수행할 수 있지만 초과 시간은 세포 사멸을 초래할 수 있으므로 15시간 흔들림 시간이 중요합니다. - 단계 4.3의 상청액을 원심분리한다. 300 x g 에서 3분 동안 배양하고 표준 프로토콜16 에 따라 미세아교세포를 배양하거나 생물학적 분석에 사용합니다.
5. 희소돌기아교세포 전구체 세포 분리
알림: 초기 분리 후 OPC를 도금할 때는 폴리-D-라이신 코팅 표면(멸균 플레이트 또는 커버 슬립)에 도금해야 합니다. 이 섹션을 완료하기 전에 이러한 자료를 준비하십시오.
- 15시간 진동 후, 플라스크에서 상청액을 제거하고 멸균된 100mm 페트리 접시에 플레이트합니다.
- 상청액을 37°C, 5%CO2 에서 30분 동안 인큐베이션하고, 15분 후에 소용돌이치며 잔존하는 미세아교세포를 제거하는데, 이는 이들이 접시에 매우 빠르게 부착되기 때문이다. 비조직 배양 처리된 페트리 접시가 이 단계에 사용될 수 있다.
- 부착되지 않은 세포 상청액을 제거하고 계수하고 폴리-D-라이신으로 코팅된 표면에 플레이트합니다. 전형적으로, 7,500-10,000 OPC가 도금된다/cm2.
- 37°C, 5%CO2 에서 최소 1시간(최대 6시간) 동안 배양한 다음 배지의 95%를 부드럽게 흡입하고 따뜻한 OPC 배지를 천천히 추가하여 우물 벽에 피펫팅하여 OPC의 중단을 최소화합니다. 셀을 사용할 준비가 될 때까지 48시간마다 미디어를 교체합니다.
참고: 한 번에 하나의 웰만 교체하는 것이 중요합니다. OPC는 민감하며 특히 건조한 조건에 내성이 없습니다. OPC 배지에 PDGF-AA를 첨가하는 것은 희소돌기아교세포로의 OPC 성숙을 지연시키는 것이다. 이 인자는 실험 초점이 성숙한 희소돌기아교세포인 경우 배양 배지에서 제외될 수 있습니다.
6. 성상 세포 분리
- 15시간 진동 후 상층액을 제거하고 따뜻한 1x PBS로 플라스크를 2x 헹굽니다.
- 0.53 mM EDTA를 함유하는 0.05% 트립신 4 mL를 첨가하고, 37°C, 5%CO2 에서 5분 동안 또는 세포가 들어올 때까지 배양한다. 성상 세포가 들어 올려 졌는지 확인하려면 표준 광시야 현미경을 사용하여 시각화하십시오. 성상 세포는 트립신 화 후 구형으로 나타납니다.
- 성상 세포가 분리되면 플라스크를 수직으로 세우고 4mL MGM을 추가합니다. 혼합하기 위해 분쇄하십시오.
- 성상 세포를 15mL 원추형 튜브에 피펫팅하고 300 x g 에서 5 분 동안 원심 분리합니다.
- 성상 세포 배지에 성상 세포를 재현탁하고 단계 1.2에 설명 된대로 피브로넥틴이 코팅 된 표면에 플레이트합니다. 또는 생물학적 분석에 사용합니다.
참고: 20ng/mL 뮤린 섬유아세포 성장 인자는 성상세포 배양을 확립하는 데 도움이 되도록 첫 번째 배지 변경 중에 추가할 수 있습니다. 또한, 표준 젤라틴 코팅은 피브로넥틴에 대한 저렴한 대안이 될 수 있다.
7. 면역세포화학을 이용한 미세아교세포, OPC, 성상교세포 및 성숙 희소돌기아교세포의 확인 및 분리
- 도금된 세포가 적절한 합류에 도달하면 배지를 부드럽게 제거하고 4% 파라포름알데히드(PFA)를 사용하여 부착 세포를 10분 동안 고정합니다. 생물 안전 캐비닛에서이 단계를 수행하십시오.
참고: 용액을 흡입하거나 추가할 때 세포 분리를 방지하기 위해 부드러운 압력으로 피펫을 사용하십시오. - PFA를 천천히 흡인 한 다음 1x PBS로 세포를 3 분 동안 5 번 세척합니다.
- 1x PBS에서 10% 혈청 및 0.1% Triton X-100을 사용하여 적절한 차단 용액을 준비합니다.
참고: 혈청 공급원은 2차 항체가 제기된 숙주 동물을 반영합니다. 예를 들어, 2차 항체가 염소 항-토끼인 경우, 적절한 차단 혈청은 정상 염소 혈청이다. 마찬가지로, 2차 항체가 당나귀 항토끼인 경우, 차단 혈청은 정상 당나귀 혈청이어야 한다. - 세포가 완전히 덮일 때까지 차단 용액을 추가하십시오. 실온에서 1 시간 동안 차단하십시오.
- 항체 희석제 용액(1x PBS 9mL, 소 혈청 알부민 0.01g, 트리톤 X-100 30μL)을 준비한다. 대안적으로, 항체는 단계 6.3에 기재된 블로킹 용액에서 희석될 수 있다.
- 다음에 특이적인 1차 항체를 항체 희석제 또는 블로킹 용액으로 희석합니다.
- 미세아교세포: 이온화된 칼슘 결합 어댑터 분자 1(Iba1)을 1:250 희석(2.4μg/mL)으로 처리했습니다.
- OPC : 신경 / 아교 항원 2 (NG2) 1 : 200 희석 (5 μg / mL).
- 성숙한 희소돌기아교세포: 1:400 희석에서 미엘린 염기성 단백질(MBP)(농도는 로트 의존적이며 최적화가 필요할 수 있음).
- 성상 세포 : 1 : 400 희석 (0.25 μg / mL)에서 신경교 섬유 산성 단백질 (GFAP)17.
참고: 같은 종에서 자란 1차 항체를 혼합하지 마십시오.
알림: GFAP는 백질 성상 세포에 안정적으로 라벨을 붙입니다. 회백질 성상 세포의 경우 대체 마커를 사용해야 할 수도 있습니다.
- 1차 항체를 4°C에서 밤새 인큐베이션합니다(부드러운 교반이 바람직함).
- 1차 항체를 제거하기 위해 1x PBS로 5분 동안 3x 세척합니다.
- 빛으로부터 보호되는 항체 희석제 또는 차단 용액에서 1:400 희석으로 적절한 2차 항체로 세포를 배양합니다.
참고: 2차 항체는 사용 가능한 현미경 매개변수에 따라 교환될 수 있는 형광단에 접합됩니다. 형광 2차 항체가 도포되면 가능한 한 빛으로부터 보호하십시오. - 2차 항체를 실온에서 1시간 동안 배양하여 빛에 대한 노출을 제한합니다.
- 과도한 2차 항체를 제거하기 위해 1x PBS로 5분 동안 3회 세척합니다.
- 핵에 라벨을 붙이려면 1:1,000 DAPI/PBS 용액을 사용하고 어두운 곳에서 실온에서 5분 동안 세포를 배양합니다.
- 어둠 속에서 3x PBS로 5 분 동안 5 번 씻으십시오.
- 장착하려면 장착 매체를 적용하고 이미징하기 전에 어두운 곳에서 건조시키십시오.
알림: 장착된 슬라이드는 실온에서 2-3일 동안 보관할 수 있습니다. 장기간 보관하려면 슬라이드를 4 ° C로 옮깁니다. 최대 신호의 경우 1 주일 이내에 이미지. 모든 대표 이미지는 컨포칼 현미경으로 이미지화되었습니다. 그러나 도립 형광 현미경도 권장됩니다.
결과
아래에 나타낸 대표적인 데이터는 IFNγ 신호전달이 OPC 분화 및 성숙에 영향을 미친다는 것을 보여준다. IFNγ 수용체 (IFNγR)가 없으면 피질 OPC는 성숙한 수초 희소 돌기 아교 세포로 쉽게 분화되지 않으며 이는 MBP 염색이없는 것으로 입증됩니다 (그림 1). 희소돌기아교세포와 성상교세포는 공통 전구세포에서 파생되기 때문에 성상교세포를 표지하는 GFAP 발현을 분석했습니다. 우리는 IFNγR 결핍 세포가 GFAP를 강하게 발현한다는 것을 발견하여 성상 세포 표현형을 채택 할 수 있음을 시사하여 이전 보고서19를 뒷받침했습니다.
CNS 세포의 국소 이질성에 대한 추가 증거는 피질, 소뇌, 뇌간 및 척수의 성상 세포에서 볼 수 있는 다양한 성상 세포 형태에 의해 입증됩니다(그림 2). 참고로, 동일한 영역의 성상 세포는 또한 형태 학적 이질성을 나타낼 수 있으며,이 glial 아형이 매우 역동적이라는 개념을 뒷받침합니다. 세포 구조의 차이는 기능적 다양성을 암시하므로 미세 환경 자극의 부재 및 존재 하에서 표현형 반응을 연구하기 위해서는 신경교 집단을 분리하는 능력이 필요합니다.
희소돌기아교세포는 신경 축삭의 수초화에 중요하며 적절한 CNS 복구 및 기능에 필요합니다. OPC는 성숙한 대응 물을 낳기 때문에 차별화 능력 뒤에있는 생물학을 이해하는 것이 중요합니다. 사이토카인 신호 전달은 줄기 및 면역 세포 행동에 상당한 영향을 미칩니다. 따라서, OPC의 지역적 반응이 차등 사이토카인 자극에 어떻게 달라질 수 있는지 이해하는 것이 중요하며(그림 3), 이는 성숙한 수초 희소돌기아교세포로 분화하는 능력에 영향을 미칠 수 있습니다.
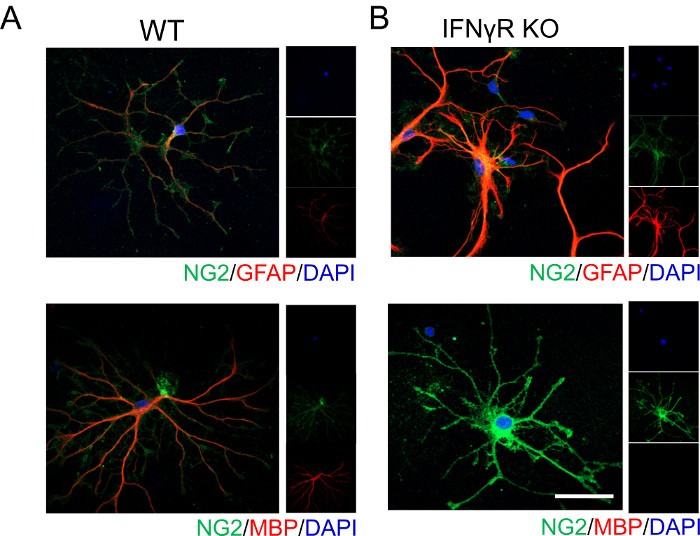
도 1: 외인성 IFNγ의 존재 하에 WT 및 IFNγR-/- 마우스에서의 OPC 분화를 보여주는 대표적인 데이터. 피질 OPC는 위에 설명된 절차에 따라 ( A ) WT 및 (B) IFNγR-/- P4 마우스 새끼로부터 분리되었습니다. 세포를 48시간 동안 1ng/mL IFNγ로 처리한 다음, 세포 분화를 묘사하기 위해 고정 및 염색하였다. OPC는 성상 세포 표현형을 채택한 것을 식별하기 위해 NG2 및 GFAP에 대해 라벨링되었습니다. 마찬가지로, OPC는 성숙한 희소돌기아교세포로 분화하는 것을 식별하기 위해 NG2 및 MBP에 대해서도 표지되었습니다. 스케일 바 = 20 μM. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
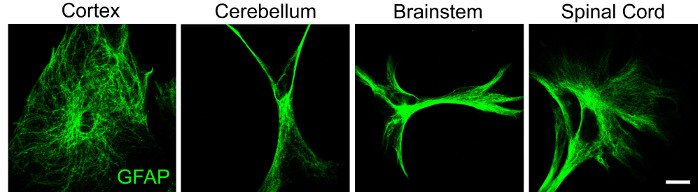
그림 2: 성상세포 형태학의 지역적 이질성을 보여주는 대표적인 데이터. 피질, 소뇌, 뇌간 및 척수의 성상 세포를 위에서 설명한 프로토콜을 사용하여 P4 마우스 새끼로부터 분리하고 배양 후 48 시간 후 면역 세포 화학에 의해 GFAP (녹색)로 표지했습니다. 스케일 바 = 20 μM. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
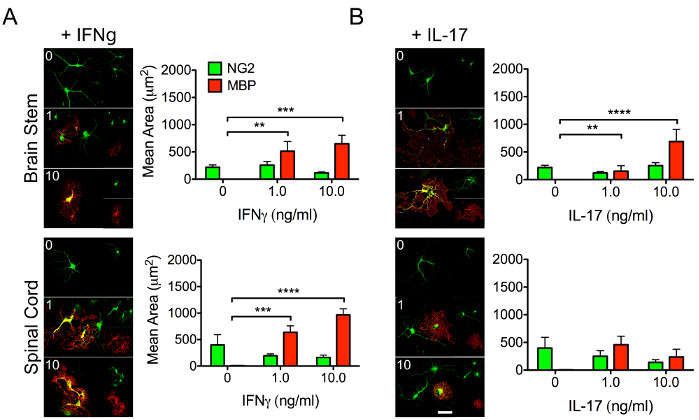
그림 3: 사이토카인에 대한 지역 OPC의 차등 반응을 보여주는 대표적인 데이터. OPC는 위에서 설명한 프로토콜을 사용하여 P4 마우스 강아지의 뇌간 및 척수로부터 분리되었습니다. 세포를 (A) IFNγ 또는 (B) 인터루킨 (IL) -17의 농도 ( 1-10 ng / mL ) 로 처리하여 수초 희소 돌기 아교 세포로 분화하는 지역 OPC의 능력에 대한 사이토 카인의 차별적 영향을 조사했습니다. 특정된 사이토카인과의 48시간 배양 후, OPC를 고정시키고 NG2(녹색) 및 MBP(적색)에 대해 표지하였다. 스케일 바 = 20 μM. 데이터는 SEM± 평균을 나타낸다. **, p < 0.01; , p < 0.001; , p < 2-원 분산 분석에 의한 0.0001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| PBS / 항생제 용액 (PAS) : | ||
| 1.0 밀리리터 | 10,000 단위 / mL 페니실린 및 10,000 mg / mL 스트렙토 마이신을 함유 한 100X 항생제 / 항진균제 | |
| 25 밀리그램 / 밀리람베르트 | 암포 테리 신 B | |
| 99 밀리리터 | 1X PBS | |
| 혼합 아교 세포 배지 (MGM) | ||
| 88 밀리리터 | 1X DMEM (고 포도당, L- 글루타민 포함, Na 피루 베이트 포함) | |
| 10 밀리리터 | 열 불활성화 FBS | |
| 1.0 밀리리터 | L- 글루타민 (100X) | |
| 1.0 밀리리터 | 항생제/항진균제 | |
| 오피씨 배지 (50mL) | ||
| 49 밀리리터 | 신경 기저 매체 | |
| 1.0 밀리리터 | B27 서플리먼트(50 X) | |
| 10 응/밀리람베르트 | PDGF-AA | |
| 참고: PDGF-AA는 각 미디어 변경 전에 새로 추가됩니다. | ||
| 성상 세포 배지 (1 L) | ||
| 764 밀리리터 | 글루타민을 함유 한 얼의 염이 함유 된 MEM | |
| 36 밀리리터 | 포도당 (20mM의 최종 농축을 위해 100 mg / mL 스톡 사용) | |
| 100 밀리리터 | 열 불활성화 FBS | |
| 100 밀리리터 | 열 불활성화 말 혈청 | |
| 10 밀리리터 | 글루타민(재고 매체에 포함되지 않은 경우 200mM 스톡 사용) | |
| 옵션: 10ng/mL 재조합 마우스 표피 성장 인자 | ||
| 알림: 모든 여과지를 멸균하고 사용할 때까지 4°C에서 보관하십시오. | ||
표 1: 버퍼 및 미디어 레시피.
토론
이 프로토콜에서 우리는 마우스 CNS에서 세 가지 주요 신경교 세포 하위 집단의 분리를 설명합니다 : 미세 아교 세포, OPC 및 성상 세포. 신경 퇴행성 및 신경 염증성 CNS 질환의 조사에 대한 주요 좌절은 일차 인간 세포 및 조직, 특히 지역 및 동일한 환자로부터의 세포 및 조직의 부족입니다. 대부분의 예에서, 인간 CNS 세포주는 그들의 정상적인 생리적 거동20,21,22의 정확한 표현이 아닐 수 있는 형질전환된, 불멸화된 암 세포로부터 유래된다. 따라서, 조절된 방식으로 CNS 세포 표현형을 연구하기 위해서는 대안적인 방법이 필요하다. 또한, 신경교세포 집단의 다양성으로 인해 세포 자율 기능과 비자율 기능을 모두 요약하기 위해 공동 배양 조건뿐만 아니라 서로 독립적으로 각 하위 유형을 조사해야 합니다. 신경교 세포는 신경 세포 지원 23, 학습 /인지24,25 및 CNS 면역 반응26에 이르기까지 CNS에서 매우 다양한 중요한 기능을 가지고 있습니다. 따라서 생리적 및 병리학 적 맥락에서 각 신경교 하위 집단의 분자 및 세포 기능을 이해하는 것이 필요합니다. 이를 위해 우리는 생존 가능한 glia 아형의 추출 및 분리를위한 신뢰할 수있는 방법을 제공합니다. 인간 피험자 연구의 실용적이고 윤리적인 제약으로 인해 동물 모델은 현재 인간 신경교 세포 생물학에 가장 관련성이 높은 대용물입니다. 특히, 마우스는 건강과 질병의 기저에 있는 특정 분자 메커니즘을 추가로 해부하기 위해 게놈을 조작하고 분석할 수 있기 때문에 이상적인 모델 동물입니다. 따라서 쥐 미세아교세포, OPC 및 성상교세포의 성공적인 제거 및 분리는 생리적, 신경퇴행성 또는 신경염증 상태에서 신경교세포의 기능을 조사하는 핵심 도구입니다.
이 프로토콜은 CNS 세포 국소 이질성을 탐색하도록 최적화될 수 있다. glia가 형태와 기능면에서 지역적 이질성을 나타낸다는 것이 점점 더 분명 해지고 있습니다. 성상 세포는 지역적으로 다양하며 CNS27 내의 위치에 따라 뚜렷한 형태를 나타냅니다. 또한, 성상 세포의 밀도 및 그의 유사 분열 지수는 해부학 적 영역을 정의 할 수 있으며, 국소 성상 세포 이질성이 CNS28 내의 위치에 기초한 분자 및 기능적 차이를 반영 할 수 있다는 가설을 뒷받침한다. 소교세포 지역 이질성도 적극적으로 조사 중이지만 CNS 발달 또는 행동에서 미세아교세포 다양성의 기본 메커니즘과 기능적 결과는 현재 불분명합니다. 그러나, 성체 미세아교세포는 세포 수, 세포 및 세포하 구조, 및 분자 시그니처(29)에서 다양성을 나타내는 것으로 알려져 있다. 더욱이, 다중 질량 세포 분석의 최근 발전은 9 명의 인간 공여자의 5 개의 다른 CNS 영역으로부터의 세포 표현형을 분석하여 인간 미세 아교 세포30의 대규모 면역 표현형을 허용하면서 미세 아교 세포의 국소 이질성을 추가로 정의했다. 현재 이러한 접근법은 초기 단계에 있으며, 동물 연구는 CNS 질병 발달에서 지역 신경교 연구를 위한 실행 가능한 솔루션이 됩니다. 마지막으로, 지역 이질성은 최근 희소 돌기 아교 세포에서도 설명되었습니다. 청소년 및 성체 CNS의 10개 영역에서 5072개의 개별 세포에 대한 단일 세포 RNA 시퀀싱은 분화의 여러 단계에 걸쳐 13개의 별개의 하위 집단을 식별했습니다31. 중요하게도, 희소돌기아교세포가 OPC로부터 성숙함에 따라, 이들의 전사 프로파일이 갈라지고 이들의 기능적 표현형이 변화하여 CNS31 내의 희소돌기아교세포 이질성을 강조하는 것으로 밝혀졌다.
따라서, 다양한 이웃 뉴런 및 다른 신경교의 맥락에서 다양한 상주 CNS 세포의 지역적 이질성을 이해하는 것은 신경염증 및 신경퇴행성 장애를 치료하기 위한 새로운 치료법의 미래 개발을 위한 중요한 근거를 제공할 수 있다. 이 프로토콜은 신경교 하위 집단의 추출, 분리 및 식별에 중점을 두지만 기능 검사를 위한 편리한 출발점을 제공합니다. 또한 신경교 세포 생물학과 관련된 유전 메커니즘을 연구하기 위해 형질 전환 마우스 모델과 적응하고 결합 할 수 있습니다. 또한 공동 배양 분석에서 신경교 세포의 서로에 대한 반응을 검사하는 데 사용할 수 있습니다. 요약된 단계는 다양한 CNS 신경교 집단을 추출 및 분리하는 비용 효율적이고 처리량이 높은 방법을 나타내며, 이를 다양한 실험 매개변수에 적용할 수 있습니다. 주목해야한다. 그러나, 여기에 기술된 방법은 더 낮은 수준의 수초화 및 증식하는 신경교의 높은 밀도로 인해 신생아를 이용한다. 이러한 이유로 성인 동물에 비해 신생아에서 생존 가능한 신경교를 분리하는 것이 기술적으로 더 실현 가능합니다. 따라서 성인 아교세포와 비교한 신생아 신경교의 표현형 차이는 실험 설계 및 데이터 해석 중에 고려되어야 합니다.
공개
저자는 공개해야 할 이해 상충이 있습니다.
감사의 말
원고 편집과 토론을 해주신 Morgan Psenicka와 그림 서식 지정에 도움을 주신 Grahame Kidd 박사에게 감사드립니다. 이 작업은 NIAID K22 AI125466 (JLW)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin and 0.53 mM EDTA | Gibco | 25300054 | Tissue dissociation |
| 12-Well Plates | Greiner Bio-One | 665 180 | Cell culture plate |
| 1X PBS pH 7.4 | Gibco | 10010031 | Standard reagent |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 15714-S | Fixative |
| 50 mL, 25 cm2 cell culture flask | Greiner Bio-One | 690 175 | Cell culture (T25) flask |
| Antibiotic-Antimycotic 100X | Gibco | 15240-096 | Media component |
| B-27 Supplement 50X | Gibco | 17504-044 | Media component |
| Bovine serum albumin | Sigma | A9647-50G | Antibody diluent |
| Confocal Microscope | Zeiss | LSM 800 | Confocal for imaging |
| DAPI | ThermoFisher | D1306 | Nuclear stain |
| DMEM (1X), high glucose with Na pyruvate | Gibco | 11995040 | Media component |
| Dnase I | Sigma | 10104159001 | Tissue dissociation |
| Fetal bovine serum heat inactivated | Gibco | A3840001 | Media component |
| Fibronectin from bovine plasma | Sigma | F1141-1MG | Cell adherent |
| Fine stitch Scissors | Sklar | 64-3260 | Dissection tools |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A11008 | Secondary staining antibody |
| Goat anti-rat IgG Alexa Fluor 555 | Invitrogen | A21434 | Secondary staining antibody |
| Hanks' Balanced Salt Solution (w/o Ca or Mg) | ThermoFisher | 14170120 | Tissue dissociation |
| L-glutamine, 200mM | Gibco | 20530081 | Media component |
| Murine epidermal growth factor | ThermoFisher | PMG8044 | Media component |
| Murine IFN-γ | Peprotech | 315-05-20UG | Media component |
| Murine PDGF-AA | Peprotech | 315-17 | Media component |
| Neurobasal | Gibco | 21103-049 | Media component |
| Normal goat serum | Sigma | G9023 | Blocking solution component |
| Operating Scissors | Surgi-OR | 95-272 | Dissection tools |
| Poly-D-Lysine 12 mm #1 German Glass Coverslip | Corning Biocoatt | 354086 | Cell adherent |
| Prolong Gold Antifade Reagent | Cell Signaling Technology | 9071S | Mounting Media |
| Rabbit anti-Iba1 | Wako | 019-19741 | Primary antibody |
| Rabbit anti-NG2 Chondroitin Proteoglycan | Millipore | ab5320 | Primary antibody |
| Rat anti-GFAP | ThermoFisher | 13-0300 | Primary antibody |
| Rat anti-myelin basic protein | Abcam | ab7349 | Primary antibody |
| Sharp Tip Scissors | Surgi-OR | 95-104 | Dissection tools |
| Stereo Microscope | Leica | S4 E Stereo Zoom Microscope | Microscope for dissection |
| Tissue Forceps | Sklar | 66-7644 | Dissection tools |
| Triton X-100 | Fisher Bioreagents | BP151-100 | Cell permabilization |
| Trypsin Inhibitor (from chicken egg white) | Sigma | 10109878001 | Tissue dissociation |
참고문헌
- Fields, R. D., et al. Glial Biology in Learning and Cognition. The Neuroscientist. 20 (5), 426-431 (2014).
- Nuriya, M., Hirase, H. Involvement of astrocytes in neurovascular communication. Progress in Brain Research. 225, 41-62 (2016).
- Nave, K. A. Myelination and support of axonal integrity by glia. Nature. 468 (7321), 244-252 (2010).
- Wake, H., Moorhouse, A. J., Miyamoto, A., Nabekura, J. Microglia: actively surveying and shaping neuronal circuit structure and function. Trends in Neurosciences. 36 (4), 209-217 (2013).
- Kierdorf, K., Prinz, M. Microglia in steady state. The Journal of Clinical Investigation. 127 (9), 3201-3209 (2017).
- Hertz, L., Chen, Y. Importance of astrocytes for potassium ion (K(+)) homeostasis in brain and glial effects of K(+) and its transporters on learning. Neurosciences and Biobehavior Reviews. 71, 484-505 (2016).
- Gordon, G. R., Howarth, C., MacVicar, B. A. Bidirectional Control of Blood Flow by Astrocytes: A Role for Tissue Oxygen and Other Metabolic Factors. Advances in Experimental Medicine and Biology. 903, 209-219 (2016).
- Schneider, J., Karpf, J., Beckervordersandforth, R. Role of Astrocytes in the Neurogenic Niches. Methods Mol Biol. 1938, 19-33 (2019).
- Sharif, Y., et al. Blood brain barrier: A review of its anatomy and physiology in health and disease. Clinical Anatomy. 31 (6), 812-823 (2018).
- von Bernhardi, R., Eugenin-von Bernhardi, J., Flores, B., Eugenin Leon, J. Glial Cells and Integrity of the Nervous System. Advances in Experimental Medicine and Biology. 949, 1-24 (2016).
- Gordon, J., Amini, S., White, M. K. General overview of neuronal cell culture. Methods in Molecular Biology. 1078, 1-8 (2013).
- Spaethling, J. M., et al. Primary Cell Culture of Live Neurosurgically Resected Aged Adult Human Brain Cells and Single Cell Transcriptomics. Cell reports. 18 (3), 791-803 (2017).
- Bayraktar, O. A., Fuentealba, L. C., Alvarez-Buylla, A., Rowitch, D. H. Astrocyte development and heterogeneity. Cold Spring Harbor Perspectives in Biology. 7 (1), 020362 (2015).
- Liu, R., et al. Region-specific and stage-dependent regulation of Olig gene expression and oligodendrogenesis by Nkx6.1 homeodomain transcription factor. Development. 130 (25), 6221-6231 (2003).
- Tan, Y. L., Yuan, Y., Tian, L. Microglial regional heterogeneity and its role in the brain. Molecular Psychiatry. 25 (2), 351-367 (2020).
- Witting, A., Moller, T. Microglia cell culture: a primer for the novice. Methods in Molecular Biology. 758, 49-66 (2011).
- Williams, J. L., Patel, J. R., Daniels, B. P., Klein, R. S. Targeting CXCR7/ACKR3 as a therapeutic strategy to promote remyelination in the adult central nervous system. Journal of Experimental Medicine. 211 (5), 791-799 (2014).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Tanner, D. C., Cherry, J. D., Mayer-Proschel, M. Oligodendrocyte progenitors reversibly exit the cell cycle and give rise to astrocytes in response to interferon-gamma. Journal of Neuroscience. 31 (16), 6235-6246 (2011).
- Stansley, B., Post, J., Hensley, K. A comparative review of cell culture systems for the study of microglial biology in Alzheimer's disease. Journal of Neuroinflammation. 9 (1), 115 (2012).
- Spaethling, J. M., et al. Primary Cell Culture of Live Neurosurgically Resected Aged Adult Human Brain Cells and Single Cell Transcriptomics. Cell Reports. 18 (3), 791-803 (2017).
- Timmerman, R., Burm, S. M., Bajramovic, J. J. An Overview of in vitro Methods to Study Microglia. Frontiers in Cellular Neuroscience. 12 (242), (2018).
- Stevens, B. Glia: much more than the neuron's side-kick. Current Biology. 13 (12), 469-472 (2003).
- Fields, R. D., et al. Glial biology in learning and cognition. Neuroscientist. 20 (5), 426-431 (2014).
- Yamamuro, K., Kimoto, S., Rosen, K. M., Kishimoto, T., Makinodan, M. Potential primary roles of glial cells in the mechanisms of psychiatric disorders. Frontiers in Cellular Neuroscience. 9 (154), (2015).
- Hartenstein, V., Giangrande, A. Connecting the nervous and the immune systems in evolution. Communications Biology. 1 (1), 64 (2018).
- Emsley, J. G., Macklis, J. D. Astroglial heterogeneity closely reflects the neuronal-defined anatomy of the adult murine CNS. Neuron Glia Biology. 2 (3), 175-186 (2006).
- Chaboub, L. S., Deneen, B. Developmental Origins of Astrocyte Heterogeneity: The Final Frontier of CNS Development. Developmental Neuroscience. 34 (5), 379-388 (2012).
- Tan, Y. L., Yuan, Y., Tian, L. Microglial regional heterogeneity and its role in the brain. Molecular Psychiatry. 25 (2), 351-367 (2020).
- Bottcher, C., et al. Human microglia regional heterogeneity and phenotypes determined by multiplexed single-cell mass cytometry. Nature Neurosciences. 22 (1), 78-90 (2019).
- Marques, S., et al. Oligodendrocyte heterogeneity in the mouse juvenile and adult central nervous system. Science. 352 (6291), 1326-1329 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유