Method Article
Рассечение и выделение мышиной глии из нескольких областей центральной нервной системы
В этой статье
Резюме
Здесь мы представляем протокол выделения in vitro множественных популяций глиальных клеток из ЦНС мыши. Этот метод позволяет проводить сегрегацию регионарной микроглии, клеток-предшественников олигодендроцитов и астроцитов для изучения фенотипов каждого из них в различных культуральных системах.
Аннотация
Представленные здесь методы демонстрируют лабораторные процедуры рассечения четырех различных областей центральной нервной системы (ЦНС) у новорожденных мышей для выделения глиальных субпопуляций. Целью процедуры является диссоциация микроглии, клеток-предшественников олигодендроцитов (OPC) и астроцитов из кортикальной, мозжечковой, ствола мозга и спинного мозга для облегчения дальнейшего анализа in vitro. Процедуры изоляции области ЦНС позволяют определить региональную гетерогенность между глиями в системах множественных клеточных культур. Выполняется быстрая изоляция области ЦНС с последующим механическим удалением мозговых оболочек для предотвращения заражения менингеальных клеток глии. Этот протокол сочетает в себе мягкую диссоциацию тканей и покрытие на определенной матрице, предназначенной для сохранения целостности и приверженности клеток. Выделение смешанной глии из нескольких областей ЦНС обеспечивает всесторонний анализ потенциально гетерогенной глии при максимальном использовании отдельных экспериментальных животных. Кроме того, после диссоциации региональной ткани смешанная глия дополнительно разделяется на несколько типов клеток, включая микроглию, OPC и астроциты для использования в одном типе клеток, вставках пластин клеточных культур или системах кокультуры. В целом, продемонстрированные методы обеспечивают комплексный протокол широкого применения для тщательного рассечения четырех отдельных областей ЦНС у новорожденных мышей и включают методы выделения трех отдельных типов клеток глии для изучения региональной гетерогенности в любом количестве систем или анализов клеточных культур in vitro.
Введение
Глии необходимы для правильной функции нейронов в ЦНС. Они состоят из трех основных субпопуляций: астроцитов, олигодендроцитов и микроглий, каждая из которых играет свою, но незаменимую роль1. Без надлежащего разнообразия и активности глиальных клеток функция нейронов будет серьезно затронута, что приведет к нарушению ЦНС. Глия способна влиять на нейротрансмиссию, и каждый тип клеток делает это по-своему. Глиальные клетки в мозге обладают способностью общаться между собой, а также с нейронными клетками, чтобы облегчить правильную функцию ЦНС2. Олигодендроциты увеличивают скорость электрической передачи за счет формирования миелиновой оболочки, что облегчает кластеризацию ионных каналов в узлах Ранвье, местах генерации потенциала нейронного действия3. Микроглия имеет решающее значение для обрезки синапсов путем мониторинга синаптической передачи и «перенастройки» нейронных связей после травмы4. Кроме того, микроглии являются наиболее распространенной резидентной иммунной клеткой ЦНС, выступающей в качестве основной формы защиты хозяина от патогенов5. Астроциты могут регулировать синаптическую передачу между нейронами, изменяя концентрацию внеклеточного калия6. Они также играют роль в контроле местного кровотока7, высвобождении и поглощении нейромодулирующих элементов8 и играют ключевую роль в поддержании гематоэнцефалического барьера9. Таким образом, каждый глиальный подтип имеет решающее значение для функции ЦНС, так как дефекты любого типа уже давно связаны с широким спектром патологических состояний, включая психические заболевания, эпилепсию и нейродегенеративные состояния10.
Наибольшим препятствием в изучении патобиологии ЦНС является невозможность исследовать клетки человека в контексте их микроокружательной ниши. Биопсийная ткань человека в основном собирается посмертно, и клетки могут быть легко повреждены или потеряны во время экстракции и обработки. Кроме того, трудно поддерживать человеческие клетки живыми и жизнеспособными in vitro в течение любого периода времени, не получая увековеченных клеточных линий из опухолей, и в этот момент они больше не точно отражают свои нормальные физиологические свойства11,12. Кроме того, существует значительное количество региональной гетерогенности среди отдельных типов клеток глии 13,14,15, и получение региональных образцов ЦНС от отдельных пациентов практически невозможно. Таким образом, необходимо разработать альтернативные модели для изучения вклада регионарной глии в конкретные расстройства ЦНС.
Здесь мы описываем систему in vitro с использованием специфической для области ЦНС мыши изоляции нескольких глиальных субпопуляций, позволяющей манипулировать и количественно оценивать микроглию, клетки-предшественники олигодендроцитов (OPC), которые дают начало зрелым олигодендроцитам и астроцитам. Каждая популяция может быть независимо выделена и подвергнута широкому спектру экспериментальных методов, включая медикаментозное или молекулярное лечение, иммуноцитохимию, экстракцию и анализ белка / РНК и другие системы кокультуры в зависимости от экспериментальной необходимости. Кроме того, этот метод изоляции дает большое количество клеток, что позволяет характеризовать и исследовать каждую глиальную популяцию с высокой пропускной способностью. Это также позволяет изучать дифференцировку, рост и пролиферацию клеток ЦНС в ответ на широкий спектр микроокружающих стимулов контролируемым образом, чтобы избежать смешивания факторов, которые обычно присутствуют в условиях in vivo. Наконец, этот метод изоляции клеток облегчает манипулирование популяциями глиальных клеток в разных областях ЦНС, чтобы исследовать, как региональная глия взаимодействует друг с другом и реагирует на различные стимулы, обеспечивая точность и воспроизводимость.
протокол
ПРИМЕЧАНИЕ: Все исследования на животных были санкционированы и одобрены Кливлендской клиникой Научно-исследовательского института Лернера Институциональным комитетом по уходу за животными и их использованию.
1. Подготовьте носители и материалы для вскрытия
ПРИМЕЧАНИЕ: Все рецепты буферов и носителей приведены в таблице 1. Эта процедура проводится в стерильных условиях в культуре тканей, обозначенной как кабинет биобезопасности.
- Готовят и стерильно фильтруют смешанные глиевые среды (МГМ). Это можно сделать накануне и хранить при 4 °C.
- Разбавляют фибронектин в концентрации 1:100 стерильнымH2O. Объем разбавленного фибронектина будет зависеть от количества детенышей и области ЦНС, используемой для эксперимента. Используйте одну колбу T25 для 1 коры, одну колбу T25 для 2-4 мозжечковых, одну колбу T25 для 2-4 стволов головного мозга и одну колбу T25 для 2-4 спинных мозгов.
ПРИМЕЧАНИЕ: Объединение тканей из одной и той же области с использованием критериев, перечисленных выше, позволит адекватную диссоциацию без изменения протокола, описанного ниже. Объединение большего количества тканей, чем описано на этапе 1.2, потребует дальнейшей оптимизации концентраций реагентов диссоциации. - Пипетка 3 мл разбавленного фибронектина в колбы Т25 при комнатной температуре и дать постоять 2 мин.
- Аспирируйте фибронектин и дайте колбам высохнуть на ночь с ослабленной крышкой колбы.
2. Рассечение коры, мозжечка, ствола мозга и спинного мозга
ПРИМЕЧАНИЕ: Эта процедура может быть выполнена на столешнице и требует рассечения. Используйте строгую асептическую технику на всех этапах процедуры и минимизируйте воздействие тканей на воздух в помещении. Держите все среды охлажденными на льду во время рассечения, чтобы обеспечить максимальное сохранение тканей. В качестве альтернативы, эта процедура может быть выполнена в капюшоне, который позволяет использовать внутреннюю область рассечения.
- Протрите все участки 70% этанолом.
- Пипетка 10 мл раствора PBS/антибиотика (PAS) в чашку Петри размером 10 см. Приготовьте одну чашку Петри для каждого щенка, который будет рассечен. Положите на лед, чтобы раствор оставался охлажденным.
- В продезинфицированном вытяжке для культивирования тканей пипетка 9 мл DMEM (без добавок) в 4 отдельные конические трубки по 15 мл, по одной для каждой области ЦНС, заменяют колпачки трубок и кладут на лед. Поместите ведро со льдом с трубками на расстоянии досягаемости от прицела рассечения.
- Поместите 10 см чашку Петри, приготовленную на шаге 2.2, на продезинфицированную стадию рассечения.
- Обезболить и усыпить щенка мыши по институциональному протоколу и удалить голову путем быстрого обезглавливания острыми ножницами.
ПРИМЕЧАНИЕ: Послеродовой день (P) используется 3-5 детенышей. Пожилые детеныши имеют более развитую ЦНС и могут не быть адекватным источником расширяющихся глиальных клеток. Молодые детеныши (P) 0-2 могут давать большее количество глии и могут быть использованы; однако ткань спинного мозга очень трудно рассечено в этом молодом возрасте из-за размера. - Очистите кожу щенка, используя 70% этанола.
- Используя мелкие ножницы, разрезайте кожный слой вдоль средней линии головы животного, начиная с каудально и двигая ростраль, пока не достигнет морды. Избегайте глубокого разрезания черепа, чтобы избежать повреждения тканей.
- Опустив голову вниз, потяните кожный слой к каждой стороне черепа и с помощью пружинных ножниц сделайте разрез вдоль средней линии черепа, начиная с отверстия magnum, снова разрезая каудальное на ростральное.
- С помощью щипцов с тонкими наконечниками потяните половинки черепа в правую и левую стороны, обнажив кору, мозжечок и ствол мозга.
- После обнажения осторожно поднимите мозг из черепа в чашку Петри размером 10 см, приготовленную на шаге 2.2. Убедитесь, что мозг остается неповрежденным, чтобы сохранить анатомическую структуру, с прикрепленным задним мозгом.
- Используя тонкие, изогнутые щипцы с точкой щипцов, обращенной вверх, отщипните мозжечок. Удалить мозговые оболочки и поместить в специальную коническую трубку объемом 15 мл в ведро со льдом.
- Убедитесь, что ствол мозга непосредственно вентральный к мозжечку и виден после удаления мозжечка. Удалите его с помощью мелкоконечных щипцов, удалите мозговые оболочки и поместите в специальную коническую трубку объемом 15 мл в ведро со льдом.
- Отделите средний мозг от коры, удалите кортикальные мозговые оболочки и поместите в назначенную коническую трубку объемом 15 мл в ведро со льдом.
- Чтобы удалить спинной мозг, поместите обезглавленного щенка мыши в лежачее положение (лежа лицом вверх) с отрезанным позвоночным столбом, приподнятым к исследователю.
- Снова опрыскивайте 70% этанолом.
- Разрезать по боковым сторонам позвоночного столба, в ростральном и каудальном направлении, через грудную клетку до достижения задних конечностей. Во время разреза отталкивания внутренних органов до тех пор, пока не будет виден позвоночный столб.
- Обрежьте вдоль каждой боковой стороны позвоночного столба до его изоляции и поместите в чашку Петри размером 10 см, приготовленную на шаге 2.2.
- Вентральной стороной вверх, используя тонкие пружинные ножницы, чередуйте разрезание правой и левой сторон каждого позвонка до достижения поясничной области, чтобы обнажить ткань спинного мозга.
- Аккуратно удалите спинной мозг и мозговые оболочки тонкими щипцами под рассекающим микроскопом. Поместите в специальную коническую трубку объемом 15 мл в ведро со льдом.
- Повторите шаги 2.5.-2.19 для каждого щенка, объединив ткань из одной области в соответствии с критериями, изложенными в шаге 1.2 для каждой подготовленной колбы T25.
ПРИМЕЧАНИЕ: Удалите мозговые оболочки как можно полнее. Если останется значительное количество мозговых оболочек, фибробластоподобный фенотип менингеальных клеток перерастет и переполнит культуру клеток. Несколько спинных мозгов, равных фенотипов, могут быть объединены для создания специфической клеточной культуры. Позаботьтесь о том, чтобы не произошло переполненности клеток, что может привести к глиальному апоптозу и дифференциальным фенотипам.
3. Диссоциация тканей
ПРИМЕЧАНИЕ: Все следующие процедуры проводятся в стерильной культуре тканей, обозначенной кабинетом биобезопасности, с использованием асептической техники и стерильных материалов.
- Добавьте 1 мл 0,05% трипсина, содержащего 0,53 мМ ЭДТА, к каждой конической трубке 9 мл ДМЭМ и ткани для начала лизиса тканей.
ПРИМЕЧАНИЕ: DMEM содержит большое количество хлорида кальция, который может действовать как ингибитор трипсина. Если диссоциация не завершена после описанных шагов, можно использовать сбалансированный солевой раствор Хэнкса без кальция или магния. После трипсинизации фермент можно нейтрализовать добавлением ингибитора трипсина, хотя кальций следует добавлять обратно в раствор, так как он является кофактором для ДНКазы I, которая используется на последующих этапах. - Тритурат с пипеткой 10 мл примерно 20x.
- Переложите клеточные суспензии в пустые конические трубки объемом 50 мл.
- Инкубируют раствор при 37 °C, 5% CO2 в течение 15 мин, осторожно перемешивая лизаты через 8 мин.
- Добавьте 5 мл МГМ и 200 мкл (5 мг/мл) ДНКазы I в каждую пробирку для окончательной концентрации 50 мкг/мл.
- Тритурируйте каждый лизат с помощью пипетки 10 мл 10x.
- Дайте клеточным суспензиям постоять в течение 3 минут при комнатной температуре, чтобы недиссоциированная ткань осела на дне трубок.
- Переведите клеточные суспензии в новые конические трубки объемом 50 мл, оставив после себя недиссоциированную ткань.
ПРИМЕЧАНИЕ: Этапы лизиса и тритурации, описанные выше, значительно ограничивают количество недиссоциированной ткани. - Центрифугируйте трубки при 300 х г в течение 3 мин при 4 °C без тормоза.
- Аспирировать супернатант и повторно суспендировать оставшиеся клеточные гранулы в 5 мл МГМ.
- Тритурируйте гранулы пипеткой 5 мл 20x.
- Нанесите суспензии 5 мл на колбы T25 с покрытием.
- Инкубируют клетки при 37 °C, 5% CO2 и изменяют среду первоначально через 24 ч для удаления клеточного мусора.
ПРИМЕЧАНИЕ: Некоторые протоколы рекомендуют первоначальную смену носителя через 72 ч. Может потребоваться оптимизация этого шага. - Выполняйте 100% изменение среды с помощью MGM каждые 48-72 ч, пока клетки не станут 80% сливающимися (примерно 5-7 дней).
ПРИМЕЧАНИЕ: Все носители должны быть нагреты до 37 °C перед заменой среды.
4. Выделение микроглии
- Как только смешанные культуры глии достигнут 80% сливания, подготовьте колбы для встряхивания, затянув крышки и запечатав парафиновой пленкой.
- Чтобы удалить микроглию из смешанных глиальных культур, закрепите колбы горизонтально на орбитальном шейкере внутри инкубатора с температурой 37 °C. Встряхните колбы по 15 х г в течение 1 ч.
- Извлеките среду и пипетку в коническую трубку объемом 15 мл. Промыть колбы дважды 3 мл теплой МГМ, добавив промывку в конические трубки объемом 15 мл. Это микроглия.
- Добавьте 5 мл теплого, свежего МГМ в колбы для культивирования.
- Запечатывайте колбы с парафиновой пленкой, закрепляйте колбы горизонтально на шейкере и встряхивайте при 15 г при 37 °C в течение 15 ч для отделения OPC от астроцитов.
ПРИМЕЧАНИЕ: Этот шаг может быть выполнен в течение ночи, но время встряхивания 15 часов имеет решающее значение, так как избыточное время может привести к гибели клеток. - Центрифугирование супернатанта с шага 4.3. при 300 х г в течение 3 мин и культивирование микроглии по стандартным протоколам16 или использование для биологического анализа.
5. Выделение клеток-предшественников олигодендроцитов
ПРИМЕЧАНИЕ: При нанесении ОПС после первоначальной изоляции они должны быть покрыты поверхностью с поли-D-лизином (стерильная пластина или крышка). Подготовьте эти материалы до завершения работы над этим разделом.
- После 15 ч встряхните супернатант из колб и тарелки на стерильной 100 мм чашке Петри.
- Инкубируют супернатант при 37 °C, 5% CO2 в течение 30 мин, закручиваясь через 15 мин, чтобы удалить оставшуюся микроглию, так как они очень быстро прилипнут к блюду. Для этого этапа могут быть использованы чашки Петри, обработанные нетканевыми культурами.
- Удалите неадгезивный супернатант клеток, подсчитайте и пластину на поверхности с поли-D-лизином. Как правило, 7 500-10 000 OPC покрыты /см2.
- Инкубируйте при 37 °C, 5% CO2 в течение не менее 1 ч (до 6 ч), затем осторожно аспирируйте 95% среды и медленно добавляйте теплые OPC-среды, пипетируя среду о стенку скважины, чтобы свести к минимуму разрушение OPC. Меняйте носитель каждые 48 часов, пока ячейки не будут готовы к использованию.
ПРИМЕЧАНИЕ: Очень важно, чтобы за один раз менялся только один колодец. OPC чувствительны и особенно нетерпимы к сухим условиям. Добавление PDGF-AA в среды OPC задерживает созревание OPC в олигодендроциты. Этот фактор может быть исключен из культуральной среды, если в экспериментальном очаге находятся зрелые олигодендроциты.
6. Выделение астроцитов
- После 15 ч встряхните супернатант и промойте колбы 2x с теплым 1x PBS.
- Добавьте 4 мл 0,05% трипсина, содержащего 0,53 мМ ЭДТА, и инкубируйте при 37 °C, 5% CO2 в течение 5 мин или до тех пор, пока клетки не поднимутся. Чтобы убедиться, что астроциты поднялись, визуализируйте их с помощью стандартного широкоугольного микроскопа. Астроциты будут казаться сферическими после трипсинизации.
- После того, как астроциты отделились, встаньте на колбу вертикально и добавьте 4 мл МГМ. Тритурировать для смешивания.
- Пипетки астроцитов в коническую трубку объемом 15 мл, центрифугу при 300 х г в течение 5 мин.
- Ресуспендирование астроцитов в астроцитарных средах и пластинах на поверхности, покрытой фибронектином, как описано на этапе 1.2. или использовать для биологического анализа.
ПРИМЕЧАНИЕ: 20 нг / мл мышиного фактора роста фибробластов могут быть добавлены во время первого изменения среды, чтобы помочь создать культуру астроцитов. Кроме того, стандартное желатиновое покрытие может быть недорогой альтернативой фибронектину.
7. Идентификация и выделение микроглии, ОПЦ, астроцитов и зрелых олигодендроцитов с помощью иммуноцитохимии
- Как только покрытые клетки достигнут соответствующего слияния, осторожно удалите среду и зафиксируйте адгезивные клетки с использованием 4% параформальдегида (PFA) в течение 10 минут. Сделайте этот шаг в шкафу биобезопасности.
ПРИМЕЧАНИЕ: При аспирации или добавлении растворов пипетка с мягким давлением предотвращает отслоение клеток. - Медленно аспирировать PFA, затем промыть клетки 3x с 1x PBS в течение 5 мин.
- Готовят соответствующий блокирующий раствор, используя 10% сыворотку и 0,1% Тритон Х-100 в 1x PBS.
ПРИМЕЧАНИЕ: Источник сыворотки отражает животное-хозяина, у которого было выращено вторичное антитело. Например, если вторичным антителом является козий анти-кролик, подходящей блокирующей сывороткой является нормальная козья сыворотка. Аналогичным образом, если вторичным антителом является ослиный анти-кролик, блокирующей сывороткой должна быть нормальная ослиная сыворотка. - Добавьте блокирующий раствор до тех пор, пока клетки не будут полностью покрыты. Блок на 1 ч при комнатной температуре.
- Готовят раствор разбавителя антител (9 мл 1x PBS, 0,01 г бычьего сывороточного альбумина, 30 мкл Triton X-100). Альтернативно, антитела могут быть разбавлены в блокирующем растворе, описанном на этапе 6.3.
- Разбавляют первичные антитела, специфичные для следующего в разбавителе антител или блокирующем растворе:
- Микроглия: ионизированная молекула-адаптер кальция 1 (Iba1) в разведении 1:250 (2,4 мкг/мл).
- OPCs: нейронный/глиальный антиген 2 (NG2) в разведении 1:200 (5 мкг/мл).
- Зрелые олигодендроциты: основной белок миелина (MBP) в разведении 1:400 (концентрация зависит от партии и может потребоваться оптимизация).
- Астроциты: глиальный фибриллярный кислый белок (GFAP) в разведении 1:400 (0,25 мкг/мл)17.
ПРИМЕЧАНИЕ: Не смешивайте первичные антитела, выращенные у одного вида.
ПРИМЕЧАНИЕ: GFAP будет надежно маркировать астроциты белого вещества. Для астроцитов серого вещества может потребоваться альтернативный маркер.
- Инкубировать первичное антитело на ночь при 4 °C (при мягком перемешивании предпочтительнее).
- Промывайте 3x с 1x PBS в течение 5 мин, чтобы удалить первичное антитело.
- Инкубировать клетки с соответствующими вторичными антителами при разведении 1:400 в разбавителе антител или блокирующем растворе, защищенном от света.
ПРИМЕЧАНИЕ: Вторичные антитела конъюгируются с флуорофором, который может быть заменен в зависимости от доступных параметров микроскопа. После того, как флуоресцентные вторичные антитела были применены, защитите от света как можно больше. - Инкубируют вторичные антитела в течение 1 ч при комнатной температуре, ограничивая воздействие света.
- Промыть 3 раза с 1x PBS в течение 5 мин, чтобы удалить избыток вторичных антител.
- Чтобы маркировать ядра, используйте раствор DAPI/PBS 1:1000 и инкубируйте клетки в течение 5 минут при комнатной температуре в темноте.
- Мойте 3x с 1x PBS в течение 5 минут в темноте.
- Для монтажа нанесите монтажный носитель и дайте высохнуть в темноте перед съемкой.
ПРИМЕЧАНИЕ: Смонтированные слайды можно хранить при комнатной температуре в течение 2-3 дней. Для длительного хранения переместите слайды до 4 °C. Изображение в течение одной недели для максимального сигнала. Все репрезентативные изображения были получены на конфокальный микроскоп; однако также рекомендуются инвертированные флуоресцентные микроскопы.
Результаты
Репрезентативные данные, показанные ниже, иллюстрируют, что передача сигналов IFNγ влияет на дифференциацию и созревание OPC. Без присутствия рецептора IFNγ (IFNγR) корковые OPC не дифференцируются в зрелые миелинизирующие олигодендроциты так же легко, о чем свидетельствует отсутствие окрашивания MBP (рисунок 1). Поскольку олигодендроциты и астроциты получены от общего прародителя, мы проанализировали экспрессию GFAP, которая маркирует астроциты. Мы обнаружили, что IFNγR-дефицитные клетки сильно экспрессируют GFAP, предполагая, что они могут принимать астроцитарный фенотип, подтверждая более ранние сообщения19.
Дополнительные доказательства региональной гетерогенности в клетках ЦНС подтверждаются различной морфологией астроцитов, наблюдаемой в астроцитах коры, мозжечка, ствола мозга и спинного мозга (рисунок 2). Следует отметить, что астроциты из той же области могут также проявлять морфологическую гетерогенность, подтверждая представление о том, что этот глиальный подтип очень динамичен. Различия в клеточной архитектуре наводят на мысль о функциональном разнообразии, и, таким образом, способность изолировать глиальные популяции необходима для изучения фенотипических реакций при отсутствии и наличии микроокружных стимулов.
Олигодендроциты имеют решающее значение для миелинизации нейронных аксонов и необходимы для правильного восстановления и функционирования ЦНС. OPC порождают своих зрелых коллег, что делает критически важным понимание биологии, стоящей за их способностью дифференцироваться. Передача сигналов цитокинов значительно влияет на поведение стволовых и иммунных клеток. Таким образом, важно понять, как региональные реакции ОПК могут варьироваться на дифференциальную стимуляцию цитокинов (рисунок 3), что может повлиять на их способность дифференцироваться в зрелые миелинизирующие олигодендроциты.
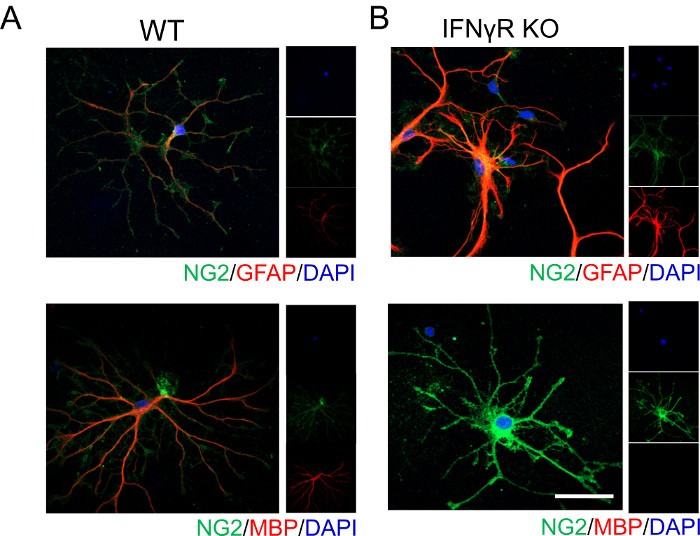
Рисунок 1: Репрезентативные данные, показывающие дифференциацию OPC у мышей WT и IFNγR-/- в присутствии экзогенного IFNγ. Кортикальные OPC были выделены из (A) WT и (B) IFNγR-/- P4 мышиных детенышей в соответствии с процедурой, описанной выше. Клетки обрабатывали 1 нг/мл IFNγ в течение 48 ч, затем фиксировали и окрашивали для очерчивания дифференцировки клеток. OPC были помечены для NG2 и GFAP для идентификации тех, кто принимал астроцитарный фенотип. Аналогичным образом, OPC также были помечены для NG2 и MBP для идентификации тех, которые дифференцировались в зрелые олигодендроциты. Шкала = 20 мкМ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
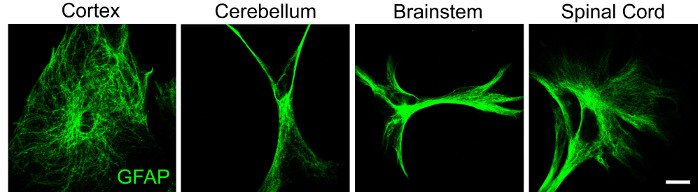
Рисунок 2: Репрезентативные данные, демонстрирующие региональную гетерогенность в морфологии астроцитов. Астроциты из коры, мозжечка, ствола мозга и спинного мозга были выделены из щенков мыши P4 с использованием протокола, описанного выше, и помечены для GFAP (зеленый) иммуноцитохимией после 48 ч в культуре. Шкала = 20 мкМ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
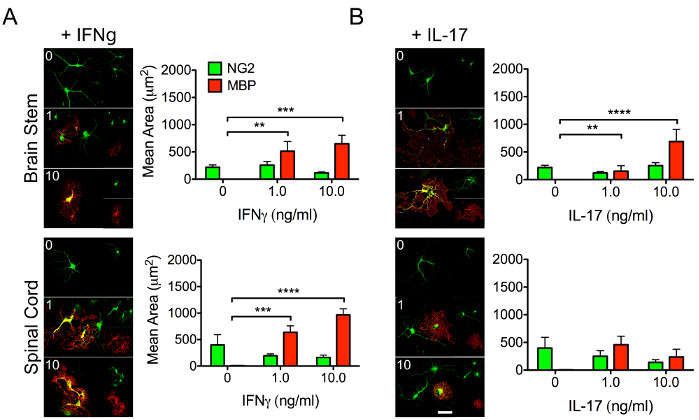
Рисунок 3: Репрезентативные данные, демонстрирующие дифференциальные реакции региональных OPC на цитокины. OPC были выделены из ствола мозга и спинного мозга щенков мыши P4 с использованием протокола, описанного выше. Клетки обрабатывали повышенными концентрациями (1-10 нг/мл) (А) ИФНγ или (В) интерлейкина (IL)-17 с целью исследования дифференциального влияния цитокина на способность региональных ОПК дифференцироваться в миелинирующие олигодендроциты. После 48-часовой инкубации с указанными цитокинами OPC были зафиксированы и помечены для NG2 (зеленый) и MBP (красный). Шкала = 20 мкМ. Представление данных означает ± SEM. **, p < 0,01; , p < 0,001; , p < 0,0001 2-полосным ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| PBS/Раствор антибиотика (PAS): | ||
| 1,0 мл | 100X антибиотик / антимикотический, содержащий 10 000 единиц / мл пенициллина и 10 000 мг / мл стрептомицина | |
| 25 мг/мл | Амфотерицин B | |
| 99 мл | 1X PBS | |
| Смешанная Глия Медиа (MGM) | ||
| 88 мл | 1X DMEM (высокий уровень глюкозы, с L-глютамином, с пируватом Na) | |
| 10 мл | Термоинактивированный FBS | |
| 1,0 мл | L-глютамин (100X) | |
| 1,0 мл | Антибиотик/Антимикотический | |
| OPC Медиа (50 мл) | ||
| 49 мл | Нейробазальные среды | |
| 1,0 мл | Добавка B27 (50X) | |
| 10 нг/мл | ППГФ-АА | |
| ПРИМЕЧАНИЕ: PDGF-AA добавляется свежим перед каждым изменением носителя. | ||
| Среда астроцитов (1 л) | ||
| 764 мл | MEM с солями Эрла, содержащими глютамин | |
| 36 мл | Глюкоза (используйте запас 100 мг/мл для окончательного концентрирования 20 мМ) | |
| 100 мл | Термоинактивированный FBS | |
| 100 мл | Термоинактивированная конская сыворотка | |
| 10 мл | Глютамин (используйте запас 200 мМ, если он не включен в стоковую среду) | |
| ДОПОЛНИТЕЛЬНО: 10 нг/мл рекомбинантного эпидермального фактора роста мыши | ||
| ПРИМЕЧАНИЕ: Стерильная фильтрация всех сред и хранение при температуре 4°C до использования. | ||
Таблица 1: Буферные и мультимедийные рецепты.
Обсуждение
В этом протоколе мы описываем выделение трех основных субпопуляций глиальных клеток из ЦНС мыши: микроглии, OPC и астроцитов. Основным препятствием для исследования нейродегенеративных и нейровоспалительных заболеваний ЦНС является отсутствие первичных клеток и тканей человека, особенно тех, которые являются региональными и от одного и того же пациента. В большинстве случаев клеточные линии ЦНС человека получены из трансформированных, увековеченных раковых клеток, которые могут не быть точными представлениями об их нормальном физиологическом поведении 20,21,22. Таким образом, альтернативные методы необходимы для контролируемого изучения фенотипов клеток ЦНС. Кроме того, разнообразие неврологических популяций глиальных клеток делает необходимым исследовать каждый подтип как независимо друг от друга, так и в условиях кокультуры, чтобы повторить как их клеточные автономные, так и неавтономные функции. Глиальные клетки имеют широкий спектр критических функций в ЦНС, начиная от нейронной поддержки23, обучения / познания 24,25 и иммунологических ответов ЦНС26. Таким образом, необходимо понимать молекулярные и клеточные функции каждой глиальной субпопуляции в физиологическом и патологическом контексте. Для этого мы предоставляем здесь надежный метод экстракции и выделения жизнеспособных подтипов глии. Из-за практических и этических ограничений в исследованиях человека, животные модели в настоящее время являются наиболее актуальными суррогатами биологии глиальных клеток человека. В частности, мыши являются идеальными модельными животными, поскольку их геномом можно манипулировать и анализировать для дальнейшего анализа определенных молекулярных механизмов, лежащих в основе здоровья и болезней. Таким образом, успешное удаление и разделение мышиной микроглии, OPC и астроцитов является ключевым инструментом для исследования функций глии во время физиологических, нейродегенеративных или нейровоспалительных состояний.
Этот протокол может быть оптимизирован для изучения региональной гетерогенности клеток ЦНС. Становится все более очевидным, что глия проявляет региональную неоднородность по форме и функциям. Астроциты регионально разнообразны и демонстрируют различную морфологию в зависимости от их расположения в ЦНС27. Кроме того, плотность астроцитов и их митотический индекс могут определять анатомические области, поддерживая гипотезу о том, что региональная гетерогенность астроцитов может отражать молекулярные и функциональные различия, основанные на их расположении в ЦНС28. Микроглиальная региональная гетерогенность также активно исследуется, хотя основные механизмы и функциональные последствия разнообразия микроглии в развитии или поведении ЦНС в настоящее время неясны. Однако известно, что взрослые микроглии демонстрируют разнообразие в клеточном количестве, клеточных и субклеточных структурах и молекулярных сигнатурах29. Кроме того, последние достижения в мультиплексированной массовой цитометрии дополнительно определили региональную гетерогенность микроглии, проанализировав клеточный фенотип из пяти различных областей ЦНС девяти доноров человека, что позволило провести крупномасштабное иммунофенотипирование микроглии человека30. В настоящее время такие подходы находятся в зачаточной стадии, что делает исследования на животных жизнеспособным решением для изучения регионарной глии в развитии заболеваний ЦНС. Наконец, региональная гетерогенность также недавно была описана в олигодендроцитах. Секвенирование одноклеточной РНК на 5072 отдельных клетках из 10 областей ювенильной и взрослой ЦНС выявило 13 различных субпопуляций на разных стадиях дифференцировки31. Важно отметить, что также было обнаружено, что по мере созревания олигодендроцитов из OPC их транскрипционные профили расходились, а их функциональные фенотипы изменялись, подчеркивая гетерогенность олигодендроцитов в ЦНС31.
Таким образом, понимание региональной гетерогенности различных резидентных клеток ЦНС в контексте их разнообразных соседних нейронов и других глий может обеспечить важное обоснование для будущей разработки новых методов лечения нейровоспалительных и нейродегенеративных расстройств. Хотя этот протокол фокусируется на извлечении, изоляции и идентификации глиальных субпопуляций, он обеспечивает удобную отправную точку для изучения их функции. Кроме того, он может быть адаптирован и объединен с трансгенными моделями мышей для изучения генетических механизмов, связанных с биологией глиальных клеток. Он также может быть использован для изучения реакций глиальных клеток друг на друга в анализах совместной культуры. Описанные этапы представляют собой экономически эффективный и высокопроизводительный метод извлечения и выделения различных глиальных популяций ЦНС, который затем может быть адаптирован к широкому спектру экспериментальных параметров. Следует отметить, что; однако, что метод, описанный здесь, использует новорожденных из-за более низких уровней миелинизации и высокой плотности размножающейся глии. По этим причинам технически более целесообразно изолировать жизнеспособную глию от новорожденных по сравнению со взрослыми животными. Таким образом, фенотипические различия в неонатальной глии по сравнению со взрослой глией должны учитываться при экспериментальном проектировании и интерпретации данных.
Раскрытие информации
У авторов есть конфликт интересов для раскрытия.
Благодарности
Мы благодарим Моргана Псеницку за редактирование и обсуждение рукописи и доктора Грэма Кидда за помощь в форматировании рисунков. Эта работа была поддержана NIAID K22 AI125466 (JLW).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin and 0.53 mM EDTA | Gibco | 25300054 | Tissue dissociation |
| 12-Well Plates | Greiner Bio-One | 665 180 | Cell culture plate |
| 1X PBS pH 7.4 | Gibco | 10010031 | Standard reagent |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 15714-S | Fixative |
| 50 mL, 25 cm2 cell culture flask | Greiner Bio-One | 690 175 | Cell culture (T25) flask |
| Antibiotic-Antimycotic 100X | Gibco | 15240-096 | Media component |
| B-27 Supplement 50X | Gibco | 17504-044 | Media component |
| Bovine serum albumin | Sigma | A9647-50G | Antibody diluent |
| Confocal Microscope | Zeiss | LSM 800 | Confocal for imaging |
| DAPI | ThermoFisher | D1306 | Nuclear stain |
| DMEM (1X), high glucose with Na pyruvate | Gibco | 11995040 | Media component |
| Dnase I | Sigma | 10104159001 | Tissue dissociation |
| Fetal bovine serum heat inactivated | Gibco | A3840001 | Media component |
| Fibronectin from bovine plasma | Sigma | F1141-1MG | Cell adherent |
| Fine stitch Scissors | Sklar | 64-3260 | Dissection tools |
| Goat anti-rabbit IgG Alexa Fluor 488 | Invitrogen | A11008 | Secondary staining antibody |
| Goat anti-rat IgG Alexa Fluor 555 | Invitrogen | A21434 | Secondary staining antibody |
| Hanks' Balanced Salt Solution (w/o Ca or Mg) | ThermoFisher | 14170120 | Tissue dissociation |
| L-glutamine, 200mM | Gibco | 20530081 | Media component |
| Murine epidermal growth factor | ThermoFisher | PMG8044 | Media component |
| Murine IFN-γ | Peprotech | 315-05-20UG | Media component |
| Murine PDGF-AA | Peprotech | 315-17 | Media component |
| Neurobasal | Gibco | 21103-049 | Media component |
| Normal goat serum | Sigma | G9023 | Blocking solution component |
| Operating Scissors | Surgi-OR | 95-272 | Dissection tools |
| Poly-D-Lysine 12 mm #1 German Glass Coverslip | Corning Biocoatt | 354086 | Cell adherent |
| Prolong Gold Antifade Reagent | Cell Signaling Technology | 9071S | Mounting Media |
| Rabbit anti-Iba1 | Wako | 019-19741 | Primary antibody |
| Rabbit anti-NG2 Chondroitin Proteoglycan | Millipore | ab5320 | Primary antibody |
| Rat anti-GFAP | ThermoFisher | 13-0300 | Primary antibody |
| Rat anti-myelin basic protein | Abcam | ab7349 | Primary antibody |
| Sharp Tip Scissors | Surgi-OR | 95-104 | Dissection tools |
| Stereo Microscope | Leica | S4 E Stereo Zoom Microscope | Microscope for dissection |
| Tissue Forceps | Sklar | 66-7644 | Dissection tools |
| Triton X-100 | Fisher Bioreagents | BP151-100 | Cell permabilization |
| Trypsin Inhibitor (from chicken egg white) | Sigma | 10109878001 | Tissue dissociation |
Ссылки
- Fields, R. D., et al. Glial Biology in Learning and Cognition. The Neuroscientist. 20 (5), 426-431 (2014).
- Nuriya, M., Hirase, H. Involvement of astrocytes in neurovascular communication. Progress in Brain Research. 225, 41-62 (2016).
- Nave, K. A. Myelination and support of axonal integrity by glia. Nature. 468 (7321), 244-252 (2010).
- Wake, H., Moorhouse, A. J., Miyamoto, A., Nabekura, J. Microglia: actively surveying and shaping neuronal circuit structure and function. Trends in Neurosciences. 36 (4), 209-217 (2013).
- Kierdorf, K., Prinz, M. Microglia in steady state. The Journal of Clinical Investigation. 127 (9), 3201-3209 (2017).
- Hertz, L., Chen, Y. Importance of astrocytes for potassium ion (K(+)) homeostasis in brain and glial effects of K(+) and its transporters on learning. Neurosciences and Biobehavior Reviews. 71, 484-505 (2016).
- Gordon, G. R., Howarth, C., MacVicar, B. A. Bidirectional Control of Blood Flow by Astrocytes: A Role for Tissue Oxygen and Other Metabolic Factors. Advances in Experimental Medicine and Biology. 903, 209-219 (2016).
- Schneider, J., Karpf, J., Beckervordersandforth, R. Role of Astrocytes in the Neurogenic Niches. Methods Mol Biol. 1938, 19-33 (2019).
- Sharif, Y., et al. Blood brain barrier: A review of its anatomy and physiology in health and disease. Clinical Anatomy. 31 (6), 812-823 (2018).
- von Bernhardi, R., Eugenin-von Bernhardi, J., Flores, B., Eugenin Leon, J. Glial Cells and Integrity of the Nervous System. Advances in Experimental Medicine and Biology. 949, 1-24 (2016).
- Gordon, J., Amini, S., White, M. K. General overview of neuronal cell culture. Methods in Molecular Biology. 1078, 1-8 (2013).
- Spaethling, J. M., et al. Primary Cell Culture of Live Neurosurgically Resected Aged Adult Human Brain Cells and Single Cell Transcriptomics. Cell reports. 18 (3), 791-803 (2017).
- Bayraktar, O. A., Fuentealba, L. C., Alvarez-Buylla, A., Rowitch, D. H. Astrocyte development and heterogeneity. Cold Spring Harbor Perspectives in Biology. 7 (1), 020362 (2015).
- Liu, R., et al. Region-specific and stage-dependent regulation of Olig gene expression and oligodendrogenesis by Nkx6.1 homeodomain transcription factor. Development. 130 (25), 6221-6231 (2003).
- Tan, Y. L., Yuan, Y., Tian, L. Microglial regional heterogeneity and its role in the brain. Molecular Psychiatry. 25 (2), 351-367 (2020).
- Witting, A., Moller, T. Microglia cell culture: a primer for the novice. Methods in Molecular Biology. 758, 49-66 (2011).
- Williams, J. L., Patel, J. R., Daniels, B. P., Klein, R. S. Targeting CXCR7/ACKR3 as a therapeutic strategy to promote remyelination in the adult central nervous system. Journal of Experimental Medicine. 211 (5), 791-799 (2014).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Tanner, D. C., Cherry, J. D., Mayer-Proschel, M. Oligodendrocyte progenitors reversibly exit the cell cycle and give rise to astrocytes in response to interferon-gamma. Journal of Neuroscience. 31 (16), 6235-6246 (2011).
- Stansley, B., Post, J., Hensley, K. A comparative review of cell culture systems for the study of microglial biology in Alzheimer's disease. Journal of Neuroinflammation. 9 (1), 115 (2012).
- Spaethling, J. M., et al. Primary Cell Culture of Live Neurosurgically Resected Aged Adult Human Brain Cells and Single Cell Transcriptomics. Cell Reports. 18 (3), 791-803 (2017).
- Timmerman, R., Burm, S. M., Bajramovic, J. J. An Overview of in vitro Methods to Study Microglia. Frontiers in Cellular Neuroscience. 12 (242), (2018).
- Stevens, B. Glia: much more than the neuron's side-kick. Current Biology. 13 (12), 469-472 (2003).
- Fields, R. D., et al. Glial biology in learning and cognition. Neuroscientist. 20 (5), 426-431 (2014).
- Yamamuro, K., Kimoto, S., Rosen, K. M., Kishimoto, T., Makinodan, M. Potential primary roles of glial cells in the mechanisms of psychiatric disorders. Frontiers in Cellular Neuroscience. 9 (154), (2015).
- Hartenstein, V., Giangrande, A. Connecting the nervous and the immune systems in evolution. Communications Biology. 1 (1), 64 (2018).
- Emsley, J. G., Macklis, J. D. Astroglial heterogeneity closely reflects the neuronal-defined anatomy of the adult murine CNS. Neuron Glia Biology. 2 (3), 175-186 (2006).
- Chaboub, L. S., Deneen, B. Developmental Origins of Astrocyte Heterogeneity: The Final Frontier of CNS Development. Developmental Neuroscience. 34 (5), 379-388 (2012).
- Tan, Y. L., Yuan, Y., Tian, L. Microglial regional heterogeneity and its role in the brain. Molecular Psychiatry. 25 (2), 351-367 (2020).
- Bottcher, C., et al. Human microglia regional heterogeneity and phenotypes determined by multiplexed single-cell mass cytometry. Nature Neurosciences. 22 (1), 78-90 (2019).
- Marques, S., et al. Oligodendrocyte heterogeneity in the mouse juvenile and adult central nervous system. Science. 352 (6291), 1326-1329 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены