Method Article
细胞性谷胱甘肽S-转移酶潜在抑制剂的分光光度筛选
* 这些作者具有相同的贡献
摘要
谷胱甘肽S-转移酶(GSTs)是参与许多化疗药物代谢的解毒酶。GSTs的表达与癌症化疗的抗性相关。对抗这种表型的一个方法就是使用抑制剂。该协议描述了一种使用分光光度测定来筛选潜在GST抑制剂的方法。
摘要
谷胱甘肽S-转移酶(GSTs)是代谢酶,负责通过谷胱甘肽(GSH)结合消除内源性或外源性电亲化合物。此外,GST是参与凋亡途径的米根活性蛋白激酶(MAPKs)的调节剂。GSTs的过度表达与使用电亲alkylating剂接受化疗的患者的疗效降低有关。使用GST抑制剂可能是扭转这一趋势和增强治疗效果的潜在解决方案。实现这一目标需要发现这种化合物,以及准确、快速和简单的酶测定。以1-氯-2,4-二苯(CDNB)作为基材的分光光度测量方案是文献中使用最多的方法。然而,已经描述的GST抑制实验没有提供一个协议,详细说明最佳抑制测定的每个阶段,如测量CNB的Michaelis-Menten常数(Km)或使用酶浓度的指示,评估测试化合物的抑制药效的关键参数。因此,通过该协议,我们描述了优化的分光光度量量GST酶测定的每个步骤,以筛选潜在抑制剂的库。我们解释半最大抑制浓度(IC50)和抑制常数(Ki)的计算,这两个特性用于测量酶抑制剂的功效。所述方法可以使用从细胞或纯重组人类 GST 中提取的 GST 池实现,即 GST alpha 1 (GSTA1)、GST mu 1 (GSTM1) 或 GST pi 1 (GSTP1)。但是,此协议不能应用于 GST theta 1 (GSTT1),因为 CDNB 不是此等值格式的基板。该方法用于利用马肝的GST测试姜黄素的抑制作用。姜黄素是一种具有抗癌特性的分子,在硅对接预测后,对GST 等构体 表现出亲和力。我们证明姜黄素是一种强大的竞争性GST抑制剂,IC50为31.6 ± 3.6 μM,Ki 为23.2 ±3.2 μM。
引言
细胞托西谷胱甘肽S-转移酶酶(GSTs,EC 2.5.1.18)催化谷胱甘肽(GSH)的结合到各种电亲化合物,如化疗剂,以解毒和消除它们很容易从身体1。七个细胞酸的一等形式已被确定为α,mu,pi,西格玛,欧米茄,泰塔和泽塔。GST主要表现在肝脏、睾丸、肺和胃肠道2中。GSTα 1 (GSTA1) 等构体在肝细胞中高度表达。身体异质表达其他亚型,包括GST pi 1 (GSTP1) 主要在大脑,心脏和肺部,和GST mu 1 (GSTM1) 在肝脏和睾丸3。虽然GST等价体之间具有高序列同源性,但根据其差异表达式4、5,每种异构体都表现出基质特异性,并以不同的方式与药物代谢和癌症有关。
电亲化合物要么外源进入人体,要么内源性产生。农药、前列腺素、致癌物质和化疗药物是谷胱甘肽结合反应的一些潜在基质。例如,在细胞内形成的任何无电子反应化合物都可能成为电亲基质。氯霉素或玛法兰等碱基剂被消除为GSTs催化的GSH的偶联体,这些酶的含量增加与这些化合物的耐药性6,7,相关。
细胞体性GSTS的另一个重要作用是调节线粒体活性蛋白激酶(MAPK)的活性,如 MAPK8(也称为c-Jun N-终端激酶,或JNK1)和 MAP3K5(也称为凋亡信号调节激酶1或ASK1)8。其单体构象中的一些等构形式会与这些蛋白质结合,从而阻断磷酸化级联。在正常情况下,GSTP1等同形式将封存 MAPK8(c-Jun 蛋白的活化剂)。将c-Jun与c-Fos蛋白结合形成活化蛋白1(AP-1)转录因子,该转录前凋亡基因。在压力细胞中,由GSTP1和 MAPK8 分离形成的复合物,c-Jun 被激活,导致凋亡的基因开始表达9。因此,这种GST等同形的更表达可能会阻断通路,从而增加细胞活力,增加细胞增殖,降低细胞对化疗的敏感性。与 MAP3K510交互的 GSTM1 的准日志也可能发生类似的情况。
GST在药物代谢和PPK的封存中所起的作用导致了GST的更伟大表达可能是肿瘤抵抗机制对化疗治疗6,11,的一个标志。例如,GSTP1在许多癌症中表达过度,其存在与预后不良和复发率增加8相关。这些基因的多态性也显示了不同药物暴露和存活率的差异患者呈现各种疾病,强化了这些酶是耐药机制的关键。例如,与GSM1空基因型的个人与较低的药物清除和更好的生存12,13。12,有几种潜在的方法可以对抗这种过度表达,例如使用GSH类似物,与GST结合激活的蛋白,或直接GST抑制剂14,15。14,
所有这些方法目前正在调查中,一些化合物已经开始临床试验,以开发它们在患者中的潜在用途。然而,据我们所知,在临床环境中没有用作GST抑制剂的化合物。事实上,某些异构体缺乏特异性或正常细胞中GSH的耗竭,可能导致器官系统中活性氧物种(ROS)的积累导致毒性,只是减少GST抑制剂14,15的潜力的一些缺点。这些化合物对身体产生其他药效作用的风险也限制了它们的使用。例如,Ethacrynic酸是实验室环境中研究最广泛的GST抑制剂,但由于它主要用作强利尿剂,因此该属性限制了其与其他药物在临床环境中的结合使用。姜黄素是另一种天然化合物,成功筛选为GST抑制剂。这种分子是从姜黄的姜黄龙类中提取的多酚醚。它显示了有希望的结果,作为一种可能的治疗方法,通过诱导各种肿瘤细胞系16,17的凋亡,对抗癌症。该化合物可以调节不同的细胞通路,如酪氨酸激酶18或GST通路。纯蛋白质的研究表明,其抑制作用对GSTA1、GSTM1和GSTP119,20。19,20然而,在癌细胞中观察到相互矛盾的结果,当细胞用姜黄素21治疗时,测量了更大的细胞内GST活性。因此,在计划任何进一步的细胞实验之前,使用描述清楚的协议和适当的控制来研究半最大抑制浓度 (IC50) 和抑制 (Ki)的常量(K i)非常重要。
因此,筛选和测试潜在的新 GST 抑制剂对临床意义重大,任何发现的新化合物都必须安全、高效,可与嗜电药物结合使用。专注于异构特异性抑制剂的研究可能使GST抑制在肿瘤组织中表现出特定的GST表达模式,从而允许开发有效的联合疗法。找到具有不同抑制模式的抑制剂也可能感兴趣。例如,使用GSH作为基材的竞争性抑制剂可以诱导其耗竭。细胞中GSH浓度的降低表明会导致神经元的氧化应激,导致凋亡。另一种常见的抑制模式——无竞争力抑制——即使基质存在于高浓度中,也不能逆转。
酶活性速率由Michaelis-Menten常数(Km)和最大速度(V最大)表示,可以通过绘制Michaelis-Menten图来确定,基底浓度与反应速度23。Km 是占用一半的酶活性位点所需的基板的浓度,这意味着高 Km 表示 的亲和力较小。V最大值 表示当所有活动位点被基板占据时达到的最大反应速度。Km 等于半 V最大值。有三种最常见的抑制模式:竞争、无竞争力和非竞争性。在竞争抑制的情况下,抑制剂与酶的活性位点结合,与基板竞争。因此,Vmax 在添加抑制剂后不会改变,但Km 增加,因为需要更多的基底来对抗抑制。只有当基板与酶形成复合物时,才出现缺乏竞争力的抑制。在这种情况下,由于抑制水平取决于基底和酶浓度,Vmax 和 Km 在加入反应时会降低。最后一种抑制模式是非竞争性的,是另外两种抑制模式的混合体。无论酶是否与基质结合,抑制剂都可以与酶的活性位点结合。这里V最大 减少后添加抑制剂,但Km 不会改变24。
1974年,Habig等人首次开发出一种测量GST活性的分光光度测定方法,使用1-2,4-二丁苯(CDNB)作为反应22的基质。GSH 和 CDNB 之间的结合形成 GS-DNB,其波长为 340 nm 时具有最大的光吸收度,可使用分光光度计进行记录。下面解释的多数技术来自Habig等人,包括关于抑制性测定的最佳设置和重要优化点的信息。该技术可应用于筛选潜在的GST抑制剂,无论是通过使用计算预测或文献综述进行合理药物选择。讨论了如何使协议适应新合成的GST蛋白或特定的异构体。例如,测试表现出临床相关多态性或单核苷酸多态性(SNPs)的GST等构体抑制效力可能是此协议的潜在用途,针对患者特定的GST。
该协议为在任何其他功能研究之前在体外筛选潜在的GST抑制剂提供了一种快速、可行和有效的方法。描述了评估酶抑制剂最常见的测量特性所需的步骤:抑制剂浓度50(IC50),是抑制剂的浓度,减少酶活性的一半;和抑制常数(Ki),代表抑制剂和酶之间分离的均衡常数,这两个分子之间的亲和力特征。这两个值分别通过非线性回归和每种抑制模式使用特定方程来衡量。我们还演示了这种抑制模式的评估,使用Michaelis-Menten图确定添加抑制剂23、25、26后V max,和Km的变化。
研究方案
1. GST酶溶液的制备
注:制备酶溶液的过程取决于在测定之前是否知道酶活性的单位。一个酶单元是每分钟合成1μmol产品所需的酶量。酶活性以单位/mL 或μmol/min/mL 表示,取决于酶溶液的稀释。特定的酶活性以单位/毫克或μmol/min/mg表示,完全取决于溶液的纯度。这两个特征都确定在下面。如果分离的GST等同物的酶单元未知,则必须估计调整每种反应的酶浓度并提供可重复的结果。
- 如果已知测定中使用的 GST 的酶单位:
- 在水中以0.1 U/mL的GST酶准备新的库存溶液,然后继续执行步骤2。
注:此溶液可储存在-20°C的等分中几个月,或在-80°C下储存更长时间,但必须避免冻结/解冻循环。
- 在水中以0.1 U/mL的GST酶准备新的库存溶液,然后继续执行步骤2。
- 如果测定中使用的 GST 的酶单元未知:
- 使用双辛辛酸(BCA)蛋白质测定或任何其他试剂盒来量化酶溶液的蛋白质浓度。
- 将蛋白质溶液稀释为0.02mg/mL的最终蛋白质浓度。
- 将酶溶液的20μL、GSH 25 mM的20μL(分子量:307.32 g/mol)和150μL的Dulbecco磷酸盐缓冲盐水(DPBS)加入到96孔板中。对于空白,加入20μL的水,而不是酶溶液。
- 在每个井中加入 10 μL 的 CDNB 50 mM(分子量:202.55 g/mol)基材。
- 在分光光度微孔板读卡器上,设置在 340 nm 读取孔的参数。建议每分钟测量 10 分钟的吸光度。
- 将板插入微孔板读卡器,然后根据步骤 1.2.5 的设置开始读取。
- 计算酶样品和空白的每分钟吸光度变化。
注:通过绘制 y 轴上的吸收度和 x 轴上的分钟来验证反应是否为线性。如果反应不是线性的,达到高原,这意味着使用所有的基板和反应太快。因此,通过将库存溶液稀释2,减少添加到井中的酶量。 - 空白校正测试样品的吸光度读数。
- 使用方程 1 表示 Beer+Lambert 定律,按每分钟反应计算 GS-DNB 形成的浓度(以 μM 为单位)。
方程1: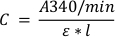
其中 C 是 μM 中基板的浓度,A340/min是每分钟吸收率的变化,如步骤 1.2.7,ε 是 340 nm (0.0096 μM-1*cm-1) 的 CDNB 结合的摩尔消光系数,l 是井中的光路长度(以厘米为单位)。-1对于充满 200 μL 酶溶液的 96 井板,路径长度约为 0.55 厘米。此值可能因板材型号而异,应与制造商核实。 - 要确定一个井中存在于 μmol/min 中的产品量,请将使用方程 1 找到的结果乘以溶液体积 2 x 10-4 L。
- 通过将步骤1.2.9的结果除以4 x 10-4毫克,使每用蛋白质的活性 正常化。结果是单位/毫克或μmol/min/mg中的特定酶活性。
注:如果由于非线性反应,在步骤1.2.6中改变稀释,则相应地调整蛋白质量。 - 要找到酶活性,通过将步骤1.2.10中的特定酶活性乘以0.002毫克/mL,调整结果以mg/mL中的蛋白质浓度。这将给出单位/mL 或 μmol/min/mL 中的酶活性。
注:与酶活性相反,此测量值不会因蛋白质溶液的稀释而改变。与步骤 1.2.10 相同,但蛋白质浓度。 - 在水中以0.1单位/mL的GST酶的库存溶液准备,然后继续执行步骤2。
注:此溶液可储存在-20°C的等分中几个月,或在-80°C下储存更长时间,但必须避免冻结/解冻循环。如果实验在较长时期内进行,则建议控制酶活性,因为蛋白质溶液可能会降解。
2. CDNB GST 等构体迈克尔斯-门滕常数的测量
注:该过程适用于 CDNB 基材,但可应用于任何其他基板,如 GSH。CDNB 的每个浓度都需要自己的空白,因为 340 nm 的吸光度会根据 CDNB 浓度增加。
- 在乙醇中准备六种不同浓度的 CDNB,范围从 10 mM 到 100 mM,乙醇为 95%(v/v)。
- 制备测定溶液,使用10μL的CDNB、20μL的GST酶、20微升的GSH 25 mM和150μL的DPBS。对于空白,而不是 CDNB 溶液,只添加 10 μL 乙醇 95%。
- 为每个 CDNB 浓度准备一个空白,其中 CDNB 为 10 μL,水为 20 μL,GSH 为 25 mM,150 μL DPBS。
- 使用微孔板读卡器将吸光度记录在每分钟 340 nm 10 分钟。
- 空白-通过从空白中减去正确其他测试井的结果来校正吸收度。根据测量值,使用方程2计算反应速度。
等式2: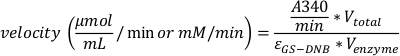
其中A340/min是每分钟吸收度的实验确定变化,V总(总体积)等于0.2 mL,V酶(酶体积)enzyme为0.02 mL,εGS-DNB是GS-DNB结合体在340纳米(9.6mM-1 *1 *cm-1) 的摩尔消光系数。在 96 井板的 200 μL 井中,路径长度为 0.55 厘米(取决于板类型),消光系数等于 5.3mM-1。速度可以用μmol/mL/min或mM/min表示。 - 将Michaelis+Menten图与基板浓度(在x轴上)的速度(在y轴上)绘制。
- 定义反应的最大速度 (V最大值) 和 Michaelis=Menten 常数 (Km) (即基板浓度为 V 最大值的一半)。
注:使用 GraphPad 棱镜等软件,可以使用非线性回归来计算 Michaelis-Menten 酶动力学参数(如 V max 和 K m ) 的酶动力学曲线。 - 以 95%(v/v) 计算 K m 的 20 倍准备 CDNB 库存溶液。
3. 潜在 GST 抑制剂的吸收
注:执行此步骤以调查反应中使用的潜在 GST 抑制剂是否产生代谢物,从而增加被测量波长的吸光度。如果确实如此,则使用的抑制剂量将对结果产生影响,并且应针对每个浓度准备一个特定的空白。
- 将抑制剂稀释到所需的浓度。
注:准备三种不同的稀释,最好是在抑制检测期间测试的最低浓度、中浓度和最高浓度。井中的最大 DMSO 浓度应等于或小于 1%(v/v)。我们在实验室中测试了DMSO浓度对测定的影响,1%没有显著改变GST活性。 - 在96井板中,加入2μL的潜在GST抑制剂,20μL的GSH 25 mM和168μL的DPBS。使用适当的控制,没有抑制剂,通过添加相等体积的溶剂用于抑制剂样品。
- 孵育反应10分钟,开始酶反应。
注:通过测试不同的孵育时间,可以优化此步骤,其双重目的是开始反应,同时避免基板完全耗尽。 - 在每个井中加入 10 μL 的 CDNB,在步骤 2 中发现的 Km 达到最终浓度。
- 摇动板几秒钟。
- 使用微孔板读卡器将吸光度记录在每分钟 340 nm 10 分钟。
- 计算每分钟吸收度的变化。
- 验证与空白反应和负控制反应相比的吸光度变化,无抑制剂。
- 如果有显著变化,对每种抑制剂浓度使用空白来调整结果。
注:此结果表明,没有GST酶的反应成分会自发反应,并产生一种代谢物,在340nm时增加吸收度。为了校正这种额外的吸光度,应测量每个浓度的特定空白。 - 如果吸光度没有显著变化,则使用一般空白,只含有用于 GST 抑制剂稀释的溶剂,用于所有浓度。
- 如果有显著变化,对每种抑制剂浓度使用空白来调整结果。
4. GST和IC50评估的抑制测定
- 准备九浓度的潜在GST抑制剂。
注:浓度可根据结果进行调整。目的是定义非线性回归曲线的底部和顶部高原。有关此步骤的更多详细信息,请参阅讨论部分。 - 在 25 mM 下用 148 μL 的 DPBS 稀释 20 μL 的 GSH 溶液,制备测定溶液。根据测定中使用的井数调整体积。
- 在透明 96 井板中,在 190 μL 的最终体积中准备酶反应。建议在这些步骤中使用多通道移液器。
- 对于测试井,加入20μL的酶溶液,2μL的潜在GST抑制剂溶液和168μL的测定溶液。
- 对于控制,加入20μL的酶溶液,2μL的LUlu素用于GST抑制剂和168μL的测定溶液。
- 对于空白井,加入20μL的水,2μL的潜在GST抑制剂和168μL的测定溶液。
注:如果 GST 抑制剂吸收 340 nm 波长,则应为测试的每个浓度准备特定空白。
- 以 20 倍 K m 为单位向每井(包括空白)添加 10 μL 的 CDNB 溶液。建议在此步骤中使用多通道移液器。
- 摇动板几秒钟。
- 使用微孔板读卡器以每分钟 340 nm 测量吸光度 10 分钟。
- 通过从测试井空白中减去结果来校正吸收度。
- 通过将使用 GST 抑制剂溶液获得的值除以控制每分钟的吸光度(无抑制剂)来使结果正常化。
- 绘制抑制剂对数浓度(x 轴)的非线性回归图(y 轴),从而确定 IC50。
注:GraphPad 棱镜通过预测显示控件中 50% 的酶活动的浓度,从非线性回归图中计算 IC50。预测基于底部和顶部高原,以及由西格莫德图形成的斜率曲线。
5. 评估Ki和抑制类型
- 准备四种不同的 CDNB 浓度:三个更高,一个等于以前发现的 K m。
- 准备三种不同的GST抑制剂浓度,等于或低于之前发现的IC50。
- 执行步骤 4.2 至 4.7 中所述的抑制测定。
- 使用方程 2计算反应的速度。
- 绘制每个抑制剂浓度的Michaelis+Menten图,并计算每个反应的 V最大值 和K米。
- 根据不同浓度时Vmax 和Km 的变化,评估GST抑制剂的抑制模式。
注:在结果和讨论部分中更详细地解释了此步骤。 - 基于抑制模式,计算Ki。
注:在 GraphPad 棱镜中,将使用不同的方程根据抑制的性质计算 Ki。 使用的方程基于添加抑制剂后观察到的Km 和V 最大值,并与控件的Km和V 最大值进行比较。
结果
迈克尔里斯门滕常数 (Km) CDNB 与 Gst 从马肝
姜黄素是一种安全的天然化合物,即使在摄入在高剂量27,显示抗癌性质16。这种分子的抑制效力在人类重组GSTs19,2019上已经得到证明。通过使用所述协议,我们使用来自马肝的 GST 等构体池评估姜黄素对 GST 活动的影响。据供应商说,这种蛋白质混合物的具体活性为25U/mg。通过溶解适当量的水中的冻干粉末,可生产0.1 U/mL的库存溶液。Ethacrynic酸被同时用作阳性对照,因为这种化合物是研究中使用最广泛的GST抑制剂。图1概述了建立 GST 活性检测和抑制剂测试的步骤。
Km 必须针对每个酶基板反应定义,因为使用等效于 Km 的基底浓度将确保在确定抑制模式28 方面不产生偏差。使用2.5 mM GSH的固定浓度测试了6种CDNB的不同浓度,从0.5 mM到5 mM不等。
反应的最终体积为200μL,在96井板中。每个实验都使用了特定的空白,使用与测试井相同的 CDNB 浓度,因为 CDNB 和 GSH 的自发结合可能发生,并且可能会增加吸光度。通过将20μL的库存溶液添加到测定混合物中,用于所有反应的最终酶浓度为0.01单位/mL。每分钟记录 340 nm 的吸收量 10 分钟。使用方程 2计算反应的速度(以mM/min)。根据速度(μM/min)绘制了基底浓度(mM)的Michaelis-Menten图(图2),并计算了 反应的K米。实验被重复,直到至少三组数据显示类似的结果。用马肝的GST测量的CDNB的Km 为0.26±0.08 mM。使用这一批GST进行每次抑制性测定,都使用0.2 mM的CDNB浓度。
在使用GSH和CDNB单独孵育的姜黄素进行实验中,没有自然形成的吸收在340nm的代谢物。每个实验中每个抑制剂浓度都使用相同的空白。
姜黄素对GSTs的抑制效力
姜黄素的抑制效力是使用与软件的硅基模拟(例如,AutoDock Vina 版本 1.1.2)预测的。29预测了不同 GST 等构形式(即 GSTA1、GSTM1 和 GSTP1)和姜黄素之间的自由结合能量(未显示数据)。然后,使用方程3计算抑制Ki的常数。
等式3: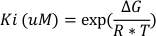
其中∆G是使用硅分析找到的自由结合能量,R是气体常数1.987 cal*K-1-1*mol-1,T是实验期间的温度,在这种情况下,在开尔文(298 K)。
根据 AutoDock Vina 返回的自由结合能量结果,姜黄素是人类 GSTA1、GSTM1 和 GSTP1 的强效 GST 抑制剂,Ki 值分别为 78.1 μM、78.1 μM 和 27.4 μM。第一次抑制性测定使用这些计算Ki 估计进行,如有必要,根据结果调整浓度。
首先,估计了IC50。这一特性是抑制剂的浓度,可使酶的反应率降低50%。因此,它依赖于酶浓度30。制备了9种抑制剂的最终浓度,从0.39μM到100μM不等,每个浓度是前一个浓度的两倍。测定溶液由20μL的GSH 2.5 mM、0.01 U/mL最终来自马肝的20μL、姜黄素溶液的2微升和148μL的PBS组成。该控件由与用于姜黄素的稀释剂相同的溶液组成。这种混合物被孵育15分钟,开始酶测定,并避免在测定溶液中的姜黄素降解,因为这种化合物在缓冲溶液31中不稳定。接下来,将 4 mM 的 10 μL CDNB 溶液添加到每井中,最终浓度为 0.2 mM CDNB。每分钟记录 340 nm 的吸收度 10 分钟,以计算每分钟吸收度的变化。为了计算IC50,每个用姜黄素孵育的样品都规范化到对照组,给出活动的百分比。通过计算抑制剂对数浓度与抑制的非线性回归,利用绘图软件对结果进行了分析。从马肝发现的GST姜黄素IC50为31.6±3.6μM(图3A)。
同一实验同时进行,使用乙酸作为阳性控制,浓度在0.39至100μM之间,如姜黄素。发现 IC50 的 6.6 ± 1.1 μM (图 3B) 。
下一步是评估姜黄素在这些转移酶上的抑制模式。对四种不同浓度的姜黄素进行了测试:0、7.5、15和30μM,以及4种不同浓度的CDNB:0.2、0.4、1和1.5 mM。该协议与上一个实验相同。每个条件的速度计算使用方程2。绘制了每个抑制剂浓度的曲线,速度(以μM/min为单位)与基底浓度(mM)(图3C)。V最大值和Km是根据使用 GraphPad 棱镜的每个绘图确定的。根据这两个参数的变化和测定的不同条件,对潜在抑制剂的抑制模式进行了评估。24由于V最大值在条件之间没有显著变化,但Km随着不同抑制剂浓度的增加而增加,姜黄素对GSTs的抑制具有竞争力。当抑制剂与酶活性位点基物竞争时,将发生这种抑制模式。为了测量竞争抑制剂的K i,GraphPad使用方程4和等式5,如科普兰等人32所述。
方程4: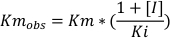
等式5: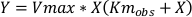
其中Km obs 是观察到的Michaelis=Menten常数,Km 是照的控制的Michaelis=Menten常数,[I]是抑制剂浓度,Ki 是抑制的常数,Y是速度,X是基底浓度。
计算基于与抑制模式评估相同的实验。姜黄 素对马肝GST的抑制量为23.2±3.2微米。
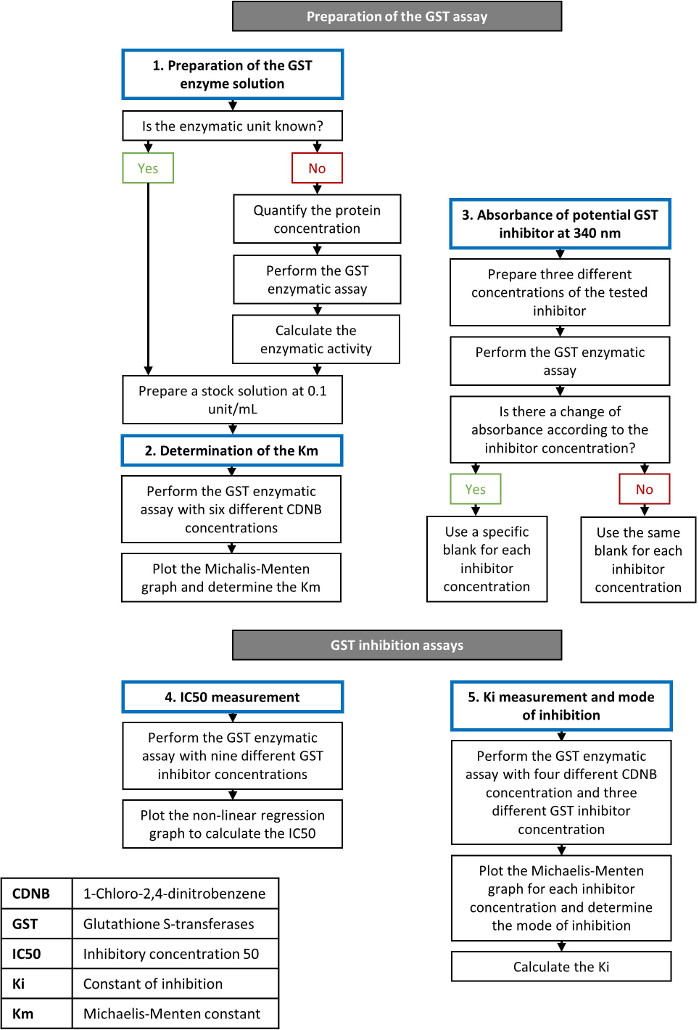
图1:描述GST酶和抑制测定步骤的流程图。有关该过程的详细信息将在协议部分中显示。 请单击此处查看此图的较大版本。
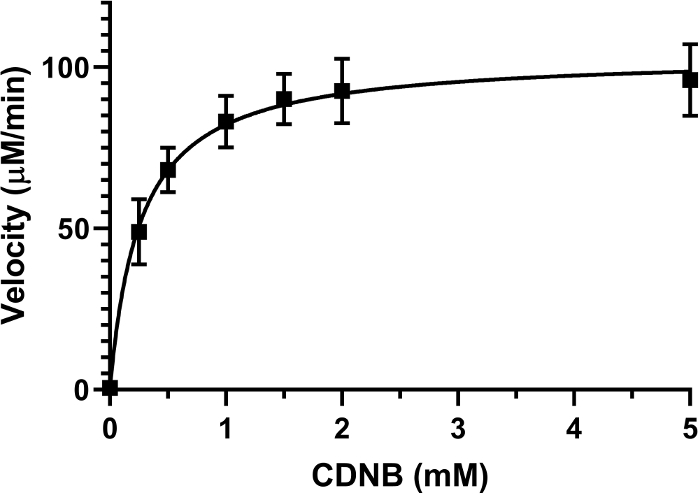
图2:GST酶活性的Michaelis-Menten图。基质 CDNB 的浓度增加,使用 GSH (2.5 mM) 的固定浓度,以确定来自马肝的 GST 池的 GST 活性。根据图形 的曲线,CDNB 的 K m 值± 0.26 米,0.08 mM。绘图上的每个数据点代表使用 SD 的四个不同实验 运行的均值。请单击此处查看此图的较大版本。
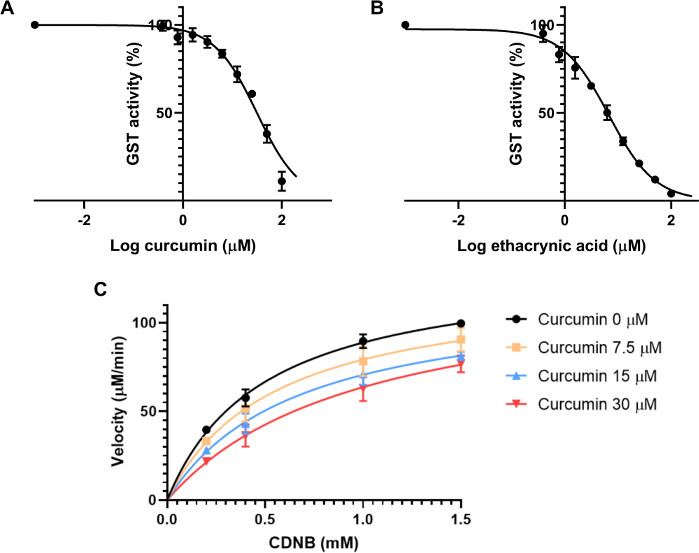
图3:姜黄素和乙酸对GST酶活性的影响。(A-B)增加姜黄素(A)或正对乙酸(B)的浓度,同时保持相同的GST(0.01 U/mL)、GSH(2.5 mM)和CDNB(0.2 mM)最终浓度,用于计算从马肝与非线性回归的GST两种化合物的IC50。IC50 被确定为姜黄素的 31.6 ± 3.6 μM,6.6 ± 1.1 μM 的乙酰酸。(C) 不同浓度姜黄素的Michaelis-Menten图,针对不同浓度的CDNB基质进行测试,表明存在竞争抑制模式。在无抑制剂下,V最大值 和Km 分别测量为132.7±4.6 μM和0.5±0.08 μM。姜黄素为30μM,V最大值 和Km 为130.4±13.1μM和1.08 ±0.39μM。所有图形中的数据点(A-C)表示使用SD的三种不同实验运行的方式 。请点击这里查看这个数字的较大版本。
讨论
我们提供一个描述分光光度量GST酶测定的每个步骤的协议,以筛选推杆抑制剂(图1,表1),并量化其抑制效力。我们还强调了为提供可重复结果的准确酶测定而考虑的最关键标准。所述协议与其他色谱方法或质谱法相比的主要优点是,该协议执行起来快速、容易,并提供 GST 活性的定量测量以及筛选分子的抑制效力。
我们提出了计算酶抑制剂的两个最重要的Michaelis-Menten参数的方法:IC50和Ki。有效的抑制剂将发挥尽可能低的Ki 和IC50,表明抑制剂和酶之间的亲和力是高30。由于IC50依赖于酶浓度和测定条件33,因此可能很难使用此值来比较不同实验中的抑制剂,或者使用其他测定条件34获得。使用抑制性 Ki 的常 数是潜在化合物抑制效力的更好指标。Ki 可用于比较两种不同抑制模式的抑制剂,因为它完全依赖于抑制剂和酶之间的亲和力。然而,要清楚地了解抑制的性质,必须确定抑制剂的两个参数30。我们分别测量了姜黄素的IC50和Ki 为31.6 ± 3.6 μM和23.2 ±3.2 μM,表明该化合物是一种有效的GST抑制剂。这些结果证实了 在 silico 预测 中,估计不同人类 GST异 构体和姜黄素的 K i 值介于 27.4 至 78.1 μM 之间。
酶活性或反应速率和酶量
如上所述,IC50依赖于酶浓度,进行不一水平的酶活性的实验可能导致错误的结论33。为了控制可能减少抑制活性的其他因素,应考虑并测量每批新一批GST的酶活性。例如,由于冻结/解冻周期过长而导致的酶批次的降解可能会减少活性,从而导致IC50降低,即使实验是在相同的条件下运行的。换句话说,使用0.01单位的酶不会给出与使用1个单位相同的结果。使用太多的酶可能导致基板的快速耗尽,反应不会具有线性形状。因此,此参数可能导致不准确的结果,因为长时间的孵育后,不会看到吸收率的变化。
Km 值
为了确保评估抑制剂所表现的抑制类型的最佳条件,基板浓度必须等于或低于Michaelis-Menten常数(Km)。Km由酶28上占据一半活性位点所需的基质浓度表示。例如,较高的基质浓度可以抵消竞争抑制剂,在这种情况下,评估这种类型的抑制将很困难。因此,此方法中的关键步骤之一是确定所选基质(此处为CDNB)的酶 K m。在一些研究中,这个值没有确定,这可能导致关于抑制剂引起的抑制模式的错误结论,如果抑制模式不正确,Ki将计算不正确,因为方程依赖于抑制模式26,28。,28如果测试了不同的 GST 等形,则必须对 Km值进行新的评估,因为此值对于一对酶和配体是唯一的。由于我们使用的 CDNB 浓度略低于 Km (0.2 mM),我们定义为 0.26 ± 0.08 mM,因此准确确定了对 GST 中姜黄素的抑制预测竞争模式。
IC50
要获得一条良好的西形曲线来估计IC50,需要同时找到底部和顶部的高原。底部高原表示提供最大抑制活性的抑制剂的浓度。在某些情况下,化合物可能无法完全抑制酶,即使在高浓度,因为诸如溶解性等技术问题。然而,像 GraphPad 棱镜这样的工具可以非常准确地适应底层高原。顶部高原由抑制剂的浓度,不足以抑制酶,因此活性最大。这两个高原对于确定IC50以及两者之间的浓度都至关重要,为了找到曲线的斜率,IC50可以从西格莫德曲线35的形状中得出。姜黄素在水中不溶性,因此该测定中使用的最大浓度有限,以避免测定溶液中的沉淀。因此,使用了不太集中的解决方案,这种解决方案并不完全抑制消费税活动。这就提出了确定底层高原的问题。为了解决这个问题,我们根据非线性回归图预测了底部值,该图为姜黄素提供了 31.6 ± 3.6 μM 的 IC50(图3A)。对于乙酰丙酸,无需预测底部高原的值,因为该化合物可溶于测定溶液中,IC50 的测量值为 6.6 ± 1.1 μM。
此方法可应用于人类最表达的 GST 等构形式,即 GSTA1、GSTM1 或 GSTP1。但是,此协议不适合量化 GSTT1 等值形式的活动,因为 CDNB 不是此子类型的基板。36, 37 同时,可以稍微修改协议以解决此问题。例如,使用1,2环氧-3-(4'-硝基苯丙烷)丙烷(ENPP)作为GST1的基质,测量360nm而不是340nm的偶联数量。37
协议步骤可对细胞培养实验中的GST活性和抑制剂测试进行适应和应用。测量使用和没有 GST 抑制剂治疗的细胞的 GST 活性将指示此化合物是否可用于此类实验环境。当抑制剂嗜脂时,它特别有趣。例如,我们提出姜黄素是一种有效的GST抑制剂使用这种协议。然而,它对细胞研究的应用可能有限,因为分子在水中的溶解性很差,在介质中迅速降解。31 关于基板 CDNB 的非等式特异性,本协议的另一种改善是可能的。在单元研究中使用此协议将只提供有关总体 GST 活动的信息,而不能提供有关精确 GST 子类型的活动的信息。添加等构体特异性基板和/或使用特定的重组GST等异形式将允许测试异构体特定的GST抑制剂。
最后,我们描述了一个完整的程序,以测试GST抑制剂,有潜力与电亲化疗结合使用。我们强调了GST酶和抑制性测定的关键步骤,以测试潜在的有趣分子,并确定其作为定量值、IC50和Ki的抑制剂的效率。此方法可应用于任何可对的人工 GST 等构体(GSTA1、GSTM1 和 GSTP1)进行的可提出性化合物,或稍微适应使用 GST 抑制剂进行细胞培养研究或测量其他有趣的 GST 等构体选择的活动。
| 试剂 | 名字 | 测定溶液中的浓度 | 其他 |
| 衬 底 | Cdnb | 测量 K米 (mM) | 在95%乙醇中稀释。最终乙醇浓度应≤ 5% (v/v) |
| 结合基板 | Gsh | 2.5 mM | 在水中稀释。 |
| 浓度必须使溶液饱和。 | |||
| 缓冲区 | Pbs | - | pH = 7.1 |
| 酶 | GST 等构体或纯等构形式池 | 0.01 单位/mL,实验确定。 | 在水中稀释。 |
| GST 抑制剂 | 选择的潜在化合物 | IC50:3个浓度,最大抑制,3个最小抑制,和3介于两者之间。 | 在 DMSO 中稀释,然后在水中稀释,使 DMSO 的最终浓度≤ 1% (v/v) |
| Ki: IC50 周围的 3 个浓度。 | |||
| 参数 | |||
| 室温 (25°C) | |||
| pH = 7.1 | |||
| DMSO ≤ 1% (v/v) | |||
| 乙醇≤ 5% (v/v) | |||
表1:在GST抑制检测期间要考虑的试剂和参数摘要。
披露声明
作者没有什么可透露的。
致谢
这项研究工作得到了中国社会委员会基金会的支持。作者感谢劳伦斯·莱斯内女士和约安·萨门托先生的技术援助,特别是在进行复制实验的同时,用抑制剂对测定进行标准化。丹尼斯·马里诺先生、西蒙娜·姆拉卡尔博士和维德·姆拉卡尔博士的富有成果的讨论和投入得到极大的承认。我们感谢帕特里夏·休佐-迪亚兹·柯蒂斯博士对视频的解说。我们感谢穆图库马尔博士对西 利科预测 的投入。我们还感谢达伦·哈特先生对这份手稿的英文证明阅读的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 1-Chloro-2,4-dinitrobenzene (CDNB) | Sigma-Aldrich | 237329 | Substrate used for the GST enzymatic assay |
| Corning UV-Transparent Microplates | Sigma-Aldrich | CLS3635 | Transparent plate to perform the enzymatic assay. When using 200 ul, the pathlength is 0.552 cm for this plate. |
| Curcumin | Sigma-Aldrich | 8511 | Used for the results section, to test the inhibition potency of curcumin |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | To prepare the stock of the putative inhibitor |
| DPBS | Sigma-Aldrich | D8537 | Buffer for the enzymatic reaction |
| Ethanol 95% | Fisher scientific | 10542382 | To dilute the CDNB |
| Glutathione S-Transferase from equine liver | Sigma-Aldrich | G6511 | Used for the results section, to test the inhibition potency of curcumin |
| L-glutathione reduced (GSH) | Sigma-Aldrich | G4251 | Co-substrate for the GST enzymatic assay |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23225 | To quantify the amount of protein present in the enzymatic solution |
| Spectramax iD3 | Molecular devices | To do spectrophotometric measurments |
参考文献
- Mannervik, B., Danielson, U. H. Glutathione transferases--structure and catalytic activity. CRC Critical Reviews in Biochemistry. 23 (3), 283-337 (1988).
- Awasthi, Y. C., Sharma, R., Singhal, S. S. Human glutathione S-transferases. The International Journal of Biochemistry. 26 (3), 295-308 (1994).
- Rowe, J. D., Nieves, E., Listowsky, I. Subunit diversity and tissue distribution of human glutathione S-transferases: interpretations based on electrospray ionization-MS and peptide sequence-specific antisera. Biochemical Journal. 325, 481-486 (1997).
- Beckett, G. J., Hayes, J. D. Glutathione S-transferases: biomedical applications. Advances in Clinical Chemistry. 30, 281-380 (1993).
- Oakley, A. Glutathione transferases: a structural perspective. Drug Metabolism Reviews. 43 (2), 138-151 (2011).
- Townsend, D. M., Tew, K. D. The role of glutathione-S-transferase in anti-cancer drug resistance. Oncogene. 22 (47), 7369-7375 (2003).
- Tew, K. D. Glutathione-associated Enzymes in Anticancer Drug Resistance. Cancer Research. 54 (16), 4313-4320 (1994).
- Laborde, E. Glutathione transferases as mediators of signaling pathways involved in cell proliferation and cell death. Cell Death and Differentiation. 17 (9), 1373-1380 (2010).
- Adler, V., et al. Regulation of JNK signaling by GSTp. The EMBO Journal. 18 (5), 1321-1334 (1999).
- Cho, S. G., et al. Glutathione S-Transferase Mu Modulates the Stress-activated Signals by Suppressing Apoptosis Signal-regulating Kinase 1. Journal of Biological Chemistry. 276 (16), 12749-12755 (2001).
- Hayes, J. D., Flanagan, J. U., Jowsey, I. R. Glutathione Transferases. Annual Review of Pharmacology and Toxicology. 45 (1), 51-88 (2005).
- Lo, H. W., Ali-Osman, F. Genetic polymorphism and function of glutathione S-transferases in tumor drug resistance. Current Opinion in Pharmacology. 7 (4), 367-374 (2007).
- Ansari, M., et al. Glutathione S-transferase gene variations influence BU pharmacokinetics and outcome of hematopoietic SCT in pediatric patients. Bone Marrow Transplantation. 48 (7), 939-946 (2013).
- Mahajan, S., Atkins, W. M. The chemistry and biology of inhibitors and pro-drugs targeted to glutathione S-transferases. Cellular and molecular life sciences: CMLS. 62 (11), 1221-1233 (2005).
- Allocati, N., Masulli, M., Ilio, C. D., Federici, L. Glutathione transferases: substrates, inihibitors and pro-drugs in cancer and neurodegenerative diseases. Oncogenesis. 7 (1), 8 (2018).
- Aggarwal, B. B., Kumar, A., Bharti, A. C. Anticancer potential of curcumin: preclinical and clinical studies. Anticancer Research. 23 (1), 363-398 (2003).
- Han, S. S., Chung, S. T., Robertson, D. A., Ranjan, D., Bondada, S. Curcumin causes the growth arrest and apoptosis of B cell lymphoma by downregulation of egr-1, c-myc, bcl-XL, NF-kappa B, and p53. Clinical Immunology. 93 (2), 152-161 (1999).
- Golonko, A., Lewandowska, H., Świsłocka, R., Jasińska, U. T., Priebe, W., Lewandowski, W. Curcumin as tyrosine kinase inhibitor in cancer treatment. European Journal of Medicinal Chemistry. 181, 111512 (2019).
- Awasthi, S., et al. Curcumin-glutathione interactions and the role of human glutathione S-transferase P1-1. Chemico-Biological Interactions. 128 (1), 19-38 (2000).
- Appiah-Opong, R., Commandeur, J. N. M., Istyastono, E., Bogaards, J. J., Vermeulen, N. P. E. Inhibition of human glutathione S-transferases by curcumin and analogues. Xenobiotica; the Fate of Foreign Compounds in Biological Systems. 39 (4), 302-311 (2009).
- Dubey, V., Owusu-Apenten, R. Curcumin Restores Glutathione-S-Transferase Activity for LNCaP Prostate Cancer Cells. Pure and Applied Chemistry. 2, 61-72 (2014).
- Habig, W. H., Pabst, M. J., Jakoby, W. B. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation. The Journal of Biological Chemistry. 249 (22), 7130-7139 (1974).
- Johnson, K. A., Goody, R. S. The Original Michaelis Constant: Translation of the 1913 Michaelis-Menten Paper. Biochemistry. 50 (39), 8264-8269 (2011).
- Ochs, R. S. Understanding Enzyme Inhibition. Journal of Chemical Education. 77 (11), 1453 (2000).
- Bisswanger, H. Enzyme assays. Perspectives in Science. 1 (1), 41-55 (2014).
- Acker, M. G., Auld, D. S. Considerations for the design and reporting of enzyme assays in high-throughput screening applications. Perspectives in Science. 1 (1), 56-73 (2014).
- Cheng, A. L., et al. . Anticancer Research. 21, 2895-2900 (2001).
- Yang, J., Copeland, R. A., Lai, Z. Defining Balanced Conditions for Inhibitor Screening Assays That Target Bisubstrate Enzymes. Journal of Biomolecular Screening. 14 (2), 111-120 (2009).
- Uppugunduri, C. R. S., Muthukumaran, J., Santos-Silva, T., Ansari, M. Identification of putative substrates and inhibitors for Glutathione S-transferases using computational methods. Zenodo. , (2017).
- Burlingham, B. T., Widlanski, T. S. An Intuitive Look at the Relationship of Ki and IC50: A More General Use for the Dixon Plot. Journal of Chemical Education. 80 (2), 214 (2003).
- Wang, Y. J., et al. Stability of curcumin in buffer solutions and characterization of its degradation products. Journal of Pharmaceutical and Biomedical Analysis. 15 (12), 1867-1876 (1997).
- Copeland, R. A. Evaluation of enzyme inhibitors in drug discovery. A guide for medicinal chemists and pharmacologists. Methods of Biochemical Analysis. 46, 1 (2005).
- Kalliokoski, T., Kramer, C., Vulpetti, A., Gedeck, P. Comparability of Mixed IC50 Data - A Statistical Analysis. PLoS ONE. 8 (4), (2013).
- Brandt, R. B., Laux, J. E., Yates, S. W. Calculation of inhibitor Ki and inhibitor type from the concentration of inhibitor for 50% inhibition for Michaelis-Menten enzymes. Biochemical Medicine and Metabolic Biology. 37 (3), 344-349 (1987).
- Brooks, H. B., et al. Basics of Enzymatic Assays for HTS. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2012).
- Arakawa, S., et al. Evaluation of hepatic glutathione transferase Mu 1 and Theta 1 activities in humans and mice using genotype information. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 40 (3), 497-503 (2012).
- Sherratt, P. J., Pulford, D. J., Harrison, D. J., Green, T., Hayes, J. D. Evidence that human class Theta glutathione S-transferase T1-1 can catalyse the activation of dichloromethane, a liver and lung carcinogen in the mouse. Comparison of the tissue distribution of GST T1-1 with that of classes Alpha, Mu and Pi GST in human. The Biochemical Journal. 326 (3), 837-846 (1997).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。