Method Article
Spektrophotometrisches Screening auf potenzielle Inhibitoren von zytosolischen Glutathion-S-Transferasen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Glutathion-S-Transferasen (GSTs) sind Entgiftungsenzyme, die am Stoffwechsel zahlreicher Chemotherapeutika beteiligt sind. Die Überexpression von GSTs korreliert mit der Resistenz gegen Krebschemotherapie. Eine Möglichkeit, diesem Phänotyp entgegenzuwirken, ist die Verwendung von Inhibitoren. Dieses Protokoll beschreibt eine Methode, bei der ein spektrophotometrischer Test verwendet wird, um potenzielle GST-Hemmer zu überprüfen.
Zusammenfassung
Glutathion-S-Transferasen (GSTs) sind metabolische Enzyme, die für die Eliminierung endogener oder exogener elektrophiler Verbindungen durch Glutathionkonjugation (GSH) verantwortlich sind. Darüber hinaus sind GSTs Regulatoren von mitogen-aktivierten Proteinkiinasen (MAPKs), die an apoptotischen Wegen beteiligt sind. Die Überexpression von GSTs korreliert mit einer verminderten therapeutischen Wirksamkeit bei Patienten, die sich einer Chemotherapie mit elektrophilen Alkylierungsmitteln unterziehen. Mit GST-Hemmern kann eine mögliche Lösung sein, um diese Tendenz umzukehren und die Behandlungspotenz zu erhöhen. Um dieses Ziel zu erreichen, ist die Entdeckung solcher Verbindungen mit einem genauen, schnellen und einfachen Enzymtest erforderlich. Ein spektrophotometrisches Protokoll mit 1-Chlor-2,4-Dinitrobenzol (CDNB) als Substrat ist die am häufigsten verwendete Methode in der Literatur. Die bereits beschriebenen GST-Hemmungsexperimente liefern jedoch kein Protokoll, das jede Phase eines optimalen Hemmungstests detailliert beschreibt, wie die Messung der Michaelis-Menten-Konstante (Km) für CDNB oder die Angabe der eingesetzten Enzymkonzentration, entscheidende Parameter zur Beurteilung der Hemmungskraft einer getesteten Verbindung. Daher beschreiben wir mit diesem Protokoll jeden Schritt eines optimierten spektrophotometrischen GST-Enzym-Assays, um Bibliotheken potenzieller Inhibitoren zu überprüfen. Wir erklären die Berechnung sowohl der halbmaximalen hemmenden Konzentration (IC50) als auch der Hemmungskonstante (Ki) – zwei Eigenschaften, die zur Messung der Wirksamkeit eines Enzyminhibitors verwendet werden. Die beschriebene Methode kann mit einem Pool von GSTs implementiert werden, die aus Zellen oder rekombinanten menschlichen GSTs extrahiert werden, nämlich GST alpha 1 (GSTA1), GST mu 1 (GSTM1) oder GST pi 1 (GSTP1). Dieses Protokoll kann jedoch nicht auf GST theta 1 (GSTT1) angewendet werden, da CDNB kein Substrat für diese Isoform ist. Diese Methode wurde verwendet, um die Hemmungskraft von Curcumin mit GSTs aus Pferdeleber zu testen. Curcumin ist ein Molekül, das Anti-Krebs-Eigenschaften zeigt und zeigte Affinität zu GST-Isoformen nach in Silico-Docking-Vorhersagen. in silico Wir haben gezeigt, dass Curcumin ein potenter, wettbewerbsfähiger GST-Hemmer ist, mit einem IC50 von 31,6 ± 3,6 m und einem Ki von 23,2 ± 3,2 m. Curcumin hat das Potenzial, mit elektrophilen Chemotherapie-Medikamenten kombiniert zu werden, um seine Wirksamkeit zu verbessern.
Einleitung
Zytosololische Glutathion-S-Transferase-Enzyme (GSTs, EC 2.5.1.18) katalysieren die Konjugation von Glutathion (GSH) in verschiedene elektrophile Verbindungen, wie Z.B. Chemotherapeutika, um sie leicht aus dem Körper zu entgiftenund zubeseitigen 1 . Sieben Isoformen von zytosolischem GST wurden als Alpha, mu, pi, Sigma, Omega, Theta und Zeta identifiziert. GSTs werden hauptsächlich in der Leber, Hoden, Lunge und Magen-Darm-Trakt2ausgedrückt. Die GST alpha 1 (GSTA1) Isoform ist stark in Hepatozyten exprimiert. Der Körper exezisiert heterogen andere Subtypen, einschließlich GST pi 1 (GSTP1) vorwiegend im Gehirn, Herz und Lunge, und GST mu 1 (GSTM1) in der Leber und Hoden3. Obwohl es eine hohe Sequenzhomologie zwischen DEN GST-Isoformen gibt, weist jede substratspezifität auf und ist auf unterschiedliche Weise am Arzneimittelstoffwechsel und Krebs beteiligt, entsprechend seiner Differentialexpression4,5.
Elektrophile Verbindungen gelangen entweder exogen in den Körper oder werden endogen hergestellt. Pestizide, Prostaglandine, Karzinogene und Chemotherapeutika sind einige der potenziellen Substrate für Glutathion-Konjugationsreaktionen6. Zum Beispiel, jede Elektronen-mangelhafte reaktive Verbindung innerhalb einer Zelle gebildet ist wahrscheinlich ein elektrophiles Substrat zu werden. Alkylierungsmittel wie Chlorambucil oder Melphalan werden als Konjugate von GSH durch GSTs katalysiert eliminiert, und erhöhte Konzentrationen dieser Enzyme wurden mit der Resistenz gegen diese Verbindungenkorreliert 6,7.
Eine weitere wichtige Rolle der zytosolischen GSTs ist die Regulierung der Aktivität von mitogen-aktivierten Proteinkinasen (MAPK) wie MAPK8 (auch bekannt als c-Jun N-Terminal Kinase, oder JNK1) und MAP3K5 (auch bekannt als Apoptose-Signalregulierende Kinase 1, oder ASK1)8. Einige Isoformen in ihrer monomeren Konformation binden an diese Proteine und blockieren so die Phosphorylierungskaskade. Unter normalen Bedingungen wird die GSTP1-Isoform MAPK8 (der Aktivator des c-Jun-Proteins) sequestrieren. Die Kombination des c-Jun mit dem c-Fos-Protein bildet den Transkriptionsfaktor des Aktivatorproteins 1 (AP-1), das für die Transkribierung pro-apoptotischer Gene verantwortlich ist. In gestressten Zellen dissoziiert der von GSTP1 und MAPK8 gebildete Komplex, c-Jun wird aktiviert, und die Gene, die zu Apoptose führen, beginnen9zu exprimieren. Eine größere Expression dieser GST-Isoform könnte daher den Weg blockieren, was zu einer erhöhten Zelllebensfähigkeit, mehr Zellproliferation und einer geringeren zellulären Empfindlichkeit gegenüber Chemotherapie nen. Ähnliche Szenarien können bei Paralogen von GSTP1 auftreten, z. B. GSTM1, das mit MAP3K510interagiert.
Die Rolle der GSTs im Arzneimittelstoffwechsel und bei der Sequestrierung von MAPKs führte zu der Hypothese, dass eine größere Expression von GSTs ein Zeichen für einen Tumorresistenzmechanismus zur chemotherapeutischen Behandlung sein könnte6,11. Zum Beispiel ist GSTP1 bei zahlreichen Krebsarten überexprimiert und seine Anwesenheit wurde mit einer schlechten Prognose und einer erhöhten Inzidenz von Rückfällen korreliert8. Polymorphismus in diesen Genen hat auch gezeigt, differentiale Arzneimittelexposition und Überlebensraten für Patienten, die verschiedene Krankheiten präsentieren, was die Vorstellung verstärkt, dass diese Enzyme entscheidend für Mechanismen der Arzneimittelresistenz sind. Zum Beispiel, Personen mit dem GSTM1 null Genotyp sind mit niedrigeren Medikamentenclearance und besseres Überleben12,13verbunden. Es gibt mehrere mögliche Mittel, um dieser Überexpression entgegenzuwirken, wie die Verwendung von GSH-Analoga, Prodrugs, die durch Konjugation mit GSTs aktiviert werden, oder direkte GST-Hemmer14,15.
Alle diese Methoden werden derzeit untersucht, und einige Verbindungen haben klinische Studien für ihre mögliche Verwendung bei Patienten begonnen. Nach bestem Wissen und Gewissen sind jedoch keine Verbindungen als GST-Hemmer in klinischen Umgebungen im Einsatz15. Tatsächlich sind ein Mangel an Spezifität für bestimmte Isoformen oder die Erschöpfung von GSH in normalen Zellen, die zu Toxizitäten führen können, die durch die Anhäufung von reaktiven Sauerstoffspezies (ROS) in Organsystemen verursacht werden, nur einige der Nachteile, die das Potenzial von GST-Hemmern14,15reduzieren. Das Risiko, dass diese Verbindungen andere pharmakodynamische Auswirkungen auf den Körper ausüben könnten, schränken auch ihre Verwendung ein. Ethakrynsäure, zum Beispiel, ist der am häufigsten untersuchte GST-Hemmer in Laborumgebungen, aber weil es in erster Linie als starkes Diuretikum verwendet wird, begrenzt diese Eigenschaft seine Verwendung in Kombination mit anderen Medikamenten in klinischen Umgebungen. Curcumin ist eine weitere natürliche Verbindung erfolgreich als GST-Hemmer gescreent. Dieses Molekül ist ein Polyphenolether aus der Curcuma longa Art von Kurkuma extrahiert. Es hat vielversprechende Ergebnisse als eine mögliche Behandlungsoption gegen Krebs gezeigt, indem die Apoptose verschiedener Arten von Tumorzelllinien16,17induzieren. Die Verbindung kann verschiedene zelluläre Wege regulieren, wie die Tyrosinkinase18 oder die GST-Signalweg. Studien mit reinen Proteinen haben seine Hemmungskraft auf GSTA1, GSTM1 und GSTP119,20gezeigt. Jedoch wurden widersprüchliche Ergebnisse in Krebszellen beobachtet, wo eine größere intrazelluläre GST-Aktivität gemessen wurde, wenn Zellen mit Curcumin21behandelt wurden. Daher ist es wichtig, die halbmaximale hemmende Konzentration (IC50) und die Hemmungskonstante (Ki) eines vermeintlichen GST-Inhibitors unter Verwendung eines klar beschriebenen Protokolls mit ordnungsgemäßen Kontrollen zu untersuchen, bevor weitere zelluläre Experimente geplant werden.
Das Screening und testen potenzieller neuer GST-Hemmer ist daher von erheblichem klinischem Interesse, und jede neue Verbindung muss sicher und effizient für den Einsatz in Kombination mit elektrophilen Medikamenten sein. Die Fokussierung der Forschung auf isoformspezifische Inhibitoren könnte eine GST-Hemmung in Tumorgeweben mit spezifischen Mustern der GST-Expression ermöglichen und somit die Entwicklung einer effektiven Kombinationstherapie ermöglichen. Die Suche nach Inhibitoren mit unterschiedlichen Hemmungsmodi könnte ebenfalls von Interesse sein. Zum Beispiel kann ein Wettbewerbsinhibitor, der GSH als Substrat verwendet, seine Erschöpfung induzieren. Diese Reduktion der GSH-Konzentration in Zellen wurde gezeigt, um oxidativen Stress in Neuronen zu induzieren, was zu Apoptose. Eine andere gängige Art der Hemmung – eine nicht wettbewerbsfähige Hemmung – kann nicht rückgängig gemacht werden, selbst wenn das Substrat in hohen Konzentrationen vorhanden ist.
Die Geschwindigkeit der enzymatischen Aktivität wird durch die Michaelis-Menten-Konstante (Km) und die maximale Geschwindigkeit (Vmax) dargestellt, die durch Plotten eines Michaelis-Menten-Graphens mit der Substratkonzentration gegen die Reaktionsgeschwindigkeit23bestimmt werden kann. Km ist die Konzentration von Substrat, die erforderlich ist, um die Hälfte der enzymatischen aktiven Stellen zu besetzen, was bedeutet, dass ein hohes Km weniger Affinität darstellt. Vmax stellt die maximale Geschwindigkeit der Reaktion dar, die erreicht wird, wenn alle aktiven Stellen vom Substrat belegt werden. Km ist gleich halb Vmax. Es gibt drei am häufigsten geghemmende Arten der Hemmung: wettbewerbsfähig, nicht wettbewerbsfähig und nicht wettbewerbsfähig. Bei Wettbewerbshemmung bindet der Inhibitor an die aktive Stelle des Enzyms und konkurriert mit dem Substrat. Daher ändert sich Vmax nicht nach Zugabe des Inhibitors, sondern Km erhöht sich, da mehr Substrat benötigt wird, um der Hemmung entgegenzuwirken. Eine nicht wettbewerbsfähige Hemmung tritt nur auf, wenn das Substrat einen Komplex mit dem Enzym bildet. In diesem Fall, da der Hemmungsgrad von der Substrat- und Enzymkonzentration abhängt, verringern sich Vmax und Km, wenn der Inhibitor der Reaktion zugesetzt wird. Die letzte Art der Hemmung ist nicht wettbewerbsfähig und ist eine Mischung aus den beiden anderen Hemmungsmustern. Der Inhibitor kann an die aktive Stelle des Enzyms binden, unabhängig davon, ob das Enzym an sein Substrat gebunden ist oder nicht. Hier nimmt Vmax nach Zugabe des Inhibitors ab, aber Km ändert sich nicht24.
Ein spektrophotometrischer Test, der die GST-Aktivität misst, wurde erstmals 1974 von Habig et al. unter Verwendung von 1-Chlor-2,4-Dinitrobenzol (CDNB) als Substrat für die Reaktion22entwickelt. Die Konjugation zwischen GSH und CDNB bildet GS-DNB, das eine maximale Lichtabsorption bei einer Wellenlänge von 340 nm aufweist, die mit einem Spektralphotometer beschreibbar ist. Der größte Teil der unten erläuterten Technik stammt von Habig et al. ab, einschließlich Informationen über die besten Einstellungen und wichtige Optimierungspunkte für einen hemmenden Test. Die Technik kann auf das Screening potenzieller GST-Hemmer angewendet werden, unabhängig davon, ob sie durch rationale Arzneimittelauswahl mittels Computervorhersagen oder durch Literaturrecherche ausgewählt werden. Wie das Protokoll an neu synthetisierte GST-Proteine oder spezifische Isoformen angepasst werden kann, wird ebenfalls diskutiert. Beispielsweise könnte die Prüfung der hemmenden Wirksamkeit von GST-Isoformen, die einen klinisch relevanten Polymorphismus aufweisen, oder von Single-Nukleotid-Polymorphismen (SNPs) potenzielle Anwendungen für dieses Protokoll sein, die auf patientenspezifische GSTs abzielen.
Dieses Protokoll bietet eine schnelle, praktikable und wirksame Methode zum Screening potenzieller GST-Inhibitoren in vitro vor allen anderen funktionellen Studien. Die Schritte, die erforderlich sind, um die am häufigsten gemessenen Eigenschaften eines enzymatischen Inhibitors zu bewerten, werden beschrieben: die hemmende Konzentration 50 (IC50), die Konzentration des Inhibitors ist, die erforderlich ist, um die enzymatische Aktivität um die Hälfte zu verringern; und die Konstante der Hemmung (Ki), die die Gleichgewichtskonstante der Dissoziation zwischen dem Inhibitor und dem Enzym darstellt, charakteristisch für die Affinität zwischen diesen beiden Molekülen. Diese beiden Werte werden durch nichtlineare Regression und unter Verwendung von Gleichungen gemessen, die für jede Hemmungsart spezifisch sind. Wir zeigen auch die Beurteilung dieses Hemmungsmusters, indem wir Michaelis-Menten-Plots verwenden, um die Veränderung von Vmax und Km nach Zugabe des Inhibitors23,25,26zu bestimmen.
Protokoll
1. Herstellung der GST-Enzymlösung
HINWEIS: Das Verfahren zur Herstellung der Enzymlösung hängt davon ab, ob die Einheiten der enzymatischen Aktivität vor dem Test bekannt sind oder nicht. Eine enzymatische Einheit ist die Menge an Enzym, die benötigt wird, um 1 Mol Produkt pro Minute zu synthetisieren. Die enzymatische Aktivität wird in Einheit/ml oder mol/min/mL dargestellt und hängt von der Verdünnung der enzymatischen Lösung ab. Die spezifische enzymatische Aktivität wird in Einheit/mg oder mol/min/mg dargestellt und hängt ausschließlich von der Reinheit der Lösung ab. Beide Merkmale werden im Folgenden bestimmt. Wenn die enzymatische Einheit einer isolierten GST-Isoform unbekannt ist, muss sie geschätzt werden, um die enzymatischen Konzentrationen für jede Reaktion anzupassen und reproduzierbare Ergebnisse zu liefern.
- Wenn die enzymatische Einheit der GST, die im Test verwendet wird, bekannt ist:
- Bereiten Sie eine frische Stammlösung des GST-Enzyms bei 0,1 U/ml in Wasser vor und fahren Sie dann mit Schritt 2 fort.
HINWEIS: Diese Lösung kann bei -20 °C in Aliquots für mehrere Monate oder bei -80 °C für längere Zeiträume gelagert werden, aber der Frost-/Tauzyklus muss vermieden werden.
- Bereiten Sie eine frische Stammlösung des GST-Enzyms bei 0,1 U/ml in Wasser vor und fahren Sie dann mit Schritt 2 fort.
- Wenn die enzymatische Einheit der GST, die im Test verwendet wird, unbekannt ist:
- Quantifizieren Sie die Proteinkonzentration der Enzymlösung mit einem Bicinchoninsäure(BCA) Protein-Assay oder einem anderen Kit.
- Verdünnen Sie die Proteinlösung auf eine endgültige Proteinkonzentration von 0,02 mg/ml.
- Fügen Sie 20 l der Enzymlösung, 20 l GSH 25 mM (Molekulargewicht: 307,32 g/mol) und 150 l der phosphatgepufferten Kochchen von Dulbecco (DPBS) zu einer 96-Well-Platte hinzu. Für den Rohling 20 l Wasser anstelle der Enzymlösung hinzufügen.
- Fügen Sie jedem Brunnen 10 l CDNB 50 mM (Molekulargewicht: 202,55 g/mol) Substrat hinzu.
- Stellen Sie auf einem spektrophotometrischen Mikroplattenleser die Parameter für das Lesen der Bohrungen auf 340 nm ein. Es wird empfohlen, die Absorption jede Minute für 10 Minuten zu messen.
- Setzen Sie die Platte in den Mikroplattenleser ein, und starten Sie den Messwert gemäß den Einstellungen von Schritt 1.2.5.
- Berechnen Sie die Änderung der Absorption pro Minute für die enzymatischen Proben und den Rohling.
HINWEIS: Stellen Sie sicher, dass die Reaktion linear ist, indem Sie die Absorption auf der y-Achse und Minuten auf der x-Achse zeichnen. Wenn die Reaktion nicht linear ist und ein Plateau erreicht, bedeutet dies, dass das gesamte Substrat verwendet wird und die Reaktion zu schnell ist. Reduzieren Sie also die Menge an Enzym, die dem Brunnen zugesetzt wird, indem Sie die Stammlösung um zwei verdünnen. - Korrigieren Sie die Absorptionswerte der Testproben.
- Berechnen Sie mit Gleichung 1, die das Beer-Lambert-Gesetz darstellt, die Konzentration von GS-DNB, die (in M) durch die Reaktion pro Minute gebildet wird.
Gleichung 1: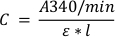
wobei C die Konzentration des Substrats in M ist, Ist A340/min die Veränderung der Absorption pro Minute, gemessen in Schritt 1.2.7, ε ist der Molaren-Aussterbekoeffizient für das CDNB-Konjugat bei 340 nm (0,0096-1*cm-1), und l ist die Länge des Lichtwegs im Brunnen (in cm). Bei einer 96-Well-Platte, die mit einer enzymatischen Lösung von 200 l gefüllt ist, beträgt die Bahnlänge etwa 0,55 cm. Dieser Wert kann je nach Plattenmodell variieren und sollte mit dem Hersteller überprüft werden. - Um die Menge des In-Werts in einem Brunnen in mol/min zu bestimmen, multiplizieren Sie die Ergebnisse, die mit Gleichung 1 gefunden wurden, mit dem Lösungsvolumen, 2 x 10-4 L.
- Normalisieren Sie die Aktivität pro verwendeter Proteinmenge, indem Sie die Ergebnisse von Schritt 1.2.9 durch 4 x 10-4 mg dividieren. Das Ergebnis ist die spezifische enzymatische Aktivität in Einheit/mg oder Mol/min/mg.
HINWEIS: Wenn die Verdünnung in Schritt 1.2.6 aufgrund einer nichtlinearen Reaktion geändert wurde, passen Sie die Proteinmenge entsprechend an. - Um die enzymatische Aktivität zu finden, passen Sie die Ergebnisse an die Proteinkonzentration in mg/ml an, indem Sie die spezifische enzymatische Aktivität in Schritt 1.2.10 mit 0,002 mg/ml multiplizieren. Dadurch wird die enzymatische Aktivität in Einheit/ml oder mol/min/mL ergeben.
HINWEIS: Im Gegensatz zur enzymatischen Aktivität ändert sich diese Maßnahme nicht, abhängig von der Verdünnung der Proteinlösung. Gleiche Note wie Schritt 1.2.10, aber für die Proteinkonzentration. - Bereiten Sie eine Stammlösung des GST-Enzyms bei 0,1 Einheit/ml in Wasser vor und fahren Sie dann mit Schritt 2 fort.
HINWEIS: Diese Lösung kann bei -20 °C in Aliquots für mehrere Monate oder bei -80 °C für längere Zeiträume gelagert werden, aber der Frost-/Tauzyklus muss vermieden werden. Die Kontrolle der enzymatischen Aktivität wird empfohlen, wenn die Experimente über einen längeren Zeitraum durchgeführt werden, da ein Abbau der Proteinlösung auftreten kann.
2. Messung der Michaelis-Menten-Konstante der GST-Isoform für CDNB
HINWEIS: Das Verfahren wird für ein CDNB-Substrat erklärt, kann aber auf jedes andere Substrat, z. B. GSH, angewendet werden. Jede CDNB-Konzentration benötigt einen eigenen Rohling, da die Absorption bei 340 nm entsprechend der CDNB-Konzentration zunimmt.
- Bereiten Sie sechs verschiedene Konzentrationen von CDNB vor, die von 10 mM bis 100 mM, in Ethanol 95% (v/v) reichen.
- Bereiten Sie die Assay-Lösung vor, mit 10 l CDNB, 20 L GST-Enzym, 20 l GSH 25 mM und 150 L DPBS. Für den Rohling statt der CDNB-Lösung nur 10 l Ethanol 95% hinzufügen.
- Bereiten Sie einen Rohling für jede CDNB-Konzentration vor, mit 10 l CDNB, 20 l Wasser, 20 l GSH 25 mM und 150 l DPBS.
- Nehmen Sie die Absorption bei 340 nm pro Minute für 10 Minuten mit einem Mikroplattenleser auf.
- Die Absorption scorrectieren, indem Sie die Ergebnisse vom Rohling von dem der richtigen anderen Testbrunnen subtrahieren. Berechnen Sie gemäß den gemessenen Werten die Geschwindigkeit der Reaktion mit Gleichung 2.
Gleichung 2: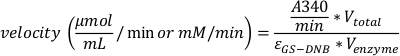
wobei A340/min die experimentell ermittelte Veränderung der Absorption pro Minute, V-Gesamtvolumen 0,2 ml,V-Enzym (Enzymvolumen) 0,02 ml und εGS-DNB der molare Aussterbekoeffizient des GS-DNB-Konjugats bei 340 nm (9,6 mM-1*cm-1 )ist. In einem 200-L-Brunnen einer 96-Well-Platte beträgt die Bahnlänge 0,55 cm (je nach Plattentyp) und der Aussterbekoeffizient beträgt 5,3 mM-1. Die Geschwindigkeit kann entweder durch mol/mL/min oder mM/min dargestellt werden. - Plotten Sie den Michaelis-Menten-Graphen mit der Geschwindigkeit (auf der y-Achse) gegen die Substratkonzentration (auf der x-Achse).
- Definieren Sie die maximale Geschwindigkeit (Vmax) der Reaktion und die Michaelis-Menten-Konstante (Km) (d.h. die Substratkonzentration bei der Hälfte von Vmax).
HINWEIS: Mit Hilfe von Software wie GraphPad Prism kann die Enzymkinetikkurve mit einer nichtlinearen Regression für die Berechnung der Michaelis-Menten-Enzym-Kinetikparameter wie Vmax und Kmangepasst werden. - Bereiten Sie eine CDNB-Lagerlösung zum 20-fachen des berechneten Km in Ethanol 95% (v/v) vor.
3. Absorption des potenziellen GST-Inhibitors
HINWEIS: Dieser Schritt wird durchgeführt, um zu untersuchen, ob der potenzielle GST-Hemmer, der in der Reaktion verwendet wird, einen Metaboliten produziert, der die Absorption bei der gemessenen Wellenlänge erhöht. Wenn dies der Fall ist, hat die Menge des verwendeten Inhibitors einen Einfluss auf die Ergebnisse, und für jede Konzentration sollte ein spezifischer Rohling vorbereitet werden.
- Verdünnen Sie den Inhibitor auf die erforderlichen Konzentrationen.
HINWEIS: Bereiten Sie drei verschiedene Verdünnungen vor, vorzugsweise die niedrigsten, mittleren und höchsten Konzentrationen, die während des Hemmungstests getestet wurden. Die maximale DMSO-Konzentration im Brunnen sollte 1 % (v/v) betragen. Wir testeten die Wirkung der DMSO-Konzentration auf den Test in unserem Labor, und 1% haben die GST-Aktivität nicht signifikant verändert. - In einer 96-Well-Platte fügen Sie 2 l des potenziellen GST-Inhibitors, 20 l GSH 25 mM und 168 l DPBS hinzu. Verwenden Sie eine geeignete Kontrolle ohne Inhibitor, indem Sie gleiche Volumina des Lösungsmittels hinzufügen, das für die Inhibitorproben verwendet wird.
- Inkubieren Sie die Reaktion für 10 Minuten, um die enzymatische Reaktion zu beginnen.
HINWEIS: Dieser Schritt kann optimiert werden, indem verschiedene Inkubationszeiten getestet werden, mit dem doppelten Ziel, die Reaktion zu beginnen und gleichzeitig eine vollständige Erschöpfung des Substrats zu vermeiden. - Fügen Sie jedem Brunnen 10 l CDNB hinzu, um eine endgültige Konzentration am In- und Km in Schritt 2 zu erreichen.
- Schütteln Sie die Platte für einige Sekunden.
- Nehmen Sie die Absorption bei 340 nm pro Minute für 10 Minuten mit einem Mikroplattenleser auf.
- Berechnen Sie die Änderung der Absorption pro Minute.
- Überprüfen Sie die Veränderung der Absorption im Vergleich zur Leerreaktion und der negativen Kontrollreaktion ohne Inhibitor.
- Wenn es eine signifikante Änderung gibt, verwenden Sie für jede Inhibitorkonzentration Leerling, um die Ergebnisse anzupassen.
HINWEIS: Dieses Ergebnis zeigt an, dass die Bestandteile der Reaktion ohne GST-Enzym spontan reagieren und einen Metaboliten produzieren, der die Absorption bei 340 nm erhöht. Um diese zusätzliche Absorption zu korrigieren, sollte für jede Konzentration ein spezifischer Rohling gemessen werden. - Wenn es keine signifikante Änderung der Absorption gibt, verwenden Sie für alle Konzentrationen einen allgemeinen Rohling, der nur das für die VERdünnung des GST-Inhibitors verwendete Lösungsmittel enthält.
- Wenn es eine signifikante Änderung gibt, verwenden Sie für jede Inhibitorkonzentration Leerling, um die Ergebnisse anzupassen.
4. Hemmungstest der GST- und IC50-Bewertung
- Bereiten Sie neun Konzentrationen des potenziellen GST-Hemmers vor.
HINWEIS: Die Konzentrationen können entsprechend den Ergebnissen angepasst werden. Ziel ist es, die unteren und oberen Hochebenen der nichtlinearen Regressionskurve zu definieren. Weitere Informationen zu diesem Schritt finden Sie im Diskussionsabschnitt. - Bereiten Sie die Assay-Lösung vor, indem Sie 20 l der GSH-Lösung bei 25 mM mit 148 l DPBS verdünnen. Passen Sie das Volumen an die Anzahl der Brunnen an, die im Test verwendet werden.
- Bereiten Sie in einer klaren 96-Well-Platte die enzymatische Reaktion in einem Endband von 190 l vor. Es wird empfohlen, für diese Schritte eine Mehrkanalpipette zu verwenden.
- Für die Testbohrungen fügen Sie 20 l der Enzymlösung, 2 l der potenziellen GST-Hemmerlösung und 168 l der Assay-Lösung hinzu.
- Zur Kontrolle fügen Sie 20 l der Enzymlösung, 2 l des für den GST-Inhibitor verwendeten Verdünnungsstoffs und 168 l der Assaylösung hinzu.
- Für die Rohbrunnen 20 l Wasser, 2 l des potenziellen GST-Inhibitors und 168 l der Assaylösung hinzufügen.
HINWEIS: Wenn der GST-Hemmer die 340 nm Wellenlänge absorbiert, sollte für jede getestete Konzentration ein spezifischer Rohling vorbereitet werden.
- Fügen Sie jedem Bohrwert 10 l der CDNB-Lösung mit 20x Km hinzu, einschließlich des Rohlings. Es wird empfohlen, für diesen Schritt eine Mehrkanalpipette zu verwenden.
- Schütteln Sie die Platte für einige Sekunden.
- Messen Sie die Absorption bei 340 nm pro Minute für 10 Minuten mit einem Mikroplattenleser.
- Die Absorption scorrectieren, indem Sie die Ergebnisse aus dem Testbrunnen leer ziehen.
- Normalisieren Sie die Ergebnisse, indem Sie die mit der GST-Inhibitorlösung erhaltenen Werte durch die Absorption der Kontrolle pro Minute ohne Inhibitor dividieren.
- Zeichnen Sie die nichtlinearen Regressionsdiagramme der logarithmischen Konzentration (x-Achse) des Inhibitors gegen die GST-Aktivität (y-Achse) und bestimmen Sie so den IC50.
HINWEIS: GraphPad Prism berechnet den IC50 aus den nichtlinearen Regressionsdiagrammen, indem es die Konzentration vorhersagt, die 50 % der enzymatischen Aktivität im Steuerelement anzeigt. Die Vorhersage basiert auf den unteren und oberen Plateaus sowie auf der Kurve der Steigung, die durch das Sigmoiddiagramm gebildet wird.
5. Beurteilung des Kiund der Art der Hemmung
- Bereiten Sie vier verschiedene CDNB-Konzentrationen vor: drei höhere und eine gleich dem zuvor gefundenen Km.
- Bereiten Sie drei verschiedene GST-Hemmerkonzentrationen vor, die dem zuvor gefundenen IC50 entsprechen oder darunter liegen.
- Führen Sie den Inhibitionstest wie in den Schritten 4.2 bis 4.7 beschrieben durch.
- Berechnen Sie die Geschwindigkeit der Reaktionen mit Gleichung 2.
- Plotten Sie die Michaelis-Menten-Diagramme für jede Inhibitorkonzentration und berechnen Sie die Vmax und Km jeder Reaktion.
- Bewerten Sie nach den Veränderungen in Vmax und Km bei Verwendung unterschiedlicher Konzentrationen die Hemmungsart des GST-Inhibitors.
HINWEIS: Dieser Schritt wird in den Ergebnis- und Diskussionsabschnitten ausführlicher erläutert. - Berechnen Sie basierend auf der Hemmungsart das Ki.
HINWEIS: In GraphPad Prism werden verschiedene Gleichungen verwendet, um das Ki entsprechend der Art der Hemmung zu berechnen. Die verwendeten Gleichungen basieren auf dem beobachteten Km und Vmax nach Zugabe des Inhibitors und im Vergleich zu den Km und Vmaxder Steuerung.
Ergebnisse
Michaelis-Menten-Konstante (Km) von CDNB mit GST aus Pferdeleber
Curcumin ist eine sichere natürliche Verbindung auch nach der Einnahme bei höheren Dosen27, die Anti-Krebs-Eigenschaften zeigte16. Die hemmende Wirksamkeit dieses Moleküls wurde auf menschlichen rekombinanten GSTs19,20gezeigt. Durch die Verwendung des beschriebenen Protokolls haben wir curcumins Wirkung auf die GST-Aktivität mit einem Pool von GST-Isoformen aus der Pferdeleber bewertet. Nach Angaben des Lieferanten beträgt die spezifische Aktivität dieser Mischung von Proteinen 25 U/mg. Durch Lösen des lyophilisierten Pulvers in der entsprechenden Wassermenge wurde eine Stammlösung von 0,1 U/ml hergestellt. Ethakrynsäure wurde parallel als positiv zu kontrollieren verwendet, da diese Verbindung der am häufigsten verwendete GST-Hemmer in Studien ist. Die Schritte bei der Einrichtung eines GST-Aktivitätstests und der Prüfung von Inhibitoren sind in Abbildung 1beschrieben.
Das Km muss für jede Enzymsubstratreaktion definiert werden, da die Verwendung der Substratkonzentration, die Km entspricht, keine Verzerrung hinsichtlich der Bestimmung der Hemmungsart28gewährleisten würde. Sechs verschiedene Konzentrationen von CDNB, von 0,5 mM bis 5 mM, wurden getestet, um diesen Parameter mit einer festen Konzentration von 2,5 mM GSH zu messen.
Das Endvolumen der Reaktion betrug 200 l, in einer 96-Well-Platte. Für jedes Experiment wurde ein spezifisches Rohling verwendet, wobei die gleiche Konzentration von CDNB wie der Testgut verwendet wurde, da eine spontane Konjugation von CDNB und GSH auftreten und die Absorption erhöhen konnte. Für alle Reaktionen wurde eine endgültige Enzymkonzentration von 0,01 Einheit/ml verwendet, indem dem Assay-Mix 20 l der Stammlösung hinzugefügt wurden. Die Absorption bei 340 nm wurde jede Minute für 10 Minuten aufgezeichnet. Die Geschwindigkeit (in mM/min) der Reaktion wurde mit Gleichung 2berechnet. Ein Michaelis-Menten-Diagramm wurde der Substratkonzentration (mM) gegen die Geschwindigkeit (M/min)(Abbildung 2) aufgeplottet und das Km der Reaktion berechnet. Das Experiment wurde wiederholt, bis mindestens drei Datensätze ähnliche Ergebnisse zeigten. Das Km CDNB mit GST aus Pferdeleber wurde mit 0,26 ± 0,08 mM gemessen. Für jeden hemmenden Test mit dieser Charge von GSTs wurde eine Konzentration von 0,2 mM CDNB verwendet.
Bei Experimenten mit Curcumin, das allein mit GSH und CDNB inkubiert wurde, wurde keine spontane Bildung eines Metaboliten gemessen, der bei 340 nm absorbiert wurde. Derselbe Rohling wurde für jede Inhibitorkonzentration in jedem Experiment verwendet.
Curcumins hemmende Potenz auf GSTs
Curcumins hemmende Potenz wurde mit einer in silico Docking Simulation mit Software vorhergesagt (z.B. AutoDock Vina Version 1.1.2). 29 Die freie Bindungsenergie zwischen verschiedenen GST-Isoformen (nämlich GSTA1, GSTM1 und GSTP1) und Curcumin wurde vorhergesagt (Daten nicht dargestellt). Dann wurde die Hemmungskonstante Ki mit Gleichung 3berechnet.
Gleichung 3: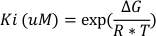
wobei ∆G die freie Bindungsenergie ist, die mit der in silico-Analyse gefunden wird, R die Gaskonstante von 1.987 cal*K-1*mol-1ist und T die Temperatur während des Experiments ist, in diesem Fall in Kelvin (298 K).
Basierend auf den vom AutoDock Vina zurückgegebenen Freibindungsenergieergebnissen ist Curcumin ein potenter GST-Hemmer für humane GSTA1, GSTM1 und GSTP1 mitK-i-Werten von 78,1 m, 78,1 m bzw. 27,4 M. Die ersten hemmenden Assays wurden mit diesen rechnerischen Ki-Schätzungen durchgeführt, und die Konzentrationen wurden bei Bedarf entsprechend den Ergebnissen angepasst.
Zunächst wurde der IC50 geschätzt. Diese Eigenschaft ist die Konzentration des Inhibitors, die die Reaktionsrate eines Enzyms um 50% reduziert. Es ist daher abhängig von der Enzymkonzentration30. Es wurden neun Endkonzentrationen des Inhibitors vorbereitet, die von 0,39 bis 100 m reichen und jede Konzentration doppelt so hoch sind wie die des vorherigen. Die Assay-Lösung bestand aus 20 l GSH 2,5 mM, 20 l GST aus Pferdeleber bei 0,01 U/ml End, 2 l der Curcumin-Lösung und 148 l PBS. Die Kontrolle bestand aus der gleichen Lösung mit dem für Curcumin verwendeten Verdünnungsmittel. Diese Mischung wurde für 15 Minuten inkubiert, um den Enzymtest zu beginnen und den Abbau des Curcumins in der Assaylösung zu vermeiden, da diese Verbindung in Pufferlösungen instabil ist31. Als nächstes wurde jedem Brunnen 10 l CDNB-Lösung bei 4 mM beieiner Endkonzentration von 0,2 mM CDNB hinzugefügt. Die Absorption bei 340 nm wurde jede Minute für 10 Minuten aufgezeichnet, um Veränderungen der Absorption pro Minute zu berechnen. Um den IC50 zu berechnen, wurde jede mit Curcumin inkubierte Probe auf die Kontrolle normalisiert, um den Prozentsatz der Aktivität zu geben. Diese Ergebnisse wurden mit der Plotting-Software analysiert, indem die nichtlineare Regression der logarithmischen Konzentration des Inhibitors im Vergleich zur Hemmung berechnet wurde. Der IC50 für Curcumin auf GST aus Pferdeleber gefunden wurde, war 31,6 ± 3,6 M (Abbildung 3A).
Das gleiche Experiment wurde parallel mit Ethakrynsäure als Positivkontrolle durchgeführt, mit Konzentrationen von 0,39 bis 100 M, wie bei Curcumin. Es wurde festgestellt, dass der IC50 6,6 ± 1,1 M beträgt (Abbildung 3B).
Der nächste Schritt war, Curcumins Hemmungsmodus auf diese Transferasen zu bewerten. Es wurden vier verschiedene Konzentrationen von Curcumin getestet: 0, 7,5, 15 und 30 m, zusammen mit vier verschiedenen Konzentrationen von CDNB: 0,2, 0,4, 1 und 1,5 mM. Das Protokoll war das gleiche wie beim vorherigen Experiment. Die Geschwindigkeit jeder Bedingung wurde mit Gleichung 2berechnet. Für jede Inhibitorkonzentration wurde eine Kurve mit der Geschwindigkeit (in M/min) gegen die Substratkonzentration (mM)(Abbildung 3C)dargestellt. Die Vmax und Km wurden basierend auf jedem Plot mit GraphPad Prism bestimmt. Die Hemmungsmethode des potenziellen Inhibitors wurde anhand der Veränderungen dieser beiden Parameter und des unterschiedlichen Zustands der Assays bewertet. 24 Da sich Vmax zwischen den Bedingungen nicht signifikant änderte, aber Km mit den verschiedenen Inhibitorkonzentrationen zunahm, ist curcumins Hemmung von GSTs konkurrenzfähig. Dieses Hemmungsmuster tritt auf, wenn der Inhibitor mit dem Substrat um die aktive Stelle des Enzyms konkurriert. Um das Ki eines Wettbewerbsinhibitors zu messen, verwendet GraphPad Gleichung 4 und Gleichung 5, wie von Copeland et al.32beschrieben.
Gleichung 4: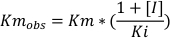
Gleichung 5: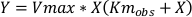
wobei Km obs die beobachtete Michaelis-Menten-Konstante ist, Km die Michaelis-Menten-Konstante der Steuerung ist, [I] die Inhibitorkonzentration ist, Ki die Konstante der Hemmung, Y die Geschwindigkeit und X die Substratkonzentration.
Die Berechnungen basieren auf den gleichen Experimenten wie die Beurteilung der Hemmungsart. Das Ki, das für die Hemmung von GST durch Curcumin aus der Pferdeleber geschätzt wurde, betrug 23,2 ± 3,2 m.
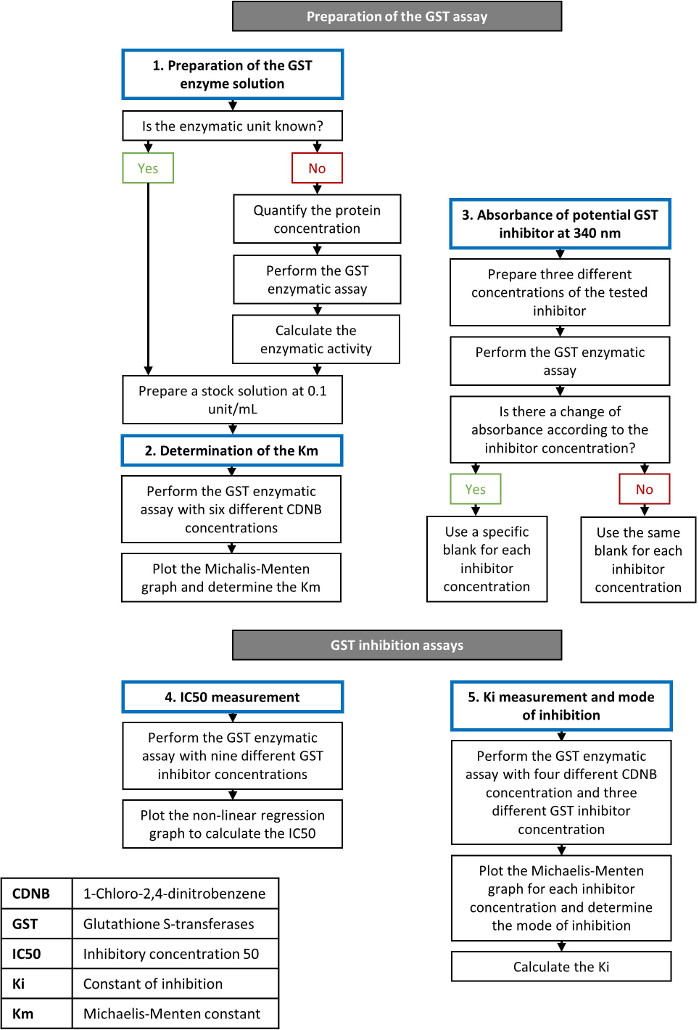
Abbildung 1: Flussdiagramm, das die Schritte der GST-Enzym- und Hemmungstests beschreibt. Einzelheiten zum Verfahren finden Sie im Protokollabschnitt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
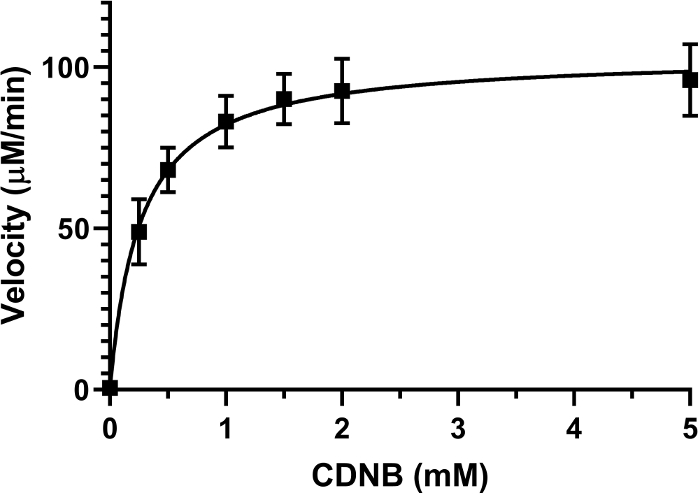
Abbildung 2: Michaelis-Menten-Diagramm der GST-Enzymaktivität. Erhöhte Konzentration des Substrats CDNB wurde mit einer festen Konzentration von GSH (2,5 mM) verwendet, um die GST-Aktivität aus einem Pool von GST aus Pferdeleber zu bestimmen. Der Km-Wert für CDNB wurde je nach Kurve des Graphen als 0,26 ± 0,08 mM ermittelt. Jeder Datenpunkt auf dem Plot stellt den Mittelwert von vier verschiedenen experimentellen Durchläufen mit SD dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
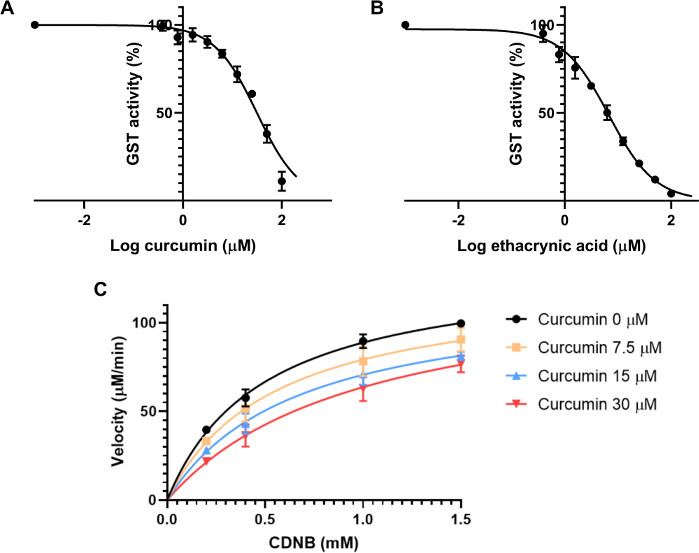
Abbildung 3: Wirkung von Curcumin und Ethakrynsäure auf die GST-Enzymaktivität. (A-B) Die Zugabe von steigenden Konzentrationen von Curcumin (A) oder der positiv kontrollierenden Ethakrynsäure (B), wobei die gleichen GST (0,01 U/ml), GSH (2,5 mM) und CDNB (0,2 mM) Endkonzentrationen verwendet wurden, um die IC50 beider Verbindungen für GST aus Pferdeleber mit einer nichtlinearen Regression zu berechnen. IC50 wurde als 31,6 ± 3,6 m für Curcumin und 6,6 ± 1,1 m für Ethakrynsäure bestimmt. (C) Michaelis-Menten-Plot mit unterschiedlichen Konzentrationen von Curcumin, getestet gegen unterschiedliche Konzentrationen von CDNB-Substrat, die auf eine wettbewerbsfähige Hemmungsweise hindeuten. Ohne Inhibitor wurden Vmax und Km mit 132,7 ± 4,6 m bzw. 0,5 ± 0,08 m gemessen. Mit 30 'M Curcumin, Vmax und Km waren 130,4 ± 13,1 m und 1,08 ± 0,39 m. Datenpunkte in allen Graphen (A-C) stellen die Mittel von drei verschiedenen Experimentellen Durchläufen mit SD dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir bieten ein Protokoll, das jeden Schritt eines spektrophotometrischen GST-Enzym-Assays beschreibt, um vermeintliche Inhibitoren zu überprüfen (Abbildung 1, Tabelle 1) und ihre hemmende Potenz zu quantifizieren. Wir hoben auch die wichtigsten Kriterien hervor, die für genaue Enzymtests zu berücksichtigen sind, die reproduzierbare Ergebnisse liefern. Wesentliche Vorteile des beschriebenen Protokolls gegenüber anderen kolorimetrischen Methoden oder Massenspektrometrie ist, dass dieses Protokoll schnell und einfach durchzuführen ist und quantitative Messungen der GST-Aktivität sowie der Hemmungskraft von geschirmten Molekülen liefert.
Wir stellen die Art und Weise der Berechnung der beiden wichtigsten Michaelis-Menten-Parameter eines Enzyminhibitors vor: den IC50 und den Ki. Ein potenter Inhibitor übt die niedrigstmöglichen Ki und IC50 aus, was darauf hinweist, dass die Affinität zwischen dem Inhibitor und dem Enzym hoch ist30. Da IC50 von der Enzymkonzentration und den Assay-Bedingungen33abhängig ist, kann es schwierig sein, diesen Wert zu verwenden, um Inhibitoren aus verschiedenen Experimenten zu vergleichen oder mit anderen Assay-Bedingungen zu erhalten34. Die Verwendung der Hemmungskonstante Ki ist ein besserer Indikator für die hemmende Potenz potenzieller Verbindungen. Ki kann verwendet werden, um zwei Inhibitoren mit verschiedenen Hemmungsmodi zu vergleichen, da es ausschließlich auf der Affinität zwischen dem Inhibitor und dem Enzym beruht. Um jedoch eine klare Vorstellung von der Art der Hemmung zu haben, muss man beide Parameter des Inhibitors30bestimmen. Wir maßen Curcumine IC50 und Ki als 31,6 ± 3,6 m bzw. 23,2 ± 3,2 m, was darauf hindeutet, dass diese Verbindung ein potenter GST-Hemmer ist. Diese Ergebnisse bestätigten die in silico Vorhersagen, die die Ki-Werte zwischen 27,4 und 78,1 m für verschiedene menschliche GST-Isoformen und Curcumin schätzten.
Enzymatische Aktivität oder Reaktionsrate und Enzymmenge
Wie oben erwähnt, ist IC50 von der Enzymkonzentration abhängig, und die Durchführung eines Experiments mit einem unbekannten Grad an enzymatischer Aktivität könnte zu falschen Schlussfolgerungen führen33. Um andere Faktoren zu kontrollieren, die die hemmende Aktivität verringern könnten, sollte man die enzymatische Aktivität für jede neue Charge von GSTs berücksichtigen und messen. Zum Beispiel könnte der Abbau einer enzymatischen Charge, verursacht durch zu viele Frost-/Tauzyklen, die Aktivität verringern und somit zu einem niedrigeren IC50 führen, selbst wenn das Experiment unter den gleichen Bedingungen durchgeführt wurde. Mit anderen Worten, die Verwendung von 0,01 Einheiten Enzym liefert nicht die gleichen Ergebnisse wie die Verwendung von 1 Einheit. Die Verwendung zu vieler Enzyme kann zu einer schnellen Erschöpfung des Substrats führen und die Reaktion hat keine lineare Form. Dieser Parameter könnte somit zu einem ungenauen Ergebnis führen, da nach einer langen Inkubationszeit keine Änderung der Absorption zu sehen wäre.
Km Wert
Um die besten Bedingungen für die Beurteilung der Art der Hemmung durch einen Inhibitor zu gewährleisten, muss die Substratkonzentration gleich oder unter der Michaelis-Menten-Konstante (Km)liegen. Km wird durch die Konzentration von Substrat dargestellt, die erforderlich ist, um die Hälfte der aktiven Stellen auf dem Enzym28zu besetzen. Zum Beispiel kann eine höhere Substratkonzentration einem Wettbewerbshemmer entgegenwirken und die Beurteilung dieser Art von Hemmung wird in einer solchen Umgebung schwierig sein. Einer der entscheidenden Schritte in dieser Methodik ist daher die Bestimmung des Km des Enzyms für das ausgewählte Substrat (hier CDNB). In einigen Studien wurde dieser Wert nicht bestimmt, und dies könnte zu falschen Schlussfolgerungen über das durch den Inhibitor verursachte Hemmungsmuster führen, und wenn die Art der Hemmung falsch ist, wird das Ki falsch berechnet, da die Gleichung auf dem Hemmmuster26,28beruht. Wenn eine andere GST-Isoform getestet wird,m ist eine neue Bewertung des K m-Wertes obligatorisch, da dieser Wert für ein Paar Enzym und Liganden eindeutig ist. Da wir eine CDNB-Konzentration verwendeten, die etwas niedriger war als die Km (0,2 mM), die wir als 0,26 ± 0,08 mM definierten, wurde die vorhergesagte Wettbewerbsart der Hemmung von Curcumin auf GST genau bestimmt.
IC50
Um eine gute Sigmoidalkurve zu erhalten, mit der der IC50 geschätzt werden kann, müssen sowohl die unteren als auch die oberen Plateaus gefunden werden. Das Bodenplateau stellt die Konzentrationen eines Inhibitors dar, die die maximale hemmende Aktivität liefern. In einigen Fällen, eine Verbindung kann das Enzym nicht vollständig hemmen, auch bei hohen Konzentrationen, wegen solcher technischen Probleme wie Löslichkeit. Werkzeuge wie GraphPad Prism passen jedoch recht genau auf das Unterplateau. Das obere Plateau besteht aus Konzentrationen des Inhibitors, die nicht ausreichen, um das Enzym zu hemmen, und daher ist die Aktivität maximal. Beide Hochebenen sind entscheidend für die Bestimmung des IC50 sowie Konzentrationen dazwischen, um die Steigung der Kurve zu finden – dann kann der IC50 aus der Form der Sigmoidkurve35abgeleitet werden. Curcumin ist schlecht in Wasser löslich, daher ist die maximale Konzentration, die in diesem Test verwendet wird, begrenzt, um Niederschläge in der Assay-Lösung zu vermeiden. So wurden weniger konzentrierte Lösungen verwendet, die die GST-Aktivität nicht vollständig hemmen. Dies warf Fragen für die Bestimmung des Grundplateaus auf. Um diesem Problem entgegenzuwirken, haben wir die unteren Werte auf der Grundlage des nichtlinearen Regressionsdiagramms vorhergesagt, das einen IC50 von 31,6 ± 3,6 M für Curcumin lieferte (Abbildung 3A). Für Ethakrynsäure war es nicht notwendig, die Werte für das Bodenplateau vorherzusagen, da diese Verbindung in der Assaylösung löslich ist und der IC50 bei 6,6 ± 1,1 m gemessen wurde.
Diese Methode kann auf die am häufigsten ausgedrückten GST-Isoformen beim Menschen angewendet werden, nämlich GSTA1, GSTM1 oder GSTP1. Dieses Protokoll ist jedoch nicht geeignet, die Aktivität der GSTT1-Isoform zu quantifizieren, da CDNB kein Substrat für diesen Subtyp ist. 36, 37 In der Zwischenzeit kann das Protokoll leicht geändert werden, um diesem Problem entgegenzuwirken. Zum Beispiel, mit 1,2-Epoxy-3-(4'-Nitrophenoxy)Propan (ENPP) als Substrat für GSTT1 und messen Sie die Menge des Konjugats bei 360nm statt 340nm. 37
Protokollschritte können angepasst und angewendet werden, um die GST-Aktivität und Inhibitortests in Zellkulturexperimenten zu testen. Die Messung der GST-Aktivität an Zellen, die mit und ohne GST-Hemmer behandelt werden, zeigt an, ob diese Verbindung in einer solchen experimentellen Umgebung verwendet werden kann. Es ist besonders interessant, wenn der Inhibitor lipophil ist. Zum Beispiel, Wir präsentierten, dass Curcumin ist ein potenter GST-Hemmer mit diesem Protokoll. Dennoch kann seine Anwendung auf zelluläre Studien begrenzt sein, da das Molekül in Wasser schlecht löslich ist und sich im Medium schnell verschlechtert. 31 Eine weitere Verbesserung dieses Protokolls ist hinsichtlich der nichtisoformen Spezifität des Substrats CDNB möglich. Die Verwendung dieses Protokolls in Zellstudien gibt nur Informationen über die gesamte GST-Aktivität, nicht jedoch über die Aktivität des genauen GST-Untertyps. Das Hinzufügen von isoformspezifischem Substrat und/oder der Verwendung spezifischer rekombinanter GST-Isoform ermöglicht die Prüfung isoformspezifischer GST-Inhibitoren.
Abschließend beschreiben wir ein vollständiges Verfahren zur Prüfung von GST-Hemmern, die das Potenzial haben, in Kombination mit elektrophiler Chemotherapie verwendet zu werden. Wir betonten die entscheidenden Schritte eines GST-Enzyms und Hemmungstests, um potenzielle interessante Moleküle zu testen und ihre Effizienz als Inhibitor mit quantitativen Werten, dem IC50 und dem Ki,zu bestimmen. Diese Methode kann auf jede vermeintliche Verbindung angewendet und auf den am häufigsten exprimierten menschlichen GST-Isoformen (GSTA1, GSTM1 und GSTP1) durchgeführt werden, oder leicht angepasst werden, um Zellkulturstudien mit GST-Inhibitoren durchzuführen oder die Aktivität anderer interessanter GST-Isoformen ihrer Wahl zu messen.
| Reagenzien | Namen | Konzentration in der Assaylösung | Andere |
| Substrat | CDNB | Gemessen Km (mM) | Verdünnt in 95% Ethanol. Die endgültige Ethanolkonzentration sollte ≤ 5 % betragen. (v/v) |
| Konjugierendes Substrat | Gsh | 2,5 mM | In Wasser verdünnt. |
| Die Konzentration muss die Lösung sättigen. | |||
| Puffer | Pbs | - | pH = 7,1 |
| Enzym | Pool von GST-Isoformen oder reiner Isoform | 0,01 Einheit/ml, experimentell bestimmt. | In Wasser verdünnt. |
| GST-Hemmer | Potenzielle Verbindung der Wahl | IC50: 3 Konzentrationen, die maximal hemmen, 3, die minimal hemmen, und 3 dazwischen. | Verdünnt in DMSO und dann in Wasser, um eine Endkonzentration von DMSO ≤ 1% (v/v) |
| Ki: 3 Konzentrationen um den IC50. | |||
| Parameter | |||
| Raumtemperatur (25°C) | |||
| pH = 7,1 | |||
| DMSO ≤ 1% (v/v) | |||
| Ethanol ≤ 5% (v/v) | |||
Tabelle 1: Zusammenfassung der Reagenzien und Parameter, die bei einem GST-Hemmungstest zu berücksichtigen sind.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Forschungsarbeit wurde von der CANSEARCH Foundation unterstützt. Die Autoren möchten Frau Laurence Lesne und Herrn Yoann Sarmiento für ihre technische Unterstützung würdigen, insbesondere bei der Durchführung der Replizierungsexperimente bei gleichzeitiger Standardisierung der Assays mit Inhibitoren. Fruchtbare Diskussionen und Beiträge von Herrn Denis Marino, Dr. Simona Mlakar und Dr. Vid Mlakar werden sehr gewürdigt. Wir danken Dr.Patricia Huezo-Diaz Curtis für ihre Hilfe bei der Erzählung des Videos. Wir danken Dr. Muthukumar für seine Beiträge zu silico Vorhersagen. Wir danken auch Herrn Darren Hart für seine Hilfe in englischer Sprache Beweis Lesen dieses Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-Chloro-2,4-dinitrobenzene (CDNB) | Sigma-Aldrich | 237329 | Substrate used for the GST enzymatic assay |
| Corning UV-Transparent Microplates | Sigma-Aldrich | CLS3635 | Transparent plate to perform the enzymatic assay. When using 200 ul, the pathlength is 0.552 cm for this plate. |
| Curcumin | Sigma-Aldrich | 8511 | Used for the results section, to test the inhibition potency of curcumin |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | To prepare the stock of the putative inhibitor |
| DPBS | Sigma-Aldrich | D8537 | Buffer for the enzymatic reaction |
| Ethanol 95% | Fisher scientific | 10542382 | To dilute the CDNB |
| Glutathione S-Transferase from equine liver | Sigma-Aldrich | G6511 | Used for the results section, to test the inhibition potency of curcumin |
| L-glutathione reduced (GSH) | Sigma-Aldrich | G4251 | Co-substrate for the GST enzymatic assay |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23225 | To quantify the amount of protein present in the enzymatic solution |
| Spectramax iD3 | Molecular devices | To do spectrophotometric measurments |
Referenzen
- Mannervik, B., Danielson, U. H. Glutathione transferases--structure and catalytic activity. CRC Critical Reviews in Biochemistry. 23 (3), 283-337 (1988).
- Awasthi, Y. C., Sharma, R., Singhal, S. S. Human glutathione S-transferases. The International Journal of Biochemistry. 26 (3), 295-308 (1994).
- Rowe, J. D., Nieves, E., Listowsky, I. Subunit diversity and tissue distribution of human glutathione S-transferases: interpretations based on electrospray ionization-MS and peptide sequence-specific antisera. Biochemical Journal. 325, 481-486 (1997).
- Beckett, G. J., Hayes, J. D. Glutathione S-transferases: biomedical applications. Advances in Clinical Chemistry. 30, 281-380 (1993).
- Oakley, A. Glutathione transferases: a structural perspective. Drug Metabolism Reviews. 43 (2), 138-151 (2011).
- Townsend, D. M., Tew, K. D. The role of glutathione-S-transferase in anti-cancer drug resistance. Oncogene. 22 (47), 7369-7375 (2003).
- Tew, K. D. Glutathione-associated Enzymes in Anticancer Drug Resistance. Cancer Research. 54 (16), 4313-4320 (1994).
- Laborde, E. Glutathione transferases as mediators of signaling pathways involved in cell proliferation and cell death. Cell Death and Differentiation. 17 (9), 1373-1380 (2010).
- Adler, V., et al. Regulation of JNK signaling by GSTp. The EMBO Journal. 18 (5), 1321-1334 (1999).
- Cho, S. G., et al. Glutathione S-Transferase Mu Modulates the Stress-activated Signals by Suppressing Apoptosis Signal-regulating Kinase 1. Journal of Biological Chemistry. 276 (16), 12749-12755 (2001).
- Hayes, J. D., Flanagan, J. U., Jowsey, I. R. Glutathione Transferases. Annual Review of Pharmacology and Toxicology. 45 (1), 51-88 (2005).
- Lo, H. W., Ali-Osman, F. Genetic polymorphism and function of glutathione S-transferases in tumor drug resistance. Current Opinion in Pharmacology. 7 (4), 367-374 (2007).
- Ansari, M., et al. Glutathione S-transferase gene variations influence BU pharmacokinetics and outcome of hematopoietic SCT in pediatric patients. Bone Marrow Transplantation. 48 (7), 939-946 (2013).
- Mahajan, S., Atkins, W. M. The chemistry and biology of inhibitors and pro-drugs targeted to glutathione S-transferases. Cellular and molecular life sciences: CMLS. 62 (11), 1221-1233 (2005).
- Allocati, N., Masulli, M., Ilio, C. D., Federici, L. Glutathione transferases: substrates, inihibitors and pro-drugs in cancer and neurodegenerative diseases. Oncogenesis. 7 (1), 8 (2018).
- Aggarwal, B. B., Kumar, A., Bharti, A. C. Anticancer potential of curcumin: preclinical and clinical studies. Anticancer Research. 23 (1), 363-398 (2003).
- Han, S. S., Chung, S. T., Robertson, D. A., Ranjan, D., Bondada, S. Curcumin causes the growth arrest and apoptosis of B cell lymphoma by downregulation of egr-1, c-myc, bcl-XL, NF-kappa B, and p53. Clinical Immunology. 93 (2), 152-161 (1999).
- Golonko, A., Lewandowska, H., Świsłocka, R., Jasińska, U. T., Priebe, W., Lewandowski, W. Curcumin as tyrosine kinase inhibitor in cancer treatment. European Journal of Medicinal Chemistry. 181, 111512 (2019).
- Awasthi, S., et al. Curcumin-glutathione interactions and the role of human glutathione S-transferase P1-1. Chemico-Biological Interactions. 128 (1), 19-38 (2000).
- Appiah-Opong, R., Commandeur, J. N. M., Istyastono, E., Bogaards, J. J., Vermeulen, N. P. E. Inhibition of human glutathione S-transferases by curcumin and analogues. Xenobiotica; the Fate of Foreign Compounds in Biological Systems. 39 (4), 302-311 (2009).
- Dubey, V., Owusu-Apenten, R. Curcumin Restores Glutathione-S-Transferase Activity for LNCaP Prostate Cancer Cells. Pure and Applied Chemistry. 2, 61-72 (2014).
- Habig, W. H., Pabst, M. J., Jakoby, W. B. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation. The Journal of Biological Chemistry. 249 (22), 7130-7139 (1974).
- Johnson, K. A., Goody, R. S. The Original Michaelis Constant: Translation of the 1913 Michaelis-Menten Paper. Biochemistry. 50 (39), 8264-8269 (2011).
- Ochs, R. S. Understanding Enzyme Inhibition. Journal of Chemical Education. 77 (11), 1453 (2000).
- Bisswanger, H. Enzyme assays. Perspectives in Science. 1 (1), 41-55 (2014).
- Acker, M. G., Auld, D. S. Considerations for the design and reporting of enzyme assays in high-throughput screening applications. Perspectives in Science. 1 (1), 56-73 (2014).
- Cheng, A. L., et al. . Anticancer Research. 21, 2895-2900 (2001).
- Yang, J., Copeland, R. A., Lai, Z. Defining Balanced Conditions for Inhibitor Screening Assays That Target Bisubstrate Enzymes. Journal of Biomolecular Screening. 14 (2), 111-120 (2009).
- Uppugunduri, C. R. S., Muthukumaran, J., Santos-Silva, T., Ansari, M. Identification of putative substrates and inhibitors for Glutathione S-transferases using computational methods. Zenodo. , (2017).
- Burlingham, B. T., Widlanski, T. S. An Intuitive Look at the Relationship of Ki and IC50: A More General Use for the Dixon Plot. Journal of Chemical Education. 80 (2), 214 (2003).
- Wang, Y. J., et al. Stability of curcumin in buffer solutions and characterization of its degradation products. Journal of Pharmaceutical and Biomedical Analysis. 15 (12), 1867-1876 (1997).
- Copeland, R. A. Evaluation of enzyme inhibitors in drug discovery. A guide for medicinal chemists and pharmacologists. Methods of Biochemical Analysis. 46, 1 (2005).
- Kalliokoski, T., Kramer, C., Vulpetti, A., Gedeck, P. Comparability of Mixed IC50 Data - A Statistical Analysis. PLoS ONE. 8 (4), (2013).
- Brandt, R. B., Laux, J. E., Yates, S. W. Calculation of inhibitor Ki and inhibitor type from the concentration of inhibitor for 50% inhibition for Michaelis-Menten enzymes. Biochemical Medicine and Metabolic Biology. 37 (3), 344-349 (1987).
- Brooks, H. B., et al. Basics of Enzymatic Assays for HTS. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2012).
- Arakawa, S., et al. Evaluation of hepatic glutathione transferase Mu 1 and Theta 1 activities in humans and mice using genotype information. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 40 (3), 497-503 (2012).
- Sherratt, P. J., Pulford, D. J., Harrison, D. J., Green, T., Hayes, J. D. Evidence that human class Theta glutathione S-transferase T1-1 can catalyse the activation of dichloromethane, a liver and lung carcinogen in the mouse. Comparison of the tissue distribution of GST T1-1 with that of classes Alpha, Mu and Pi GST in human. The Biochemical Journal. 326 (3), 837-846 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten