Method Article
从小鼠中分离心肌细胞的安特格拉德灌注方法
摘要
我们开发了一种通过前代灌注技术分离高质量个体小鼠心脏细胞的简化e方法 。这种方法是无兰根多夫和有用的隔离心室和心室肌细胞或间质细胞,如心脏成纤维细胞或祖先。
摘要
在使用小鼠心脏的基础研究中,分离可行的单个心肌细胞是需要克服的关键技术步骤。传统上,通过使用兰根多夫装置逆行灌注心脏与酶,将心肌细胞与兔子、豚鼠或大鼠隔离开来。然而,当使用这种方法与小老鼠的心脏时,需要高度的技能。最近报告了一种不使用兰根多夫装置的前体灌注方法,用于分离小鼠心肌细胞。我们在这里报告一个完整的协议,为改善前体灌注切除的心脏,以隔离从成年小鼠的个别心脏细胞(8 - 108周大)。前体灌注通过在切除心脏左心室的顶点附近注射灌注来进行,使用输液泵夹住主动脉。所有程序均在显微镜下预热加热垫上进行,从而可以监测注射和灌注过程。结果表明,心室和心室肌细胞和成纤维细胞可以同时从一只成年小鼠中分离出来。
引言
一般来说,解剖组织的单细胞分离的第一步是将组织细分成小块,然后消化结缔组织和细胞外基质与酶。然而,心肌细胞不能用这种切碎方法进行分离,因为富集细胞外基质成分,包括胶原蛋白和弹性纤维,使心肌太硬,无法切碎,心肌细胞对缺氧和微环境的其他变化高度敏感。因此,利用基于兰根多夫的逆行灌注系统1,开发出一种用酶消化细胞外基质的方法,将单个心肌细胞从心脏分离出来2、3、4。
在小鼠模型中,基于兰根多夫的逆行灌注心脏与酶也用于隔离个别心肌细胞5,6,7,8。然而,小而细的老鼠主动脉的及其安装在兰根多夫装置上进行逆行灌注需要高度的技巧,因为成人心脏主动脉的直径约为 1 . 2 毫米。此外,它需要时间来执行多个实验,因为兰根多夫仪器应该清洗之前,香水的下一个心脏。
作为逆行灌注的替代方案,开发出一种无需兰根多夫装置的新型方法,将心肌细胞从成年小鼠心脏中分离出来。这种划时代的方法是基于冠状动脉9的前部灌注。我们最近改进了这个前科协议的每一步,如主动脉夹紧、针插入和温度控制,并用显微镜10监测所有灌注程序。我们在这里详细报告这种前体灌注方法的改进,以缩短隔离时间,并提供补充视频。在这种方法中,心脏的灌注大约需要7分钟,酶的10mL,这个短暂的消化周期增加了细胞的生存能力。这是一个简单的方法,隔离单一心脏细胞的高质量,而无需添加化学物质,如2,3-丁二醇单xime (BDM)6,11或陶林5,8.我们相信,这种方法将降低该技术的技术门槛,提高小鼠心肌细胞在基础研究中的效用。
研究方案
所有动物实验均符合美国国家卫生研究院出版的《实验室动物护理和使用指南》(NIH第85-23号出版物,1996年修订),并经滋贺医科大学动物护理与使用委员会机构审查委员会批准(第2019-3-7号批准)。这些方法是按照核准的准则进行的。
1. 仪器和解决方案
注:实验过程的轮廓在流程图(补充图1)中说明。输液泵(或注射器泵)应用于心脏的单向流动的前部灌注。不建议使用产生脉动流的围动泵。
- 在实验之前
- 用指甲油在距尖端约 3 毫米的地方标记注射针。让空气干燥后,在室温下将其保存在容器中。在灌注过程中,最好用红色或鲜艳的颜色来确认插入心肌的深度。
- 通过切断 1.5-0.5 和 0.2 mL 样品管的盖子,并将盖子连接到带双面胶带或胶粘剂的 60 毫米培养皿底部,使心脏站立。在一道菜中固定三个不同大小的盖子,可以根据鼠标心脏的大小选择合适的盖子。洗完后可以重复使用这个心脏支架。
- 制作 表1中所示的库存解决方案。将库存解决方案存储在 4 °C。
- 在实验日
注:细胞隔离缓冲区 (CIB) 包含 (mM) 130 纳克、5.4 KCl、0.5 MgCl2、 0.33 NaH2PO4、 22 葡萄糖 、 40 单位/mL 胰岛素和 25 HEPES (pH 调整为 7.4 与 NaOH):和Tyrode解决方案包含(在mM)140纳克,5.4 KCl,1.8卡Cl 2,0.5毫克2,0.33NaH2PO4,5.5葡萄糖和5.0 HEPES(pH调整为7.4与NAOH)。- 准备CIB。使用微波炉将 160 mL 蒸馏水 (DW) 加热到 32 °C 左右,然后加入 20 mL 的 10X CIB。加入 0.79 克葡萄糖和 10 μL 胰岛素溶液后,使用 1 M NaOH 调整 pH,并使用 DW 将 pL 调至 200 mL。
- 准备酶混合溶液(酶混合)。加入 30 毫克拼贴酶、1.8 毫克三聚氰辛、1.8 毫克蛋白酶和 90 μL 100 mM CaCl2 库存溶液至 30 mL CIB(最终 Ca2+ 浓度为 0.3 mM),混合并将其保持在冰上。在小鼠<4周大,减少肌氨辛和蛋白酶到0.9毫克10。使用前在水浴中加热37°C。
- 准备 CIB-Ca2+-BSA 解决方案。加入 30 毫克 BSA 和 90 μL 的 100 mM CaCl2 库存解决方案到 15 mL CIB(最终 Ca2+ 浓度为 1.2 mM),混合,通过 20μm 过滤器过滤,并将其保持在冰上。
- 准备 CIB-EGTA 解决方案。在完成步骤 1.2.2 和 1.2.3 中描述的解决方案后,以 1:1000 稀释(最终 EGTA 浓度为 0.4 mM)向剩余 CIB 添加 400 m M EGTA 库存解决方案并混合。将 35 毫米培养皿和心立盘与 CIB-EGTA 一起填充,并将其放在冰上。
- 将大约 20 毫升 CIB-EGTA 倒入 30 毫升玻璃烧杯中,并在烧杯中放入塑料转移移液器,将其保持在冰上。
- 准备泰罗德解决方案。将 100 mL 的 10 倍 Tyrode 添加到 800 mL 的 DW 中,然后使用微波炉将其加热至约 32 °C。 添加 0.99 克葡萄糖和 1.8 mL 的 1 M CaCl2后,使用 1 M NaOH 调整 pH,并带 DW 将 pH 调至 1000 mL。
- 准备细胞悬念解决方案。将 30 毫克 BSA 和 300 μL 的 50 倍抗生素添加到 15 mL 的 Tyrode 溶液中。
- 准备注射器。用柔性延长管和带有 CIB-EGTA 的标记注射针填充 20 mL 注射器。用加热的酶混合物填充 30 mL 注射器。将它们都保持在37°C,直到使用前。
- 准备灌注盘。在立体显微镜下预热加热垫。将灌注板(多井培养板的盖子)放在预热加热垫上。将血管夹放入灌注板中,直到使用,从而预热血管夹。将 60 毫米培养皿用于管道输送,并将细胞过滤器放在预热加热垫上。
2. 老鼠心脏的安特格拉德灌注
注意:用于吸吮心脏的塑料转移移液器应柔软,不要急剧向尖端逐渐减少。选择带锯齿的小血管夹。推荐的仪器列在 材料表中。
- 割除鼠标心脏和夹紧主动脉
注:成年小鼠(>8周大)应服用过量的五巴比妥钠(>300毫克/千克,腹膜内注射)和肝素(8000单位/千克)。- 通过吸吮快速切除鼠标心脏。
- 迅速打开胸腔,露出心脏。切开塑料转移移液器,其尖端的大小与暴露的心脏大致相同,或略小于裸露的心脏(通常在距离 0.5 mL 标记到尖端约 1 厘米的地方,但这取决于心脏大小)。
- 将心脏吸入移液器中,抬起移液器以创造足够的空间插入剪刀,然后用弯曲的剪刀从后侧切除心脏,避免损坏 atria。
- 立即将切除的心脏转移到含有冰冷 CIB-EGTA 的 30 毫升玻璃烧杯中,以阻止收缩。此过程通常需要<1分钟。
- 在主动脉周围清洁
- 将心脏转移到一个35毫米的培养皿中,里面装满了冰冷的CIB-EGTA,取出肺和其他可见的组织,然后将大致清洁的心脏转移到装满冰镇CIB-EGTA的心脏支架上,然后用顶点放下。
- 在立体显微镜下,取出脂肪和结缔组织,以清洁主动脉周围。如果切割主动脉的长度太长,包括胸动脉、左侧普通胡萝卜动脉或左下腹动脉,则切断胸动脉下的主动脉以缩短主动脉以进入下一步。此过程通常需要大约 4 分钟。
- 夹住主动脉,将夹紧的心脏放在灌注板上
- 在显微镜下,将心脏放在心脏支架上。操作者应面对心脏前表面,用钳子拾起主动脉的末端,用一个小血管夹夹紧主动脉附近,同时轻轻向下推下主动脉一点。
- 将夹紧的心脏放在灌注板上,前侧向上,然后用几滴 CIB-EGTA 盖住它,以防止其干燥。这个过程通常需要20<。
- 通过吸吮快速切除鼠标心脏。
- 心脏的安特勒德灌注
注意:首先,用CIB-EGTA香水心脏以排出血液并防止凝血。- 插入注射针,开始灌注以排出血液
- 设置20mL注射器,里面装满了预热的CIB-EGTA连接到柔性延长管和输液泵上的有标记的注射针。以 0.5 mL/min 的慢速启动泵,小心地将针头和管子装满 CIB-EGTA,并确保防止任何空气进入管子。
- 将注射针放在灌注板上,正面对角线形状较短。将针头滑向心脏的顶点,直到它接触它,然后小心地将针头插入左心室的顶点附近,不扭曲。在进行插入时,不要将针头从盘子中分离。
- 观看红色标记,估计针插入的深度。针头插入完成后,从冠状动脉流出的血液应开始排出。
- 用胶带固定板上的注射针,并将泵速提高到 1 mL/min。这个过程通常需要大约30s。如果心脏被成功灌注,在显微镜下可以看到毛细管中的CIB-EGTA的流动。
- 用酶混合物灌注心脏
注意:在酶灌注过程中,可以通过检查针上的红色标记来监测插入针头的深度。- 在灌注2-3 mL的CIB-EGTA,以完全从冠状动脉排出血液后,将香水改为酶混合物。避免让气泡进入管子。检查酶混合物的流动情况,通过检查红色标记的位置,确保注射针头不会出来。
- 灌注 1-2 mL 后,将泵速提高到 1.5 mL/min。取出积聚的含有不时用移液器流出心脏的血液的香水。
注意:随着时间的推移,心肌壁在某些地方会变半透明,并出现斑驳,这是成功灌注后细胞外基质消化的一个迹象。另一个迹象是,由于Ca2+ 在酶混合物中的存在,导致的机在跳动重新启动。 - 当香水混合物的总体积为10mL时停止灌注。
- 插入注射针,开始灌注以排出血液
3. 隔离单个心脏细胞
- 分离心脏细胞
- 与酶混合灌注后,将注射器中剩余的 10 mL 酶混合物转移到放在加热垫上的 60 mm 培养盘中,并加入 20 毫克 BSA(酶混合物中的 BSA 为 0.2%)。掉落的BSA粉末应立即溶解,用手轻轻旋转。从心脏取出注射针和血管夹。
- 分离心室和腹腔,并将每个心室转移到加热垫上补充0.2%BSA的酶混合物中。
- 心室肌细胞的隔离
- 用两个钳子抓住史诗,轻轻撕裂和拉心室从一边到另一边的酶混合物补充0.2%BSA成小块。用温和的管道分散细胞(大约30次)。
- 通过 100μm 网状细胞过滤器过滤未消化的碎屑,并将过滤液转移到 15 mL 离心管中,在 50 × 克 下进行离心 3 分钟。在预热的 CIB-Ca2+-BSA 溶液中恢复盆栽心肌细胞,在 37 °C 时孵育 5 分钟,然后在 14 × g 下进行离心机 3 分钟。
- 在细胞暂停溶液中补充最终沉淀的心肌细胞(成分列在 表 2中),并将其保持在 37 °C。
- 心肌细胞的隔离
- 在第 3.2 步心室肌细胞分数的最后离心过程中,开始隔离心室肌细胞。将存储在第 3.1 步的 atria 转移到预热的 CIB-Ca2+-BSA 溶液中,将其撕成碎片,并通过在加热垫上用 10 μL 的移液器尖端管状分离细胞。
- 以14× 克 的离心器混合物,3分钟,用细胞暂停溶液重新取回被切除的心室细胞。
- 心脏成纤维细胞的隔离和文化
- 将超自然人从第 3.2 步的第一次离心转移到另一个 15 mL 离心管,并在 190 × g 下将离心机转移 5 分钟。在杜尔贝科的改良鹰介质 (DMEM) 中用离心处理两次沉淀细胞,然后用 DMEM 补充 10% 胎儿牛白蛋白 (FBS) 和抗生素暂停细胞。
- 将最终细胞部分板入培养瓶(25厘米2),使细胞在95%空气和5%CO2的潮湿大气中粘附在烧瓶底部。90分钟后孵化,丢弃未连接的细胞,并添加新鲜培养介质。细胞在大约4天后应接近汇流,此时它们应通过尝试化放大并播种到新的培养皿中。
4. 从阿特里亚和心室中采集蛋白质
- 灌注后,将腹腔和心室分离,并在裂解缓冲中均质,使用 1.5 mL 样品管中的小型研磨机将组织重量与 100 μL 缓冲器的比例为 10 毫克。
- 将同质物在冰中保持 40 分钟,每 10 分钟混合一次涡流以提取蛋白质,然后在 4 °C 时将管子离心在 15000 × g 中搅拌 20 分钟。 将超自然成分存储在 -80 °C 作为蛋白质样本。
5. 隔离心脏细胞的免疫染色
注意:使用生物胶水将非粘附心肌细胞固定到细胞成像盘底部是必要的。
- 将分离的心肌细胞粘附在玻璃底培养皿中
- 在开始细胞隔离之前,根据制造商的指示,用生物胶水(如 Cell-Tak)涂上玻璃底培养盘,用 DW 冲洗,并在室温下干燥。
- 在 CIB-Ca2+-BSA溶液中分离的心肌细胞重新悬念后,将细胞悬浮液放在胶涂层菜肴的底部,在室温下不激动地孵育 20 分钟。
- 免疫染色
- 将分离的心肌细胞放在用生物胶水预制的玻璃底盘上,将其保持在室温下 40 分钟,使细胞粘附在盘上。底玻璃文化菜肴中的文化心脏成纤维细胞。
- 用磷酸盐缓冲盐水 (PBS) 冲洗细胞,用 4% 的副甲醛 (PFA) 固定电池 5 分钟,摇晃。用 PBS 清洗固定细胞 10 分钟三次,并在室温下用阻隔渗透溶液在震动时孵育 60 分钟。
- 在室温下或在 4 °C 的夜间,在阻塞渗透溶液中稀释主要抗体的探针细胞 60 分钟。 用PBS清洗细胞3次10分钟,然后在室温下用荧光标记的二次抗体孵育60分钟。
- 用PBS清洗三次10分钟后,用DAPI(PBS中稀释1:10000)弄脏核。使用对焦激光扫描显微镜分析荧光信号。
6. 全细胞补丁夹钳录音
- 使用水平微电极拉拔器从玻璃毛细细丝中制造贴片电极。电极的电阻范围从2到4 MΩ,当充满K+丰富的移液器解决方案(表2)。将一组孤立的心肌细胞转移到安装在倒显微镜舞台上的录音室,以 36-37 °C 的速度与 Tyrode 超级融合,速度为 1 mL/min。
- 通过贴片电极应用持续时间为 5-10 毫秒的电流脉冲,使用 K+丰富的移液器解决方案记录操作潜力,该溶液包含 30 毫克/mL 安培素 B。
7. 西方污点分析
- 在这项研究中,对小分子量蛋白质(如心房标记物心房肽(ANP))进行西式污点分析。
- 溶解最终浓度为1X样品缓冲的蛋白质样本,2%2'甲基乙醇,并在37°C下去自然化蛋白质60分钟。 将 20 μg 蛋白质加载到每个井中,并在运行缓冲区时进行电泳,每凝胶 20 mA,持续 120 分钟。
- 将蛋白质转移到 PVDF 膜中,在 10 V 的传输缓冲区中传输 40 分钟。用 TBST 清洗转移的膜两次 5 分钟,然后在室温下用 TBST 中 5% 脱脂牛奶阻断 60 分钟,并在 4 °C 下用在 TBST 中溶解的主要抗体探针。
- 用TBST清洗膜5次7分钟,用TBST稀释的二次抗体在室温下孵育120分钟。
- 用TBST清洗膜5次7分钟后,用化学发光检测仪可视化信号,并使用lumino图像分析仪分析信号。
结果
这种方法的原则很简单:灌注剂从左腔室流出,主动脉瓣打开,灌注物以与血液运行相同的方向进入冠状动脉,因为主动脉通过夹紧封闭,从而使心肌的深度灌注能够消化细胞外基质。
与目前方法新分离的心室肌细胞显示在图1A中。图1B显示心室和心室肌细胞的放大图像。这种隔离程序导致高产(70%-80%)来自成年小鼠的棒状静默心室肌细胞(8-10周),在隔离后约5小时内可用(图1C),间隔与使用传统的兰根多夫程序7时相似。然而,在2岁(图1C)的>老年小鼠中,新分离的活细胞比例较低。使用此协议获得每个成人心脏的心室肌细胞总数约为3×106细胞,与先前报告的7,12的值相似。心室和心室肌细胞(图1D)中记录的运动潜力与兰根多夫方法10获得的细胞中的动作潜力相似。免疫学分析证实,心室肌细胞的肉瘤结构组织良好,具有清晰可见的细胞膜(图2A)。用这种方法分离的单个心肌细胞可直接用于实验,如电生理分析10或免疫染色实验。
心肌成纤维细胞存在于间歇空间中。细胞外基质的充分消化导致这些细胞的分离。分离的心脏成纤维细胞在培养条件下增殖,可通过多次或储存在液氮中,以适当的细胞储液。图2B显示,大多数培养的心脏成纤维细胞在亚文化期间已经转化为肌纤维细胞,这证实了α光滑的肌肉行为在13,14的表达增加。此外,心脏祖先可以用目前的方法分离,并在适当的培养介质中培养,开始自动跳动10,15。
强健心肌的同质化并不容易,尤其是对于拥有大量细胞外纤维的老年小鼠的心脏组织而言。前体灌注后,来自腹腔和心室的蛋白质很容易在裂解缓冲区中同质化,用轻力提取蛋白质。西方污点分析表明,ANP在阿特里亚(但不包括在心室)中(20周大)和年龄(108周大)小鼠(图3)的具体表现。
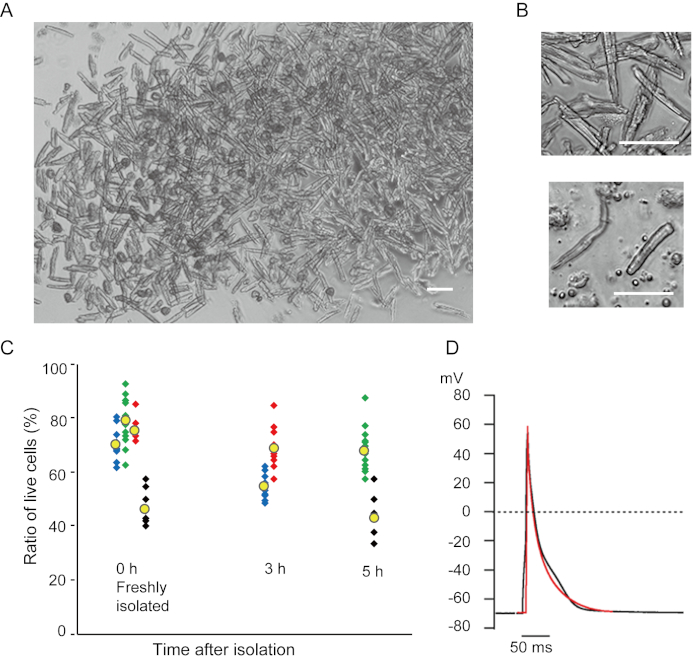
图1。从小鼠中分离出心肌细胞。A. 心室肌细胞刚刚与前体灌注分离,图像获得放大倍数较低。最后洗涤后,心肌细胞用2毫升的细胞暂停溶液进行再利用,其中100微升被滴到玻璃底培养皿和等待的细胞沉降中。酒吧, 100μm.B. 孤立心室肌细胞 (上) 和心室肌细胞 (下) 的放大图像。酒吧,100微米.C。分离的细胞悬浮在细胞悬念溶液中,并储存在37°C的理想时间段,活心室肌细胞的数量在显微镜下计算在10-15个领域。圆形细胞被认为是不可逆转的受伤或死亡16。绿色、蓝色和红色符号来自3只8-10周大的老鼠,黑色符号来自106周大的老鼠。黄色符号表示每个组的平均值。D. 从8-10只小鼠的心室(黑色)和心室(红色)肌细胞记录的代表作用潜力。这些数据是在隔离后约3小时从细胞中获得的。 请单击此处查看此图的较大版本。
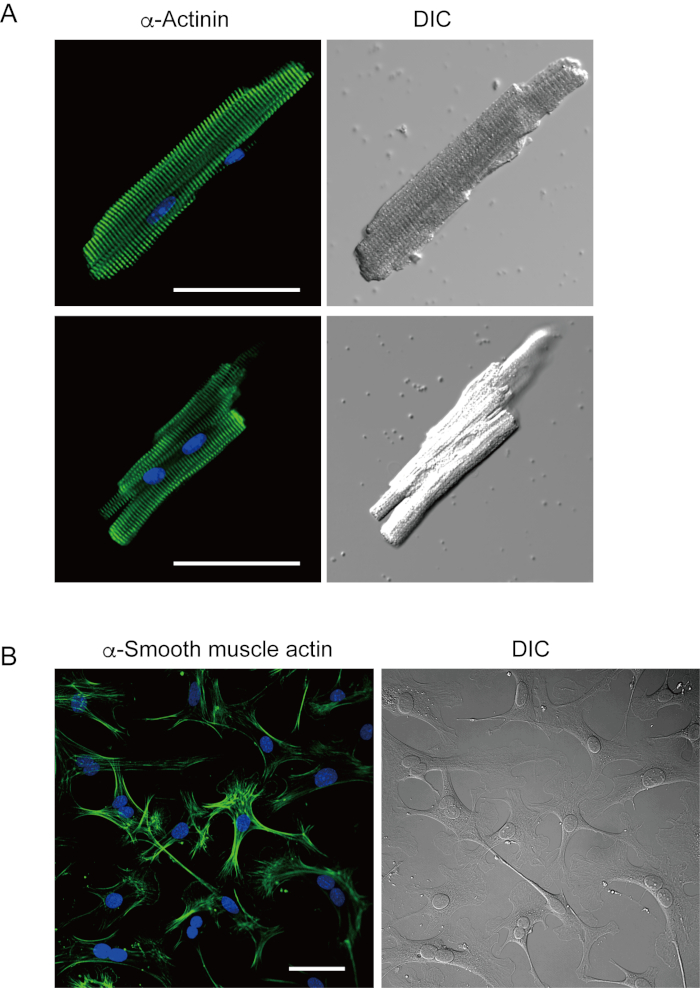
图2。在孤立的老鼠心室肌细胞中对α-actin进行免疫染色,在培养小鼠心脏成纤维细胞中α光滑的肌肉作用。A. 共聚焦激光扫描显微镜的免疫染色α-actinin(绿色)、DAPI染色核(蓝色)和DIC图像的心室肌细胞从小鼠心脏分离与前兆灌注。酒吧, 50 μm.B. 免疫污染用于α光滑的肌肉行为素 (绿色), DAPI 染色核 (蓝色) 和从小鼠心脏分离的心脏成纤维细胞的 DIC 图像与前体灌注。心脏成纤维细胞被培养了四天。酒吧, 100 μm. 请点击这里查看此图的更大版本。
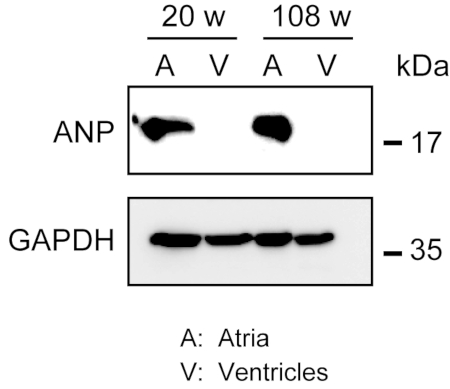
图3。西方污点分析ANP在阿特里亚和心室。从成人(20周)和年龄(108周)心脏准备的心室标记心内肽(ANP)的西方污点分析。ANP存在于腹腔中,但在心室中不存在。使用甘油醛3磷酸盐脱氢酶(GAPDH)作为控制家居蛋白质。 请单击此处查看此图的较大版本。
| 分离心脏细胞的库存解决方案 | |
| 10X CIB (500 mL) | |
| 纳克 | 37.99 克 |
| 科西 | 2.01 克 |
| 1 M 毫克2 | 2.5升 |
| 纳赫2PO4 | 0.23 克 |
| 赫佩斯 | 29.79 克 |
| DW | 填充高达 500 mL |
| 100 mM 卡克2 股票出口 | |
| 卡克2 | 100立方米 |
| 400 mM EGTA 库存解决方案 | |
| 埃格塔 | 400立方米 |
| 胰岛素溶液 | |
| 胰岛素 | 1 单位/mL 在 0.1 M HCl |
| 50X 抗生素库存解决方案 (20 mL) | |
| 盘尼西林 | 100毫克 |
| 链霉素 | 100毫克 |
| 酚红色 | 1.5 克 |
| DW | 20 mL,并使用过滤消毒 |
| 10X 泰罗德解决方案 (1000 mL) | |
| 纳克 | 81.82 克 |
| 氯化钾 | 4.03 克 |
| 1 M 毫克2 | 5升 |
| 纳赫2PO4 | 0.47 克 |
| 赫佩斯 | 11.92 克 |
| 纳赫 | 0.8 克 |
| DW | 填充至多1000mL |
| 库存溶胶素用于免疫染色 | |
| 达皮股票 | |
| 达皮 | 甲醇中2毫克/百升 |
| 西斑点库存解决方案 | |
| 赫佩斯缓冲区(100毫升) | |
| 纳克 | 0.88 克 |
| 400米埃格塔 | 0.25毫升 |
| 赫佩斯 | 0.24 克 |
| 1M 纳赫 | 将pH调整为7.4 |
| DW | 填充高达 500 mL |
| 蛋白酶抑制剂鸡尾酒 | |
| 完整的迷你 | 1 片 |
| DW | 0.4升 |
表1。股票解决方案的描述。将库存解决方案保持在 4 °C。 阿里报价蛋白酶抑制剂鸡尾酒储存在 -20 °C。
| 分离心脏细胞的解决方案 | |
| CIB (200 mL) | |
| 10倍投行 | 20升 |
| 胰岛素溶液 | 0.01毫升 |
| 葡萄糖 | 0.79 克 |
| 1M 纳赫 | pH调整到7.4 |
| DW | 填充至多200mL |
| 酶混合溶液 (30 mL) | |
| 拼贴画类型2 | 30毫克 |
| 胰蛋白酶 | 1.8毫克 |
| 蛋白酶 | 1.8毫克 |
| 100 mM 卡克2 库存解决方案 | 0.09毫升 |
| CIB | 30升 |
| CIB-Ca2+-BSA (15 mL) | |
| BSA | 30毫克 |
| 100 mM 卡克2 库存解决方案 | 0.18毫升 |
| CIB | 15升 |
| 西布-埃格塔 (150 mL) | |
| 400 mM EGTA 库存解决方案 | 0.150毫升 |
| CIB | 150毫升 |
| 泰罗德解决方案 (1000 mL) | |
| 10X 泰罗德股票解决方案 | 100毫升 |
| 葡萄糖 | 0.99 克 |
| 1M 卡2 | 1.8升 |
| 1M 纳赫 | pH调整到7.4 |
| DW | 填充至多1000mL |
| 细胞悬念解决方案 (15 mL) | |
| BSA | 30毫克 |
| 50X 抗生素库存解决方案 | 0.3升 |
| 泰罗德解决方案 | 15升 |
| 免疫染色解决方案 | |
| 细胞粘附解决方案 (0.3 mL) | |
| 细胞-塔克 | 0.01毫升 |
| 0.1 百万纳赫科3 (pH8.0) | 0.285毫升 |
| 0.1米纳赫 | 0.005毫升 |
| 阻塞渗透性利扎汀溶液 (10 mL) | |
| 胎儿牛血清 | 1升 |
| 特里顿X-100 | 1升 |
| 10倍PBS | 1升 |
| DW | 7升 |
| K+丰富的移液器解决方案 | |
| 阿斯巴酸钾 | 70立方米 |
| 氯化钾 | 50米 |
| KH2PO4 | 10米 |
| 毫克索4 | 1立方米 |
| ATP 钠盐 | 3米 |
| GTP 锂盐 | 0.1米 |
| 埃格塔 | 5米 |
| 赫佩斯 | 5米 |
| 科赫 | pH调整到7.2 |
| 解决西方斑点问题 | |
| 裂解缓冲区 (1 mL) | |
| 赫佩斯缓冲区 | 0.86毫升 |
| 非海德-P40 | 0.1升 |
| 蛋白酶抑制剂鸡尾酒 | 0.04毫升 |
| 运行缓冲区(1000 mL) | |
| 10X TG (0.25 M 三合院和 1.92 M 甘氨酸) | 100毫升 |
| SDS | 1 克 |
| DW | 900毫升 |
| 传输缓冲区(1000 mL) | |
| 10倍TG | 100毫升 |
| 甲醇 | 200毫升 |
| DW | 700毫升 |
| 膨胀缓冲区 (TBST) (1000 mL) | |
| 5M 纳克 | 20升 |
| 2M 特里斯-赫克 (pH 7.5) | 5升 |
| 10% 补间 20 | 10升 |
| DW | 965毫升 |
表2。描述分离心脏细胞、免疫染色和西性印迹的工作解决方案。在实验前准备所有工作解决方案。
补充图1。细胞隔离的轮廓。心室和心室肌细胞和心脏成纤维细胞从一颗心脏分离的流动图。请单击此处下载此图。
讨论
由于心脏极易缺血,因此应尽可能缩短切除心脏并将其浸入冰冷的 CIB-EGTA 以阻止收缩所花的时间(< 1 分钟)。这是该方法的第一个关键步骤。第二个关键步骤涉及心脏的方向。第 2.1.2 步切除心脏的特殊方向使主动脉周围的脂肪和结缔组织更容易看到和去除。在主动脉周围清洁后,将夹紧的心脏与前表面侧面放在灌注板上。最后的关键步骤是插入注射针。当将针头推向心脏时,注射针不应与灌注板分离,以保持与心脏的恒定距离。插入的位置靠近左心室的顶点。小心插入针头而不扭曲,因为这种扭曲可能会扩大孔。通过观察红色标记,可以估计插入针头的深度。如果针头插入太深,尖端可能会穿透心室隔膜,进入右心室或通过手套瓣进入左中庭。确认冠状动脉血液消失后,针头应用胶带固定到灌注板上。
更长的主动脉长度使得很难将主动脉夹在正确的位置。如果夹子离阿特里亚太远,心脏可能会在灌注后旋转。为了防止这种情况,切断胸动脉下的主动脉,以缩短主动脉,然后夹紧。
如果血液在灌注后未以 0.5 mL/min 的初始速度开始排出,则将速度提高到 1 mL/min。如果这没有帮助,注射针头可能定位不正确,如在右心室,心室隔膜或左心肌壁。在这种情况下,立即取出针头,并尝试在左心室顶点附近重新插入针头。多次插入针头时,消化的细胞可能会从开孔流出。请注意,这通常不会严重影响细胞分离。
操作员可以使用立体显微镜监测心脏前体灌注的整个过程,观察颜色和透明度的变化,并重新启动阿提亚的跳动以及消化。总共10mL的酶混合物应该是最大的要求,即使是对于一个老心脏。在年轻的心脏(5-7周大),我们减少体积到9 mL,这是类似于通过逆行灌注与相同的酶混合的方法。
最终离心处的超分子含有碎片、血细胞和非细胞,而颗粒主要含有心肌细胞和污染物,如成纤维细胞和内皮细胞。为了净化心肌细胞,需要更多的步骤。一般来说,颗粒应在适当的细胞培养介质中重新喷出,并在组织细胞培养盘上预镀2小时,在37°C时,然后通过管道和预镀培养物轻轻去除心肌细胞。
酶混合物含有低浓度的Ca 2+(0.3 mM)。因此,我们用细胞悬念溶液(1.8 mM Ca2+)在CIB-Ca 2+-BSA(1.2 mM Ca2+)中孵育消化细胞,Ca2+的逐渐增加可避免造成细胞损伤7。只要分离的心肌细胞完好无损(没有收缩的静止细胞),这个Ca2+适应程序不会影响小鼠的细胞生存能力。由于受损细胞在潜伏期间死亡,因此我们获得了一个健康的细胞群。同样,分离的完整心室肌细胞(未不规则收缩的静止细胞)可以存储在同一细胞悬念溶液中。然而,与心室肌细胞相比,心室肌细胞的存储往往更加微妙。
在实验室中,除非插入左心室的针头发生故障,否则这种隔离方法几乎总是成功的。我们还成功地将细胞从手术横向主动脉收缩准备的超营养心脏中分离。然而,在老年小鼠中,经常有小心肌梗塞,灌注在一些地方停止,导致消化不全,从而产生低产量(图1C),类似于兰根多夫的逆行方法。在这种情况下,即使在灌注开始时也能观察到心脏扭曲的形状。
这种前额灌注方法有助于将心脏细胞与不同年龄但较大的动物(如兔子和豚鼠)隔离开来。在断奶之前,有可能将这种方法应用于新生儿或幼鼠。
这种前体灌注方法的优点之一是,它减少了与使用基于兰根多夫的逆行灌注法为小老鼠心脏相关的技术障碍。灌注所需的时间约为7分钟,酶为10mL,这种短暂的消化期增加了细胞的生存能力。此外,它使灌注通过心脏的冠状动脉循环进行,即使在主动脉瓣被消化后。心肌细胞的分离通常需要兰根多夫为基础的逆行灌注和进一步孵化与酶17。然而,这种前体灌注方法可以用酶深入灌注组织,以分离心肌细胞。
在使用多个小鼠的实验中,兰根多夫装置应在注入下一颗心脏之前进行清洁。然而,在目前的前代方法中,只要事先准备了所需的仪器套数(如注射针和灌注板),就可以连续进行灌注。
我们这里报告小鼠心脏前体灌注的基本方法,使用与兰根多夫为基础的逆行灌注法相同的解决方案,没有额外的化学物质。香水的成分可以改变,以适应实验的目的,如使用含有EGTA的洗涤剂,而不是酶,使一个减细胞的心脏18。
披露声明
作者没有什么可透露的。
致谢
作者感谢山本和森喜朗在形态学实验中的帮助。这项工作得到了日本科学促进协会(18K06871至M.O.K.和17K08536至H.M)的科学研究资助(C)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
参考文献
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, Pt 3 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688(2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。