Method Article
마우스에서 심근세포 절연을 위한 영양 관류 방법
요약
우리는 선행 관류 기술에 의해 고품질의 개별 마우스 심장 세포를 격리하기위한 simple 방법을 개발했습니다. 이 방법은 Langendorff가 없으며 심실 및 심방 심근 세포 또는 심장 섬유아세포 또는 선조와 같은 간질 세포를 분리하는 데 유용합니다.
초록
마우스 심장을 이용한 기본 연구에서실행 가능한 개별 심근세포를 격리하는 것은 극복해야 할 중요한 기술적 단계입니다. 전통적으로 토끼, 기니 피그 또는 쥐로부터 심근구를 분리하는 것은 랑엔도르프 장치를 사용하여 효소로 심장의 역행 적 정류를 통해 수행되었습니다. 그러나 이 방법을 작은 마우스 심장과 함께 사용할 때 높은 수준의 기술이 필요합니다. 랑엔도르프 장치를 사용하지 않는 영양 관류 방법은 최근에 마우스 심근세포의 분리를 위해 보고되었다. 본 명세서에서는 성숙한 마우스(8-108주 이전)로부터 개별 심장 세포를 분리하기 위해 절제된 심장의 개선된 영양 배분 관류에 대한 완전한 프로토콜을 보고합니다. 영양 관류는 소비 펌프를 사용하여 절제된 심실의 좌심실 의 정점 근처에 퍼서브를 주입하여 수행됩니다. 모든 절차는 현미경의 밑에 미리 온온히터 매트에 수행됩니다, 이는 주입 및 관류 과정을 감시할 수 있습니다. 결과는 심실 과 심방 심근 세포, 그리고 섬유 아세포가 동시에 단 하나 성인 마우스에서 잘 격리될 수 있다는 것을 건의합니다.
서문
일반적으로, 해부된 조직의 단일 세포 격리의 첫 번째 단계는 조직을 작은 조각으로 잘라내고, 결합 조직 및 효소를 가진 세포외 매트릭스의 소화를 포함한다. 그러나, 심근세포는 콜라겐과 엘라스틴 섬유를 포함한 세포외 매트릭스 성분으로 농축되어 심근을 다진 것이 너무 힘들게 만들고, 심근세포는 저산소증 및 마이크로 환경의 다른 변화에 매우 민감하기 때문에 이러한 도마로 격리될 수 없다. 따라서, 랑엔도르프 계열 역행 관혈 시스템1을이용하여, 효소로 세포외 매트릭스를 소화하는 방법이 심장2,3,4로부터개별 심근세포를 분리하도록 개발되었다.
마우스 모델에서, 랑엔도르프 계의 역행성 심혼은 또한 개별 심근세포의 분리를 위해 이용된다5,6,7,8. 그러나, 작고 얇은 마우스 대어와 그 장착은 성상 심혼에 있는 대어타의 직경이 약 1.2mm이기 때문에, 역행성 perfusion을 수행하기 위하여 Langendorff 장치에 설치하는 기술의 높은 정도를 요구합니다. 또한 랑엔도르프 장치를 세척한 후 다음 심장을 침전시키기 전에 여러 실험을 수행하는 데 시간이 걸립니다.
역행 관류의 대안으로, 랑엔도르프 장치없이 성인 마우스 심장에서 심근구를 분리하는 새로운 방법이 개발되었다. 이 획기적인 제조 방법은 관상 동맥9의영양 가혈을 기반으로하였다. 최근에대마의 클램핑, 바늘 삽입, 온도 조절 등 이 격급 프로토콜의 각 단계를 개선하고현미경(10)으로모든 관류 절차를 모니터링했다. 본 원에서 이 선고성 관류 방법의 정제를 상세히 보고하여 격리 시간을 단축하고 추가 비디오를 제공합니다. 이 방법에서, 심혼의 관류는 효소의 10 mL를 가진 대략 7 분 소요되고, 이 짧은 소화 기간은 세포의 생존도를 증가시킵니다. 이는 2,3-부탄단 단축(BDM)6,11 또는 타우린5,8과같은 화학물질의 첨가를 요구하지 않고 고품질로 단일 심장 세포를 격리하는 간단한 방법입니다. 우리는이 방법은 기술의 기술 임계 값을 낮추고 기본 연구에서 마우스 심근 세포의 유용성을 향상시킬 것이라고 믿습니다.
프로토콜
모든 동물 실험은 미국 국립 보건원 (NIH 간행물 No. 85-23, 개정 1996)에 의해 간행된 실험실 동물의 배려 그리고 사용을 위한 가이드에 부합하고, 의학 동물 관리 및 사용 위원회의 시가 대학 의학회에 의해 승인되었습니다 (2019-3-7 호 승인). 이 방법은 승인된 지침에 따라 수행되었습니다.
1. 악기 및 솔루션
참고: 실험 절차의 개요는 흐름 다이어그램(보충도 1)에설명되어 있습니다. 주입 펌프(또는 주사기 펌프)는 단방향 흐름으로 심장의 대기 중류에 사용해야 합니다. 맥동 유동을 생성하는 연동 펌프는 권장되지 않습니다.
- 실험 전에
- 매니큐어로 끝에서 약 3mm 떨어진 부위에 주사 바늘을 표시합니다. 공기가 건조하도록 허용한 후 실온에서 용기에 보관하십시오. 적색 또는 밝은 색상은 관혈 중에 심근내로 삽입의 깊이를 확인하는 것이 바람직하다.
- 1.5, 0.5 및 0.2mL 샘플 튜브의 뚜껑을 절단하고 양면 테이프 또는 접착제로 60mm 배양 접시의 바닥에 뚜껑을 부착하여 심장을 서십시오. 한 접시에 세 개의 다른 크기의 뚜껑을 고정하면 마우스 심장의 크기에 따라 적절한 뚜껑을 선택할 수 있습니다. 이 심장 스탠드는 세척 후 재사용할 수 있습니다.
- 표 1에표시된 대로 스톡 솔루션을 만듭니다. 스톡 솔루션을 4°C에 저장합니다.
- 실험 당일
참고: 세포 격리 버퍼(CIB)는 (mM에서) 130 NaCl, 5.4 KCl, 0.5 MgCl2,0.33 NaH2PO4,22 포도당, 40 단위/mL 인슐린 및 25 HEPES (PH는 NaOH와 함께 7.4로 조정됨)를 포함합니다. 및 티로드 용액은 (mM) 140 NaCl, 5.4 KCl, 1.8 CaCl2,0.5 MgCl2,0.33 NaH2PO4, 5.5 포도당 및 5.0 HEPES (PH는 NaOH와 함께 7.4로 조정)를 포함합니다.- CIB를 준비합니다. 전자레인지를 사용하여 약 32°C로 증류수(DW)를 따뜻하게 한 다음 10X CIB20mL를 추가합니다. 인슐린 용액의 0.79 g 포도당 및 10 μL을 첨가한 후, 1M NaOH를 사용하여 pH를 조정하고 DW로 200mL로 가져온다.
- 효소 혼합 용액(효소 믹스)을 준비합니다. 콜라게나아제 30 mg, 트립신 1.8 mg, 프로테아제 1.8 mg, 100 mM CaCl2 스톡 용액 90 μL을 CIB 30 mL (최종 Ca2 + 농도는 0.3 mMM)에 넣고 얼음 위에 보관하십시오. 생쥐에서 <4주, 트립신과 프로테아제는 0.9 mg10으로감소한다. 사용하기 전에 수조에 37 °C에서 따뜻하게하십시오.
- CIB-Ca2+-BSA 솔루션을 준비합니다. 30 mg BSA와 100mM CaCl2 스톡 용액의 90 μL을 CIB 15mL(최종 Ca2+ 농도는 1.2mMM)에 추가하고 혼합하고 20μm 필터를 통해 필터를 사용하여 얼음 위에 보관하십시오.
- CIB-EGTA 솔루션을 준비합니다. 1.2.2 및 1.2.3 단계에 설명된 솔루션을 만든 후, 1:1000 희석(최종 EGTA 농도는 0.4mMMM)으로 나머지 CIB에 400m EGTA 스톡 솔루션을 추가하고 혼합한다. CIB-EGTA로 35mm 문화 요리와 하트 스탠드 접시를 채우고 얼음 위에 보관하십시오.
- 약 20mL의 CIB-EGTA를 30mL 유리 비커에 붓고 비커에 플라스틱 이송 파이펫을 서서 얼음 위에 보관하십시오.
- 타이로드 솔루션을 준비합니다. 10X 티로드 100mL를 DW 800mL에 넣고 전자레인지를 사용하여 약 32°C로 데우도록 데우습니다. 포도당 0.99 g와 1M CaCl2의1.8mL를 추가한 후, 1M NaOH를 사용하여 pH를 조정하고 DW로 1000 mL로 가져온다.
- 셀 리서스펜션 용액을 준비합니다. 15mL의 티로드 용액에 BSA 30 mg과 50X 항생제 300 μL을 추가합니다.
- 주사기를 준비합니다. 유연한 확장 튜브와 CIB-EGTA로 표시된 주입 바늘과 연결된 20mL 주사기를 채웁니다. 30mL 주사기를 데운 효소 믹스로 채웁니다. 사용하기 직전까지 37°C에서 모두 누를 수 있습니다.
- 관류 판을 준비합니다. 입체 현미경으로 히터 매트를 미리 데우십시오. 전동 히터 매트에 관류 플레이트(다중 음양판 뚜껑)를 놓습니다. 바침수 판에 발라 바클을 미리 데우며 사용까지 구혈 플레이트에 넣습니다. 60mm 배양 접시를 피펫팅용으로 놓고 전동 히터 매트에 셀 스트레이너도 놓습니다.
2. 마우스 심장의 영양 과수
참고: 심장을 빨아들이는 데 사용되는 플라스틱 이송 파이펫은 부드럽고 끝쪽으로 날카롭게 테이퍼되지 않아야 합니다. 세레이션이 있는 작은 혈관 클램프를 선택합니다. 권장 계측기는 재료 표에나열됩니다.
- 마우스 심장의 절제및 대어테를 클램핑
참고: 성인 마우스 (>8 주 오래 된) 나트륨 펜토 바르 비탈의 과다 복용에 의해 안락사 해야 한다 (>300 mg/kg, 복 막 [i.p.] 주사) 헤파린 (8000 단위/kg).- 빨기하여 마우스 심장을 빠르게 소비합니다.
- 흉부 구멍을 빠르게 열어 심장을 노출시합니다. 플라스틱 이송 파이펫을 잘라, 팁은 노출 된 심장 (일반적으로 팁쪽으로 0.5 mL 마크에서 약 1cm 의 사이트에서, 그러나 그것은 심장 크기에 따라 달라집니다)와 거의 동일한 크기, 또는 약간 작다.
- 파이펫에 심장을 빨아, 가위를 삽입하기에 충분한 공간을 만들기 위해 파이펫을 올리고, 등쪽에서 곡선 가위로 심장을 흥분시켜 아리아를 손상시키지 않도록 합니다.
- 수축을 막기 위해 얼음처럼 차가운 CIB-EGTA가 들어있는 30mL 유리 비커로 즉시 소비된 심장을 옮춥니다. 이 절차는 일반적으로 <1 분 걸립니다.
- 대오르타 주변 청소
- 얼음으로 차가운 CIB-EGTA로 채워진 35mm 배양 접시에 심장을 옮기고 폐와 기타 눈에 보이는 조직을 제거한 다음, 대략 청소된 심장을 차가운 CIB-EGTA로 채워진 심장 스탠드로 옮기고 정점을 내려놓습니다.
- 입체 현미경에서, 대장구장 주위에 청소하는 지방과 결합 조직을 제거합니다. 절단 대동맥의 길이가 너무 긴 경우 brachiocephalic 동맥을 포함 하 여, 왼쪽 일반적인 경동맥 또는 왼쪽 subclavian 동맥, 다음 단계로 진행 하기 위해 그것을 단축 하는 brachiocephalic 동맥 바로 아래 대동맥을 잘라. 이 절차는 일반적으로 약 4 분 걸립니다.
- 대문을 고정하고 관류 판에 클램프 심장을 배치
- 현미경의 밑에, 심장 스탠드에 심혼을 놓습니다. 운전자는 심장의 전방 표면에 직면하고, 핀셋으로 대동맥 끝을 집어 들고, 대동맥을 약간 밀어 붙이면서 작은 혈관 클램프로 아트리아 근처의 대동맥을 고정시켜야 합니다.
- 앞쪽면으로 관류 판에 고정된 심장을 올려 놓고 CIB-EGTA 몇 방울로 덮어 건조하지 않도록 하십시오. 이 절차는 일반적으로 <20 초걸립니다.
- 빨기하여 마우스 심장을 빠르게 소비합니다.
- 심장의 영양관류
참고 : 첫째, 혈액을 배출하고 응고를 방지하기 위해 CIB-EGTA와 심장을 perfuse.- 주사 바늘을 삽입하고 혈액을 배출하는 관류를 시작합니다.
- 유연한 확장 튜브와 주입 펌프에 표시된 주입 바늘에 연결된 예온 된 CIB-EGTA로 채워진 20 mL 주사기를 설정합니다. 0.5 mL/min의 느린 속도로 펌프를 시작하여 바늘과 튜브를 CIB-EGTA로 조심스럽게 채우고 공기가 튜브에 유입되는 것을 방지하십시오.
- 주사제 바늘을 관혈판에 놓고 대각선 모양의 짧은 면을 앞에 놓습니다. 바늘을 만질 때까지 심장 정점을 향해 밀어 넣은 다음 왼쪽 심실 의 정점 근처에 바늘을 비틀지 않고 심실 챔버에 조심스럽게 삽입합니다. 삽입을 수행하는 동안 플레이트에서 바늘을 분리하지 마십시오.
- 빨간색 마크를 보고 바늘 삽입의 깊이를 추정하십시오. 바늘 삽입이 완료되면 관상 동맥에서 흐르는 혈액이 배출되기 시작해야합니다.
- 플레이트의 사출 바늘을 테이프로 고정하고 펌프 속도를 1mL/분으로 늘립니다. 이 절차는 일반적으로 약 30 초 걸립니다. 심장이 성공적으로 침투하는 경우, 피카르슘 바로 아래에 있는 모세관에서 CIB-EGTA의 흐름은 현미경으로 볼 수 있다.
- 효소 믹스로 심장을 풍부하
참고: 효소 관류 동안, 삽입된 바늘의 깊이는 바늘에 빨간 자국을 확인하여 감시될 수 있습니다.- 관상 동맥에서 혈액을 완전히 배출하기 위해 CIB-EGTA의 2-3 mL을 인내한 후, 효소 혼합물로 난투를 변경합니다. 기포가 튜브에 들어오도록 허용하지 마십시오. 효소 믹스의 흐름을 확인하고, 주사 바늘이 빨간 자국의 위치를 확인하여 나오지 않았는지 확인하십시오.
- 1-2mL이 침투한 후 펌프 속도를 1.5mL/분으로 늘립니다. 때때로 파이펫으로 심장에서 흘러나온 혈액을 함유한 축적된 난투를 제거합니다.
참고: 시간이 지남에 따라 심근 벽은 일부 장소에서 반투명하게 되고 얼룩덜룩하게 나타나며, 이는 성공적인 관류에 따른 세포외 매트릭스의 소화의 징후입니다. 또 다른 징후는 효소 믹스에서 Ca 2+의 존재로 인한 심방 박동의 재시작입니다. - 효소 혼합의 총 부피가 10mL일 때 관류를 중지합니다.
- 주사 바늘을 삽입하고 혈액을 배출하는 관류를 시작합니다.
3. 개별 심장 세포의 격리
- 해리 심장 세포
- 효소 믹스와 관류 후, 히터 매트에 놓인 60mm 배양 접시에 주사기에 남아 있는 효소 믹스 10mL을 옮기고 20 mg의 BSA(효소 믹스에 BSA)를 추가한다. 떨어뜨린 BSA 파우더는 손으로 부드럽게 소용돌이침으로써 즉시 녹아야 합니다. 심혼에서 주사 바늘과 혈관 클램프를 제거합니다.
- 심실과 아리아를 분리하고 히터 매트에 0.2% BSA로 보충된 효소 믹스로 각각 옮김합니다.
- 심실 심근 세포의 격리
- 두 개의 핀셋으로 에피카르듐을 잡고, 부드럽게 찢어서 0.2 % BSA로 보충 효소 믹스에서 심실을 좌우로 당깁니다. 부드러운 파이펫팅(약 30회)으로 셀을 분산시합니다.
- 100μm 메쉬 셀 스트레이너를 통해 소화되지 않은 잔해를 걸러내고, 3분 동안 5 ×0g에서 원심분리를 위해 15mL 원심분리기 튜브로 여과물을 전달합니다. 미리 따뜻해진 CIB-Ca2+-BSA 용액에서 펠렛 심근세포를 다시 중단하고 37°C에서 5분 동안 배양한 다음 원심분리기를 14 × g에서 3분 동안 배양합니다.
- 세포 재서스펜션 용액에서 최종 침전된 심근세포를 다시 중단하고(구성은 표 2에나열됨) 37°C에서 보관한다.
- 심방 근세포의 격리
- 3.2 단계에서 심실 근세포 분획에 대한 최종 원심 분리 중에 심방 심근세포를 분리하기 시작합니다. 3.1 단계에서와 같이 저장된 atria를 미리 따뜻워진 CIB-Ca2+-BSA 용액으로 옮기고, 히터 매트의 10 μL에서 파이펫 팁으로 파이펫팅하여 세포를 분리합니다.
- 세포 혼합물을 14× g에서 3분 동안 원심분리하고 세포 재서스펜션 용액으로 펠렛 심방 세포를 재중단한다.
- 심장 섬유아세포의 격리 및 배양
- 3.2단계에서 최초 원심분리기에서 다른 15mL 원심분리기 튜브로 상피체를 옮기고, 원심분리기는 190g에서 5분 동안 ×. 덜벡코의 변형이글 배지(DMEM)에서 원심분리로 침전된 세포를 두 번 세척한 다음, 10% 태아 소 알부민(FBS) 및 항생제로 보충된 DMEM으로 세포를 일시 중단한다.
- 배양 플라스크(25cm2)에서최종 세포 분획을 플레이트하고 세포가 95% 공기 및 5% CO2의가습된 대기에서 플라스크의 바닥에 부착할 수 있도록 한다. 90 분 인큐베이션 후 부착되지 않은 세포를 버리고 신선한 배양 배지를 추가하십시오. 세포는 약 4 일 후에 합류에 가까워야하며, 이 시점에서 트립시화에 의해 증폭되고 새로운 배양 요리로 시드되어야합니다.
4. 아리아와 심실에서 단백질 을 수확
- 관류 후, 아리아와 심실을 분리하고, 1.5mL 샘플 튜브에서 작은 분쇄기를 사용하여 완충의 100 μL에 10mg의 조직 중량의 비율로 리시스 완충제에서 균질화한다.
- 단백질을 추출하기 위해 10분마다 소용돌이가 섞어 40분 간 얼음에 동종모를 보관한 다음, 4°C에서 20분 동안 15000g의 원심분리기를 ×. 단백질 샘플로 -80°C에 상체 분획을 저장합니다.
5. 고립 된 심장 세포의 면역 염색
참고: 생물학적 접착제를 사용하여 세포 이미징 접시의 바닥에 비 부착 성 심근세포의 고정화가 필요합니다.
- 유리 바닥 배양 접시에 고립 된 심근세포의 접착
- 세포 격리를 시작하기 전에 제조업체의 지시에 따라 유리 바닥 배양 접시에 생물학적 접착제(예: Cell-Tak)를 코팅하고 DW로 헹구고 실온에서 공기 건조를 합니다.
- CIB-Ca2+-BSA 용액에서 분리된 심근세포의 재중단 후 접착제 코팅 된 접시의 바닥에 셀 서스펜션을 떨어 뜨리고 동요없이 실온에서 20 분 동안 배양하십시오.
- 면역 염색
- 격리된 심근세포를 생물학적 접착제로 미리 코팅한 유리 바닥 접시에 접시를 매고 40분 동안 실온에서 유지하여 세포가 접시에 부착되도록 합니다. 바닥 유리 배양 접시에 문화 심장 섬유 아세포.
- 인산염 완충식식염(PBS)으로 세포를 헹구고, 흔들리는 5분 동안 4% 파라포름알데히드(PFA)로 고정합니다. 고정된 셀을 PBS로 10분 3회 세척하고, 실온에서 60분 동안 블로킹-투과성용액을 흔들어 보습한다.
- 1 차적인 항체를 가진 프로브 세포는 실온에서 60 분 또는 4 °C에서 하룻밤 동안 차단-투과화 용액에서 희석됩니다. PBS로 세포를 10분 3회 세척한 다음 실온에서 60분 동안 형광 라벨이 부착된 이차 항체로 배양합니다.
- 10 분 동안 PBS로 세 번 세척 한 후, DAPI (PBS에서 1:10000 희석)로 핵을 얼룩. 공초점 레이저 스캐닝 현미경을 사용하여 형광 신호를 분석합니다.
6. 전셀 패치 클램프 레코딩
- 수평 미세 전극 풀러를 사용하여 유리 모세 혈관에서 패치 전극을 제조합니다. 전극의 저항은 K+풍부한 파이펫 용액(표 2)으로채워지면 2 ~ 4 MΩ범위였습니다. 36-37°C에서 1mL/분의 속도로 티로드와 함께 대칭된 반전 된 현미경의 단계에 장착 된 기록 챔버에 절연 된 심근 세포의 알리쿼트를 전송합니다.
- 패치 전극을 통해 1Hz의 속도로 5-10 ms의 전류 펄스를 적용하여 30 mg/mL 암포테리신 B를 함유한 K+리치 파이펫 솔루션을 사용하여 천공 패치 클램프 방법을 사용하여 실행 잠재력을 기록합니다.
7. 웨스턴 블롯 분석
- 이 연구에서는 심방 마커 심방 내성 펩타이드 (ANP)와 같은 작은 분자량 단백질의 서양 얼룩 분석을 수행합니다.
- 단백질 샘플을 1X 시료 버퍼, 2% 2' 메르카토에탄올의 최종 농도로 용해시키고, 단백질을 37°C에서 60분 동안 분해한다. 각 우물에 단백질 20 μg를 적재하고 젤 당 20 mA로 120 분 동안 완충을 실행하여 전기 전도를 수행합니다.
- 단백질을 10V에서 40분 동안 10V로 이송 완충내의 PVDF 멤브레인으로 이송한다. TBST로 이송된 멤브레인을 5분 동안 두 번 세척한 다음 TBST에서 실온에서 60분 동안 5% 탈지 우유로 차단하고, 4°C에서 하룻밤 동안 TBST에 용해된 1차 항체를 프로브한다.
- 7 분 동안 TBST로 멤브레인을 5 번 세척하고 실온에서 120 분 동안 TBST에서 희석 된 이차 항체로 배양하십시오.
- TBST로 멤브레인을 7분 동안 5회 세척한 후, 화학발광 분석으로 신호를 시각화하고 루미노 이미지 분석기로 분석합니다.
결과
이 방법의 원리는 간단하다 : 후두는 왼쪽 챔버에서 흐르고, 대동맥 판막이 열리고, 배후는 혈액 실행과 같은 방향으로 관상 동맥으로 실행, 대동맥은 클램핑에 의해 폐쇄되기 때문에, 이는 세포 외 매트릭스를 소화하기 위해 심근의 깊은 관류를 가능하게.
본 방법으로 갓 분리된 심실 심근세포는 도 1A에도시된다. 도 1B는 심실 및 심방 심근 세포의 확대된 이미지를 나타낸다. 이 격리 절차는 높은 수율 (70%-80%)을 초래했습니다. 종래랑엔도르프 계발 시술7을사용할 때와 유사한 간격으로, 격식 후 약5h(도 1C)내에서 사용할 수 있었던 성인 마우스(8-10주)로부터 의 막대 모양의 정지심심근 심사이클을 사용할 수 있었다. 그러나, 갓 분리된 실행 가능한 세포의 비율은 >2세(도1C)의숙성마우스에서 낮았다. 이 프로토콜을 사용하여 성인 심장당 얻어진 심실 심낭의 총 수는 약 3 x 106 세포였으며, 이는 이전에 보고된 값과 유사했다7,12. 심실 및 심방 심근세포(도1D)에기록된 작용 전위는 랑엔도르프계법(10)에의해 얻어진 세포와 유사하였다. 면역염색 분석은 심실 심낭의 육종구조가 명확하게 보이는 세포막(도2A)으로잘 조직되었다는 것을 확인하였다. 이 방법으로 분리된 개별 심근세포는전기생리분석(10) 또는 면역염색 실험과 같은 실험에서 직접 사용될 수 있다.
심장 섬유아세포는 간질 공간에 존재합니다. 세포 외 매트릭스의 충분한 소화는 그 세포의 격리를 초래한다. 고립 된 심장 섬유아세포는 배양 조건하에서 증식하고 여러 번 통과하거나 적절한 세포 저수지 용액에서 액체 질소에 저장 될 수 있습니다. 도 2B는 배양된 심장 섬유아세포의 대부분이 서브컬쳐 동안 근섬유세포로 변형되었다는 것을 보여 주며, α 부드러운 근육액틴(13,14)의발현이 증가함에 따라 확인되었다. 또한, 심장 선조는 현재의 방법으로 격리되고 자동으로10,15로뛰기 시작하는 적절한 배양 배지에서 배양될 수 있다.
강력한 심근의 균질화는 특히 많은 양의 세포외 섬유를 소유한 숙성 된 마우스의 심장 조직에 대해 쉽지 않습니다. 영양 절전 후, 심실과 심실에서 단백질은 단백질을 추출하는 가벼운 힘으로 용해 완충제에서 쉽게 균질화 될 수 있습니다. 서양 얼룩 분석은 ATria에서 ANP의 특정 발현을 보여주었지만 성인 (20 주 이전)과 세 (108 주 이전) 마우스(도 3)에서심실이 없는 것으로 입증되었습니다.
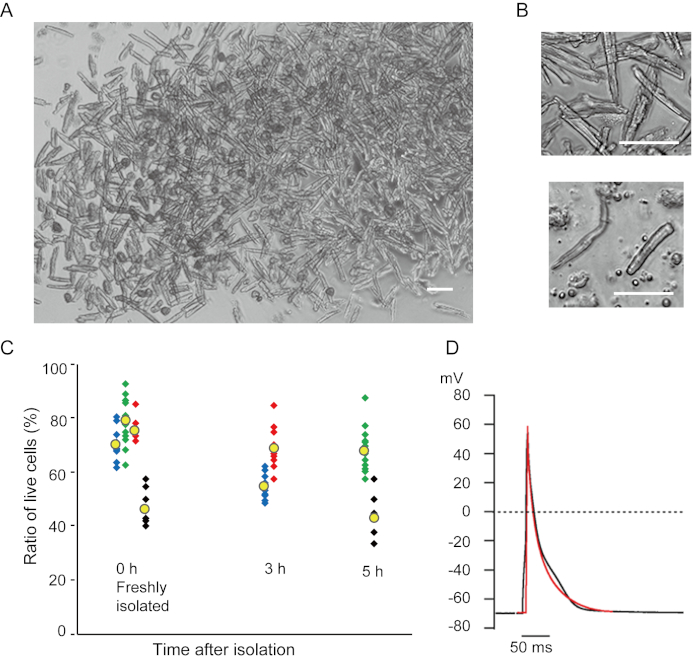
그림 1. 마우스에서 분리된 심근세포. A. 심실 근세포는 음류 관류로 갓 분리되어 있으며, 이미지는 배율이 낮습니다. 최종 세척 후, 심근세포는 2mL의 세포 재서스펜션 용액으로 재중단되었고, 그 중 100μL은 유리 바닥 배양 접시에 떨어졌고 세포 정착이 기다렸다. 바, 100 μm.B. 격리된 심실 심사이클(위) 및 심방 심낭(아래)의 확대된 이미지. Bar, 100 μm.C. 절연 세포는 세포 재서스펜션 용액에서 일시 중단되고 원하는 기간 동안 37°C로 저장되었고, 현미경하에서 10-15개의 필드에 살아있는 심실 심낭의 수가 계산되었다. 둥근 세포는 돌이킬 수 없는 부상을 입었거나죽은 16으로간주되었다. 녹색, 파란색 및 빨간색 기호는 8-10 주 된 3 마리의 마우스에서 얻어졌으며 검은 기호는 106 주 된 마우스에서 나았다. 노란색 기호는 각 그룹의 평균을 나타냅니다. D. 8-10 마우스의 심실 (블랙) 및 심방 (빨간색) 심근 (빨간색) 심근 (빨간색) 심근에서 기록된 대표적인 행동 잠재력. 데이터는 격리 후 약 3시간 동안 세포로부터 얻어졌다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
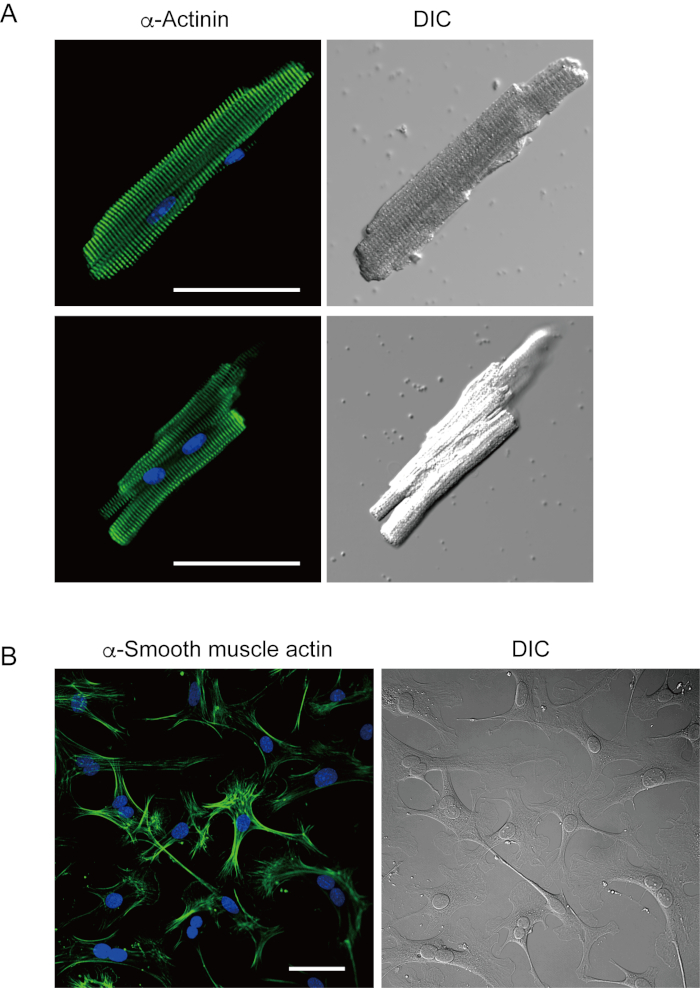
그림 2. 분리된 마우스 심실 근세포에서 α 액틴을 위한 면역 염색및 배양마우스 심장 섬유아세포에서 α 매끄러운 근육 액틴. A. α 액티닌(녹색), 핵(blue)을 위한 DAPI 염색 및 선행 관류를 가진 마우스 심근세포의 DIC 이미지에 대한 면역스테인링의 공초점 레이저 스캐닝 현미경 검사. Bar, 50 μm.B. 면역 염색α 부드러운 근육 액틴 (녹색), 핵 (파란색)에 대한 DAPI 염색 및 영양 과구가있는 마우스 심장에서 분리 된 심장 섬유 아세포의 DIC 이미지. 심장 섬유아세포는 4일 동안 배양되었다. 바, 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
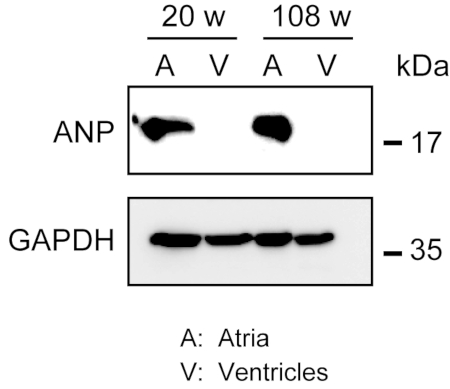
그림 3. atria 및 심실에서 ANP의 서양 얼룩 분석. 심방 마커 심방 내성 펩티드 (ANP)에 대한 서양 얼룩 분석은 성인 (20 주) 및 숙성 (108 주) 심혼에서 제조된 심실 (V) 에서 제조된다. ANP는 심실에 존재하지 만 심실에 존재하지 않습니다. 글리세랄데히드 3-인산염 탈수소효소(GAPDH)를 대조군 하우스 키핑 단백질로 사용하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 심장 세포 격리를 위한 스톡 솔루션 | |
| 10X CIB (500mL) | |
| 나Cl | 37.99 g |
| KCI | 2.01 g |
| 1 M MgCl2 | 2.5 mL |
| NaH2PO4 | 0.23 g |
| 헤페스 | 29.79 g |
| DW | 최대 500mL 채우기 |
| 100 mM CaCl2 주식 주 | |
| CaCl2 | 100mM |
| 400m EGTA 스톡 솔루션 | |
| EGTA | 400mM |
| 인슐린 솔루션 | |
| 인슐린 | 0.1 M HCl에서 1 유닛/mL |
| 50X 항생제 재고 솔루션(20mL) | |
| 페니실린 | 100 mg |
| 연쇄상 구균 | 100 mg |
| 페놀 레드 | 1.5 g |
| DW | 20mL 및 필터링으로 살균 |
| 10X 타이로드 용액 (1000 mL) | |
| 나Cl | 81.82 g |
| KCl | 4.03 g |
| 1 M MgCl2 | 5 mL |
| NaH2PO4 | 0.47 g |
| 헤페스 | 11.92 g |
| 나오 (주) | 0.8 g |
| DW | 최대 1000mL 채우기 |
| 면역 염색용 스톡 솔루틴 | |
| DAPI 주식 | |
| DAPI | 메탄올에 2 mg/mL |
| 웨스턴 블롯용 스톡 솔루션 | |
| 헤페스 버퍼 (100mL) | |
| 나Cl | 0.88 g |
| 400 mM EGTA | 0.25 mL |
| 헤페스 | 0.24 g |
| 1M 나오 | pH를 7.4로 조정 |
| DW | 최대 500mL 채우기 |
| 프로테아제 억제제 칵테일 | |
| 미니 완성 | 1 정수 |
| DW | 0.4 mL |
표 1. 주식 솔루션에 대한 설명. 재고 솔루션을 4°C로 유지하십시오. -20°C에서 보관을 위한 Aliquot 프로테아제 억제제 칵테일.
| 심장 세포를 제거하기위한 솔루션 | |
| CIB (200mL) | |
| 10X CIB | 20mL |
| 인슐린 솔루션 | 0.01 mL |
| 포도당 | 0.79 g |
| 1M 나오 | pH는 7.4로 조정 |
| DW | 최대 200mL 채우기 |
| 효소 혼합 용액 (30 mL) | |
| 콜라게나아제 타입2 | 30 mg |
| 트립신 | 1.8 mg |
| 프로테아제 | 1.8 mg |
| 100 mM CaCl2 스톡 솔루션 | 0.09 mL |
| CIB | 30mL |
| CIB-Ca2+-BSA (15mL) | |
| BSA | 30 mg |
| 100 mM CaCl2 스톡 솔루션 | 0.18 mL |
| CIB | 15 mL |
| CIB-EGTA (150mL) | |
| 400m EGTA 스톡 솔루션 | 0.150 mL |
| CIB | 150mL |
| 타이로드 솔루션 (1000 mL) | |
| 10X 타이로드 스톡 솔루션 | 100 mL |
| 포도당 | 0.99 g |
| 1M 카클2 | 1.8 mL |
| 1M 나오 | pH는 7.4로 조정 |
| DW | 최대 1000mL 채우기 |
| 셀 리서스펜션 용액(15mL) | |
| BSA | 30 mg |
| 50X 항생제 재고 솔루션 | 0.3mL |
| 타이로드 솔루션 | 15 mL |
| 면역 염색을 위한 솔루션 | |
| 셀 부착 용액(0.3mL) | |
| 셀탁 | 0.01 mL |
| 0.1 M NaHCO3 (pH8.0) | 0.285 mL |
| 0.1 M 나오 | 0.005 mL |
| 블로킹-페르메아빌리자틴 용액 (10mL) | |
| 태아 소 혈청 | 1 mL |
| 트리톤 X-100 | 1 mL |
| 10X PBS | 1 mL |
| DW | 7 mL |
| K+ 풍부한 파이펫 솔루션 | |
| 칼륨 아산자 | 70 mM |
| KCl | 50mM |
| KH2PO4 | 10mM |
| MgSO4 | 1 mM |
| ATP 디나트륨 소금 | 3 mM |
| GTP 리튬 염 | 0.1 mM |
| EGTA | 5 mM |
| 헤페스 | 5 mM |
| 코 | pH는 7.2로 조정 |
| 웨스턴 블롯용 솔루션 | |
| 리시스 버퍼 (1mL) | |
| 헤페 버퍼 | 0.86 mL |
| 노니데-P40 | 0.1 mL |
| 프로테아제 억제제 칵테일 | 0.04 mL |
| 런닝 버퍼 (1000 mL) | |
| 10X TG (0.25 M 트라이및 1.92 M 글리신) | 100 mL |
| SDS | 1 g |
| DW | 900 mL |
| 전송 버퍼(1000mL) | |
| 10X TG | 100 mL |
| 메탄올 | 200 mL |
| DW | 700 mL |
| 블로팅 버퍼(TBST) (1000 mL) | |
| 5M 나Cl | 20mL |
| 2M 트라이-HCl (pH 7.5) | 5 mL |
| 10% 트웬 20 | 10mL |
| DW | 965 mL |
표 2. 심장 세포, 면역 염색 및 서양 얼룩을 격리하기위한 작업 솔루션에 대한 설명. 실험 직전에 모든 작업 솔루션을 준비합니다.
보충 도 1. 셀 격리의 개요입니다. 심실 및 심방 근세포 및 심장 섬유아세포의 절연의 흐름 다이어그램은 단일 심장에서. 이 그림을 다운로드하려면 여기를 클릭하십시오.
토론
심장은 허혈에 매우 취약하기 때문에, 심장을 소비하고 수축을 중지 얼음 차가운 CIB-EGTA에 몰입하는 데 걸리는 시간은 가능한 한 짧게 유지되어야한다 (<1 분). 이 메서드의 첫 번째 중요 단계입니다. 두 번째 중요한 단계는 마음의 방향에 관한 것입니다. 단계 2.1.2에서 절제 된 심장의 특정 방향은 대어타 주위의 지방 및 결합 조직을 쉽게보고 제거 할 수 있습니다. 대금반 주위를 청소한 후, 고정된 심장을 앞쪽 표면면을 관류판에 올려 놓습니다. 마지막 중요한 단계는 주입 바늘의 삽입을 관련시킵니다. 바늘을 심장쪽으로 전진할 때, 주사 바늘은 플레이트로부터 일정한 거리를 유지하기 위해 관류 판에서 분리되어서는 안된다. 삽입의 위치는 좌심실의 정점 근처에 있습니다. 이러한 비틀림이 구멍을 확대 할 수 있기 때문에, 비틀지 않고 조심스럽게 바늘을 삽입합니다. 바늘의 삽입의 깊이는 빨간 자국을 보고 추정될 수 있다. 바늘이 너무 깊게 삽입되면 팁은 심실 중격을 관통하고 오른쪽 심실을 입력하거나 승모 판막이 있지만 왼쪽 아트리움에 들어갈 수 있습니다. 관상 동맥에서 혈액의 실종을 확인 한 후, 바늘은 관류 판에 테이프로 고정해야합니다.
대오르타 길이가 길어지면 대어를 올바른 위치에 고정하기가 어렵습니다. 클램프가 심장에서 너무 멀리 떨어져 있으면, 심혼은 주입 후 회전할 수 있습니다. 이를 방지하기 위해, 바로 brachiocephalic 동맥 아래에 대동맥을 잘라 클램핑 하기 전에 대동맥을 단축.
혈액이 0.5 mL /min의 초기 속도로 관류 후 배출되기 시작하지 않으면 속도를 1 mL /min로 증가시킵니다. 도움이 되지 않는 경우, 주사 바늘은 오른쪽 심실, 심실 중격 또는 왼쪽 심근 벽과 같이 잘못 배치될 수 있다. 이러한 경우 바늘을 즉시 제거하고 왼쪽 심실의 정점 근처에 다시 삽입하십시오. 바늘을 여러 번 삽입할 때 소화된 세포가 열린 구멍에서 흘러나올 수 있습니다. 이것은 일반적으로 세포 격리에 심각한 영향을 미치지 않습니다.
연산자는 스테레오스코픽 현미경을 사용하여 심장의 영양 관류의 전체 과정을 모니터링하여 소화와 함께 아트리아의 구타의 색상과 투명성의 변화를 관찰할 수 있습니다. 효소 믹스의 총 10 mL는 오래된 심장에 대해서도 필요한 최대여야합니다. 젊은 마음 (5-7 주 이전)에서, 우리는 동일한 효소 믹스와 역행 관류를 통해 접근 과 유사한 9 mL로 볼륨을 감소시다.
최종 원심분리기의 상신제는 파편, 혈액세포 및 비심낭세포를 포함하는 반면, 펠릿에는 주로 심근세포와 섬유아세포 및 내피세포와 같은 비심세포오염이 포함되어 있습니다. 심근세포를 정화하려면 더 많은 단계가 필요합니다. 일반적으로 펠릿은 적절한 세포 배양 배지에서 재주중단되고 조직 세포 배양 접시에 37°C에서 2시간 동안 준비한 다음 배양에 대한 파이펫팅 및 준비로 심근세포를 부드럽게 제거해야 한다.
효소 믹스는 Ca2+ (0.3 mMM)의 낮은 농도를 포함합니다. 따라서 우리는 CIB-Ca2+-BSA (1.2 mMM Ca2+)에서소화 된 세포를 배양하고 세포 회수 용액 (1.8 mMCa2 +)으로최종 재발 방지 전에 Ca2 +의 점진적 증가는 세포 손상을 유발하는 것을방지합니다 7. 고립 된 심근세포가 손상되지 않는 한 (수축이없는 정지 세포)이 Ca2 +적응 절차는 마우스의 세포 생존가능성에 영향을 미치지 않습니다. 손상된 세포가 이 잠복기 도중 정지하고 있기 때문에, 우리는 결과적으로 건강한 세포 단을 얻습니다. 유사하게, 절연된 심방 심근세포(불규칙한 수축 이없는 퀼트 세포)는 동일한 세포 회수 용액에 저장될 수 있다. 그러나, 심방 심근세포는 심실 심근세포에 비해 저장되는 것이 더 섬세해 경향이 있다.
실험실에서, 이 격리 방법은 왼쪽 심실에 바늘 삽입이 실패하지 않는 한 거의 항상 성공적이다. 우리는 또한 외과 횡방향 대동맥 수축에 의해 준비된 비대성 심혼에서 세포를 격리하는 것을 성공했습니다. 그러나, 종종 작은 심근 경색이 있는 숙성 마우스에서는, 관류는 어떤 장소에서 중단되고, 불완전한 소화의 결과로, 따라서 낮은 수율(그림 1C),Langendorff 기지를 둔 역행 방법과 유사합니다. 이러한 경우, 관류의 시작에도 심장의 왜곡된 모양을 관찰할 수 있다.
이 영양 관류 방법은 토끼와 기니 피그와 같은 다양한 연령대의 쥐에서 심장 세포를 분리하는 데 유용합니다. 이 방법을 신생아 또는 청소년 쥐에 적용 하기 전에 수 있습니다.
이 선행 관류 방법의 장점 중 하나는 작은 마우스 하트에 대한 Langendorff 기반 역행 관류 방법을 사용하는 것과 관련된 기술적 장애물을 감소시키는 것입니다. 관류에 필요한 시간은 효소의 10mL로 약 7 분이며,이 짧은 소화 기간은 세포의 생존가능성을 증가시킵니다. 또한 대동맥 판막이 소화된 후에도 심혼의 관상 동맥 순환을 통해 관전을 수행할 수 있습니다. 심방 근세포의 격리는 일반적으로 랑엔도르프 기반역성 역행 성 관류및효소(17)를가진 추가 배양을 필요로 한다. 그러나 이 영양 배후 접근법은 심방 근구를 분리하는 효소로 조직을 깊이 침투시킬 수 있습니다.
여러 마우스를 사용한 실험에서 랑엔도르프 장치는 다음 심장을 침투하기 전에 세척해야 합니다. 그러나, 본 선급방법에서는, 원하는 수의 계측기 세트(예를 들어, 주사기 바늘 및 관류 판)가 사전에 제조되는 한, 관류는 지속적으로 수행될 수 있다.
본 명세서에서는 추가 화학물질이 없는 랑엔도르프 계 역행 관류 방법과 동일한 솔루션을 사용하여 마우스 심장의 선행 관류의 기본 방법론을 보고합니다. 멸부의 조성물은 세포탈화된심장(18)을만들기 위해 효소 대신 EGTA를 함유하는 세제를 사용하는 등의 실험의 목적에 맞게 변경될 수 있다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 태야마모토와 Y. 모리가 형태학적 실험에 도움을 준 것에 대해 감사를 표합니다. 이 작품은 과학진흥을 위한 일본학회(18K06871~M.O.K., 17K08536~H.M.)의 과학연구보조금(C)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
참고문헌
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, Pt 3 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688(2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유