Method Article
Farelerden Kardiyomiyosit İzolasyonu için Antegrad Perfüzyon Yöntemi
Bu Makalede
Özet
Antegrad perfüzyon tekniği ile yüksek kaliteli bireysel fare kalp hücrelerini izole etmek için basit bire yöntemi geliştirdik. Bu yöntem Langendorff içermez ve kardiyak fibroblastlar veya progenitörler gibi ventrikül ve atriyal miyositleri veya interstisyel hücreleri izole etmek için yararlıdır.
Özet
Fare kalbi kullanılarak yapılan temel araştırmalarda, uygulanabilir bireysel kardiyomiyositleri izole etmek üstesinden gelinmesi gereken önemli bir teknik adımdır. Geleneksel olarak, tavşanlardan, kobaylardan veya sıçanlardan kardiyomiyositlerin izole edilmesi, langendorff aparatı kullanılarak enzimlerle kalbin retrograd perfüzyonu yoluyla gerçekleştirilir. Bununla birlikte, bu yöntem küçük bir fare kalbi ile kullanıldığında yüksek derecede beceri gerekir. Yakın zamanda fare kardiyomiyositlerinin izolasyonu için Langendorff aparatı kullanmayan bir antegrad perfüzyon yöntemi bildirilmiştir. Burada, yetişkin farelerden (8 - 108 haftalık) bireysel kalp hücrelerini izole etmek için ekscise kalbin gelişmiş antegrad perfüzyonu için tam bir protokol bildiriyoruz. Antegrad perfüzyon, bir infüzyon pompası kullanılarak, aortları kenetlenmiş olan eksizyon kalbinin sol ventrikülünün zirvesine perfüzyon enjekte edilmesiyle gerçekleştirilir. Tüm prosedürler, enjeksiyon ve perfüzyon işlemlerinin izlenmesini sağlayan mikroskop altında önceden ısıtılmış bir ısıtıcı paspas üzerinde gerçekleştirilir. Sonuçlar, ventrikül ve atriyal miyositlerin ve fibroblastların aynı anda tek bir yetişkin fareden iyi izole edilebileceğini göstermektedir.
Giriş
Genel olarak, parçalanmış dokunun tek hücre izolasyonunun ilk adımı, dokuyu küçük parçalara ayırmayı, ardından bağ dokusunun ve hücre dışı matrisin enzimlerle sindirilmesini içerir. Bununla birlikte, kardiyomiyositler böyle bir doğrama yöntemiyle izole edilemez, çünkü kollajen ve elastin lifleri de dahil olmak üzere hücre dışı matris bileşenleriyle zenginleştirme miyokardları kıymak için çok zor hale getirir ve kardiyomiyositler hipoksiye ve mikroçevrimdeki diğer değişikliklere karşı oldukça hassastır. Böylece, Langendorff tabanlı retrograd perfüzyon sistemi1kullanılarak, hücre dışı matrisi enzimlerle sindirme yöntemi, bireysel kardiyomiyositleri kalpten izole etmek için geliştirilmiştir2,3,4.
Fare modellerinde, langendorff bazlı retrograd perfüzyon kalbin enzimlerle perfüzyonu, bireysel kardiyomiyositlerinizolasyonuiçin de kullanılır 5 ,6,7,8. Bununla birlikte, küçük ve ince fare aortunun kanülasyonu ve retrograd perfüzyon yapmak için Langendorff aparatına montesi yüksek derecede beceri gerektirir, çünkü yetişkin kalbindeki aortu çapı yaklaşık 1,2 mm'dir. Ayrıca, Langendorff aparatı bir sonraki kalbe perfüzyon yapmadan önce temizlenmesi gerektiğinden, birden fazla deney yapmak zaman alır.
Retrograd perfüzyona alternatif olarak, langendorff aparatı olmadan yetişkin bir fare kalbinden kardiyomiyositleri izole etmek için yeni bir yöntem geliştirilmiştir. Bu çağ yapma yöntemi koroner arterlerin antegrad perfüzyonunu temel9. Son zamanlarda aortu sıkıştırma, iğne takma ve sıcaklık kontrolü gibi bu antegrad protokolün her adımını geliştirdik ve tüm perfüzyon prosedürlerini mikroskop10ile izledik. Burada, izolasyon süresini kısaltmak ve ek bir video sağlamak için bu antegrad perfüzyon yönteminin inceliğini ayrıntılı olarak rapor ediyoruz. Bu yöntemde, kalbin perfüzyonu enzimlerin 10 mL'si ile yaklaşık 7 dakika sürer ve bu kısa sindirim süresi hücrelerin canlılığını arttırır. Bu, 2,3 butanedione monoksim (BDM)6,11 veya taurin5,8gibi kimyasalların eklenmesini gerektirmeden tek kalp hücrelerini yüksek kalitede izole etmek için basit bir yöntemdir. Bu yöntemin tekniğin beceri eşiğini düşüreceğine ve temel araştırmalarda fare kardiyomiyositlerinin yararını artıracağına inanıyoruz.
Protokol
Abd Ulusal Sağlık Enstitüleri (NIH Yayını No. 85-23, revize edilmiş 1996) tarafından yayınlanan Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun tüm hayvan deneyleri Shiga Tıp Bilimi Üniversitesi Hayvan Bakım ve Kullanım Komitesi kurumsal İnceleme Kurulu tarafından onaylanmıştır (onay no. 2019-3-7). Yöntemler onaylanmış yönergelere uygun olarak gerçekleştirilmiştir.
1. Enstrümanlar ve çözüm
NOT: Deneysel prosedürün ana hatları bir akış diyagramında gösterilmiştir (Tamamlayıcı Şekil 1). Kalbin tek yönlü bir akışla antegrad perfüzyonu için bir infüzyon pompası (veya şırınna pompası) kullanılmalıdır. Titreşimli bir akış oluşturan peristaltik bir pompa önerilmez.
- Deneyden önce
- Enjeksiyon iğnesini uçtan yaklaşık 3 mm uzaklıktaki bir yerde oje ile işaretleyin. Havanın kurumasını sağladıktan sonra, oda sıcaklığında kapta saklayın. Perfüzyon sırasında miyokard içine ekleme derinliğini doğrulamak için kırmızı veya parlak bir renk istenir.
- 1,5, 0,5 ve 0,2 mL'lik numune tüplerinin kapaklarını keserek ve kapakları çift taraflı bant veya yapıştırıcı ile 60 mm'lik bir kültür kabının dibine takarak kalbin ayakta durmasını sağlar. Üç farklı boyutlu kapağın bir tabakta sabitlenmesi, fare kalbinin boyutuna göre uygun olanı seçmeyi mümkün kılar. Bu kalp standı yıkandıktan sonra tekrar kullanılabilir.
- Tablo 1'degösterildiği gibi stok çözümü yapın. Stok çözümlerini 4 °C'de saklayın.
- Deney gününde
NOT: Hücre izolasyon tamponu (CIB) içerir (mM içinde) 130 NaCl, 5.4 KCl, 0.5 MgCl2, 0.33 NaH2PO4, 22 glikoz, 40 birim / mL insülin ve 25 HEPES (pH NaOH ile 7.4'e ayarlanmış); ve Tirot çözeltisi (mM olarak) 140 NaCl, 5.4 KCl, 1.8 CaCl2, 0.5 MgCl2, 0.33 NaH2PO4, 5.5 glikoz ve 5.0 HEPES (NaOH ile 7.4'e ayarlanmış pH) içerir.- CIB'i hazırlayın. Mikrodalga kullanarak 160 mL damıtılmış suyu (DW) yaklaşık 32 °C'ye ısıtın ve ardından 20 mL 10X CIB ekleyin. 0,79 g glikoz ve 10 μL insülin çözeltisi ilave ettikten sonra, 1 M NaOH kullanarak pH'ı ayarlayın ve DW ile 200 mL'ye getirin.
- Enzim karışımı çözeltisini (enzim karışımı) hazırlayın. 30 mg kollajenaz, 1.8 mg tripsin, 1.8 mg proteaz ve 90 μL 100 mM CaCl2 stok çözeltisini 30 mL CIB'ye ekleyin (son Ca2 + konsantrasyonu 0.3 mM'dir), karıştırın ve buzda tutun. 4 haftalık < farelerde, tripsin ve proteazı 0.9 mg10'a düşürün. Kullanmadan önce bir su banyosunda 37 °C'de ısıtın.
- CIB-Ca2+-BSA çözümünü hazırlayın. 15 mL CIB'ye 30 mg BSA ve 90 μL 100 mM CaCl2 stok çözeltisi ekleyin (son Ca2+ konsantrasyonu 1,2 mM'dir), karıştırın, 20-μm filtreden filtreleyin ve buzda tutun.
- CIB-EGTA çözümünü hazırlayın. 1.2.2 ve 1.2.3 adımlarında açıklanan çözümleri yaptıktan sonra, kalan CIB'ye 1:1000 seyreltmede 400 mM EGTA stok çözeltisi ekleyin (nihai EGTA konsantrasyonu 0.4 mM'dir) ve karıştırın. 35 mm'lik kültür yemeğini ve kalp standı yemeğini CIB-EGTA ile doldurun ve buzda tutun.
- 30 mL'lik bir cam kabın içine yaklaşık 20 mL CIB-EGTA dökün ve beherde plastik bir transfer pipetini bekletin ve buzda tutun.
- Tırrode çözümünü hazırlayın. 800 mL DW'ye 100 mL 10X Tirod ekleyin ve mikrodalga kullanarak yaklaşık 32 °C'ye ısıtın. 0.99 g glikoz ve 1.8 mL 1 M CaCl2ekledikten sonra, pH'ı 1 M NaOH kullanarak ayarlayın ve DW ile 1000 mL'ye getirin.
- Hücre resüspensyon çözeltisini hazırlayın. 15 mL Tirot çözeltisine 30 mg BSA ve 300 μL 50X antibiyotik ekleyin.
- Şırınnaları hazırlayın. Esnek uzatma tüpü ve işaretli enjeksiyon iğnesi ile bağlı 20 mL şırıngayı CIB-EGTA ile doldurun. 30 mL şırınnayı ısıtılmış enzim karışımı ile doldurun. Kullanmadan hemen öncesine kadar ikisini de 37 °C'de tutun.
- Perfüzyon plakasını hazırlayın. Isıtıcı paspasını stereoskopik mikroskop altında önceden ısıtın. Perfüzyon plakasını (çok kuyulu bir kültür plakasının kapağı) önceden ısıtılmış ısıtıcı paspasın üzerine yerleştirin. Damar kelepçesini kullanıma kadar perfüzyon plakasına yerleştirerek önceden ısıtın. Pipetleme için 60 mm'lik kültür çanağı ve hücre süzgecini önceden ısıtılmış ısıtıcı paspasın üzerine de yerleştirin.
2. Fare kalbinin antegrad perfüzyonu
NOT: Kalbi emmek için kullanılan plastik transfer pipet yumuşak olmalı ve ucuna doğru keskin bir şekilde konik olmamalıdır. Tırtıklı küçük bir vasküler kelepçe seçin. Önerilen araçlar Malzeme Tablosundalistelenmiştir.
- Fare kalbinin eksizyonu ve aortu sıkıştırma
NOT: Yetişkin fareler (>8 haftalık) heparin (8000 birim/kg) ile aşırı dozda sodyum pentobarbital (>300 mg/kg, intraperitoneal [i.p.] enjeksiyon) ile ötenazi yapılmalıdır.- Emerek fare kalbini hızlı bir şekilde geçirin.
- Kalbi açığa çıkarmak için torasik boşluğu hızla açın. Ucu açıkta kalan kalple yaklaşık olarak aynı boyutta veya biraz daha küçük olan plastik transfer pipetini kesin (genellikle 0,5 mL işaretinden uca doğru yaklaşık 1 cm uzaklıktaki bir yerde, ancak kalp boyutuna bağlıdır).
- Kalbi pipete emin, makas eklemek için yeterli alan oluşturmak için pipeti kaldırın ve kalbi sırt tarafından kavisli makasla çıkararak atriaya zarar vermekten kaçının.
- Kasılmayı durdurmak için eksiz kalbi hemen buz soğutmalı CIB-EGTA içeren 30 mL'lik cam behere aktarın. Bu prosedür genellikle <1 dakika sürer.
- Aortu temizleme
- Kalbi buz soğutmalı CIB-EGTA ile dolu 35 mm'lik bir kültür yemeğine aktarın ve akciğeri ve diğer görünür dokuları çıkarın ve ardından kabaca temizlenmiş kalbi soğutulmuş CIB-EGTA ile dolu kalp standına aktarın ve tepeyi aşağı yerleştirin.
- Stereoskopik mikroskop altında, aortu temizlemek için yağ ve bağ dokularını çıkarın. Brakiyofalik arter, sol ortak karotis arter veya sol subklaviyen arter dahil olmak üzere kesilen aortu uzunluğu çok uzunsa, bir sonraki adıma geçmek için braşiosefalik arterin hemen altındaki aortu kesin. Bu prosedür genellikle yaklaşık 4 dakika sürer.
- Aortu sıkıştırmak ve kenetlenmiş kalbi perfüzyon plakasına yerleştirmek
- Mikroskop altında kalbi kalp standına yerleştirin. Operatör kalbin ön yüzeyine bakmalı, aortu cımbızla almalı ve aortu biraz aşağı iterken aortu küçük bir vasküler kelepçe ile atria'nın yakınında kenetlemelidir.
- Kenetlenmiş kalbi ön tarafı yukarıda olacak şekilde perfüzyon plakasına yerleştirin ve kurumasını önlemek için birkaç damla CIB-EGTA ile örtün. Bu prosedür genellikle <20 s sürer.
- Emerek fare kalbini hızlı bir şekilde geçirin.
- Kalbin antegrad perfüzyonu
NOT: öncelikle kanı boşaltmak ve pıhtılaşmayı önlemek için kalbi CIB-EGTA ile perfüze edin.- Enjeksiyon iğnesini yerleştirin ve kanı boşaltmak için perfüzyona başlayın
- Esnek uzatma tüpüne bağlı önceden ısıtilmiş CIB-EGTA ve infüzyon pompasına işaretli bir enjeksiyon iğnesi ile dolu 20 mL şırıngayı ayarlayın. İğne ve tüpü CIB-EGTA ile dikkatlice doldurmak için pompayı 0,5 mL/dk yavaş bir hızda başlatın ve tüpe herhangi bir hava girmesini önlediğinizden emin olun.
- Enjeksiyon iğnesini, öndeki diyagonal şeklin daha kısa tarafı ile perfüzyon plakasına yerleştirin. İğneyi dokunana kadar kalbin tepe noktasına doğru kaydırın ve ardından iğneyi sol ventrikülün tepe noktasına doğru bükmeden dikkatlice ventrikül odasına yerleştirin. Yerleştirme işlemi yaparken iğneyi plakadan ayırmayın.
- İğne yerleştirmenin derinliğini tahmin etmek için kırmızı işareti izleyin. İğne takma işlemi tamamlandığında koroner arterden akan kanlar taburcu edilmeye başlanmalıdır.
- Plakadaki enjeksiyon iğnesini bantla sabitleyin ve pompa hızını 1 mL / dak'a çıkarın. Bu prosedür genellikle yaklaşık 30 s sürer. Kalp başarılı bir şekilde perfüzyona maruz kalırsa, epikardyumun hemen altındaki kılcal damardaki CIB-EGTA'nın akışı mikroskop altında görülebilir.
- Enzim karışımı ile kalbi perfüzyon
NOT: Enzimyak perfüzyon sırasında iğne üzerindeki kırmızı işaret kontrol edilerek takılan iğnenin derinliği izlenebilir.- Koroner arterden kanı tamamen boşaltmak için 2-3 mL CIB-EGTA'ya perfüzyon yapıldıktan sonra, perfüzatı enzim karışımına değiştirin. Hava kabarcıklarının tüpe girmesine izin vermekten kaçının. Enzim karışımının akışını kontrol edin ve kırmızı işaretin konumunu kontrol ederek enjeksiyon iğnesinin çıkmadığından emin olun.
- 1-2 mL perfüzyon yapıldıktan sonra pompa hızını 1,5 mL/dk'ya yükseltin. Zaman zaman pipetle kalpten akan kan içeren birikmiş perfüzatı çıkarın.
NOT: Zamanla, miyokard duvarı bazı yerlerde yarı saydam hale gelecek ve benekli görünecektir, bu da başarılı perfüzyondan sonra hücre dışı matrisin sindiriminin bir işaretidir. Başka bir işaret, enzim karışımında Ca2+ varlığından kaynaklanan atriyal atağın yeniden başlatılmasıdır. - Perfüzyon yapılan enzim karışımının toplam hacmi 10 mL olduğunda perfüzyonu durdurun.
- Enjeksiyon iğnesini yerleştirin ve kanı boşaltmak için perfüzyona başlayın
3. Bireysel kalp hücrelerinin izolasyonu
- Kalp hücrelerini ayrıştırıyor
- Enzim karışımı ile perfüzyondan sonra, şırıngda kalan enzim karışımının 10 mL'sini ısıtıcı paspasa yerleştirilen 60 mm'lik bir kültür kabına aktarın ve 20 mg BSA ekleyin (enzim karışımında% 0.2 BSA). Düşen BSA tozu, bir elle hafifçe dönerek hemen çözülmelidir. Enjeksiyon iğnesini ve damar kelepçesini kalpten çıkarın.
- Ventrikülleri ve atriayı ayırın ve her biri ısıtıcı paspasında% 0.2 BSA ile desteklenmiş enzim karışımına aktarın.
- Ventrikül miyositlerinin izolasyonu
- Epicardiumu iki cımbızla alın ve %0,2 BSA ile desteklenmiş enzim karışımında ventrikülleri hafifçe yırtın ve bir yandan diğer yana çekerek küçük parçalara ayırın. Hücreleri nazik pipetleme ile dağıtın (yaklaşık 30 kez).
- Sindirilmemiş kalıntıları 100-μm örgü hücre süzgecinden geçirin ve filtratı 3 dakika boyunca 50 × g'da santrifüjleme için 15 mL'lik bir santrifüj tüpüne aktarın. Peletlenmiş kardiyomiyositleri önceden ısıtılmış CIB-Ca2+-BSA çözeltisine yeniden kullanın, 37 °C'de 5 dakika kuluçkaya yatırın ve ardından 3 dakika boyunca 14 × g'da santrifüj edin.
- Hücre resüspenzyon çözeltisindeki son çökülen kardiyomiyositleri yeniden kullanın (kompozisyon Tablo 2'delistelenmiştir) ve 37 °C'de tutun.
- Atriyal miyositlerin izolasyonu
- Adım 3.2'deki ventriküler miyosit fraksiyonu için son santrifüjleme sırasında, atriyal miyositleri izole etmeye başlayın. Adım 3.1'de olduğu gibi depolanan atriayı önceden ısıtılmış CIB-Ca2+-BSA çözeltisine aktarın, parçalara ayırın ve ısıtıcı paspasında 10 μL'de pipet ucuyla pipetle pipetle pipetle kaplayarak hücreleri ayırın.
- Hücre karışımını 3 dakika boyunca 14 × g'da santrifüjleyin ve peletlenmiş atriyal hücreleri hücre resüspensyon çözeltisi ile yeniden kullanın.
- Kardiyak fibroblastların izolasyonu ve kültürü
- Süpernatantı 3.2 adımındaki ilk santrifüjden başka bir 15 mL santrifüj tüpüne aktarın ve 5 dakika boyunca 190 × g'da santrifüj. Çökemiş hücreleri Dulbecco'nun Modifiye Kartal Ortamı'nda (DMEM) santrifüjleme ile iki kez yıkayın ve ardından hücreleri% 10 fetal sığır albümin (FBS) ve antibiyotiklerle desteklenmiş DMEM ile askıya alın.
- Son hücre fraksiyonunu bir kültür şişesinde (25 cm2)plakala ve hücrelerin şişenin dibine% 95 hava ve% 5 CO2nemli bir atmosferde yapışmasını sağlar. 90 dakikalık inkübasyondan sonra, eklenmemiş hücreleri atın ve taze kültür ortamı ekleyin. Hücreler yaklaşık 4 gün sonra izdiah yakınında olmalı, bu noktada trypsinization ile güçlendirilmeli ve yeni kültür yemeklerine tohumlanmalıdır.
4. Atria ve ventriküllerden proteinlerin toplanması
- Perfüzyondan sonra, atria ve ventrikülleri ayırın ve 1,5 mL'lik bir numune tüpünde küçük bir öğütücü kullanarak 10 mg doku ağırlığı ile 100 μL tampon oranında lizis tamponunda homojenize edin.
- Homojenatı proteinleri çıkarmak için her 10 dakikada bir karıştırılan girdapla 40 dakika buzda tutun ve ardından tüpü 15000 × g'da 4 °C'de 20 dakika santrifüjlayın. Süpernatant fraksiyonu protein örneği olarak -80 °C'de saklayın.
5. İzole kalp hücrelerinin immünostaining
NOT: Yapışmayan kardiyomiyositlerin biyolojik tutkal kullanılarak hücre görüntüleme kabının dibine hareketsiz hale getirilmesi gereklidir.
- İzole kardiyomiyositlerin cam tabanlı bir kültür yemeğine yapıştırılması
- Hücre izolasyonu başlamadan önce, cam tabanlı kültür çanağına biyolojik tutkal (örneğin, Hücre Tak) üreticinin talimatına göre kaplayın, DW ile durulayın ve oda sıcaklığında hava kurulayın.
- CIB-Ca2+-BSA çözeltisinde izole kardiyomiyositlerin yeniden canlandırılmasından sonra, hücre süspansiyonunu tutkal kaplı tabakların altına bırakın ve ajitasyon olmadan oda sıcaklığında 20 dakika kuluçkaya yatırın.
- İmmünasyon
- İzole kardiyomiyositleri biyolojik tutkalla kaplanmış cam tabanlı bir tabağa yerleştirin ve hücrelerin yemeğe yapışmasını sağlamak için oda sıcaklığında 40 dakika tutun. Alt cam kültür yemeklerinde kültür kardiyak fibroblastlar.
- Hücreleri fosfat tamponlu salin (PBS) ile durulayın ve sallama ile 5 dakika boyunca% 4 paraformaldehit (PFA) ile sabitlayın. Sabit hücreleri PBS ile üç kez 10 dakika yıkayın ve oda sıcaklığında 60 dakika boyunca tıkanma-permeabilizasyon çözeltisinde sallama ile kuluçkaya yatırın.
- Oda sıcaklığında 60 dakika veya gece boyunca 4 °C'de bloke-permeabilizasyon çözeltisinde seyreltilmiş birincil antikorlu prob hücreleri. Hücreleri PBS ile üç kez 10 dakika yıkayın ve daha sonra oda sıcaklığında 60 dakika floresan etiketli ikincil antikor ile kuluçkaya yatırın.
- PBS ile 10 dakika boyunca üç kez yıkadıktan sonra, çekirdeği DAPI ile lekelayın (PBS'de 1:10000 seyreltme). Konfokal lazer tarama mikroskobu kullanarak floresan sinyalleri analiz edin.
6. Tüm hücreli yama kelepçe kayıtları
- Yatay bir mikroelekrod çekirdici kullanarak cam kılcal damarlardan yama elektrotlarını üretin. Elektrodun direnci, K+zengin pipet çözeltisi (Tablo 2) ile doldurulduğu zaman 2 ila4MΩ arasında değişmektedir. İzole kardiyomiyositlerden oluşan bir aliquot'u, 36-37 °C'de 1 mL/dk hızında Tyrode ile aşılanmış ters mikroskop aşamasına monte edilmiş bir kayıt odasına aktarın.
- Yama elektrodu ile 1 Hz hızında 5-10 ms'lik akım darbeleri uygulayarak 30 mg/mL amfoterisin B içeren K+-rich pipet çözeltisi ile delikli patch-clamp yöntemini kullanarak eylem potansiyellerini kaydedin.
7. Batı blot analizleri
- Bu çalışmada, atriyal belirteç atriyal natriüretik peptit (ANP) gibi küçük moleküler ağırlıklı proteinlerin Batı blot analizini gerçekleştirin.
- Protein örneğini 1X Örnek tamponu, %2 2' mercaptoethanol'un son konsantrasyonunda çözün ve proteinleri 37 °C'de 60 dakika denatüre edin. Her kuyuya 20 μg protein yükleyin ve 120 dakika boyunca jel başına 20 mA ile çalışan tamponda elektroforezi gerçekleştirin.
- Proteini 40 dakika boyunca 10 V'ta transfer tamponunda bir PVDF membranına aktarın. Aktarılan membranı TBST ile 5 dakika boyunca iki kez yıkayın, ardından oda sıcaklığında 60 dakika boyunca TBST'de % 5 yağsız sütle tıkayın ve TBST'de bir gecede çözünen birincil antikor ile 4 °C'de problayın.
- Membranı TBST ile 7 dakika boyunca 5 kez yıkayın ve oda sıcaklığında 120 dakika boyunca TBST'de seyreltilmiş ikincil antikorla kuluçkaya yatırın.
- Membranı TBST ile 7 dakika boyunca 5 kez yıkadıktan sonra, sinyalleri bir chemi-luminescence tahlil ile görselleştirin ve bir lumino-görüntü analizörü ile analiz edin.
Sonuçlar
Bu yöntemin prensibi basittir: perfüzat sol odadan akar, aort kapağı açılır ve perfüzyon kan akışı ile aynı yönde koroner artere akar, çünkü aort, hücre dışı matrisi sindirmek için miyokardın derin perfüzyonunu sağlayan kenetlenerek kapatılır.
Mevcut yöntemle yeni izole edilmiş ventrikül miyositleri Şekil 1A'dagösterilmiştir. Şekil 1B, ventrikül ve atriyal miyositlerin genişlemiş görüntülerini göstermektedir. Bu izolasyon prosedürü yüksek verimle sonuçlandı (%70-%80) tecritten sonra yaklaşık 5 saat içinde mevcut olan yetişkin farelerden (8-10 hafta) çubuk şeklindeki sessiz ventrikül miyositlerinin (Şekil 1C), geleneksel Langendorff tabanlı prosedür7kullanırken benzer bir aralık. Bununla birlikte, yeni izole edilmiş canlı hücrelerin oranı >2 yaşındaki yaşlı farelerde daha düşüktü (Şekil 1C). Bu protokol kullanılarak yetişkin kalbi başına elde edilen toplam ventrikül miyosit sayısı, daha önce bildirilen değere benzer olan yaklaşık 3 x 106 hücreydi. Ventrikül ve atriyal miyositlerde kaydedilen eylem potansiyelleri (Şekil 1D) Langendorff tabanlı yöntem10ile elde edilen hücrelerdekilere benzerdi. İmmünostaining analizi, ventriküler miyositlerin sarkolerik yapısının açıkça görülebilen bir hücre zarı ile iyi organize edildiğini doğruladı (Şekil 2A). Bu yöntemle izole edilen bireysel kardiyomiyositler, elektrofizyolojik analiz10 veya immünostaining deneyi gibi deneylerde doğrudan kullanılabilir.
Kardiyak fibroblastlar interstisyel alanlarda bulunur. Hücre dışı matrisin yeterli sindirimi, bu hücrelerin izolasyonu ile sonuçlanır. İzole kardiyak fibroblastlar kültür koşullarında çoğalır ve birkaç kez geçiş yapılabilir veya uygun bir hücre rezervuar çözeltisinde sıvı nitrojende saklanabilir. Şekil 2B, kültürlü kardiyak fibroblastların çoğunun alt kültür sırasında miyofibroblastlara dönüştüğünü göstermektedir, α pürüzsüz kas aktinin artan ifadesi ile doğrulanmıştır13,14. Ayrıca, kardiyak alerjenitörler mevcut yöntemle izole edilebilir ve otomatik olarak atmaya başlayan uygun kültür ortamında kültürlenebilir10,15.
Sağlam miyokardın homojenizasyonu, özellikle çok miktarda hücre dışı life sahip olan yaşlı farelerden gelen kalp dokusu için kolay değildir. Antegrad perfüzyondan sonra, atria ve ventriküllerden elde edilen protein, proteinleri çıkarmak için hafif kuvvetle lizis tamponunda kolayca homojenize edilebilir. Batılı bir leke analizi, ANP'nin atria'da spesifik ekspresyonunu göstermiştir, ancak yetişkin (20 haftalık) ve yaşlı (108 haftalık) farelerden gelen ventriküllerde değildir (Şekil 3).
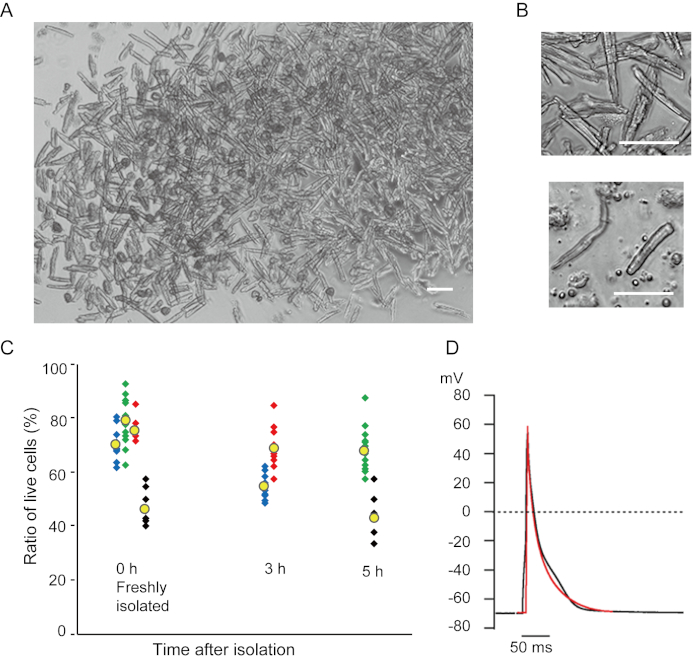
Şekil 1. Farelerden izole kardiyomiyositler. A. Ventrikül miyositleri, düşük büyütme ile elde edilen görüntülerle, antegrad perfüzyon ile yeni izole edilmiştir. Son yıkamadan sonra, kardiyomiyositler 2 mL hücre resüspenzyon çözeltisi ile yeniden kullanıldı, 100 μL'si cam tabanlı kültür kabına bırakıldı ve hücre yerleşimi bekleniyordu. Çubuk, 100 μm.B. İzole ventrikül miyositlerinin (üst) ve atriyal miyositlerin (alt) genişlemiş görüntüleri. Bar, 100 μm.C. İzole hücreler hücre resüspenzyon çözeltisinde askıya alındı ve istenen süre boyunca 37°C'de depolandı ve canlı ventrikül miyositlerinin sayısı mikroskop altında 10-15 alanda sayıldı. Yuvarlatılmış hücrelerin geri döndürülemez şekilde yaralandığı veya öldüğü kabul edildi16. 8-10 haftalıkken 3 fareden yeşil, mavi ve kırmızı semboller, 106 haftalık fareden ise siyah semboller elde edildi. Sarı sembol her grubun ortalamasını gösterir. D. 8-10 farenin ventriküler (siyah) ve atriyal (kırmızı) miyositlerinden kaydedilen temsili eylem potansiyelleri. Veriler, izolasyondan yaklaşık 3 saat sonra hücrelerden elde edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
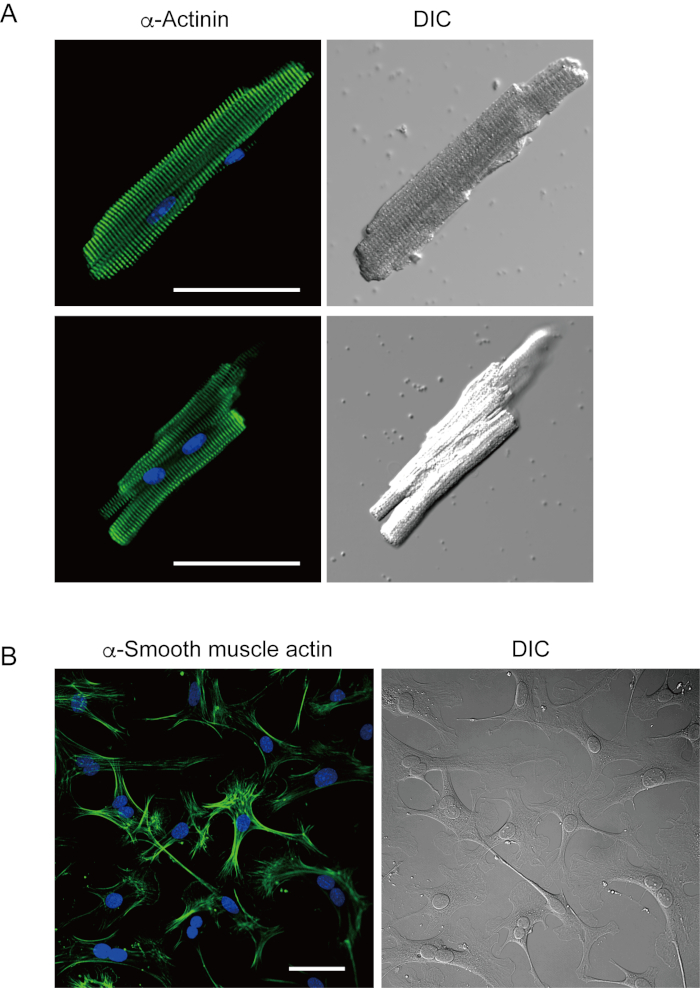
Şekil 2. İzole fare ventrikül miyositlerinde α-actinin için immünostaining ve kültürlü fare kardiyak fibroblastlarda α pürüzsüz kas aktizasyonu. A. α-actinin (yeşil), çekirdekler için DAPI boyama (mavi) ve fare kalbinden antegrad perfüzyon ile izole edilmiş ventriküler miyositlerin DIC görüntüsü için immünostaining konfokal lazer tarama mikroskopisi. Bar, 50 μm.B. α pürüzsüz kas aktinin (yeşil), çekirdekler için DAPI boyama (mavi) ve fare kalbinden antegrad perfüzyon ile izole edilmiş kardiyak fibroblastların DIC görüntüsü için immünostaining. Kardiyak fibroblastlar dört gün boyunca kültürlendi. Bar, 100 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
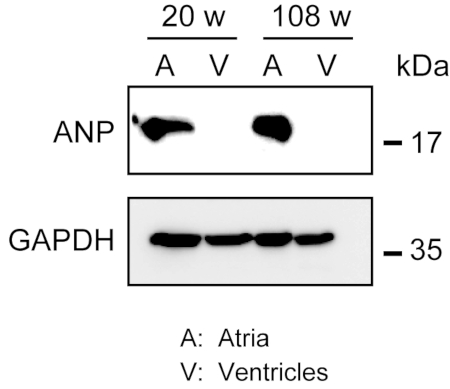
Şekil 3. Atria ve ventriküllerde ANP'nin Batı leke analizleri. Batı blot, yetişkin (20 hafta) ve yaşlı (108 hafta) kalplerden hazırlanan atria (A) ve ventriküllerde (V) atriyal belirteç atriyal natriüretik peptit (ANP) için analiz eder. ANP atria'da bulunur, ancak ventriküllerde yoktur. Kontrol evi tutma proteini olarak gliseraldehit 3-fosfat dehidrogenaz (GAPDH) kullanın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Kalp hücrelerini izole etmek için stok çözümleri | |
| 10X CIB (500 mL) | |
| NaCl | 37,99 g |
| KCI | 2,01 g |
| 1 M MgCl2 | 2,5 mL |
| NaH2PO4 | 0,23 g |
| HEPES | 29,79 g |
| Dw | 500 mL'ye kadar doldurun |
| 100 mM CaCl2 stok soution | |
| CaCl2 | 100 mM |
| 400 mM EGTA stok çözümü | |
| EGTA | 400 mM |
| İnsülin çözeltisi | |
| Insülin | 0,1 M HCl'de 1 birim/mL |
| 50X Antibiyotik stok çözeltisi (20 mL) | |
| penisilin | 100 mg |
| Streptomisiin | 100 mg |
| Fenol kırmızısı | 1,5 g |
| Dw | 20 mL ve filtreleme ile sterilize |
| 10X Tirod çözeltisi (1000 mL) | |
| NaCl | 81,82 g |
| Kartal | 4,03 g |
| 1 M MgCl2 | 5 mL |
| NaH2PO4 | 0,47 g |
| HEPES | 11,92 g |
| NaOH | 0,8 g |
| Dw | 1000 mL'ye kadar doldurun |
| İmmünasyon için stok solutin | |
| DAPI stoku | |
| DAPI | Metanolde 2 mg/mL |
| Batı lekeleri için stok çözümleri | |
| HEPES tamponu (100 mL) | |
| NaCl | 0,88 g |
| 400 mM EGTA | 0,25 mL |
| HEPES | 0,24 g |
| 1M NaOH | pH'ı 7,4'e ayarlama |
| Dw | 500 mL'ye kadar doldurun |
| Proteaz inhibitörleri kokteyli | |
| Tam mini | 1 tablet |
| Dw | 0,4 mL |
Tablo 1. Stok çözümlerinin açıklaması. Stok çözümlerini 4 °C'de tutun. -20 °C'de depolama için aliquot proteaz inhibitörleri kokteyli.
| Kalp hücrelerini izole etmek için çözümler | |
| CIB (200 mL) | |
| 10X CIB | 20 mL |
| İnsülin çözeltisi | 0,01 mL |
| glikoz | 0,79 g |
| 1M NaOH | pH ayarı 7,4 |
| Dw | 200 mL'ye kadar doldurun |
| Enzim karışımı çözeltisi (30 mL) | |
| Kollajenaz tip2 | 30 mg |
| Trypsin | 1.8 mg |
| proteaz | 1.8 mg |
| 100 mM CaCl2 stok çözümü | 0,09 mL |
| CIB | 30 mL |
| CIB-Ca2+-BSA (15 mL) | |
| Bsa | 30 mg |
| 100 mM CaCl2 stok çözümü | 0,18 mL |
| CIB | 15 mL |
| CIB-EGTA (150 mL) | |
| 400 mM EGTA stok çözümü | 0.150 mL |
| CIB | 150 mL |
| Tirozit çözeltisi (1000 mL) | |
| 10X Tyrode stok çözümü | 100 mL |
| glikoz | 0,99 g |
| 1M CaCl2 | 1,8 mL |
| 1M NaOH | pH ayarı 7,4 |
| Dw | 1000 mL'ye kadar doldurun |
| Hücre resüspenzyon çözeltisi (15 mL) | |
| Bsa | 30 mg |
| 50X Antibiyotik stok çözümü | 0,3 mL |
| Tırrode çözümü | 15 mL |
| İmmünasyon için çözümler | |
| Hücre yapışan çözeltisi (0,3 mL) | |
| Hücre Tak | 0,01 mL |
| 0,1 M NaHCO3 (pH8,0) | 0,285 mL |
| 0,1 M NaOH | 0,005 mL |
| Blokaj-permeabilizatin çözeltisi (10 mL) | |
| Fetal sığır serumu | 1 mL |
| Triton X-100 | 1 mL |
| 10X PBS | 1 mL |
| Dw | 7 mL |
| K+ zengin pipet çözeltisi | |
| Potasyum aspartat | 70 mM |
| Kartal | 50 mM |
| KH2PO4 | 10 mM |
| MGSO4 | 1 mM |
| ATP disodium tuzu | 3 mM |
| GTP lityum tuzu | 0,1 mM |
| EGTA | 5 mM |
| HEPES | 5 mM |
| Koh | pH ayarı 7,2 |
| Batı lekeleri için çözümler | |
| Lizis tamponu (1 mL) | |
| HEPES arabelleği | 0,86 mL |
| Nonidet-P40 | 0,1 mL |
| Proteaz inhibitörleri kokteyli | 0,04 mL |
| Çalıştırma arabelleği (1000 mL) | |
| 10X TG (0,25 M Tris ve 1,92 M Glisin) | 100 mL |
| SDS | 1 g |
| Dw | 900 mL |
| Aktarım arabelleği (1000 mL) | |
| 10X TG | 100 mL |
| metanol | 200 mL |
| Dw | 700 mL |
| Şişirme arabelleği (TBST) (1000 mL) | |
| 5M NaCl | 20 mL |
| 2M Tris-HCl (pH 7.5) | 5 mL |
| %10 Ara 20 | 10 mL |
| Dw | 965 mL |
Tablo 2. Kalp hücrelerini izole etmek, immünostaining ve Batı şişkinliği için çalışma çözümlerinin tanımı. Deneylerden hemen önce tüm çalışma çözümlerini hazırlayın.
Tamamlayıcı Şekil 1. Hücre yalıtımının anahattı. Ventrikül ve atriyal miyositlerin ve kardiyak fibroblastların tek bir kalpten izolasyonunun akış şeması. Bu rakamı indirmek için lütfen tıklayınız.
Tartışmalar
Kalp iskemiye karşı oldukça hassas olduğundan, kalbi çıkarmak ve kasılmayı durdurmak için buz gibi CIB-EGTA'ya daldırmak için geçen süre mümkün olduğunca kısa tutulmalıdır (<1 dk). Bu, bu yöntemin ilk kritik adımıdır. İkinci kritik adım kalbin yönüyle ilgilidir. 2.1.2. adımda ekscise kalbin özel yönelimi, aortu etrafındaki yağ ve bağ dokularını görmeyi ve çıkarmayı kolaylaştırır. Aortu temizledikten sonra, kenetlenmiş kalbi ön yüzey tarafı perfüzyon plakasına yerleştirin. Son kritik adım enjeksiyon iğnesinin yerleştirilmesini içerir. İğneyi kalbe doğru ilerletirken, plakadan sabit bir mesafeyi korumak için enjeksiyon iğnesi perfüzyon plakasından ayrılmamalıdır. Yerleştirmenin konumu sol ventrikülün tepeye yakındır. İğneyi bükmeden dikkatlice yerleştirin, çünkü bu bükülme deliği büyütebilir. İğnenin takılmasının derinliği kırmızı işaret izlenerek tahmin edilebilir. İğne çok derine yerleştirilirse, uç ventrikül septumunu delebilir ve sağ ventrikül veya mitral kapakçık ile sol kulakçık girebilir. Kanın koroner arterden kaybolduğunu doğruladıktan sonra, iğne perfüzyon plakasına bantla sabitlenmelidir.
Daha uzun bir aort uzunluğu, aortu doğru konumda sıkıştırmayı zorlaştırır. Kelepçe atria'dan çok uzaksa, perfüzyon infüzyonundan sonra kalp dönebilir. Bunu önlemek için, kenetlenmeden önce aortu kısaltmak için brakifalik arterin hemen altındaki aortu kesin.
Perfüzyondan sonra kan 0,5 mL/dk başlangıç hızında boşalmaya başlamazsa, hızı 1 mL/dk'ya çıkarın. Bu yardımcı olmazsa, enjeksiyon iğnesi sağ ventrikül, ventrikül septum veya sol miyokard duvarı gibi yanlış konumlandırılabilir. Böyle bir durumda, iğneyi hemen çıkarın ve sol ventrikülün zirvesine yakın bir yerine yeniden yerleştirmeye çalışın. İğneyi birkaç kez yerleştirirken, sindirilmiş hücreler açılan deliklerden dışarı akabilir. Bunun genellikle hücre izolasyonu ciddi şekilde etkilemediğini unutmayın.
Operatörler, renk ve saydamlıktaki değişiklikleri gözlemlemek ve sindirimle birlikte aryanın atışını yeniden başlatmak için stereoskopik bir mikroskop kullanarak kalbin tüm antegrad perfüzyon sürecini izleyebilir. Toplam 10 mL enzim karışımı, eski bir kalp için bile gereken maksimum değer olmalıdır. Genç kalplerde (5-7 haftalık), hacmi aynı enzim karışımı ile retrograd perfüzyon yoluyla yaklaşıma benzer şekilde 9 mL'ye düşürüyoruz.
Son santrifüjdeki süpernatant döküntüler, kan hücreleri ve miyosit olmayanlar içerirken, pelet esas olarak kardiyomiyositler ve fibroblastlar ve endotel hücreleri gibi kirletici miyositler içerir. Kardiyomiyositleri arındırmak için daha fazla adıma ihtiyaç vardır. Genel olarak, pelet uygun hücre kültürü ortamında yeniden kullanılmalı ve bir doku hücresi kültür çanağı üzerinde 37 °C'de 2 saat önceden tabaklanmalı ve daha sonra kültür için pipetleme ve ön plaka ile kardiyomiyositleri nazikçe çıkarılmalıdır.
Enzim karışımı düşük konsantrasyonda Ca2+ (0.3 mM) içerir. Bu nedenle, hücre resüspenzyon çözeltisi(1.8mM Ca 2+ ) ile son resüspenzyondan önce CIB-Ca2+-BSA'da (1.2 mM Ca2+) sindirilmiş hücreleri kuluçkaya yatırıyoruz ve Ca2+ 'daki kademeli artış hücre hasarına neden olmaktan kaçınıyor7. İzole kardiyomiyositler sağlam olduğu sürece (kasılma olmayan sessiz hücreler) bu Ca2+adaptasyon prosedürü farelerde hücre canlılığını etkilemez. Bu kuluçka sırasında hasarlı hücreler ölürken, sonuç olarak sağlıklı bir hücre grubu elde ediyoruz. Benzer şekilde, izole edilmiş sağlam atriyal miyositler (düzensiz kasılma olmadan sessiz hücreler) aynı hücre resüspenzyon çözeltisinde saklanabilir. Bununla birlikte, atriyal miyositler ventrikül miyositlerine kıyasla depolanmaları daha hassas olma eğilimindedir.
Laboratuvarda, sol ventrikül içine iğne yerleştirilmesi başarısız olmadıkça bu izolasyon yöntemi hemen hemen her zaman başarılıdır. Cerrahi enine aort daralması ile hazırlanan hipertrofik kalpten hücreleri izole etmede de başarılı olduk. Bununla birlikte, genellikle küçük miyokard enfarktüslerine sahip olan yaşlı farelerde, perfüzyon bazı yerlerde durur, bu da eksik sindirime ve dolayısıyla Langendorff tabanlı retrograd yöntemine benzer şekilde düşük verime (Şekil 1C) neden olursa. Bu gibi durumlarda, kalbin çarpık şekli perfüzyon başlangıcında bile gözlenebilir.
Bu antegrad perfüzyon yöntemi, kalp hücrelerini çeşitli yaşlardaki farelerden izole etmek için yararlıdır, ancak tavşan ve kobaylar gibi daha büyük hayvanlardan izole etmek için yararlıdır. Bu yöntemin weaning'den önce yenidoğan veya genç sıçanlara uygulanması mümkün olabilir.
Bu antegrad perfüzyon yönteminin avantajlarından biri, küçük fare kalpleri için Langendorff tabanlı retrograd perfüzyon yönteminin kullanılmasıyla ilgili teknik engelleri azaltmasıdır. Perfüzyon için gereken süre enzimlerin 10 mL'si ile yaklaşık 7 dakikadır, bu kısa sindirim süresi hücrelerin canlılığını arttırır. Ek olarak, perfüzyonun aort kapakları sindirildikten sonra bile kalbin koroner dolaşımı yoluyla gerçekleştirililmesini sağlar. Atriyal miyositlerin izolasyonu genellikle Langendorff bazlı retrograd perfüzyon ve enzimlerle daha fazla inkübasyon gerektirir17. Bununla birlikte, bu antegrad perfüzyon yaklaşımı, atriyal miyositleri izole etmek için dokuyu enzimle derinlemesine perfüzyonlayabilir.
Birden fazla farenin kullandığı deneylerde, Langendorff aparatı bir sonraki kalbe perfüzyondan önce temizlenmelidir. Bununla birlikte, mevcut antegrade yönteminde, istenen sayıda alet seti (örneğin şırınga iğneleri ve perfüzyon plakaları) önceden hazırlandığı sürece perfüzyon sürekli olarak yapılabilir.
Burada, ek kimyasallar olmadan Langendorff tabanlı retrograd perfüzyon yöntemiyle aynı çözümleri kullanarak fare kalbinin antegrad perfüzyonunun temel metodolojisini rapor ediyoruz. Perfüzyonun bileşimi, hücreden çıkarılanmış bir kalp yapmak için enzimler yerine EGTA içeren bir deterjan kullanmak gibi deneyin amacına uyacak şekilde değiştirilebilir18.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, morfolojik deneylerdeki yardımları için T. Yamamoto ve Y. Mori'ye teşekkür ediyor. Bu çalışma, Japonya Bilimi Destekleme Derneği'nden (18K06871'den M.O.K.'ye ve 17K08536'dan H.M.'ye) Bilimsel Araştırmalar için Yardım Hibesi (C) ile desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
Referanslar
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, Pt 3 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688(2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır