Method Article
Un Método De Perfusión Anterógrada Para El Aislamiento De Cardiomiocitos De Ratones
En este artículo
Resumen
Desarrollamos un método simple para aislar las células individuales de alta calidad del corazón del ratón por la técnica anterógrada de la perfusión. Este método está libre de Langendorff y es útil para aislar miocitos ventriculares y auriculares o células intersticiales, como fibroblastos cardíacos o progenitores.
Resumen
En la investigación básica con corazón de ratón, aislar cardiomiocitos individuales viables es un paso técnico crucial a superar. Tradicionalmente, el aislamiento de cardiomiocitos de conejos, conejillos de Indias o ratas se ha realizado a través de la perfusión retrógrada del corazón con enzimas utilizando un aparato de Langendorff. Sin embargo, se requiere un alto grado de habilidad cuando este método se utiliza con un pequeño corazón de ratón. Un método anterógrado de la perfusión que no utiliza un aparato de Langendorff fue divulgado recientemente para el aislamiento de los cardiomyocytes del ratón. Adjunto divulgamos un protocolo completo para la perfusión anterógrada mejorada del corazón suprimido para aislar las células de corazón individuales de los ratones adultos (8 - 108 semanas de viejo). La perfusión anterógrada se realiza mediante la inyección de perfusato cerca del ápice del ventrículo izquierdo del corazón extirpado, cuya aorta se sujetó, utilizando una bomba de infusión. Todos los procedimientos se llevan a cabo en una estera calentadora precalentada bajo un microscopio, lo que permite monitorear los procesos de inyección y perfusión. Los resultados sugieren que los miocitos ventriculares y atriales, y los fibroblastos se puedan aislar bien de un solo ratón adulto simultáneamente.
Introducción
Generalmente, el primer paso del aislamiento unicelular del tejido diseccionado implica mincing el tejido en pedazos pequeños, seguido por la digestión del tejido conectivo y de la matriz extracelular con las enzimas. Sin embargo, los cardiomiocitos no se pueden aislar con un método de corte, ya que el enriquecimiento con componentes de la matriz extracelular, incluidas las fibras de colágeno y elastina, hace que el miocardio sea demasiado resistente a la picada, y los cardiomiocitos son altamente sensibles a la hipoxia y otros cambios en el microambiente. Así, utilizando el sistema de perfusión retrógrada basado en Langendorff1,se ha desarrollado un método de digestión de la matriz extracelular con enzimas para aislar cardiomiocitos individuales delcorazón 2,3,4.
En modelos de ratón, la perfusión retrógrada basada en Langendorff del corazón con enzimas también se utiliza para el aislamiento de cardiomiocitos individuales5,6,7,8. Sin embargo, la canulación de la aorta de ratón pequeña y delgada y su montaje en el aparato de Langendorff para realizar la perfusión retrógrada requiere un alto grado de habilidad, ya que el diámetro de la aorta en el corazón adulto es de aproximadamente 1,2 mm. Además, se necesita tiempo para realizar múltiples experimentos como el aparato De Langendorff debe ser limpiado antes de perfundir el siguiente corazón.
Como alternativa a la perfusión retrógrada, un método nuevo para aislar cardiomyocytes de un corazón adulto del ratón sin un aparato de Langendorff fue desarrollado. Este método de creación de época se basó en la perfusión anterógrada de las arterias coronarias9. Recientemente mejoramos cada paso de este protocolo anterógrado, como el pinzamiento de la aorta, la inserción de agujas y el control de temperatura, y monitoreamos todos los procedimientos de perfusión con un microscopio10. Adjunto divulgamos detalladamente el refinamiento de este método anterógrado de la perfusión para acortar el tiempo para el aislamiento y para proporcionar un vídeo suplemental. En este método, la perfusión del corazón toma aproximadamente 7 minutos con 10 mL de las enzimas, y este corto período de digestión aumenta la viabilidad de las células. Este es un método simple para aislar las células cardíacas individuales a una alta calidad sin necesidad de la adición de sustancias químicas, tales como 2,3-butanodiona monoxima (BDM)6,11 o taurina5,8. Creemos que este método reducirá el umbral de habilidad de la técnica y mejorar la utilidad de los cardiomiocitos de ratón en la investigación básica.
Protocolo
Todos los experimentos con animales se ajustaron a la Guía para el cuidado y uso de animales de laboratorio publicada por los Institutos Nacionales de Salud de los Estados Unidos (Publicación de los NIH No. 85-23, revisada en 1996) y fueron aprobados por la Junta de Revisión institucional del Comité de Cuidado y Uso de Animales de la Universidad de Ciencias Médicas de Shiga (aprobado No. 2019-3-7). Los métodos se llevaron a cabo de acuerdo con las directrices aprobadas.
1. Instrumentos y solución
NOTA: Un esquema del procedimiento experimental se ilustra en un diagrama de flujo (Figura suplementaria 1). Se debe usar una bomba de infusión (o una bomba de jeringa) para la perfusión anterógrada del corazón con un flujo unidireccional. No se recomienda una bomba peristáltica que cree un flujo pulsante.
- Antes de lo experimental
- Marque la aguja de inyección en un sitio aproximadamente a 3 mm de la punta con esmalte de uñas. Después de dejar que se seque al aire, manténgalo en el recipiente a temperatura ambiente. Un color rojo o brillante es deseable para confirmar la profundidad de inserción en el miocardio durante la perfusión.
- Haga que el corazón se mantenga cortando las tapas de los tubos de muestra de 1.5, 0.5 y 0.2 mL y uniendo las tapas a la parte inferior de un plato de cultivo de 60 mm con cinta adhesiva de doble cara o adhesivo. La fijación de tres tapas de diferentes tamaños en un plato permite elegir la adecuada según el tamaño del corazón del ratón. Este soporte de corazón se puede reutilizar después del lavado.
- Hacer la solución de stock como se muestra en la Tabla 1. Almacene las soluciones de stock a 4 °C.
- En el día del experimento
NOTA: El tampón de aislamiento celular (CIB) contiene (en mM) 130 NaCl, 5,4 KCl, 0,5 MgCl2,0,33 NaH2PO4,22 glucosa, 40 unidades/mL de insulina y 25 HEPES (pH ajustado a 7,4 con NaOH); y la solución de Tyrode contiene (en mM) 140 NaCl, 5,4 KCl, 1,8 CaCl2,0,5 MgCl2,0,33 NaH2PO4, 5,5 glucosa y 5,0 HEPES (pH ajustado a 7,4 con NaOH).- Preparar el CIB. Calentar 160 mL de agua destilada (DW) usando un microondas a alrededor de 32 °C y luego añadir 20 mL de 10X CIB. Después de la adición de 0,79 g de glucosa y 10 μL de solución de insulina, ajustar el pH utilizando 1 M de NaOH y llevar a 200 mL con DW.
- Prepare la solución de mezcla de enzimas (mezcla de enzimas). Añadir 30 mg de colagenasa, 1,8 mg de tripsina, 1,8 mg de proteasa y 90 μL de 100 mM de caCl2 solución común a 30 mL de CIB (la concentración final de Ca2+ es de 0,3 mM), mezclar y mantenerlo en hielo. En ratones <4 semanas de edad, reducir la tripsina y la proteasa a 0,9 mg10. Calentar a 37 °C en un baño de agua antes de su uso.
- Prepare la solución CIB-Ca2+-BSA. Añadir 30 mg de BSA y 90 μL de solución común de CaCl2 de 100 mM a 15 mL de CIB (la concentración final de Ca2+ es de 1,2 mM), mezclar, filtrar a través de un filtro de 20 μm y mantenerlo en hielo.
- Prepare la solución CIB-EGTA. Después de hacer las soluciones descritas en los pasos 1.2.2 y 1.2.3, añadir 400 mM de solución de culata a la CIB restante a una dilución de 1:1000 (la concentración final de EGTA es de 0,4 mM), y mezclar. Llene el plato de cultivo de 35 mm y el plato de soporte de corazón con CIB-EGTA y manténgalos en hielo.
- Vierta aproximadamente 20 mL de CIB-EGTA en un vaso de precipitados de vidrio de 30 mL y soporte una pipeta de transferencia de plástico en el vaso de precipitados, manteniéndolo sobre hielo.
- Prepare la solución de Tyrode. Añadir 100 mL de 10X Tyrode a 800 mL de DW y calentarlo con microondas a unos 32 °C. Después de añadir 0,99 g de glucosa y 1,8 mL de 1 M CaCl2,ajustar el pH utilizando 1 M De NaOH y llevar a 1000 mL con DW.
- Prepare la solución de resuspensión celular. Añadir 30 mg de BSA y 300 μL de antibióticos 50X a 15 mL de solución de Tyrode.
- Preparar jeringas. Llene la jeringa de 20 ml conectada con el tubo de extensión flexible y la aguja de inyección marcada con CIB-EGTA. Llene la jeringa de 30 ml con la mezcla de enzimas calentadas. Sostenga ambos a 37 °C hasta justo antes de su uso.
- Prepare la placa de perfusión. Prewarm la estera del calentador bajo un microscopio estereoscópico. Coloque la placa de perfusión (tapa de una placa de cultivo de múltiples pozos) en la estera del calentador precalentada. Precalentar la pinza vascular colocándola en la placa de perfusión hasta su uso. Coloque el plato de cultivo de 60 mm para pipetear y el colador celular en la estera del calentador precalentada también.
2. Perfusión anterógrada del corazón del ratón
NOTA: La pipeta de transferencia de plástico utilizada para succionar el corazón debe ser suave y no estar cónicamente hacia la punta. Elija una pequeña abrazadera vascular con aserrado. Los instrumentos recomendados se enumeran en la Tabla de Materiales.
- Escisión del corazón de ratón y sujeción de la aorta
NOTA: Los ratones adultos (>8 semanas de edad) deben ser eutanasiados por una sobredosis de pentobarbital sódico (>300 mg/kg, inyección intraperitoneal [i.p.]) con heparina (8000 unidades/kg).- Extirpar el corazón del ratón rápidamente chupando.
- Abra la cavidad torácica rápidamente para exponer el corazón. Corte la pipeta de transferencia de plástico, cuya punta es aproximadamente del mismo tamaño que, o ligeramente más pequeña que, el corazón expuesto (generalmente en un sitio aproximadamente 1 cm de la marca de 0.5 mL hacia la punta, pero depende del tamaño del corazón).
- Succiome el corazón en la pipeta, eleve la pipeta para crear suficiente espacio para insertar tijeras y elimine el corazón con tijeras curvas del lado dorsal, evitando dañar las aurículas.
- Transfiera inmediatamente el corazón extirpado al vaso de precipitados de vidrio de 30 mL que contiene CIB-EGTA refrigerado por hielo para detener la contracción. Este procedimiento suele tardar <1 min.
- Limpieza alrededor de la aorta
- Transfiera el corazón a un plato de cultivo de 35 mm lleno de CIB-EGTA refrigerado por hielo y retire el pulmón y otros tejidos visibles, y luego transfiera el corazón más o menos limpio al soporte cardíaco lleno de CIB-EGTA refrigerado y colóquelo con el ápice hacia abajo.
- Bajo el microscopio estereoscópico, retire la grasa y los tejidos conectivos para limpiar alrededor de la aorta. Si la longitud de la aorta cortada es demasiado larga incluyendo la arteria braquiocefálica, la arteria carótida común izquierda o la arteria subclavia izquierda, corte la aorta justo debajo de la arteria braquiocefálica para acortarla con el fin de proceder al siguiente paso. Este procedimiento generalmente toma aproximadamente 4 min.
- Sujeción de la aorta y colocación del corazón sujeto en la placa de perfusión
- Bajo el microscopio, coloque el corazón en el soporte del corazón. El operador debe enfrentar la superficie anterior del corazón, recoger el extremo de la aorta con pinzas y sujetar la aorta cerca de las aurículas con una pequeña abrazadera vascular mientras empuja suavemente hacia abajo sobre la aorta un poco.
- Coloque el corazón sujeto en la placa de perfusión con el lado anterior hacia arriba, y luego cúbralo con unas gotas de CIB-EGTA para evitar que se seque. Este procedimiento generalmente toma <20 s.
- Extirpar el corazón del ratón rápidamente chupando.
- Perfusión anterógrada del corazón
NOTA: Primero, perfunda el corazón con CIB-EGTA para descargar sangre y prevenir la coagulación.- Inserte la aguja de inyección y comience la perfusión para descargar sangre
- Ajuste la jeringa de 20 ml llena de CIB-EGTA preguerra conectada al tubo de extensión flexible y una aguja de inyección marcada en la bomba de infusión. Inicie la bomba a una velocidad lenta de 0,5 mL/min para llenar cuidadosamente la aguja y el tubo con CIB-EGTA y asegúrese de evitar que el aire entre en el tubo.
- Coloque la aguja de inyección en la placa de perfusión con el lado más corto de la forma diagonal en el frente. Deslice la aguja hacia el ápice del corazón hasta que lo esté tocando y luego inserte cuidadosamente la aguja cerca del ápice del ventrículo izquierdo en la cámara ventricular sin torcerla. No suelte la aguja de la placa mientras realiza la inserción.
- Observe la marca roja para estimar la profundidad de la inserción de la aguja. Cuando se completa la inserción de la aguja, la sangre que fluye de la arteria coronaria debe comenzar a ser descargada.
- Fije la aguja de inyección en la placa con cinta adhesiva y aumente la velocidad de la bomba a 1 mL/min. Este procedimiento generalmente toma aproximadamente 30 s. Si el corazón se perfunde con éxito, el flujo del CIB-EGTA en el capilar justo debajo del epicardio se puede ver bajo el microscopio.
- Perfusión el corazón con la mezcla de la enzima
NOTA: Durante la perfusión enzimática, la profundidad de la aguja insertada se puede controlar comprobando la marca roja en la aguja.- Después de perfundir 2-3 mL de CIB-EGTA para descargar completamente la sangre de la arteria coronaria, cambie el perfusate a la mezcla de la enzima. Evite permitir que las burbujas de aire entren en el tubo. Compruebe el flujo de la mezcla de enzimas y asegúrese de que la aguja de inyección no haya salido comprobando la posición de la marca roja.
- Después de que 1-2 mL se haya perfundido, aumente la velocidad de la bomba a 1.5 mL/min. Retire el perfusato acumulado que contiene sangre que ha salido del corazón con una pipeta de vez en cuando.
NOTA: Con el tiempo, la pared miocárdica se volverá translúcida en algunos lugares y aparecerá moteada, lo que es un signo de digestión de la matriz extracelular después de una perfusión exitosa. Otro signo es el reinicio de la paliza auricular causada por la presencia de Ca2+ en la mezcla de enzimas. - Detener la perfusión cuando el volumen total de la mezcla de enzimas perfundida es de 10 mL.
- Inserte la aguja de inyección y comience la perfusión para descargar sangre
3. Aislamiento de células cardíacas individuales
- Disociación de las células del corazón
- Después de la perfusión con la mezcla enzimática, transfiera 10 mL de la mezcla de enzimas que queda en la jeringa a un plato de cultivo de 60 mm colocado en la estera calentadora y agregue 20 mg de BSA (0.2% de BSA en la mezcla de enzimas). El polvo de BSA caído debe disolverse inmediatamente arremolinándose suavemente con una mano. Retire la aguja de inyección y la abrazadera vascular del corazón.
- Separe los ventrículos y las aurículas y transfiera cada uno en la mezcla de enzimas complementada con BSA al 0,2% en la estera del calentador.
- Aislamiento de miocitos ventriculares
- Agarre el epicardio con dos pinzas, y rasgue suavemente y tire de los ventrículos de lado a lado en la mezcla de enzimas complementada con 0.2% BSA en trozos pequeños. Dispersar las células con un pipeteo suave (aproximadamente 30 veces).
- Filtre los desechos no digeridos a través de un colador de células de malla de 100 μm y transfiera el filtrado a un tubo centrífugo de 15 mL para su centrifugación a 50 × g durante 3 min. Resuspend los cardiomiocitos peletizados en solución precalentada de CIB-Ca2+-BSA, incubarlo durante 5 min a 37 °C, y luego centrifugarlo a 14 × g durante 3 min.
- Resuspend los cardiomiocitos precipitados finales en la solución de resuspensión celular (la composición se enumera en la Tabla 2)y sosténgalo a 37 °C.
- Aislamiento de miocitos auriculares
- Durante la centrifugación final para la fracción de miocitos ventriculares en el paso 3.2, comience a aislar los miocitos auriculares. Transferir las aurículas, almacenadas como en el paso 3.1, a la solución de CIB-Ca2+-BSA precalentada, desgarrarlos en pedazos y disociar las células pipeteando con punta de pipeta a 10 μL en la estera del calentador.
- Centrifugar la mezcla celular a 14 × g durante 3 min y resuspend las células auriculares peletizado con solución de resuspensión celular.
- Aislamiento y cultivo de fibroblastos cardíacos
- Transfiera el sobrenadante de la primera centrifugación en el paso 3.2 a otro tubo de centrífuga de 15 mL, y la centrífuga a 190 × g durante 5 min. Lave las células precipitadas dos veces con centrifugación en el Medio de Águila Modificada (DMEM) de Dulbecco, y luego suspenda las células con DMEM complementado con albúmina bovina fetal al 10% (FBS) y antibióticos.
- Encarute la fracción celular final en un matraz de cultivo (25 cm2)y deje que las células se adhieran al fondo del matraz en una atmósfera humidificada de 95% de aire y 5% deCO2. Después de 90 min de incubación, deseche las células no unidas y agregue el medio de cultivo fresco. Las células deben acercarse a la confluencia después de aproximadamente 4 días, momento en el cual deben ser amplificadas por tripsinización y sembradas en nuevos platos de cultivo.
4. Cosecha de proteínas de aurículas y ventrículos
- Después de la perfusión, separe las aurículas y los ventrículos, y homogeneícelos en tampón de lisis en una proporción de 10 mg de peso tisular a 100 μL de tampón usando una pequeña amoladora en un tubo de muestra de 1,5 mL.
- Mantenga el homogeneato en hielo durante 40 minutos con vórtice mezclándose cada 10 min para extraer proteínas, y luego centrifugar el tubo a 15000 × g durante 20 min a 4 °C. Almacene la fracción sobrenadante a -80 °C como una muestra de proteína.
5. Inmunotaining de las células aisladas del corazón
NOTA: La inmovilización de cardiomyocytes no adherentes a la parte inferior del plato de la proyección de imagen de la célula usando el pegamento biológico es necesaria.
- Adhesión de cardiomiocitos aislados a un plato de cultivo con fondo de cristal
- Antes de comenzar el aislamiento celular, cubra el plato de cultivo con fondo de vidrio con pegamento biológico (por ejemplo, Cell-Tak) de acuerdo con las instrucciones del fabricante, enjuague con DW y seque al aire a temperatura ambiente.
- Después de la resuspensión de los cardiomiocitos aislados en CIB-Ca2 +- solución de BSA, deje caer la suspensión celular en la parte inferior de los platos recubiertos con pegamento, e incubar durante 20 minutos a temperatura ambiente sin agitación.
- Inmunosuficiente
- Platee los cardiomiocitos aislados en un plato con fondo de vidrio precubierto con pegamento biológico y manténgalo a temperatura ambiente durante 40 minutos para permitir que las células se adhieran al plato. Cultín los fibroblastos cardiacos en platos de la cultura del fondo-cristal.
- Enjuague las células con solución salina tamponada con fosfato (PBS) y fijarlas con paraformadehído al 4% (PFA) durante 5 min con agitación. Lave las células fijas con PBS durante 10 min tres veces, e incubarlas en una solución de bloqueo-permeabilización durante 60 min a temperatura ambiente con agitación.
- Sondear las células con anticuerpos primarios diluidas en solución de bloqueo-permeabilización durante 60 min a temperatura ambiente o durante la noche a 4 °C. Lave las células con PBS durante 10 minutos tres veces, e incube luego con anticuerpos secundarios marcados con fluorescencia durante 60 minutos a temperatura ambiente.
- Después de lavarlos tres veces con PBS durante 10 min, manteche los núcleos con DAPI (dilución 1:10000 en PBS). Analice las señales fluorescentes usando un microscopio confocal de la exploración del laser.
6. Grabaciones de abrazadera de parche de celda entera
- Fabrique los electrodos de parche de un capilar de vidrio utilizando un tirador de microelectrodo horizontal. La resistencia del electrodo varió de 2 a 4 MΩ cuando se llenó con una solución de pipeta rica en K+(Tabla 2). Transferir una alícuota de cardiomiocitos aislados a una cámara de grabación montada en el escenario de un microscopio invertido sobrefundido con Tyrode a una velocidad de 1 mL/min a 36-37 °C.
- Registre los potenciales de acción utilizando el método de abrazadera de parche perforada con solución de pipeta rica en K+que contiene 30 mg /mL de anfotericina B mediante la aplicación de pulsos de corriente de 5-10 ms de duración a una velocidad de 1 Hz a través del electrodo de parche.
7. Análisis de Western blot
- En este estudio, realice un análisis occidental de la mancha blanca /negra de proteínas de pequeño peso molecular, tales como péptido natriurético atrial del marcador atrial (ANP).
- Disuelva la muestra de proteína en la concentración final de tampón de muestra 1X, mercaptoetanol al 2% 2', y desnaturalice las proteínas durante 60 min a 37 °C. Cargue 20 μg de proteína en cada pozo y realice electroforesis en tampón en funcionamiento con 20 mA por gel durante 120 min.
- Transferir la proteína a una membrana de PVDF en tampón de transferencia a 10 V durante 40 min. Lave la membrana transferida dos veces con TBST durante 5 min, luego bloquee con leche descremada al 5 % en TBST durante 60 min a temperatura ambiente y sondee con el anticuerpo primario disuelto en TBST durante la noche a 4 °C.
- Lave la membrana 5 veces con TBST durante 7 min, e incube con el anticuerpo secundario diluido en TBST durante 120 min a temperatura ambiente.
- Después de lavar la membrana 5 veces con TBST durante 7 min, visualice las señales con un ensayo de quimi-luminiscencia y analícelos con un analizador de lumino-imagen.
Resultados
El principio de este método es simple: el perfusato fluye desde la cámara izquierda, la válvula aórtica se abre y el perfusato desemboca en la arteria coronaria en la misma dirección que la sangre, ya que la aorta se cierra por pinzamiento, lo que permite la perfusión profunda del miocardio para digerir la matriz extracelular.
Los miocitos ventriculares recién aislados con el método actual se muestran en la Figura 1A. La Figura 1B muestra imágenes agrandadas de los miocitos ventriculares y auriculares. Este procedimiento de aislamiento resultó en un alto rendimiento (70%-80%) de miocitos ventriculares quietos en forma de varilla de ratones adultos (8-10 semanas), que estaban disponibles dentro de aproximadamente 5 h después del aislamiento(Figura 1C),un intervalo similar al que se utiliza el procedimiento tradicional basado en Langendorff7. Sin embargo, la proporción de células viables recién aisladas fue menor en ratones envejecidos de >2 años de edad(Figura 1C). El número total de miocitos ventriculares obtenidos por corazón adulto utilizando este protocolo fue de aproximadamente 3 x 106 células, que fue similar al valor previamente reportado7,12. Los potenciales de acción registrados en los miocitos ventriculares y auriculares(Figura 1D)fueron similares a los de las células obtenidas por el método basado en Langendorff10. Un análisis inmunosutenso confirmó que la estructura sarcomérica de los miocitos ventriculares estaba bien organizada con una membrana celular claramente visible(Figura 2A). Los cardiomiocitos individuales aislados con este método se pueden utilizar directamente en experimentos, como un análisis electrofisiológico10 o un experimento de inmunotensación.
Los fibroblastos cardiacos existen en espacios intersticiales. La digestión suficiente de la matriz extracelular resulta en el aislamiento de esas células. Los fibroblastos cardiacos aislados proliferan bajo condiciones de la cultura y se pueden pasar varias veces o almacenar en nitrógeno líquido en una solución apropiada del depósito de la célula. La Figura 2B muestra que la mayoría de los fibroblastos cardíacos cultivados se habían transformado en miofibroblastos durante el subcultivo, como lo confirma el aumento de la expresión de actina muscular α-lisa13,14. Además, los progenitores cardíacos pueden ser aislados con el método actual y cultivados en medios de cultivo apropiados, que comienzan a latir automáticamente10,15.
La homogeneización del miocardio robusto no es fácil, especialmente para el tejido cardíaco de ratones envejecidos, que posee una gran cantidad de fibras extracelulares. Después de la perfusión anterógrada, la proteína de las aurículas y los ventrículos se puede homogeneizar fácilmente en el tampón de lisis con la fuerza de la luz para extraer proteínas. Un análisis de Western blot demostró la expresión específica de ANP en aurículas pero no en ventrículos de ratones adultos (20 semanas de edad) y envejecidos (108 semanas de edad) (Figura 3).
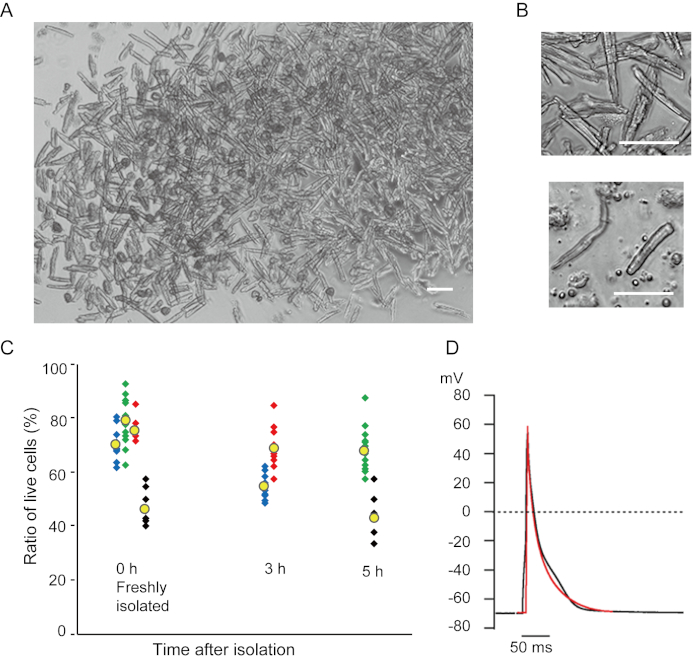
Figura 1. Cardiomiocitos aislados de ratones. A. Miocitos ventriculares recién aislados con la perfusión anterógrada, con imágenes adquiridas con bajo aumento. Después del lavado final, los cardiomiocitos fueron resuspended con 2 mL de solución de resuspensión celular, 100 μL de los cuales se dejó caer sobre el plato de cultivo con fondo de vidrio y se esperaba el asentamiento celular. Bar, 100 μm.B. Imágenes agrandadas de miocitos ventriculares aislados (superior) y miocitos auriculares (inferior). Bar, 100 μm.C. Las células aisladas se suspendieron en la solución de resuspensión celular y se almacenaron a 37 °C durante el período deseado, y el número de miocitos ventriculares vivos se contó en 10-15 campos bajo un microscopio. Se consideró que las células redondeadas habían sido irreversiblemente heridas o muertas16. Los símbolos verdes, azules y rojos fueron obtenidos a partir de 3 ratones en 8-10 semanas de viejo, y los símbolos negros eran a partir del ratón de 106 semanas de viejo. El símbolo amarillo indica la media de cada grupo. D. Potenciales de acción representativos registrados de miocitos ventriculares (negros) y auriculares (rojos) de 8-10 ratones. Los datos fueron obtenidos de las células aproximadamente 3 h después del aislamiento. Haga clic aquí para ver una versión más amplia de esta figura.
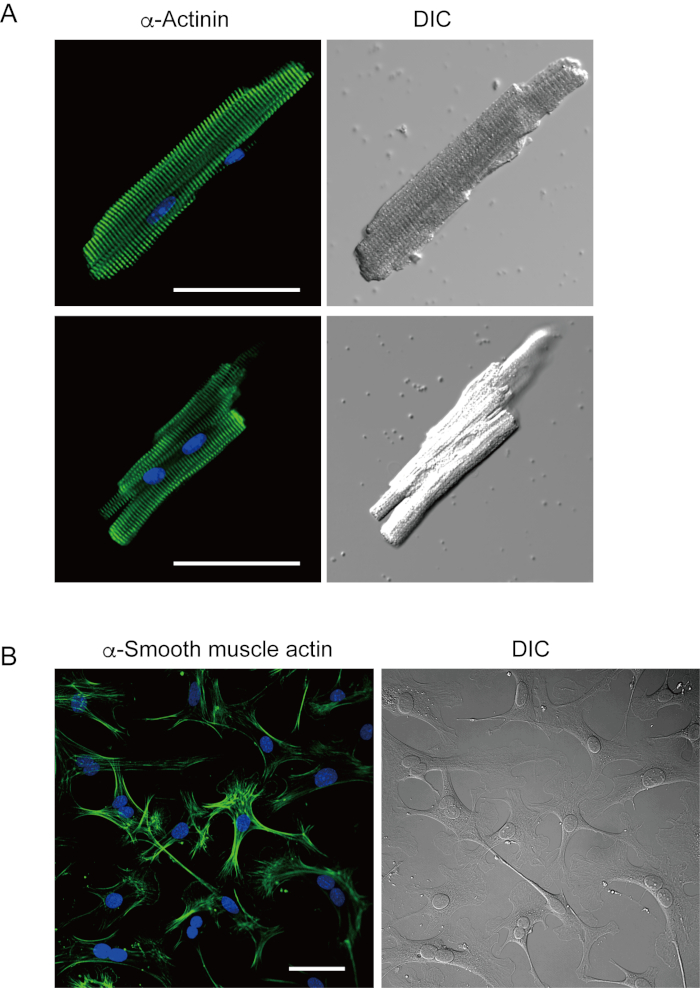
Figura 2. Immunostaining para la α-actinina en miocitos ventriculares aislados del ratón y actinéi del músculo α-liso en fibroblastos cardiacos cultivados del ratón. A. Microscopia confocal de la exploración del laser de immunostaining para la α-actinina (verde), la coloración de DAPI para los núcleos (azul) y una imagen de DIC de los miocitos ventriculares aislados del corazón del ratón con la perfusión anterógrada. Barra, 50 μm.B. Inmunostaining para la actina del músculo α-liso (verde), tinción de DAPI para núcleos (azul) y una imagen DIC de fibroblastos cardiacos aislados del corazón del ratón con la perfusión anterógrada. Los fibroblastos cardiacos fueron cultivados por cuatro días. Barra, 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
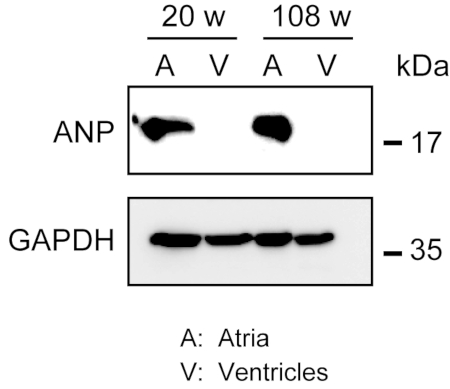
Figura 3. Análisis occidentales de la mancha blanca /negra de ANP en aurículas y ventrículos. Los análisis occidentales de la mancha blanca /negra para el péptido natriurético atrial del marcador (ANP) en las aurículas (a) y los ventrículos (v) se prepararon de los corazones adultos (20 semanas) y envejecidos (108 semanas). Anp está presente en las aurículas, pero ausente en los ventrículos. Use gliceroaldehído 3-fosfato deshidrogenasa (GAPDH) como una proteína de control de mantenimiento de la casa. Haga clic aquí para ver una versión más amplia de esta figura.
| Soluciones de stock para aislar las células del corazón | |
| 10X CIB (500 mL) | |
| NaCl | 37,99 g |
| Kci | 2,01 g |
| 1 m MgCl2 | 2,5 mL |
| NaH2PO4 | 0,23 g |
| HEPES | 29,79 g |
| Dw | Llenar hasta 500 mL |
| Soución de stock de CaCl2 de 100 mM | |
| CaCl2 | 100 mM |
| Solución de stock EGTA de 400 mM | |
| EGTA | 400 mM |
| Solución de insulina | |
| insulina | 1 unidad/mL en HCl de 0,1 M |
| Solución común de antibióticos 50X (20 mL) | |
| penicilina | 100 mg |
| estreptomicina | 100 mg |
| Rojo fenol | 1,5 g |
| Dw | 20 mL y esterilizar con filtrado |
| Solución 10X Tyrode (1000 mL) | |
| NaCl | 81,82 g |
| Kcl | 4,03 g |
| 1 m MgCl2 | 5 mL |
| NaH2PO4 | 0,47 g |
| HEPES | 11,92 g |
| NaOH | 0,8 g |
| Dw | Llenar hasta 1000 mL |
| Solutina común para inmunotendora | |
| Acciones de DAPI | |
| DAPI | 2 mg/mL en metanol |
| Soluciones de stock para manchas occidentales | |
| Tampón HEPES (100 mL) | |
| NaCl | 0,88 g |
| EGTA de 400 mM | 0,25 mL |
| HEPES | 0,24 g |
| NaOH de 1M | ajustar el pH a 7,4 |
| Dw | Llenar hasta 500 mL |
| Cóctel de inhibidores de la proteasa | |
| Mini completo | 1 tableta |
| Dw | 0,4 mL |
Tabla 1. Descripción de las soluciones de stock. Mantenga las soluciones de stock a 4 °C. Cóctel de inhibidores de la proteasa alícuota para almacenamiento a -20 °C.
| Soluciones para las células isoltas del corazón | |
| CIB (200 mL) | |
| 10X CIB | 20 mL |
| Solución de insulina | 0,01 mL |
| glucosa | 0,79 g |
| NaOH de 1M | El pH se ajusta a 7,4 |
| Dw | Llenar hasta 200 mL |
| Solución de mezcla enzimática (30 mL) | |
| Tipo de colagenasa2 | 30 mg |
| tripsina | 1,8 mg. |
| proteasa | 1,8 mg. |
| Solución de stock de CaCl2 de 100 mM | 0,09 mL |
| Cib | 30 mL |
| CIB-Ca2+-BSA (15 mL) | |
| Bsa | 30 mg |
| Solución de stock de CaCl2 de 100 mM | 0,18 mL |
| Cib | 15 mL |
| CIB-EGTA (150 mL) | |
| Solución de stock EGTA de 400 mM | 0,150 mL |
| Cib | 150 mL |
| Solución de tiro (1000 mL) | |
| Solución de stock 10X Tyrode | 100 mL |
| glucosa | 0,99 g |
| 1M CaCl2 | 1,8 mL |
| NaOH de 1M | El pH se ajusta a 7,4 |
| Dw | Llenar hasta 1000 mL |
| Solución de resuspensión celular (15 mL) | |
| Bsa | 30 mg |
| Solución común de antibióticos 50X | 0,3 mL |
| Solución de tyrode | 15 mL |
| Soluciones para inmunosutensiones | |
| Solución adherente celular (0,3 mL) | |
| Célula-Tak | 0,01 mL |
| 0,1 M NaHCO3 (pH8,0) | 0,285 mL |
| 0,1 M NaOH | 0,005 mL |
| Solución de bloqueo-permeabilizatina (10 mL) | |
| Suero fetal bovino | 1 mL |
| Tritón X-100 | 1 mL |
| PBS 10X | 1 mL |
| Dw | 7 mL |
| K+ solución de pipeta rica | |
| Aspartato de potasio | 70 mM |
| Kcl | 50 mM |
| KH2PO4 | 10 mM |
| MgSO4 | 1 mM |
| Sal disódica de ATP | 3 mM |
| SAL DE LITIO GTP | 0,1 mM |
| EGTA | 5 mM |
| HEPES | 5 mM |
| Koh | El pH se ajusta a 7,2 |
| Soluciones para manchas occidentales | |
| Tampón de lisis (1 mL) | |
| Búfer HEPES | 0,86 mL |
| Nonidet-P40 | 0,1 mL |
| Cóctel de inhibidores de la proteasa | 0,04 mL |
| Búfer de ejecución (1000 mL) | |
| 10X TG (0,25 M Tris y 1,92 M Glicina) | 100 mL |
| Sds | 1 g |
| Dw | 900 mL |
| Búfer de transferencia (1000 mL) | |
| 10X TG | 100 mL |
| metanol | 200 mL |
| Dw | 700 mL |
| Búfer de borrado (TBST) (1000 mL) | |
| NaCl de 5M | 20 mL |
| 2M Tris-HCl (pH 7.5) | 5 mL |
| 10% Preadolescente 20 | 10 mL |
| Dw | 965 mL |
Tabla 2. Descripción de las soluciones de trabajo para aislar las células del corazón, inmunotenso y western blotting. Prepare todas las soluciones de trabajo justo antes de los experimentos.
Figura suplementaria 1. Esquema del aislamiento celular. Diagrama de flujo del aislamiento de miocitos ventriculares y auriculares y fibroblastos cardíacos de un solo corazón. Haga clic aquí para descargar esta figura.
Discusión
Dado que el corazón es altamente susceptible a la isquemia, el tiempo necesario para extirpar el corazón y sumergirlo en CIB-EGTA helado para detener la contracción debe mantenerse corto como sea posible (<1 min). Este es el primer paso crítico de este método. El segundo paso crítico se refiere a la dirección del corazón. La orientación particular del corazón extirpado en el paso 2.1.2 facilita la vista y la eliminación de la grasa y los tejidos conectivos alrededor de la aorta. Después de limpiar alrededor de la aorta, coloque el corazón sujeto con el lado de la superficie anterior hacia arriba en la placa de perfusión. El paso crítico final implica la inserción de la aguja de inyección. Al avanzar la aguja hacia el corazón, la aguja de inyección no debe desprenderse de la placa de perfusión para mantener una distancia constante de la placa. La posición de la inserción está cerca del ápice del ventrículo izquierdo. Inserte la aguja cuidadosamente sin torcer, ya que dicha torsión puede agrandar el agujero. La profundidad de la inserción de la aguja se puede estimar observando la marca roja. Si la aguja se inserta demasiado profundo, la punta puede perforar a través del tabique ventricular y entrar en el ventrículo derecho o a través de la válvula mitral y entrar en la aurícula izquierda. Después de confirmar la desaparición de la sangre de la arteria coronaria, la aguja se debería fijar con la cinta a la placa de la perfusión.
Una longitud de aorta más larga hace que sea difícil sujetar la aorta en la posición correcta. Si la abrazadera está demasiado distante de las aurículas, el corazón puede girar después de la infusión de perfusato. Para prevenir esto, corte la aorta justo debajo de la arteria braquiocefálica para acortar la aorta antes de sujetarse.
Si la sangre no comienza a descargarse después de la perfusión a una velocidad inicial de 0,5 mL/min, aumente la velocidad a 1 mL/min. Si eso no ayuda, la aguja de inyección puede colocarse incorrectamente, como en el ventrículo derecho, el tabique ventricular o la pared miocárdica izquierda. En tal caso, retire la aguja inmediatamente y trate de volver a insertarla cerca del ápice del ventrículo izquierdo. Al insertar la aguja varias veces, las células digeridas pueden fluir fuera de los agujeros abiertos. Tenga en cuenta que esto no suele afectar seriamente el aislamiento celular.
Los operadores pueden monitorear todo el proceso de perfusión anterógrada del corazón utilizando un microscopio estereoscópico para observar los cambios de color y transparencia y reiniciar el latido de las aurículas junto con la digestión. Un total de 10 mL de mezcla de enzimas debe ser el máximo requerido, incluso para un corazón viejo. En corazones más jóvenes (5-7 semanas de edad), reducimos el volumen a 9 mL, que es similar al enfoque a través de la perfusión retrógrada con la misma mezcla de enzimas.
El sobrenadante en la centrifugación final contiene escombros, células sanguíneas y no miocitos, mientras que el pellet contiene principalmente cardiomiocitos y no miocitos contaminantes, como fibroblastos y células endoteliales. Para purificar los cardiomiocitos, se necesitan más pasos. En general, el pellet debe resuspended en el medio de cultivo celular apropiado y preplated durante 2 h a 37 °C en un plato de cultivo celular de tejido, y luego eliminar suavemente los cardiomiocitos por pipeteo y preplating para el cultivo.
La mezcla enzimática contiene una baja concentración de Ca2+ (0,3 mM). Por lo tanto, incubamos células digeridas en CIB-Ca2+-BSA (1,2 mM Ca2+)antes de la resuspensión final con la solución de resuspensión celular (1,8 mM Ca2+),y el aumento gradual de Ca2+ evita causar daño celular7. Mientras los cardiomiocitos aislados estén intactos (células quietas sin contracción) este procedimiento de adaptación de Ca2+no afecta la viabilidad celular en ratones. Como las células dañadas están muriendo durante esta incubación, en consecuencia obtenemos un grupo celular sano. Del mismo modo, los miocitos auriculares intactos aislados (células quietas sin contracción irregular) se pueden almacenar en la misma solución de resuspensión celular. Sin embargo, los miocitos auriculares tienden a ser más delicados para ser almacenados en comparación con los miocitos ventriculares.
En el laboratorio, este método de aislamiento es casi siempre exitoso a menos que la inserción de la aguja en el ventrículo izquierdo falle. También hemos tenido éxito en aislar las células del corazón hipertrofiado preparado por la constricción aórtica transversal quirúrgica. Sin embargo, en ratones envejecidos, que a menudo tienen pequeños infartos de miocardio, la perfusión cesa en algunos lugares, lo que resulta en una digestión incompleta y, por lo tanto, un bajo rendimiento(Figura 1C),similar al método retrógrado basado en Langendorff. En tales casos, la forma distorsionada del corazón se puede observar incluso al comienzo de la perfusión.
Este método de perfusión anterógrada es útil para aislar las células cardíacas de ratones de varias edades, pero no de animales más grandes, como conejos y conejillos de Indias. Puede ser posible aplicar este método a ratas neonatales o juveniles antes del destete.
Una de las ventajas de este método de perfusión anterógrada es que disminuye los obstáculos técnicos asociados con el uso del método de perfusión retrógrada basado en Langendorff para corazones de ratón pequeños. El tiempo requerido para la perfusión es de aproximadamente 7 min con 10 mL de las enzimas, este corto período de digestión aumenta la viabilidad de las células. Además, permite realizar la perfusión a través de la circulación coronaria del corazón, incluso después de que las válvulas aórticas hayan sido digeridas. El aislamiento de los miocitos auriculares generalmente requiere perfusión retrógrada basada en Langendorff y una mayor incubación con enzimas17. Este acercamiento anterógrado de la perfusión, sin embargo, puede perfundir profundamente el tejido con la enzima para aislar miocitos atriales.
En experimentos con múltiples ratones, el aparato de Langendorff debe limpiarse antes de perfundir el siguiente corazón. Sin embargo, en el método anterógrado actual, siempre que el número deseado de conjuntos de instrumentos (por ejemplo, jeringas agujas y placas de perfusión) se preparen de antemano, la perfusión se puede realizar continuamente.
Adjunto divulgamos la metodología básica de la perfusión anterógrada del corazón del ratón usando las mismas soluciones que el método retrógrado Langendorff-basado de la perfusión sin los productos químicos adicionales. La composición del perfusato puede ser cambiada para adaptarse al propósito del experimento, como el uso de un detergente que contiene EGTA en lugar de las enzimas para hacer un corazón descelularizado18.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a T. Yamamoto y Y. Mori por su ayuda en los experimentos morfológicos. Este trabajo fue apoyado por una Beca de Ayuda para la Investigación Científica (C) de la Sociedad Japonesa para la Promoción de la Ciencia (18K06871 a M.O.K. y 17K08536 a H.M.).
Materiales
| Name | Company | Catalog Number | Comments |
| Amphotericin B | Wako Pure Chemical Industries, Japan | ||
| Alexa Fluor 488 anti-mouse IgG antibody | Molecular Probes, USA | A11001 | Fluorescent-labeled secondary antibody. (1:400 dilution for immunostaining) |
| Anti-α-actinin (ACTN) | Sigma-Aldrich, USA | A7811 | Mouse monoclonal antibody (clone EA-53). (1:400 dilution for immunostaining) |
| Anti-atrial natriuretic peptide (ANP) | Merck-Millipore, USA | AB5490-I | Rabbit polyclonal antibody (1:2000 dilution for Western blots) |
| Anti-Glyceraldehyde 3-phosphate dehydrogenase (GAPDH) | Cell Signaling Technology, USA | 2118 | Mouse monoclonal antibody (1:10000 dilution for Western blots) |
| Anti-smooth muscle actin (SMA) | Dako, Denmark | M0851 | Mouse monoclonal antibody (clone 1A4) (1:400 for immunostaining) |
| Anti-rabbit IgG antibody | Amersham, GE Healthcare, USA | NA934 | Secondary antibody (1:10000 dilution for Western blots) |
| ATP disodium salt | Sigma-Aldrich, USA | A26209 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich, USA | A9418 | |
| Cell-Tak | Corning | 354240 | Biological material for adhesion of the cell or tissues |
| Chemi-Lumi One Super | Nacalai Tesque, Japan | 02230-14 | Chemiluminescent reagent used for western blotting. |
| Collagenase Type 2 | Worthington Biochemicals, USA | LS004176 | Choose the activity guaranteed to be greater than 300 unit/mg. |
| Complete Mini | Roche, Germany | 11836153001 | A mixture of several protease inhibitors. |
| 4'6'diamidino-2-phenylindole (DAPI) | Nacalai Tesque, Japan | 11034-56 | Used for cell-impermeant nuclear stainig |
| Dulbecco's Modified Eagle's Medium (DMEM) | Nacalai Tesque, Japan | 08458-45 | including 4.5 g/L gluose |
| Extension tube | Top, Japan | X1-50 | Connect with syringe and injection needle for antegrade perfusion. |
| EPC-8 patch-clamp amplifier | HEKA, Germany | ||
| Fetal bovine serum (FBS) | Sigma-Aldrich, USA | F7524-500ML | |
| Glass capillaries | Narishige Scientific Instrument Lab., Japan | outside diameter 1.5 mm, inside diameter 0.9 mm | |
| GTP lithium salt | Sigma-Aldrich, USA | G5884 | |
| Horizontal microelectrode puller | Germany) | P-97 | |
| Heater mat | Natsume Seisakusho, Japan | KN-475-3-40 | Equipment to warm the perfusion plate. |
| Infusion pump | TERUMO, Japan | TE-311 | Infusion syringe pump for antegrade perfusion. |
| Injeciton needle (27 gauge) | TERUMO, Japan | NN-2719S | Needle for insertion into the left ventricle. |
| Insulin (from bovine pancrease) | Sigma-Aldrich, USA | I5500 | Dissolve in 0.1 M HCl. |
| Mini cordless grinder | Funakoshi, Japan | cG-4A | Small grinder for homogenizing tissue in 1.5 mL sample tube. |
| 4%-Paraformaldehyde Phosphate Buffer solution (4% PFA) | Nacalai Tesque, Japan | 09154-85 | |
| Penicillin G potassium | Nacalai Tesque, Japan | 26239-84 | |
| Phenol Red | Nacalai Tesque, Japan | 26807-21 | |
| 10X Phosphate Buffered Saline (pH7.4) (10X PBS) | Nacalai Tesque, Japan | 27575-31 | |
| Plastic multi-well culture plate | Falcon, USA | 353226 | Use the lid of the multi-well culture plate as the perfusion plate. |
| Plastic syringe (20 mL) | TERUMO, Japan | SS-20ES | Use for infusion of CIB-EGTA. |
| Plastic syringe (30 mL) | TERUMO, Japan | SS-30ES | Use for infusion of Enzyme-mix |
| Plastic transfer pipette | Sarstedt, Germany | 86.1171 | Cut the tip just before sucking mouse heart into the pipette. |
| Polyvinylidene difluoride (PVDF) membrane | Merck-Millipore, USA | IPVH00010 | Immobilin-P membrane (Transfer membrane for protein blotting) |
| Protease | Sigma-Aldrich, USA | P5147 | A mixture of three or more proteases including extracellular serine protease. |
| 4X Sample buffer solution | Fuji Film, Japan | 198-13282 | Contains 0.25 M Tris-HCl (pH 6.8), 8 w/v% SDS,40 w/v% Glyceroland 0.02 w/v% BPB |
| SDS polyacrylamide gel (15%) | Fuji Film, Japan | 193-14991 | |
| Streptomycin sulfate | Nacalai Tesque, Japan | 32237-14 | |
| 10X Tris-Glycine buffer solution (10X TG) | Nacalai Tesque, Japan | 09422-81 | Contains 0.25 M-Tris and 1.92 M-Glycine, (pH 8.3) |
| Trypsin | Sigma-Aldrich, USA | T8003 | Trypsin from bovine Type 1. |
| Vascular clamp | Karl Hammacher GmbH, Germany | HSE 004-35 | Small straight vascular clamp used for clamping aorta. |
| All other reagents | Nacalai Tesque, Japan |
Referencias
- Langendorff, O. Untersuchungen am überlebenden Säugethierherzen. Pflügers Archiv: European Journal of Physiology. 61, 291-332 (1898).
- Berry, M. N., Friend, D. S., Scheuer, J. Morphology and metabolism of intact muscle cells isolated from adult rat heart. Circulation Research. 26 (6), 679-687 (1970).
- Powell, T., Terrar, D. A., Twist, V. W. Electrical properties of individual cells isolated from adult rat ventricular myocardium. Journal of Physiology. 302, 131-153 (1980).
- Joshi-Mukherjee, R., et al. Structural and functional plasticity in long-term cultures of adult ventricular myocytes. Journal of Molecular and Cellular Cardiology. 65, 76-87 (2013).
- Benndorf, K., Boldt, W., Nilius, B. Sodium current in single myocardial mouse cells. Pflügers Archiv: European Journal of Physiology. 404 (2), 190-196 (1985).
- Zhou, Y. Y., et al. Culture and adenoviral infection of adult mouse cardiac myocytes: methods for cellular genetic physiology. American Journal of Physiology-Heart and Circulatory Physiology. 279 (1), 429-436 (2000).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Fiset, C., Clark, R. B., Larsen, T. S., Giles, W. R. A rapidly activating sustained K+ current modulates repolarization and excitation-contraction coupling in adult mouse ventricle. Journal of Physiology. 504, Pt 3 557-563 (1997).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal to aged mice. Physiological Reports. 6 (9), 13688(2018).
- Sambrano, G. R., et al. Navigating the signalling network in mouse cardiac myocytes. Nature. 420 (6916), 712-714 (2002).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 6257-6262 (2002).
- Santiago, J. J., et al. Cardiac fibroblast to myofibroblast differentiation in vivo and in vitro: expression of focal adhesion components in neonatal and adult rat ventricular myofibroblasts. Developmental Dynamics. 239 (6), 1573-1584 (2010).
- Chistiakov, D. A., Orekhov, A. N., Bobryshev, Y. V. The role of cardiac fibroblasts in post-myocardial heart tissue repair. Experimental and Molecular Pathology. 101 (2), 231-240 (2016).
- Omatsu-Kanbe, M., Matsuura, H. A novel type of self-beating cardiomyocytes in adult mouse ventricles. Biochemical and Biophysical Research Communications. 381 (3), 361-366 (2009).
- Shan, D., Marchase, R. B., Chatham, J. C. Overexpression of TRPC3 increases apoptosis but not necrosis in response to ischemia-reperfusion in adult mouse cardiomyocytes. American Journal of Physiology. 294 (3), 833-841 (2008).
- Nakamura, H., et al. Presence and functional role of the rapidly activating delayed rectifier K(+) current in left and right atria of adult mice. European Journal of Pharmacology. 649 (1-3), 14-22 (2010).
- Milgroom, A., Ralston, E. Clearing skeletal muscle with CLARITY for light microscopy imaging. Cell Biology International. 40 (4), 478-483 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados