Method Article
珠子将蛋白质和核酸加载到附体人类细胞中
摘要
珠子加载将蛋白质、质粒和颗粒引入粘附的哺乳动物细胞。这种细胞加载技术价格低廉、速度快,不会对细胞健康产生重大影响。它最适合活细胞成像。
摘要
许多活细胞成像实验使用外源粒子(例如肽、抗体、珠子)在细胞内标记或发挥作用。然而,将蛋白质引入细胞膜是很困难的。现有方法的选择有限,效率低下,需要昂贵和技术要求高的设备,或在狭窄的参数内工作。在这里,我们描述了一种相对简单且经济高效的技术,用于将DNA、RNA和蛋白质加载到活的人类细胞中。珠子加载会诱发细胞膜的暂时机械中断,使大分子进入粘附的活哺乳动物细胞。每次实验的珠子加载成本低于 0.01 美元,是可用成本最低的电池加载方法。此外,珠子加载不会对细胞造成实质性压力或影响其生存能力或增殖。本文稿描述了珠子装载过程的步骤、适应、变化和技术限制。这种方法特别适用于活细胞成像,但为需要将蛋白质、珠子、RNA 或质粒引入活体、粘附哺乳动物细胞的其他应用提供了实用的解决方案。
引言
将大分子加载到哺乳动物细胞中需要方法,使它们能够穿过细胞的血浆膜1。几种方法可以通过转染将质粒引入哺乳动物细胞,包括脂质转染2 和脂肪乙基-德克斯特拉转染3。然而,将蛋白质或膜不透水颗粒加载到细胞中的方法更为有限。
一些技术已经绕过了这一困难的障碍,采用了各种策略。首先,显微投射通过微管将粒子送入显微镜4下的活细胞。虽然可以说是最可控和侵入性最小的方法,但这种技术的吞吐量相对较低,因为必须逐个加载细胞。此外,微投射需要专门的设备,而且技术要求很高。
其次,电电是一种通过电压诱导膜中断5、6、7将蛋白质电注入细胞的方法。然而,这种方法再次需要专门的,昂贵的设备,冲击可能会导致细胞压力和死亡。此外,细胞必须在电镀前尝试化,然后重新镀放,从而限制了电聚后细胞被调查的时间范围。
第三,细胞膜可以化学改性为临时的,可逆渗透8,9。链霉素-O加载将内毒素插入细胞膜,形成临时毛孔,允许外源膜不透水颗粒,包括蛋白质和DNA质粒,进入细胞10。经过2小时的恢复,大约一半的细胞修复这些毛孔,并停止从溶液内化颗粒。然而,这种技术需要很长的恢复时间,与不能容忍内毒素的细胞类型不相容。
第四,机械干扰通过细胞膜11的物理扰动将粒子加载到细胞中。这可以通过多种方式完成,包括刮伤,刮伤和滚动珠子在细胞12,13。早在1987年,珠子就被用来机械地将蛋白质加载到细胞中。最近,珠子加载技术经过优化和调整,超越蛋白质,包括质粒和RNA的加载,如这里所述。
珠子加载是一种简单、廉价和快速的方法,用于将蛋白质和质粒加载到粘附的人体细胞中。玻璃珠在细胞上短暂滚动,暂时破坏其细胞膜。这允许溶液中的粒子进入。由于珠子加载效率低,最适合单分子或单细胞显微镜实验。珠子加载可以引入各种各样的蛋白质,包括碎片抗体(Fab),15,16纯化蛋白,如scFvs,17体内,18,19,或mRNA涂层蛋白,例如MS2涂层蛋白(MCP)20,21。普拉斯米德表达载体也可以添加到蛋白质溶液和珠子同时加载22,23,24,25。
除了蛋白质和质粒,250纳米聚苯乙烯珠的分子通过珠子加载(个人交流)被引入细胞。珠子装载成本非常低廉,每次材料实验成本不到 0.01 美元,无需额外的昂贵设备。通过尽量减少每个实验使用的探头数量,成本进一步降低,因为只有图像室中央直径为 14 mm 直径的微井中的细胞被加载。需要注意的是,有限的装载区域意味着珠子装载不适合散装电池装载。
本文稿介绍了珠子装载过程,包括如何构建珠子装载装置并进行实验。结果表明,蛋白质、RNA和DNA可以加载到不同的细胞类型中,同时携带两种不同的珠子加载蛋白质具有高度相关细胞浓度和相对较低的差异。还讨论了基于细胞类型和蛋白质、质粒或RNA的载量的协议变化。虽然珠子被认为穿孔和破坏细胞膜,当适当执行时,珠子加载过程只会将少量细胞从成像室底部移出。经过短暂的恢复期后,细胞继续生长和分裂。这种方法非常适合活细胞显微镜实验,包括单分子蛋白和RNA跟踪、转化后修饰检测、动态细胞机制观察或亚细胞定位监测15、16、22、26、27。
研究方案
1. 清洁、消毒和干燥的玻璃珠,以避免堵塞,并确保甚至在细胞上扩散。
- 在氢氧化钠(NaOH)中消毒约5毫升的玻璃珠。在 50 mL 圆锥形管中测量珠子。加入 25 mL 的 2 M NaOH,然后使用摇床或旋转器轻轻混合 2 小时。
- 装饰 Naoh, 保留尽可能多的珠子。如果珠子处于悬浮状态,则用离心机短暂地旋转珠子管(1 分钟,1000 × 克,室温)。
- 用细胞培养级水彻底清洗珠子,直到pH值为中性(使用eluent上的pH测试条来确认中性pH值)。每次洗净水,像以前一样。
- 用 100% 乙醇 2-3x 彻底清洗珠子。每次都像以前一样去甲醇。
- 擦干珠子。将珠子洒在无菌容器内形成薄层(如 10 厘米的培养皿)。让容器打开,让珠子在生物安全柜里晾干过夜。通过轻拍或轻轻摇动容器并确保珠子完全干燥,并检查珠子是否具有无结块或剥落的沙质。
- 紫外线消毒干珠15分钟。
2. 组装珠子装载机设备。
- 用胶带或夹紧金属可重复使用的成像室的男性和女性端之间的网格覆盖珠子保持室的整个开口(聚丙烯或等效材料,105μm 开口,让珠子通过)。
- 紫外线消毒设备15分钟。将珠子添加到仪器中,然后用蜡膜将其紧密密封。
注意:此时珠子必须完全清洁和干燥。他们应该是松散的,看起来沙子没有团块。如果它们不出现,重新洗净并完全干燥珠子。 - 将仪器存放在密封的干燥容器中,由二氧化硅凝胶或其他干燥介质干燥。如果珠子变得潮湿,这将明显由珠子团团,彻底干燥和消毒珠子装载机,代之以新鲜的珠子。
注意:所有这些预防措施将防止任何霉菌或细菌在珠子装载机内或周围的生长。珠子装载机装置可以以不同的方式制造。请参阅讨论中的细节。
3. 准备粘附细胞的玻璃底室。
- 将哺乳动物细胞播种到35毫米玻璃底室中。确保珠子加载时细胞的汇合度约为 80%。(请参阅 表 1, 了解有关不同细胞类型的更多信息,以及关于不同细胞类型中珠子加载有效性的说明。
注:细胞只能在腔室中心的微井中播种,以保存使用多少细胞。 - 在正常条件下孵育细胞,直到它们完全粘附在玻璃上。
注:细胞密度必须足够高,并且细胞必须牢固地粘附在玻璃上。如果不符合这些要求,细胞可能会在珠子加载过程中剥落。可以延长细胞播种和珠子加载之间的时间线,以确保适当的细胞粘附和汇合。
4. 珠子加载单元格
注:如果需要,用磷酸盐缓冲盐水(PBS)短暂清洗细胞,然后加入2 mL的最佳介质。孵育至少30分钟。
- 制作含有所需质粒、蛋白质和/或颗粒的 3-8 μL 溶液。根据实验要求,使用每种类型的质粒的 +1 μg (0.1-1 pmol) 和 +0.5 μg (0.01 nmol) 蛋白质。使用低保留管来蛋白质,这样它们就不会留在管壁上。将溶液与 PBS 一起调到最低 3 μL,并调整溶液体积以覆盖要加载的整个细胞区域(即腔室的微井,图 1B)。
- 通过上下管道和/或轻拂管子,彻底混合溶液。在桌面微富中将溶液短暂旋转到管子底部。
- 将珠子加载溶液和细胞室转移到组织培养罩中。使用无菌技术在组织培养罩中执行剩余步骤。
- 从细胞中取出介质并暂时将其存储在无菌管中。轻轻吸气所有介质从腔室的边缘,并倾斜在大约45°角的腔室,并删除在中心微井的媒体剩余下降。在中度去除过程中,请务必避免让移液器尖端接触玻璃,这可能导致细胞剥落和丢失。快速移动到下一步,使细胞不会干燥太久。
- 轻轻地将珠子装载液移到房间中央的玻璃微井上。可选: 孵化与温柔的摇摆 30 英镑, 而不允许房间完全干涸。
- 轻轻驱散细胞顶部的玻璃珠单层,最好使用珠子装载装置(图1A)。确保珠子完全覆盖玻璃底微井中的细胞。
- 用两根手指捏住房间,用 2 英寸将其抬起并牢固地将其放下,将其敲击到引擎盖表面。使用大约相当于将盘子从该高度掉落的力。重复总共 +10 水龙头。
注意:确保水龙头不会实质性地剥落细胞。可以针对单元格类型优化攻丝。如果细胞加载不良,则用力轻触:然而,如果许多细胞剥落,点击更轻。 - 轻轻地将中等的回放到腔室中,慢慢地输送到腔室的塑料侧。尝试吸气任何漂浮的珠子,而不会打扰细胞。如果删除太多,在此步骤中添加更多预热介质。在孵化器中孵育细胞0.5-2小时。
- 紫外线消毒珠子装载机15分钟,然后在干燥条件下将其送回储存。
- 根据制造商推荐的协议,在细胞中添加染料(如 DAPI 或 HaloTag 配体污渍(如果实验需要)。
- 在成像前用介质清洗细胞3倍,以去除溶液中的珠子和多余的加载组件。避免直接将水管输送到细胞上,以防止细胞剥落。
5. 成像珠子加载的细胞
- 立即或在实验需要时对细胞进行成像。使用能够捕捉荧光(激光或单色光源)的显微镜。确保激发波长适合所选荧光或染料(例如,绿色荧光蛋白 (GFP) 的 488 nm 波长光)。
注:一旦细胞恢复,珠子加载的蛋白质可能会被成像(只要30分钟后加载到这里描述的细胞系)。普拉斯米德表达需要≥2小时取决于表达载体元素(图1C,并在讨论中进一步解释)。珠子加载电池的成像可以在任何显微镜上进行,显微镜配备与加载探头相关的适当荧光源,能够捕捉荧光图像的相机,如电子倍增电耦合器件 (EMCCD) 或科学互补的金属氧化物半导体 (sCMOS) 摄像机,以及控制温度、湿度和二氧化碳的孵化器。有关荧光显微镜的指南,请参阅 27。
结果
珠子加载最常见的应用是将一种或多种蛋白质引入粘附的人体细胞中。为了说明这一点,细胞被珠子装上一种Cy3和Alexa488结合的Fab蛋白的溶液。虽然不是微井中的每个细胞都装有珠子,但装载的细胞几乎总是同时含有Cy3-和Alexa488标记的蛋白质(图2A)。根据先前的估计,当4微升稀释的0.5微克Fab被珠子加载29,如 图2A,每个细胞装载约106Fab 分子。
编码 GFP 的普拉斯米德 DNA (1 μg 质粒 DNA, 1.8 μL 的 557 ng/μL 溶液) 和 0.5 μg 的 Cy3 标签 Fab 也通过珠子加载引入细胞,随后表达和可视化 (图 2B)。GFP荧光表明,GFP编码质粒不仅被装入细胞,而且表示。因此,在同一细胞中,珠子加载可以引入蛋白质探针(例如,Cy3标记的Fab)和记者质粒(例如GFP),就像以前在这个实验室里22、23、24。我们确定,40%的细胞是珠装法布蛋白,21%的珠子加载细胞表示共载质粒,如图2B中具有代表性的视野所示。通常,每个腔室都装有 1-2 微克质粒,与脂质素的含量大致相同。
珠子加载的细胞表达质粒水平大相径庭(图2C,D)。为了具体测量这一点,我们使用费舍尔比率测试来比较蛋白质和质粒强度数据的分布。结果表明,虽然蛋白质1和2的强度分布相似(p = +1),但每种蛋白质的分布明显小于质粒(p = 3.2e-6和 1.8e-5)。虽然这可能是由于每个细胞加载多少质粒的变异性,但更大的变异来源可能来自质粒表达所需的许多步骤,这些步骤可能因细胞而异,包括导入细胞核、转录和翻译。相比之下,珠子加载蛋白的水平有轻微的细胞对细胞的差异,两个同时加载的蛋白质的水平高度相关(图2D,E)。
普拉斯米德表达可以看到早在2-4小时后珠装,但可能会发生以后取决于何时获得最佳质粒表达。我们建议执行一个时间过程,以确定特定质粒跨越2-24小时后珠子加载的最佳表达窗口。这可以在一个具有长时间成像的腔室中完成,也可以通过珠子加载和惊人的多个腔室来完成。珠子加载的细胞仍然粘附,并且足够健康,可以生长和分裂。珠子加载的人类 U2OS 细胞在珠子加载前、紧接之后和 24 小时后直接成像。适当的珠子加载对细胞数量或其形态几乎没有明显的影响,如 图3A(左,中)所示。
相比之下, 图3B中描绘了珠子装得太少、拍击力过大。这造成了许多细胞损失(没有细胞的盖玻璃大片和分离的、漂浮的、失去焦点的细胞)、细胞形态差(细胞出现四舍五入和粘附不良),以及珠子加载后残留在盖玻璃上的珠子簇。虽然细胞被认为在珠子加载过程中受到机械损伤,但细胞在适当的珠子加载室中生长和增殖,珠子加载后24小时细胞数量增加就证明了这一点(图3A,右图)。对细胞生存能力的影响可以通过各种测定来评估,例如3-(4,5-二甲基硫醇-2-yl)-2,5-二苯甲基溴溴(MTT)检测,将珠子加载与模拟加载细胞30进行比较。此外,这一和以前的工作表明,珠子加载细胞进行细胞分裂(图3C 和 补充视频1),和三位体病的时间不受珠子加载31的影响,这作为进一步的证据,在珠子加载后持续细胞健康。
珠子加载是一种多功能技术,可容纳多个粘附的细胞线和各种大分子。在这里,这个品种已经证明加载RPE1和赫拉细胞线与Fab(图4A,B)。表1提供了在这个实验室内外不同细胞系中珠子加载的进一步示例,并指出了其他实验室的珠子加载协议之间的一些细微差别。值得注意的是,用于装载的玻璃珠的直径因实验室而异,尽管在几个细胞系14中发现直径为75微米的小珠子最有效的装载。此外,该实验室也开始将珠子加载RNA(数据未显示)。图4C显示一个具有代表性的U2OS细胞珠加载与Cy5-RNA 9mer和Cy3-DNA 28mer在一起。
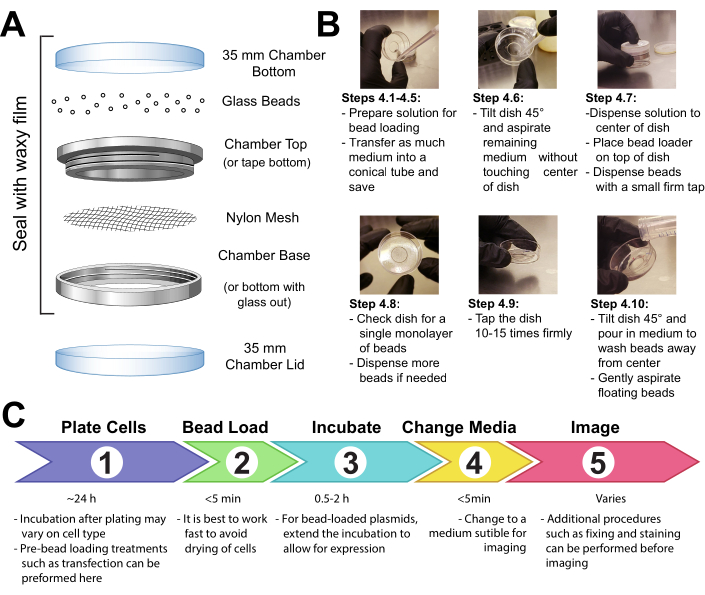
图1:珠子加载装置、技术和时间轴请点击这里查看此图的较大版本。
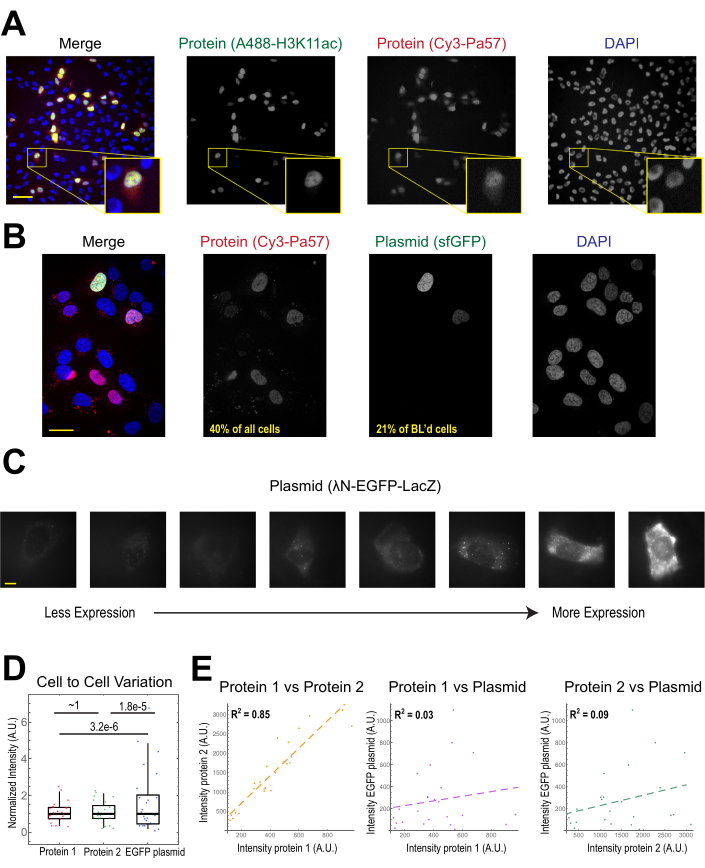
图2。珠子加载导致蛋白质浓度低变异性,但质粒表达变异性高。(A) 细胞在 4 μL 的珠子加载溶液中,每片 Alexa488 结合的抗 H3K27 乙酰 Fab(绿色)和 Cy3 结合抗 RNAPII-Serine 5 磷化 Fab(红色)的珠子加载中均含有 0.5 μg 的珠子。细胞被 DAPI 染色(蓝色),然后立即成像。比例条 = 20μm.(B) 细胞在 4 μL 的珠子加载溶液中加入 0.5 μg 的 Fab 蛋白 (Cy3 结合抗 RNAPII-Serine 5 磷酸蛋白,红色) 和 1 μg 质粒编码超级折叠器 GFP-H2B (绿色) 。24小时后,细胞被DAPI染色(蓝色)和成像活。比例杆 = 30μm.(C-E) 蛋白质 1 (JF646-哈洛利甘标记的光环标签 -MCP),蛋白质 2 (Cy3 结合抗弗拉格法布), 和质粒编码 EGFP (\N-EGFP-LacZ) 被珠子加载到细胞中。每个荧光通道的总强度在每个细胞质的1.3 x 1.3μm贴片中测量。N = 25 个细胞。(C) 代表细胞表示珠子加载的质粒, \N-EGFP-LacZ.所有细胞都使用相同的成像条件和强度。斑点是表达的蛋白质的聚合物。比例尺条 = 10 μm.(D) 图表显示每个细胞从质粒中表达的蛋白质 1、蛋白质 2 或 EGFP 的总强度。每个通道都正常化为中位数。通过费舍尔比率测试计算了邦费罗尼校正的P值,以确定蛋白质或质粒强度数据的分布是否具有相同的变异性。每个点代表一个单元格。(E) 蛋白质、蛋白质1和质粒、蛋白质2和质粒的总强度是相互绘制的。显示计算的 R2值。每个点代表一个单元格。缩写: DAPI = 4+, 6 - 迪亚米迪诺 - 2 - 苯林多勒;EGFP = 增强的绿色荧光蛋白;A.U. = 任意单位;MCP = MS2 涂层蛋白;RNAPII = RNA 聚合酶 II.请单击此处查看此图的较大版本。
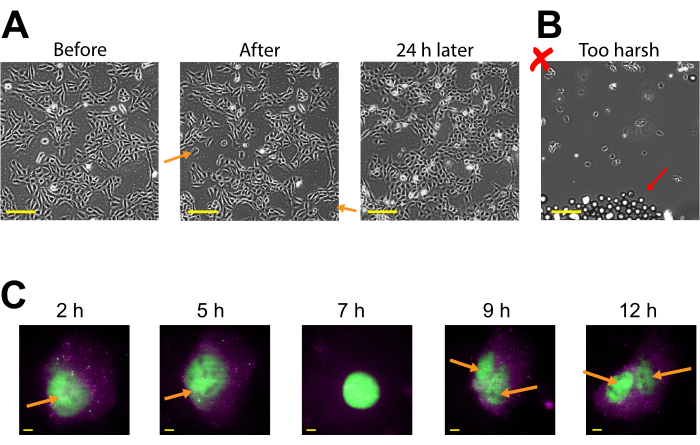
图3:珠子加载细胞保持粘附性,健康到足以生长和分裂。 (A) U2OS细胞在4微升珠子加载溶液中加入0.5微克的Cy3结合抗FLG Fab。细胞直接在珠子加载后成像,在珠子加载后24小时成像。橙色箭头识别在珠子加载过程中细胞脱落的区域。比例杆 = 2 毫米(B) U2OS 细胞珠子的代表图像, 其中装有来自(A)的组件, 但具有苛刻的敲击和太多的珠子。红色箭头可识别额外的玻璃珠。比例杆 = 2 毫米(C)U2OS 电池加载了 14.4 kbp 质粒 smFLAG-KDM5B-15xBoxB-24xMS2 中的 1.5 μg, 0.5 μg 的 Cy3 结合防弗拉格法布 (绿色), 130 ng 的光环塔格 - MCP (品红色) 在 8 μL 的珠子加载解决方案。就在成像之前,光环塔格被JF646-哈洛利甘德弄脏了。从记者质粒转录的 mRNA 的 MS2 茎环由 MCP(品红色斑点)标记,旗标记翻译的记者蛋白由防弗拉格法布(绿色共定位到 mRNA)标记。成熟的 Fab 标签蛋白质定位到细胞核。这个细胞在珠子加载后4-15小时被成像。黄色箭头识别细胞核之前和细胞分裂后的细胞核。秤杆 = 5μm。缩写: MCP = MS2 涂层蛋白。 请单击此处查看此图的较大版本。
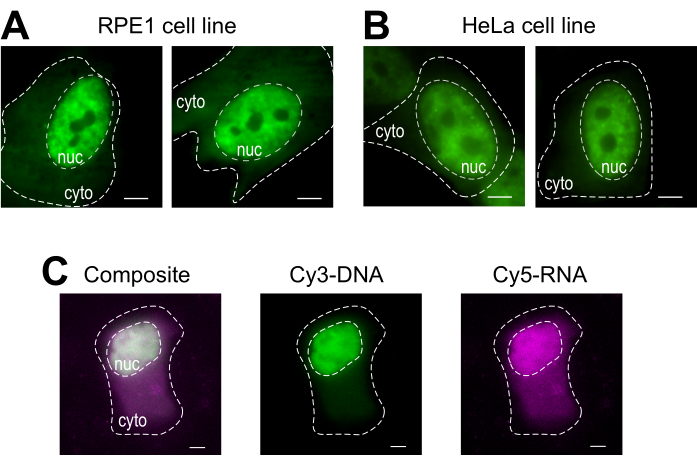
图4:珠子装载协议的细胞类型加载材料的变化。 (A-B)RPE1(A) 和 HeLa(B) 细胞在 4 μL 的加载溶液中装载了 1.5 μg 的核 Fab 蛋白 (抗 RNAPII-Serine 5 磷化) 。每个细胞的细胞核(核)和细胞质(细胞)都标有标记。细胞被珠子装上后6小时被成像。比例条 = 5 μm.(C) 人类 U2OS 细胞在 4 μL 的珠子加载溶液中同时装有 Cy5-RNA 9mer (品红色) 和 Cy3-DNA 28mer (绿色) 寡头, 每个 10 皮科莫莱。细胞在被珠子装上后4小时被成像。所有细胞核都由虚线突出显示。秤杆 = 5μm。缩写:RNAPII = RNA聚合酶II。 请单击此处查看此图的较大版本。
| 细胞线 | 细胞类型 | 珠子加载有效性 | 注释/参考 |
| 干细胞(人类) | 胚胎干细胞 | 难 | *如果镀在明胶涂层板上,许多细胞在珠子加载过程中剥落 |
| 赫克 293 | 人类胚胎肾细胞 | 难 | *在珠子加载之前,需要将凝胶基质放置到成像室表面。一开始装珠时轻轻点击。 |
| 神经元(大鼠) | 原发性胚胎神经元(e-18),分离 | 效率很低 | *使用此标准珠子加载协议未观察到神经元的高效珠子加载。这可能是由于神经元的非粘附性质或由此对神经过程的损害。 |
| MDCK (犬) | 马丁-达比犬肾细胞 | 见麦克尼尔和沃德 (1987)14 | *低效率珠子装载14 |
| U2OS(人类) | 骨 肉瘤 | 标准珠子加载协议 | |
| 赫拉(人类) | 子宫颈癌 | 标准珠子加载协议 | |
| RPE1(人类) | 表皮细胞不朽与 hTERT | 标准珠子加载协议 | |
| 赫夫(人类) | 主要前皮成纤维细胞 | 见贝斯特罗等人 (2009)31 | *修改倾斜协议,而不是点击31 |
| BALB/c 3T3、NIH 3T3 和瑞士 3T3 (鼠标) | 胚胎成纤维细胞 | 见吉尔摩和罗默 (1996)32,艾默生等人 (2014)33 和麦克尼尔和沃德 (1987)14 | *425\600 μm 玻璃珠报告32 |
| *使用 200\300 μm 玻璃珠33 | |||
| *75 μm 玻璃珠比 400 μm14效果更好 | |||
| DM(印度蒙雅克) | 皮肤成纤维细胞 | 见曼德斯、木村和库克 (1999)34 | |
| 乔 (仓鼠) | 类似表皮卵巢细胞 | 见梅梅杜拉和贝尔蒙特 (2003)35 | *使用 425\600 μm 玻璃珠35 |
| 贝(牛) | 牛主动脉内皮细胞(BAEC-11) | 见麦克尼尔和沃德 (1987)14 | *75 μm 玻璃珠比 400 μm14效果更好 |
| Ptk - 2 (波托穆斯三叶草) | 上皮肾细胞 | 见麦克尼尔和沃德 (1987)14 | *75 μm 玻璃珠比 400 μm14效果更好 |
| HUVEC(人类) | 脐静脉内皮细胞 | 见吉尔摩和罗默 (1996)32 | *使用 425\600 μm 玻璃珠32 |
| J774 和 J774.2 (鼠标) | 单细胞巨噬细胞 | 见贝克尔等人 (2005)36 和麦克尼尔和沃德 (1987)14 | *温柔的激动(而不是敲击)和425-600μm玻璃珠36 |
| MS-5 (鼠标) | 骨髓频闪细胞 | 见莫莱纳尔等人 (2003)37 | |
| WPE1-NB11(人类) | 前列腺上皮细胞 | 见吉尔摩和罗默 (1996)32 和 | *使用 425\600 μm 玻璃珠32 |
| 艾默生等人 (2014)33 | *使用 200\300 μm 玻璃珠33 |
表1:以不同单元格的珠子加载。 对于尚未在此实验室中加载珠子的细胞系,提供协议变化的参考和说明。
补充视频1:珠子加载细胞经历细胞分裂的例子。 U2OS 电池装载了 1.5 μg 的 14.4 kbp 质粒 smFLAG-KDM5B-15xBoxB-24xMS2, 0.5 μg 的 Cy3 结合防弗拉格 Fab (绿色), 130 ng 的光环塔格 -MCP (品红色) 在 8 μL 的珠子加载解决方案。就在成像之前,光环塔格被JF646-哈洛利甘德弄脏了。从记者质粒转录的 mRNA 的 MS2 茎环由 MCP(品红色斑点)标记,旗标记的翻译记者蛋白通过反 FLAG Fab(绿色共定位到 mRNA)标记。成熟的 Fab 标签蛋白质定位到细胞核。这个细胞在珠子加载后4-15小时被成像。秤杆 = 10μm。缩写: MCP = MS2 涂层蛋白。 请点击这里下载此视频。
讨论
此处描述的珠子加载技术是将大分子和其他粒子引入粘附细胞的成本效益和时间效益好的方法。这种多功能工艺可以加载蛋白质(图2A)15,16,26,27,蛋白质和质粒(图2B,C)22,25,RNA(图4C),100和250纳米聚苯乙烯珠(个人通信),合成染料39或量子点34,40 .珠子加载可能也有能力加载其他类型的膜防渗颗粒。其最常用的应用是将抗体或 Fabs 加载到活细胞中,以瞄准内源性表位,如转化后修饰 (PTMs)。目标,如PTM,往往很难标记在活细胞没有建立PTM特定的,基因编码探头41,42。相比之下,珠子加载可以将多种类型的探针、记者或其他分子工具一起引入同一个细胞,以便同时监测多个读数。我们预计珠子加载将是装载各种大分子或颗粒的有用技术。
珠子加载的一个主要优点是成本低:每个实验的成本低于0.01美元。珠子装载机设备可以轻松使用总成本为 150 英镑(合 150 美元)的廉价材料制造,这比任何其他电池装载方法都便宜得多。通过用塑料设备替换可重复使用的金属室,珠子装载机设备的成本可以进一步降低到 10 美元以下。为此,要么在 35 mm 的腔室中钻一个洞,要么从 35 mm 的玻璃底室中取出玻璃,然后用胶带牢固地固定网格。代替设备,珠子加载甚至可以使用宽孔1000微升移液器尖端勺子和洒珠子到细胞上,虽然这种变化使得很难洒在细胞上的单层珠子(第4.6步)。
珠子加载的另一个好处是,细胞可以保持正常的整体形态,快速恢复,并继续生长和分裂,至少对于在这里研究的U2OS、RPE1和 HeLa细胞,以及其他地方研究的其他细胞系(图3)图4A,B:补充视频1;和表1)31。在珠子加载过程中,细胞会承受物理压力,有时会脱落和剥落(在最佳条件下,5% 的细胞剥落,但如果珠子加载过于有力或在细胞上加载太多的玻璃珠(如图 3B所示),则可能会发生更大的细胞损失。然而,仍然附着在盖唇上的珠子加载细胞通常看起来健康,在珠子加载后30分钟(图3A)即可成像。我们通常允许细胞有30分钟的恢复期,但预计在珠子加载后更早成像是可行的。
这种技术的一个主要缺点是,细胞需要能够承受加载过程中轻微的身体压力,并保持安全地粘附在覆盖唇上。在涂层板(例如 HEK 和干细胞)上生长的不良/非粘附细胞系或细胞在珠子加载过程中经常在轻敲时分离。此外,经验表明,原发性神经元对珠子加载过于敏感。
珠子加载最适合单细胞或单分子实验。根据我们的经验,珠子加载具有大约20-40%的蛋白质加载效率,而+20%的珠子加载细胞也表达了共同加载质粒(图2A,B)。因此,珠子加载质粒对蛋白质表达的效率可能不如珠子加载纯化蛋白,因为质粒不仅必须进入细胞,而且必须表达(这涉及核导入、转录和翻译,每个都可能降低表达效率)。珠装质粒表达的低效率可以通过使用替代的转染协议,如脂化,在珠子加载蛋白质或探针16,27之前绕过。此外,在珠子加载前在最佳介质中孵育细胞30分钟可能有助于质粒表达。由于质粒表达率低,在这个实验室中,珠子加载并不经常被用作基于脂质的转染的替代品。唯一的例外是,当纯化蛋白,如Fab,是共同加载,在这种情况下,它是相当方便的珠子加载蛋白质和质粒在同一时间。此外,对于对脂质感染反应迟钝或不耐受的细胞,珠子加载可能为瞬态质粒表达提供替代方法,尽管效率低下。
披露声明
作者没有利益冲突可以披露。
致谢
我们感谢斯塔塞维奇实验室的成员进行了无数次对话,帮助改进和发展了本协议。具体来说,琳达·福雷罗博士和菲尔·福克斯博士就珠子加载不同细胞类型提供建议。我们衷心感谢横须贺博士、佐藤裕子博士和木村弘治博士分享了他们的玻璃珠装货协议。我们非常感谢阿肖克·普拉萨德博士和迭戈·克拉普夫博士慷慨地分享他们的珠子加载协议,将无机粒子引入细胞。我们感谢特拉维斯·桑德斯博士、克雷格·马歇尔博士和托马斯·桑坦杰洛博士慷慨地分享了他们标有RNA试剂。ALK、MNS、CAC、GG 和 TJS 得到了国家卫生研究院 (NIH) 授予 R35GM119728 和国家科学基金会 (NSF) 职业补助金 MCB-1845761 的支持,这两者都用于 TJS。CAC 还获得了 NSF NRT 奖 DGE-1450032 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 10 cm cell culture dishes | VWR | 82050-916 | Use to culture cells |
| 35 mm cell culture dishes | Falcon | 353001 | Use to construct bead loader |
| Attofluor Cell Chamber | Thermo Fisher Scientific | A7816 | Use to construct the custom bead loader |
| DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960069 | Use in general cell culture |
| Drierite Indicating Absorbents | Thermo Fisher Scientific | 07-578-3B | Store the bead loader in a desiccator with these absorbent pellets |
| Fetal Bovine Serum | Atlas Biologics | F-0050-A | Use in general cell culture and as a supplement before bead loading |
| Glass beads, acid washed, ≤106 µm* | Millipore Sigma | G4649 | Sprinkle on cells to bead load plasmid DNA and proteins |
| Glass bottom dishes, 35 mm, #1.5, 14 mm glass | MatTek Corporation | P35G-1.5-14-C | Seed cells onto these chambers for imaging |
| L-Glutamine-200 mM | Thermo Fisher Scientific | 25030081 | Use to make DMEM + media |
| Opti-MEM, Reduced Serum Medium | Thermo Fisher Scientific | 31985070 | Optimal media for incubating cells before bead loading (optional step) |
| Parafilm | VWR | 52858-032 | waxy film used to construct bead loader |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140-122 | Use to make DMEM + media |
| Phenol-free DMEM | Thermo Fisher Scientific | 31053036 | Use on cells before imaging |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9625 | Working stock of sterile 1X PBS |
| Sodium Hydroxide (NaOH) | Thermo Fisher Scientific | S318-500 | Use 2 M solution to wash glass beads |
| Spectra Mesh Woven Filters, Polypropylene, 105 µm opening | Spectrum Labs | 148496 | Use to construct bead loader |
| Trypsin | Thermo Fisher Scientific | 25300062 | Use in general cell culture |
参考文献
- Stewart, M. P., et al. In vitro and ex vivo strategies for intracellular delivery. Nature. 538 (7624), 183-192 (2016).
- Felgner, P. L., et al. Lipofection: a highly efficient, lipid-mediated DNA-transfection procedure. Proceedings of the National Academy of Sciences of the United States of America. 84 (21), 7413-7417 (1987).
- Schenborn, E. T., Goiffon, V. DEAE-dextran tansfection of mammalian cultured cells. Methods in Molecular Biology. 130, 147-153 (2000).
- Celis, J. E. Microinjection of somatic cells with micropipettes: comparison with other transfer techniques. Biochemical Journal. 223 (2), 281-291 (1984).
- Chakrabarti, R., Wylie, D. E., Schuster, S. M. Transfer of monoclonal antibodies into mammalian cells by electroporation. Journal of Biological Chemistry. 264 (26), 15494-15500 (1989).
- Wilson, A. K., Horwitz, J., De Lanerolle, P. Evaluation of the electroinjection method for introducing proteins into living cells. American Journal of Physiology. 260 (2), 355-363 (1991).
- Potter, H. Transfection by electroporation. Current Protocols in Molecular Biology. 62 (1), 1-6 (2003).
- Fawell, S., et al. Tat-mediated delivery of heterologous proteins into cells. Proceedings of the National Academy of Sciences of the United States of America. 91 (2), 664-668 (1994).
- Prior, T. I., FitzGerald, D. J., Pastan, I. Translocation mediated by domain II of Pseudomonas exotoxin A: transport of barnase into the cytosol. Biochemistry. 31 (14), 3555-3559 (1992).
- Walev, I., et al. Delivery of proteins into living cells by reversible membrane permeabilization with streptolysin-O. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3185-3190 (2001).
- Pitchiaya, S., Androsavich, J. R., Walter, N. G. Intracellular single molecule microscopy reveals two kinetically distinct pathways for microRNA assembly. EMBO Reports. 13 (8), 709-715 (2012).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. The Journal of Cell Biology. 98 (4), 1556-1564 (1984).
- Ortiz, D., Baldwin, M. M., Lucas, J. J. Transient correction of genetic defects in cultured animal cells by introduction of functional proteins. Molecular and Cellular Biology. 7 (8), 3012-3017 (1987).
- McNeil, P. L., Warder, E. Glass beads load macromolecules into living cells. Journal of Cell Science. 88 (5), 669-678 (1987).
- Hayashi-Takanaka, Y., et al. Tracking epigenetic histone modifications in single cells using Fab-based live endogenous modification labeling. Nucleic Acids Research. 39 (15), 6475-6488 (2011).
- Morisaki, T., et al. Real-time quantification of single RNA translation dynamics in living cells. Science. 352 (6292), 1425-1429 (2016).
- Tanenbaum, M. E., Gilbert, L. A., Qi, L. S., Weissman, J. S., Vale, R. D. A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell. 159 (3), 635-646 (2014).
- Zhao, N., et al. A genetically encoded probe for imaging nascent and mature HA-tagged proteins in vivo. Nature Communications. 10 (1), 2947(2019).
- Jedlitzke, B., Mootz, H. D. Photocaged nanobodies delivered into cells for light activation of biological processes. ChemPhotoChem. 5 (1), 22-25 (2021).
- Coulon, A., et al. Kinetic competition during the transcription cycle results in stochastic RNA processing. eLife. 3, 03939(2014).
- Pichon, X., Robert, M. -C., Bertrand, E., Singer, R. H., Tutucci, E. New generations of MS2 variants and MCP fusions to detect single mRNAs in living eukaryotic cells. Methods in Molecular Biology. 2166, 121-144 (2020).
- Koch, A., et al. Quantifying the dynamics of IRES and cap translation with single-molecule resolution in live cells. Nature Structural & Molecular Biology. 27, 1095-1104 (2020).
- Moon, S. L., et al. Multicolor single-molecule tracking of mRNA interactions with RNP granules. Nature cell biology. 21 (2), 162-168 (2019).
- Moon, S. L. Coupling of translation quality control and mRNA targeting to stress granules. Journal of Cell Biology. 219 (8), 202004120(2020).
- Cialek, C. A., et al. Imaging translational control by Argonaute with single-molecule resolution in live cells. bioRxiv. , (2021).
- Forero-Quintero, L. S., et al. Live-cell imaging reveals the spatiotemporal organization of endogenous RNA polymerase II phosphorylation at a single gene. bioRxiv. , (2020).
- Lyon, K., Aguilera, L. U., Morisaki, T., Munsky, B., Stasevich, T. J. Live-cell single RNA imaging reveals bursts of translational frameshifting. Molecular Cell. 75 (1), 172-183 (2019).
- JoVE. Introduction to Fluorescence Microscopy. General Laboratory Techniques. JoVE Science Education Database. , JoVE. Cambridge, MA. (2021).
- Hayashi-Takanaka, Y., Yamagata, K., Nozaki, N., Kimura, H. Visualizing histone modifications in living cells: spatiotemporal dynamics of H3 phosphorylation during interphase. Journal of Cell Biology. 187 (6), 781-790 (2009).
- Kumar, P., Nagarajan, A., Uchil, P. D. Analysis of cell viability by the MTT assay. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Stasevich, T. J., et al. Regulation of RNA polymerase II activation by histone acetylation in single living cells. Nature. 516 (7530), 272-275 (2014).
- Besteiro, S., Michelin, A., Poncet, J., Dubremetz, J. -F., Lebrun, M. Export of a Toxoplasma gondii rhoptry neck protein complex at the host cell membrane to form the moving junction during invasion. PLOS Pathogens. 5 (2), 1000309(2009).
- Gilmore, A. P., Romer, L. H. Inhibition of focal adhesion kinase (FAK) signaling in focal adhesions decreases cell motility and proliferation. Molecular Biology of the Cell. 7 (8), 1209-1224 (1996).
- Emerson, N. T., Hsia, C. -H., Rafalska-Metcalf, I. U., Yang, H. Mechanodelivery of nanoparticles to the cytoplasm of living cells. Nanoscale. 6 (9), 4538-4543 (2014).
- Manders, E. M. M., Kimura, H., Cook, P. R. Direct imaging of DNA in living cells reveals the dynamics of chromosome formation. Journal of Cell Biology. 144 (5), 813-822 (1999).
- Memedula, S., Belmont, A. S. Sequential recruitment of HAT and SWI/SNF components to condensed chromatin by VP16. Current Biology. 13 (3), 241-246 (2003).
- Becker, T., Volchuk, A., Rothman, J. E. Differential use of endoplasmic reticulum membrane for phagocytosis in J774 macrophages. Proceedings of the National Academy of Sciences of the United States of America. 102 (11), 4022-4026 (2005).
- Molenaar, C., et al. Visualizing telomere dynamics in living mammalian cells using PNA probes. The EMBO Journal. 22 (24), 6631-6641 (2003).
- Jones, S. A., Shim, S. -H., He, J., Zhuang, X. Fast, three-dimensional super-resolution imaging of live cells. Nature Methods. 8 (6), 499-505 (2011).
- Sabri, A., Xu, X., Krapf, W. M. Elucidating the origin of heterogeneous anomalous diffusion in the cytoplasm of mammalian cells. Physical Review Letters. 125 (5), 053901(2020).
- Sato, Y., et al. Genetically encoded system to track histone modification in vivo. Scientific Reports. 3, 2436(2013).
- Sato, Y., Stasevich, T. J., Kimura, H. Visualizing the dynamics of inactive X chromosomes in living cells using antibody-based fluorescent probes. X-Chromosome Inactivation. Methods in Molecular Biology. 1861, Humana. New York, NY, USA. 91-102 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。