Method Article
구슬로 단백질과 핵산을 부착된 인간 세포로
요약
비드 로딩은 단백질, 플라스미드 및 입자를 부착 된 포유류 세포로 소개합니다. 이 셀 로딩 기술은 저렴하고 빠르며 세포 건강에 실질적으로 영향을 미치지 않습니다. 그것은 살아있는 세포 화상 진찰에 가장 적합합니다.
초록
많은 살아있는 세포 화상 진찰 실험은 세포 내의 레이블 또는 기능을 위하여 외인성 입자 (예를 들면, 펩티드, 항체, 구슬)를 이용합니다. 그러나, 그것의 막을 통해 세포로 단백질을 소개하는 것은 어렵습니다. 현재 방법의 제한된 선택은 낮은 효율성으로 어려움을 겪고, 비용이 많이 들고 기술적으로 까다로운 장비 또는 좁은 매개 변수 내에서 의 기능을 필요로 합니다. 여기에서, 우리는 살아있는 인간 세포로 DNA, RNA 및 단백질을 적재하기 위한 상대적으로 간단하고 비용 효과적인 기술을 기술합니다. 비드 로딩은 세포막에 일시적인 기계적 중단을 유도하여 거대 분자가 부착된 살아있는 포유류 세포에 들어갈 수 있도록 합니다. 실험당 0.01 USD 미만의 비드 로딩은 셀 로딩 방법이 가장 저렴합니다. 또한, 비드 로딩은 세포를 실질적으로 스트레스를 주거나 생존력이나 증식에 영향을 미치지 않습니다. 이 원고는 비드 로딩 절차, 적응, 변형 및 기술적 한계의 단계를 설명합니다. 이 방법론은 살아있는 세포 화상 진찰에 특히 적합하지만 단백질, 구슬, RNA 또는 플라스미드를 살아있는, 부착 된 포유류 세포로 도입해야하는 다른 응용 분야에 대한 실용적인 솔루션을 제공합니다.
서문
거대분자를 포유류 세포로 적재하면 세포의 혈장 막1을교차할 수 있는 방법론이 필요합니다. 여러 가지 방법은 지방혈 성 전환2 및 diethylaminoethyl-dextran transfection3을포함하여 트랜스페션을 통해 포유류 세포로 플라스미드를 도입할 수 있다. 그러나, 단백질 또는 막 불투과성 입자를 세포로 적재하는 방법은 더 제한적이다.
여러 가지 기술을 사용하여 이 어려운 장애물을 우회했습니다. 첫째, 미세 주입은 현미경4에서살아있는 세포로 마이크로 피펫을 통해 입자를 전달합니다. 틀림없이 가장 통제되고 가장 침습적인 방법이지만, 이 기술은 세포가 하나씩 로드되어야 하기 때문에 상대적으로 낮은 처리량입니다. 또한, 미세 분사에는 특수 장비가 필요하며 기술적으로 요구됩니다.
둘째, 전기기화는 전압 유도 막중단5,6,7을통해 세포에 단백질을 전자 주입하는 방법입니다. 그러나,이 방법은 다시 전문, 비싼 장비를 필요로하고, 충격은 세포 스트레스와 사망을 일으킬 수 있습니다. 또한, 세포는 전기기화 전에 트립시화되어야 하며, 이후에 보충되어야 하며, 세포가 전기포화 후 조사할 수 있는 기간을 제한한다.
셋째, 세포막은 일시적이고 가역적인 투과화8,9를위해 화학적으로 변형될 수 있다. 연쇄상 구균-O 로딩은 세포막에 내독신을 삽입하여 일시적인 모공을 형성하여 단백질과 DNA 플라스미드를 포함한 외인성 막 불투과성 입자가세포(10)에진입할 수 있도록 한다. 2시간 회복 후, 약 절반의 세포가 이러한 모공을 수리하고 용액에서 입자를 내면화하는 것을 중단한다. 그러나,이 기술은 긴 회복 시간을 필요로하고 내독소를 용납 할 수없는 세포 유형과 호환되지 않습니다.
넷째, 기계적 중단은세포막(11)의물리적 인 혼란을 통해 세포에 입자를 로드한다. 이것은 셀12,13위에 긁힘, 긁기 및 롤링 구슬을 포함하여 여러 가지 방법으로 수행 될 수있다. 1987년 초, 비드는 기계적으로14개의단백질을 세포로 적재하는 데 사용되어 왔다. 최근에는 비드 로딩 기술이 단백질 을 넘어 플라스미드 및 RNA의 하중을 포함하도록 최적화되고 적응되어 여기에 설명된 바와 같이.
비드 로딩은 단백질과 플라스미드를 부착된 인간 세포에 적재하는 쉽고 저렴하며 빠른 방법입니다. 유리 구슬은 세포 위에 짧게 압연되어 일시적으로 세포 막을 방해합니다. 이를 통해 솔루션의 파티클이 입력할 수 있습니다. 비드 로딩은 효율이 낮기 때문에 단일 분자 또는 단일 세포 현미경 실험에 가장 적합합니다. 비드 로딩은 단편화된 항체(Fab),15,16가지 정제 단백질s scFvs, 17내트라내트,18,19또는 mRNA 코트 단백질, 예를 들어 MS2 코트 단백질(MCP) 20,21을포함한 다양한단백질을 도입할수 있다. 플라스미드 발현 벡터는 또한 단백질 용액에 첨가될 수 있고 동시에 비드로드가22,23,24,25일된다.
단백질과 플라스미드를 넘어, 250nm 폴리스티렌 구슬만큼 큰 분자는 비드 로딩 (개인 통신)을 통해 세포로 도입되었습니다. 비드 하중은 엄청나게 저렴하며, 재료 실험당 0.01 USD 미만의 비용이 들며 추가 비용이 많이 드는 장비가 필요하지 않습니다. 이미징 챔버의 중앙 14mm 직경 마이크로웰에 있는 세포만로드되기 때문에 실험당 사용되는 프로브의 양을 최소화함으로써 비용이 더욱 절감된다. 제한된 적재 영역은 비드 로딩이 벌크 셀 로딩에 적합하지 않다는 것을 의미합니다.
이 원고는 비드 로딩 장치를 구성하고 실험을 수행하는 방법을 포함하여 비드 로딩 프로세스를 제시합니다. 그것은 단백질, RNA 및 DNA가 각종 세포 모형으로 로드될 수 있고, 동시에 구슬장한 단백질이 높게 연관된 세포 농도 및 상대적으로 낮은 분산이 있다는 것을 보여줍니다. 또한 단백질, 플라스미드 또는 RNA의 세포 유형 및 적재에 기초한 프로토콜의 변이도 논의된다. 구슬은 세포막을 천포하고 방해하는 것으로 생각되지만, 적절하게 수행될 때 비드 로딩 공정은 이미징 챔버의 바닥에서 소수의 세포만 제거합니다. 짧은 회복 기간 후에, 세포는 성장하고 분할하는 것을 계속합니다. 이러한 방법론은 단일 분자 단백질 및 RNA 추적, 번역 후 변형 검출, 동적 세포 메커니즘의 관찰 또는 세포 외 국소화 모니터링15,16,22,26,27을포함하는 살아있는 세포 현미경실험에이상적입니다.
프로토콜
1. 응집을 피하고 세포 꼭대기까지 확산되도록 유리 구슬을 청소, 살균 및 건조시.
- 수산화 나트륨(NaOH)에서 약 5mL의 유리 구슬을 살균합니다. 50mL 원문 튜브에서 구슬을 측정합니다. 2M NaOH25mL을 넣고 셰이커 나 회전자를 사용하여 2 시간 동안 부드럽게 섞습니다.
- NaOH를 데산하여 가능한 한 많은 구슬을 유지합니다. 구슬이 현탁액인 경우 원심분리기에서 비드 튜브를 짧게 회전시니다(1분 ~1000 ×g,실온).
- pH가 중성될 때까지 세포 배양등급 물로 구슬을 철저히 세척하십시오(용광에 pH 테스트 스트립을 사용하여 중성 pH를 확인하십시오). 이전과 같이 매번 세척물을 데치.
- 100 % 에탄올 2-3 x로 구슬을 철저히 씻으십시오. 이전과 같이 매번 에탄올을 데치수.
- 구슬을 말리십시오. 비드를 뿌리면 멸균 용기 내부에 얇은 층(예: 10cm 페트리 접시)을 형성합니다. 컨테이너를 열어 두면 구슬이 하룻밤 사이에 생물 안전 캐비닛에 공기건조시키십시오. 구슬이 용기를 두드리거나 부드럽게 흔들어 서 뭉치거나 벗겨져 있지 않은 모래 질감을 가지고 있는지 확인하여 구슬이 완전히 건조되는지 확인하십시오.
- 건조한 구슬을 15분 동안 자외선 살균합니다.
2. 비드 로더 장치를 조립합니다.
- 메쉬 패치(폴리프로필렌 또는 이와 동등한 재료, 105 μm 개구부로 구슬이 통과할 수 있도록)를 고정하여, 금속 재사용 가능한 이미징 챔버의 수컷과 여성 끝 사이의 메쉬를 테이프로 들고 있는 구슬의 전체 개구부를 덮는다(도1A).
- 15 분 동안 장치를 자외선 살균하십시오. 구슬을 장치에 넣고 밀랍 필름으로 단단히 밀봉합니다.
참고: 이 단계에서비드는 완전히 깨끗하고 건조해야 합니다. 그들은 느슨하고 덩어리가없는 모래를 보아야합니다. 나타나지 않으면 다시 씻고 구슬을 완전히 건조시다. - 실리카 젤 또는 기타 건조제 배지에 의해 건조된 밀봉된 건조 용기에 장치를 보관하십시오. 비드가 축축해지면 비드 덩어리로 명백해지고, 철저히 건조하고 비드 로더를 살균하고 신선한 구슬로 교체하십시오.
참고: 이러한 모든 예방 조치는 비드 로더 내의 구슬 안 또는 주변에서 곰팡이 나 박테리아가 자라는 것을 방지할 수 있습니다. 상기 비드 로더 장치는 다른 방법으로 이루어질 수 있다. 토론의 세부 정보를 참조하십시오.
3. 부착 셀의 유리 바닥 챔버를 준비합니다.
- 35mm 유리 바닥 챔버에 종자 부착 포유동물 세포. 비드 로딩 시 셀이 약 80% 컨실수 있는지 확인합니다. (다양한 세포 유형에 대한 자세한 정보와 다른 세포 유형의 비드 로딩의 효과에 대한 메모는 표 1을 참조하십시오.)
참고: 세포는 얼마나 많은 세포가 사용되는지 보존하기 위해 챔버의 중심에 있는 마이크로웰에서만 씨를 뿌린 다. - 그들은 완전히 유리에 부착 될 때까지 정상 조건하에서 세포를 배양.
참고: 세포 밀도가 충분히 높고 세포가 유리에 단단히 부착되는 것이 필수적입니다. 이러한 요구 사항이 충족되지 않으면 비드 로딩 중에 셀이 벗겨질 수 있습니다. 셀 파싱과 비드 로딩 사이의 타임라인은 적절한 세포 접착력과 소모성을 보장하기 위해 길어질 수 있습니다.
4. 구드 로딩 셀
참고: 필요한 경우 인산염 완충식염(PBS)으로 세포를 잠깐 세척한 다음 최적의 배지의 2mL를 추가합니다. 적어도 30 분 동안 배양하십시오.
- 원하는 플라스미드, 단백질 및/또는 입자를 포함하는 3-8 μL의 용액을 만듭니다. 실험 적 요구 사항에 따라 각 유형의 플라스미드 및 ~0.5 μg (0.01 nmol)의 단백질의 ~1 μg (0.1-1 pmol)를 사용하십시오. 단백질에 대한 낮은 보존 튜브를 사용하여 튜브 벽에 남아 있지 않습니다. PBS를 사용하여 용액을 최소 3 μL까지 가져오고, 로드할 세포의 전체 영역(즉, 챔버의 마이크로웰, 도 1B)을코팅하도록 용액 볼륨을 조정한다.
- 위아래로 파이프팅 및/또는 튜브를 가볍게 하여 솔루션을 완전히 섞습니다. 용액을 탁상 미세 분리기에서 튜브 바닥으로 간단히 회전합니다.
- 비드 로딩 용액과 세포의 챔버를 조직 배양 후드로 옮킨다. 멸균 기술을 사용하여 조직 배양 후드의 나머지 단계를 수행합니다.
- 세포에서 배지를 제거하고 일시적으로 멸균 튜브에 보관하십시오. 챔버 의 가장자리 주위에서 모든 매체를 부드럽게 흡인하고 챔버를 약 45 ° 각도로 기울이고 중앙 마이크로웰의 나머지 미디어 방울을 제거합니다. 중간 제거 하는 동안, 파이펫 팁 유리터치 하지 않도록 해야 합니다., 세포 박리 및 손실 발생할 수 있습니다. 세포가 오랫동안 건조하지 않도록 다음 단계로 빠르게 이동합니다.
- 빈로딩 용액을 챔버 중앙의 유리 마이크로웰에 부드럽게 파이펫합니다. 선택 사항: 챔버가 완전히 건조할 수 없이 ~ 30초에 부드러운 흔들림으로 인큐베이션하십시오.
- 유리 구슬의 단층은 셀 위에 부드럽게 분산되어 바람직하게는 비드 로딩장치(도 1A)를이용하여 바람직하게는 된다. 구슬이 유리 바닥 마이크로웰의 세포를 완전히 덮는지 확인합니다.
- 두 손가락으로 챔버를 꼬집고 ~ 2 인치를 들어 올려 단단히 내려 놓고 후드 표면에 대고 두드릅니다. 그 높이에서 접시를 떨어뜨리는 것과 거의 동등한 힘을 사용합니다. 총 ~ 10 개의 탭을 반복합니다.
참고: 탭이 셀을 크게 벗겨내지 않도록 합니다. 탭은 셀 유형에 최적화될 수 있습니다. 셀이 제대로 로드되지 않으면 더 많이 누릅니다. 그러나 많은 세포가 벗겨지면 더 가볍게 누릅니다. - 챔버의 플라스틱 측면에 천천히 파이펫을 하여 챔버에 중간 을 부드럽게 다시 넣습니다. 셀을 방해하지 않고 떠다니는 구슬을 흡인하십시오. 너무 많이 제거된 경우 이 단계에서 미리 따뜻해지는 미디어를 더 추가합니다. 인큐베이터에서 0.5-2 h의 세포를 배양한다.
- 비드 로더를 15분 동안 UV 살균한 후 건조 조건에서 보관하십시오.
- 제조업체의 권장 프로토콜에 따라 염료(예: DAPI 또는 HaloTag 리간드 얼룩,실험에 필요한 경우)를 세포에 추가합니다.
- 이미징 전에 배지로 세포를 3배 세척하여 용액의 구슬 및 과도한 적재 성분을 제거합니다. 세포에 직접 파이펫팅을 하지 않도록 하여 필링을 하지 마십시오.
5. 비드로드 셀 이미징
- 실험에 필요한 경우 즉시 또는 필요할 때 셀을 이미지화합니다. 형광(레이저 또는 단색 광원)을 캡처할 수 있는 현미경을 사용합니다. 발아 파장이 선택한 형광또는 염료(예: 녹색 형광 단백질(GFP)용 488nm 파장 라이트에 적합한지 확인합니다.
참고: 비드로드 단백질은 세포가 회복되면(여기에 설명된 세포주에 대해 30분 포스트 로딩이 즉시)나 면 에 심해질 수 있다. Plasmid 식은 표현 벡터 요소에 따라 ≥2 h를취하고(도 1C및 토론에서 추가 설명). 비드 로드 셀의 이미징은 적재된 프로브와 관련된 적절한 형광원을 갖춘 임의의 현미경, 전자곱배전전장치(EMCCD) 또는 과학적 보완금속-옥사이드 반도체(sCMOS) 카메라, 및 인큐베이터와 같은 형광 영상을 캡처할 수 있는 카메라로 온도, 습도, 이산화탄소를 제어할 수 있다. 형광 현미경 검사법에 대한 가이드는 27을 참조하십시오.
결과
비드 로딩의 가장 일반적인 적용은 하나 이상의 유형의 단백질을 부착된 인간 세포에 도입하는 것입니다. 이를 설명하기 위해 세포는 Cy3-및 Alexa488-cojugated Fab 단백질의 용액으로 구단으로 로드되었습니다. 마이크로웰의 모든 세포가 구슬로 적재된 것은 아니지만, 거의 항상 로드된 세포는 Cy3-와 Alexa488표지 단백질을 함께 가지고있었다(그림 2A). 이전 추정에 따르면, Fab의 0.5 마이크로그램이 4 마이크로리터에서 희석될 때29개의마이크로리터가 구슬로 적재되어 있으며, 도 2A에서와같이 각 세포는 약 106팹 분자로 로드된다.
플라스미드 DNA 인코딩 GFP(플라스미드 DNA 1μg, 557 ng/μL 용액의 1.8 μL) 및 Cy3 라벨 Fab의 0.5 μg도 비드 하중을 통해 세포로 유입되어 이후에 발현 및 시각화하였다(도2B). GFP 형광은 GFP-인코딩 플라스미드가 세포에 로드되었을 뿐만 아니라 발현되었다는 것을 나타냈다. 따라서, 동일한 세포에서, 비드 로딩은 이전에 본 실험실에서 수행된 단백질 프로브(예를 들어, Cy3 표지된 팹) 및 리포터 플라스미드(예를 들어, GFP)를 이전에22,23,24로도입할 수 있다. 우리는 세포의 40 %가 팹 단백질로 구슬로드되고 비드로드 세포의 21 %가 도 2B의대표적인 시야에 도시된 플라스미드를 표현했다고 결정했습니다. 전형적으로, 각 챔버는 플라스미드의 1-2 μg, 리포페션과 거의 동일한 양으로 로드된다.
비드로드 된 세포는 플라스미드의 매우 다양한 수준을 표현(도 2C,D). 이를 구체적으로 측정하기 위해 피셔 비율 테스트를 사용하여 단백질 및 플라스미드 강도 데이터의 분포를 비교했습니다. 그 결과 단백질 1과 2가 유사한 강도 분포(p = ~1)를 가졌지만, 각 단백질은 플라스미드(p= 3.2e-6 및 1.8e-5)보다 현저히 적은 분포를 보였다. 이것은 세포 당 로드되는 얼마나 많은 플라스미드에 있는 가변성 때문일 수 있더라도, 세포의 사이에서 크게 변화할 가능성이 있는 플라스미드 발현에 요구되는 많은 단계에서 가변성의 더 중대한 근원이 생길 수 있습니다, 세포 핵으로 가져오는 것을 포함하여, 전사, 및 번역. 대조적으로, 비드 로드 단백질의 수준은 약간의 세포 대 세포 분산을 가졌고, 두 개의 동시에 로드된 단백질의 수준은 서로 매우 상관관계가있었다(도 2D,E).
플라스미드 식은 2-4h 포스트 비드 로딩으로 일찍 볼 수 있지만 최적의 플라스미드 발현이 얻어지는 시기에 따라 나중에 발생할 수 있다. 2-24h 포스트 비드 로딩에 걸친 특정 플라스미드에 대한 절식 창을 결정하는 데 타임 코스를 수행하는 것이 좋습니다. 이것은 긴 기간 화상 진찰을 가진 한 챔버에서 또는 구단 로딩 및 비틀거리는 다중 챔버에 의해 행해질 수 있습니다. 비드로드 된 세포는 부착 남아 있으며 성장하고 분할 할 만큼 건강합니다. 비드로드 인간 U2OS 셀은 비드 로딩 후 24시간 전에 직접 이미지화되었다. 그림 3A(왼쪽, 가운데)에 도시된 바와 같이 적절한 비드 로딩은 세포 수 또는 형태에 거의 눈에 띄는 영향을 미치지 않았다.
대조적으로, 너무 많은 구슬과 과도한 도청 힘이있는 가난한 구슬 하중이 도 3B에묘사됩니다. 이로 인해 많은 세포 손실(세포와 분리, 부동, 초점이 벗어난 세포가 없는 커버글래스의 큰 패치), 가난한 세포 형태(반올림및 제대로 부착된 세포) 및 비드 로딩 후 커버글래스에 남아 있는 구슬 의 클러스터가 발생했습니다. 세포는 비드 로딩 중에 기계적 손상을 겪는 것으로 생각되지만, 비드 로딩 후 24시간 세포의 증가수에 의해 입증된 바와 같이, 세포는 제대로 비드로드된 챔버에서 성장하고 증식된다(그림3A,오른쪽). 세포 생존가능성에 미치는 영향은 3-(4,5-디메틸티아졸-2-yl)-2,5-디페닐테트라졸륨 브로마이졸 브로마이졸 브로마이드(MTT)와 같은 다양한 분석법을 통해 평가될 수 있으며, 모의 전하세포(30)에비드로드를 비교한다. 또한, 이와 전작은 비드로드 세포가 세포분열(도 3C 및 보충 비디오 1)을겪고 있으며, 미토시스의 타이밍은 비드로딩(31)에의해 영향을 받지 않으며, 이는 비드 로딩 후 지속세포 건강에 대한 추가 증거역할을 한다.
비드 로딩은 여러 부착 세포주 및 다양한 거대 분자를 수용하는 다목적 기술입니다. 여기서, 이러한 다양성은FAB(도 4A,B)를가진 RPE1 및 HeLa 세포주를 적재함으로써 입증되었다. 표 1은 이 실험실 과 그 너머의 다른 세포주에서 비드 로딩의 추가 예를 제공하고 다른 실험실에서 비드 로딩 프로토콜 간의 미묘한 차이 중 일부를 지적합니다. 참고로, 적재에 사용되는 유리 구슬의 직경은 실험실마다 크게 다르지만, 가장 효율적인 적재는 여러셀주(14)에서75μm 직경의 구슬에 대해 발견되었다. 또한, 이 실험실은 비드 로딩 RNA를 시작했다 (데이터는 표시되지 않음). 도 4C는 Cy5-RNA 9mer 및 Cy3-DNA 28mer를 함께 탑재한 대표적인 U2OS 세포 비드로드를 함께 표시한다.
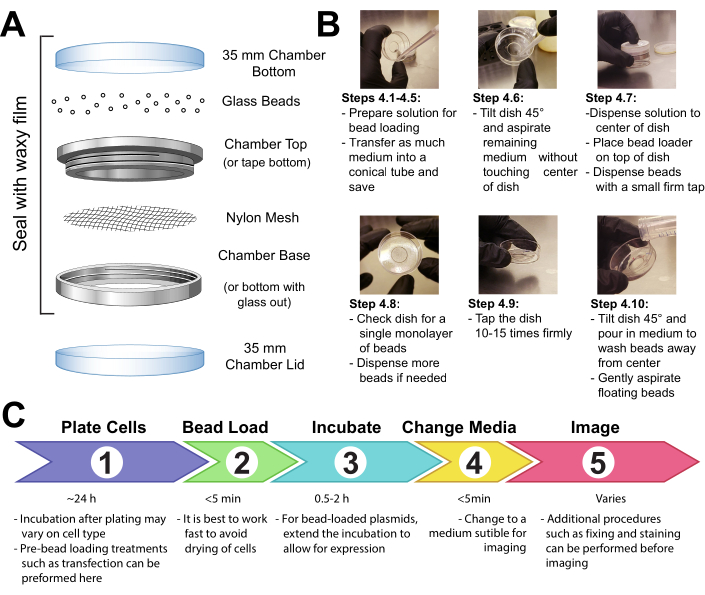
그림 1: 비드 로딩 장치, 기술 및 타임라인을 클릭하여 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
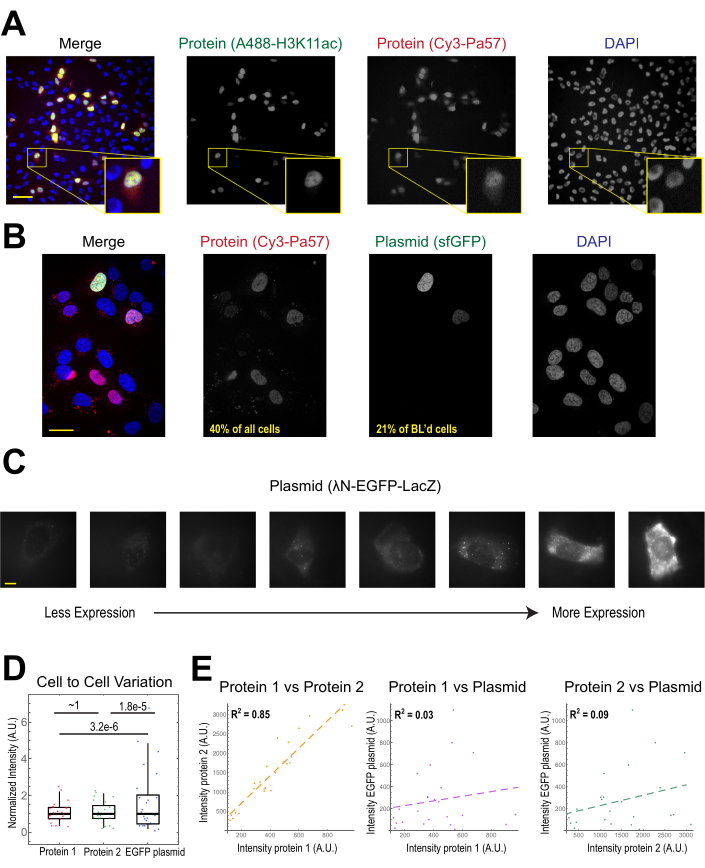
그림 2. 비드 로딩은 단백질 농도가 낮지만 플라스미드 발현의 가변성이 높다. (A)세포는 각각 의 0.5 μg로 비드로드되어 각각의 Alexa488-공주 항 H3K27 아세틸 팹(녹색) 및 Cy3-컨쥬게이드 안티 RNAPII-Serine 5-인포시드 팹(red)을 4μL로 적재하였다. 세포는 DAPI 염색(파란색)이었으며 즉시 실시간 이미지를 촬영했습니다. 스케일 바 = 20 μm.(B)세포는 팹 단백질의 0.5 μg(Cy3-컨쥬게이드 안티 RNAPII-Serine 5-인포리드 단백질, 빨간색)와 1 μg의 플라스미드 인코딩 슈퍼폴더 GFP-H2B(녹색)를 4 μL의 4μL로 적재하였다. 24 시간 후, 세포는 DAPI 염색 (파란색) 및 라이브 이미지되었다. 스케일 바 = 30 μm.(C-E)단백질 1(JF646-HaloLigand-표지할로태그-MCP), 단백질 2(Cy3-컨쥬게이드 안티 플래그 팹), 및 PLAsmid 인코딩 EGFP(λN-EGFP-LacZ)가 세포에 함께 비드로드되었다. 각 형광 채널의 총 강도는 각 세포의 세포질에서 1.3 x 1.3 μm 패치로 측정되었다. N = 25 셀. (C)비드 로드 플라스미드, λN-EGFP-LacZ를 발현하는 대표적인 세포. 동일한 이미징 조건과 강도는 모든 세포에 사용되었습니다. 반점은 표현된 단백질의 골재입니다. 스케일 바 = 10 μm.(D)차트는 플라스미드로부터 발현된 단백질 1, 단백질 2 또는 EGFP의 각 세포의 총 강도를 나타낸다. 각 채널은 중앙값으로 정규화되었습니다. 본페로니-보정P 값은 피셔 비율 시험에 의해 계산되어 단백질 또는 플라스미드 강도 데이터의 분포가 동일한 가변성을 가지고 있는지 여부를 결정하였다. 각 점은 셀을 나타냅니다. (E)단백질, 단백질 1 및 플라스미드, 또는 단백질 2 및 플라스미드 모두에 대한 총 강도는 서로에 대해 플롯됩니다. 계산된 R2 값이 표시됩니다. 각 점은 셀을 나타냅니다. 약어: DAPI = 4′,6-디아미드노-2-페닐린돌; EGFP = 향상된 녹색 형광 단백질; A.U. = 임의 단위; MCP = MS2 코트 단백질; RNAPII = RNA 폴리머라제 II. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
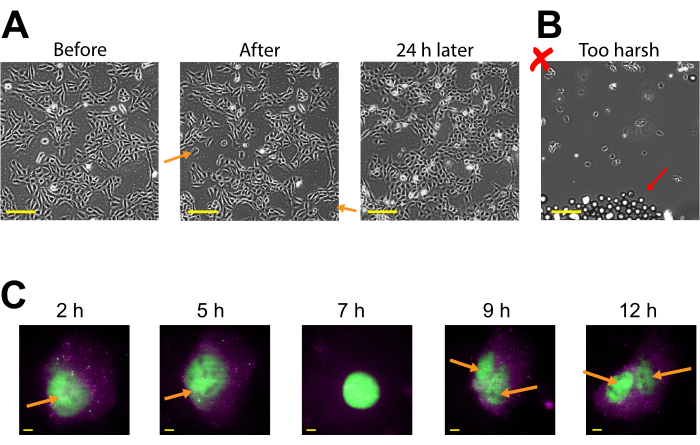
그림 3: 비드 로드 된 세포는 부착 된 상태로 유지되고 성장하고 분할 할 만큼 건강합니다. (A)U2OS 세포는 비드 로딩 용액의 4 μL에서 Cy3-공주 안티 플래그 팹의 0.5 μg로 비드로드하였다. 셀은 구시 하중 직후, 구드 로딩 후, 24h를 구시적전 후 직접 이미지하였다. 주황색 화살표는 비드 로딩 중에 세포가 벗겨지는 영역을 식별합니다. 스케일 바 = 2mm.(B)U2OS 세포의 대표적인 이미지는(A)에서구성 요소와 구슬로드하지만 가혹한 도청과 너무 많은 구슬. 빨간색 화살표는 추가 유리 구슬을 식별합니다. 스케일 바 = 2mm.(C)U2OS 세포는 14.4 kbp 플라스미드 smFLAG-KDM5B-15xBoxB-24xBoxB-24xMS2, 0.5 μg의 1.5 μg로 로드되었다. 이미징 직전에 HaloTag는 JF646-HaloLigand로 염색되었습니다. 리포터 플라스미드로부터 전사된 mRNA의 MS2 줄기 루프는 MCP(마젠타 반점)에 의해 표지되고, 플래그 태그가 지정된 번역된 리포터 단백질은 안티 플래그 팹(녹색 코현지화에서 mRNA까지)에 의해 표지된다. 성숙한 Fab 표지 단백질은 핵에 국소화합니다. 이 셀은 비드 로딩 후 4-15h를 이미지화했습니다. 황색 화살표는 세포 분열 후에 세포 핵과 핵을 확인합니다. 스케일 바 = 5 μm. 약어: MCP = MS2 코트 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
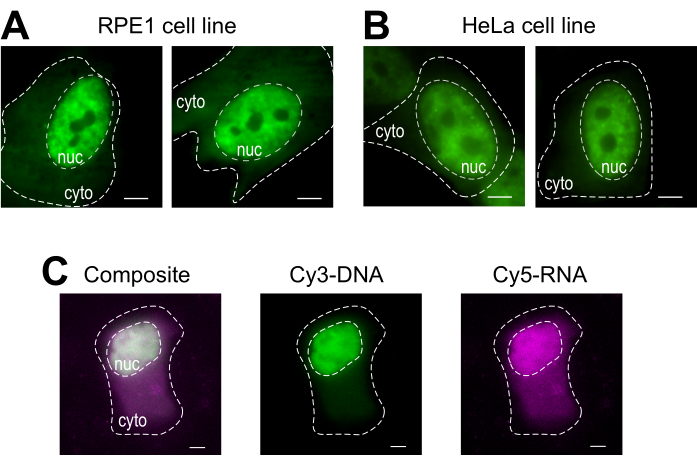
그림 4: 비드 로딩 프로토콜의 셀 타입 로딩 재료의 변형. (A-B) RPE1(A)및 HeLa(B)세포는 적재용액의 4μL에서 핵팹 단백질(안티 RNAPII-Serine 5-인산화)의 1.5 μg로 비드로드하였다. 각 세포의 핵 (nuc) 및 세포질 (cyto)는 표시됩니다. 셀은 비드로드된 후 6h를 이미지하였다. 스케일 바 = 5 μm.(C)인간 U2OS 세포는 비드 로딩 용액의 4 μL에서 각각 Cy5-RNA 9mer(마젠타) 및 Cy3-DNA 28mer(green) 올리고, 10피코몰로 비드로드하였다. 셀은 비드로드된 후 4h를 이미지화하였다. 모든 세포 핵은 파선에 의해 강조된다. 스케일 바 = 5 μm. 약어: RNAPII = RNA 폴리머라제 II. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 셀 라인 | 셀 타입 | 비드 로딩 효과 | 메모/참조 |
| 줄기 세포 (인간) | 배아 줄기 세포 | 어렵다 | *젤라틴 코팅 플레이트에 도금된 경우 비드 로딩 중에 많은 세포가 벗겨짐 |
| HEK 293 | 인간 배아 신장 세포 | 어렵다 | *비드 로딩 전에 이미징 챔버 표면에 젤 매트릭스를 내려놓아야 합니다. 처음에 비드 로딩시 부드럽게 누릅니다. |
| 뉴런 (쥐) | 1 차적인 배아 뉴런 (e-18), 해리 | 매우 비효율적 | *이 표준 비드 로딩 프로토콜을 사용하여 뉴런의 효율적인 비드 로딩이 관찰되지 않았습니다. 이것은 뉴런의 비 준수 특성 또는 신경 과정에 결과적으로 손상 때문일 수 있습니다. |
| MDCK (개) | 매딘 다비 개 신장 세포 | 맥닐과 워드 (1987)14 참조 | *저효율 비드 로딩14 |
| U2OS (인간) | 골육종 | 표준 비드 로딩 프로토콜 | |
| 헬라 (인간) | 자궁 경부암 | 표준 비드 로딩 프로토콜 | |
| RPE1 (인간) | hTERT로 불멸의 상피 세포 | 표준 비드 로딩 프로토콜 | |
| HFF (인간) | 기본 포피부 섬유아세포 | Besteiro 외 를 참조하십시오 (2009)31 | *31을 두드리는 대신 기울기 프로토콜 수정 |
| BALB/c 3T3, NIH 3T3 및 스위스 3T3(마우스) | 배아 섬유아세포 | 길모어와 로머 (1996)32,에머슨 외(2014)33, 맥닐과 워드 (1987)14 참조 | *425-600 μm 유리 비드 보고32 |
| *사용 200-300 μm 유리 구슬33 | |||
| *75 μm 유리 구슬은 400 μm14보다 더 나은 결과를 주었다 | |||
| DM (인도 문자크) | 피부 섬유아세포 | 만더스, 키무라, 쿡 (1999)34 참조 | |
| CHO (햄스터) | 상피와 같은 난소 세포 | 메메둘라와 벨몬트 (2003)35 참조 | *사용 425-600 μm 유리 구슬35 |
| BAE (소) | 소 대동맥 내피 세포 (BAEC-11) | 맥닐과 워드 (1987)14 참조 | *75 μm 유리 구슬은 400 μm14보다 더 나은 결과를 주었다 |
| PtK-2 (포토무스 트리다클리스) | 상피 신장 세포 | 맥닐과 워드 (1987)14 참조 | *75 μm 유리 구슬은 400 μm14보다 더 나은 결과를 주었다 |
| 후벡 (인간) | 배꼽 정맥 내피 세포 | 길모어와 로머 (1996)32 참조 | *사용 425-600 μm 유리 구슬32 |
| J774 및 J774.2 (마우스) | 단세포 대식세포 | 베커 외(2005)36, 맥닐과 워더 (1987)14참조 | *부드러운 동요(두드리는 대신) 및 425-600 μm 유리 구슬36 |
| MS-5(마우스) | 골수 기질 세포 | 몰레나 외(2003)37참조 | |
| WPE1-NB11 (인간) | 전립선 상피 세포 | 길모어와 로머 (1996)32 번 | *사용 425-600 μm 유리 구슬32 |
| 에머슨 외 (2014)33 | *사용 200-300 μm 유리 구슬33 |
표 1: 다른 세포주에서 비드 로딩. 이 실험실에서 아직 구슬로드되지 않은 세포주에 대해 프로토콜의 변형에 대한 참조 및 메모가 제공됩니다.
보충 비디오 1: 셀 분할을 겪고 있는 구단로드 셀의 예입니다. U2OS 세포는 14.4 kbp 플라스미드 smFLAG-KDM5B-15xBoxB-24xMS2, Cy3-컨쥬게이트 안티 플래그 팹(green) 0.5 μg, 할로태그-MCP(마젠타) 8L의 130ng로 적재하였다. 이미징 직전에 HaloTag는 JF646-HaloLigand로 염색되었습니다. 리포터 플라스미드로부터 전사된 mRNA의 MS2 줄기 루프는 MCP(마젠타 반점)에 의해 표지되고, 플래그 태그가 지정된 번역된 리포터 단백질은 안티 플래그 팹(녹색 코현지화에서 mRNA까지)을 통해 표지된다. 성숙한 Fab 표지 단백질은 핵에 국소화합니다. 이 셀은 비드 로딩 후 4-15h를 이미지화했습니다. 스케일 바 = 10 μm. 약어: MCP = MS2 코트 단백질. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
여기에 설명된 비드 로딩 기술은 거대 분자 및 기타 입자를 부착 세포로 도입하는 비용 효율적이고 시간 효율적인 방법입니다. 이 다목적 공정은단백질(도 2A)15,16,26,27,단백질과 플라스미드(도2B,C)22, 25,RNA(도4C),100 및 250nm 폴리스티렌 비드(개인 서신), 합성 염료39 또는 퀀텀닷34,40을 로드할 수있습니다. . 비드 로딩은 다른 유형의 멤브레인 불투과성 입자를 로드할 수 있습니다. 가장 자주 사용되는 응용 프로그램은 항체 또는 Fabs를 적재하여 번역 후 변형(PTM)과 같은 내인성 전형체를 살아있는 세포로 표적화하는 것입니다. PTM과 같은 표적은 종종 확립된 PTM 특이적, 유전적으로 인코딩된 프로브41,42없이 살아있는 세포에 라벨을 붙이기 어렵다. 대조적으로, 비드 로딩은 여러 유형의 프로브, 리포터 또는 기타 분자 도구를 동일한 세포로 함께 도입하여 여러 판독을 동시에 모니터링할 수 있습니다. 우리는 비드 로딩이 다양한 거대 분자 또는 입자를적재하는 데 유용한 기술이 될 것으로 예상합니다.
비드 로딩의 주요 장점은 저렴한 비용입니다 : 각 실험 비용은 0.01 USD 미만입니다. 비드 로더 장치는 다른 셀 로딩 방법보다 훨씬 저렴한 재료로 150 달러까지 저렴하게 만들 수 있습니다. 비드 로더 장치의 비용은 재사용 가능한 금속 챔버를 플라스틱 챔버로 대체하여 $10 미만으로 더 줄일 수 있습니다. 이를 위해 35mm 챔버에 구멍을 뚫거나 35mm 유리 바닥 챔버에서 유리를 제거한 다음 테이프로 메쉬를 제자리에 단단히 고정시하십시오. 장치 대신, 비드 로딩은 넓은 보어 1000 μL 파이펫 팁을 사용하여 세포에 구슬을 스쿱하고 뿌릴 수도 있지만, 이러한 변화로 인해 구슬의 단층층을 세포에 뿌리기가 어렵다(단계 4.6).
비드 로딩의 또 다른 장점은 세포가 정상 전체 형태를 유지하고, 빠르게 회복하고, 적어도 U2OS, RPE1 및 HeLa 세포가 여기에서 연구한 다른 세포주를 위해 연구된 다른 세포주를 위해 계속 성장하고 분열할 수 있다는것입니다(그림 3; 그림 4A,B; 보충 비디오 1; 및 표 1)31. 비드 로딩 하는 동안, 세포는 물리적 스트레스를 겪고 때로는 이탈 및 껍질 (세포의 ~5%는 최적의 조건에서 벗겨, 하지만 더 큰 세포 손실 비드 로딩수행 너무 강제로 수행 되 거나 너무 많은 유리 구슬 세포 위에 로드 되는 경우 발생할 수 있습니다., 그림 3B에묘사 된 대로). 그러나, 커버슬립에 부착된 비드로드 셀은 일반적으로 건강하게 나타나며 비드 로딩 후 30분 으로 즉시 이미지화될 수있다(도 3A). 우리는 일반적으로 세포가 30 분 복구 기간을 허용하지만 더 빨리 비드 후 로딩이 가능하다는 것을 예상합니다.
이 기술의 주요 단점은 세포가 적재 하는 동안 사소한 물리적 스트레스를 견딜 수 있어야 하 고 커버 슬립에 단단히 부착 유지. 코팅 된 플레이트 (예 : HEK 및 줄기 세포)에서 자란 가난한 / 비 부착 세포 주 또는 세포는 종종 비드 로딩 중에 부드러운 도청시 분리됩니다. 또한, 경험은 기본 뉴런이 비드 로딩에 너무 민감하다는 것을 보여주었습니다.
비드 로딩은 단일 세포 또는 단일 분자 실험에 가장 적합합니다. 우리의 경험에서, 비드 로딩은 약 20-40 % 단백질 적재 효율을 가지며, 비드로드 세포의 ~20 %는 또한 공동로드 플라스미드(도 2A,B)를표현했다. 따라서, 비드 로딩 플라스미드는 플라스미드가 세포를 입력할 뿐만 아니라 표현되어야 하기 때문에 비드 로딩 정제 단백질보다 단백질 발현에 덜 효율적일 수 있다(무엇보다도 핵 수입, 전사 및 번역이 포함되며, 각각은 발현 효율을 낮출 수 있다). 비드 로드 된 플라스미드 발현의 낮은 효율은 비드 로딩 단백질 또는 프로브(16,27)전에 지방 흡입과 같은 대체 경질 프로토콜을 사용하여 우회 할 수 있습니다. 또한, 비드 로딩 전에 30분 동안 최적의 매체에서 세포를 배양하면 플라스미드 발현을 지원할 수 있다. 낮은 플라스미드 발현으로 인해 비드 하중은 이 실험실에서 리포펙션 기반 의 전환에 대한 대안으로 자주 사용되지 않았습니다. 유일한 예외는 Fab과 같은 정제 된 단백질이 공동 로드될 때이며, 이 경우 단백질과 플라스미드를 동시에 비드로드하는 것이 매우 편리합니다. 더욱이, 리포페션에 반응하지 않거나 내성이 없는 세포의 경우, 비드 로딩은 과도 플라스미드 발현을 위한 저효율, 방법이기는 하지만 대체적인 것을 제공할 수 있다.
공개
저자는 공개 할 이해 상충이 없습니다.
감사의 말
우리는 이 프로토콜을 개선하고 개발하는 데 도움이 되는 수많은 대화에 대해 Stasevich 연구소의 회원들에게 감사드립니다. 특히 린다 포레로 박사와 필 폭스 박사는 다양한 세포 유형에 대한 비드 로딩에 대한 조언을 구사합니다. 하야시 다카나카 요코 박사, 사토 유코 박사, 기무라 히로시 박사가 유리 비드 로딩 프로토콜을 공유해 주신 것에 대해 진심으로 감사드립니다. 아쇼크 프라사드 박사와 디에고 크라프 박사에게 무기 입자를 세포에 도입하기 위한 비드 로딩 프로토콜을 아낌없이 공유해 주셔서 대단히 감사합니다. 트래비스 샌더스 박사, 크레이그 마셜 박사, 토마스 산탄젤로 박사에게 표기된 RNA 시약을 아낌없이 공유해 주셔서 감사합니다. ALK, MNS, CAC, GG 및 TJS는 국립 보건원 (NIH) 보조금 R35GM119728 및 국립 과학 재단 (NSF) 경력 보조금 MCB-1845761에 의해 지원되었다, 모두 TJS에. CAC는 또한 NSF NRT 상 DGE-1450032에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 10 cm cell culture dishes | VWR | 82050-916 | Use to culture cells |
| 35 mm cell culture dishes | Falcon | 353001 | Use to construct bead loader |
| Attofluor Cell Chamber | Thermo Fisher Scientific | A7816 | Use to construct the custom bead loader |
| DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960069 | Use in general cell culture |
| Drierite Indicating Absorbents | Thermo Fisher Scientific | 07-578-3B | Store the bead loader in a desiccator with these absorbent pellets |
| Fetal Bovine Serum | Atlas Biologics | F-0050-A | Use in general cell culture and as a supplement before bead loading |
| Glass beads, acid washed, ≤106 µm* | Millipore Sigma | G4649 | Sprinkle on cells to bead load plasmid DNA and proteins |
| Glass bottom dishes, 35 mm, #1.5, 14 mm glass | MatTek Corporation | P35G-1.5-14-C | Seed cells onto these chambers for imaging |
| L-Glutamine-200 mM | Thermo Fisher Scientific | 25030081 | Use to make DMEM + media |
| Opti-MEM, Reduced Serum Medium | Thermo Fisher Scientific | 31985070 | Optimal media for incubating cells before bead loading (optional step) |
| Parafilm | VWR | 52858-032 | waxy film used to construct bead loader |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140-122 | Use to make DMEM + media |
| Phenol-free DMEM | Thermo Fisher Scientific | 31053036 | Use on cells before imaging |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9625 | Working stock of sterile 1X PBS |
| Sodium Hydroxide (NaOH) | Thermo Fisher Scientific | S318-500 | Use 2 M solution to wash glass beads |
| Spectra Mesh Woven Filters, Polypropylene, 105 µm opening | Spectrum Labs | 148496 | Use to construct bead loader |
| Trypsin | Thermo Fisher Scientific | 25300062 | Use in general cell culture |
참고문헌
- Stewart, M. P., et al. In vitro and ex vivo strategies for intracellular delivery. Nature. 538 (7624), 183-192 (2016).
- Felgner, P. L., et al. Lipofection: a highly efficient, lipid-mediated DNA-transfection procedure. Proceedings of the National Academy of Sciences of the United States of America. 84 (21), 7413-7417 (1987).
- Schenborn, E. T., Goiffon, V. DEAE-dextran tansfection of mammalian cultured cells. Methods in Molecular Biology. 130, 147-153 (2000).
- Celis, J. E. Microinjection of somatic cells with micropipettes: comparison with other transfer techniques. Biochemical Journal. 223 (2), 281-291 (1984).
- Chakrabarti, R., Wylie, D. E., Schuster, S. M. Transfer of monoclonal antibodies into mammalian cells by electroporation. Journal of Biological Chemistry. 264 (26), 15494-15500 (1989).
- Wilson, A. K., Horwitz, J., De Lanerolle, P. Evaluation of the electroinjection method for introducing proteins into living cells. American Journal of Physiology. 260 (2), 355-363 (1991).
- Potter, H. Transfection by electroporation. Current Protocols in Molecular Biology. 62 (1), 1-6 (2003).
- Fawell, S., et al. Tat-mediated delivery of heterologous proteins into cells. Proceedings of the National Academy of Sciences of the United States of America. 91 (2), 664-668 (1994).
- Prior, T. I., FitzGerald, D. J., Pastan, I. Translocation mediated by domain II of Pseudomonas exotoxin A: transport of barnase into the cytosol. Biochemistry. 31 (14), 3555-3559 (1992).
- Walev, I., et al. Delivery of proteins into living cells by reversible membrane permeabilization with streptolysin-O. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3185-3190 (2001).
- Pitchiaya, S., Androsavich, J. R., Walter, N. G. Intracellular single molecule microscopy reveals two kinetically distinct pathways for microRNA assembly. EMBO Reports. 13 (8), 709-715 (2012).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. The Journal of Cell Biology. 98 (4), 1556-1564 (1984).
- Ortiz, D., Baldwin, M. M., Lucas, J. J. Transient correction of genetic defects in cultured animal cells by introduction of functional proteins. Molecular and Cellular Biology. 7 (8), 3012-3017 (1987).
- McNeil, P. L., Warder, E. Glass beads load macromolecules into living cells. Journal of Cell Science. 88 (5), 669-678 (1987).
- Hayashi-Takanaka, Y., et al. Tracking epigenetic histone modifications in single cells using Fab-based live endogenous modification labeling. Nucleic Acids Research. 39 (15), 6475-6488 (2011).
- Morisaki, T., et al. Real-time quantification of single RNA translation dynamics in living cells. Science. 352 (6292), 1425-1429 (2016).
- Tanenbaum, M. E., Gilbert, L. A., Qi, L. S., Weissman, J. S., Vale, R. D. A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell. 159 (3), 635-646 (2014).
- Zhao, N., et al. A genetically encoded probe for imaging nascent and mature HA-tagged proteins in vivo. Nature Communications. 10 (1), 2947 (2019).
- Jedlitzke, B., Mootz, H. D. Photocaged nanobodies delivered into cells for light activation of biological processes. ChemPhotoChem. 5 (1), 22-25 (2021).
- Coulon, A., et al. Kinetic competition during the transcription cycle results in stochastic RNA processing. eLife. 3, 03939 (2014).
- Pichon, X., Robert, M. -. C., Bertrand, E., Singer, R. H., Tutucci, E. New generations of MS2 variants and MCP fusions to detect single mRNAs in living eukaryotic cells. Methods in Molecular Biology. 2166, 121-144 (2020).
- Koch, A., et al. Quantifying the dynamics of IRES and cap translation with single-molecule resolution in live cells. Nature Structural & Molecular Biology. 27, 1095-1104 (2020).
- Moon, S. L., et al. Multicolor single-molecule tracking of mRNA interactions with RNP granules. Nature cell biology. 21 (2), 162-168 (2019).
- Moon, S. L. Coupling of translation quality control and mRNA targeting to stress granules. Journal of Cell Biology. 219 (8), 202004120 (2020).
- Cialek, C. A., et al. Imaging translational control by Argonaute with single-molecule resolution in live cells. bioRxiv. , (2021).
- Forero-Quintero, L. S., et al. Live-cell imaging reveals the spatiotemporal organization of endogenous RNA polymerase II phosphorylation at a single gene. bioRxiv. , (2020).
- Lyon, K., Aguilera, L. U., Morisaki, T., Munsky, B., Stasevich, T. J. Live-cell single RNA imaging reveals bursts of translational frameshifting. Molecular Cell. 75 (1), 172-183 (2019).
- JoVE. Introduction to Fluorescence Microscopy. General Laboratory Techniques. JoVE Science Education Database. , (2021).
- Hayashi-Takanaka, Y., Yamagata, K., Nozaki, N., Kimura, H. Visualizing histone modifications in living cells: spatiotemporal dynamics of H3 phosphorylation during interphase. Journal of Cell Biology. 187 (6), 781-790 (2009).
- Kumar, P., Nagarajan, A., Uchil, P. D. Analysis of cell viability by the MTT assay. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Stasevich, T. J., et al. Regulation of RNA polymerase II activation by histone acetylation in single living cells. Nature. 516 (7530), 272-275 (2014).
- Besteiro, S., Michelin, A., Poncet, J., Dubremetz, J. -. F., Lebrun, M. Export of a Toxoplasma gondii rhoptry neck protein complex at the host cell membrane to form the moving junction during invasion. PLOS Pathogens. 5 (2), 1000309 (2009).
- Gilmore, A. P., Romer, L. H. Inhibition of focal adhesion kinase (FAK) signaling in focal adhesions decreases cell motility and proliferation. Molecular Biology of the Cell. 7 (8), 1209-1224 (1996).
- Emerson, N. T., Hsia, C. -. H., Rafalska-Metcalf, I. U., Yang, H. Mechanodelivery of nanoparticles to the cytoplasm of living cells. Nanoscale. 6 (9), 4538-4543 (2014).
- Manders, E. M. M., Kimura, H., Cook, P. R. Direct imaging of DNA in living cells reveals the dynamics of chromosome formation. Journal of Cell Biology. 144 (5), 813-822 (1999).
- Memedula, S., Belmont, A. S. Sequential recruitment of HAT and SWI/SNF components to condensed chromatin by VP16. Current Biology. 13 (3), 241-246 (2003).
- Becker, T., Volchuk, A., Rothman, J. E. Differential use of endoplasmic reticulum membrane for phagocytosis in J774 macrophages. Proceedings of the National Academy of Sciences of the United States of America. 102 (11), 4022-4026 (2005).
- Molenaar, C., et al. Visualizing telomere dynamics in living mammalian cells using PNA probes. The EMBO Journal. 22 (24), 6631-6641 (2003).
- Jones, S. A., Shim, S. -. H., He, J., Zhuang, X. Fast, three-dimensional super-resolution imaging of live cells. Nature Methods. 8 (6), 499-505 (2011).
- Sabri, A., Xu, X., Krapf, W. M. Elucidating the origin of heterogeneous anomalous diffusion in the cytoplasm of mammalian cells. Physical Review Letters. 125 (5), 053901 (2020).
- Sato, Y., et al. Genetically encoded system to track histone modification in vivo. Scientific Reports. 3, 2436 (2013).
- Sato, Y., Stasevich, T. J., Kimura, H. Visualizing the dynamics of inactive X chromosomes in living cells using antibody-based fluorescent probes. X-Chromosome Inactivation. Methods in Molecular Biology. 1861, 91-102 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유