需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
果蝇卵母细胞的核迁移
摘要
在 果蝇中,卵母细胞核在形成过程中经历微管依赖性迁移。在这里,我们描述了一个协议,这是开发,以遵循迁移,通过执行现场成像的鸡蛋室 前vive。我们的程序保持卵室活12小时,以获得多位置3D延时电影使用旋转盘共聚焦显微镜。
摘要
活细胞成像对于了解调节细胞运动、细胞骨架重新排列或细胞内极性模式的细胞和分子机制尤为必要。在研究卵母细胞核定位时,实时成像技术对于捕捉这个过程的动态事件至关重要。 果蝇 卵室是一个多细胞结构和一个很好的模型系统来研究这种现象,因为它的大小和众多的遗传工具可用性。在 嗜血杆菌 中期生成期间,细胞核从卵母细胞内的中心位置迁移,采用由微管生成的力介导的不对称位置。这种细胞核的迁移和定位对于确定胚胎的极性轴和随后的成年苍蝇是必要的。这种迁移的一个特点是,它发生在三个维度(3D),创造了一个活成像的必要性。因此,为了研究调节核迁移的机制,我们制定了一个培养解剖卵室的协议,并利用旋转盘共聚焦显微镜进行12小时的实时成像。总的来说,我们的条件使我们能够长期保存 果蝇 卵室,从而使核迁移的完成能够在大量3D样品中实现。
引言
几年来,嗜血性卵母细胞已成为研究核迁移的示范系统。嗜血性卵母细胞在称为卵室的多细胞结构中发育。卵室包括16个生殖细胞(15个护士细胞和卵母细胞),周围环绕着上皮层的卵泡体细胞。卵室发育被细分为14个阶段(图1A),在此期间卵母细胞将生长并积累胚胎早期发育所需的储备。在开发过程中,在微管重组和母体决定因素的不对称传输时,卵母细胞沿着前体和多鼻体轴两极分化。这些轴确定胚胎和成人的后续极性轴产生于这个卵母细胞1的受精。在形成过程中,细胞核在卵母细胞中采用不对称位置。在第6阶段,细胞核以细胞为中心。当卵母细胞接收到的后卵泡细胞发出的尚未识别的信号时,细胞核会在第7阶段(图1B)2、3阶段向前等离子体膜和横向等离子体膜之间的交叉处迁移。此不对称位置需要诱导多索-文特轴的确定。
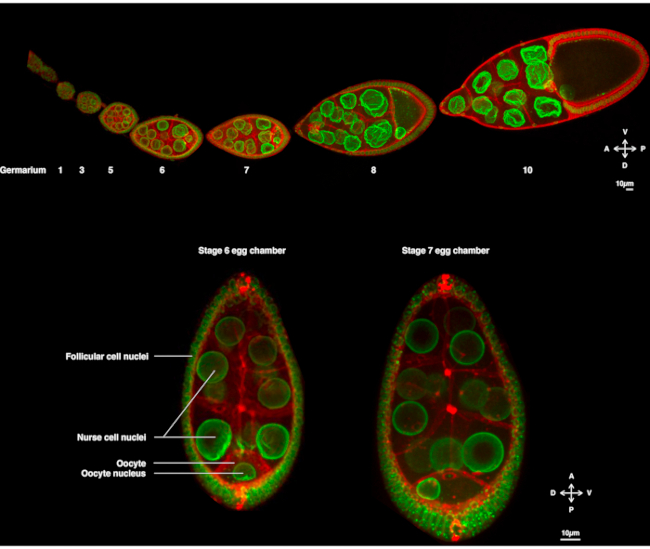
图1:果蝇黑色素加斯特卵室。(A) 转基因苍蝇的固定卵磷表示Fs(2)Ket-GFP,标记核信封和泛素-PH-RFP,标记等离子体膜。卵变由不同阶段的卵子室组成。成熟度沿着前后轴增加,前尖端(左)的天体和后尖的较旧阶段(右)。(B) 活蛋室的Z-投影,通过旋转盘共聚焦显微镜在卵母细胞的6级(左),其中细胞核以卵母细胞为中心。核将迁移到第7阶段(右)与前血浆膜(卵母细胞和护士细胞之间)和侧向血浆膜(卵母细胞和卵泡细胞之间)接触时采用不对称位置。此位置将诱导经侧的确定,从而诱导蛋室的圆周- 静脉轴。请单击此处查看此图的较大版本。
几十年来,这种核迁移一直通过免疫染色在固定组织上进行研究。这种方法显然证明这个过程依赖于一个密集的微管网络4,5。最近,我们开发了一个协议,提供条件兼容的活成像的卵母细胞在几个小时内,使有可能研究这个过程动态6。
因此,我们首次能够描述,细胞核在迁移过程中具有优先和特征轨迹,一个沿着前等离子膜(APM),另一个沿着卵母细胞的横向等离子膜(LPM)(图2)。这些最新成果强调了实时成像协议在研究核迁移等动态过程时的重要性。
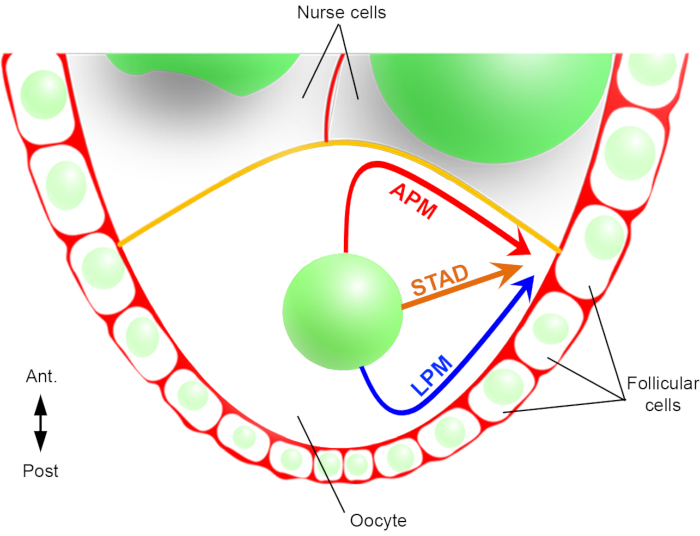
图2:细胞核不同迁移路径的示意图表示。在卵母细胞形成的第6阶段,卵母细胞是一个具有中央核的大细胞。在此阶段,前后极性轴设置与卵母细胞的后/横等离子膜接触卵泡细胞和前血浆膜(黄色)与护士细胞2接触。我们以前曾报告说,细胞核可以沿着前等离子膜(APM),沿着侧质等离子膜(LPM),或通过细胞质(STAD,直接迁移到前额皮层)6。请单击此处查看此图的较大版本。
卵母细胞核迁移是一种大约3h6的现象,到目前为止,触发实际迁移开始的事件还不得而知。用于研究这种机制的蛋白质突变体也会推迟迁移的开始。这些未知变量促使我们获得图像在很长一段时间内(10-12小时)。因此,确保卵母细胞存活是很重要的。随着蛋室的发展,它沿着前后轴从球形拉长到椭圆形。这种拉长是由卵泡细胞的旋转驱动的,卵泡细胞从第1阶段到第8阶段,垂直于前后轴7。此外,卵室周围还环绕着具有脉动特性肌肉的管状护套。其生理功能是将发育中的卵泡连续推向卵管8。为了限制解剖后诱导卵室振荡的运动,我们设计了一个高度为150微米的观测微室(图3A)。这个高度略高于10级和11级的卵泡大小。它大大限制了样品的垂直运动,同时保留了卵室的旋转,从而导致卵泡发育的有限缺陷。然后,我们使用旋转盘共聚焦显微镜对解剖的卵室进行 12 小时的实时成像。在这里,我们描述了我们研究第6阶段和第7阶段之间的卵母细胞核迁移的议定书。
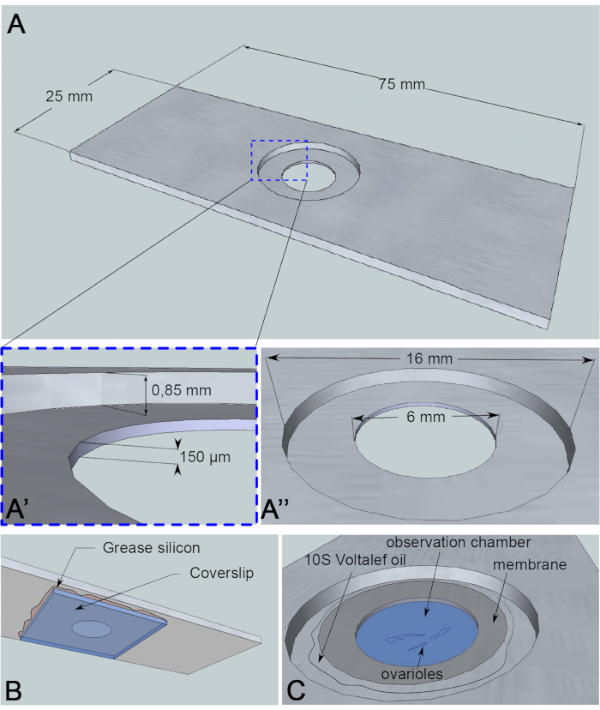
图3:观察室的示意图表示。(A) (上视图) 铝滑梯的精确尺寸与在滑梯中间钻的井的高度 (A') 和周长 (A') 。(B) (下视图) 封堵油井的盖片用硅润滑脂密封在滑梯上。(C) (上图) 解剖的卵巢在气体渗透膜覆盖的成像介质中发展。光环碳油用于稳定膜。请单击此处查看此图的较大版本。
为了跟踪核迁移并精确评估卵母细胞的轨迹,需要核包络和等离子体膜的标记。为此,选择了两个信号/噪声比高且不会在实时成像过程中褪色的转基因基因。为了标记等离子膜,建议使用 P[ubi-PH-RFP] 对人类磷脂酶C ∂(PLC∂1)的普莱克斯特林同源(PH)域进行编码。此 PH 域与沿卵母细胞9的等离子膜分布的磷酸二肽 PI (4,5)P2 结合。对于核包络 , P [ PPT - un1 ] Fs ( 2 ) Ket - GFP 蛋白陷阱菌株,其中 GFP 入编码的基因中 , Drosophila+ - 进口显示一个同质和强烈的信号10 。幼蝇(1-2天大)在卵巢解剖前被放置在含有干酵母24-48小时的新鲜小瓶中。
对于这种实时成像检测,一块1毫米厚的铝片,对样品没有反应,已被切成显微镜滑梯的尺寸。滑梯中央有一个直径为16毫米的孔,该孔已被反向到0.85毫米。这个计数器有一个直径为6毫米的孔,深度为150μm(图3A)。盖片粘在铝室底部的硅胶油脂(样品惰性)(图3B)。将样品放入中等填充井中后,将渗透到O2/CO2交换的膜放在中型油上,周围是卤化碳油(图3C)。
对于解剖,建议使用尖端尺寸为 0.05 x 0.02 mm 的不锈钢钳子和直径为 0.20 mm 的针头进行卵巢分离(图 4B,C)。迁移核在装有摄像头的旋转盘反向显微镜 CSU-X1 上成像。在 24 °C 下每 15 分钟通过延时获取多位置图像。 15 分钟的间隔允许进行多位置采集,对荧光蛋白的光照漂烁有限,并且样品的光毒性有限。此外,较短的间隔不会提供更多的信息数据来跟踪核轨迹。电影是通过斐济软件11处理和分析。
研究方案
1. 成像介质制备
- 在使用当天准备新的媒体。皮佩特 200 μL 施耐德介质 (含 L-麸质胺和 0.40 g/L 的 NaHCO3 辅以 10% 热灭活胎儿小腿血清, 100 U/mL 青霉素, 和 100 毫克/毫升链霉素).
- 补充 30 μL 胰岛素 10 毫克/毫升。
- 加入4微升热灭活胎儿小腿血清。
2. 观察室准备
- 使用移液器尖端,在穿刺滑梯底部的孔周围涂抹少量硅胶润滑脂(图 4D)。
- 放置 24 x 50 mm 的覆盖唇,厚度为 0.13-0.16 mm。
- 使用移液器尖端的宽端,对盖唇施加压力,将硅胶压平,以密封盖片,并在滑梯上形成硅胶环内部(图 4F,G)。
3. 卵巢解剖
- 在 CO2 垫上麻醉所需表型的雌性苍蝇。
- 将女性在150微升的成像介质中移植到解剖井中(图4H)。
- 用钳子抓住一个女性的胸腔,用第二对钳子捏住腹角质层。
- 分离和分离对卵巢,这应该很容易看到角质层打开。
- 小心切除子宫、卵管和肌肉护套(图4I)。
- 放置10-15μL的成像介质,并在成像室中转移一个卵巢(图4J,K)。
4. 鸡蛋室隔离
- 要分离卵巢,用针头握住卵巢的后端(朝向较旧的阶段)。用另一根针小心地拉着天葵,把卵巢分开。
- 取出蛋室上剩余的肌肉护套;一根针拿着护套,另一根针穿过较大的房间(第9阶段或更长的阶段)。
- 让未护套的奥瓦里奥尔下沉并接触盖唇。
- 在钳子的帮助下,将晚期和卵巢的其他部分从显微室中取出。小心地用针头将卵巢与其他小血管距离,以方便获取(图4L)。
5. 观察室关闭
- 切一小块(10×10毫米)的渗透膜(图4M,N)。
- 小心地将膜涂在成像介质上以排出任何气泡(图4O)。
- 在膜轮廓上,在油井周围用一层薄薄的卤化碳油密封腔室(图4P,Q)。
6. 成像
- 使用 40 倍目标(HCX PL Apo,1.25NA,油浸入)将成像设置放在倒置显微镜的滑动支架上。
- 定位和保存核准备迁移的不同阶段 6 卵母细胞的位置。
- 设置 488 和 561 nm 激光器。测量输出的激光功率为150mW,分别使用30%的激光功率和300ms和500ms的曝光。
- 设置实验。以12小时为间隔,间隔为15分钟-41节,间隔为1微米,以核为中心。
注:根据上述曝光时间,此设置允许在 45 s 左右获得一个位置。由于位置更改导致延迟,建议在这些条件下设置最多 12 个职位。
7. 图像分析
- 使用插入式正交视图处理软件斐济上的电影,并手动跟踪原子核。

图4:一步一步的微室安装图片。 (A,B,C)准备所需的工具:解剖井板、钳子、针头、成像介质、硅润滑脂、透水膜和铝滑梯。(D) 用移液器尖端在铝滑梯背面涂上硅润滑脂。(E) 玻璃盖唇粘在硅润滑脂上,以创建腔室底部。(F,G)在盖唇上施加压力,用移液器尖端的宽四肢在腔室内创建一个关节。(H,I)成像介质中苍蝇卵巢的解剖。(J) 在微室中滴入一滴成像介质。(K, L)用针头分离微室中的卵巢。(M,N,O)渗透膜切成10×10毫米的正方形,并放置在微室的介质下降。(P,Q)用卤化碳油密封微型室。样品已准备好成像。 请单击此处查看此图的较大版本。
结果
在迁移之前,核是动态的,在定义为迁移前的期间围绕中心位置振荡。这些小动作反映了在卵母细胞中间保持平衡的推拉力的平衡。通过量化核的轨迹,我们已经表明,APM和LPM轨迹具有类似的比例。我们通过细胞核与等离子膜6之间的第一次接触来定义轨迹的性质。因此,核到达APM或LPM,然后沿着它滑动,达到其在两个等离子膜交叉口的最终位置(图5,
讨论
其他协议描述如何准备和培养果蝇卵室前活体活成像检测12,13。此协议的新颖性是使用使用空心铝滑梯、覆盖滑梯和 O2/CO 2渗透膜构建的成像室。此设置的主要优点是限制 Z 中的移动,而不会对样品施加压力。因此,卵母细胞仍然可以自由移动,这就是为什么首先,使用40倍的目标,第二,z堆栈沿40μm获得,而卵母细胞是大约20μm...
披露声明
作者声明没有相互竞争的利益。
致谢
我们非常感谢让-安托万·莱佩桑特和尼古拉斯·蒂索,他们最初开发了协议,并与我们分享了图3的一些图形元素。我们感谢范妮·罗兰-戈塞林,他拍摄了图4的照片。我们还感谢其他实验室成员的有益讨论,这些讨论有助于改进这项技术,纳撒尼尔·亨尼曼的评论帮助改进了这份手稿。我们感谢法国生物成像(ANR-10-INBS-04)成员雅克·莫诺德研究所的ImagoSeine核心设施。Maélys Loh 得到了法国研究部 (MESRI) 的博士奖学金的支持。安托万·吉切特和弗雷德·伯纳德得到了ARC(授予PJA20181208148)、癌症企业协会(2020年#221366授予Gefluc)和巴黎IdEx大学(ANR-18-IDEX-0001)的新兴赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24x50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 - 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 - 188 | Observation-chamber preparation |
参考文献
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891 (2009).
- Bernard, F., Lepesant, J. -. A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168 (2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Developmental Biology. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ' n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。