Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Drosophila Oosyte'de Nükleer Göç
Bu Makalede
Özet
Drosophila'da, oosit çekirdeği oogenez sırasında mikrotübül bağımlı göçe uğrar. Burada, yumurta odaları ex-vivo üzerinde canlı görüntüleme yaparak göçü takip etmek için geliştirilen bir protokolü açıklıyoruz. Prosedürümüz, iplik disk konfokal mikroskopi kullanarak çok konumlu 3D hızlandırılmış filmler elde etmek için yumurta odalarını 12 saat boyunca canlı tutar.
Özet
Canlı hücre görüntüleme, özellikle organel hareketleri, sitoskeleton yeniden düzenlemelerini veya hücre içindeki polarite desenlerini düzenleyen hücresel ve moleküler mekanizmaları anlamak için gereklidir. Oosit çekirdek konumlandırmasını incelerken, bu sürecin dinamik olaylarını yakalamak için canlı görüntüleme teknikleri gereklidir. Drosophila yumurta odası, çok hücreli bir yapıdır ve çok sayıda genetik aletin büyüklüğü ve mevcudiyeti nedeniyle bu fenomeni incelemek için mükemmel bir model sistemidir. Drosophila orta-oogenez sırasında çekirdek, mikrotübül tarafından oluşturulan kuvvetlerin aracılık ettiği asimetrik bir pozisyonu benimsemek için oosit içindeki merkezi bir konumdan göç eder. Çekirdeğin bu göçü ve konumlandırılması, embriyonun ve sonraki yetişkin sineğinin polarite eksenlerini belirlemek için gereklidir. Bu geçişin bir özelliği, canlı görüntüleme için bir gereklilik yaratan üç boyutta (3D) gerçekleşmesidir. Böylece, nükleer göçü düzenleyen mekanizmaları incelemek için, parçalanmış yumurta odalarını kültüre etmek ve iplik disk konfokal mikroskopi kullanarak zaman atlamalı alımlarla 12 saat boyunca canlı görüntüleme yapmak için bir protokol geliştirdik. Genel olarak, koşullarımız Drosophila yumurta odalarını uzun süre canlı tutmamıza izin verir, böylece nükleer göçün tamamlanmasının 3D olarak çok sayıda örnekte görselleştirilmesini sağlar.
Giriş
Birkaç yıldır, Drosophila oosit nükleer göçü incelemek için bir model sistem olarak ortaya çıkmıştır. Drosophila oosit yumurta odası adı verilen çok hücreli bir yapıda gelişir. Yumurta odaları, foliküler somatik hücrelerin epitel tabakası ile çevrili 16 mikrop hücresini (15 hemşire hücresi ve oosit) kapsar. Yumurta odası gelişimi, oositin büyüyeceği ve embriyonun erken gelişimi için gerekli rezervleri biriktireceği 14 aşamaya (Şekil 1A) ayrılmıştır. Gelişim sırasında, maternal determinantların mikrotübül reorganasyonu ve asimetrik taşınması üzerine, oosit antero-dorsal ve dorso-ventral eksenler boyunca polarize eder. Bu eksenler embriyonun ve yetişkinin bu oositin döllenmesinden kaynaklanan sonraki polarite eksenlerini belirler1. Oogenez sırasında çekirdek oositte asimetrik bir pozisyon benimsemiştir. Evre 6'da çekirdek hücrede ortalanır. Oosit tarafından alınan arka foliküler hücreler tarafından yayılan henüz tanımlanmış bir sinyal üzerine, çekirdek aşama 7'de ön ve lateral plazma membranları arasındaki kavşağa doğru göç eder (Şekil 1B)2,3. Bu asimetrik pozisyon, dorso-ventral eksenin belirlenmesini sağlamak için gereklidir.
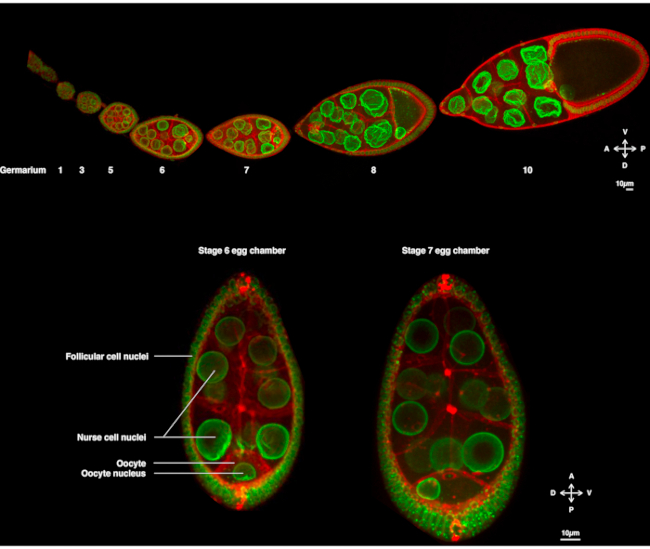
Şekil 1: Drosophila melanogaster yumurta odaları. (A) Plazma zarlarını etiketleyen nükleer zarfları ve ubi-PH-RFP'yi etiketleyen Fs(2)Ket-GFP'yi ifade eden transgenik sineklerden kaynaklanan yumurtalık düzeltildi. Yumurtalık, farklı aşamalarda gelişmekte olan yumurta odalarından oluşur. Olgunlaşma, mikrop kök hücresinin bulunduğu ön uçta (solda) germarium ve arka uçta (sağda) eski aşama ile antero-posterior eksen boyunca artar. (B) Çekirdeğin oositte ortaladığı oogenezin 6. Çekirdek, ön plazma zarı (oosit ve hemşire hücresi arasında) ve lateral plazma zarı (oosit ve foliküler hücreler arasında) ile temas halinde 7. Bu pozisyon, dorsal tarafın ve dolayısıyla yumurta odasının dorso-ventral ekseninin belirlenmesine neden olacaktır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Uzun yıllar boyunca, bu nükleer göç immünostaining ile sabit dokular üzerinde çalışılmıştır. Bu yaklaşım özellikle bu sürecin yoğun bir mikrotübül ağına bağlı olduğunu göstermeyi mümkün kıldı4,5. Daha yakın zamanda, bu sürecin dinamik olarak incelenmesini mümkün hale getiren birkaç saat boyunca oosit canlı görüntüleme ile uyumlu koşullar sunan bir protokol geliştirdik6.
Bu nedenle, ilk kez, çekirdeğin göçü sırasında, biri ön plazma membranı (APM) ve diğeri oosit lateral plazma membranı (LPM) boyunca tercihli ve karakteristik yörüngelere sahip olduğunu tanımlayabildik (Şekil 2). Bu son sonuçlar, nükleer göç gibi dinamik süreçleri incelerken canlı görüntüleme protokollerinin öneminin altını çiziyor.
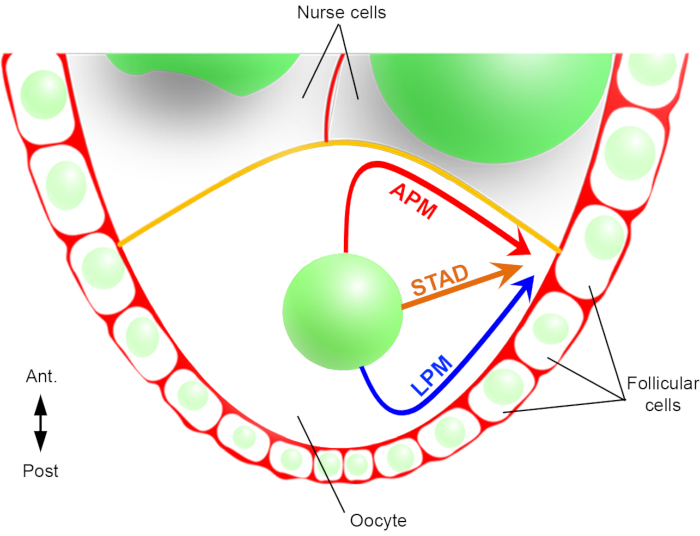
Şekil 2: Çekirdeğin farklı geçiş yollarının şematik gösterimi. Oogenezin 6. Bu aşamada, antero-arka polarite ekseni foliküler hücrelerle temas eden oositin arka/lateral plazma zarı ile ayarlanır ve ön plazma zarı (sarı) hemşire hücreleri ile temas halindedir2. Çekirdeğin ön plazma zarı (APM), lateral plazma zarı (LPM) boyunca veya sitoplazma (STAD, doğrudan antero-dorsal korteks)6boyunca göç edebileceğini daha önce bildirmiştik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Oosit çekirdek göçü yaklaşık 3 h6fenomenidir ve şimdiye kadar gerçek geçişin başlangıcını tetikleyen olay bilinmemektedir. Göçün başlangıcı, bu mekanizmayı incelemek için kullanılan protein mutantları tarafından da geciktirilebilir. Bu bilinmeyen değişkenler bizi uzun zaman dilimlerinde (10-12 saat) görüntü almaya motive etti. Bu nedenle, oositlerin hayatta kalmasını sağlamak önemlidir. Yumurta odası geliştikçe, antero-posterior eksen boyunca küresel bir şekilde eliptik bir şekle geçer. Bu uzama,1. Ek olarak, pulsatile özelliğine sahip tübüler bir kas kılıfası yumurta odalarını çevreler. Fizyolojik işlevi, gelişmekte olan folikülleri sürekli olarak yumurta kanalına doğru itmektir8. Yumurta odalarının diseksiyondan sonra salınımlarını teşvik eden hareketleri sınırlamak için, yüksekliği 150 μm olan bir gözlem mikro odası tasarladık (Şekil 3A). Bu yükseklik, 10 ve 11. Yumurta odasının dönüşünü korurken numunenin dikey hareketlerini önemli ölçüde sınırlar, böylece folikül gelişiminde sınırlı kusurlara neden olur. Daha sonra eğirme diski konfokal mikroskobu kullanarak çok konumlu zaman atlamalı alımlarla parçalanmış yumurta odalarında 12 saat boyunca canlı görüntüleme gerçekleştiriyoruz. Burada 6 ve 7.
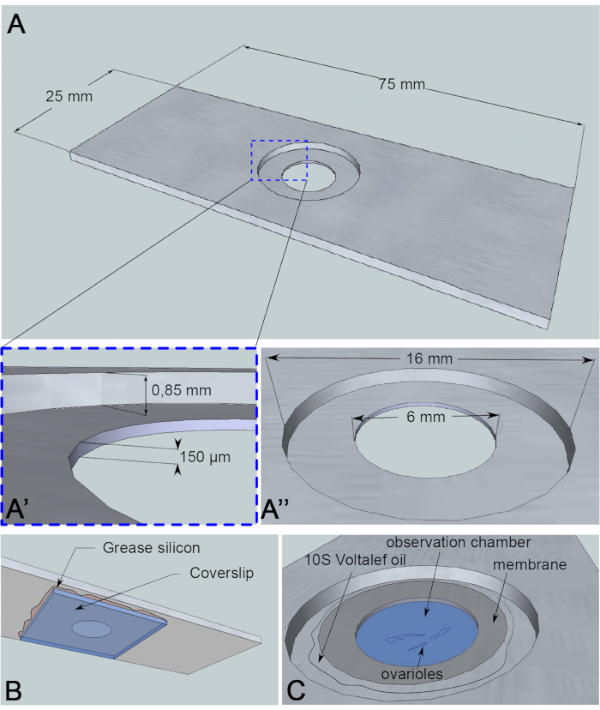
Şekil 3: Gözlem odasının şematik gösterimi. (A) (Üst görünüm) Alüminyum kaydırağın hassas boyutları, slaydın ortasında açılan kuyunun yükseklikleri (A') ve çevresi (A'') ile. (B) (Alt görünüm) Kuyuyu tıkayan bir kapak kapağı silikon gresle kaydırağa kapatılır. (C) (Üst görüş) Diseksiyonlu ovarioles, gaz geçirgen bir membranla kaplı bir görüntüleme ortamında gelişir. Halokarbon yağı zarı stabilize etmek için kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Nükleer göçü takip etmek ve oositteki yörüngeleri hassas bir şekilde değerlendirmek için hem nükleer zarf hem de plazma zarı için işaretleyicilere ihtiyaç vardır. Bu amaçla, sinyal/gürültü oranı yüksek olan ve canlı görüntüleme boyunca solmayan iki transgene seçilmiştir. Plazma membranını etiketlemek için, RFP ile kaynaşmış İnsan Fosfolipaz C ∂1'in (PLC∂1) Pleckstrin Homology (PH) etki alanını kodlayan bir P[ubi-PH-RFP] kullanılması önerilir. Bu PH etki alanı, oosit9'unplazma zarı boyunca dağıtılan fosfoinositid PI(4,5)P2'ye bağlanır. Nükleer zarf için, P[PPT-un1]Fs(2)GFP'nin Drosophila ß-importin'i kodlayan gen içine yerleştirildiği Ket-GFP protein kapanı suşu homojen ve yoğun bir sinyalgörüntüler 10. Genç sinekler (1-2 günlük) yumurtalık diseksiyonu öncesinde 24-48 saat kuru maya içeren taze şişelere yerleştirilir.
Bu canlı görüntüleme tahlil için, numune için tepkisel olmayan 1 mm kalınlığında bir alüminyum parçası, bir mikroskopi kaydırağı boyutlarına kesilmiştir. Slaytın ortasında 0,85 mm'ye karşı kontrabordlanmış 16 mm çapında bir deliğe sahiptir. Bu karşıbore, 150 μm derinliğe sahip ek bir 6 mm çapında deliğe sahiptir (Şekil 3A). Alüminyum haznenin alt kısmına silikon gres (numune için atıl) ile bir kapak saplanır(Şekil 3B). Numuneleri orta dolgulu kuyuya yerleştirdikten sonra, O2/CO2 değişimine geçirgen bir membran ortamın üzerine yerleştirilir ve halokarbon yağı ile çevrilidir (Şekil 3C).
Diseksiyon için, 0,05 x 0,02 mm uç boyutuna sahip paslanmaz çelik forseps ve yumurtalıkların ayrılması için 0,20 mm çapında iğneler kullanılması önerilir (Şekil 4B,C). Göç eden çekirdek, bir kamera ile donatılmış dönen disk konfokal ters mikroskop CSU-X1 üzerinde görüntülenir. Çok konumlu görüntüler, 24 °C'de her 15 dakikada bir zaman atlamalı olarak elde edildi. 15 dakikalık bir aralık, floresan proteinlerin sınırlı fotobleachingi ve numuneler için fototoksiklik ile çok pozisyonlu alımların gerçekleştirilmesini sağlar. Ayrıca, daha kısa bir aralık nükleer yörüngeleri takip etmek için çok daha bilgilendirici veriler sağlamaz. Filmler Fiji yazılımı11 aracılığıyla işlenir ve analiz edilir.
Protokol
1. Görüntüleme ortamı hazırlığı
- Kullanım gününde taze medya hazırlayın. Pipet 200 μL Schneider ortamı (L-Glutamin ve 0.40 g/L NaHCO3 içeren% 10 ısı inaktive fetal baldır serumu, 100 U / mL penisilin ve 100 mg / mL streptomisin ile tamamlanır).
- 30 μL insülin ile takviye 10 mg / mL.
- 4 μL ısı inaktive fetal baldır serumu ekleyin.
2. Gözlem odası hazırlığı
- Pipet ucu ile delinmiş slaydın alt tarafındaki deliğin etrafına az miktarda silikon gres uygulayın(Şekil 4D).
- 0,13-0,16 mm kalınlığında 24 x 50 mm kapak kılıfı yerleştirin.
- Bir pipet ucunun geniş ucuyla, kapak ucunu kapatmak ve slayda silikon halka iç oluşturmak için silikonu düzleştirmek için kapak ucuna basınç uygulayın (Şekil 4F,G).
3. Yumurtalık diseksiyonu
- Bir CO2 pedinde istenen fenotipin dişi bir sineğini uyuşturun.
- Dişi görüntüleme ortamının 150 μL'sinde bir diseksiyon kuyusuna aktarın (Şekil 4H).
- Toraksını topsla kaparak ve dorsal karın manikülünü ikinci bir çift tostikülle sıkıştırarak bir dişi açın.
- Manikür açıklığı sırasında kolayca görülebilecek yumurtalık çiftini izole edin ve ayırın.
- Uterus, oviduct ve kas kılımını dikkatlice çıkarın (Şekil 4I).
- Görüntüleme ortamının 10-15 μL'lik bir damlasını yerleştirin ve görüntüleme odasına bir yumurtalık aktarın (Şekil 4J,K).
4. Yumurta odası izolasyonu
- Yumurtalıkları ayırmak için, yumurtalığın arka ucunun (eski aşamalara doğru) iğneyle tutun. Başka bir iğne ile germarium dikkatlice çekerek yumurtalıkları ayırın.
- Yumurta odalarında kalan kas kılımını çıkarın; bir iğne kılıdayı tutar ve diğeri daha büyük odalardan (aşama 9 veya daha büyük) yumurtalık çeker.
- Duyulmamış yumurta boylarının batmasına ve kapakla temas etmesine izin verin.
- Geç aşamaları ve yumurtalıkların geri kalanını, kümesler yardımıyla mikro odadan çıkarın. Kazanımı kolaylaştırmak için yumurtalıkları diğerlerinden iğnelerle dikkatlice uzaklaştırın (Şekil 4L).
5. Gözlem odası kapanışı
- Küçük bir kare (10 x 10 mm) geçirgen membran kesin (Şekil 4M,N).
- Herhangi bir hava kabarcığı çıkarmak için membranı görüntüleme ortamının üzerine dikkatlice uygulayın (Şekil 4O).
- Membran konturu üzerindeki kuyunun etrafında ince bir halokarbon yağı tabakası ile odayı hermetik olarak kapatın(Şekil 4P,Q).
6. Görüntüleme
- Görüntüleme kurulumunu 40x amaç kullanarak ters mikroskobun slayt tutucusuna yerleştirin (HCX PL Apo, 1.25NA, yağ daldırma).
- Çekirdeğin göç etmeye hazır olduğu farklı aşama 6 oositlerin konumlarını bulun ve kaydedin.
- 488 ve 561 nm lazerleri kurun. 150 mW'lık ölçülen çıkış lazer gücü ile lazer gücünün %30'unu ve sırasıyla 300 ms ve 500 ms pozlama kullanın.
- Deneyi ayarla. Çekirdek üzerinde 1 μm ortalanmış 15 dk-41 bölüm aralığı ile 12 saat zaman atlamalı bir zaman aralığı alın.
NOT: Yukarıda açıklanan pozlama süresine göre, bu ayar yaklaşık 45 s'de bir pozisyon alınmasına izin verir. Pozisyon değiştirme nedeniyle bir gecikme olduğundan, bu koşullarda en fazla 12 pozisyon ayarlanız önerilir.
7. Görüntü analizi
- Yazılım Fiji'deki filmleri, eklenti Ortogonal görünümünü kullanarak işleyin ve çekirdeği manuel olarak izleyin.

Şekil 4: Adım adım mikro hazne montaj resimleri. (A,B,C) Gerekli aletlerin hazırlanması: iyi plaka, forseps, iğneler, görüntüleme ortamı, silikon gres, geçirgen membran ve alüminyum slayt. (D) Alüminyum kaydırağın arkasında silikon gresin pipet ucu ile uygulanması. (E) Odanın tabanını oluşturmak için silikon gres üzerine bir cam kapaklı yapıştırılır. (F,G) Odanın içinde bir eklem oluşturmak için pipet ucunun daha geniş ekstremitesi ile kapak ucuna basınç uygulaması. (H,I) Görüntüleme ortamındaki sinek yumurtalıklarının diseksiyonu. (J) Mikro bölmede bir damla görüntüleme medyasının pipetletlentir. (K,L) İğneler kullanılarak mikro bölmedeki yumurtalıkların ayrılması. (M,N,O) Geçirgen membran 10 x 10 mm kareye kesilir ve mikro haznedeki ortamın damlasının üzerine yerleştirilir. (P,Q) Mikro haznenin halokarbon yağı ile sızdırmazlık. Örnekler görüntülenmeye hazır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Göç öncesi, çekirdek dinamiktir ve göç öncesi olarak tanımlanan bir dönemde merkezi bir konum etrafında salınır. Bu küçük hareketler, oosit ortasında dengeyi koruyan itme ve çekme kuvvetleri dengesini yansıtır. Çekirdeklerin yörüngelerini ölçerek, APM ve LPM yörüngelerinin benzer oranlara sahip olduğunu gösterdik. Yörüngenin doğasını çekirdek ve plazma zarı arasındaki ilk temasla tanımlıyoruz6. Böylece, çekirdek, iki plazma zarının kesişimindeki son konum...
Tartışmalar
Diğer protokoller, Drosophila yumurta odalarının canlı görüntüleme için ex vivo'nun nasıl hazırlanacağını ve kültüre edilmesini açıklar12,13. Bu protokolün yeniliği, içi boş bir alüminyum kaydırak, bir kapak kılıfı ve bir O2/CO2 geçirgen membran kullanılarak inşa edilen bir görüntüleme odasının kullanılmasıdır. Bu kurulumun ana avantajı, numuneye baskı uygulamadan Z'deki hareketi sınırlamakt?...
Açıklamalar
Yazarlar rakip çıkarlar beyan etmemektedir.
Teşekkürler
Protokolü geliştiren ve Şekil 3'ün bazı grafik öğelerini bizimle paylaşan Jean-Antoine Lepesant ve Nicolas Tissot'a son derece minnettarız. Şekil 4'ün fotoğraflarını çeken Fanny Roland-Gosselin'e teşekkür ederiz. Ayrıca bu tekniğin iyileştirilmesine katkıda bulunan yararlı tartışmalar için diğer laboratuvar üyelerine ve bu makalenin geliştirilmesine yardımcı olan yorumları için Nathaniel Henneman'a teşekkür ederiz. Fransa-Biyoimaging (ANR-10-INBS-04) üyesi Jacques Monod Enstitüsü'nün ImagoSeine çekirdek tesisini kabul ediyoruz. Maëlys Loh, Fransa Araştırma Bakanlığı'ndan (MESRI) doktora bursu ile desteklenmektedir. Antoine Guichet ve Fred Bernard ARC (Grant PJA20181208148), Association des Entreprises contre le Cancer (Grant Gefluc 2020 #221366) ve IdEx Université de Paris'ten (ANR-18-IDEX-0001) emergence hibesi ile desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24x50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 - 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 - 188 | Observation-chamber preparation |
Referanslar
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891 (2009).
- Bernard, F., Lepesant, J. -. A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168 (2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Developmental Biology. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ' n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır