JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
드로소필라 오키테의 핵 이주
요약
Drosophila에서,oocyte 핵은 oogenesis 도중 microtubule 의존적인 이주를 겪습니다. 여기서, 우리는 계란 챔버 전 vivo에라이브 이미징을 수행하여 마이그레이션을 따라 개발 된 프로토콜을 설명합니다. 우리의 절차는 회전 디스크 공초점 현미경 검사를 사용하여 다중 위치 3D 타임 랩스 영화를 취득하기 위해 12 시간 동안 살아있는 계란 챔버를 유지합니다.
초록
살아있는 세포 화상 진찰은 세포 내의 세포 운동, 세포 골격 재배열, 또는 극성 패터닝을 통제하는 세포 및 분자 기계장치를 이해하기 위하여 특히 필요합니다. 난소 핵 포지셔닝을 연구할 때, 라이브 이미징 기술은 이 과정의 역동적인 사건을 포착하는 데 필수적입니다. Drosophila 계란 챔버는 다세포 구조와 수많은 유전 도구의 큰 크기와 가용성 때문에이 현상을 연구 하는 우수한 모델 시스템. Drosophila 중간 oogenesis 도중, 핵은 microtubule 생성한 힘에 의해 중재된 비대칭 위치를 채택하기 위하여 oocyte 내의 중앙 위치에서 이동합니다. 핵의 이 이동 및 위치는 태아의 극성 축과 후속 성인 비행을 결정하기 위하여 필요합니다. 이 마이그레이션의 한 가지 특징은 3차원(3D)으로 발생하여 라이브 이미징이 필요하다는 것입니다. 따라서, 핵 이동을 규제하는 메커니즘을 연구하기 위해, 우리는 해부 된 계란 챔버를 배양하고 회전 디스크 공초점 현미경 을 사용하여 시간 경과 취득에 의해 12 시간 동안 라이브 이미징을 수행하는 프로토콜을 개발했습니다. 전반적으로, 우리의 조건은 우리가 오랜 시간 동안 Drosophila 계란 챔버를 보존 할 수 있습니다, 따라서 3D의 샘플의 많은 수에서 시각화 할 핵 마이그레이션의 완료를 가능하게.
서문
몇 년 동안 드로소필라 오키테는 핵 이주를 연구하는 모델 시스템으로 부상했습니다. Drosophila oocyte는 계란 챔버에게 불린 다세포 구조물에서 발전합니다. 계란 챔버는 여포 체 세포의 상피 층으로 둘러싸인 16 개의 생식 세포 (15 명의 간호사 세포 및 난미세포)를 포함합니다. 계란 챔버 개발은 14 단계로 세분화되었습니다(그림 1A),그 동안 oocyte 성장하고 배아의 초기 개발에 필요한 매장량을 축적할 것이다. 개발 중, 현미경 재구성 및 모계 결정요인의 비대칭 수송시, 난소세포는 안테로-등대 및 등류 복부를 따라 편광한다. 이 축은 배아의 후속 극성 축과 이 난미1의수정에서 발생하는 성인을 결정한다. oogenesis 동안, 핵은 oocyte에 비대칭 위치를 채택합니다. 6단계에서, 핵은 세포에 중심을 두고 있다. 난십체에 의해 수신되는 후방 여포 세포에 의해 방출되는 신호를 아직 확인되지 않은 후, 핵은 7단계(도 1B)2,3단계에서전방 및 측면 혈장 막 사이의 교차를 향해 이동한다. 이러한 비대칭 위치는 등대-복부 축의 판정을 유도하기 위해 요구된다.
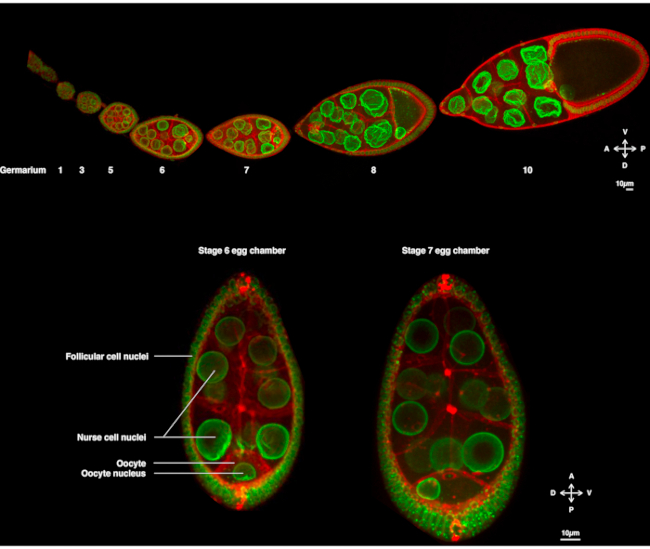
그림 1: 드로소필라 멜라노가스터 달걀 챔버. (A)핵 봉투와 플라즈마 멤브레인에 라벨을 붙이는 유비-PH-RFP를 표시하는 Fs(2)Ket-GFP를 발현하는 형질전환 파리로부터의 고정 된 오방. ovariole는 다른 단계에서 계란 챔버를 개발로 구성되어 있습니다. 성숙은 배아 줄기 세포가 상주하는 전방 팁(왼쪽)에서 발아마리움을 가진 전방 후방 축을 따라 증가하고 후방 끝(오른쪽)에서 구층이 증가합니다. (B)핵이 난낭을 중심으로 하는 oogenesis(왼쪽)의 6단계에서 디스크 공초점 현미경을 회전시킴으로써 살아있는 계란 챔버의 Z-프로젝션. 핵은 전방 플라즈마 멤브레인 (난소와 간호사 세포 사이)와 측면 혈장 막 (난낭과 여포 세포 사이)와 접촉하여 단계 7 (오른쪽)에서 비대칭 위치를 채택하기 위해 마이그레이션됩니다. 이러한 위치는 등쪽 측의 결단을 유도하고, 따라서 계란 챔버의 등복부 축을 유도할 것이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
수십 년 동안, 이 핵 이주는 면역 염색에 의하여 고정된 조직에 공부되었습니다. 이 접근 방식은 특히이 과정이 마이크로 튜블러4,5의조밀 한 네트워크에 따라 달라지는 것을 입증 할 수 있게했습니다. 최근에는 몇 시간 동안 난낭의 라이브 이미징과 호환되는 조건을 제공하는 프로토콜을 개발하여 이 과정을 동적으로6으로연구할 수 있게 되었습니다.
따라서, 처음으로, 우리는 핵이 이동 하는 동안 우대 및 특성 궤적을 설명할 수 있었다, 전방 플라즈마 멤브레인을 따라 하나 (APM) 및 oocyte의 측면 플라즈마 멤브레인을 따라 다른(그림 2). 이러한 최신 결과는 핵 마이그레이션과 같은 동적 프로세스를 연구할 때 실시간 이미징 프로토콜의 중요성을 강조합니다.
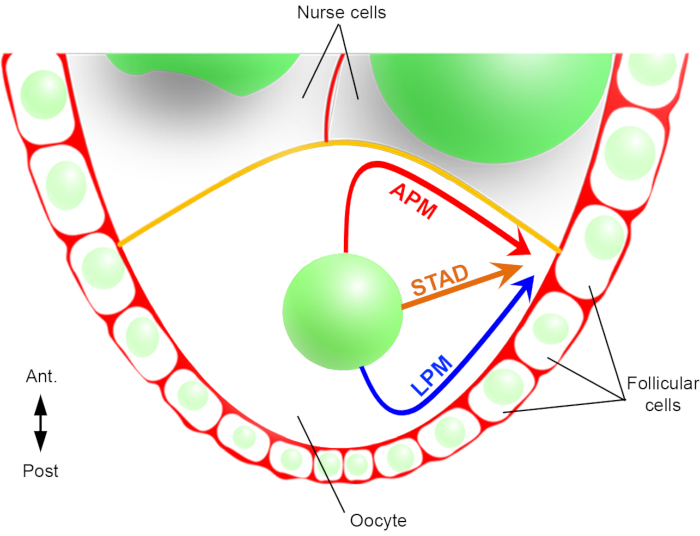
그림 2: 핵의 다른 이동 경로의 회로도 표현. oogenesis의 단계 6에서, oocyte는 중앙 핵을 가진 큰 세포입니다. 이 단계에서, 전방 후방 극성 축은 여포 세포와 접촉하여 난낭의 후방/측면 플라즈마 멤브레인으로 설정되고 전방 플라즈마 멤브레인(노란색)은 간호사 세포2와접촉한다. 우리는 이전에 핵이 전방 플라즈마 막 (APM)을 따라, 측면 혈장 막 (LPM)을 따라 또는 세포질 (STAD, 곧장 안테로-등쪽 피질)을 통해 이동할 수 있다고 보고했다6. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
난구 핵 이동은 약 3 h6의현상이며, 지금까지 실제 마이그레이션의 시작을 촉발시키는 이벤트는 알 수 없습니다. 이주의 시작은 또한 이 기계장치를 공부하는 데 이용된 단백질 돌연변이에 의해 연기될 수 있습니다. 이러한 알려지지 않은 변수는 오랜 기간(10-12h)에 걸쳐 이미지를 획득하도록 동기를 부여했습니다. 따라서 난모세포가 살아 있는지 확인하는 것이 중요합니다. 계란 챔버가 발전함에 따라 구형에서 타원형 모양으로 안테로 후방 축을 따라 길게 변합니다. 이러한 신장은 1단계에서 8단계로, 안후축7에수직으로 발생하는 여포 세포의 회전에 의해 구동된다. 또한, 맥동 특성이있는 근육의 관 칼집은 계란 챔버를 둘러싸고 있습니다. 그것의 생리적 기능은 지속적으로 oviduct를 향해 개발 여포를 밀어하는 것입니다 8. 해부 후 계란 챔버의 진동을 유발하는 움직임을 제한하기 위해 높이 150 μm을 측정하는 관측 마이크로 챔버(도 3A)를설계했습니다. 이 높이는 10단계와 11단계에서 여포의 크기보다 약간 높습니다. 계란 챔버의 회전을 유지하면서 시료의 수직 이동을 상당히 제한하여 여포 발달에 제한된 결함을 초래합니다. 그런 다음 회전 디스크 공초점 현미경을 사용하여 다중 위치 시간 경과 획득에 의해 해부 된 계란 챔버에 12 시간 동안 라이브 이미징을 수행합니다. 여기서 우리는 6단계와 7단계 사이의 난소핵 이주를 연구하기 위한 우리의 의정서를 설명합니다.
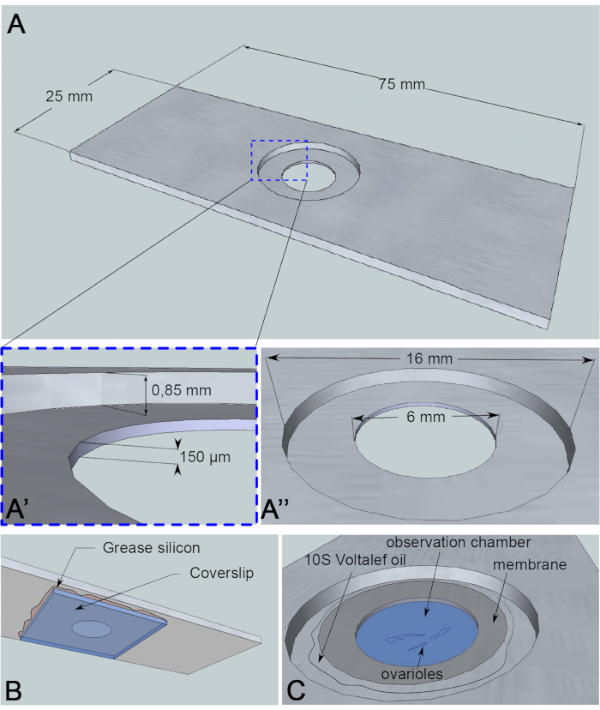
도 3: 관측실의 회로도 표현. (A)(상단 보기) 슬라이드 의 중간에 드릴웰의 높이 (A)와 둘레 (A')와 알루미늄 슬라이드의 정확한 치수. (B)(하단 뷰) 우물을 차단하는 커버슬립은 실리콘 그리스로 슬라이드에 밀봉된다. (C)(최고 보기) 해부 된 ovarioles는 가스 투과성 멤브레인에 의해 덮여 있는 화상 진찰 매체에서 개발한다. 할로카본 오일은 멤브레인을 안정화하는 데 사용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
핵 이주를 따르고 난마세포의 궤적을 정밀하게 평가하기 위해서는 핵 봉투와 플라즈마 멤브레인 모두에 대한 마커가 필요합니다. 이 목표를 가지고, 높은 신호 / 소음 비율을 가지고 라이브 이미징의 과정을 통해 퇴색하지 않는 두 개의 전간이 선택되었습니다. 플라즈마 멤브레인에 라벨을 붙이기 위해 RFP에 융합된 인간 인지질제 C ∂1(PLC∂1)의 Pleckstrin Homology(PH) 도메인을 인코딩하는 P[ubi-PH-RFP]를 사용하는 것이 좋습니다. 본 PH 도메인은난소9의혈장 막을 따라 분포된 인포이노시타이드 PI(4,5)P2에 결합한다. 핵 봉투의 경우, GFP가 Drosophila ß-importin을 인코딩하는 유전자 내에 GFP가 삽입되는 P[PPT-un1]Fs(2)는 동질적이고 강렬한신호(10)를표시한다. 어린 파리(1~2일)는 난소 해부 24-48h 전에 건조한 효모가 들어있는 신선한 유리병에 놓입니다.
이 라이브 이미징 분석의 경우, 시료에 대해 반응성이 없는 1mm 두께의 알루미늄 조각이 현미경 슬라이드의 치수로 절단되었습니다. 슬라이드 중앙에 16mm 직경의 구멍이 있어 0.85mm로 반소되어 있습니다. 이 카운터보어는 깊이가 150 μm(도3A)인추가 6mm 직경 구멍을 가지고 있습니다. 커버슬립은 알루미늄챔버(도 3B)의바닥에 실리콘 그리스(시료에 대한 불활성)로 접착된다. 샘플을 중간 채워진 우물에 배치한 후,O2/CO2교환에 투과가능한 멤브레인을 매체 위에 배치하고 할로카본 오일(도3C)에둘러싸여 있다.
해부에 대 한, 0.05 x 0.02 mm의 팁 치수를 가진 스테인레스 스틸 집게를 사용 하 여 하는 것이 좋습니다., 그리고 0.20 m m 직경 바늘 의 분리에 대 한(도 4B,C). 마이그레이션하는 핵은 카메라가 장착된 회전 디스크 공초점 반전 현미경 CSU-X1에 이미지됩니다. 다중 위치 이미지는 24°C에서 15분마다 타임랩트에 의해 획득되었다. 15분 간격을 통해 샘플에 대한 형광 단백질 및 광독성의 제한된 광표백으로 다중 위치 획득을 수행할 수 있습니다. 또한, 짧은 간격은 핵 궤적을 따르는 훨씬 더 유익한 데이터를 제공하지 않을 것입니다. 영화는 피지 소프트웨어(11)를 통해 처리및 분석됩니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 이미징 중간 준비
- 사용 당일 신선한 미디어를 준비하십시오. 슈나이더 배지의 파이펫 200 μL (L-글루타민과 0.40 g/L의 NaHCO3은 10% 열 불활성 태아 송아지 혈청, 페니실린 의 100 U/mL, 그리고 100 mg/mL의 연쇄상 구균)로 보완되었습니다.
- 인슐린 의 30 μL 와 보충 10 mg/mL.
- 열 불활성 태아 종아리 세럼 4 μL을 추가합니다.
2. 관측실 준비
- 파이펫 팁으로 천공슬라이드(도 4D)의아래쪽 구멍 주위에 소량의 실리콘 그리스를 발라주세요.
- 두께 0.13-0.16mm의 24 x 50mm 커버슬립을 배치합니다.
- 파이펫 팁의 넓은 끝으로 커버슬립을 밀봉하고슬라이드(도 4F,G)에실리콘 링 내부를 만들기 위해 실리콘을 평평하게 하기 위해 커버슬립에 압력을 가한다.
3. 난소 해부
- CO2 패드에서 원하는 표현형의 암컷 비행을 마취시화한다.
- 해부 우물에서 이미징 배지의 150 μL에서 여성을이송한다(도 4H).
- 포셉으로 흉부를 잡고 두 번째 포셉으로 등복부 큐티클을 꼬집어 한 여성을 엽니다.
- 큐티클 개구부 시 쉽게 볼 수 있는 난소 쌍을 분리하고 분리합니다.
- 자궁, 배기 및 근육 칼집(그림 4I)을조심스럽게 제거합니다.
- 이미징 배지의 10-15 μL 을 떨어 뜨리고 이미징 챔버에 난소 1개를 전달한다(도4J,K).
4. 달걀 챔버 격리
- 난소를 분리하려면 난소의 후방 끝을 바늘로 (이전 단계로) 잡습니다. 다른 바늘로 세균을 조심스럽게 잡아당겨 바오리올을 따로 떼어 놓습니다.
- 계란 챔버에 나머지 근육 칼집을 제거; 칼집을 들고 다른 하나는 큰 챔버를 통해 ovariole에 당기고 (단계 9 이상).
- 흔들리지 않는 오바리오레가 가라앉고 커버슬립에 연락하도록 허용합니다.
- 집게의 도움으로 미세 챔버에서 늦은 단계와 난소의 나머지 부분을 제거합니다. 조심스럽게 획득을 용이하게하기 위해 바늘로 다른 사람으로부터 혈관을 거리(도 4L).
5. 관측실 폐쇄
- 투과성 멤브레인의 작은 사각형(10 x 10mm)을 자른다(도4M,N).
- 어떤 기포(도 4O)를추방하기 위해 이미징 매체의 상단에 멤브레인을 신중하게 적용합니다.
- 밀폐막의 윤곽에 우물 주위에 할로카본 오일의 얇은 층으로 챔버를 밀봉(도 4P,Q).
6. 이미징
- 40배 목표(HCX PL 아포, 1.25NA, 오일 침수)를 사용하여 반전된 현미경의 슬라이드 홀더에 이미징 설정을 배치합니다.
- 핵이 마이그레이션할 준비가 된 다른 단계 6 난모세포의 위치를 찾아 저장합니다.
- 488 및 561 nm 레이저를 설정합니다. 150mW의 측정 된 출력 레이저 전력으로 레이저 전력의 30 %와 300 ms 및 500 ms 노출을 각각 사용합니다.
- 실험을 설정합니다. 핵을 중심으로 1 μm의 간격으로 15 분-41 섹션의 간격으로 12 h의 시간 경과를 취하십시오.
참고: 위에서 설명한 노출 시간에 따라 이 설정을 사용하면 약 45초에서 한 위치를 획득할 수 있습니다. 위치 변경으로 인해 지연이 있으므로 이러한 조건에서 최대 12개의 포지션을 설정하는 것이 좋습니다.
7. 이미지 분석
- 플러그인 직교 보기를 사용하여 소프트웨어 피지에서 영화를 처리하고 수동으로 핵을 추적합니다.

그림 4: 단계 마이크로 챔버 장착 사진. (A, B, C) 필요한 도구의 준비 : 잘 플레이트, 집게, 바늘, 이미징 매체, 실리콘 그리스, 투과 성 멤브레인 및 알루미늄 슬라이드를 해부. (D)파이펫 팁이 있는 알루미늄 슬라이드 뒷면의 실리콘 그리스를 적용합니다. (E)유리 커버슬립이 실리콘 그리스에 붙어 챔버의 바닥을 만듭니다. (F,G) 피펫 팁의 넓은 극단으로 커버슬립의 압력 적용으로 챔버 내부의 조인트를 만듭니다. (H,I) 이미징 미디어에서 플라이 난소의 해부. (J)마이크로 챔버에서 이미징 매체의 한 방울의 파이프팅. (K,L) 바늘을 사용하여 마이크로 챔버에서 혈관의 분리. (M,N,O) 투과성 멤브레인은 10 x 10mm 정사각형으로 절단하고 마이크로 챔버에서 배지의 방울 위에 배치합니다. (P,Q) 할로탄소 오일마이크로 챔버밀봉. 샘플을 이미지화할 준비가 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
마이그레이션하기 전에 핵은 동적이며 사전 마이그레이션으로 정의된 기간 동안 중앙 위치 주위의 진동이 발생합니다. 이 작은 움직임은 난모세포의 중간에 평형을 유지하는 밀고 당기는 힘의 균형을 반영한다. 핵의 궤적을 정량화함으로써, 우리는 APM과 LPM 궤적이 비슷한 비율을 가지고 있음을 보여 주었다. 우리는 핵과 혈장 멤브레인6사이의 첫 번째 접촉에 의해 궤적의 본질?...
Access restricted. Please log in or start a trial to view this content.
토론
다른 프로토콜은 실시간 이미징 분석12,13에대한 Drosophila 계란 챔버 전 vivo를 준비하고 문화하는 방법을 설명합니다. 이 프로토콜의 참신은 중공 알루미늄 슬라이드, 커버슬립 및 O2/CO2 투과성 멤브레인을 사용하여 생성된 이미징 챔버의 사용입니다. 이 셋업의 주요 장점은 샘플에 압력을 가하지 않고 Z의 움직임을 제한하는 것입니...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 경쟁 이익을 선언하지 않습니다.
감사의 말
우리는 원래 프로토콜을 개발하고 우리와 함께 그림 3의 몇 가지 그래픽 요소를 공유 장 앙투안 레페산트와 니콜라스 티소트에 매우 감사드립니다. 그림 4의 사진을 찍은 패니 롤랜드 고셀린에게 감사드립니다. 우리는 또한이 기술의 개량에 기여 도움이 토론에 기여한 다른 실험실 구성원과 이 원고를 개선하는 데 도움이 그의 의견에 대한 나다니엘 Henneman에 감사드립니다. 우리는 프랑스 바이오 이미징 (ANR-10-INBS-04)의 회원 인 자크 모노드 연구소의 이마고세인 핵심 시설을 인정합니다. Maëlys Loh는 프랑스 연구부(MESRI)의 박사 학위 펠로우십의 지원을 받고 있습니다. 앙투안 구이체와 프레드 버나드는 ARC (그랜트 PJA20181208148), 협회 데 엔트레프리즈 콘트레 르 암 (그랜트 게플루크 2020 #221366)과 IdEx Université 드 파리 (ANR-18-IDEX-0001)의 출현 보조금에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24x50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 - 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 - 188 | Observation-chamber preparation |
참고문헌
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891(2009).
- Bernard, F., Lepesant, J. -A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, Cambridge, England. 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168(2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Developmental Biology. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ' n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), New York, N.Y. 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유