需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
成纤维细胞衍生的人类工程结缔组织用于筛查应用
摘要
这里介绍的是一种方案,用于在具有双极的多孔板中为48个组织的平行培养生成工程结缔组织,适用于机制研究,疾病建模和筛选应用。该协议与来自不同器官和物种的成纤维细胞兼容,并且在这里以人类原发性心脏成纤维细胞为例。
摘要
成纤维细胞是表型高度动态的细胞,它们响应生化和生物力学刺激迅速转入肌成纤维细胞。目前对纤维化过程(包括心脏纤维化)的理解仍然很差,这阻碍了新的抗纤维化疗法的发展。可控和可靠的人体模型系统对于更好地了解纤维化病理学至关重要。这是一种高度可重复和可扩展的方案,可在48孔铸造板中生成工程结缔组织(ECT),以促进在3D(3D)环境中研究成纤维细胞和纤维化组织的病理生理学。ECT在极点周围产生,刚度可调,允许在定义的生物力学载荷下进行研究。在定义的负载条件下,可以研究由细胞 - 基质相互作用控制的表型适应性。并行测试在48孔格式中是可行的,并有机会对多个参数进行时程分析,例如组织压实和针对负载的收缩。从这些参数中,可以研究组织刚度和弹性等生物力学特性。
引言
纤维化疾病研究的一个主要障碍是缺乏具有代表性的人类3D组织模型,这些模型可以深入了解成纤维细胞及其病理衍生物的行为。为了研究纤维化过程,标准2D培养系统不是最佳的,因为分离的成纤维细胞在不合规的2D底物上培养时迅速转入α平滑肌肌动蛋白(SMA)表达肌成纤维细胞1,2,3。因此,标准2D培养物中的成纤维细胞不反映规则的"健康"组织表型3,4,5,6。在柔韧的底物上引入培养物以模拟非纤维化(10 kPa)和纤维化(35 kPa)组织环境7,但这些缺乏第三维度,这在病理生理学方面非常重要。组织工程提供了克服这一限制的机会,允许在定义且实验上可调的细胞外基质(ECM)环境中进行成纤维细胞培养,例如,通过细胞性,ECM组成和ECM浓度的改变,所有这些都可以确定组织生物力学。
使用成纤维细胞生成了各种3D模型。漂浮的圆盘和微球是最早的,并证明胶原蛋白以时间依赖的方式重塑和压实。成纤维细胞对胶原原纤维施加牵引力,这一过程可以通过添加促纤维化剂(例如转化生长因子-β1(TGF-β1))来促进。8,9,10,11,12,13,14,15,16.然而,自由漂浮的培养物不允许受控的外部载荷,因此构成连续收缩或压实模型。片状工程组织开辟了研究组织生物力学性质的稳态调节的可能性,即通过单,双轴,多轴或循环应变测试17,18,19,20.例如,这些模型已被用于证明细胞数量对组织刚度的影响,发现其与细胞骨架完整性和肌球蛋白细胞骨架收缩力呈正相关。18,19.然而,重要的是要注意,力到应变的转换由于力传感器和锚点的夹紧点周围的组织变形不均匀而变得复杂。这种固有的限制可以通过狗骨或环形组织绕过,在锚点提供一些组织执法21,22,23.环形组织可以通过将细胞胶原水凝胶分配到环形模具中来制备。当水凝胶致密时,在模具的不可压缩内棒周围形成组织,这为进一步的组织收缩提供了阻力24,25,26,27.在初始和通常最大压实后,组织也可以转移到可调节的垫片上,以进一步限制在定义的组织长度处的圆形ECT3,24,25,26,27,28,29,30.生物物理特性可以在标准水平或垂直应变应力设备中使用适当的称重传感器在单向或动态应变下进行评估3.由于组织具有大致均匀的圆形结构,并且可以保持在杆/钩(锚固点和/或力传感器)上,尽管这些可能仍将压缩区域封闭在加载杆周围,但与夹紧相比,这种格式允许更均匀的应变变化3.此外,锚定的组织引发双极细胞形状,并且细胞通过沿着促进各向异性牵引的力线伸长来适应组织力。31,32,33,34,35,36.我们以前在功能应激应变实验中将来自大鼠和人心脏成纤维细胞(CF)的环形ECT应用于单个刚性极点,并使用病毒转导成纤维细胞进行功能的获得和丧失研究24,25,26 和药理学研究37.此外,我们可以在ECT模型中识别CF介导的纤维化的性别差异。27.
以下用于生成人ECT的协议,以从商业供应商处获得的作为冷冻保存CF的初级人CF为例(见 材料表),将环形组织的优势与为48孔平台生产宏观组织的简单快速方法相结合,该平台设计用于并行高内涵测试。
重要的是,ECT模型不限于特定的成纤维细胞类型,并记录了用于研究其他成纤维细胞,例如皮肤成纤维细胞38,39。此外,来自患者活检的成纤维细胞同样有效,成纤维细胞的选择最终取决于要解决的科学问题。
该方案中描述的用于生成ECT的平台是市售的48孔3D细胞/组织培养板(图1A)。描述了在48孔板的帮助下,在定义的几何形状和机械载荷下制备,培养和监测ECT形成和功能的方法。成型的ECT由集成的柔性杆固定,机械载荷可以根据最终用途通过使用具有不同硬度的极(邵氏A值36-89)进行微调,从而影响其弯曲刚度。建议使用岸边 A 值为 46 的杆子。此外,该协议还与前面描述的定制圆形模具兼容,其中ECT围绕单个刚性杆37保持。该模具的尺寸如图 1B所示。
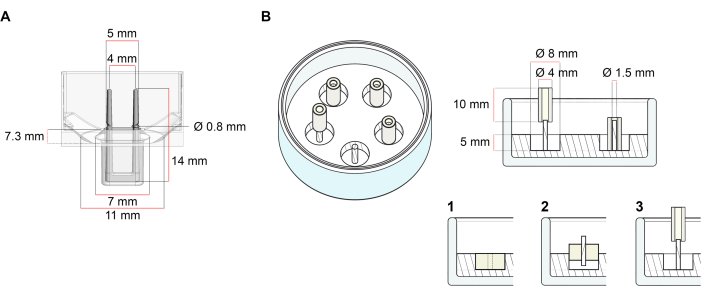
图1:铸造模具的示意图。 (A)具有两个柔性杆的铸造模具的技术图纸和尺寸。模具包括一个由短壁分隔的内周,该短壁在模具主体上固定双固定杆。柔性杆彼此之间具有自由的水平距离,并在底座处连接。该模具允许180 μL的浇注体积。每个模具的孔允许至少600μL培养基的体积容量。可以使用不同的材料成分来生产具有特定刚度的杆(例如,TM5MED-TM9MED)。(B)带有单个刚性杆的环形模具的技术图纸和尺寸。这是一种具有独特几何形状和机械环境的替代模具,可与ECT铸造协议一起使用37。环形模具装配方法改编自已发表的较大格式28,41。简而言之,该方法包括(1)将聚四氟乙烯(PTFE)模塑垫片(直径8毫米)倒入玻璃盘(直径60毫米)中的聚二甲基硅氧烷(PDMS,硅胶)中,以及(2)将PDMS杆架(直径1.5毫米)同心固定在形成的空腔内,其用于(3)保持可拆卸的极(直径4毫米硅胶管)。空心空间生成物允许180 μL的浇注体积。每个玻璃培养皿可以装入多个压印模具(例如,用5个模具显示),并且具有高达5 mL培养基的容量。 请点击此处查看此图的放大版本。
研究方案
所有步骤都必须在安装在1级防护等级下的实验室的II类生物安全罩中进行。根据当地法规和要执行的操作类型,例如病毒介导的基因转移,必须将收容水平提高到生物安全级别2或3。所有培养物在37°C下保持在37°C的细胞培养箱中,空气中有5%CO 2 的加湿气氛。请注意,为T75细胞培养瓶提供体积(步骤1和2)。根据标准细胞培养建议,将体积调整为不同的培养形式。
1. 解冻和预接种原发性心脏成纤维细胞(CF)用于单层培养(5-12天)
注意:作为替代方案,HFF-1细胞可以按照供应商建议的标准亚培养方案使用。
- 根据制造商的说明准备成纤维细胞生长培养基(FGM)。任选地,添加抗生素,如 100 U/mL 青霉素和 100 mg/mL 链霉素。使用前允许所有组件完全混合。在4°C下储存长达14天。
- 将女性生殖器切割温至20-25°C。
- 在37°C的水浴中解冻冷冻保存的CF(理想情况下,每个冷冻管含有1 x 106至2 x 106 / mL细胞)约2分钟,直到小瓶中仅留下少量冰。
- 使用2 mL血清学移液管,将细胞悬浮液滴入含有10 mL FGM的适当无菌离心管中。为了获得最佳的细胞检索,用1mL女性生殖器切割冲洗冷冻管并将其转移到离心管中。由于细胞在这个阶段非常敏感,因此使用带有孔头的血清学移液器重悬,以尽量减少剪切应力对细胞的损害。
注意:如果冷冻保存培养基含有高百分比的DMSO,请确保在FGM中细胞重悬后,DMSO含量小于1%。或者,在20-25°C下以300× g 离心重悬的细胞5分钟,用于培养基交换。然后,小心地吸出上清液,旋转管以移走沉淀的细胞,并将它们重悬在所需的FGM体积中以进行接种。 - 将0.5×10 6 个细胞接种在12mL女性生殖器切割中放入T75细胞培养瓶中。如果使用其他实验室器具,请调整细胞数量以保持6.7 x 103 / cm2的接种密度。
- 每隔一天更换一次女性生殖器切割,持续5天或直到细胞达到80%汇合度。
注意:扩增后的细胞产量主要取决于细胞大小和增殖速率,这可能因细胞供体而异。通常,该标准培养程序允许在培养5天后从T75细胞培养瓶中检索4 x 106至5 x 106 CF。
2. 人CF的酶分散(10-20分钟)
注意:本步骤旨在为亚培养单层细胞和ECT制备建立人CF的单细胞悬浮液。该方案已针对传代3-4中的人类CF单层培养物进行了优化。为了获得最佳标准化,建议在单层中对CF进行亚培养,至少在ECT制备前进行一次。该协议必须针对来自不同供体和供应商的成纤维细胞进行优化。替代的脱离方案可能涉及用例如含有蛋白水解酶和胶原蛋白溶解酶的试剂替换基于重组丝氨酸蛋白酶的解离试剂。
- 将女性生殖器切割,PBS(无Ca2 + / Mg 2 +-)和细胞解离试剂加热至20-25°C。
- 从培养的细胞中吸出培养基。
- 用6 mL PBS洗涤细胞并吸出。
- 向细胞中加入6mL细胞解离试剂,并在20-25°C下孵育3分钟,直到细胞开始明显分离。
注意:根据 CF 源,这可能需要几分钟的时间。或者,如果细胞在室温下不分离,则在37°C下孵育以提高酶的活性。为了确保最佳的细胞活力,请在显微镜下监测细胞脱离。 - 通过将6-12mL的FGM加入细胞解离试剂中的移位细胞来中和酶活性。使用10 mL血清学移液器轻轻地上下移液4-8次,以确保单细胞悬浮液并将细胞转移到新鲜的50 mL收集管中。根据制造商的说明,借助显微镜和血细胞计数器或自动细胞计数器验证产量。
- 在20-25°C下以300× g 离心细胞悬浮液5分钟。
注意:为了达到足以产生所需量ECT的细胞产量,可以在高达1:6的稀释液中对细胞进行亚培养,以进行进一步扩增。让细胞生长,直到达到80%的汇合度(约5-6天),培养基每隔一天更换一次。然后重复酶分散并继续步骤2.7。继续进行ECT准备。 - 吸出上清液并轻拂管以移走沉淀。在20-25°C下将细胞重悬于FGM中,以获得≥15 x 106 / mL的细胞悬浮液(比步骤3.3所需的细胞多约40%。)。这解释了在以下步骤中由于应变引起的细胞损失。
- 通过40μm网状细胞过滤器过滤细胞悬浮液。
注意:细胞附聚物不利于ECT的最佳形成。当使用人CF方案的酶分散直接铸造ECT时,过滤细胞悬浮液可确保没有干扰均匀组织形成的主要细胞团块。异质性将影响可靠的应力-应变分析。 - 重计数细胞数并评估细胞活力,以确保悬浮液中的细胞数量可靠,存活率为≥80%,以继续进行ECT制备。
- 使用自动细胞计数器通过排除电流来评估细胞数量和活力。
- 或者,在显微镜和血细胞计数器的帮助下,使用台盼蓝(致癌物,危害类别2 - 采取预防措施)染料排除测试,以直接鉴定和枚举活细胞(排除染料的完整细胞膜)和死细胞(允许染料与细胞内蛋白质结合的受损细胞膜)细胞。
- 将细胞悬浮液的收集管保留在20-25°C,并立即继续步骤3。
3. ECT准备(1小时)
注:ECT生成原理图如图 2所示。
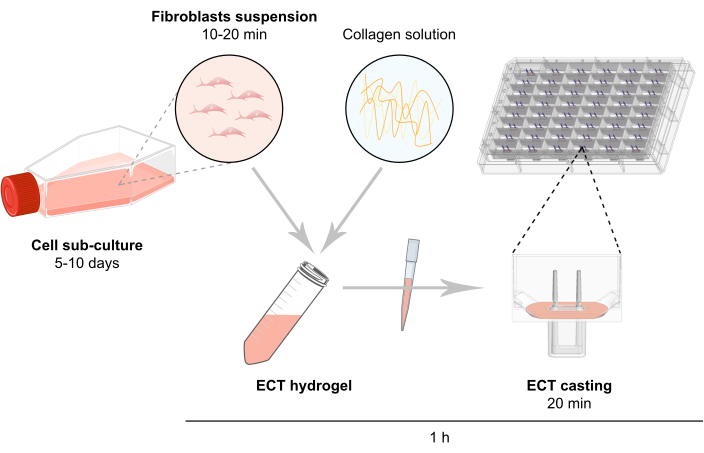
图2:ECT生成原理图。 成纤维细胞在用于ECT生成之前在2D培养物中扩增。5-10天后,酶分散细胞,并在含有1型牛胶原蛋白的缓冲混合物中重建细胞悬浮液。将细胞 - 胶原水凝胶混合物移液到48孔板中的单个孔中,用于3D工程组织培养,设计为具有两个柔性杆的铸造模具,以实现ECT悬浮在规定的长度和负载下。ECT 通常在测量前培养 1 至 20 天。 请点击此处查看此图的放大版本。
- 通过将DMEM粉末溶解在ddH2O(134mg / mL,用于 材料表中指定的配方)中,在37°C下恒定旋转1小时,制备10x DMEM储备溶液。通过过滤灭菌。该库存在4°C或-20°C下稳定长达14天,长达12个月。
- 通过稀释10x DMEM储备溶液并在无菌的ddH2O中加入20%(v / v)FCS来新鲜制备2x DMEM。可选地,使用抗生素,如200 U / mL青霉素和200 mg / mL链霉素。有关移液量,请参阅 表1 。该储备在4°C下稳定长达14天。
注意:执行步骤 3.1。和 3.2.在开始酶促分散细胞(步骤2)之前,用于制备ECT。
| 试剂 | 最终浓度 | 容积(毫升) |
| 10× DMEM | 不适用 | 2 |
| 富强鑫 | 20 % (v/v) | 2 |
| 盘尼西林 | 200 微升 | 0.2 |
| 链霉素 | 200毫克/毫升 | 0.2 |
| 二氧化硫 | 不适用 | 5.6 |
| 总 | 不适用 | 10 |
表1:2x DMEM的组成。
注意:使用前,细胞胶原水凝胶混合物和离心管的所有成分必须保存在冰上。这将有助于防止胶原蛋白自组装,然后再将细胞 - 胶原蛋白水凝胶混合物分布在整个铸造模具中。
- 根据表2,通过在20-25°C下向步骤2.10开始的细胞悬浮液中加入FGM,将细胞悬浮液调节至8.88×106个细胞/ mL的密度。然后,将带有细胞悬浮液的收集管移动到冰上。
- 为了制备ECT水凝胶混合物,将50 mL离心管预冷到冰上,并按以下顺序向其添加 表2 中列出的不同组分,避免气泡形成。
注意:要制备的最大ECT数量取决于步骤2.9中确定的总细胞数。每次ECT使用0.3毫克胶原蛋白,从含有6-7毫克/ mL的储备溶液中获得。胶原蛋白储备溶液的浓度决定了获得最佳ECT胶原蛋白含量所需的体积。其他ECT水凝胶组分的体积必须相应地进行调整。参见 表2 ,根据6.49mg / mL的胶原蛋白储备溶液调整体积。 表2 中描述的体积在本协议中用作示例性指南。- 使用具有宽孔径尖端的血清学移液器移液1型酸溶性胶原蛋白水凝胶。
- 通过加入2x DMEM来调整胶原蛋白溶液的盐含量,同时通过旋转管轻轻混合。
- 通过添加0.2 M NaOH来中和pH值,同时通过旋转管轻轻混合。酚红色指示灯将从黄色变为红色。
注意:必须针对每个单独的胶原蛋白批次调整 NaOH 体积,以获得最佳的 pH 中和。中和取决于缓冲液类型和制剂等因素,以及绝对胶原蛋白浓度,并且影响胶原基质组装和细胞活力23,40。一旦通过添加DMEM增加离子含量并且pH值被中和,胶原蛋白的自组装就会随之而来,并且不得被破坏。因此,请迅速执行以下操作,不要中断。 - 滴加细胞悬浮液(从步骤3.3开始),同时通过旋转管轻轻混合。
| ECT 编号: | 1 | 6 | 24 | 48 | |
| 包括 10 % 盈余 | |||||
| 细胞胶原水凝胶成分: | (μL) | (μL) | (μL) | (μL) | |
| 胶原蛋白储备(6.49毫克/毫升) | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 2× DMEM | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 0.2 毫诺 | 3.1 | 20.5 | 81.8 | 163.7 | |
| 女性生殖器切割中的细胞混合物(8.88×106 个细胞/毫升) | 84.5 | 557.4 | 2229.7 | 4459.5 | |
| 总体积(μL) | 180.0 | 1188.0 | 4752.0 | 9504.0 | |
| 这是一个示例性表,用于制备每个ECT的铸件体积为180μL,每个ECT总共含有750,000个细胞和0.3mg胶原蛋白。 | |||||
表2:ECT水凝胶的制备 (包括10%的盈余,导致移液错误)。
- 通过轻轻地上下移液一次,混合整个悬浮液,使用具有宽孔头的血清学移液器,以避免气泡形成并最大限度地减少剪切应力。通过轻轻旋转管子10次来确保完全混合,并在整个铸造过程中将含有ECT水凝胶混合物的50 mL离心管保持在冰上。
- 用ECT水凝胶混合物预湿1 mL移液器吸头,并将其180μL均匀分配到48孔浇注板的每个模具中,避免可能影响胶原基质组件完整性的过度剪切力,并确保整个板在15-20分钟内完成。
注:推荐的浇注体积为180 μL,但可延长至200 μL38。因此,当优选时, 表2 中的体积可以适应到200μL,以保持细胞和胶原蛋白之间相同的浓度和比例。- 确保在模具内形成完整的回路(图3A)。如果不连续地施用ECT水凝胶混合物,将防止完整的ECT环形成(图3B)。
- 避免移液到内孔(图3C)和移液过程中形成气泡(图3D),以确保均匀和功能性的组织形成。
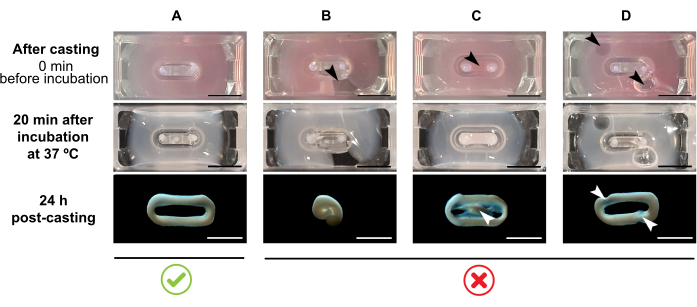
图 3:多孔形式的浇注、水凝胶形成和 ECT 缩合。 顶部面板直接体现了铸造后ECT的外观。中间面板表示在37°C下孵育20分钟后ECT的外观。 底部面板说明了准备后24小时ECT的压实状态,从两极中取出。(A)在前24小时内两极之间正确形成ECT(B-D)移液错误的例子,阻止了正确的ECT形成。白色和黑色箭头指出由于铸造不当导致ECT的结构缺陷。比例尺:5 毫米。 请单击此处查看此图的放大版本。
- 小心地将48孔浇注板置于细胞培养箱内,让ECT水凝胶混合物重建15-30分钟。孵育后,它将呈现凝胶状和不透明(图3,中间面板)。
- 每孔加入600μL37°C温热的FGM,无需将培养基直接移液到形成ECT上,因为这可能导致组织破坏。沿着井壁轻轻添加培养基,因为此时,ECT也不得从底部分离(图4)。
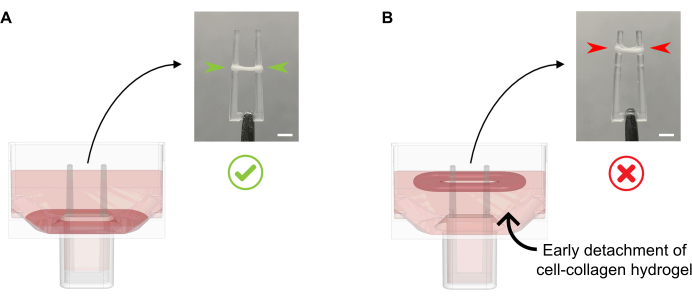
图4:将培养基正确和不恰当地添加到新鲜铸造的ECT中。 (A)在初始ECT凝固后(浇注后20分钟)加入培养基时,冷凝ECT必须不受干扰地留在井底。在接下来的24小时内,细胞驱动的基质压实将使ECT沿着斜坡滑动。最终的ECT位置由定义杆高的凹腔控制;这确保了所有ECT都稳定在同一位置,以便比较平行ECT培养物中的极弯曲活动。(B)形成ECT从底部分离,同时添加培养基的速度过快。浮动ECT将在上层培养基层压实。如果ECT在不同的位置稳定,则极收缩力将不具有直接可比性。比例尺:2 毫米。 请单击此处查看此图的放大版本。
- 孵育24小时。
- 此后每天用500μL女性生殖器切割替换培养基,直到分析。
注意:在细胞非依赖性凝胶化的初始阶段之后,人CF开始进一步压实ECT水凝胶混合物。在24小时内,ECT应明显压实并升高到将其保持在柔性杆上的水平(图3 和 图4A)。
4. 通过测量横截面积(CSA)评估ECT压实度(每个ECT5分钟)。
注意:组织压实在胶原蛋白组装后立即开始,在最初的几个小时内尤其重要。压实描述了主要由细胞驱动的压力垂直于组织的长轴的基质触发的变化。通过确定ECT的横截面积(CSA)来评估该参数。
- 在所需的时间点,使用体视显微镜记录ECT的顶部和侧面视图的宏观图像(图5C)。
注:ECT可在48孔浇注板的培养井内成像。或者,将ECT转移到透明底部多孔板中进行成像。建议对极点上的ECT进行成像,因为去除这些会导致预紧力的损失,因此,在短时间内,由于张力释放,组织可能会进一步收缩,最终扭转,这可能会妨碍尺寸分析的正确成像。 - 使用图像处理程序执行线阵扫描分析。设置刻度并使用 直线 工具在每个成像平面中每个臂至少6个位置处跟踪和测量ECT直径(图5B,C)。
- 计算顶视图平面和侧视图平面的平均直径,并根据椭圆面积方程计算 CSA:


图 5:通过横截面积 (CSA) 分析监测 ECT 压实随时间的变化。 使用人CF和I型胶原蛋白产生ECT,并在两个柔性极周围培养5天。(A)在5天内放置在柔性模具中的控制ECT的代表性图像。比例尺 = 5 毫米。这种明场图像也可用于确定极点偏转变化,以估计组织收缩。(B) ECT横截面积的示意图(绿色顶视图直径和粉红色侧视图直径)。(C)使用立体显微镜获得的ECT的俯视图和侧视图的宏观图像,以及使用图像处理程序对组织直径进行线扫描分析的相应示例。比例尺 = 2 毫米。平均直径是根据每个视图平面上测量的所有线长度的平均值计算得出的。 请点击此处查看此图的放大版本。
5. 通过极偏转分析监测ECT收缩(每48孔铸造板15分钟)。
注意:ECT 培养通常进行 5 天,但可进一步延长至少 20 天。极点偏转是由于细胞收缩力驱使的组织收缩沿组织的长轴向拉伸而发生的。ECT收缩的评估可以通过培养期间任何一天的影像学检查进行。
- 在记录设备下对48孔铸造板进行成像,该记录设备具有固定距离放置的集成面阵扫描相机,并配备了高分辨率(≥5百万像素)单色图像传感器。
- 使用近紫外(~390nm)光源来最大化对比度,从而便于自动检测两极的尖端,因为它们含有荧光染料(图6A,C)。如果可用,建议使用远心镜头进行成像,因为它们可以最大限度地减少图像失真。
注:或者,来自单个孔或整个板的宏观明场图像以及带有比例尺的明场图像可用于分析(图5A)。
- 使用近紫外(~390nm)光源来最大化对比度,从而便于自动检测两极的尖端,因为它们含有荧光染料(图6A,C)。如果可用,建议使用远心镜头进行成像,因为它们可以最大限度地减少图像失真。
- 使用图像处理程序测量每日记录(图6C,D)中的两极之间的距离,或者通过在能够检测黑暗背景上的高对比度明亮像素的软件上运行记录的图像进行自动分析。
- 通过与零日初始距离相比,通过极点距离的变化来计算极点偏转。
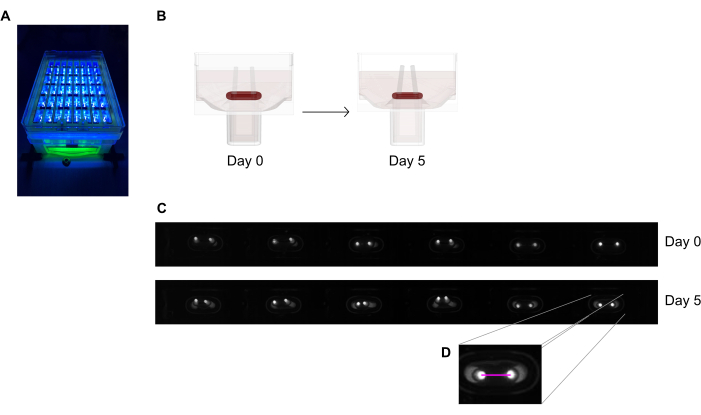
图6:根据极点偏转评估组织收缩的示意图 。(A)在近紫外光激发下,在48孔铸造板中对荧光极进行示例性的高分辨率记录。这种方法优于明场图像,可实现更精确的杆尖自动跟踪。(B)示意图展示了ECT压实和收缩如何导致极点弯曲。(C) 铸件后第0天和第5天同一印牌的范例行记录。 四. 特写显示了如何使用图像处理程序测量两极之间的距离(粉红色线)。 请点击此处查看此图的放大版本。
注意:请注意,通过明亮的尖端图像测量的极点偏转只是由于成像平面的差异而导致的组织收缩的估计值。另外,请注意,在组织培养过程中应用促纤维化物质(如TGF-β1)可增强ECT压实和收缩,并最终导致早期组织破坏。
6. 通过破坏性拉伸测量和应力-应变分析评估ECT的刚度和其他生物力学特性(每个ECT20分钟)
注意:最佳应力-应变曲线可以显示三个区域:脚趾区域、弹性区域和塑性区域。ECT应力-应变曲线示例如图 7所示。应力-应变曲线的分析允许提取组织的重要生物力学参数,例如刚度、最大强度、弹性、可塑性、延展性、弹性和韧性。
- 通过使用镊子首先将担架(包括ECT)从井中拉出来来收获ECT。然后可以将担架固定在其底座上,并使用细钩或移液器吸头将ECT滑过担架尖端。
- 将ECT转移到两个钩子上,夹紧在固定臂和拉伸动态机械分析(DMA)流变仪的传感器臂上,该流变仪配备了填充PBS的37°C回火器官浴(定制)(图7A)。
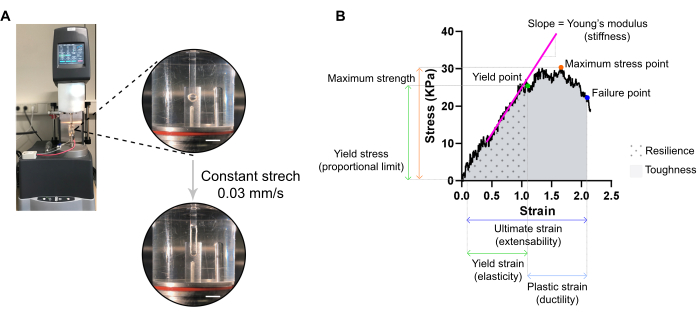
图7:ECT破坏性拉伸测量分析。 (A)在拉伸动态力学分析(DMA)流变仪上进行流变破坏性拉伸测量。高功率视图:ECT 安装在环境室中的 L0 处并连接到上极和下极以进行应力-应变分析。底部高功率视图:ECT应变以0.03 mm/s的恒定速率,直到故障点达到极限应变。比例尺 = 5 mm.(B)ECT的应力 - 应变图,显示主要测量参数。弹性区域的上限对应于屈服点,塑性区域由屈服点和失效点(延展性)组成。弹性区域线性相的斜率对应于反映组织刚度的杨氏模量。最大强度对应于组织可以承受的最大拉伸应力。由于纤维微断裂,应力减小,直到组织达到失效点。这发生在最终应变(可扩展性)时,由于组织的破裂,观察到应力突然下降。回弹性对应于组织在永久变形(直到屈服点)之前吸收的能量(kJ / m3),并由曲线下面积(AUC)给出,直到屈服点应变。韧性对应于组织可以吸收的总能量(kJ / m3),直到破裂,并由AUC给出,直到最终应变。 请点击此处查看此图的放大版本。
- 将流变仪设置为以恒定的线性速率施加单轴张力,该速率约为每秒钩之间初始距离的 1%。0.03 mm/s 的恒定拉伸速率可用于典型的 ECT 尺寸。去皮传感器,启动拉伸并记录直到ECT破裂。
注意:在拉伸试验之前,必须记录ECT的宏观图像(步骤4.1),因为数据归一化需要CSA。
注:应力-应变分析,包括 CSA 计算,可在拉伸试验后及时处理。使用电子表格软件和统计分析软件来分析数据。 - 通过 CSA (mm2) 对每个 ECT 的测量力值 (mN) 进行归一化,以获得应力值 (kPa)。
- 在 XY 图上绘制应力值与应变(由上钩和下钩之间的相对距离给出的组织变形的几何度量)。
注意:紧接拉伸前的组织初始长度(上钩和下钩之间的距离)L0必须手动调整,并且对应于脚趾区域的开始(根据组织特性,脚趾区域可以不存在)。每个应变点值必须根据等式计算,其中Ltotal 是每个测量点处的总间隙: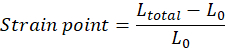
绘制数据时,使用所选 L0 处的应力值进行背景减法。 - 从应力-应变曲线中确定不同的生物力学参数(以 图7B 为例)。
注:应力-应变曲线可以显示三个区域:脚趾、弹性和塑性区域。在组织开始微断裂之前,弹性区域的上限对应于屈服点,其应变是组织弹性的量度。塑性区域由屈服点和失效点之间组成。后一点对应于由于组织破裂而导致的压力突然下降,定义了最终的染色,这是组织延伸性的量度。第三个测量点对应于最大强度,该强度由组织在拉伸过程中可以承受而不会断裂的最高应力定义。由曲线下的面积给出的弹性和韧性分别对应于组织吸收的能量,直到屈服点和失效点。对于获得的每条曲线,弹性区域线性部分的斜率对应于杨氏模量,也称为弹性模量,并且是测量组织刚度的机械性能。- 从每条曲线中提取屈服点、失效点和最大应力点的 XY 值(分别为应变和应力)。
- 通过绘制弹性区域线性回归的线性回归,评估每个ECT的杨氏模量(刚度,以kPa = mN·mm-2为单位)。
- 使用统计程序计算曲线下面积 (AUC),以确定弹性和韧性,直至屈服点和失效点。通过梯形方法计算 AUC。将基线设置为零,并仅考虑基线上方的峰值,这些峰值至少为 Y 轴中从最小值到最大值的距离的 10%。
注:回弹性和韧性的模量由σ× ε给出,其中σ为应力(kPa),ε为应变(L/ΔL,mm/mm)。因此,回弹性和韧性分别是组织在永久变形前和直至破裂前吸收的kJ/m3(kPa = kN·m-2 = kN·m·m-3 = kJ/m·m-3 = kJ/m3)的能量。
结果
与最初的细胞胶原水凝胶体积相比,ECT在前24小时内达到约95%的压实率。在控制条件下和存在食品接触物质的情况下,组织压实和收缩在铸造后数小时发生,并且明显增加至第5天(图5A)。在接下来的 15 天内,极点偏转可能会进一步增加(测试时间最长的时间为 20 天)。极点偏转的大小取决于细胞类型、细胞状态以及细胞和组织培养条件。通常,在培养的第5天测量生物力?...
讨论
所提出的方案描述了从原发性人CF产生ECT,这允许研究这些细胞对其细胞外基质环境的机械影响,反之亦然。
成纤维细胞需要扩增以产生足够的细胞用于计划的ECT实验(0.75×106 细胞/ ECT)。为了获得最佳的可重复性,建议在2D单层培养物中预培养冷冻或组织衍生的成纤维细胞,标准化持续时间高达80%,每次传代内以及将其用于ECT生成之前(方案步骤3)。为了培养原代?...
披露声明
GLS和SL起草了手稿。所有作者都为协议开发做出了贡献,并编辑了手稿。TM、MT 和 WHZ 是 myriamed GmbH 的科学顾问,WHZ 是 myriamed GmbH 的创始人和股东。
致谢
这项工作得到了德国心脏学会(GLS的DGK研究奖学金)和德国研究基金会(DFG通过GLS和AD的IRTG 1816项目;DFG 417880571和DFG TI 956/1-1用于MT;SFB 1002 TP C04 用于 MT 和 WHZ;SFB 1002 TP S01 用于 WHZ;和 EXC 2067/1-390729940J 用于 WHZ)。WHZ得到了德国联邦科学与教育部(BMBF通过IndiHEART项目)和Leducq基金会(20CVD04)的支持。MT,WHZ和SL由德国心血管研究中心(DZHK)提供支持。
材料
| Name | Company | Catalog Number | Comments |
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
参考文献
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force--Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。