Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Фибробласт, полученный из искусственной соединительной ткани человека для скрининга
В этой статье
Резюме
Здесь представлен протокол для генерации инженерных соединительных тканей для параллельной культуры из 48 тканей в многолуночной пластине с двойными полюсами, подходящей для механистических исследований, моделирования заболеваний и скрининговых приложений. Протокол совместим с фибробластами из разных органов и видов и иллюстрируется здесь с первичными сердечными фибробластами человека.
Аннотация
Фибробласты являются фенотипически высокодинамичными клетками, которые быстро трансформенцируются в миофибробласты в ответ на биохимические и биомеханические раздражители. Современное понимание фиброзных процессов, включая сердечный фиброз, остается плохим, что препятствует разработке новых антифиброзных методов лечения. Контролируемые и надежные модельные системы человека имеют решающее значение для лучшего понимания патологии фиброза. Это высоковоспроизводимый и масштабируемый протокол для генерации инженерных соединительных тканей (ЭСТ) в 48-луночной литейной пластине для облегчения исследований фибробластов и патофизиологии фиброзной ткани в 3-мерной (3D) среде. ЭСТ генерируются вокруг полюсов с перестраиваемой жесткостью, что позволяет проводить исследования при определенной биомеханической нагрузке. При определенных условиях нагрузки могут быть изучены фенотипические адаптации, контролируемые клеточно-матричными взаимодействиями. Параллельное тестирование возможно в формате 48 скважин с возможностью анализа времени и времени нескольких параметров, таких как уплотнение и сжатие тканей против нагрузки. Из этих параметров можно изучать биомеханические свойства, такие как жесткость и эластичность тканей.
Введение
Основным препятствием в изучении фиброзных заболеваний является отсутствие репрезентативных 3D-моделей тканей человека, которые дают представление о поведении фибробластов и их патологических производных. Для изучения фиброзных процессов стандартные системы 2D-культур являются неоптимальными, поскольку изолированные фибробласты быстро трансформенцируются в α гладкомышечные актины (СМА), экспрессирующие миофибробласты при культивировании на несоответствующих 2D-субстратах1,2,3. Таким образом, фибробласты в стандартной 2D культуре не отражают регулярный «здоровый» тканевый фенотип3,4,5,6. Культуры на гибких субстратах были введены для моделирования нефиброзной (10 кПа) и фиброзной (35 кПа) тканевой среды7, но им не хватает третьего измерения, что очень важно в отношении патофизиологии. Тканевая инженерия дает возможность преодолеть это ограничение, позволяя культивировать фибробласты в определенном и экспериментально перестраиваемом внеклеточном матриксе (ECM) -контексте, например, путем изменения клеточности, состава ECM и концентрации ECM, все из которых могут определять биомеханику ткани.
Различные 3D-модели были сгенерированы с использованием фибробластов. Плавающие диски и микросферы были одними из первых и демонстрируют, что коллаген ремоделируется и уплотняется в зависимости от времени. Фибробласты оказывают тракционные силы на коллагеновые фибриллы, процесс, который может быть облегчен добавлением профиброзных агентов, таких как трансформирующий фактор роста бета-1 (TGF-β1)8,9,10,11,12,13,14,15,16. Однако свободно плавающие культуры не допускают контролируемой внешней нагрузки и, следовательно, представляют собой непрерывно уменьшающиеся или уплотняющиеся модели. Листовидные инженерные ткани открыли возможность изучения гомеостатической регуляции биомеханических свойств тканей, а именно посредством одно-, би-, многоосевого или циклического тестирования деформаций17,18,19,20. Эти модели были использованы, например, для демонстрации влияния клеточного числа на жесткость тканей, которая, как было установлено, положительно коррелирует с целостностью цитоскелета и сократимостью цитоскелета актомиозина.18,19. Однако важно отметить, что превращения силы в деформацию осложняются неравномерной деформацией тканей вокруг точек зажима силовых преобразователей и опорных точек. Это внутреннее ограничение может быть обойдено собачьими костями или кольцеобразными тканями, предлагая некоторое укрепление тканей в опорных точках.21,22,23. Кольцеобразные ткани могут быть получены путем распределения клеточно-коллагенового гидрогеля в кольцеобразные формы. Когда гидрогель сжимается, вокруг несжимаемого внутреннего стержня формы образуется ткань, которая обеспечивает сопротивление дальнейшему сокращению ткани.24,25,26,27. После начального и, как правило, максимального уплотнения ткани также могут быть перенесены в регулируемые спейсеры для дальнейшего сдерживания круговой ЭСТ на определенной длине ткани.3,24,25,26,27,28,29,30. Биофизические свойства могут быть оценены в стандартных горизонтальных или вертикальных устройствах напряжения напряжения с соответствующими тензодатчиками при однонаправленной или динамической деформации3. Поскольку ткани имеют в значительной степени однородную круговую структуру и могут удерживаться на стержнях / крючках (точках крепления и / или преобразователях силы), хотя они все еще могут заключать области сжатия вокруг нагрузочных стержней, этот формат позволяет более равномерно варьировать деформацию по сравнению с зажимом.3. Кроме того, закрепленные ткани вызывают биполярную форму клеток, и клетки приспосабливаются к тканевым силам путем удлинения вдоль силовых линий, способствующих анизотропному вытяжению.31,32,33,34,35,36. Ранее мы применяли кольцеобразную ЭСТ от сердечных фибробластов крыс и человека (МВ) вокруг одного жесткого полюса в экспериментах с функциональным напряжением-деформацией и проводили исследования усиления и потери функции с использованием вирусно трансдуцированных фибробластов.24,25,26 и фармакологические исследования37. Кроме того, мы могли бы определить половые различия при муковисцидозе, опосредованном муковисцидозом, в модели ЭСТ.27.
Следующий протокол для генерации ЭСТ человека, примером которого является первичный человеческий муковисцидоз, полученный в виде криоконсервированного CF от коммерческих поставщиков (см. Таблицу материалов), сочетает в себе преимущества кольцеобразных тканей с простым и быстрым способом получения макроскопических тканей для 48-луночной платформы, предназначенной для параллельного тестирования с высоким содержанием.
Важно отметить, что модель ЭСТ не ограничена конкретным типом фибробластов, с документированным использованием в исследовании других фибробластов, например, фибробластов кожи38,39. Более того, фибробласты из биопсии пациента работают одинаково хорошо, и выбор фибробластов в конечном итоге зависит от научного вопроса, который необходимо решить.
Платформа, используемая для генерации ЭСТ, описанная в этом протоколе, представляет собой коммерчески доступную 48-луночную 3D-пластину для культивирования клеток/тканей (рисунок 1A). Описаны способы подготовки, культивирования и контроля образования и функционирования ЭСТ при заданной геометрии и механической нагрузке с помощью 48-луночной пластины. Сформированные ЭСТ удерживаются встроенными гибкими полюсами, и механическая нагрузка может быть точно настроена в соответствии с конечной целью с помощью полюсов с различной твердостью (значение Shore A 36-89), влияя на их жесткость изгиба. Рекомендуются столбы с берегом значения А 46. Протокол, кроме того, совместим с ранее описанной пользовательской круглой формой, где ЭСТ удерживается вокруг одного жесткого стержня37. Размеры этой формы приведены на рисунке 1B.
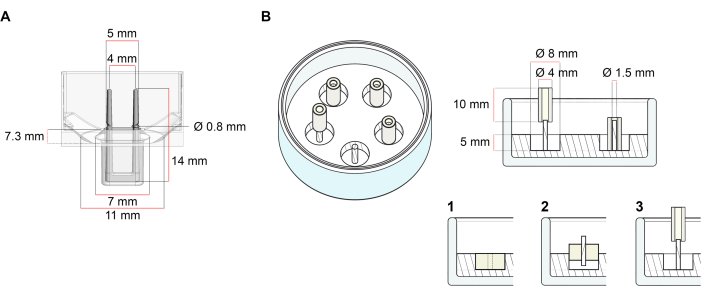
Рисунок 1: Схематическое изображение литейных форм. (A) Технический чертеж и размеры литейной формы с двумя гибкими полюсами. Форма содержит внутреннюю окружность, ограниченную короткой стенкой, которая удерживает двойные подпорные столбы в основном корпусе формы. Гибкие полюса имеют свободное горизонтальное расстояние друг от друга и соединены у основания. Пресс-форма допускает объем литья 180 мкл. Лунка каждой формы допускает объемную емкость не менее 600 мкл питательной среды. Различные композиции материалов могут быть использованы для получения столбов с определенной жесткостью (например, TM5MED-TM9MED). (B) Технический чертеж и размеры кольцеобразной формы с одним жестким стержнем. Это альтернативная форма с различной геометрией и механической средой, которая может использоваться с протоколом литья ECT37. Кольцеобразный метод сборки пресс-форм был адаптирован из опубликованных более крупных форматов28,41. Вкратце, способ включает в себя (1) импринтирование политетрафторэтиленовых (PTFE) формовочных распорок (диаметром 8 мм) в полидиметилсилоксане (PDMS, силикон), налитых в стеклянную посуду (диаметр 60 мм), и (2) фиксацию держателя полюса PDMS (диаметр 1,5 мм) концентрически внутри образовавшейся полой полости, которая служит для (3) удержания съемного полюса (силиконовая трубка диаметром 4 мм). Образовавшееся полое пространство позволяет увеличить объем литья 180 мкл. Каждая стеклянная тарелка может вмещать несколько отпечатанных форм (на примере с 5 формами) и имеет емкость до 5 мл питательной среды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Все шаги должны осуществляться в вытяжках биобезопасности класса II, установленных в лабораториях под уровнем локализации 1. В зависимости от местных правил и типа манипуляций, которые должны быть выполнены, таких как вирусно-опосредованный перенос генов, уровень сдерживания должен быть увеличен до уровня биобезопасности 2 или 3. Все культуры поддерживают при 37 °C в инкубаторе клеточных культур с увлажненной атмосферой 5% CO2 в воздухе. Обратите внимание, что объемы (шаги 1 и 2) предусмотрены для колбы для культуры клеток T75. Отрегулируйте объемы в соответствии с различными форматами культивирования в соответствии со стандартными рекомендациями по клеточным культурам.
1. Размораживание и предварительное покрытие первичного сердечного фибробласта (МВ) для однослойной культуры (5-12 дней)
ПРИМЕЧАНИЕ: В качестве альтернативы ячейки HFF-1 могут использоваться в соответствии со стандартным протоколом субкультуры в соответствии с рекомендациями поставщика.
- Подготовьте питательную среду фибробластов (FGM) в соответствии с инструкциями производителя. Необязательно добавляют антибиотики, такие как пенициллин 100 Ед/мл и стрептомицин 100 мг/мл. Обеспечьте полное смешивание всех компонентов перед использованием. Хранить при температуре 4 °C до 14 дней.
- Теплые калечащие операции на женских половых органах до 20-25 °C.
- Разморозьте криоконсервированный CF (в идеале содержащий от 1 x 106 до 2 x 106/мл клеток на криовиал) на водяной бане при 37 °C в течение примерно 2 мин, пока во флаконе не останется только небольшое количество льда.
- Используя серологическую пипетку объемом 2 мл, перенесите клеточную суспензию по каплям в соответствующую стерильную центрифужную трубку, содержащую 10 мл калечащих операций на женских половых органах. Для оптимального извлечения клеток промыть криовиаль 1 мл калечащих операций на женских половых органах и перенести ее в трубку центрифуги. Поскольку клетки очень чувствительны на этом этапе, повторное суспендирование с использованием серологической пипетки с наконечником отверстия, чтобы свести к минимуму повреждение клеток при сдвиговом напряжении.
ПРИМЕЧАНИЕ: Если криоконсервационная среда содержит высокий процент ДМСО, убедитесь, что после повторного суспендирования клеток при калечащих операциях на женских половых органах содержание ДМСО составляет менее 1 %. Альтернативно, центрифугируют повторно суспендированные ячейки при 300 х г в течение 5 мин при 20-25 °C для среднего обмена. Затем осторожно аспирируйте супернатант, закрутите трубку, чтобы выбить гранулированные клетки, и повторно суспендируйте их в нужном объеме калечащих операций на женских половых органах для посева. - Посейте 0,5 х 106 клеток в 12 мл калечащих операций на женских половых органах в колбу для культивирования клеток Т75. Если используется другое лабораторное оборудование, отрегулируйте количество ячеек, чтобы сохранить плотность посева 6,7 x 103/см2.
- Заменяйте калечащие операции на женских половых органах через день в течение 5 дней или до тех пор, пока клетки не достигнут 80% конфюлюзии.
ПРИМЕЧАНИЕ: Выход клеток после расширения зависит главным образом от размера клетки и скорости пролиферации, которые могут различаться между донорами клеток. Как правило, эта стандартная процедура культивирования позволяет извлекать от 4 x 106 до 5 x 106 CF из колбы для культивирования клеток T75 после 5 дней посева.
2. Ферментативная дисперсия муковисцидоза человека (10-20 мин)
ПРИМЕЧАНИЕ: Этот шаг направлен на создание одноклеточной суспензии человеческого муковисцидоза как для субкультурных монослойных клеток, так и для подготовки ЭСТ. Этот протокол был оптимизирован для монослойных культур муковисцидоза человека в отрывках 3-4. Для оптимальной стандартизации рекомендуется субкультирование CF в монослое, по крайней мере, один раз перед подготовкой ЭСТ. Этот протокол должен быть оптимизирован для фибробластов, происходящих от разных доноров и поставщиков. Альтернативные протоколы отслоения могут включать замену рекомбинантных реагентов диссоциации на основе серинпротеазы, например, теми, которые содержат протеолитические и коллагенолитические ферменты.
- Теплый FGM, PBS (Ca2+/Mg2+-free) и реагент диссоциации клеток до 20-25 °C.
- Аспирировать среду из культивируемых клеток.
- Промывайте ячейки 6 мл PBS и аспирата.
- Добавьте к клеткам 6 мл реагента диссоциации клеток и инкубируйте в течение 3 мин при 20-25 °C, пока клетки не начнут заметно отделяться.
ПРИМЕЧАНИЕ: В зависимости от источника CF это может занять на несколько минут больше. Альтернативно, если клетки не отделяются при комнатной температуре, инкубируют при 37 °C для улучшения активности ферментов. Чтобы обеспечить оптимальную жизнеспособность клеток, контролируйте отслоение клеток под микроскопом. - Нейтрализуют ферментативную активность путем добавления 6-12 мл калечащих операций на женских половых органах к смещенным клеткам в реагенте диссоциации клеток. Осторожно пипетку вверх и вниз 4-8 раз, используя серологическую пипетку 10 мл, чтобы обеспечить одноклеточную суспензию и перенести клетки в свежую 50 мл сборную трубку. Проверяйте выход с помощью микроскопа и гемоцитометра или автоматизированного счетчика клеток по инструкции производителя.
- Центрифугируют клеточную суспензию при 300 х г в течение 5 мин при 20-25 °С.
ПРИМЕЧАНИЕ: Чтобы достичь выхода клеток, достаточного для генерации желаемого количества ЭСТ, клетки могут быть субкультурированы в разведении до 1:6 для дальнейшего расширения. Дайте клеткам расти до тех пор, пока не будет достигнуто 80% сливание (примерно 5-6 дней), при этом среда меняется через день. Затем повторите ферментативную дисперсию и перейдите к шагу 2.7. продолжить подготовку к ЭСТ. - Аспирируйте супернатант и щелкните трубкой, чтобы выбить гранулу. Повторно суспендируют клетки при калечащих операциях на женских половых органах при 20-25 °C для получения клеточной суспензии ≥ 15 x 106/мл (приблизительно на 40 % больше клеток, чем требуется для стадии 3.3.). Это объясняет потерю клеток из-за напряжения на следующем этапе.
- Процедите клеточную суспензию через сетчатый клеточный сетчатый сетчатый фильтр 40 мкм.
ВНИМАНИЕ: Клеточные агломераты вредны для оптимального образования ЭСТ. При использовании ферментативной дисперсии человеческого протокола CF для прямого литья ЭСТ, процеживание клеточной суспензии обеспечивает отсутствие крупных клеточных сгустков, которые мешают образованию однородной ткани. Гетерогенности поставят под угрозу надежный анализ напряжения-деформации. - Пересчитать количество клеток и оценить жизнеспособность клеток для обеспечения надежного количества клеток в суспензии с ≥80% жизнеспособностью для продолжения подготовки ЭСТ.
- Используйте автоматический счетчик ячеек для оценки количества ячеек и жизнеспособности путем исключения электрического тока.
- В качестве альтернативы используют тест на исключение красителя трипана синего (канцероген, категория опасности 2 - принять меры предосторожности) с помощью микроскопа и гемоцитометра для прямой идентификации и перечисления живых (интактные клеточные мембраны, исключающие краситель) и мертвых (скомпрометированные клеточные мембраны, которые позволяют связывать краситель с внутриклеточными белками) клеток.
- Зарезервируйте всасывающую трубку с клеточной суспензией при 20-25 °C и немедленно перейдите к шагу 3.
3. Подготовка к ЭСТ (1 ч)
ПРИМЕЧАНИЕ: Схематический обзор генерации ЭСТ описан на рисунке 2.
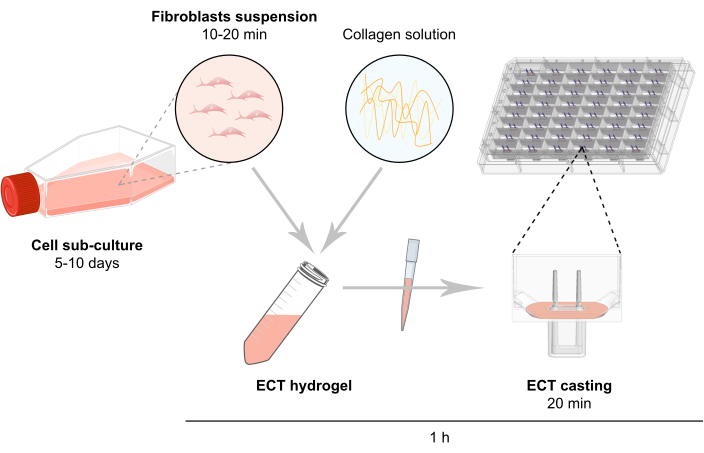
Рисунок 2: Схематический обзор генерации ЭСТ. Фибробласты расширяются в 2D-культуре перед использованием в генерации ЭСТ. Через 5-10 дней клетки ферментативно диспергируют и клеточную суспензию восстанавливают в буферную смесь, содержащую бычий коллаген типа 1. Смесь ячеек и коллагена гидрогеля пипетируется в отдельные скважины в 48-луночной пластине для 3D-инженерной культуры тканей, разработанной в виде литейных форм с двумя гибкими полюсами для обеспечения суспензии ЭСТ при определенной длине и нагрузке. ЭСТ обычно культивируют в течение 1-20 дней до измерений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Готовят 10-кратный раствор DMEM путем растворения порошка DMEM в ddH2O (134 мг/мл для состава, указанного в Таблице материалов) при постоянном вращении при 37 °C в течение 1 ч. Стерилизуют путем фильтрации. Запас стабилен до 14 дней при 4 °C или -20 °C в течение 12 месяцев.
- Приготовьте 2x DMEM, разбавив 10x DMEM стоковый раствор и добавив 20% (v/v) FCS в стерильный ddH2O. Необязательно используйте антибиотики, такие как пенициллин 200 Ед/мл и стрептомицин 200 мг/мл. Обратитесь к таблице 1 для объемов дозирования. Запас стабилен до 14 дней при 4 °C.
ПРИМЕЧАНИЕ: Выполните шаги 3.1. и 3.2. перед началом ферментативной дисперсии клеток (стадия 2.) для получения ЭСТ.
| Реагент | Конечная концентрация | Объем (мл) |
| 10× ДМЭМ | н/д | 2 |
| ФТС | 20 % (об/об) | 2 |
| Пенициллин | 200 ЕД/мл | 0.2 |
| Стрептомицин | 200 мг/мл | 0.2 |
| ддН2О | н/д | 5.6 |
| Итог | н/д | 10 |
Таблица 1: Состав 2x DMEM.
ВНИМАНИЕ: Все компоненты для клеточно-коллагеновой гидрогелевой смеси и центрифужных трубок должны храниться на льду перед использованием. Это поможет предотвратить самосборку коллагена перед распределением клеточно-коллагеновой гидрогелевой смеси по всем литейным формам.
- Исходя из таблицы 2, отрегулируйте клеточную суспензию до плотности 8,88 х 106 ячеек/мл путем добавления калечащих операций на женских половых органах при 20-25 °C к клеточной суспензии со стадии 2.10. Затем переместите коллекционную трубку с клеточной суспензией на лед.
- Чтобы приготовить гидрогелевую смесь ЭСТ, предварительно охладите 50-литровую центрифужную трубку на льду и добавьте к ней различные компоненты, перечисленные в таблице 2 , в следующем порядке, избегая образования пузырьков воздуха.
ПРИМЕЧАНИЕ: Максимальное число ЭСТ, которое должно быть подготовлено, зависит от общего числа клеток, определенного на шаге 2.9. Используйте 0,3 мг коллагена на ЭСТ, полученное из исходного раствора, содержащего 6-7 мг/мл. Концентрация раствора коллагена определяет объем, необходимый для получения оптимального содержания коллагена ЭСТ. Объемы других компонентов гидрогеля ЭСТ должны быть соответствующим образом адаптированы. Скорректированные объемы в соответствии с раствором коллагена 6,49 мг/мл см. в таблице 2 . Тома, описанные в таблице 2 , используются в настоящем протоколе в качестве примерного руководства.- Пипетка кислоторастворимо-коллагенового типа 1 гидрогель с использованием серологической пипетки с широким отверстием наконечника.
- Отрегулируйте содержание соли в растворе коллагена, добавив 2x DMEM при осторожном смешивании, закручивая трубку.
- Нейтрализуйте рН, добавив 0,2 М NaOH при осторожном перемешивании путем закручивания трубки. Фенольный красный индикатор превратится из желтого в красный.
ПРИМЕЧАНИЕ: Объем NaOH должен быть титрован для каждой отдельной партии коллагена для оптимальной нейтрализации pH. Нейтрализация зависит от таких факторов, как тип буфера и препарат, а также абсолютная концентрация коллагена, и влияет на сборку коллагеновой матрицы и жизнеспособность клеток23,40. Как только содержание ионов увеличивается добавлением DMEM и рН нейтрализуется, самосборка коллагена следует и не должна быть нарушена. Поэтому выполняйте следующее быстро и без перерывов. - Добавьте клеточную суспензию (из стадии 3.3) по каплям, осторожно перемешивая, закручивая трубку.
| Номер ЭСТ: | 1 | 6 | 24 | 48 | |
| в том числе 10% профицит | |||||
| Компоненты клеточно-коллагенового гидрогеля: | (мкл) | (мкл) | (мкл) | (мкл) | |
| Запас коллагена (6,49 мг/мл) | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 2× ДМЭМ | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 0,2 М НаОН | 3.1 | 20.5 | 81.8 | 163.7 | |
| Клеточная смесь при калечащих операциях на женских половых органах (8,88×106 клеток/мл) | 84.5 | 557.4 | 2229.7 | 4459.5 | |
| Общий объем (мкл) | 180.0 | 1188.0 | 4752.0 | 9504.0 | |
| Это примерная таблица для приготовления литейного объема 180 мкл на ЭСТ, содержащего в общей сложности 750 000 клеток и 0,3 мг коллагена на ЭСТ. | |||||
Таблица 2: Получение гидрогеля ЭСТ (включая 10% излишек с учетом ошибок пипетирования).
- Смешайте всю суспензию, осторожно пипетируя вверх и вниз только один раз, используя серологическую пипетку с широким наконечником отверстия, чтобы избежать образования пузырьков и свести к минимуму напряжение сдвига. Обеспечьте полную смесь, осторожно закрутив трубку 10 раз, и держите 50 мл центрифужной трубки, содержащей смесь гидрогеля ЭСТ, на льду на протяжении всего процесса литья.
- Предварительно смочите наконечник пипетки объемом 1 мл гидрогелевой смесью ЭСТ и равномерно распределите 180 мкл в каждую форму 48-луночной литейной пластины, избегая чрезмерных сил сдвига, которые могут повлиять на целостность сборки коллагеновой матрицы, и гарантируя, что вся пластина будет выполнена за 15-20 минут.
ПРИМЕЧАНИЕ: Рекомендуемый объем литья составляет 180 мкл, но его можно увеличить до 200 мкл38. Поэтому, когда это предпочтительно, объемы в таблице 2 могут быть адаптированы к 200 мкл таким образом, чтобы сохранить те же концентрации и соотношение между клетками и коллагеном.- Убедитесь, что в пресс-форме сформирован полный контур (рисунок 3А). Если гидрогелевая смесь ЭСТ наносится прерывисто, будет предотвращено полное образование кольца ЭСТ (рисунок 3В).
- Избегайте пипетки во внутреннюю скважину (рисунок 3C) и образования пузырьков во время пипетки (рисунок 3D), чтобы обеспечить однородное и функциональное образование ткани.
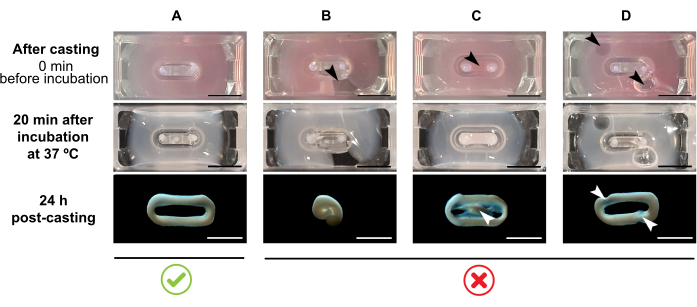
Рисунок 3: Литье, образование гидрогеля и конденсация ЭСТ в многолуночном формате. Верхние панели иллюстрируют внешний вид ЭСТ непосредственно после литья. Средние панели иллюстрируют появление ЭСТ после инкубации в течение 20 минут при 37 °C. Нижние панели иллюстрируют состояние уплотнения ЭСТ через 24 ч после подготовки, снятой с полюсов. (A) Правильное формирование ЭСТ между двумя полюсами в течение первых 24 ч. (B-D) Примеры ошибок дозирования, препятствующих правильному образованию ЭСТ. Белые и черные стрелки указывают на структурные дефекты ЭСТ из-за неправильного литья. Шкала: 5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Аккуратно поместите 48-луночную литейную пластину внутрь инкубатора клеточной культуры и дайте гидрогелевой смеси ЭСТ восстановиться в течение 15-30 мин. После инкубации он будет выглядеть гелеобразным и непрозрачным (рисунок 3, средняя панель).
- Добавьте 600 мкл теплого КЖПО при 37 °C на лунку, не пипетируя питательную среду непосредственно на формирующейся ЭСТ, так как это может привести к разрушению тканей. Аккуратно добавьте культуральную среду вдоль стенки колодца, так как в этот момент ЭСТ также не должна отделяться от дна (рисунок 4).
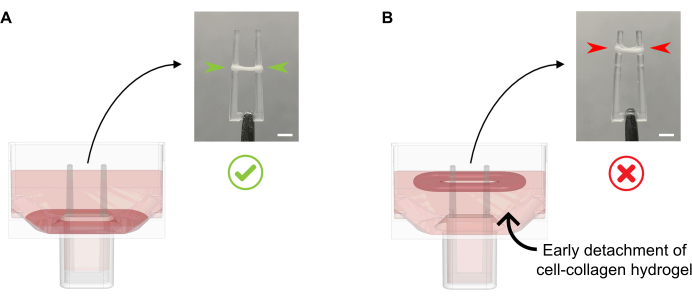
Рисунок 4: Правильное и неправильное добавление питательной среды к свежеотлитой ЭСТ. (A) При добавлении культуральной среды после первоначального затвердевания ЭСТ (через 20 мин после заливки) конденсационную ЭСТ следует оставлять ненарушенной на дне скважины. В течение следующих 24 часов уплотнение матрицы с клеточным приводом заставит ЭСТ скользить вверх по рампе. Конечное положение ЭСТ контролируется вогнутыми полостями на определенной высоте полюса; это гарантирует, что все ЭСТ располагаются в одном и том же положении, что позволяет сравнивать активность изгиба полюсов в параллельной культуре ЭСТ. (B) Формирование ЭСТ, отделенной от дна, при слишком быстром добавлении питательной среды. Плавающая ЭСТ будет уплотняться на верхнем уровне культуры среды. Силы сжатия полюсов не будут напрямую сопоставимы, если ECT расположится на разных позициях. Шкала: 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Инкубировать в течение 24 ч.
- Заменяйте среду каждый день после этого 500 мкл калечащих операций на женских половых органах до анализа.
ПРИМЕЧАНИЕ: После начальной фазы клеточно-независимого гелеобразования муковисцидоз человека начинает дополнительно уплотнять смесь гидрогеля ЭСТ. В течение 24 ч ЭСТ должна казаться заметно уплотненной и поднятой до уровня, на котором она удерживается на гибких полюсах (рис. 3 и рисунок 4А).
4. Оценка уплотнения ЭСТ путем измерения площади поперечного сечения (CSA) (5 мин на ЭСТ).
ПРИМЕЧАНИЕ: Уплотнение тканей начинается сразу после сборки коллагена и особенно важно в течение первых часов. Уплотнение описывает изменения, в основном вызванные клеточным сжатием матрицы перпендикулярно длинной оси ткани. Этот параметр оценивается путем определения площади поперечного сечения (CSA) ЭСТ.
- В нужные моменты времени используйте стереомикроскоп для записи макроскопических изображений верхнего и бокового видов ЭСТ (рисунок 5C).
ПРИМЕЧАНИЕ: ЭСТ может быть изображена внутри культивирующих скважин 48-луночной литейной плиты. В качестве альтернативы можно перенести ЭСТ на четкую нижнюю многоскважинную пластину для визуализации. Рекомендуется визуализировать ЭСТ на полюсах, поскольку их удаление приводит к потере преднагрузки, и, следовательно, в течение короткого периода времени ткань может дополнительно сокращаться с возможным торсионом из-за высвобождения напряжения, что может помешать надлежащей визуализации для анализа размеров. - Используйте программу обработки изображений для выполнения анализа сканирования строки. Установите шкалу и используйте инструмент «Прямая линия » для отслеживания и измерения диаметров ЭСТ не менее 6 позиций на плечо в каждой плоскости изображения (рисунок 5B, C).
- Рассчитайте средний диаметр от плоскостей верхнего и бокового вида и рассчитайте CSA в соответствии с уравнением эллиптической площади:


Рисунок 5: Мониторинг уплотнения ЭСТ с течением времени с помощью анализа площади поперечного сечения (CSA). ЭСТ были получены с использованием человеческого муковисцидоза и коллагена типа I и культивировались вокруг двух гибких полюсов в течение 5 дней. (A) Представлены репрезентативные изображения контрольных ЭСТ, помещенных в гибкие формы в течение 5 дней. Шкала стержня = 5 мм. Такие изображения яркого поля также могут быть использованы для определения вариации отклонения полюса для оценки сокращения ткани. (B) Схематическое изображение площади поперечного сечения ЭСТ (диаметр вида сверху зеленым цветом и диаметр бокового вида розовым). (C) Макроскопические изображения верхнего и бокового видов ЭСТ, полученные с помощью стереомикроскопа и соответствующего примера анализа диаметров тканей с использованием программы обработки изображений. Шкала = 2 мм. Усредненные диаметры рассчитываются на основе среднего значения всех длин линий, измеренных на каждом плане просмотра. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Мониторинг сокращения ЭСТ путем анализа отклонения полюса (15 мин на 48-луночную литейную пластину).
ПРИМЕЧАНИЕ: Эст культуру обычно проводят в течение 5 дней, но она может быть дополнительно продлена, по крайней мере, до 20 дней. Отклонение полюса происходит из-за сокращения ткани, вызванного силой сокращения клеток в направлении натяжения вдоль длинной оси ткани. Оценка сокращения ЭСТ может быть выполнена путем визуализации в любой день во время посева.
- Снимите изображение 48-луночной литейной пластины под записывающим устройством со встроенной камерой сканирования площади, размещенной на фиксированном расстоянии, оснащенной монохромным датчиком изображения высокого разрешения (≥ 5 мегапикселей).
- Используйте источник света, близкий к ультрафиолетовому излучению (~ 390 нм), чтобы максимизировать контрастность и, таким образом, облегчить автоматическое обнаружение кончиков полюсов, поскольку они содержат флуоресцентный краситель (рисунок 6A, C). При наличии телецентрические объективы рекомендуются для визуализации, поскольку они минимизируют искажения изображения.
ПРИМЕЧАНИЕ: В качестве альтернативы для анализа могут быть использованы макроскопические изображения ярких полей из отдельных скважин или всей пластины, сопровождаемой шкалой (рисунок 5А).
- Используйте источник света, близкий к ультрафиолетовому излучению (~ 390 нм), чтобы максимизировать контрастность и, таким образом, облегчить автоматическое обнаружение кончиков полюсов, поскольку они содержат флуоресцентный краситель (рисунок 6A, C). При наличии телецентрические объективы рекомендуются для визуализации, поскольку они минимизируют искажения изображения.
- Измерьте расстояние между полюсами из ежедневных записей (рисунок 6C, D) с помощью программы обработки изображений или автоматизированного анализа, запустив записанные изображения на программном обеспечении, способном обнаруживать высококонтрастные яркие пиксели на темном фоне.
- Рассчитайте отклонение полюса через изменение расстояния полюсов по сравнению с начальным расстоянием в нулевой день.
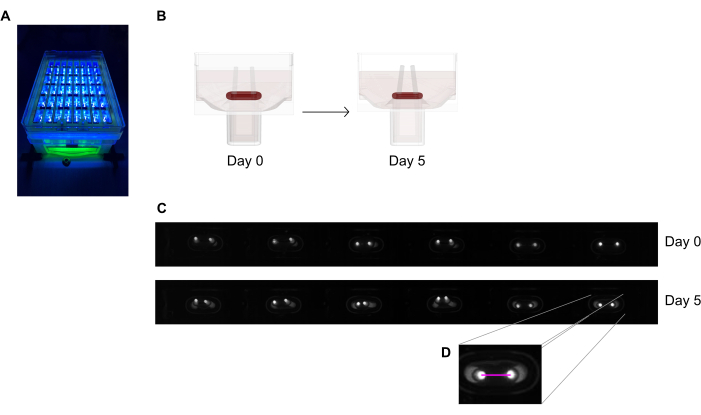
Рисунок 6: Схематический обзор оценки сокращения тканей в соответствии с отклонением полюса. (A) Примерная запись флуоресцентных полюсов с высоким разрешением в 48-луночной литейной пластине при возбуждении ближнего УФ-излучения. Этот метод предпочтительнее изображений с ярким полем для более точной автоматической трассировки наконечников полюсов. (B) Схематические чертежи демонстрируют, как уплотнение и сжатие ЭСТ приводит к изгибу полюсов. (C) Примерный ряд одних и тех же пластинчатых записей в день 0 и день 5 после отливки. Д. Крупный план показывает, как измерить расстояние (розовую линию) между полюсами с помощью программы обработки изображений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Учтите, что отклонение полюса, измеренное ярким изображением кончика, является только оценкой сокращения ткани из-за разницы в плоскостях визуализации. Кроме того, обратите внимание, что применение профиброзных веществ, таких как TGF-β1, во время культивирования тканей усиливает уплотнение и сокращение ЭСТ и может в конечном итоге привести к раннему разрушению тканей.
6. Оценка жесткости и других биомеханических свойств ЭСТ методом измерения деструктивного растяжения и напряженно-деформированного анализа (20 мин на ЭСТ)
ПРИМЕЧАНИЕ: Оптимальная кривая напряжения-деформации может отображать три области: область пальца ноги, упругую область и пластическую область. Пример кривой напряжения-деформации ЭСТ показан на рисунке 7. Анализ кривой напряжения-деформации позволяет извлечь важные биомеханические параметры ткани, такие как, например, жесткость, максимальная прочность, эластичность, пластичность, растяжимость, упругость и ударная вязкость.
- Соберите ЭСТ, сначала вытащив носилки, в том числе ЭСТ, из колодца, используя щипцы. Затем носилки можно держать на его основании, а ЭСТ скользить по наконечникам носилок с помощью тонкого крючка или наконечника пипетки.
- Перенесите ЭСТ на два крючка, зажатых к неподвижному рычагу, и рычаг преобразователя реометра удлинительного динамического механического анализа (DMA), оснащенного 37 °C закаленной органной ванной (изготовленной на заказ), заполненной PBS (рисунок 7A).
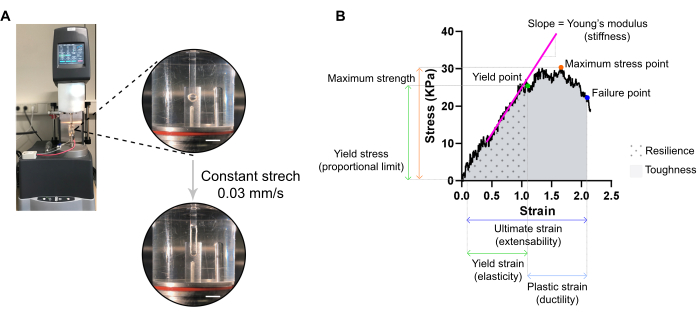
Рисунок 7: Анализ измерения разрушения растяжения ЭСТ. (A) Реологическое измерение разрушения растяжения на реометре экстенсивного динамического механического анализа (DMA). Вид верхней высокой мощности: ЭСТ после установки на L0 в камере окружающей среды и подключения к верхнему и нижнему полюсу для анализа напряжения-деформации. Вид с высокой мощностью снизу: ЭСТ напрягается с постоянной скоростью 0,03 мм/с до точки отказа при предельной деформации. Шкала стержней = 5 мм. (B) Диаграмма напряжения-деформации ЭСТ, показывающая основные измеряемые параметры. Верхний предел упругой области соответствует температуре текучести, а пластическая область находится между точкой текучести и точкой отказа (пластичностью). Наклон линейной фазы упругой области соответствует модулю Юнга, отражающему жесткость ткани. Максимальная прочность соответствует максимальному растягивающему напряжению, которое может выдержать ткань. Из-за микроразрыва волокон напряжение уменьшается до тех пор, пока ткань не достигнет точки отказа. Это происходит при конечном напряжении (растяжимости), где наблюдается внезапное падение напряжения из-за разрыва ткани. Упругость соответствует энергии (кДж/м3), поглощенной тканью до постоянной деформации (до точки текучести) и задается площадью под кривой (AUC) до деформации предельной точки текучести. Ударная вязкость соответствует общей энергии (кДж/м3), которую ткань может поглощать до разрыва и задается AUC до конечного напряжения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Установите реометр на применение одноосного напряжения с постоянной линейной скоростью примерно 1 % от начального расстояния между крючками в секунду. Постоянная скорость растяжения 0,03 мм/с может использоваться при типичных размерах ЭСТ. Нанесите датчик, инициируйте растяжение и записывайте до точки разрыва ЭСТ.
ВНИМАНИЕ: Макроскопические снимки ЭСТ (этап 4.1.) должны быть записаны перед испытанием на растяжение, так как CSA требуется для нормализации данных.
ПРИМЕЧАНИЕ: Анализ напряжения-деформации, включая расчет CSA, может быть обработан позже по времени после испытания на растяжение. Используйте программное обеспечение для электронных таблиц и программное обеспечение для статистического анализа для анализа данных. - Нормализуйте измеренные значения силы (мН) на ЭСТ по ее CSA (мм2) для получения значений напряжений (кПа).
- Построение значений напряжения против деформации (геометрическая мера деформации ткани, заданная относительным расстоянием между верхним и нижним крючком) на графике XY.
ПРИМЕЧАНИЕ: Начальная длина ткани (расстояние между верхним и нижним крючком) непосредственно перед началом растяжения, L0, должна быть вручную отрегулирована и соответствует началу области пальца ноги (область пальца ноги может отсутствовать в зависимости от свойств ткани). Каждое значение точки деформации должно быть рассчитано в соответствии с уравнением, в котором Ltotal является общим разрывом в каждой точке измерения: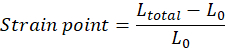
При построении графика данных используйте значение напряжения при выбранном L0 для фонового вычитания. - Определите различные биомеханические параметры из кривой напряжения-деформации (используйте рисунок 7B в качестве примера).
ПРИМЕЧАНИЕ: Кривая напряжения-деформации может отображать три области: области пальца ноги, упругие и пластиковые области. Верхний предел эластической области, до того, как ткань начнет микроразрыв, соответствует температуре текучести, а ее деформация является мерой эластичности ткани. Пластиковая область находится между температурой текучести и точкой отказа. Более поздняя точка соответствует внезапному падению стресса из-за разрыва ткани, определяя конечное пятно, которое является мерой растяжимости ткани. Третья точка измерения соответствует максимальной прочности, которая определяется наибольшим напряжением, которое ткань может выдержать, не ломаясь во время растяжения. Упругость и ударная вязкость, задаваемые площадью под кривой, соответствуют энергии, поглощаемой тканью, вплоть до точки текучести и точки отказа соответственно. Для каждой полученной кривой наклон линейной части упругой области соответствует модулю Юнга, также известному как модуль упругости, и является механическим свойством, измеряющим жесткость ткани.- Извлеките из каждой кривой значения XY (деформация и напряжение соответственно) температуры текучести, точки отказа и максимальной точки напряжения.
- Оцените модуль Юнга (жесткость в кПа = мН·мм-2) каждой ЭСТ от наклона линейной части упругой области, построив линейную регрессию этой области.
- Используйте статистическую программу для вычисления площади под кривой (AUC), чтобы определить как устойчивость, так и ударную вязкость, вплоть до температуры текучести и точки отказа соответственно. Вычисление AUC трапециевидным методом. Установите базовую линию на ноль и учитывайте только пики выше базовой линии, которые составляют не менее 10 % расстояния от минимального до максимального значения по оси Y.
ПРИМЕЧАНИЕ: Модули упругости и ударной вязкости задаются σ × ε, где σ - напряжение (кПа), а ε - деформация (L/ΔL, мм/мм). Таким образом, упругость и ударная вязкость представляют собой энергию в кДж/м3 (кПа = кН·м-2 = кН·м·м-3 = кДж/м·м·м-3 = кДж/м3), поглощенную тканью до постоянной деформации и до разрыва соответственно.
Результаты
ЭСТ достигает около 95% уплотнения по сравнению с исходным объемом гидрогеля клетки-коллагена в течение первых 24 ч. Уплотнение и сжатие тканей в контролируемых условиях и в присутствии FCS наступает через несколько часов после отливки и заметно увеличивается до 5 дня (рисунок 5A...
Обсуждение
Представленный протокол описывает генерацию ЭСТ от первичного муковисцидоза человека, что позволяет изучить механическое воздействие этих клеток на их внеклеточную матричную среду и наоборот.
Фибробласты должны быть расширены, чтобы получить достаточное количество к...
Раскрытие информации
GLS и SL подготовили рукопись. Все авторы внесли свой вклад в разработку протокола и отредактировали рукопись. TM, MT и WHZ являются научными консультантами myriamed GmbH. WHZ является основателем и акционером myriamed GmbH.
Благодарности
Эта работа была поддержана Немецким кардиологическим обществом (DGK Research Fellowship for GLS) и Немецким исследовательским фондом (DFG в рамках проекта IRTG 1816 для GLS и AD; DFG 417880571 и DFG TI 956/1-1 для MT; SFB 1002 TP C04 для MT и WHZ; SFB 1002 TP S01 для WHZ; и EXC 2067/1-390729940J для WHZ). WHZ поддерживается Федеральным министерством науки и образования Германии (BMBF через проект IndiHEART) и Fondation Leducq (20CVD04). MT, WHZ и SL поддерживаются Немецким центром сердечно-сосудистых исследований (DZHK).
Материалы
| Name | Company | Catalog Number | Comments |
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Ссылки
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force--Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены