Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fibroblast Türetilmiş İnsan Tarafından Tasarlanmış Bağ Dokusu Tarama Uygulamaları için
Bu Makalede
Özet
Burada sunulan, mekanistik çalışmalar, hastalık modelleme ve tarama uygulamaları için uygun, çift kutuplu çok kuyulu bir plakada 48 dokudan oluşan paralel bir kültür için tasarlanmış bağ dokuları üretmek için bir protokoldür. Protokol, farklı organ ve türlerden fibroblastlarla uyumludur ve burada insan primer kardiyak fibroblastlarla örneklenmiştir.
Özet
Fibroblastlar fenotipik olarak son derece dinamik hücrelerdir ve biyokimyasal ve biyomekanik uyaranlara yanıt olarak hızla miyofibroblastlara transdifferentiate. Kardiyak fibrozis de dahil olmak üzere fibrotik süreçlerin mevcut anlayışı zayıf kalır ve bu da yeni anti-fibrotik tedavilerin gelişimini engeller. Kontrol edilebilir ve güvenilir insan modeli sistemleri fibrozis patolojisinin daha iyi anlaşılması için çok önemlidir. Bu, fibroblastların ve fibrotik dokunun patofizyolojisinin 3 boyutlu (3D) bir ortamda çalışmalarını kolaylaştırmak için 48 kuyulu bir döküm plakasında mühendislik bağ dokuları (EKT) oluşturmak için son derece tekrarlanabilir ve ölçeklenebilir bir protokoldür. EKT, kutupların etrafında ayarlanabilir sertlik ile üretilir ve tanımlanmış bir biyomekanik yük altında çalışmalara izin verir. Tanımlanan yükleme koşullarında hücre-matris etkileşimleri ile kontrol edilen fenotipik adaptasyonlar incelenebilir. Paralel test, doku sıkıştırma ve yüke karşı kasılma gibi birden fazla parametrenin zaman dilimi analizi fırsatı ile 48 kuyu formatında uygulanabilir. Bu parametrelerden doku sertliği ve elastikiyet gibi biyomekanik özellikler incelenebilir.
Giriş
Fibrotik hastalıkların incelenmesinde önemli bir engel, fibroblastların davranışları ve patolojik türevleri hakkında fikir veren temsili insan 3D doku modellerinin olmamasıdır. Fibrotik süreçleri incelemek için, standart 2D kültür sistemleri alt optimaldir, çünkü izole fibroblastlar, uyumlu olmayan 2D substratlarda kültürlendiğinde α düz kas aktinine (SMA) hızla transdifferentiate olurlar1,2,3. Bu nedenle, standart 2D kültüründeki fibroblastlar düzenli bir "sağlıklı" doku fenotipini yansıtmaz3,4,5,6. Fibrotik olmayan (10 kPa) ve fibrotik (35 kPa) doku ortamlarını simüle etmek için esnek substratlardaki kültürler tanıtılmıştır7, ancak bunlar patofizyoloji açısından çok önemli olan üçüncü boyuttan yoksundur. Doku mühendisliği, fibroblast kültürüne tanımlanmış ve deneysel olarak tonlanabilir hücre dışı matris (ECM) bağlamında, örneğin hücresellik, ECM bileşimi ve ECM konsantrasyonundaki değişikliklerle izin vererek bu sınırlamanın üstesinden gelme fırsatı sağlar, bunların hepsi doku biyomekaniğini belirleyebilir.
Fibroblastlar kullanılarak çeşitli 3D modeller üretilmiştir. Yüzen diskler ve mikroküreler ilkler arasındaydı ve kolajenin zamana bağlı bir şekilde yeniden şekillendirildiğini ve sıkıştırıldığını gösteriyor. Fibroblastlar kollajen fibriller üzerinde çekiş kuvvetleri uygular, büyüme faktörü-beta 1 (TGF-β1) gibi pro-fibrotik ajanların eklenmesiyle kolaylaştırılabilir bir süreçtir.8,9,10,11,12,13,14,15,16. Bununla birlikte, serbestçe yüzen kültürler kontrollü dış yüklemeye izin vermez ve bu nedenle sürekli küçülen veya sıkıştırıcı modeller oluşturur. Levha benzeri mühendislik dokuları, dokuların biyomekanik özelliklerinin homeostatik düzenlemesini, yani uni, bi, multiaksiyel veya döngüsel suş testi yoluyla inceleme imkanını açtı.17,18,19,20. Bu modeller, örneğin, hücre sayısının doku sertliği üzerindeki etkisini göstermek için kullanılmıştır, bu da sitoskeleton bütünlüğü ve aktomiyosin sitoskeleton kontrtilitesi ile pozitif olarak ilişkili bulunmuştur.18,19. Bununla birlikte, gerinim kuvveti dönüşümlerinin, kuvvet dönüştürücülerinin ve çapa noktalarının kelepçe noktalarının etrafındaki homojen olmayan doku deformasyonu ile karmaşık olduğunu belirtmek önemlidir. Bu doğal sınırlama, köpek kemiği veya halka şeklindeki dokular tarafından atlanabilir ve çapa noktalarında bazı doku uygulamaları sunar21,22,23. Halka şeklindeki dokular, hücre-kollajen hidrojelleri halka şeklindeki kalıplara dağıtılarak hazırlanabilir. Hidrojel sıkıştırırken, kalıbın sıkıştırılamaz iç çubuğunun etrafında bir doku oluşur ve bu da daha fazla doku kasılması için direnç sunar.24,25,26,27. İlk ve tipik olarak maksimum sıkıştırmadan sonra, dokular tanımlanmış bir doku uzunluğunda dairesel EKT'yi daha fazla kısıtlamak için ayarlanabilir aralayıcılara da aktarılabilir3,24,25,26,27,28,29,30. Biyofiziksel özellikler, tek yönlü veya dinamik gerinim altında uygun yük hücrelerine sahip standart yatay veya dikey gerinim gerinim cihazlarında değerlendirilebilir3. Dokular büyük ölçüde düzgün dairesel bir yapıya sahip olduğu ve çubuklar / kancalar (ankraj noktaları ve / veya kuvvet dönüştürücüleri) üzerinde tutulabildiğinden, bunlar hala yükleme çubuklarının etrafındaki sıkıştırma alanlarını kaplayabilir, ancak bu format sıkıştırmaya kıyasla daha düzgün bir gerinim varyasyonu sağlar.3. Ayrıca, bağlantılı dokular bipolar hücre şekli ortaya çıkarır ve hücreler anisotropik çekişi teşvik eden kuvvet çizgileri boyunca uzayarak doku kuvvetlerine uyum sağlar.31,32,33,34,35,36. Daha önce fonksiyonel stres-suş deneylerinde tek bir sert kutbun etrafına sıçan ve insan kardiyak fibroblastlarından (CF) halka şeklinde EKT uyguladık ve viral olarak transdüklenmiş fibroblastlar kullanarak fonksiyon çalışmaları kazandır ve kaybettik.24,25,26 ve farmakolojik çalışmalar37. Ayrıca, ECT modelinde CF aracılı fibroziste cinsiyet farklılıklarını belirleyebiliriz.27.
Ticari satıcılardan kriyoprezer korunmuş CF olarak elde edilen birincil insan CF'si ile örneklendirilen insan EKT'nin üretimi için aşağıdaki protokol (bkz. Malzeme Tablosu), halka şeklindeki dokuların avantajlarını paralel yüksek içerikli testler için tasarlanmış 48 kuyulu bir platform için makroskopik dokular üretmenin kolay ve hızlı bir yolu ile birleştirir.
Daha da önemlisi, EKT modeli belirli bir fibroblast tipi ile sınırlı değildir, örneğin cilt fibroblastları38,39 gibi diğer fibroblastların araştırılmasında belgelenmiş kullanım ile. Ayrıca, hastanın biyopsilerinden elde edilen fibroblastlar eşit derecede iyi çalışır ve fibroblast seçimi sonuçta ele alınacak bilimsel soruya bağlıdır.
Bu protokolde açıklanan ECT üretimi için kullanılan platform, piyasada bulunan 48 kuyulu 3D hücre/doku kültürü plakasıdır (Şekil 1A). 48 kuyu plakası yardımıyla tanımlanmış bir geometri ve mekanik yük altında AİHM oluşumu ve işlevinin hazırlanması, kültlenmesi ve izlenmesi yöntemleri açıklanmıştır. Oluşan EKT entegre esnek kutuplar tarafından tutulur ve mekanik yük, bükme sertliklerini etkileyen farklı sertliğe sahip kutuplar (Shore A değeri 36-89) kullanılarak nihai amaca göre ince ayar yapılabilir. Kıyı A değeri 46 olan kutuplar önerilir. Protokol ayrıca, AİHM'nin tek bir sert çubuk etrafında tutulduğu daha önce tanımlanmış özel dairesel bir kalıpla uyumludur37. Bu kalıbın boyutları Şekil 1B'de verilmiştir.
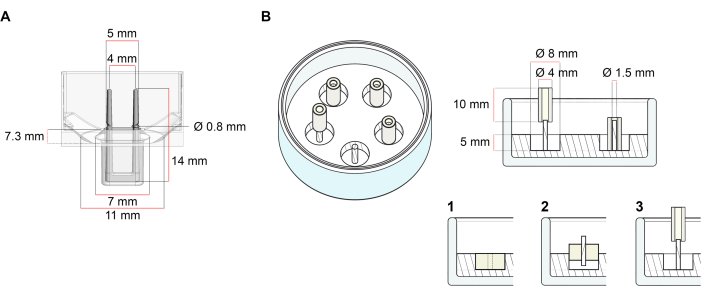
Şekil 1: Döküm kalıplarının şematik gösterimi. (A) İki esnek kutuplu döküm kalıbın teknik çizimi ve boyutları. Kalıp, kalıbın ana gövdesinde çift istinat direkleri tutan kısa bir duvarla sınırlandırılmış bir iç çevreden oluşur. Esnek direkler birbirine serbest yatay mesafeye sahiptir ve tabana bağlanır. Kalıp 180 μL döküm hacmine izin verir. Her kalıbın kuyusu, en az 600 μL kültür ortamı hacim kapasitesi sağlar. Farklı malzeme bileşimleri, belirli sertliklere sahip kutuplar üretmek için kullanılabilir (örneğin, TM5MED-TM9MED). (B) Tek bir sert çubuklu halka şeklindeki kalıbın teknik çizimi ve boyutları. Bu, AİHM döküm protokolü37 ile kullanılabilen farklı geometriye ve mekanik ortama sahip alternatif bir kalıptır. Halka şeklindeki kalıp montaj yöntemi yayınlanan daha büyük formatlardan uyarlanmıştır28,41. Kısacası, yöntem (1) polidimetilsiloksan (PDMS), silikon) cam tabaklara dökülür (çapı 60 mm) ve (2) bir PDMS kutup tutucusunu (1,5 mm çapında) oluşan içi boş boşluğun içine merkezi olarak sabitlemek, bu da (3) çıkarılabilir bir direği (4 mm çapında silikon tüp) tutmaya yarar. İçi boş alan sonucu 180 μL döküm hacmi sağlar. Her cam tabak birden fazla baskılı kalıbı (örnek olarak 5 kalıpla gösterilmiştir) komporte edebilir ve 5 mL'ye kadar kültür ortamı kapasitesine sahiptir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Tüm adımlar, muhafaza seviyesi 1 altındaki laboratuvarlara monte edilen Sınıf II biyogüvenlik davlumbazlarında yapılmalıdır. Viral aracılı gen transferi gibi yerel düzenlemelere ve yapılacak manipülasyonların türüne bağlı olarak, muhafaza seviyesi biyogüvenlik seviyesi 2 veya 3'e yükseltilmelidir. Tüm kültürler 37 °C'de havada % 5 CO2 nemlendirilmiş atmosfere sahip bir hücre kültürü inkübatörde tutulur. Birimlerin (Adım 1 ve 2) bir T75 hücre kültürü şişesi için sağlandığını unutmayın. Birimleri standart hücre kültürü önerilerine göre farklı kültür biçimlerine ayarlayın.
1. Monolayer kültürü için birincil kardiyak fibroblast (CF) çözme ve ön kaplama (5-12 gün)
NOT: Alternatif olarak, HFF-1 hücreleri tedarikçinin tavsiye ettiği standart alt kültür protokolünü izleyerek kullanılabilir.
- Fibroblast büyüme ortamını (FGM) üreticinin talimatlarına göre hazırlayın. İsteğe bağlı olarak, 100 U/mL penisilin ve 100 mg/mL streptomisiin gibi antibiyotikler ekleyin. Kullanmadan önce tüm bileşenlerin tamamen karıştırılmasına izin verin. 4 °C'de 14 güne kadar saklayın.
- Sıcak FGM ila 20-25 °C.
- Kriyoprezer korunmuş CF'yi (ideal olarak cryovial başına 1 x 106 ila 2 x 106/mL hücre içerir) yaklaşık 2 dakika boyunca 37 °C'de bir su banyosunda, şişede sadece az miktarda buz kalana kadar çözün.
- 2 mL serolojik pipet kullanarak, hücre süspansiyonu damla yönünde 10 mL FGM içeren uygun bir steril santrifüj tüpüne aktarın. En uygun hücre alımı için, cryovial'ı 1 mL FGM ile durulayın ve santrifüj tüpüne aktarın. Hücreler bu aşamada çok hassas olduğundan, kesme stresi ile hücre hasarını en aza indirmek için delik ucu olan serolojik bir pipet kullanarak yeniden depolayın.
NOT: Kriyoprezervasyon ortamı yüksek oranda DMSO içeriyorsa, FGM'de hücre resüspensyondan sonra DMSO içeriğinin %1'den az olduğundan emin olun. Alternatif olarak, yeniden hesaplanan hücreleri orta değişim için 20-25 °C'de 5 dakika boyunca 300 x g'da santrifüj edin. Daha sonra, süpernatantı dikkatlice emiş, peletlenmiş hücreleri yerinden çıkarmak için tüpü döndürün ve tohumlama için istenen FGM hacminde yeniden biriktirin. - 12 mL FGM'de 0,5 x 106 hücreyi T75 hücre kültürü şişesine tohum. Başka bir labware kullanılıyorsa, 6,7 x 103/cm2 tohumlama yoğunluğunu korumak için hücre numarasını ayarlayın.
- FGM'i 5 gün boyunca veya hücreler % 80 izdiah edene kadar iki günde bir değiştirin.
NOT: Genişlemeden sonraki hücre verimi esas olarak hücre büyüklüğüne ve hücre donörleri arasında farklılık gösterebilecek çoğalma oranına bağlıdır. Tipik olarak, bu standart kültür prosedürü, 5 günlük kültürden sonra bir T75 hücre kültürü şişesinden 4 x 106 ila 5 x 106 CF alınmasına izin verir.
2. İnsan CF'nin enzymatic dağılımı (10-20 dk)
NOT: Bu adım, hem alt kült oluşturan monolayer hücreler hem de EKT'nin hazırlanması için insan CF'sinin tek bir hücre süspansiyonu oluşturmayı amaçlamaktadır. Bu protokol, 3-4. pasajlarda insan CF monolayer kültürleri için optimize edilmiştir. Optimum standardizasyon için, monolayerde alt kültleme CF'leri, EKT hazırlığından önce en az bir kez önerilir. Bu protokol, farklı bağışçılardan ve satıcılardan kaynaklanan fibroblastlar için optimize edilmelidir. Alternatif kopma protokolleri, rekombinant serine proteaz bazlı ayrışma reaktiflerinin, örneğin proteolitik ve kollajenolitik enzimler içerenlerle değiştirilmesini içerebilir.
- Sıcak FGM, PBS (Ca2+/Mg2+-free) ve hücre ayrışması reaktifi 20-25 °C'ye kadar.
- Ortamı kültürlü hücrelerden epire edin.
- Hücreleri 6 mL PBS ile yıkayın ve aspirat.
- Hücrelere 6 mL hücre ayrıştırma reaktifi ekleyin ve hücreler gözle görülür şekilde ayırmaya başlayana kadar 20-25 °C'de 3 dakika kuluçkaya yaslanın.
NOT: CF kaynağına bağlı olarak, bu birkaç dakika daha uzun sürebilir. Alternatif olarak, hücreler oda sıcaklığında ayrılmazsa, enzimlerin aktivitesini iyileştirmek için 37 ° C'de kuluçkaya yaslanın. En iyi hücre canlılığını sağlamak için mikroskop altında hücre müfrezesini izleyin. - Hücre dissositasyon reaktifinde yerinden çıkan hücrelere 6-12 mL FGM ekleyerek enzimamatik aktiviteyi nötralize edin. Tek bir hücre süspansiyonu sağlamak ve hücreleri taze bir 50 mL toplama tüpüne aktarmak için 10 mL serolojik pipet kullanarak 4-8 kez yavaşça yukarı ve aşağı pipet. Üreticinin talimatlarına göre bir mikroskop ve hemositometre veya otomatik bir hücre sayacı yardımıyla verimi doğrulayın.
- Hücre süspansiyonu 300 x g'da 20-25 °C'de 5 dakika santrifüj.
NOT: İstenilen miktarda EKT'nin üretimi için yeterli hücre verimine ulaşmak için, hücreler daha fazla genişleme için 1:6'ya kadar seyreltmede alt kültüre edilebilir. Hücrelerin% 80 izdiah edilene kadar (yaklaşık 5-6 gün), her gün orta değişimle büyümesine izin verin. Ardından enzymatic dağılımı tekrarlayın ve 2.7 adımına devam edin. AİHM hazırlığına devam etmek için. - Üst gövdeyi epire edin ve peletin yerinden çıkarmak için tüpü vurun. FGM'deki hücreleri 20-25 °C'de yeniden depolaarak ≥ 15 x 106/mL hücre süspansiyonu elde edin (3.3. adım için gerekenden yaklaşık % 40 daha fazla hücre). Bu, aşağıdaki adımda zorlanma nedeniyle hücre kaybını oluşturur.
- Hücre süspansiyonunu 40 μm örgü hücre süzgecinden geçirin.
DİkKAT: Hücre aglomeraları AİHM'in optimal oluşumuna zararlıdır. Doğrudan ECT dökümü için insan CF protokolünün enzimatik dağılımını kullanırken, hücre süspansiyonunun zorlanması homojen doku oluşumuna müdahale eden ana hücre kümelerinin olmamasını sağlar. Heterojenlikler güvenilir stres-gerinim analizlerini tehlikeye atacaktır. - Hücre numarasını yeniden anlatın ve AİHM hazırlığına devam etmek için % 80'≥ uygunluk ile bir süspansiyonda güvenilir bir hücre numarası sağlamak için hücre canlılığını değerlendirin.
- Elektrik akımı hariç tutma özelliğine göre hücre sayısını ve canlılığını değerlendirmek için otomatik bir hücre sayacı kullanın.
- Alternatif olarak, canlı (boyayı dışlayan sağlam hücre zarları) ve ölü (boyanın hücre içi proteinlere bağlanmasına izin veren tehlikeye atılmış hücre zarları) hücrelerinin doğrudan tanımlanması ve numaralandırılması için bir mikroskop ve hemositometre yardımıyla trippan mavisi (kanserojen, tehlike kategorisi 2 - ihtiyati önlemler alın) boya dışlama testini kullanın.
- Toplama tüpünü 20-25 °C'de hücre süspansiyonu ile ayırın ve hemen adım 3'e geçin.
3. AİHM hazırlığı (1 saat)
NOT: EKT oluşturmanın şematik özeti Şekil 2'de açıklanmıştır.
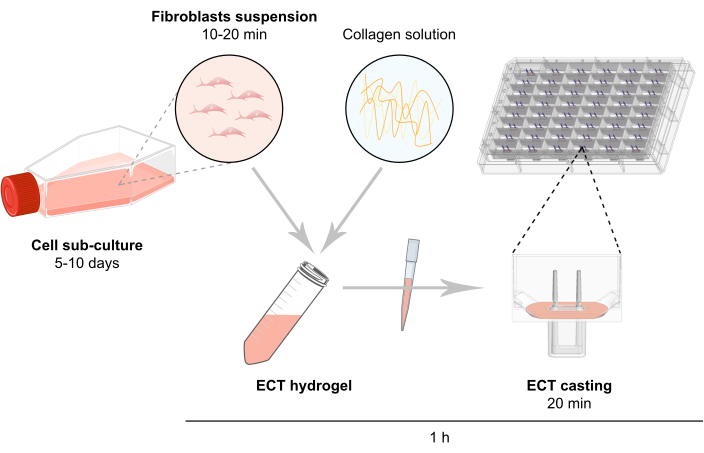
Şekil 2: EKT üretimine şematik genel bakış. Fibroblastlar, ECT neslinde kullanılmadan önce 2B kültürde genişletilir. 5-10 gün sonra hücreler enzmatik olarak dağılır ve hücre süspansiyonu sığır kollajen tipi 1 içeren tamponlu bir karışımda yeniden inşa edilir. Hücre-kollajen hidrojel karışımı, ECT süspansiyonun tanımlanmış bir uzunluk ve yükte etkinleştirilebilmesi için iki esnek direğe sahip döküm kalıpları olarak tasarlanan 3D mühendislik doku kültürü için 48 kuyulu bir plakada tek tek kuyulara pipetlenmiştir. ECT genellikle ölçümlerden önce 1 ila 20 gün boyunca kültürlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- DMEM tozunu ddH2O'da (Malzeme Tablosunda belirtilen formülasyon için 134 mg/mL) 1 saat boyunca 37 °C'de sabit bir dönüş altında eriterek 10x DMEM stok çözeltisi hazırlayın. Filtrasyon ile sterilize edin. Stok 12 aya kadar 4 °C veya -20 °C'de 14 güne kadar stabildir.
- 10x DMEM stok çözeltisini seyrelterek ve steril ddH2O'ya % 20 (v/v) FCS ekleyerek 2x DMEM'i yeni hazırlayın. Boru ses birimleri için Tablo 1'e başvurun. Stok 4 °C'de 14 güne kadar stabildir.
NOT: 3.1 adımlarını gerçekleştirin. ve 3.2. ECT'nin hazırlanması için hücrelerin enzymatic dağılımına başlamadan önce (adım 2.).
| Reaktif | Son Konsantrasyon | Birim (mL) |
| 10× DMEM | Yok | 2 |
| FCS | %20 (v/v) | 2 |
| Penisilin | 200 U/mL | 0.2 |
| Streptomisiin | 200 mg/mL | 0.2 |
| ddH2O | Yok | 5.6 |
| Toplam | Yok | 10 |
Tablo 1: 2x DMEM bileşimi.
DİkKAT: Hücre kollajen hidrojel karışımı ve santrifüj tüpleri için tüm bileşenler kullanılmadan önce buz üzerinde tutulmalıdır. Bu, hücre-kollajen hidrojel karışımını döküm kalıpları boyunca dağıtmadan önce kollajen kendi kendine montajının oluşmasını önlemeye yardımcı olacaktır.
- Tablo 2'yi temel alarak, 2.10. Ardından, hücre süspansiyonlu toplama tüpünü buza taşıyın.
- ECT hidrojel karışımını hazırlamak için, buz üzerinde 50 mL santrifüj tüpü önceden soğutun ve hava kabarcığı oluşumunu önleyerek Tablo 2'de listelenen farklı bileşenleri aşağıdaki sırayla ekleyin.
NOT: Hazırlanacak maksimum EKT sayısı, 2.9. 6-7 mg/mL içeren bir stok çözeltisinden elde edilen ECT başına 0,3 mg kolajen kullanın. Kollajen stok çözeltisinin konsantrasyonu, optimum ECT kollajen içeriği elde etmek için gereken hacmi belirler. Diğer ECT hidrojel bileşenlerinin hacimleri buna göre uyarlanmalıdır. 6,49 mg/mL'lik bir kollajen stok çözeltisine göre ayarlanmış hacimler için Tablo 2'ye bakın. Tablo 2'de açıklanan birimler bu protokolde örnek bir kılavuz olarak kullanılır.- Pipet asit çözünür-kollajen tip 1 hidrojel geniş bir delik ucu ile serolojik pipet kullanarak.
- Tüpü döndürerek hafifçe karıştırırken 2x DMEM ekleyerek kollajen çözeltisinin tuz içeriğini ayarlayın.
- Tüpü döndürerek hafifçe karıştırırken 0,2 M NaOH ekleyerek pH'ı nötralize edin. Fenol kırmızı göstergesi sarıdan kırmızıya dönecektir.
NOT: NaOH hacmi, en uygun pH nötralizasyon için her bir kollajen grubu için titratlanmalıdır. Nötralizasyon, tampon tipi ve hazırlanması gibi faktörlerin yanı sıra mutlak kollajen konsantrasyonuna bağlıdır ve kollajen matrisi montajını ve hücre canlılığını etkiler23,40. İyonik içerik DMEM ilavesi ile arttırıldıktan ve pH nötralize edildikten sonra, kollajenin kendi kendine montajı takip eder ve bozulmamalıdır. Bu nedenle, aşağıdakileri hızlı ve mola vermeden gerçekleştirin. - Tüpü döndürerek hafifçe karıştırırken hücre süspansiyonu (adım 3.3'ten itibaren) damla yönünde ekleyin.
| ECT numarası: | 1 | 6 | 24 | 48 | |
| %10 fazla dahil | |||||
| Hücre kollajen hidrojel bileşenleri: | (μL) | (μL) | (μL) | (μL) | |
| Kollajen stoğu (6.49 mg/mL) | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 2× DMEM | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 0,2 M NaOH | 3.1 | 20.5 | 81.8 | 163.7 | |
| FGM'de hücre karışımı (8,88×106 hücre/mL) | 84.5 | 557.4 | 2229.7 | 4459.5 | |
| Toplam hacim (μL) | 180.0 | 1188.0 | 4752.0 | 9504.0 | |
| Bu, TOPLAM 750.000 hücre ve EKT başına 0,3 mg kolajen içeren, EKT başına 180 μL döküm hacmi hazırlamak için örnek bir tablodur. | |||||
Tablo 2: ECT hidrojel hazırlanması (pipetleme hataları için % 10 fazla muhasebe dahil).
- Kabarcık oluşumunu önlemek ve kesme stresini en aza indirmek için geniş delikli bir uçlu serolojik pipet kullanarak, sadece bir kez yukarı ve aşağı doğru hafifçe pipetleyerek tüm süspansiyonu karıştırın. Tüpü 10 kez hafifçe döndürerek tam karışımı sağlayın ve ECT hidrojel karışımı içeren 50 mL santrifüj tüpünü döküm işlemi boyunca buz üzerinde tutun.
- ECT hidrojel karışımı ile 1 mL pipet ucunu önceden ıslatın ve 180 μL'yi 48 kuyulu döküm plakasının her kalıbına eşit olarak dağıtın, kollajen matris tertibatının bütünlüğünü etkileyebilecek aşırı kesme kuvvetlerini önleyin ve tüm plakanın 15-20 dakikada yapılmasını sağlayın.
NOT: Önerilen döküm hacmi 180 μL'dir, ancak 200 μL38'e kadar uzatılabilir. Bu nedenle, tercih edildiğinde, Tablo 2'deki hacimler, hücreler ve kollajen arasındaki aynı konsantrasyonları ve oranı tutacak şekilde 200 μL'ye uyarlanabilir.- Kalıp içinde tam bir döngü oluşturulduğından emin olun (Şekil 3A). ECT hidrojel karışımı süreksiz uygulanırsa, tam bir AİHM halka oluşumu önlenecektir (Şekil 3B).
- Homojen ve fonksiyonel bir doku oluşumunu sağlamak için iç kuyuya (Şekil 3C) pipetlemekten ve pipetleme sırasında kabarcıkların oluşumundan kaçının (Şekil 3D).
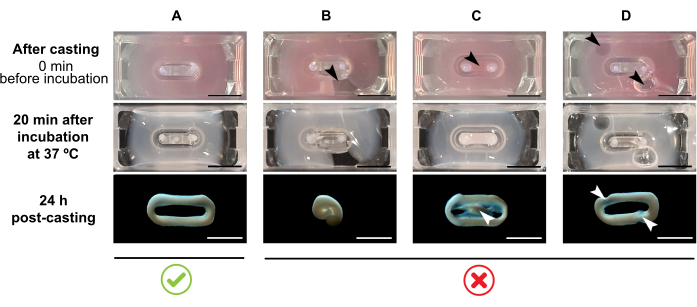
Şekil 3: Çok kuyulu formatta döküm, hidrojel oluşumu ve EKT yoğuşması. Üst paneller, dökümden hemen sonra ECT görünümünü örneklendirir. Orta paneller, 37 °C'de 20 dakika kuluçkadan sonra ECT görünümünü örneklendirir. Alt paneller, kutuplardan çıkarılan hazırlıktan sonra ECT 24 h'nin sıkıştırma durumunu örneklendirir. (A) İlk 24 saat boyunca iki kutup arasında uygun AİHM oluşumu( B-D) Uygun AİHM oluşumunu engelleyen pipetleme hataları örnekleri. Beyaz ve siyah oklar, yanlış döküm nedeniyle AİHM'nin yapısal kusurlarına işaret eder. Ölçek çubuğu: 5 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- 48 kuyulu döküm plakasını hücre kültürü inkübatörünün içine dikkatlice yerleştirin ve ECT hidrojel karışımının 15-30 dakika boyunca yeniden inşalanmasını sağlayın. İnkübasyondan sonra jel benzeri ve opak görünecektir (Şekil 3, orta panel).
- Doku bozulmasına neden olabileceğinden, kültür ortamını doğrudan oluşturan EKT'ye pipetlemeden kuyu başına 600 μL 37 °C sıcak FGM ekleyin. Kültür ortamını kuyu duvarı boyunca yavaşça ekleyin, çünkü bu noktada AİHM de alttan ayrılmamalıdır (Şekil 4).
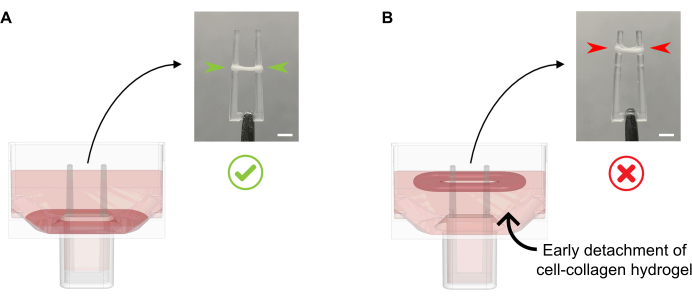
Şekil 4: Kültür ortamının yeni dökülen EKT'ye uygun ve yanlış eklenmesi. (A) İlk EKT katılaştırmadan sonra (dökümden 20 dk sonra) kültür ortamı eklenirken, yoğuşma EKT kuyunun dibinde bozulmadan bırakılmalıdır. Sonraki 24 saat boyunca, hücre güdümlü matris sıkıştırması ECT'nin rampaya kaymasını sağlayacaktır. Son EİHm pozisyonu, tanımlanmış bir kutup yüksekliğinde içbükey boşluklarla kontrol edilir; bu, paralel AİHM kültüründe kutup bükme etkinliğinin karşılaştırılmasına izin vermek için tüm EKT'lerin aynı konuma yerleşmesini sağlar. (B) Kültür ortamını çok hızlı eklerken alttan ayrılmış EKT oluşturmak. Yüzen ECT, üst kültür orta düzeyinde sıkıştırır. AİHM farklı pozisyonlara yerleşirse direk sözleşme kuvvetleri doğrudan karşılaştırılamaz. Ölçek çubuğu: 2 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- 24 saat kuluçkaya yaslanın.
- Analize kadar ortamı her gün 500 μL FGM ile değiştirin.
NOT: Hücreden bağımsız jelleşmenin ilk aşamasından sonra, insan CF'si ECT hidrojel karışımını daha da sıkıştırmaya başlar. 24 saat içinde, ECT özellikle sıkıştırılmış görünmeli ve esnek kutuplarda tutulduğu seviyeye yükseltilmelidir (Şekil 3 ve Şekil 4A).
4. Kesit alanı (CSA) (EKT başına 5 dk) ölçerek EKT sıkıştırmasını değerlendirmek.
NOT: Doku sıkışması kollajen montajından hemen sonra başlar ve özellikle ilk saatlerde önemlidir. Sıkıştırma, esas olarak matrisin doku uzun eksenine dik olarak hücre güdümlü sıkıştırılmasıyla tetiklenen değişiklikleri açıklar. Bu parametre, EKT'nin kesit alanı (CSA) belirlenerek değerlendirilir.
- İstenilen zaman noktalarında, AİHM'nin üst ve yan görünümlerinin makroskopik görüntülerini kaydetmek için bir stereo mikroskop kullanın (Şekil 5C).
NOT: AİHM, 48 kuyulu döküm plakasının kült kuyularının içinde görüntülenebilir. Alternatif olarak, GÖRÜNTÜLEME için ECT'yi net bir alt çok kuyulu plakaya aktarın. Kutuplardaki AİHM'nin ön yük kaybına yol açanları çıkarmak olarak görüntülenmesi tavsiye edilir ve sonuç olarak, kısa bir süre içinde doku, boyut analizleri için uygun görüntülemeyi engelleyebilecek gerginlik salınımı nedeniyle nihai burulma ile daha fazla kasılabilir. - Hat tarama çözümlemesi gerçekleştirmek için görüntü işleme programı kullanın. Bir ölçek ayarlayın ve her görüntüleme düzleminde kol başına en az 6 konumdaKI EKT çaplarını izlemek ve ölçmek için Düz Çizgi aracını kullanın (Şekil 5B,C).
- Üst ve yan görünüm düzlemlerinden ortalama çapı hesaplayın ve eliptik alan denklemine göre CSA'yı hesaplayın:


Şekil 5: Kesitsel alan (CSA) analizi ile zaman içinde EKT sıkıştırmanın izlenmesi. ECT, insan CF ve kollajen tipi I kullanılarak üretildi ve 5 gün boyunca iki esnek kutup etrafında kültürlendi. (A) 5 gün süre ile esnek kalıplara yerleştirilen kontrol EKT'nin temsili görüntüleri sunulur. Ölçek çubuğu = 5 mm. Bu tür parlak alan görüntüleri, doku kasılmasını tahmin etmek için kutup saptırma varyasyonunu belirlemek için de kullanılabilir. (B) Bir EKT'nin kesit alanının şematik gösterimi (yeşilde üst görünüm çapı ve pembe yan görünüm çapı). (C) Bir görüntü işleme programı kullanılarak doku çaplarının çizgi tarama analizinin stereomikroskop ve muhabir örneği ile elde edilen bir EKT'nin üst ve yan görünümlerinin makroskopik görüntüleri. Ölçek çubuğu = 2 mm. Ortalama çaplar, her görünüm planında ölçülen tüm satır uzunluklarının ortalamasından hesaplanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Kutup saptırma analizi ile ECT daralmanın izlenmesi (48 kuyu döküm plakası başına 15 dk).
NOT: EKT kültürü genellikle 5 gün boyunca gerçekleştirilir, ancak en az 20 güne kadar daha uzatılabilir. Kutup sapması, hücre kasılma kuvvetinin dokunun uzun ekseni boyunca gerginlik yönünde yönlendirdİğİ doku kasılması nedeniyle meydana gelir. AİHM daralmasının değerlendirilmesi kültür sırasında herhangi bir günde görüntüleme ile yapılabilir.
- 48 kuyulu döküm plakasını, sabit bir mesafeye yerleştirilmiş entegre alan tarama kamerasına sahip bir kayıt cihazının altına, yüksek çözünürlüklü (≥ 5 mega piksel) tek renkli görüntü sensörü ile donatın.
- Kontrastı en üst düzeye çıkarmak ve böylece floresan boya içerdikleri için kutupların uçlarının otomatik olarak algılanmasını kolaylaştırmak için UV'ye yakın (~390 nm) bir ışık kaynağı kullanın (Şekil 6A,C). Varsa, görüntü bozulmalarını en aza indirdiği için görüntüleme için telesantrik lensler önerilir.
NOT: Alternatif olarak, analiz için tek kuyulardan veya bir ölçek çubuğu eşliğinde tam plakadan makroskopik parlak alan görüntüleri kullanılabilir (Şekil 5A).
- Kontrastı en üst düzeye çıkarmak ve böylece floresan boya içerdikleri için kutupların uçlarının otomatik olarak algılanmasını kolaylaştırmak için UV'ye yakın (~390 nm) bir ışık kaynağı kullanın (Şekil 6A,C). Varsa, görüntü bozulmalarını en aza indirdiği için görüntüleme için telesantrik lensler önerilir.
- Karanlık bir arka plan üzerinde yüksek kontrastlı parlak pikselleri algılayabilen yazılımda kaydedilmiş görüntüler çalıştırarak bir görüntü işleme programı veya otomatik analiz kullanarak kutuplar arasındaki günlük kayıtlardan (Şekil 6C,D) uzaklığı ölçün.
- Sıfırın altındaki başlangıç mesafesine kıyasla kutup mesafesinin değişimi yoluyla kutup sapmasını hesaplayın.
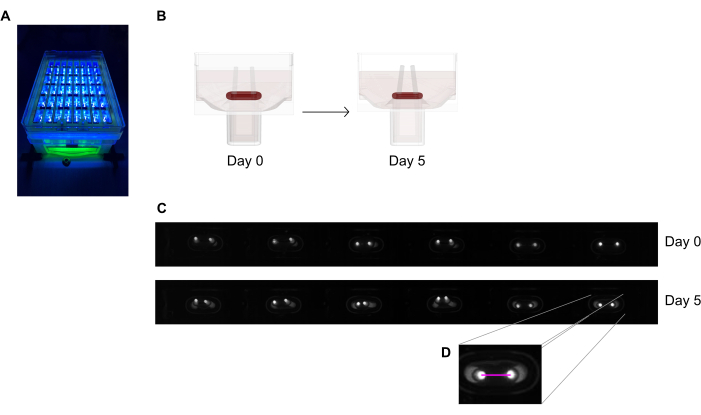
Şekil 6: Doku kasılmalarının kutup saptırmaya göre değerlendirilmesine şematik genel bakış. (A) 48 kuyulu döküm plakasındaki floresan direklerin UV'ye yakın ışık uyarılma altında örnek yüksek çözünürlüklü kaydı. Bu yöntem, daha hassas kutup ucu otomatik izleme için parlak alan resimleri yerine tercih edilir. (B) Şematik çizimler, ECT sıkıştırma ve daralmanın kutup bükmeye nasıl yol açtığını göstermektedir. (C) Dökümden sonraki 0. ve 5. günde aynı plakanın örnek bir sırası. D. Yakın çekim, bir görüntü işleme programı kullanarak kutuplar arasındaki mesafenin (pembe çizgi) nasıl ölçüldür olduğunu gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
NOT: Parlak uç görüntüsü ile ölçülen kutup saptırmanın, görüntüleme düzlemlerindeki farklılık nedeniyle doku kasılmasının sadece bir tahmini olduğunu düşünün. Ayrıca, doku kültürü sırasında TGF-β1 gibi pro-fibrotik maddelerin uygulanmasının EKT sıkışmasını ve kasılmasını artırdığını ve sonuçta erken doku bozulmasına yol açabileceğini unutmayın.
6. Yıkıcı çekme ölçümü ve gerilme gerinim analizi ile ECT'nin sertlik ve diğer biyomekanik özelliklerinin değerlendirilmesi (EKT başına 20 dk)
NOT: En uygun gerilme gerinim eğrisi üç bölgeyi görüntüleyebilir: baş aşağı bölgesi, elastik bölge ve plastik bölge. Şekil 7'de bir EKT gerinim-gerinim eğrisi örneği gösterilmiştir. Bir gerilme-gerinim eğrisinin analizi, dokunun sertlik, maksimum mukavemet, elastikiyet, plastisite, genişletilebilirlik, esneklik ve tokluk gibi önemli biyomekanik parametrelerinin çıkarılmasını sağlar.
- Hasat ECT önce sedye çekerek, ECT dahil, kuyusundan, uzunlayıp kullanarak. Sedye daha sonra tabanında tutulabilir ve AİHM ince bir kanca veya pipet ucu kullanarak sedye uçlarının üzerinden kaymıştır.
- ECT'yi sabit kola ve PBS ile dolu 37 °C temperli organ banyosu (özel yapım) ile donatılmış uzatmalı dinamik mekanik analiz (DMA) reometresinin dönüştürücü koluna kenetlenmiş iki kancaya aktarın (Şekil 7A).
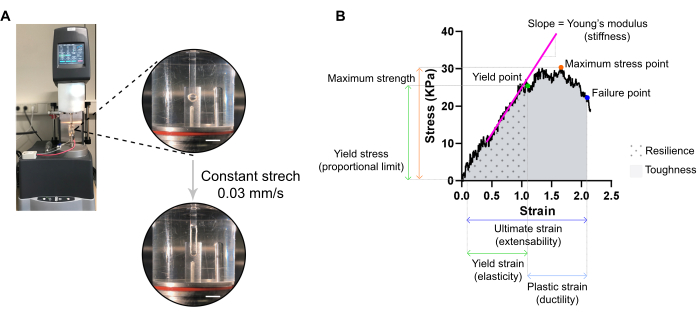
Şekil 7: AİHM yıkıcı çekme ölçüm analizi. (A) Uzatmalı dinamik mekanik analiz (DMA) reometresinde reolojik yıkıcı çekme ölçümü. Üst yüksek güç görünümü: L0'de bir çevre odasına monte edildikten ve stres-gerinim analizleri için bir üst ve alt direğe bağlandıktan sonra EKT. Alt yüksek güç görünümü: ECT, nihai gerilmedeki arıza noktasına kadar sabit bir hızda 0,03 mm/sn gerilir. Ölçek çubukları = 5 mm. (B) Ölçülen ana parametreleri gösteren bir EKT'nin gerilme gerilme diyagramı. Elastik bölgenin üst sınırı verim noktasına karşılık gelir ve plastik bölge verim noktası ile arıza noktası (süneklik) arasında oluşur. Elastik bölgenin doğrusal fazının eğimi, Young'ın doku sertliğini yansıtan modülüne karşılık gelir. Maksimum güç, bir dokunun dayanabileceği maksimum gerilme stresine karşılık gelir. Lif mikrofracturingi nedeniyle, doku başarısızlık noktasına ulaşana kadar stres azalır. Bu, dokunun yırtılması nedeniyle ani bir stres düşüşünün gözlendiği nihai zorlanmada (genişletilebilirlik) meydana gelir. Esneklik, kalıcı deformasyondan önce doku tarafından emilen enerjiye (kJ/m3) karşılık gelir (verim noktasına kadar) ve eğrinin (AUC) altındaki alan tarafından verim noktası zorlanmasına kadar verilir. Tokluk, dokunun yırtılana kadar emebileceği toplam enerjiye (kJ/m3) karşılık gelir ve AUC tarafından nihai zorlanmaya kadar verilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Tek eksenel gerilimi, kancalar arasındaki başlangıç mesafesinin yaklaşık % 1'i kadar sabit doğrusal hızda uygulayacak şekilde reometreyi ayarlayın. Tipik EKT boyutlarıyla 0,03 mm/s sabit bir esneme hızı kullanılabilir. Dönüştürücünün darasının, streç başlatın ve ECT yırtılma noktasına kadar kaydedin.
DİkKAT: Veri normalleştirme için CSA gerektiğinden, gerilme testinden önce ECT'nin makroskopik resimleri (adım 4.1.) kaydedilmelidir.
NOT: CSA hesaplaması da dahil olmak üzere gerilme gerinim analizi, gerilme testi sırasında daha sonra işlenebilir. Verileri analiz etmek için bir elektronik tablo yazılımı ve istatistiksel bir analiz yazılımı kullanın. - Stres değerlerini (kPa) elde etmek için ölçülen kuvvet değerlerini (mN) CSA'sı (mm2) ile ECT başına normalleştirin.
- XY grafiğinde gerilim değerlerini zorlanmaya (üst ve alt kanca arasındaki bağıl mesafenin verdiği geometrik doku deformasyon ölçüsü) karşı çizin.
NOT: Germe başlamadan hemen önce dokunun başlangıç uzunluğu (üst ve alt kanca arasındaki mesafe), L0, manuel olarak ayarlanmalıdır ve ayak başlağı bölgesinin başlangıcına karşılık gelir (ayak başlağı bölgesi doku özelliklerine bağlı olarak mevcut olmayabilir). Her gerinim noktası değeri, Ltotal'ın her ölçüm noktasındaki toplam boşluk olduğu denkleme göre hesaplanmalıdır: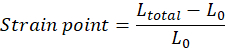
Verileri çizerken, arka plan çıkarma için seçili L0'daki stres değerini kullanın. - Gerilim-gerinim eğrisinden farklı biyomekanik parametreleri belirleyin (örnek olarak Şekil 7B'yi kullanın).
NOT: Gerilme gerinim eğrisi üç bölgeyi görüntüleyebilir: başsayısı, elastik ve plastik bölgeler. Elastik bölgenin üst sınırı, doku mikro çatlak yapmaya başlamadan önce, verim noktasına karşılık gelir ve suşu doku elastikiyetinin bir ölçüsüdür. Plastik bölge verim noktası ile arıza noktası arasında oluşur. Daha sonraki nokta, dokunun yırtılması nedeniyle ani bir stres düşüşüne karşılık gelir ve doku genişletilebilirliğinin bir ölçüsü olan nihai lekeyi tanımlar. Üçüncü ölçüm noktası, dokunun esneme sırasında kırılmadan taşıyabileceği en yüksek stresle tanımlanan maksimum güce karşılık gelir. Eğrinin altındaki alan tarafından verilen esneklik ve tokluk, doku tarafından emilen enerjiye sırasıyla verim noktasına ve başarısızlık noktasına kadar karşılık gelir. Elde edilen her eğri için, elastik bölgenin doğrusal kısmının eğimi, Elastik modül olarak da bilinen Young modülüne karşılık gelir ve dokunun sertliğini ölçen mekanik bir özelliktir.- Her eğriden verim noktasının, hata noktasının ve maksimum gerilme noktasının XY değerlerini (sırasıyla gerinim ve gerinim) çıkarın.
- Her EKT'nin modülünün (kPa = mN·mm-2'deki sertlik) elastik bölgenin doğrusal kısmının eğiminden o bölgenin doğrusal bir regresyonunu çizerek değerlendirin.
- Eğrinin (AUC) altındaki alanı hesaplamak için sırasıyla verim noktasına ve hata noktasına kadar hem dayanıklılığı hem de tokluğu belirlemek için istatistiksel bir program kullanın. AUC'yi yamuk yöntemiyle hesapla. Taban çizgisini sıfır olarak ayarlayın ve yalnızca taban çizgisinin üstündeki tepeleri göz önünde bulundurun;
NOT: Esneklik ve tokluk modülü, σ stres (kPa) ve ε gerinim (L/ΔL, mm/mm) olduğu σ × ε tarafından verilir. Bu nedenle, esneklik ve tokluk, kalıcı deformasyondan önce ve yırtılana kadar doku tarafından emilen kJ/m3 'teki enerjidir (kPa = kN·m-2 = kN·m·m-3 = kJ/m·m·m-3).
Sonuçlar
ECT, ilk 24 saat içindeki ilk hücre kollajen hidrojel hacmine kıyasla yaklaşık% 95 sıkıştırmaya ulaşır. Kontrol koşulları altında ve FCS varlığında doku sıkışması ve kasılması dökümden birkaç saat sonra ortaya çıkar ve özellikle 5. güne kadar artar (Şekil 5A). Kutup sapması takip eden 15 gün boyunca daha da artabilir (20 gün test edilen en uzun süreydi). Kutup saptırma büyüklüğü hücre tipine, hücre durumuna ve hücre ve doku kültürü koşullarına...
Tartışmalar
Sunulan protokol, bu hücrelerin hücre dışı matris ortamları üzerindeki mekanik etkisinin incelenmesine izin veren birincil insan CF'sinden EKT'nin üretilmesini açıklar.
Planlanan EKT deneyleri (0,75 x 106 hücre/EKT) için yeterli hücre elde etmek için fibroblastların genişletilmesi gerekir. En iyi tekrarlanabilirlik için, 2D monolayer kültüründe kültür öncesi dondurulmuş veya dokudan türetilmiş fibroblastların, her pasajda % 80'e kadar standartlaştırılm?...
Açıklamalar
GLS ve SL taslağı hazırladı. Tüm yazarlar protokol gelişimine katkıda bulundu ve makaleyi düzenledi. TM, MT ve WHZ, sayısız GmbH'nin bilimsel danışmanlarıdır.
Teşekkürler
Bu çalışma Alman Kardiyak Derneği (GLS için DGK Araştırma Bursu) ve Alman Araştırma Vakfı (DFG tarafından GLS ve AD için IRTG 1816 projesi aracılığıyla desteklenmiştir; MT için DFG 417880571 ve DFG TI 956/1-1; MT ve WHZ için SFB 1002 TP C04; WHZ için SFB 1002 TP S01; ve WHZ için EXC 2067/1-390729940J). WHZ, IndiHEART projesi aracılığıyla Alman Federal Bilim ve Eğitim Bakanlığı (BMBF) ve Fondation Leducq (20CVD04) tarafından desteklenmektedir. MT, WHZ ve SL, Alman Kardiyovasküler Araştırmalar Merkezi (DZHK) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Referanslar
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force--Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır