Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Tejido conectivo de ingeniería humana derivado de fibroblastos para aplicaciones de detección
En este artículo
Resumen
Aquí se presenta un protocolo para generar tejidos conectivos diseñados para un cultivo paralelo de 48 tejidos en una placa de múltiples pocillos con polos dobles, adecuado para estudios mecanicistas, modelado de enfermedades y aplicaciones de detección. El protocolo es compatible con fibroblastos de diferentes órganos y especies y se ejemplifica aquí con fibroblastos cardíacos primarios humanos.
Resumen
Los fibroblastos son células fenotípicamente altamente dinámicas, que se transdiferencian rápidamente en miofibroblastos en respuesta a estímulos bioquímicos y biomecánicos. La comprensión actual de los procesos fibróticos, incluida la fibrosis cardíaca, sigue siendo deficiente, lo que dificulta el desarrollo de nuevas terapias antifibróticas. Los sistemas de modelos humanos controlables y confiables son cruciales para una mejor comprensión de la patología de la fibrosis. Este es un protocolo altamente reproducible y escalable para generar tejidos conectivos (TEC) diseñados en una placa de fundición de 48 pocillos para facilitar los estudios de fibroblastos y la fisiopatología del tejido fibrótico en un entorno tridimensional (3D). Los ECT se generan alrededor de los polos con rigidez sintonizable, lo que permite estudios bajo una carga biomecánica definida. Bajo las condiciones de carga definidas, se pueden estudiar adaptaciones fenotípicas controladas por interacciones célula-matriz. Las pruebas paralelas son factibles en el formato de 48 pocillos con la oportunidad de analizar el curso de tiempo de múltiples parámetros, como la compactación y contracción del tejido contra la carga. A partir de estos parámetros, se pueden estudiar propiedades biomecánicas como la rigidez y elasticidad de los tejidos.
Introducción
Un obstáculo importante en el estudio de las enfermedades fibróticas es la falta de modelos representativos de tejidos humanos en 3D que proporcionen información sobre el comportamiento de los fibroblastos y sus derivados patológicos. Para estudiar los procesos fibróticos, los sistemas de cultivo 2D estándar son subóptimos, ya que los fibroblastos aislados se transdiferencian rápidamente en miofibroblastos que expresan actina del músculo α liso (AME) cuando se cultivan en sustratos 2D no conformes1,2,3. Por lo tanto, los fibroblastos en el cultivo 2D estándar no reflejan un fenotipo tisular "sano" regular3,4,5,6. Se han introducido cultivos sobre sustratos flexibles para simular ambientes tisulares no fibróticos (10 kPa) y fibróticos (35 kPa)7, pero estos carecen de la tercera dimensión, que es muy importante con respecto a la fisiopatología. La ingeniería de tejidos brinda la oportunidad de superar esta limitación al permitir el cultivo de fibroblastos en un contexto de matriz extracelular (ECM) definido y experimentalmente sintonizable, por ejemplo, por alteraciones en la celularidad, la composición de ECM y la concentración de ECM, todo lo cual puede determinar la biomecánica del tejido.
Se han generado varios modelos 3D utilizando fibroblastos. Los discos flotantes y las microesferas estuvieron entre los primeros y demuestran que el colágeno se remodela y compacta de una manera dependiente del tiempo. Los fibroblastos ejercen fuerzas de tracción sobre las fibrillas de colágeno, un proceso que puede facilitarse mediante la adición de agentes profibróticos como el factor de crecimiento transformador beta 1 (TGF-β1)8,9,10,11,12,13,14,15,16. Sin embargo, los cultivos que flotan libremente no permiten la carga externa controlada y, por lo tanto, constituyen modelos que se encogen o compactan continuamente. Los tejidos diseñados en forma de lámina abrieron la posibilidad de estudiar la regulación homeostática de las propiedades biomecánicas de los tejidos, es decir, a través de pruebas de deformación uni, bi, multiaxial o cíclica.17,18,19,20. Estos modelos se han utilizado, por ejemplo, para demostrar la influencia del número de células en la rigidez del tejido, que se encontró que se correlaciona positivamente con la integridad del citoesqueleto y la contractilidad del citoesqueleto de actomiosina.18,19. Sin embargo, es importante tener en cuenta que las conversiones de fuerza a deformación se complican por la deformación no uniforme del tejido alrededor de los puntos de sujeción de los transductores de fuerza y los puntos de anclaje. Esta limitación inherente puede ser evitada por tejidos de hueso de perro o en forma de anillo, ofreciendo cierta aplicación de tejidos en los puntos de anclaje.21,22,23. Los tejidos en forma de anillo se pueden preparar distribuyendo un hidrogel de colágeno celular en moldes en forma de anillo. A medida que el hidrogel se compacta, se forma un tejido alrededor de la varilla interna incompresible del molde, que ofrece resistencia para una mayor contracción del tejido.24,25,26,27. Después de la compactación inicial y típicamente máxima, los tejidos también pueden transferirse a espaciadores ajustables para restringir aún más la TEC circular a una longitud de tejido definida.3,24,25,26,27,28,29,30. Las propiedades biofísicas pueden evaluarse en dispositivos estándar de tensión por deformación horizontal o vertical con células de carga adecuadas bajo deformación unidireccional o dinámica3. Como los tejidos tienen una estructura circular en gran medida uniforme y se pueden sostener en barras / ganchos (puntos de anclaje y / o transductores de fuerza), aunque estos aún pueden encerrar áreas de compresión alrededor de las barras de carga, este formato permite una variación de deformación más uniforme en comparación con el sujeción.3. Además, los tejidos anclados provocan una forma de célula bipolar, y las células se adaptan a las fuerzas del tejido por elongación a lo largo de las líneas de fuerza que promueven la tracción anisotrópica.31,32,33,34,35,36. Anteriormente hemos aplicado TEC en forma de anillo de fibroblastos cardíacos (FQ) de rata y humanos alrededor de un solo polo rígido en experimentos funcionales de tensión y tensión y hemos realizado estudios de ganancia y pérdida de función mediante el uso de fibroblastos transducidos viralmente.24,25,26 y estudios farmacológicos37. Además, pudimos identificar diferencias de sexo en la fibrosis mediada por FQ en el modelo de TEC27.
El siguiente protocolo para la generación de TEC humana, ejemplificado con la FQ humana primaria obtenida como FQ criopreservada de proveedores comerciales (ver Tabla de Materiales), combina las ventajas de los tejidos en forma de anillo con una forma fácil y rápida de producir tejidos macroscópicos para una plataforma de 48 pocillos diseñada para pruebas paralelas de alto contenido.
Es importante destacar que el modelo TEC no se restringe a un tipo específico de fibroblastos, con el uso documentado en la investigación de otros fibroblastos, por ejemplo, fibroblastos cutáneos38,39. Además, los fibroblastos de las biopsias del paciente funcionan igualmente bien, y la elección de los fibroblastos depende en última instancia de la cuestión científica que se debe abordar.
La plataforma utilizada para la generación de TEC descrita en este protocolo es una placa de cultivo de células/tejidos 3D de 48 pocillos disponible comercialmente (Figura 1A). Se describen los métodos para la preparación, el cultivo y el monitoreo de la formación y función de ECT bajo una geometría definida y carga mecánica con la ayuda de la placa de 48 pocillos. Los ECT formados se sujetan mediante postes flexibles integrados y la carga mecánica se puede ajustar de acuerdo con el propósito final mediante el uso de postes con diferente dureza (valor Shore A 36-89), influyendo en sus rigideces de flexión. Se recomiendan los polos con una orilla Un valor de 46. El protocolo es, además, compatible con un molde circular personalizado descrito anteriormente, donde el ECT se mantiene alrededor de una sola varilla rígida37. Las dimensiones de este molde se dan en la Figura 1B.
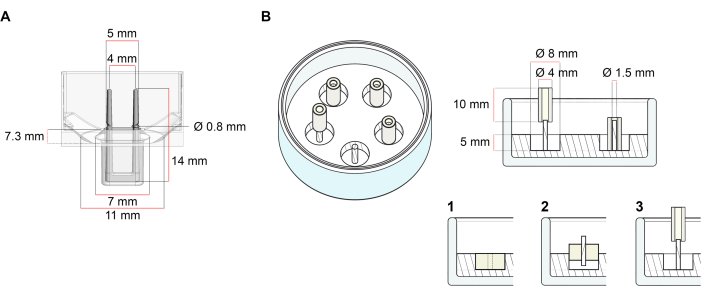
Figura 1: Representación esquemática de moldes de fundición. (A) Plano técnico y dimensiones de un molde de fundición con dos postes flexibles. El molde comprende una circunferencia interior delimitada por una pared corta que sostiene postes de retención dobles en el cuerpo principal del molde. Los polos flexibles tienen una distancia horizontal libre entre sí y están conectados en la base. El molde permite un volumen de fundición de 180 μL. El pozo de cada molde permite una capacidad de volumen de al menos 600 μL de medios de cultivo. Se pueden utilizar diferentes composiciones de materiales para producir postes con rigideces específicas (por ejemplo, TM5MED-TM9MED). (B) Dibujo técnico y dimensiones de un molde en forma de anillo con una sola varilla rígida. Se trata de un molde alternativo con geometría y entorno mecánico distintos, que se puede utilizar con el protocolo de fundición ECT37. El método de ensamblaje de moldes en forma de anillo se adaptó de formatos más grandes publicados28,41. En resumen, el método incluye (1) la impresión de espaciadores de moldeo de politetrafluoroetileno (PTFE) (8 mm de diámetro) en polidimetilsiloxano (PDMS, silicona) vertidos en platos de vidrio (diámetro 60 mm), y (2) la fijación de un soporte de poste PDMS (1,5 mm de diámetro) concéntricamente dentro de la cavidad hueca formada, que sirve para (3) sostener un poste extraíble (tubo de silicona de 4 mm de diámetro). El espacio hueco resultante permite 180 μL de volumen de fundición. Cada plato de vidrio puede contener múltiples moldes impresos (se muestra ejemplarmente con 5 moldes) y tiene la capacidad de hasta 5 ml de medio de cultivo. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Todos los pasos deben realizarse en campanas de bioseguridad de Clase II instaladas en laboratorios bajo nivel de contención 1. Dependiendo de las regulaciones locales y el tipo de manipulaciones que se realizarán, como la transferencia de genes mediada por virus, el nivel de contención debe aumentarse al nivel de bioseguridad 2 o 3. Todos los cultivos se mantienen a 37 °C en una incubadora de cultivo celular con una atmósfera humidificada de 5 % de CO2 en el aire. Tenga en cuenta que los volúmenes (pasos 1 y 2) se proporcionan para un matraz de cultivo celular T75. Ajuste los volúmenes a diferentes formatos de cultivo de acuerdo con las recomendaciones estándar de cultivo celular.
1. Descongelación y pre-recubrimiento de fibroblastos cardíacos primarios (FQ) para cultivo monocapa (5-12 días)
NOTA: Como alternativa, las células HFF-1 se pueden utilizar siguiendo el protocolo de subcultivo estándar según lo aconsejado por el proveedor.
- Prepare el medio de crecimiento de fibroblastos (MGF) de acuerdo con las instrucciones del fabricante. Opcionalmente, agregue antibióticos como 100 U/mL de penicilina y 100 mg/ml de estreptomicina. Permita la mezcla completa de todos los componentes antes de su uso. Conservar a 4 °C durante un máximo de 14 días.
- MGF caliente a 20-25 °C.
- Descongele la FQ criopreservada (idealmente conteniendo 1 x 106 a 2 x 106/ml de células por criovial) en un baño de agua a 37 °C durante aproximadamente 2 min, hasta que solo quede una pequeña cantidad de hielo en el vial.
- Utilizando una pipeta serológica de 2 ml, transfiera la suspensión celular gota a gota a un tubo de centrífuga estéril apropiado que contenga 10 ml de MGF. Para una recuperación celular óptima, enjuague el criovial con 1 ml de MGF y transfiéralo al tubo de la centrífuga. Como las células son muy sensibles en esta etapa, resuspenda usando una pipeta serológica con una punta de orificio para minimizar el daño celular por esfuerzo cortante.
NOTA: Si el medio de criopreservación contiene un alto porcentaje de DMSO, asegúrese de que después de la resuspensión celular en la MGF, el contenido de DMSO sea inferior al 1 %. Alternativamente, centrifugue las células resuspendidas a 300 x g durante 5 min a 20-25 °C para el intercambio de medio. Luego, aspire el sobrenadante con cuidado, gire el tubo para desalojar las células peletizadas y vuelva a suspenderlas en el volumen deseado de MGF para la siembra. - Sembrar 0,5 x 106 células en 12 ml de MGF en un matraz de cultivo celular T75. Si se utiliza otro material de laboratorio, ajuste el número de celda para mantener una densidad de siembra de 6,7 x 103/cm2.
- Reemplace la MGF cada dos días durante 5 días o hasta que las células alcancen el 80 % de confluencia.
NOTA: El rendimiento celular después de la expansión depende principalmente del tamaño celular y la tasa de proliferación, que puede diferir entre los donantes celulares. Por lo general, este procedimiento de cultivo estándar permite la recuperación de 4 x 106 a 5 x 106 CF de un matraz de cultivo celular T75 después de 5 días de cultivo.
2. Dispersión enzimática de la FQ humana (10-20 min)
NOTA: Este paso tiene como objetivo establecer una suspensión unicelular de la FQ humana tanto para las células monocapa de subcultivo como para la preparación de la TEC. Este protocolo ha sido optimizado para cultivos monocapa de FQ humana en pasajes 3-4. Para una estandarización óptima, se recomienda el subcultivo de CF en monocapa, al menos una vez antes de la preparación de la TEC. Este protocolo debe estar optimizado para fibroblastos procedentes de diferentes donantes y proveedores. Los protocolos alternativos de desprendimiento pueden implicar la sustitución de reactivos de disociación recombinantes basados en serina proteasa por, por ejemplo, aquellos que contienen enzimas proteolíticas y colagenolíticas.
- MGF caliente, PBS (libre de Ca2+/Mg2+) y reactivo de disociación celular a 20-25 °C.
- Aspirar el medio a partir de las células cultivadas.
- Lavar las células con 6 mL de PBS y aspirar.
- Agregue 6 ml del reactivo de disociación celular a las células e incube durante 3 min a 20-25 ° C hasta que las células comiencen a desprenderse visiblemente.
NOTA: Dependiendo de la fuente de FQ, esto puede tardar varios minutos más. Alternativamente, si las células no se desprenden a temperatura ambiente, incube a 37 °C para mejorar la actividad de las enzimas. Para garantizar una viabilidad celular óptima, monitoree el desprendimiento celular bajo el microscopio. - Neutralizar la actividad enzimática añadiendo 6-12 ml de MGF a las células desalojadas en el reactivo de disociación celular. Pipete suavemente hacia arriba y hacia abajo 4-8 veces usando una pipeta serológica de 10 ml para garantizar una suspensión de una sola célula y transfiera las células a un tubo de recolección fresco de 50 ml. Verifique el rendimiento con la ayuda de un microscopio y un hemocitómetro o un contador celular automatizado de acuerdo con las instrucciones del fabricante.
- Centrifugar la suspensión celular a 300 x g durante 5 min a 20-25 °C.
NOTA: Con el fin de alcanzar un rendimiento de células suficiente para la generación de la cantidad deseada de TEC, las células pueden ser subcultivadas en una dilución de hasta 1:6 para una mayor expansión. Deje que las células crezcan hasta alcanzar el 80 % de confluencia (aproximadamente 5-6 días), con el medio cambiando cada dos días. A continuación, repita la dispersión enzimática y continúe con el paso 2.7. para continuar con la preparación del TCE. - Aspire el sobrenadante y mueva el tubo para desalojar el pellet. Resuspend las células en la MGF a 20-25 °C para obtener una suspensión celular de ≥ 15 x 106/ml (aproximadamente un 40 % más de células de las requeridas para el paso 3.3.). Esto explica la pérdida celular debido al esfuerzo en el siguiente paso.
- Colar la suspensión celular a través de un colador celular de malla de 40 μm.
PRECAUCIÓN: Los aglomerados celulares son perjudiciales para la formación óptima de TEC. Cuando se utiliza el protocolo de dispersión enzimática de la FQ humana para fundir directamente la TEC, el esfuerzo de la suspensión celular garantiza la ausencia de grupos celulares principales que interfieren con la formación de tejido homogéneo. Las heterogeneidades comprometerán los análisis fiables de tensión-deformación. - Reconte el número de células y evalúe la viabilidad celular para garantizar un número de células fiable en una suspensión con ≥80 % de viabilidad para proceder con la preparación de la TEC.
- Utilice un contador de celdas automatizado para evaluar el número de celdas y la viabilidad por exclusión de corriente eléctrica.
- Alternativamente, use la prueba de exclusión de colorante azul de tripano (carcinógeno, categoría de peligro 2 - tome medidas de precaución), con la ayuda de un microscopio y un hemocitómetro para la identificación directa y enumeración de células vivas (membranas celulares intactas que excluyen el tinte) y muertas (membranas celulares comprometidas que permiten la unión del tinte a proteínas intracelulares).
- Reserve el tubo de recolección con suspensión celular a 20-25 °C y proceda inmediatamente con el paso 3.
3. Preparación ECT (1 h)
NOTA: La descripción general esquemática de la generación de ECT se describe en la Figura 2.
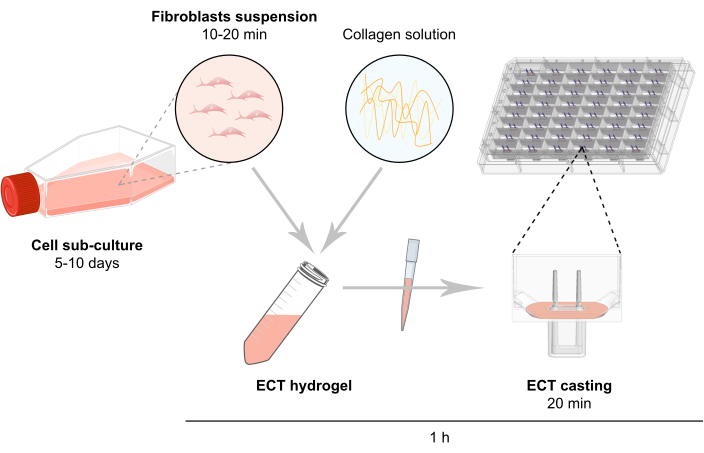
Figura 2: Visión general esquemática de la generación de ECT. Los fibroblastos se expanden en cultivo 2D antes de su uso en la generación de TEC. Después de 5-10 días, las células se dispersan enzimáticamente y la suspensión celular se reconstituye en una mezcla tamponada que contiene colágeno bovino tipo 1. La mezcla de hidrogel de colágeno celular se canaliza en pozos individuales en una placa de 48 pocillos para el cultivo de tejidos de ingeniería 3D, diseñada como moldes de fundición con dos polos flexibles para permitir la suspensión ECT a una longitud y carga definidas. La TEC generalmente se cultiva durante 1 a 20 días antes de las mediciones. Haga clic aquí para ver una versión más grande de esta figura.
- Preparar una solución madre de DMEM 10x disolviendo polvo de DMEM en ddH2O (134 mg/ml para la formulación especificada en la Tabla de Materiales) bajo una rotación constante a 37 °C durante 1 h. Esterilizar por filtración. El stock es estable durante un máximo de 14 días a 4 °C o -20 °C durante un máximo de 12 meses.
- Prepare recién 2x DMEM diluyendo una solución madre de DMEM 10x y agregando 20 % (v/v) FCS en ddH2O estéril. Opcionalmente, use antibióticos como 200 U/mL de penicilina y 200 mg/mL de estreptomicina. Consulte la Tabla 1 para los volúmenes de pipeteo. El stock es estable hasta 14 días a 4 °C.
NOTA: Realice los pasos 3.1. y 3.2. antes de comenzar la dispersión enzimática de las células (paso 2.) para la preparación de la TEC.
| Reactivo | Concentración final | Volumen (ml) |
| 10× DMEM | n/a | 2 |
| FCS | 20 % (v/v) | 2 |
| Penicilina | 200 U/ml | 0.2 |
| Estreptomicina | 200 mg/ml | 0.2 |
| ddH2O | n/a | 5.6 |
| Total | n/a | 10 |
Tabla 1: Composición de 2x DMEM.
PRECAUCIÓN: Todos los componentes de la mezcla de hidrogel celular-colágeno y los tubos de centrífuga deben mantenerse en hielo antes del uso. Esto ayudará a evitar que se produzca el autoensamblaje de colágeno antes de distribuir la mezcla de hidrogel de colágeno celular a través de los moldes de fundición.
- Sobre la base de la Tabla 2, ajuste la suspensión celular a una densidad de 8,88 x 106 células/ml añadiendo MGF a 20-25 °C a la suspensión celular a partir del paso 2.10. Luego, mueva el tubo de recolección con suspensión celular al hielo.
- Para preparar la mezcla de hidrogel ECT, enfríe previamente un tubo centrífugo de 50 ml sobre hielo y agréguele los diferentes componentes enumerados en la Tabla 2 en el siguiente orden, evitando la formación de burbujas de aire.
NOTA: El número máximo de ECT a preparar depende del número total de celdas determinado en el paso 2.9. Utilizar 0,3 mg de colágeno por TEC, obtenido de una solución madre que contiene 6-7 mg/ml. La concentración de la solución madre de colágeno determina el volumen necesario para obtener un contenido óptimo de colágeno ECT. Los volúmenes de los demás componentes del hidrogel ECT deberán adaptarse en consecuencia. Consulte la Tabla 2 para ver los volúmenes ajustados de acuerdo con una solución madre de colágeno de 6,49 mg/ml. Los volúmenes descritos en la Tabla 2 se utilizan en este protocolo como una guía ejemplar.- Pipetear el hidrogel ácido soluble en colágeno tipo 1 utilizando una pipeta serológica con una punta de orificio ancha.
- Ajuste el contenido de sal de la solución de colágeno agregando el DMEM 2x mientras se mezcla suavemente girando el tubo.
- Neutralice el pH agregando 0.2 M NaOH mientras mezcla suavemente girando el tubo. El indicador rojo fenol cambiará de amarillo a rojo.
NOTA: El volumen de NaOH debe ajustarse para cada lote de colágeno individual para la neutralización óptima del pH. La neutralización depende de factores como el tipo de tampón y la preparación, así como de la concentración absoluta de colágeno, y afecta al ensamblaje de la matriz de colágeno y a la viabilidad celular23,40. Una vez que el contenido iónico se incrementa por la adición de DMEM y el pH se neutraliza, el autoensamblaje de colágeno sigue y no debe interrumpirse. Por lo tanto, realice lo siguiente rápidamente y sin interrupciones. - Agregue la suspensión celular (del paso 3.3) gota a gota mientras mezcla suavemente girando el tubo.
| Número ECT: | 1 | 6 | 24 | 48 | |
| incluido el 10 % de excedente | |||||
| Componentes del hidrogel de colágeno celular: | (μL) | (μL) | (μL) | (μL) | |
| Stock de colágeno (6,49 mg/ml) | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 2× DMEM | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 0,2 M NaOH | 3.1 | 20.5 | 81.8 | 163.7 | |
| Mezcla celular en la MGF (8.88×106 celdas/ml) | 84.5 | 557.4 | 2229.7 | 4459.5 | |
| Volumen total (μL) | 180.0 | 1188.0 | 4752.0 | 9504.0 | |
| Esta es una tabla ejemplar para preparar un volumen de fundición de 180 μL por TEC, que contiene un total de 750.000 células y 0,3 mg de colágeno por TEC. | |||||
Cuadro 2: Preparación del hidrogel ECT (incluido un excedente del 10 % que tiene en cuenta los errores de pipeteo).
- Mezcle toda la suspensión canalizando suavemente hacia arriba y hacia abajo solo una vez, utilizando una pipeta serológica con una punta de orificio ancha para evitar la formación de burbujas y minimizar el esfuerzo cortante. Asegure la mezcla completa girando suavemente el tubo 10 veces y mantenga el tubo centrífugo de 50 ml que contiene la mezcla de hidrogel ECT en hielo durante todo el proceso de fundición.
- Moje previamente una punta de pipeta de 1 ml con mezcla de hidrogel ECT y distribuya 180 μL de ella uniformemente en cada molde de la placa de fundición de 48 pocillos, evitando fuerzas de cizallamiento excesivas que puedan afectar la integridad del ensamblaje de la matriz de colágeno y asegurando que toda la placa se realice en 15-20 min.
NOTA: El volumen de fundición recomendado es de 180 μL, pero se puede ampliar a 200 μL38. Por lo tanto, cuando se prefiere, los volúmenes de la Tabla 2 se pueden adaptar a 200 μL de una manera que mantenga las mismas concentraciones y la misma proporción entre las células y el colágeno.- Asegúrese de que se forma un bucle completo dentro del molde (Figura 3A). Si la mezcla de hidrogel ECT se aplica de forma discontinua, se evitará la formación completa de un anillo ECT (Figura 3B).
- Evitar el pipeteo en el pozo interior (Figura 3C) y la formación de burbujas durante el pipeteo (Figura 3D), para asegurar una formación de tejido homogénea y funcional.
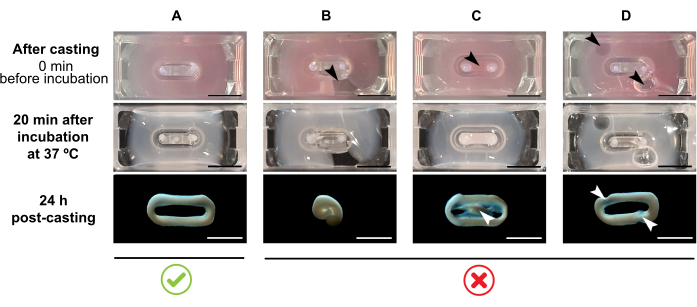
Figura 3: Fundición, formación de hidrogel y condensación ECT en formato multipocillo. Los paneles superiores ejemplifican la apariencia de ECT directamente después de la fundición. Los paneles centrales ejemplifican la aparición de TEC después de la incubación durante 20 minutos a 37 °C. Los paneles inferiores ejemplifican el estado de compactación de ECT 24 h después de la preparación, retirados de los polos. (A) Formación adecuada de ECT entre dos polos durante las primeras 24 h. (B-D) Ejemplos de errores de pipeteo que impiden la formación adecuada de ECT. Las flechas blancas y negras apuntan a defectos estructurales de ECT debido a una fundición inadecuada. Barra de escala: 5 mm. Haga clic aquí para ver una versión más grande de esta figura.
- Coloque cuidadosamente la placa de fundición de 48 pocillos dentro de la incubadora de cultivo celular y deje que la mezcla de hidrogel ECT se reconstituya durante 15-30 minutos. Después de la incubación, aparecerá similar a un gel y opaco (Figura 3, panel central).
- Agregue 600 μL de MGF caliente a 37 °C por pozo, sin pipetear el medio de cultivo directamente sobre la TEC en formación, ya que esto puede provocar la interrupción del tejido. Agregue suavemente el medio de cultivo a lo largo de la pared del pozo, ya que en este punto, el ECT tampoco debe separarse de la parte inferior (Figura 4).
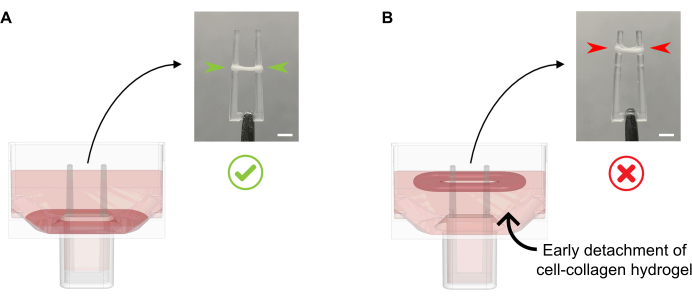
Figura 4: Adición adecuada e inadecuada del medio de cultivo al ECT recién fundido. (A) Al agregar el medio de cultivo después de la solidificación inicial de ECT (20 minutos después de la fundición), el ECT condensado debe dejarse sin perturbaciones en el fondo del pozo. Durante las próximas 24 h, la compactación de la matriz impulsada por células hará que el ECT se deslice por la rampa. La posición final del ECT está controlada por cavidades cóncavas a una altura de poste definida; esto asegura que todos los ECT se asienten en la misma posición para permitir una comparación de la actividad de flexión de polos en cultivo ECT paralelo. (B) Formar ECT separado de la parte inferior mientras se agrega el medio de cultivo demasiado rápido. El TEC flotante se compactará en el nivel medio de cultivo superior. Las fuerzas de contratación de polos no serán directamente comparables si el TCE se asienta en diferentes posiciones. Barra de escala: 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
- Incubar durante 24 h.
- Reemplace el medio todos los días a partir de entonces, con 500 μL de MGF hasta el análisis.
NOTA: Después de la fase inicial de gelificación independiente de la célula, la FQ humana comienza a compactar aún más la mezcla de hidrogel ECT. Dentro de las 24 h, el ECT debe aparecer notablemente compactado y elevado al nivel donde se mantiene en los polos flexibles (Figura 3 y Figura 4A).
4. Evaluación de la compactación ECT mediante la medición del área de sección transversal (CSA) (5 min por ECT).
NOTA: La compactación del tejido comienza inmediatamente después del ensamblaje del colágeno y es particularmente significativa durante las primeras horas. La compactación describe los cambios desencadenados principalmente por la compresión impulsada por la célula de la matriz perpendicularmente al eje largo del tejido. Este parámetro se evalúa determinando el área de sección transversal (CSA) del TCE.
- En los puntos de tiempo deseados, use un microscopio estereoscópico para grabar imágenes macroscópicas de las vistas superior y lateral del ECT (Figura 5C).
NOTA: El ECT se puede visualizar dentro de los pozos de cultivo de la placa de fundición de 48 pocillos. Alternativamente, transfiera el ECT a una placa de múltiples pocillos de fondo transparente para obtener imágenes. Se recomienda obtener imágenes de la TEC en los polos, ya que la eliminación de esos conduce a la pérdida de precarga y, en consecuencia, en un corto período de tiempo, el tejido puede contraerse aún más con una eventual torsión debido a la liberación de tensión, lo que puede dificultar la obtención de imágenes adecuadas para los análisis de dimensiones. - Utilice un programa de procesamiento de imágenes para realizar un análisis de escaneo de línea. Establezca una escala y utilice la herramienta Línea recta para trazar y medir los diámetros ECT a un mínimo de 6 posiciones por brazo en cada plano de imagen (Figura 5B,C).
- Calcule el diámetro medio de los planos de vista superior y lateral y calcule CSA de acuerdo con una ecuación de área elíptica:


Figura 5: Monitoreo de la compactación ECT a lo largo del tiempo mediante análisis de área transversal (CSA). La TEC se generó utilizando FQ humana y colágeno tipo I y se cultivó alrededor de dos polos flexibles durante 5 días. (A) Se presentan imágenes representativas de control ECT colocadas en moldes flexibles durante un tiempo de 5 días. Barra de escala = 5 mm. Tales imágenes de campo brillante también se pueden usar para determinar la variación de la deflexión del polo para estimar la contracción del tejido. (B) Representación esquemática del área de sección transversal de un ECT (diámetro de la vista superior en verde y diámetro de la vista lateral en rosa). (C) Imágenes macroscópicas de vistas superiores y laterales de un TEC obtenidas con un estereomicroscopio y un ejemplo correspondiente de análisis de escaneo de línea de los diámetros de los tejidos utilizando un programa de procesamiento de imágenes. Barra de escala = 2 mm. Los diámetros promediados se calculan a partir de la media de todas las longitudes de línea medidas en cada plano de vista. Haga clic aquí para ver una versión más grande de esta figura.
5. Monitoreo de la contracción ECT mediante análisis de deflexión de polos (15 min por placa de fundición de 48 pocillos).
NOTA: El cultivo de TEC generalmente se realiza durante 5 días, pero se puede extender aún más al menos hasta 20 días. La deflexión del polo ocurre debido a la contracción del tejido impulsada por la fuerza de contracción celular en la dirección de la tensión a lo largo del eje largo del tejido. La evaluación de la contracción de la TEC se puede realizar mediante imágenes en cualquier día durante el cultivo.
- Imagine la placa de fundición de 48 pocillos bajo un dispositivo de grabación con una cámara de escaneo de área integrada colocada a una distancia fija, equipada con un sensor de imagen monocromo de alta resolución (≥ 5 megapíxeles).
- Utilice una fuente de luz casi UV (~ 390 nm) para maximizar el contraste y facilitar así la detección automatizada de las puntas de los polos, ya que contienen un tinte fluorescente (Figura 6A, C). Si están disponibles, se recomiendan lentes telecéntricas para la obtención de imágenes, ya que minimizan las distorsiones de la imagen.
NOTA: Alternativamente, se pueden utilizar imágenes macroscópicas de campo brillante de pozos individuales o de la placa completa acompañadas de una barra de escala para el análisis (Figura 5A).
- Utilice una fuente de luz casi UV (~ 390 nm) para maximizar el contraste y facilitar así la detección automatizada de las puntas de los polos, ya que contienen un tinte fluorescente (Figura 6A, C). Si están disponibles, se recomiendan lentes telecéntricas para la obtención de imágenes, ya que minimizan las distorsiones de la imagen.
- Mida la distancia entre los polos de los registros diarios (Figura 6C, D) utilizando un programa de procesamiento de imágenes o análisis automatizado ejecutando imágenes grabadas en un software capaz de detectar píxeles brillantes de alto contraste sobre un fondo oscuro.
- Calcule la deflexión del polo a través de la variación de la distancia de los polos en comparación con la distancia inicial en el día cero.
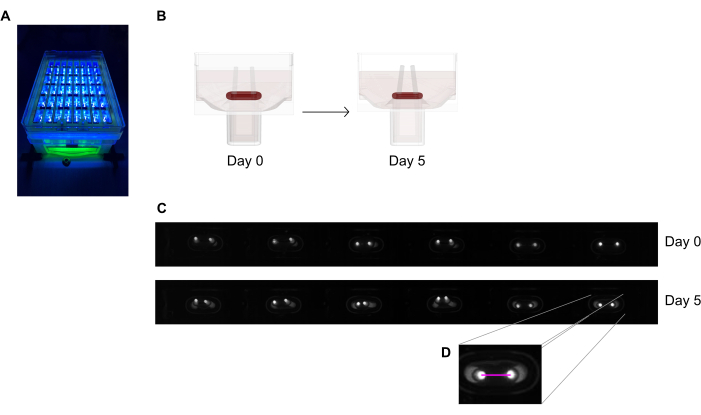
Figura 6: Descripción general esquemática de la evaluación de la contracción del tejido según la deflexión del polo. (A) Registro ejemplar de alta resolución de polos fluorescentes en la placa de fundición de 48 pocillos bajo excitación de luz uv cercana. Este método se prefiere a las imágenes de campo brillante para un rastreo automatizado de punta de poste más preciso. (B) Los dibujos esquemáticos demuestran cómo la compactación y contracción ECT conduce a la flexión de los polos. (C) Una fila ejemplar de la misma placa registra el día 0 y el día 5 después de la fundición. D. El primer plano muestra cómo medir la distancia (línea rosa) entre los polos utilizando un programa de procesamiento de imágenes. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: Considere que la deflexión del polo medida por la imagen de punta brillante es solo una estimación de la contracción del tejido debido a la diferencia en los planos de imagen. Además, tenga en cuenta que la aplicación de sustancias profibróticas como TGF-β1 durante el cultivo de tejidos mejora la compactación y contracción de la TEC y, en última instancia, puede conducir a una interrupción temprana del tejido.
6. Evaluación de la rigidez y otras propiedades biomecánicas de la TEC mediante medición destructiva de la tracción y análisis de tensión-deformación (20 min por ECT)
NOTA: Una curva óptima de tensión-deformación puede mostrar tres regiones: región del dedo del pie, región elástica y región plástica. En la Figura 7 se muestra un ejemplo de curva de tensión-deformación ECT. El análisis de una curva tensión-deformación permite extraer parámetros biomecánicos importantes del tejido como, por ejemplo, rigidez, máxima resistencia, elasticidad, plasticidad, extensibilidad, resiliencia y tenacidad.
- Cosecha ECT tirando primero de la camilla, incluyendo ECT, de su pozo, usando fórceps. La camilla se puede sostener en su base, y el ECT se desliza sobre las puntas de la camilla con un gancho fino o una punta de pipeta.
- Transfiera el ECT a dos ganchos sujetos al brazo estacionario y al brazo transductor de un reómetro de análisis mecánico dinámico extensional (DMA) equipado con un baño de órgano templado de 37 °C (hecho a medida) lleno de PBS (Figura 7A).
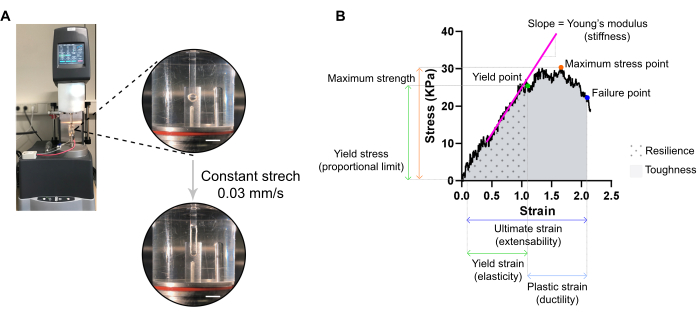
Figura 7: Análisis de medición de tracción destructiva ECT. (A) Medición de tracción destructiva reológica en un reómetro de análisis mecánico dinámico extensional (DMA). Vista superior de alta potencia: ECT después de montar en L0 en una cámara ambiental y conectado a un polo superior e inferior para análisis de tensión-deformación. Vista inferior de alta potencia: ECT tensado a una velocidad constante de 0,03 mm/s hasta el punto de falla en la tensión final. Barras de escala = 5 mm. (B) Diagrama de tensión-deformación de un ECT que muestra los principales parámetros medidos. El límite superior de la región elástica corresponde al punto de elasticidad y la región plástica se compone entre el punto de elasticidad y el punto de falla (ductilidad). La pendiente de la fase lineal de la región elástica corresponde al módulo de Young que refleja la rigidez del tejido. La resistencia máxima corresponde a la tensión de tracción máxima que un tejido puede soportar. Debido a la microfracturación de fibra, el estrés disminuye hasta que el tejido alcanza el punto de falla. Esto ocurre en la tensión final (extensibilidad) donde se observa una caída repentina del estrés debido a la ruptura del tejido. La resiliencia corresponde a la energía (kJ/m3) absorbida por el tejido antes de la deformación permanente (hasta el punto de rendimiento) y está dada por el área bajo la curva (AUC) hasta la tensión del punto de rendimiento. La tenacidad corresponde a la energía total (kJ/m3) que el tejido puede absorber hasta la ruptura y está dada por el AUC hasta la tensión final. Haga clic aquí para ver una versión más grande de esta figura.
- Ajuste el reómetro para aplicar tensión uniaxial a una velocidad lineal constante de aproximadamente el 1 % de la distancia inicial entre los ganchos por segundo. Se puede utilizar una velocidad de estiramiento constante de 0,03 mm/s con las dimensiones típicas de ECT. Tara del transductor, iniciar el estiramiento y grabar hasta el punto de ruptura de la TEC.
PRECAUCIÓN: Las imágenes macroscópicas de la TEC (paso 4.1.) deben registrarse antes de la prueba de tracción, ya que se requiere el CSA para la normalización de los datos.
NOTA: El análisis de tensión-deformación, incluido el cálculo de CSA, se puede procesar más tarde en el tiempo después de la prueba de tracción. Utilice un software de hoja de cálculo y un software de análisis estadístico para analizar los datos. - Normalizar los valores de fuerza medida (mN) por ECT por su CSA (mm2) para obtener valores de tensión (kPa).
- Trazar los valores de tensión contra la deformación (una medida geométrica de la deformación del tejido dada por la distancia relativa entre el gancho superior e inferior) en un gráfico XY.
NOTA: La longitud inicial del tejido (distancia entre el gancho superior e inferior) inmediatamente antes de que se produzca el estiramiento, L0, debe ajustarse manualmente y corresponde al comienzo de la región del dedo del pie (la región del dedo del pie puede estar ausente dependiendo de las propiedades del tejido). Cada valor de punto de deformación debe calcularse de acuerdo con la ecuación, en la que Ltotal es el espacio total en cada punto de medición: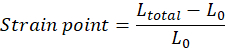
Al trazar los datos, utilice el valor de tensión en L0 seleccionado para la resta de fondo. - Determinar diferentes parámetros biomecánicos a partir de la curva tensión-deformación (use la Figura 7B como ejemplo).
NOTA: Una curva de tensión-deformación puede mostrar tres regiones: dedo del pie, elástica y regiones plásticas. El límite superior de la región elástica, antes de que el tejido comience la microfractura, corresponde al punto de elasticidad, y su tensión es una medida de la elasticidad del tejido. La región plástica se comprende entre el punto de rendimiento y el punto de falla. El punto posterior corresponde a una caída repentina del estrés debido a la ruptura del tejido, definiendo la tinción final, que es una medida de la extensibilidad del tejido. El tercer punto de medición corresponde a la fuerza máxima, que se define por la mayor tensión que el tejido puede soportar sin romperse durante el estiramiento. La resistencia y la tenacidad, dadas por el área bajo la curva, corresponden a la energía absorbida por el tejido hasta el punto de rendimiento y hasta el punto de falla, respectivamente. Para cada curva obtenida, la pendiente de la parte lineal de la región elástica corresponde al módulo de Young, también conocido como módulo elástico, y es una propiedad mecánica que mide la rigidez del tejido.- Extraiga de cada curva los valores XY (deformación y tensión, respectivamente) del punto de elasticidad, el punto de falla y el punto de tensión máximo.
- Evaluar el módulo de Young (rigidez en kPa = mN·mm-2) de cada ECT a partir de la pendiente de la parte lineal de la región elástica trazando una regresión lineal de esa región.
- Utilice un programa estadístico para calcular el área bajo la curva (AUC) para determinar tanto la resiliencia como la tenacidad, hasta el punto de rendimiento y el punto de falla, respectivamente. Calcular el AUC por el método trapezoidal. Establezca la línea de base en cero y considere solo los picos por encima de la línea de base, que son al menos el 10 % de la distancia desde el valor mínimo hasta el máximo en el eje Y.
NOTA: Los módulos de resiliencia y tenacidad vienen dados por σ × ε, donde σ es la tensión (kPa) y ε es la deformación (L/ΔL, mm/mm). Así, resiliencia y tenacidad son la energía en kJ/m3 (kPa = kN·m-2 = kN·m·m-3 = kJ/m·m·m-3 = kJ/m3) absorbida por el tejido antes de la deformación permanente y hasta la ruptura, respectivamente.
Resultados
La TEC alcanza alrededor del 95 % de compactación en comparación con el volumen inicial de hidrogel de colágeno celular dentro de las primeras 24 h. La compactación y contracción del tejido en condiciones de control y en presencia de FCS se produce unas horas después de la fundición y aumenta notablemente hasta el día 5 (Figura 5A). La deflexión del polo puede aumentar aún más durante los siguientes 15 días (20 días fue el tiempo más largo de prueba). La magnitud de la deflexi?...
Discusión
El protocolo presentado describe la generación de TEC a partir de la FQ humana primaria, lo que permite estudiar el impacto mecánico de estas células en su entorno de matriz extracelular y viceversa.
Los fibroblastos deben expandirse para producir suficientes células para los experimentos de TEC planificados (0,75 x 106 células / TEC). Para la mejor reproducibilidad, se aconseja precultivar fibroblastos congelados o derivados de tejidos en cultivo monocapa 2D durante una duraci...
Divulgaciones
GLS y SL redactaron el manuscrito. Todos los autores contribuyeron al desarrollo del protocolo y editaron el manuscrito. TM, MT y WHZ son asesores científicos de myriamed GmbH. WHZ es el fundador y accionista de myriamed GmbH.
Agradecimientos
Este trabajo fue apoyado por la Sociedad Alemana de Cardiología (DGK Research Fellowship for GLS) y por la Fundación Alemana de Investigación (DFG a través del proyecto IRTG 1816 para GLS y AD; DFG 417880571 y DFG TI 956/1-1 para MT; SFB 1002 TP C04 para MT y WHZ; SFB 1002 TP S01 para WHZ; y EXC 2067/1-390729940J para WHZ). WHZ cuenta con el apoyo del Ministerio Federal Alemán de Ciencia y Educación (BMBF a través del proyecto IndiHEART) y la Fundación Leducq (20CVD04). MT, WHZ y SL cuentan con el apoyo del Centro Alemán de Investigación Cardiovascular (DZHK).
Materiales
| Name | Company | Catalog Number | Comments |
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Referencias
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force--Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados