このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
スクリーニング用途のための線維芽細胞由来ヒト工学的結合組織
要約
ここで提示されるプロトコルは、機械研究、疾患モデリング、およびスクリーニング用途に適した、二重極を有するマルチウェルプレートで48組織の平行培養のための設計された結合組織を生成するプロトコルである。プロトコルは、異なる臓器や種からの線維芽細胞と互換性があり、ヒトの原発性心臓線維芽細胞とここで例示される。
要約
線維芽細胞は、生化学的および生体力学的刺激に応答して、すぐに筋線維芽細胞にトランスファ分化する、典型的に非常に動的な細胞である。心臓線維症を含む線維化プロセスの現在の理解は貧弱なままであり、新しい抗線維化療法の開発を妨げている。制御可能で信頼性の高いヒトモデルシステムは、線維症病理をよりよく理解するために重要です。これは、3次元(3D)環境における線維芽細胞および線維組織の病態生理学の研究を容易にするために、48ウェル鋳造板で設計された結合組織(ECT)を生成する高度に再現性と拡張性の高いプロトコルです。ECTは、調整可能な剛性を有する極の周りに生成され、定義された生体力学的負荷の下での研究を可能にする。定義された荷重条件の下で、細胞とマトリックスの相互作用によって制御される表述法の適応を検討することができる。並列テストは、負荷に対する組織圧縮や収縮などの複数のパラメータのタイムコース分析の機会を持つ48ウェル形式で実現可能です。これらのパラメータから、組織の剛性や弾力性などの生体力学的特性を検討することができる。
概要
線維性疾患の研究における大きな障害は、線維芽細胞とその病理学的誘導体の挙動に関する洞察を提供する代表的なヒト3D組織モデルの欠如である。繊維プロセスを研究するために、標準的な2D培養システムは、非準拠の2D基質上で培養した場合、分離繊維芽細胞がα平滑筋アクチン(SMA)に急速にトランス分化されるため、最適ではない。したがって、標準2D培養における線維芽細胞は、規則的な「健康な」組織表現型3、4、5、6を反映していない。柔軟な基質上の培養物は、非繊維性(10kPa)および繊維(35kPa)組織環境をシミュレートするために導入されているが、これらは、病態生理学に関して非常に重要である第3の次元を欠いている。組織工学は、定義された実験的に調整可能な細胞外マトリックス(ECM)コンテキストにおいて線維芽細胞培養を可能にすることによって、この限界を克服する機会を提供する。例えば、細胞性、ECM組成、およびECM濃度の変化によって、そのすべてが組織バイオメカニクスを決定することができる。
線維芽細胞を用いて様々な3Dモデルが生成されている。フローティングディスクとマイクロスフィアは、最初の一つであったし、コラーゲンが再モデリングされ、時間に依存して圧縮されていることを実証しました。線維芽細胞は、コラーゲン線維に対して牽引力を発揮し、成長因子-β1(TGF-β1)を変換するなどのプロ線維化剤の添加によって促進できるプロセスである。8,9,10,11,12,13,14,15,16.しかし、自由に浮動するカルチャでは、制御された外部ローディングが許可されないため、モデルの縮小や圧縮が連続的に行われます。シート状の工学的組織は、ユニ、バイ、多軸、または周期株試験を通じて、組織の生体力学的特性のホメオ静電気調節を研究する可能性を開いた17,18,19,20.これらのモデルは、例えば、細胞数が組織の剛性に及ぼす影響を実証するために使用されており、細胞骨格の完全性およびアトミオシン細胞骨格収縮と正の相関性を有することが判明した。18,19.ただし、力変換器とアンカーポイントのクランプポイントの周囲の不均一な組織変形によって、力と歪みへの変換が複雑であることに注意することが重要です。この固有の制限は、犬の骨やリング状の組織によってバイパスすることができ、アンカーポイントでいくつかの組織執行を提供します21,22,23.リング状の組織は、細胞コラーゲンヒドロゲルをリング型の金型に分散させることで作製できます。ヒドロゲルがコンパクト化するにつれて、組織は型の非圧縮性の内側の棒の周りに形成され、さらなる組織収縮のための抵抗性を提供する24,25,26,27.最初および典型的な最大圧縮の後、組織はまた、定義された組織の長さで円形ECTをさらに抑制するために調節可能なスペーサーに移すことができる3,24,25,26,27,28,29,30.生物物理学的特性は、単方向または動的歪みの下で適切なロードセルを備えた標準的な水平または垂直歪みストレスデバイスで評価することができます3.組織は大部分が均一な円形構造を持ち、バー/フック(アンカレッジポイントおよび/または力トランスデューサ)に保持することができるので、これらはまだローディングバーの周りの圧縮領域を囲むかもしれませんが、この形式はクランプと比較してより均一な歪みの変化を可能にします3.さらに、アンカー組織は双極細胞形状を惹起し、異方性牽引を促進する力線に沿った伸びによって細胞が組織力に適応する31,32,33,34,35,36.我々は以前、機能的ストレス株実験で単一の硬い極の周りにラットおよびヒト心臓線維芽細胞(CF)からリング状のECTを適用し、ウイルスに感染した線維芽細胞を使用して機能の利益と喪失の研究を行った24,25,26 および薬理学的研究37.さらに、ECTモデルにおけるCF媒介性線維症の性差を特定できる27.
商業ベンダーから凍結保存CFとして得られたヒトの一次CF( 資料表を参照)で得られたヒトECTの生成のための次のプロトコルは、リング状の組織の利点と、並列高コンテンツテスト用に設計された48ウェルプラットフォーム用の巨視組織を簡単かつ迅速に製造する方法を組み合わせたものです。
重要なことに、ECTモデルは、特定の線維芽細胞型に限定されず、他の線維芽細胞の調査における文書化された使用、例えば、皮膚線維芽細胞38,39である。さらに、患者の生検からの線維芽細胞も同様にうまく機能し、線維芽細胞の選択は最終的に取り組む科学的な質問に依存する。
このプロトコルに記載されたECTの生成に使用されるプラットフォームは、市販の48ウェル3D細胞/組織培養プレートである(図1A)。48ウェルプレートの助けを借りて、定義された幾何学と機械的負荷の下でECTの形成と機能を調製、培養、およびモニタリングするための方法が記載されています。形成されたECTは統合された適用可能な極によって握られ、機械負荷は異なった硬度の極(Shore A値36-89)を使用して、曲げ剛性に影響を与えることによって最終的な目的に従って微調整することができる。海岸の電柱 値は 46 です。プロトコルは、さらに、ECTが単一の堅いrod37の周りに保持される、以前に説明されたカスタム円形の金型と互換性がある。この金型の寸法は 図1Bに示されています。
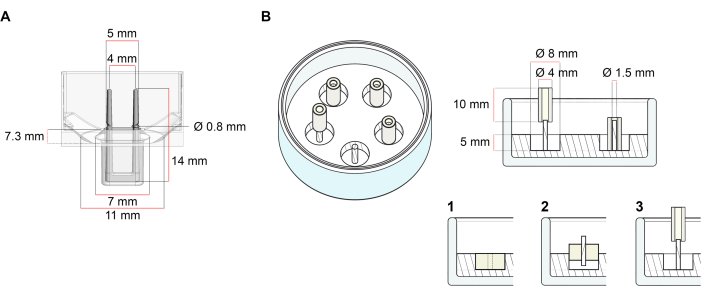
図1:鋳造金型の概略図 (A) 2つの柔軟なポールを持つ鋳造金型の技術図面と寸法。金型は、金型本体に二重保持極を保持する短い壁で区切られた内周を含みます。柔軟な極は互いに自由な水平距離を有し、基盤で接続されている。金型は180 μLの鋳造体積を可能にします。各金型のウェルは、少なくとも600 μLの培養培地の体積容量を可能にします。異なる材料組成物は、特定の剛性を有する極(例えば、TM5MED-TM9MED)を製造するために使用することができる。(B)技術的な図面と単一の硬いロッドを持つリング状の金型の寸法。これは、ECT鋳造プロトコル37で使用できる、明確な幾何学と機械環境を備えた代替金型です。リング状の金型組立方法は、公開された大きなフォーマット28,41から適応した。簡単に言えば、この方法は、(1)ポリテトラフルオロエチレン(PTFE)成形スペーサー(8mm径)をガラス皿に注いだポリジメチルシロキサン(PDMS、シリコーン)(直径60mm)、および(2)PDMSポールホルダー(直径1.5mm)を固定して、形成された中空空洞の内側に同心円状に固定し、(3)直径(3)を固定する。中空空間により、180 μLの鋳造体積が可能になります。各ガラス皿は、複数のインプリント型(例えば5つの金型で示される)をコンポートすることができ、培養培地の最大5 mLの容量を有する。この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
すべてのステップは、封じ込めレベル1の下の実験室に設置されたクラスIIバイオセーフティフードで行われなければなりません。ウイルス媒介遺伝子の移入など、現地の規制や実行する操作の種類に応じて、封じ込めレベルをバイオセーフティレベル2または3に引き上げる必要があります。全ての培養物は、空気中の5%CO2 の加湿雰囲気を有する細胞培養インキュベーターにおいて37°Cで維持される。なお、T75細胞培養フラスコについては、体積(ステップ1および2)が提供される。標準的な細胞培養の推奨事項に従って、異なる培養形式にボリュームを調整します。
1. 単層培養用の一次心臓線維芽細胞(CF)の解凍およびプレメッキ(5-12日)
注: 代わりに、HFF-1 セルは、サプライヤーから助言された標準的なサブカルチャー プロトコルに従って使用できます。
- メーカーの指示に従って繊維芽細胞増殖培地(FGM)を準備します。必要に応じて、100 U/mLペニシリンおよび100mg/mLストレプトマイシンなどの抗生物質を添加する。使用前にすべてのコンポーネントの完全な混合を許可します。4°Cで14日間保存します。
- 20-25 °CにFGMを温める。
- 37°Cの水浴中の凍結保存CF(理想的には1 x 106 〜2 x 106/mL細胞を含む)を約2分間解凍し、バイアルに少量の氷しか残さない。
- 2 mL血清学的ピペットを使用して、細胞懸濁液を10 mLのFGMを含む適切な無菌遠心分離管にドロップワイズして移す。最適な細胞検索のために、FGMの1 mLで極低温をすすいで遠心分離管に移します。細胞はこの段階で非常に敏感であるように、剪断応力による細胞損傷を最小にするためにボアチップを有する血清学的ピペットを使用して再中断する。
注: 凍結保存媒体に DMSO の割合が高い場合は、FGM でセルを再懸濁した後、DMSO の含有量が 1 % 未満であることを確認してください。あるいは、再懸濁した細胞を培地交換のために20〜25°Cで5分間5分間300xgで遠心分離する。次いで、上清を注意深く吸引し、チューブを旋回させてペレット化した細胞を外し、それらをFGMの所望の体積で再懸濁して播種する。 - T75細胞培養フラスコにFGMの12 mLで0.5 x 106 細胞をシードします。他のラボウェアを使用する場合は、セル番号を調整して、6.7 x 103/cm2 のシード密度を維持します。
- FGM を 5 日間、または細胞が 80 % の合流に達するまで、1 日おきに交換してください。
注:拡張後の細胞収量は、主に細胞サイズと増殖率に依存し、細胞ドナー間で異なる場合があります。典型的には、この標準的な培養手順は、培養5日後にT75細胞培養フラスコから4 x 106 〜5 x 106 CFを取得することを可能にする。
2. ヒトCFの酵素分散(10-20分)
注:このステップは、単層細胞の培養とECTの調製の両方に対して、ヒトCFの単一細胞懸濁液を確立することを目的としています。このプロトコルは、3-4の通路でヒトCF単層培養のために最適化されています。最適な標準化のために、ECT調製前に少なくとも1回は単層でCFを培養することをお勧めします。このプロトコルは、異なるドナーおよびベンダーから発生する線維芽細胞に対して最適化する必要があります。代替剥離プロトコルは、組換えセリンプロテアーゼベースの解離試薬を、例えば、タンパク質分解酵素およびコラージュ分解酵素を含むものと置き換えることを含む。
- 温かいFGM、PBS(Ca2+/Mg2+フリー)、および細胞解離試薬を20〜25°Cにする。
- 培養細胞から培地を吸引する。
- PBSと吸引の6 mLで細胞を洗浄します。
- 細胞解離試薬6 mLを細胞に加え、細胞が目に見えて剥離し始めるまで20〜25°Cで3分間インキュベートする。
注: CF ソースによっては、数分かかる場合があります。あるいは、細胞が室温で剥離しない場合は、37°Cでインキュベートして酵素の活性を向上させる。最適な細胞生存率を確保するために、顕微鏡下で細胞剥離を監視します。 - 細胞解離試薬中の解離細胞に6-12 mLのFGMを加えて酵素活性を中和する。10 mL血清ピペットを使用して4〜8回ピペットを軽く上下にして単一の細胞懸濁液を確保し、新鮮な50 mLのコレクションチューブに細胞を移します。メーカーの指示に従って、顕微鏡とヘモサイトメーターまたは自動セルカウンターの助けを借りて収量を確認します。
- 20〜25°Cで5分間300xgで細胞懸濁液を遠心分離する。
注:ECTの所望の量の生成に十分な細胞の収量に達するために、細胞はさらなる拡大のために1:6までの希釈でサブ培養することができる。80%の合流度(約5〜6日)に達するまで細胞を増殖させ、一日おきに培地変化を起こします。次に酵素分散を繰り返し、ステップ2.7に進みます。ECT の準備を続行します。 - 上清を吸引し、ペレットを取り除くためにチューブをフリックします。FGMの細胞を20〜25°Cで再懸濁して、≥15 x 106/mLの細胞懸濁液を得る(ステップ3.3に必要以上に約40%多い細胞)。これは、次のステップでの緊張による細胞損失を占めます。
- 40 μm メッシュセルストレーナーを介してセル懸濁液をひずみます。
注意: 細胞凝集体は、ECTの最適な形成に有害である。ECTを直接鋳造するためにヒトCFプロトコルの酵素分散を使用する場合、細胞懸濁液を圧迫すると、均質な組織形成を妨げる主要な細胞塊の不在を保証する。異質性は、信頼性の高い応力-ひずみ分析を損ないます。 - 細胞数を再集計し、細胞生存率を評価し、ECT調製を進める≥80%生存率を有する懸濁液中の信頼できる細胞数を確保する。
- 自動セルカウンターを使用して、電流除外によるセル数と生存率を評価します。
- あるいは、生きた(染料を排除する無傷の細胞膜)および死死(細胞内タンパク質への色素の結合を可能にする細胞膜)の直接同定および列挙のための顕微鏡およびヘモサイトメーターの助けを借りて、トリパンブルー(発がん性物質、危険カテゴリー2 - 予防措置を取る)染料排除試験を使用する。
- 20-25°Cのセル懸濁液で回収管を予約し、ステップ3に進みます。
3. ECT製剤 (1時間)
注: ECT 生成の概略図の概要は 、図 2 に説明されています。
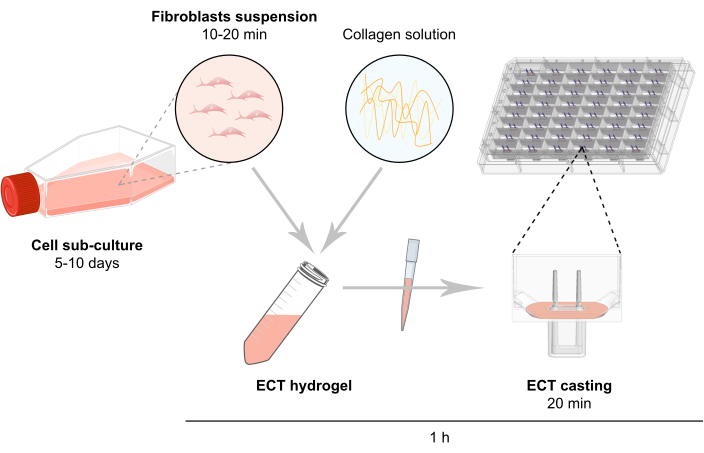
図 2: ECT 生成の概略図 線維芽細胞は、ECT生成で使用する前に2D培養で拡大される。5〜10日後、細胞は酵素的に分散し、細胞懸濁液は、ウシコラーゲン1型を含む緩衝混合物中で再構成される。細胞コラーゲンヒドロゲル混合物は、3D設計された組織培養のための48ウェルプレートの個々の井戸に配管され、2つの柔軟なポールを備えた鋳造金型として設計され、定義された長さと負荷でECT懸濁液を可能にします。ECTは、通常、測定の前に1〜20日間培養される。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- DMEM粉末をddH2O( 材料表で指定された製剤用134mg/mL)で1時間37°Cで一定の回転で溶解して、10倍のDMEMストック溶液を調製します。ろ過によって殺菌する。在庫は4°Cまたは-20°Cで最大12ヶ月間、最大14日間安定しています。
- 10x DMEMストック溶液を希釈し、滅菌ddH2Oに20%(v/v)FCSを添加して2倍のDMEMを調製し、必要に応じて、200 U/mLペニシリンおよび200mg/mLストレプトマイシンなどの抗生物質を使用する。ボリュームのピペッティングについては 、表1 を参照してください。在庫は4°Cで14日間まで安定しています。
注: 手順 3.1 を実行します。3.2.細胞の酵素分散を開始する前に(ステップ2.)ECTの調製のために。
| 試薬 | 最終濃度 | ボリューム (mL) |
| 10× DMEM | 該当する | 2 |
| FCS | 20 % (v/v) | 2 |
| ペニシリン | 200 U/mL | 0.2 |
| ストレプトマイシン | 200 mg/mL | 0.2 |
| ddH2O | 該当する | 5.6 |
| トータル | 該当する | 10 |
表1:2x DMEMの組成
注意:細胞コラーゲンヒドロゲル混合物および遠心チューブのすべての成分は、使用前に氷の上に保管する必要があります。これは、細胞-コラーゲンヒドロゲル混合物を鋳型全体に分配する前にコラーゲン自己集合が起こるのを防ぐのに役立ちます。
- 表2に基づき、ステップ2.10から細胞懸濁液に20~25°CのFGMを加えて、細胞懸濁液を8.88 x 106セル/mLの密度に調整します。次に、細胞懸濁液を含む回収管を氷に移動します。
- ECTヒドロゲル混合物を調製するために、氷上の50 mL遠心分離管を予め冷やし、次の順序で 表2 に示す異なる成分を加え、気泡形成を回避する。
メモ: 準備する ECT の最大数は、ステップ 2.9 で決定されたセルの合計数によって異なります。6-7 mg/mLを含むストック溶液から得られるECT当たり0.3mgのコラーゲンを使用してください。コラーゲンストック溶液の濃度は、最適なECTコラーゲン含有量を得るために必要な量を決定します。他のECTヒドロゲル成分の体積は、それに応じて適合されなければならない。6.49 mg/mLのコラーゲンストック溶液に従った調整量については 、表2 を参照してください。 表2 に記載されているボリュームは、このプロトコルで例示的なガイドラインとして使用されます。- 酸可溶性コラーゲン1型ヒドロゲルを広いボアチップを有する血清ピペットを用いたピペット。
- 2x DMEMを加え、チューブを渦巻いて軽く混合して、コラーゲン溶液の塩分を調整します。
- 管を渦巻いて軽く混合しながら0.2 M NaOHを加えてpHを中和する。フェノールの赤のインジケータは、赤に黄色から回ります.
注: 最適な pH 中和のために、NaOH ボリュームは個々のコラーゲン バッチごとに滴定する必要があります。中和は、緩衝剤の種類や調製、および絶対コラーゲン濃度などの要因に依存し、コラーゲンマトリックスアセンブリおよび細胞生存率23,40に影響を及ぼします。イオン含有量がDMEMの添加によって増加し、pHが中和されると、コラーゲンの自己集合が続き、破壊されてはならない。したがって、以下を迅速かつ中断せずに実行します。 - チューブを渦巻いて軽く混合しながら、セルサスペンション(ステップ3.3から)ドロップワイズを加えます。
| ECT 番号: | 1 | 6 | 24 | 48 | |
| 10%の黒字を含む | |||||
| 細胞コラーゲンヒドロゲル成分: | (μL) | (μL) | (μL) | (μL) | |
| コラーゲンストック(6.49mg/mL) | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 2× DMEM | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 0.2 M NaOH | 3.1 | 20.5 | 81.8 | 163.7 | |
| FGMの細胞混合(8.88×106 セル/mL) | 84.5 | 557.4 | 2229.7 | 4459.5 | |
| 総容量(μL) | 180.0 | 1188.0 | 4752.0 | 9504.0 | |
| これは、ECTあたり合計750,000個の細胞と0.3mgのコラーゲンを含むECTあたり180μLの鋳造体積を調製するための例示的な表である。 | |||||
表2:ECTヒドロゲルの調製 (ピペット誤差に対する10%余剰会計を含む)。
- 泡の形成を避け、せん断応力を最小限に抑えるために、広いボアチップを持つ血清学的ピペットを使用して、一度だけ上下に穏やかにピペットを入れ、懸濁液全体を混合します。チューブを10回軽く旋回させることで完全な混合物を確保し、鋳造プロセス全体を通してECTヒドロゲル混合物を含む50 mL遠心分離管を氷の上に保ちます。
- ECTヒドロゲル混合物で1 mLピペットチップを予め濡らし、48ウェル鋳造プレートの各型に180 μLを均等に分配し、コラーゲンマトリックスアセンブリの完全性に影響を与える可能性のある過度のせん断力を回避し、プレート全体が15〜20分で行われることを保証します。
注:推奨される鋳造量は180 μLですが、200 μL38まで拡張できます。したがって、好ましい場合には、 表2 中の体積は、細胞とコラーゲンとの間で同じ濃度と比を保つ方法で200μLに適合させることができる。- 完全なループが金型内に形成されていることを確認します(図3A)。ECTヒドロゲル混合物が不連続に適用される場合、完全なECTリング形成は防止される(図3B)。
- 内側のウェル(図3C)へのピペット化や、ピペット形成時の気泡の形成(図3D)を避け、均質で機能的な組織形成を確実にします。
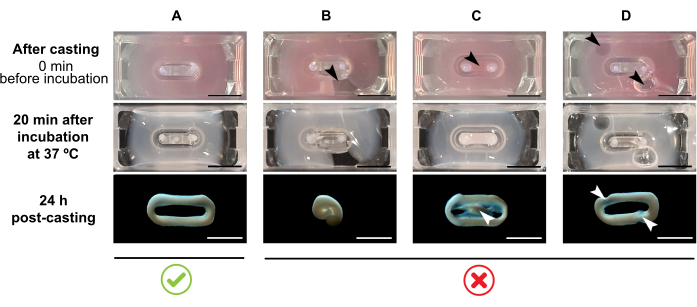
図3:マルチウェル形式での鋳造、ヒドロゲル形成、およびECT凝縮 トップパネルは、キャスト直後のECTの外観を例示しています。中間パネルは、37°Cで20分間インキュベーションした後のECTの外観を例示する。 下のパネルは、調製後のECT24時間の圧縮状態を例示し、極から取り出す。(A)最初の24時間(B-D)の間に2つの極間の適切なECT形成(B-D)適切なECT形成を妨げるピペット化誤差の例。白と黒の矢印は、不適切な鋳造によるECTの構造的欠陥を指しています。スケールバー: 5 mm. この図の大きなバージョンを表示するには、ここをクリックしてください。
- 細胞培養インキュベーター内に48ウェルの鋳造プレートを慎重に配置し、ECTヒドロゲル混合物を15〜30分間再構成させます。インキュベーション後、ゲル状と不透明に見えます(図3、中央パネル)。
- 37 °Cの温かいFGMの600 μLをウェルあたりに加え、培養培地を形成ECTに直接ピペット化することなく、組織破壊を引き起こす可能性があります。この時点で、ECTを底部から切り離してはなりません(図4)。
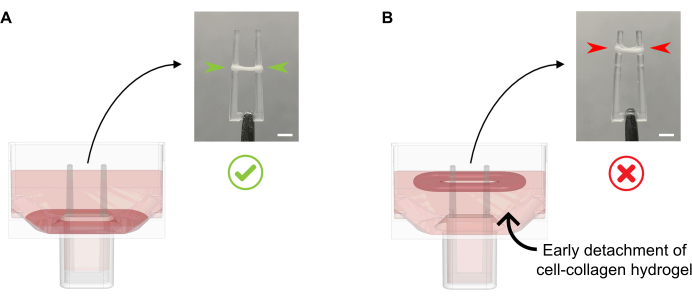
図4:キャストしたばかりのECTに培養培地を適切かつ不適切に添加する。 (A)初期ECT固化後(鋳造後20分)の培養培地を添加する一方で、凝縮ECTはウェルの底部に邪魔されずに放置する必要がある。次の 24 時間の間に、セル駆動マトリックス圧縮により、ECT がランプを上にスライドします。最終的な ECT 位置は、定義された極高の凹面キャビティによって制御されます。これにより、すべての ECT が同じ位置に落ち着いて、平行 ECT カルチャでのポールベンディングアクティビティの比較が可能になります。(B)培養液を速く添加しながら、ECTを底から剥離する。フローティングECTは、上層培養培地レベルでコンパクト化されます。電柱の契約力は、ECTが異なる位置に落ち着いた場合、直接比較されません。スケールバー: 2 mm. この図の大きなバージョンを表示するには、ここをクリックしてください。
- 24時間インキュベート。
- 分析まで、毎日500 μLのFGMで培地を交換してください。
注:細胞非依存のゲル化の初期段階の後、ヒトCFはECTヒドロゲル混合物をさらにコンパクトにし始めます。24時間以内に、ECTは特に圧縮され、柔軟なポールに保持されているレベルまで上げられたように見えるはずです(図3 および 図4A)。
4. 断面面積(CSA)(ECTあたり5分)を測定してECT圧縮を評価する。
注:組織の圧縮は、コラーゲンアセンブリの直後に開始し、最初の時間の間に特に重要です。圧縮は、主に組織の長い軸に垂直にマトリックスの細胞駆動圧縮によって引き起こされる変化を記述します。このパラメータは、ECTの断面面積(CSA)を決定することによって評価されます。
- 所望の時点で、ステレオ顕微鏡を使用して、ECTの上部および側面図の巨視的な画像を記録します(図5C)。
注:ECTは48ウェル鋳造板の培養井戸の内部でイメージすることができます。あるいは、ECTをイメージング用の透明な底部マルチウェルプレートに移します。電柱のECTをプレロードの損失につながるものとして画像化することをお勧めしますが、その結果、短期間で、組織は緊張放出による最終的なトーションとさらに収縮し、寸法分析のための適切なイメージングを妨げる可能性があります。 - ライン スキャン解析を実行するには、画像処理プログラムを使用します。スケールを設定し、[ 直線] ツールを使用して、各イメージングプレーン内のアームあたり最低6桁のECT直径をトレースおよび測定します(図5B、C)。
- 上面と側面のビュー平面から平均直径を計算し、楕円面積の方程式に従って CSA を計算します。


図5:断面面積(CSA)解析による時間経過によるECT圧縮のモニタリング ECTをヒトCFとコラーゲンI型を用いて生成し、2つの柔軟な極を5日間培養した。(A)5日間にわたってフレキシブルモールドに配置された制御ECTの代表的な画像が提示されます。スケールバー= 5 mmこのような明視野画像は、組織の収縮を推定するための極偏向変化を決定するためにも使用することができる。(B)ECTの断面面積の概略図(上面の直径は緑、側面の直径はピンク)。(C)画像処理プログラムを用いた組織の直径の線の分析の実体顕微鏡と対応例を用いて得られたECTの上および側面の図のマクロスコピック画像。スケールバー= 2 mm平均直径は、各ビュー プランで測定されたすべてのライン長の平均から計算されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
5. ポール偏向解析によるECT収縮のモニタリング(48ウェル鋳造プレートあたり15分)。
注: ECT の培養は通常 5 日間行われますが、少なくとも 20 日間は延長できます。極偏向は、組織の長い軸に沿った張力の方向に細胞収縮力によって駆動される組織収縮のために起こる。ECT収縮の評価は、培養中の任意の日に撮像することによって行うことができる。
- 高分解能(≥5メガピクセル)のモノクロ画像センサーを搭載した、一定距離に設置された統合領域スキャンカメラを備えた記録装置の下にある48ウェルキャスティングプレートを画像化します。
- 近紫外線(約390nm)の光源を使用してコントラストを最大限に引き出し、蛍光色素を含む極の先端を自動検出できるようにします(図6A、C)。可能であれば、テレセントリックレンズは画像の歪みを最小限に抑えるため、イメージングに推奨されます。
注: また、単一のウェルまたはスケール バーを伴うプレート全体からの巨視的な明視野画像を分析に使用することもできます(図 5A)。
- 近紫外線(約390nm)の光源を使用してコントラストを最大限に引き出し、蛍光色素を含む極の先端を自動検出できるようにします(図6A、C)。可能であれば、テレセントリックレンズは画像の歪みを最小限に抑えるため、イメージングに推奨されます。
- 画像処理プログラムを使用して、または暗い背景上の高コントラスト明るいピクセルを検出できるソフトウェア上で記録された画像を実行して、毎日の記録(図6C、D)からの極間の距離を測定します。
- ゼロ日の初期距離と比較した場合、極の距離の変動を通じて極偏向を計算します。
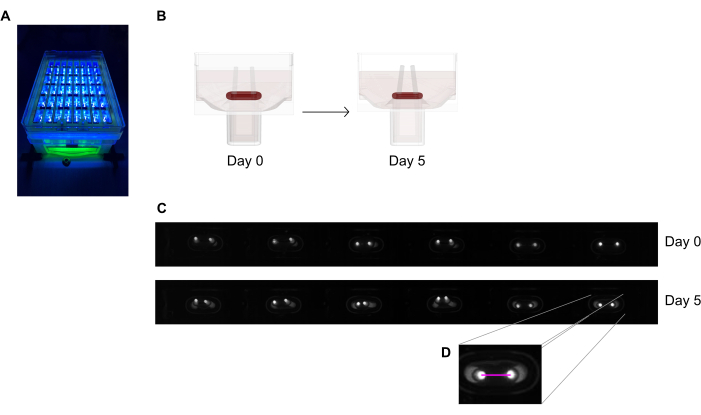
図6:極偏向による組織収縮評価の概略図(A)48ウェルキャストプレートの蛍光極の例示的な高解像度記録を、ほぼUV光励起の下で行う。この方法は、より正確な極先端自動トレースのための明視野画像よりも好ましいです。(B)模式図は、ECTの圧縮および収縮がポール曲げにつながる方法を示す。(C)鋳造後0日目および5日目に同じプレートの例示的な行が記録される。D.クローズアップは、画像処理プログラムを使用して極間の距離(ピンク線)を測定する方法を示しています。この図の大きなバージョンを表示するには、ここをクリックしてください。
注: 明るい先端画像で測定された極偏向は、撮像平面の違いによる組織収縮の推定にすぎないと考えてください。また、組織培養中にTGF-β1のような繊維質物質を適用すると、ECTの圧縮と収縮が高まり、最終的には早期組織破壊につながる可能性があることに注意してください。
6. 破壊引張り測定と応力歪解析によるECTの剛性とその他の生体力学的特性の評価(ECT当たり20分)
注: 最適な応力-ひずみ曲線は、つま先領域、弾性領域、およびプラスチック領域の 3 つの領域を表示できます。ECT 応力-ひずみ曲線の例を 図 7 に示します。応力-ひずみ曲線の解析により、組織の重要な生体力学的パラメータ(例えば、剛性、最大強度、弾力性、可塑性、拡張性、弾力性、靭性など)を抽出できます。
- 最初に鉗子を使用して、ECTを含む担架を井戸から引き抜くことによってECTを収穫する。ストレッチャーは、そのベースに保持することができ、ECTは細かいフックやピペットチップを使用して担架の先端の上に滑りました。
- ECTを、伸縮アームと、PBSで満たされた37°Cの気性オルガンバス(カスタムメイド)を備えたRheometerの伸縮腕とトランスデューサアームにクランプされた2つのフックに移します(図7A)。
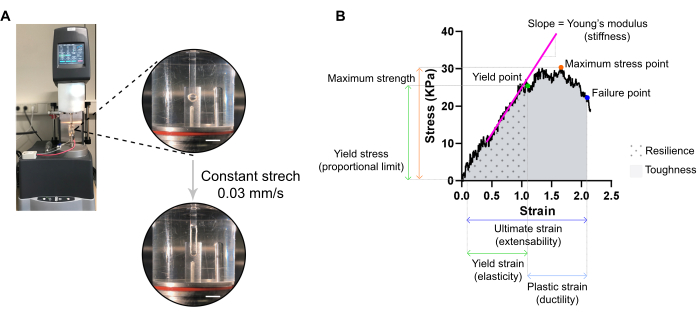
図7:ECT破壊引張り測定解析。 (A) 伸張動的力学解析(DMA)レオメータのレオロジー破壊性引張測定。上部高出力ビュー:環境チャンバのL0 に取り付けた後のECTは、応力歪み解析のために上下の極に接続されています。ボトムハイパワービュー:ECTは、究極の歪みで故障点まで0.03 mm/sの一定速度で歪みます。スケールバー = 5 mm. (B) 主要な測定パラメータを示す ECT の応力ひずみ図。弾性領域の上限は降伏点に対応し、プラスチック領域は降伏点と故障点(延性)の間で構成される。弾性領域の線形相の傾きは、組織の剛性を反映するヤング率に対応します。最大強度は、組織が耐えることができる最大の引張応力に対応します。繊維マイクロフラクチュリングのために、組織が故障点に達するまでストレスが減少する。これは、組織の破裂によるストレスの急激な低下が観察される究極の緊張(拡張性)で起こる。復元力は、永久変形前の組織によって吸収されるエネルギー(kJ/m3)に対応し(降伏点まで)、降伏点歪みまでのカーブ(AUC)下の領域によって与えられます。靭性は、組織が破裂するまで吸収できる総エネルギー(kJ/m3)に相当し、AUCによって究極の株まで与えられる。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- 1秒あたりのフック間の初期距離の約1%の一定の直線速度で単軸張力を適用するように、リメーターを設定します。一定の延伸速度は、一般的なECT寸法で0.03 mm/sを使用できます。トランスデューサを破り、ストレッチを開始し、ECT破裂の時点まで記録します。
注意: CSA はデータの正規化に必要なため、ICT のマクロコピー画像 (ステップ 4.1) は、引張テストの前に記録する必要があります。
注: CSA 計算を含む応力-ひずみ解析は、後で引張テストの際に処理できます。データ分析には、スプレッドシート ソフトウェアと統計解析ソフトウェアを使用します。 - CSA (mm2) によって ECT あたりの測定力値 (mN) を正規化して、応力値 (kPa) を取得します。
- XY グラフ上の歪み(上部と下のフックの相対的な距離によって与えられる組織変形の幾何学的尺度)に対する応力値をプロットします。
注:ストレッチが続く直前の組織の初期長(上部と下のフックの間の距離)は、手動で調整する必要があり、つま先領域の始まりに対応する必要があります(つま先領域は組織の特性に応じて存在しない場合があります)。各ひずみポイントの値は、Ltotal がすべての測定点の合計ギャップとなる式に従って計算する必要があります。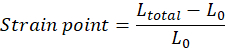
データをプロットする場合は、選択した L0 の応力値を背景の減算に使用します。 - 応力-ひずみ曲線から異なる生体力学的パラメータを決定します(例として 図7B を使用)。
注: 応力-ひずみ曲線は、つま先、弾性、およびプラスチック領域の 3 つの領域を表示できます。弾性領域の上限は、組織が微小破砕を開始する前に、収量点に対応し、その菌株は組織の弾力性の尺度である。プラスチック領域は降伏点と故障点の間で構成されます。後の点は、組織の破裂によるストレスの急激な低下に対応し、組織の伸びの尺度である究極の汚れを定義する。3番目の測定点は、最大強度に対応し、これは、組織がストレッチ中に壊れることなく耐えることができる最高のストレスによって定義されます。弾性力と靭性は、曲線下の領域によって与えられ、それぞれ降伏点および故障点まで組織によって吸収されるエネルギーに対応する。取得した曲線ごとに、弾性領域の線形部分の傾きは、弾性率とも呼ばれるヤング率に対応し、組織の剛性を測定する機械的特性です。- 降伏点、故障点、最大応力点の XY 値(それぞれひずみと応力)を各曲線から抽出します。
- ヤング率(kPa = mN·mm-2の剛性)を、その領域の線形回帰をプロットして、弾性領域の線形部分の傾きから評価します。
- 統計プログラムを使用して、カーブの下の領域(AUC)を計算し、降伏点と故障点までそれぞれ、弾力性と靭性の両方を決定します。台形法で AUC を計算します。ベースラインをゼロに設定し、ベースラインの上のピーク(Y 軸の最小値から最大値までの距離の少なくとも 10%)のみを考慮します。
注: 弾性率と靭性は、σ× εによって与えられ、σは応力(kPa)であり、εはひずみ(L/ΔL、mm/mm)です。したがって、弾力性と靭性は、kJ/m3(kPa = kN·m-2 = kN·m-3 = kJ/m·m-3 = kJ/m-3 = kJ/m3)のエネルギーであり、永久変形前および破裂するまでそれぞれである。
結果
ECTは、最初の24時間内の最初の細胞コラーゲンヒドロゲル体積と比較して約95%の圧縮に達する。組織の圧縮と収縮は、制御条件下およびFCSの存在下で、鋳造後数時間を経て、5日目まで顕著に増加する(図5A)。極偏向は、次の15日間(20日間がテストされた最長時間)の間にさらに増加する可能性があります。極偏向の大きさは、細胞の種類、細胞の状態、細胞および組織培養...
ディスカッション
提示されたプロトコルは、細胞外マトリックス環境に対するこれらの細胞の機械的影響を研究することを可能にする、一次ヒトCFからのECTの生成を記述し、その逆もまた同様である。
線維芽細胞は、計画されたECT実験(0.75 x 106 細胞/ECT)に十分な細胞を得るために拡張する必要があります。最良の再現性のために、ECT生成で使用する前に、各通路内で80%の合流度ま?...
開示事項
GLSとSLは原稿を起草した。すべての著者は、プロトコルの開発に貢献し、原稿を編集しました。TM、MT、およびWHZは無数のGmbHの科学的アドバイザーであり、WHZは無数のGmbHの創設者であり株主です。
謝辞
この研究は、ドイツ心臓協会(GLSのためのDGK研究フェローシップ)とドイツ研究財団(GLSおよびADのためのプロジェクトIRTG 1816を通じてDFG)によって支えられました。MT の DFG 417880571および DFG TI 956/1-1;MT および WHZ のための SFB 1002 TP C04;WHZ のための SFB 1002 TP S01;および EXC 2067/1-390729940J WHZ 用)。WHZは、ドイツ連邦科学教育省(プロジェクトIndiHEARTを通じてBMBF)とフォンダシオン・ルデュック(20CVD04)によってサポートされています。MT、WHZ、SLはドイツ心臓血管研究センター(DZHK)によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
参考文献
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force--Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved