Method Article
单侧肾缺血再灌注损伤的有效小鼠模型
摘要
肾缺血再灌注损伤与住院患者的高发病率和死亡率相关。在这里,我们提出了一种简单有效的单侧肾缺血再灌注损伤小鼠模型,并提供了在肾脏中观察到的代表性病理变化的顺序概述。
摘要
缺血再灌注损伤 (IRI) 是急性肾功能衰竭的主要原因,也是移植功能延迟的重要因素。动物模型是唯一可用的资源,可以模拟 体内遇到的IRI相关损伤的复杂性。本文描述了一种有效的单侧肾IRI小鼠模型,可提供高度可重复的数据。通过闭塞右肾蒂 30 分钟然后再灌注来诱发缺血。除外科手术外,还将通过比较七种不同再灌注时间(4小时,8小时,16小时,1天,2天,4天和7天)的数据,提供肾脏IRI后预期生理和组织病理学变化的顺序概述。将共享用于提前计划实验的关键数据,例如平均手术时间,平均麻醉剂消耗量和体重随时间的变化。这项工作将帮助研究人员实施可靠的肾脏IRI模型,并选择与他们预期的调查目标一致的适当再灌注时间。
引言
肾脏是体内灌注程度最高的器官之一,极易受到血液灌注变化的影响1。肾缺血再灌注损伤 (IRI) 仍然是急性肾功能衰竭的主要原因2,3 与住院患者的高发病率和高死亡率相关4.由于可用的治疗选择有限,4,5 肾IRI目前是生物医学中几项研究工作的重点6,7 旨在开发新的治疗靶点和表征肾损伤的早期和敏感标志物8,9,10.确定可靠,省时且具有成本效益的动物模型对于满足这些需求至关重要。本文提出了一种简单有效的单侧肾IRI小鼠模型。通过钳夹右肾蒂30分钟11,12诱发缺血。该模型的一个关键部分是选择最合适的再灌注时间,以重现感兴趣的病理事件,例如肾小管坏死,多形核炎性细胞浸润或纤维化。因此,研究人员可以获得IRI肾脏中预期的代表性病理变化的顺序概述。
研究方案
以下方案描述了生存手术。因此,应用了最高的无菌和外科实践。所有动物实验均按照机构指南进行,并得到机构动物护理和使用委员会的批准。为了消除IRI效应中的性别和菌株差异,研究中仅使用雄性C57BL6小鼠。所有动物的年龄和体重都匹配,以产生可比较的结果。
1. 准备工作
注:不同实验阶段和干预措施的时间表如图 1A所示。
- 每次手术前对手术台进行清洁和消毒。准备并放置所有必需的材料(灭菌器械和棉签,无菌纱布和窗帘,预稀释的麻醉剂,加热垫,无菌血管钳,无菌盐水溶液以及皮肤防腐剂和缝合线)在手术台上(见 材料表)。
- 通过腹膜内注射氯胺酮/甲苯噻嗪(分别为100mg / kg和20mg / kg体重,先前在无菌盐水中稀释)麻醉雄性C57BL6小鼠(年龄范围11-13周)。
注意:熟练的动物处理对于最大限度地减少动物的压力至关重要,因为压力反应会对麻醉剂的作用产生负面影响。 - 氯胺酮/甲苯噻嗪给药后,使用剃须刀片和肥皂剃除右侧的手术区域。
注意:剃须皮肤可以改善伤口愈合以及生存手术的一般结果。 - 首先用70%的酒精对手术区域的皮肤进行消毒,然后用棉签用聚维酮碘溶液消毒。
- 皮肤准备后,将鼠标放在腹侧褥疮位置的加热台上,并将体温稳定在37°C(通过直肠和垫传感器探头监测)。
注意:当肾脏放置在腹侧卧位而不是侧位时,更容易进入和手术暴露。 - 当体温稳定时,将眼药膏涂抹在小鼠的眼睛上。
注意:解离性麻醉剂,如氯胺酮,使动物的眼睛在麻醉时保持睁开。
2. 手术
- 一旦疼痛反射消失(用镊子捏脚趾),使用手术刀在右侧进行约1厘米的背侧手术切口。从最后一根肋骨后面的切口开始,继续尾部平行于腰椎中线约1厘米。
- 用剪刀横断腹部肌肉组织,观察腹膜后间隙。使用无菌棉签去除肌肉切片过程中产生的少量血液。
注意:由于使用背侧入路,因此通过此手术可进入腹膜后,而不是腹膜腔。 - 将右肾从腹腔中推出。使用格雷夫镊子小心地暴露肾脏。
注意:始终保持镊子关闭,以避免在放置在腹部时对肾脏造成创伤性伤害,并且仅用于小心地将肾脏推向并引导到手术切口并离开它。 - 慢慢暴露右肾并识别肾蒂。小心地取出椎弓根周围的脂肪组织。
- 为了诱发缺血,将血管钳放在肾动脉和肾蒂静脉上,避免钳夹相邻的输尿管。使用哈尔斯特德蚊子止血剂来操纵血管钳。
注意:缺血通过可视化肾脏颜色从红粉红色变为深紫色来确认(图1B)。 - 用浸泡在盐水中的无菌纱布覆盖夹紧的肾脏,以避免干燥,并放置30分钟。
- 在此期间定期监测纱布的麻醉深度和湿度。
注意:麻醉的诱导剂量足以提供镇痛,直到缺血事件结束;因此,不需要额外的麻醉剂注射。 - 在缺血期结束前不久,取下纱布并揭开肾脏。握住灭蚊止血器,准备取出钳子。
- 在第30分钟,用止血剂打开血管钳并将其从肾蒂上取出,以允许肾脏再灌注。
注意:再灌注通过肾脏颜色从深紫色变为红粉红色的可视化来确认(图1C)。 - 对假动物执行上述相同的程序,而不夹紧肾蒂。
- 验证肾脏颜色变化后,将肾脏返回到腹腔。使用十字形图案用可吸收的缝合线5-0关闭腹部肌肉。
注意:可能需要第二次注射麻醉剂,以在肌肉和皮肤缝合期间保持镇痛。一半的初始剂量已被证明在手术结束前有效提供镇痛。 - 使用水平床垫图案用可吸收的缝合线5-0关闭皮肤。使用棉签用聚维酮碘溶液清洁伤口。
3. 恢复和手术后
注意:由于术后时间是实际的再灌注时间,因此适当的术后护理在道德上是强制性的,并且在科学上是相关的。再灌注时间可根据研究人员的要求进行选择。比较 4 h、8 h、16 h、1 天、2 天、4 天和 7 天的再灌注次数,以获得肾脏 IRI 诱导的病理变化的顺序概述。
- 将鼠标保持在加热垫上,直到它开始从麻醉中恢复。
注:建议等到鼠标开始移动其支腿并尝试四处移动。在手术过程中需要额外的麻醉剂注射的情况下,恢复时间更长。阿替美唑是一种α-2受体拮抗剂,可以腹膜内以0.5mg / kg体重的剂量施用,以逆转甲苯噻嗪作用并缩短恢复期。对于疼痛管理,丁丙诺啡(0.1mg / kg体重,腹膜内)术前给药,在恢复期和术后阶段每6小时施用一次。不鼓励使用非甾体抗炎药,因为该家族中的几种药物会引起肾毒性,因此可以改变结果。 - 从麻醉中恢复后,将小鼠放回笼子里,自由取水和食物。
注意:可以在培养皿中提供捣碎的食物以及用于隐藏和玩耍的材料(例如,纸片,纸巾管)。 - 每天监测小鼠以评估伤口愈合,食物和水的摄入量,体重和行为。
注意:使用以下量表评估伤口愈合状态:1,干燥;2、湿润;3、部分开启;4、开业。这项研究记录了伤口愈合迅速,超过90%的干伤口在第2天后。
4. 安乐死和样本采集
- 用腹膜内施用戊巴比妥钠对小鼠实施安乐死,其剂量是小鼠麻醉剂量(100mg / kg)的两倍。
- 根据需要收集液体和组织样本。
注意:收集两个肾脏,全血(用于血细胞计数),血清(用于血液生化),尿液,心脏和肺部。血液生化分析需要几微升血清(血尿素氮(BUN),肌酐,电解质)。如果需要,在安乐死前24小时,可以将小鼠放入代谢笼中以收集更高的尿量,从而可以测定肾功能参数。
结果
生理参数
小鼠从这种单侧肾IRI手术中恢复,平安无事;显示为活动并处于警报状态;并在第二天表现出正常的进食,饮水和行为。一些小鼠可能有IRI后体重减轻,尽管它通常小于初始体重的10%(图2)。体重减轻幅度更大(˃10%)可能是有害的,这些动物应该从研究中移除。假手术小鼠在手术后没有显示体重变化(手术后24小时测量)。大多数小鼠在手术后第4天和第7天之间恢复了初始体重(参见IRI 7天组, 图2)。可以使用传统的标志物(如血尿素氮 (BUN) 和肌酐)来评估肾功能。此外,分析还包括血清中的电解质水平(钠,钾和氯化物)和自动分类血细胞计数。
组织病理学改变
使用4%多聚甲醛固定,石蜡包埋的整个矢状体中段肾的矢状部分用苏木精/曙红(HE),荧光酸Schiff和Masson的三色染色剂进行组织病理学发现的评估。这种单侧肾IRI模型产生的最明显的变化可见于皮质-髓质交界处,特别是在近端小管、亨勒袢厚的上升肢体和远端卷曲的小管以及肾小管间质中(参见图3的图例)。下图显示了肾脏中IRI之后最具特征性的病变的显微镜图像。表1提供了顺序组织病理学发现的清单。
开发了一种管状损伤评分系统,用于对随时间变化的损伤进行分类(图4)。其中,三个不同的评估者评估了五个定义的改变:1)肾小管上皮衰减;2)刷子边框丢失;3)肾小管坏死;4)腔内阻塞;5)存在蛋白石膏。赋值"1"表示存在更改,"0"表示不存在更改。
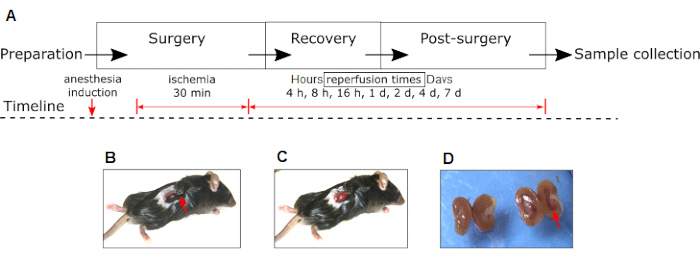
图1:小鼠的实验性肾脏IRI模型 (A)显示了实验和干预(麻醉诱导,缺血和再灌注)的阶段。请注意,在缺血期间右肾的颜色从深红色(B)到再灌注(C)期间的粉红色变化。(D)手术后24小时,IRI右肾(红色箭头)与同一动物的对侧非IRI肾相比的宏观外观。(B)中的红色箭头表示止血钳的位置。缩写:IRI = 缺血再灌注损伤。 请点击此处查看此图的大图。
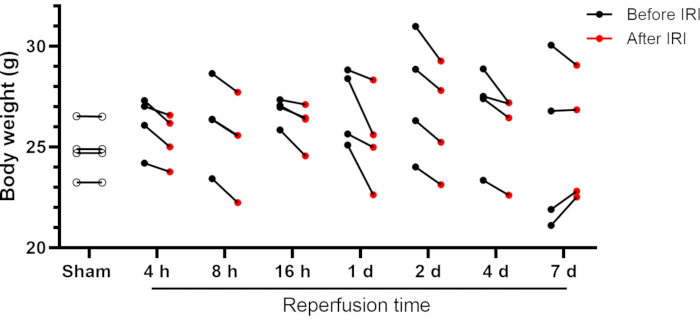
图2:肾脏IRI之前和之后小鼠的体重。 将显示单个数据。缩写:IRI =缺血再灌注损伤;h = 小时;d = 天。 请点击此处查看此图的大图。
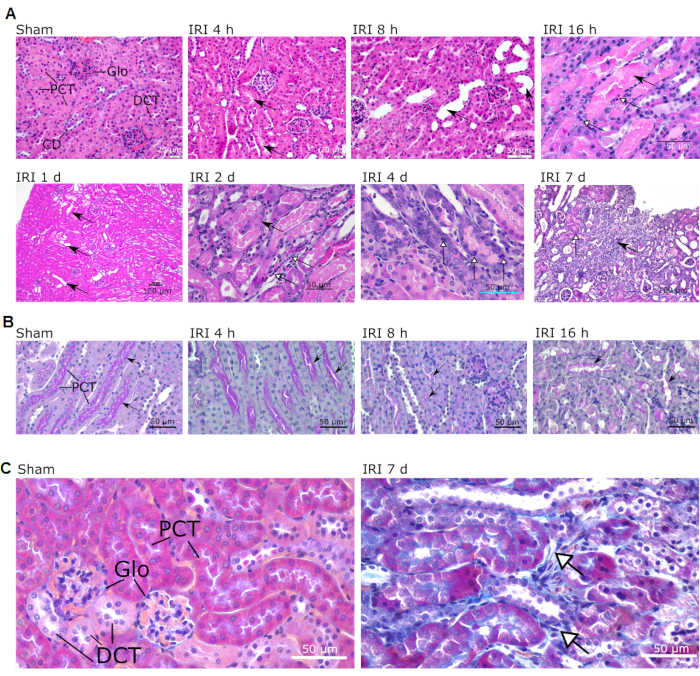
图3:在IR手术小鼠的皮质和皮质 - 髓质交界处观察到的典型微观病变。 显示了假和不同的再灌注时间(在每张图片上方显示)。(A)完整的结构以假显示(放大倍率40x;比例尺= 20μm)。IRI 4 h中的箭头表示管状管腔中存在蛋白质铸模(放大40x;比例尺= 20μm)。IRI 8 h中的箭头显示管状扩张(放大40x;比例尺= 50μm)。IRI 16 h中的黑色箭头显示髓段的管状铸模;白色箭头显示细胞坏死区域(放大40x;比例尺= 50μm)。IRI 1 d中的黑色箭头表示管状扩张(放大倍率为10x;比例尺= 100μm)。IRI 2 d中的黑色箭头显示细胞核增大;白色箭头显示淋巴细胞和巨噬细胞浸润的区域(放大40x;比例尺= 50μm)。IRI 4 d中的白色箭头表示有丝分裂的管状细胞(放大40x;比例尺= 50μm)。IRI 7 d中的黑色箭头显示局灶性纤维化区域;白色箭头显示再生区域(放大20x;比例尺= 100μm)。(B)PAS染色显示小鼠在早期再灌注(4小时,8小时和16小时)期间的肾皮质。请注意画笔边框(箭头)的渐进衰减。放大倍率 40x;比例尺= 50μm(C)假和IRI 7 d小鼠的Masson三色染色显示间质纤维化区域(白色箭头)。放大倍率 40x;比例尺 = 50 μm。缩写:IRI =缺血再灌注损伤;球 = 肾小球;PCT = 近端波纹小管;DCT = 远端波纹小管;CD = 收集管道;PAS = 高碘酸希夫;d = 天。 请点击此处查看此图的大图。
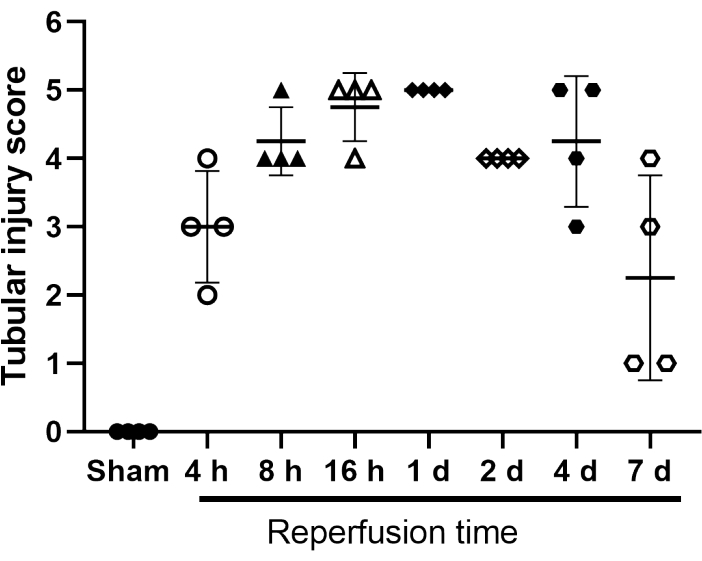
图4:假手术和IRI手术小鼠的管状损伤评分。 评分系统等级1至5用于肾小管上皮衰减;画笔边框丢失;肾小管坏死;腔阻塞;和蛋白质石膏的存在。赋值"1"表示存在更改,"0"表示不存在更改。将显示单个值。条形表示平均± SD (n = 4)。缩写:IRI = 缺血再灌注损伤。 请点击此处查看此图的大图。
| 输入法后的时间 | 最显著的病理改变 |
| 4 小时 | 肾小管梗阻 |
| 流明中的蛋白质铸模 | |
| 8 小时 | 肾小管扩张 |
| 早期坏死 | |
| 上皮衰减 | |
| 16 小时 | 细胞坏死 |
| 管状铸件 | |
| 中性粒细胞浸润 | |
| 1 天 | 坏死 |
| 肾小管扩张 | |
| 中性粒细胞浸润 | |
| 2 天 | 肾小管扩张 |
| 淋巴细胞和巨噬细胞浸润 | |
| 细胞核增大 | |
| 4 天 | 小管细胞中突出的有丝分裂活性 |
| 7 天 | 局灶性纤维化 |
| 再生区域 |
表1:随时间变化最显著的病理变化。 根据每组4-6只动物的显微镜检查进行诊断。
讨论
小鼠肾脏IRI模型因其相对较低的运营成本和各种转基因模型的可用性而在生物医学研究中很受欢迎12.这里介绍的单侧肾脏IRI模型模拟了在人肾脏IRI中观察到的特征性病理变化,例如肾小管扩张,坏死和纤维化13。这些结果基于不同的再灌注时间。
该方案的关键步骤包括维持恒定的体温和在肾蒂中正确放置血管钳。体温影响动物的新陈代谢14,改变生理和细胞水平的实验结果15。在该模型中,使用直肠和焊盘传感器探头在手术前稳定体温。此外,强烈建议在整个手术过程中连续监测体温,特别是在放置血管钳以诱导缺血之前。
肾脏的暴露和血管钳的正确放置也是实验成功的关键。在通过手术切口暴露肾脏期间,由于镊子处理不当而对肾囊造成损害,将导致肾周出血和炎症。血管钳应放在肾蒂上,阻塞肾动脉和肾静脉,而不影响输尿管和肾上动脉。此步骤的关键是仔细解剖肾肺门周围的脂肪组织14,16。
此模型具有成本效益和时间效率。每只小鼠的麻醉消耗量为156.47±37.88μL(平均±SD,n = 17)预稀释的氯胺酮/甲苯噻嗪鸡尾酒(1:10氯胺酮,1:50甲苯噻嗪,盐水;储备溶液浓度,100mg / mL两者)。手术可以在相对较短的时间内进行。每只小鼠的总手术时间为53±5.23分钟(平均±SD,n = 17)。通过训练有素的人员,可以同时进行多台手术。在我们小组中,一位经验丰富的研究人员进行了手术,直到钳子从肾蒂上释放出来,而另一位研究人员则从伤口闭合开始,直到小鼠恢复。通过这种方法,我们能够在一天内进行大量的手术。在该模型中,我们使用背外侧方法,与中线方法16相比,这导致较少的创伤并减少腹腔的液体和热量损失。
先前发表的方案已经描述了肾小板钳夹技术以诱导小鼠急性肾损伤17,18,19。然而,在这些研究中,除了单侧IRI外,还进行了对侧肾切除术,缺血时间范围为15至26分钟。在该方案中,我们诱导单侧缺血30分钟,同时保留对侧肾。这导致存活率为100%。然而,该模型不适合诱导氮氧血症性肾损伤,部分原因是非手术干预的对侧肾所施加的代偿作用。然而,在同一只动物中保持一个肾脏不受影响提供了使用更长的缺血时间和更高的存活率的优势。除此之外,对侧肾可用于评估在实验过程中应用的测试药物或治疗的可能副作用,并研究肾 - 肾串扰效应20,21。例如,该模型可用于显示活性氧在IRI和对侧非手术干预肾脏11的细胞水平上诱导的改变。
该模型在旨在鉴定和表征单侧肾损伤标志物,肾串扰效应,肾后IRI诱导的血流动力学变化以及用于肾脏IRI的候选药物的潜在肾毒性作用的研究中具有潜在的应用。这种对主要病理变化的详细描述是选择最合适的时间研究特定细胞过程的宝贵工具,从炎症和坏死(4小时至2天)到再生(4天)和纤维化(7天及以后)。
披露声明
作者声明本文没有利益冲突。
致谢
本文展示的部分工作由圣基茨和尼维斯罗斯大学兽医学院(RUSVM)的综合哺乳动物研究中心创立。非常感谢长岛大学兽医学院兽医生物医学科学系提供的经济援助。
材料
| Name | Company | Catalog Number | Comments |
| Atipamezole hydrochloride | Penn Veterinary Supply, Inc., PA, USA | PVS8700 | 5 mg/mL |
| Buprenorphine | Penn Veterinary Supply, Inc., PA, USA | PRMBURPEN22 | 0.3 mg/mL |
| Commercial euthanasia solution | various suppliers | na | e.g., Euthasol Virbac (sodium pentobarbital 390 mg/mL + sodium phenytoin 50 mg/mL) |
| Eye ointment Puralube | Dechra Veterinary Products, KS, USA | na | 3.5 g (1/8 oz) |
| Heating pad RightTempJr | Kent Scientific, CT, USA | RT-JR-20 | Consider the one with two temperature probes |
| Ketamine hydrochloride | Penn Veterinary Supply, Inc., PA, USA | VED1220 | 100 mg/ml |
| S&T Vascular clamp | Fine Science Tools, Inc., Germany | 00398-02 | Jaw dimensions: 5.5 x 1.5 mm; length: 11 mm |
| Sterile Disposable Towel Drapes | Kent Scientific, CT, USA | SURGI-5023-3 | Disposable, individualy packed |
| Surgical instruments (Graefe forceps, Halsted-Mosquito hemostat, scissors, etc) | Fine Science Tools, Inc., Germany | Various | Consider the extra fine straight scissor and the angled Graefe forceps |
| Vicryl suture | Ethicon US, LLC | J493G | Size 5-0 |
| Xylazine hydrochloride | Penn Veterinary Supply, Inc., PA, USA | VAM4821 | 100 mg/mL |
参考文献
- Ray, S. C., Mason, J., O'Connor, P. M. Ischemic renal injury: can renal anatomy and associated vascular congestion explain why the medulla and not the cortex is where the trouble starts. Seminars in Nephrology. 39 (6), 520-529 (2019).
- Weight, S. C., Bell, P. R., Nicholson, M. L. Renal ischaemia--reperfusion injury. The British Journal of Surgery. 83 (2), 162-170 (1996).
- Ratliff, B. B., Abdulmahdi, W., Pawar, R., Wolin, M. S. Oxidant mechanisms in renal injury and disease. Antioxidants & Redox Signaling. 25 (3), 119-146 (2016).
- Schrier, R. W., Wang, W., Poole, B., Mitra, A. Acute renal failure: definitions, diagnosis, pathogenesis, and therapy. The Journal of Clinical Investigation. 114 (1), 5-14 (2004).
- Fernández, A. R., Sánchez-Tarjuelo, R., Cravedi, P., Ochando, J., López-Hoyos, M. Review: Ischemia reperfusion injury-a translational perspective in organ transplantation. International Journal of Molecular Sciences. 21 (22), 8549 (2020).
- Wu, C. -. L., et al. Tubular peroxiredoxin 3 as a predictor of renal recovery from acute tubular necrosis in patients with chronic kidney disease. Scientific Reports. 7 (1), 43589 (2017).
- Nishida, K., et al. Systemic and sustained thioredoxin analogue prevents acute kidney injury and its-associated distant organ damage in renal ischemia reperfusion injury mice. Scientific Reports. 10 (1), 20635 (2020).
- Mishra, J., et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet. 365 (9466), 1231-1238 (2005).
- Han, W. K., Bailly, V., Abichandani, R., Thadhani, R., Bonventre, J. V. Kidney injury molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury. Kidney International. 62 (1), 237-244 (2002).
- Coca, S. G. Kidney injury biomarkers with clinical utility: has Godot finally arrived. American Journal of Nephrology. 50 (5), 357-360 (2019).
- Godoy, J. R., et al. Segment-specific overexpression of redoxins after renal ischemia and reperfusion: protective roles of glutaredoxin 2, peroxiredoxin 3, and peroxiredoxin 6. Free Radical Biology & Medicine. 51 (2), 552-561 (2011).
- Wei, Q., Dong, Z. Mouse model of ischemic acute kidney injury: technical notes and tricks. American Journal of Physiology - Renal Physiology. 303 (11), 1487-1494 (2012).
- Gaut, J. P., Liapis, H. Acute kidney injury pathology and pathophysiology: a retrospective review. Clinical Kidney Journal. 14 (2), 526-536 (2021).
- Le Clef, N., Verhulst, A., D'Haese, P. C., Vervaet, B. A. Unilateral renal ischemia-reperfusion as a robust model for acute to chronic kidney injury in mice. PLoS One. 11 (3), 0152153 (2016).
- Pelkey, T. J., et al. Minimal physiologic temperature variations during renal ischemia alter functional and morphologic outcome. Journal of Vascular Surgery. 15 (4), 619-625 (1992).
- Kennedy, S. E., Erlich, J. H. Murine renal ischaemia-reperfusion injury. Nephrology. 13 (5), 390-396 (2008).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. Journal of Visualized Experiments: JoVE. (78), e50495 (2013).
- Hesketh, E. E., et al. Renal ischaemia reperfusion injury: a mouse model of injury and regeneration. Journal of Visualized Experiments: JoVE. (88), e51816 (2014).
- Wei, J., et al. New mouse model of chronic kidney disease transitioned from ischemic acute kidney injury. American Journal of Physiology. Renal Physiology. 317 (2), 286-295 (2019).
- Basile, D. P., Leonard, E. C., Tonade, D., Friedrich, J. L., Goenka, S. Distinct effects on long-term function of injured and contralateral kidneys following unilateral renal ischemia-reperfusion. American Journal of Physiology - Renal Physiology. 302 (5), 625-635 (2012).
- Polichnowski, A. J., et al. Pathophysiology of unilateral ischemia-reperfusion injury: importance of renal counterbalance and implications for the AKI-CKD transition. American Journal of Physiology. Renal Physiology. 318 (5), 1086-1099 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。