Method Article
Ein effektives Mausmodell der einseitigen renalen Ischämie-Reperfusionsverletzung
In diesem Artikel
Zusammenfassung
Nierenischämie-Reperfusionsverletzungen sind mit hoher Morbidität und Mortalität bei hospitalisierten Patienten verbunden. Hier stellen wir ein einfaches und effektives Mausmodell der einseitigen renalen Ischämie-Reperfusionsverletzung vor und geben einen sequentiellen Überblick über repräsentative pathologische Veränderungen, die in der Niere beobachtet wurden.
Zusammenfassung
Die Ischämie-Reperfusionsverletzung (IRI) ist die Hauptursache für akutes Nierenversagen und trägt wesentlich zur verzögerten Transplantatfunktion bei. Tiermodelle sind die einzigen verfügbaren Ressourcen, die die Komplexität der IRI-assoziierten Schäden nachahmen, die in vivo aufgetreten sind. Dieses Papier beschreibt ein effektives Mausmodell der einseitigen renalen IRI, das hochgradig reproduzierbare Daten liefert. Ischämie wird durch Verschließen des rechten Nierenpedikels für 30 Minuten induziert, gefolgt von einer Reperfusion. Zusätzlich zum chirurgischen Eingriff wird ein sequenzieller Überblick über die erwarteten physiologischen und histopathologischen Veränderungen nach renaler IRI durch den Vergleich von Daten aus sieben verschiedenen Reperfusionszeiten (4 h, 8 h, 16 h, 1 Tag, 2 Tage, 4 Tage und 7 Tage) gegeben. Kritische Daten für die Planung von Experimenten, wie die mittlere Operationszeit, der durchschnittliche Anästhesieverbrauch und Änderungen des Körpergewichts im Laufe der Zeit, werden ausgetauscht. Diese Arbeit wird den Forschern helfen, ein zuverlässiges renales IRI-Modell zu implementieren und die geeignete Reperfusionszeit auszuwählen, die mit ihren beabsichtigten Untersuchungszielen übereinstimmt.
Einleitung
Die Nieren gehören zu den am höchsten durchbluteten Organen im Körper und sind extrem anfällig für Veränderungen der Blutdurchblutung1. Nierenischämie-Reperfusions-Verletzung (IRI) bleibt die Hauptursache für akutes Nierenversagen 2,3 und ist mit hoher Morbidität und hoher Mortalität bei hospitalisierten Patientenverbunden 4. Da nur begrenzte therapeutische Optionen zur Verfügung stehen,4,5 Die renale IRI steht derzeit im Mittelpunkt mehrerer Forschungsanstrengungen in der Biomedizin6,7, die auf die Entwicklung neuartiger therapeutischer Ziele und die Charakterisierung früher und sensitiver Marker für Nierenschädigungen abzielen 8,9,10 . Die Identifizierung eines zuverlässigen, zeit- und kosteneffizienten Tiermodells wird als wesentlich angesehen, um diese Anforderungen zu erfüllen. Dieses Papier stellt ein einfaches und effektives Mausmodell der einseitigen renalen IRI vor. Ischämie wird durch Klemmen des rechten Nierenpedikels für 30 min11,12 induziert. Ein entscheidender Teil dieses Modells ist die Auswahl der am besten geeigneten Reperfusionszeit, die die pathologischen Ereignisse von Interesse wie tubuläre Nekrose, polymorphe infiltration von Entzündungszellen oder Fibrose reproduziert. Daher erhalten die Forscher diesen sequentiellen Überblick über repräsentative pathologische Veränderungen, die in der IRI-Niere erwartet werden.
Protokoll
Das folgende Protokoll beschreibt eine Überlebensoperation. Daher wird die höchste aseptische und chirurgische Praxis angewendet. Alle Tierversuche wurden in Übereinstimmung mit den institutionellen Richtlinien durchgeführt und vom Institutional Animal Care and Use Committee genehmigt. Um geschlechts- und stammbasierte Unterschiede in den IRI-Effekten zu eliminieren, wurden in der Studie nur männliche C57BL6-Mäuse verwendet. Alle Tiere wurden in Alter und Gewicht angepasst, um vergleichbare Ergebnisse zu erzielen.
1. Vorbereitung
HINWEIS: Eine Zeitleiste der verschiedenen experimentellen Phasen und Interventionen ist in Abbildung 1A dargestellt.
- Reinigen und desinfizieren Sie den OP-Tisch vor jedem Eingriff. Bereiten Sie alle erforderlichen Materialien vor und legen Sie sie (sterilisierte Instrumente und Wattestäbchen, sterile Gaze und Vorhänge, vorverdünnte Anästhetika, Heizkissen, sterilisierte Gefäßklemme, sterile Kochsalzlösung sowie Hautantiseptika und -nähte) auf den Operationstisch (siehe Materialtabelle).
- Anästhesien männlicher C57BL6-Mäuse (Altersgruppe 11-13 Wochen) durch intraperitoneale Injektion von Ketamin / Xylazin (100 mg / kg bzw. 20 mg / kg Körpergewicht, zuvor in steriler Kochsalzlösung verdünnt).
HINWEIS: Ein geschickter Umgang mit Tieren ist unerlässlich, um den Stress für das Tier zu minimieren, da Stressreaktionen die Wirkung von Anästhetika negativ beeinflussen können. - Rasieren Sie nach der Verabreichung von Ketamin / Xylazin den Operationsbereich an der rechten Flanke mit einer Rasierklinge und Seife.
HINWEIS: Die Rasur der Haut verbessert die Wundheilung sowie die allgemeinen Ergebnisse von Überlebensoperationen. - Desinfizieren Sie die Haut im Operationsbereich zuerst mit 70% Alkohol und dann mit Povidon-Jodlösung mit einem Wattestäbchen.
- Legen Sie die Maus nach der Hautvorbereitung auf einen Heiztisch in einer ventralen Dekubitusposition und stabilisieren Sie die Körpertemperatur bei 37 °C (überwacht durch Rektal- und Padsensorsonden).
HINWEIS: Nieren sind leichter zugänglich und chirurgisch exponiert, wenn sie in ventralem Dekubitus und nicht lateral platziert werden. - Während die Körpertemperatur stabilisiert ist, tragen Sie Augensalbe auf die Augen der Maus auf.
HINWEIS: Dissoziative Anästhetika wie Ketamin bewirken, dass die Augen des Tieres während der Narkose offen bleiben.
2. Chirurgie
- Sobald die Schmerzreflexe fehlen (Zehenkneifen mit einer Pinzette), führen Sie einen ca. 1 cm langen dorso-lateralen chirurgischen Schnitt an der rechten Flanke mit einer Skalpellklinge durch. Beginnen Sie den Schnitt hinter der letzten Rippe und fahren Sie ca. 1 cm parallel zur Lendenmittellinie kaudal fort.
- Transektieren Sie die Bauchmuskulatur mit einer Schere, um den retroperitonealen Raum zu visualisieren. Entfernen Sie die kleinen Mengen Blut, die während des Schneidens der Muskeln mit sterilen Wattestäbchen produziert werden.
HINWEIS: Da der dorsolaterale Ansatz verwendet wird, wird mit diesem Verfahren auf das Retroperitoneum und nicht auf die Peritonealhöhle zugegriffen. - Drücken Sie die rechte Niere aus der Bauchhöhle heraus. Verwenden Sie die Graefe-Pinzette, um die Niere vorsichtig freizulegen.
HINWEIS: Halten Sie die Pinzette immer geschlossen, um eine traumatische Verletzung der Niere zu vermeiden, wenn sie auf den Bauch gelegt wird, und verwenden Sie sie nur, um die Niere vorsichtig in Richtung des chirurgischen Einschnitts und aus ihr heraus zu drücken und zu führen. - Legen Sie langsam die rechte Niere frei und identifizieren Sie den Nierenpedikel. Entfernen Sie vorsichtig das Fettgewebe um den Stiel herum.
- Um eine Ischämie zu induzieren, legen Sie die Gefäßklemme über die Nierenarterie und die Vene, die im Nierenstiel vorhanden sind, und vermeiden Sie es, den benachbarten Harnleiter zu klemmen. Verwenden Sie einen Halsted-Mosquito-Hämostat zur Manipulation der Gefäßklemme.
HINWEIS: Ischämie wird durch die Visualisierung einer Farbänderung der Niere von rot-rosa zu dunkelviolett bestätigt (Abbildung 1B). - Bedecken Sie die eingeklemmte Niere mit steriler Gaze, die in Kochsalzlösung getränkt ist, um Austrocknung zu vermeiden, und lassen Sie sie 30 Minuten einwirken.
- Überwachen Sie während dieser Zeit regelmäßig die Anästhesietiefe und -feuchtigkeit der Gaze.
HINWEIS: Die Induktionsdosis der Anästhesie ist ausreichend, um Analgesie bis zum Ende des ischämischen Ereignisses bereitzustellen; Daher sind keine zusätzlichen anästhetischen Injektionen erforderlich. - Kurz vor dem Ende der Ischämieperiode entfernen Sie die Gaze und decken die Niere auf. Halten Sie den Hämostat Halsted-Mosquito für die Klemmenentfernung bereit.
- Öffnen Sie in Minute 30 die Gefäßklemme mit dem Hämostat und entfernen Sie sie aus dem Nierenstamm, um eine Reperfusion der Niere zu ermöglichen.
HINWEIS: Die Reperfusion wird durch die Visualisierung einer Veränderung der Nierenfarbe von dunkelviolett zu rot-rosa bestätigt (Abbildung 1C). - Führen Sie die gleichen Verfahren durch, die oben für Scheintiere ohne Klemmen des Nierenpedikels beschrieben wurden.
- Nach Überprüfung der Nierenfarbveränderung bringen Sie die Niere in die Bauchhöhle zurück. Schließen Sie die Bauchmuskulatur mit resorbierbarer Naht 5-0 unter Verwendung eines Kreuzmusters.
HINWEIS: Eine zweite Injektion von Anästhetika kann erforderlich sein, um die Analgesie während der Naht der Muskeln und der Haut aufrechtzuerhalten. Die Hälfte der Anfangsdosis hat sich bei der Bereitstellung von Analgesie bis zum Abschluss der Operation als wirksam erwiesen. - Schließen Sie die Haut mit einer resorbierbaren Naht 5-0 mit einem horizontalen Matratzenmuster. Reinigen Sie die Wunde mit einer Povidon-Jodlösung mit einem Wattestäbchen.
3. Genesung und nach der Operation
HINWEIS: Da die postoperative Zeit die tatsächliche Reperfusionszeit ist, ist eine ordnungsgemäße postoperative Versorgung ethisch obligatorisch und wissenschaftlich relevant. Die Reperfusionszeiten können nach Bedarf des Forschers ausgewählt werden. Reperfusionszeiten von 4 h, 8 h, 16 h, 1 Tag, 2 Tage, 4 Tage und 7 Tage werden verglichen, um einen sequentiellen Überblick über pathologische Veränderungen zu erhalten, die durch renale IRI induziert werden.
- Halten Sie die Maus auf dem Heizkissen, bis sie sich von der Narkose erholt.
HINWEIS: Es wird empfohlen zu warten, bis die Maus beginnt, ihre Beine zu bewegen und versucht, sich zu bewegen. In Fällen, in denen während der Operation zusätzliche Anästhesieinjektionen erforderlich sind, ist die Erholungszeit länger. Atipamezol, ein Alpha-2-Rezeptor-Antagonist, kann in einer Dosis von 0,5 mg/kg Körpergewicht intraperitoneal verabreicht werden, um die Xylazin-Effekte umzukehren und die Erholungsphase zu verkürzen. Zur Schmerzbehandlung wird Buprenorphin (0,1 mg/kg Körpergewicht, intraperitoneal) während der Genesungs- und postoperativen Phase präoperativ und alle 6 Stunden verabreicht. Von der Verwendung von nichtsteroidalen entzündungshemmenden Medikamenten wird abgeraten, da mehrere Medikamente in dieser Familie Nephrotoxizität induzieren und daher die Ergebnisse verändern können. - Nach der Genesung von der Narkose legen Sie die Maus zurück in ihren Käfig mit freiem Zugang zu Wasser und Nahrung.
HINWEIS: Wurstwaren können in einer Petrischale sowie Material zum Verstecken und Spielen (z. B. Papierblätter, Papierhandtuchtuben) bereitgestellt werden. - Überwachen Sie die Maus täglich, um die Wundheilung, die Nahrungs- und Wasseraufnahme, das Körpergewicht und das Verhalten zu beurteilen.
HINWEIS: Der Wundheilungsstatus wurde anhand der folgenden Skala beurteilt: 1, trocken; 2, nass; 3, teilweise geöffnet; 4, geöffnet. Eine schnelle Wundheilung wurde in dieser Studie dokumentiert, wobei mehr als 90% der trockenen Wunden nach Tag 2 auftraten.
4. Euthanasie und Probenentnahme
- Euthanasie die Mäuse mit Natriumpentobarbital, das intraperitoneal in einer Dosis verabreicht wird, die doppelt so hoch ist wie die Anästhesiedosis für Mäuse (100 mg/kg).
- Sammeln Sie bei Bedarf Flüssigkeits- und Gewebeproben.
HINWEIS: Beide Nieren, Vollblut (für die Blutzellzahl), Serum (für Blutbiochemie), Urin, das Herz und die Lunge wurden gesammelt. Für die Analyse der Blutbiochemie werden einige Mikroliter Serum benötigt (Blutharnstoffstickstoff (BUN), Kreatinin, Elektrolyte). Bei Bedarf können Mäuse 24 Stunden vor der Euthanasie in Stoffwechselkäfige gelegt werden, um ein höheres Urinvolumen zu sammeln, das die Bestimmung von Nierenfunktionsparametern ermöglicht.
Ergebnisse
Physiologische Parameter
Mäuse erholten sich von dieser einseitigen renalen IRI-Operation ereignislos; erschien aktiv und aufmerksam; und zeigte normales Essen, Trinken und Verhalten am nächsten Tag. Einige Mäuse können nach der IRI einen Körpergewichtsverlust haben, obwohl er normalerweise weniger als 10% des anfänglichen Körpergewichts beträgt (Abbildung 2). Größere Körpergewichtsverluste (˃10%) können schädlich sein, und diese Tiere sollten aus der Studie entfernt werden. Scheinoperierte Mäuse zeigten keine Veränderungen des Körpergewichts nach der Operation (gemessen 24 Stunden nach der Operation). Die meisten Mäuse erholten sich zwischen den Tagen 4 und 7 nach der Operation von ihrem anfänglichen Körpergewicht (siehe IRI-7-Tage-Gruppe, Abbildung 2). Die Nierenfunktion kann mit traditionellen Markern wie Blutharnstoffstickstoff (BUN) und Kreatinin beurteilt werden. Zusätzlich wurden Elektrolytspiegel im Serum (Natrium, Kalium und Chlorid) und ein automatisiertes Differentialblutbild in die Analyse einbezogen.
Histopathologische Veränderungen
Die Beurteilung der histopathologischen Befunde erfolgte unter Verwendung von 4% paraformaldehydfixierten, paraffineingebetteten ganzen mittelsagittalen Abschnitten der Niere, die mit Hämatoxylin / Eosin (HE), Periodensäure Schiff und Massons trichromen Flecken angefärbt waren. Die offensichtlichsten Veränderungen, die durch dieses einseitige renale IRI-Modell hervorgerufen werden, sind an der kortiko-medullären Verbindung zu sehen, insbesondere in den proximalen Tubulus, dicken aufsteigenden Gliedmaßen der Henle-Schleife und distalen gewundenen Tubuli sowie im tubulären Interstitium (siehe Legende für Abbildung 3). Mikroskopische Aufnahmen, die die charakteristischsten Läsionen nach IRI in der Niere zeigen, sind in Abbildung 3 zu sehen. Eine Liste der sequentiellen histopathologischen Befunde ist in Tabelle 1 enthalten.
Ein röhrenförmiges Verletzungs-Scoring-System wurde entwickelt, um den Schaden im Laufe der Zeit zu kategorisieren (Abbildung 4). Dabei wurden fünf definierte Veränderungen von drei verschiedenen Evaluatoren bewertet: 1) tubuläre epitheliale Dämpfung; 2) Bürstenrandverlust; 3) tubuläre Nekrose; 4) luminale Obstruktion; und 5) Vorhandensein von proteinhaltigem Guss. Eine Zuweisung von "1" zeigt an, dass die Änderung vorhanden ist, "0", dass sie nicht vorhanden ist.
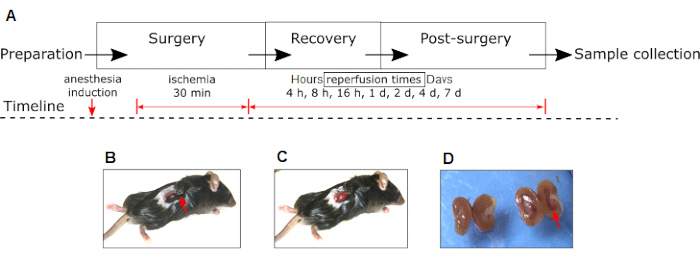
Abbildung 1: Experimentelles renales IRI-Modell in der Maus . (A) Phasen von Experimenten und Interventionen (Anästhesieinduktion, Ischämie und Reperfusion) werden gezeigt. Bitte beachten Sie die Veränderungen in der Farbe der rechten Niere zu dunkelrot während der Ischämie (B) zu rosa während der Reperfusion (C). (D) Makroskopisches Erscheinungsbild der rechten IRI-Niere (roter Pfeil) im Vergleich zur kontralateralen Nicht-IRI-Niere desselben Tieres 24 h nach der Operation. Der rote Pfeil in (B) zeigt die Position der hämostatischen Klemme. Abkürzung: IRI = Ischämie-Reperfusionsverletzung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
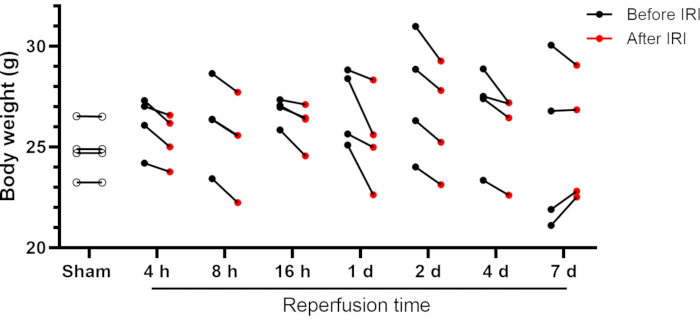
Abbildung 2: Körpergewicht der Mäuse vor und nach der renalen IRI. Einzelne Daten werden angezeigt. Abkürzungen: IRI = Ischämie-Reperfusionsverletzung; h = Stunden; d = Tage. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
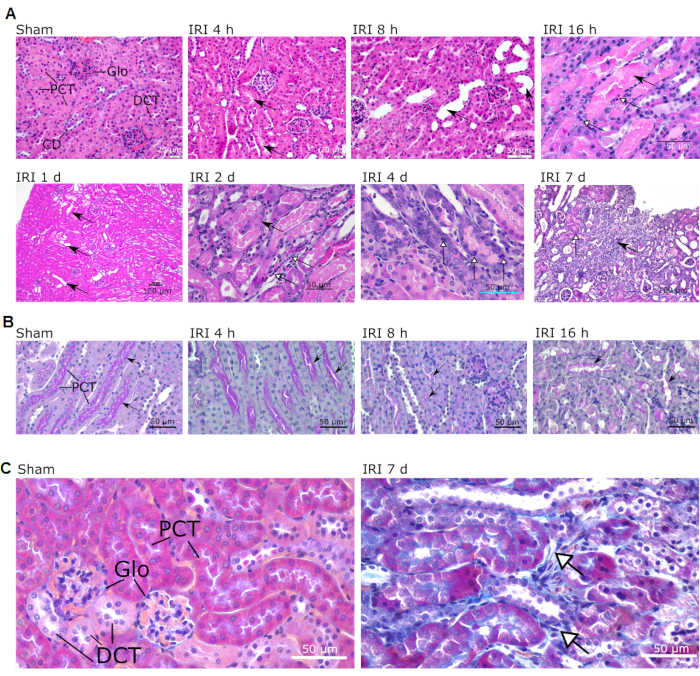
Abbildung 3: Typische mikroskopische Läsionen, die im Kortex und im kortiko-medullären Übergang von IR-betriebenen Mäusen beobachtet wurden. Schein- und unterschiedliche Reperfusionszeiten werden angezeigt (über jedem Bild angegeben). (A) Inakte Strukturen werden in Scheinform dargestellt (Vergrößerung 40x; Maßstabsstab = 20 μm). Pfeile in IRI 4 h zeigen das Vorhandensein von proteinhaltigem Guss im röhrenförmigen Lumen an (Vergrößerung 40x; Skalenbalken = 20 μm). Pfeile in IRI 8 h zeigen eine röhrenförmige Dilatation (Vergrößerung 40x; Skalenbalken = 50 μm). Schwarzer Pfeil in IRI 16 h zeigt Rohrguss in Marksegmenten; Weiße Pfeile zeigen Bereiche der zellulären Nekrose (Vergrößerung 40x; Skalenbalken = 50 μm). Schwarze Pfeile in IRI 1 d zeigen die röhrenförmige Dilatation an (Vergrößerung 10x; Skalenbalken = 100 μm). Schwarzer Pfeil in IRI 2 d zeigt vergrößerte Zellkerne; Weiße Pfeilspitzen zeigen Bereiche der Lymphozyten- und Makrophageninfiltration (Vergrößerung 40x; Skalenbalken = 50 μm). Weiße Pfeilspitzen in IRI 4 d zeigen mitotische tubuläre Zellen an (Vergrößerung 40x; Skalenbalken = 50 μm). Schwarzer Pfeil in IRI 7 d zeigt einen Bereich der fokalen Fibrose; Die weiße Pfeilspitze zeigt einen Regenerationsbereich (Vergrößerung 20x; Skalenbalken = 100 μm). (B) PAS-Färbung, die die Nierenrinde von Mäusen während der frühen Reperfusion (4 h, 8 h und 16 h) zeigt. Beachten Sie die fortschreitende Dämpfung des Pinselrahmens (Pfeile). Vergrößerungen 40x; Skalenbalken = 50 μm (C) Masson trichrome Färbung von Schein- und IRI 7 d-Mäusen, die Bereiche der interstitiellen Fibrose zeigen (weiße Pfeile). Vergrößerung 40x; Maßstabsstäbe = 50 μm. Abkürzungen: IRI = Ischämie-Reperfusionsverletzung; Glo = Glomerulus; PCT = proximal gewundener Tubulus; DCT = distaler gewundener Tubulus; CD = Sammelkanal; PAS = Periodensäure Schiff; d = Tag. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
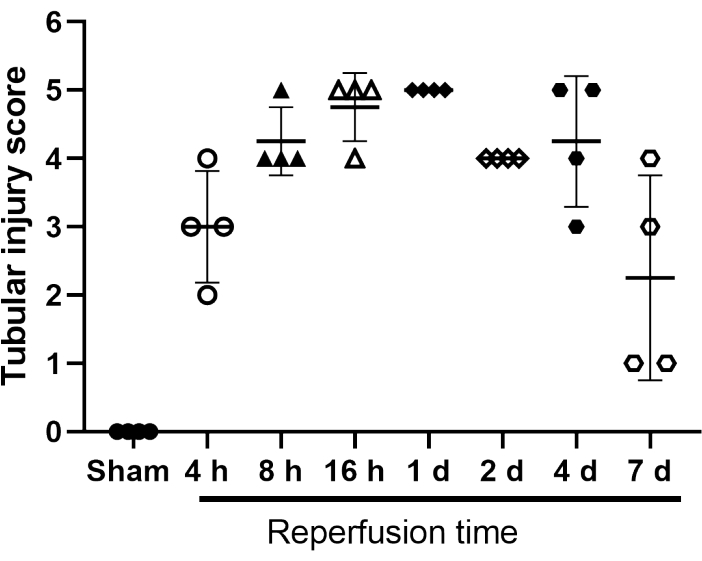
Abbildung 4: Tubular Injury Score von Schein- und IRI-operierten Mäusen. Scoring-System Skala 1 bis 5 für die röhrenförmige Epitheldämpfung; Verlust des Pinselrands; tubuläre Nekrose; luminale Obstruktion; und Vorhandensein von proteinhaltigem Guss. Eine Zuweisung von "1" zeigt an, dass die Änderung vorhanden ist, "0", dass sie nicht vorhanden ist. Einzelne Werte werden angezeigt. Balken stellen den Mittelwert ± SD dar (n = 4). Abkürzung: IRI = Ischämie-Reperfusionsverletzung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Zeit nach IRI | Signifikanteste pathologische Veränderungen |
| 4 Std. | Rohrverschluss |
| Protein in Lumen gegossen | |
| 8 Std. | Röhrendilatation |
| Beginnende Nekrose | |
| Abschwächung des Epithels | |
| 16 Std. | Zelluläre Nekrose |
| Rohrguss | |
| Neutrophile Infiltration | |
| 1 Tag | Nekrose |
| Röhrendilatation | |
| Neutrophile Infiltration | |
| 2 Tage | Röhrendilatation |
| Infiltration von Lymphozyten und Makrophagen | |
| Vergrößerte Zellkerne | |
| 4 Tage | Prominente mitotische Aktivität in Tubuluszellen |
| 7 Tage | Fokale Fibrose |
| Bereiche der Regeneration |
Tabelle 1: Signifikanteste pathologische Veränderungen im Laufe der Zeit. Diagnostiziert auf der Grundlage einer mikroskopischen Untersuchung von 4-6 Tieren pro Gruppe.
Diskussion
Nieren-IRI-Modelle für Maus sind in der biomedizinischen Forschung aufgrund ihrer relativ niedrigen Betriebskosten und der Verfügbarkeit verschiedener transgener Modellebeliebt 12. Das hier vorgestellte einseitige renale IRI-Modell ahmt charakteristische pathologische Veränderungen nach, die bei der renalen IRI beim Menschen beobachtet wurden, wie tubuläre Dilatation, Nekrose und Fibrose13. Diese Ergebnisse basieren auf unterschiedlichen Reperfusionszeiten.
Zu den kritischen Schritten dieses Protokolls gehören die Aufrechterhaltung einer konstanten Körpertemperatur und die korrekte Platzierung der Gefäßklemme im Nierenstammwasser. Die Körpertemperatur beeinflusst den Stoffwechsel des Tieres14 und verändert die experimentellen Ergebnisse sowohl auf physiologischer als auch auf zellulärer Ebene15. Bei diesem Modell wurde die Körpertemperatur vor der Operation mit rektalen und Pad-Sensorsonden stabilisiert. Darüber hinaus wird eine kontinuierliche Überwachung der Körpertemperatur während des gesamten chirurgischen Eingriffs dringend empfohlen, insbesondere vor dem Einsetzen der Gefäßklemme, um eine Ischämie auszulösen.
Die Exposition der Niere und die richtige Platzierung der Gefäßklemme sind ebenfalls entscheidend für den Erfolg des Experiments. Eine Schädigung der Nierenkapsel durch unsachgemäße Handhabung der Pinzette während der Exposition der Niere durch den chirurgischen Schnitt führt zu perirenalen Blutungen und Entzündungen. Die Gefäßklemme sollte auf den Nierenpedikel gelegt werden, der die Nierenarterie und die Nierenvene verdeckt, ohne den Harnleiter und die Nebennierenarterien zu beeinträchtigen. Entscheidend für diesen Schritt ist die sorgfältige Dissektion des Fettgewebes, das das Nierenhilum 14,16 umgibt.
Dieses Modell ist kostengünstig und zeitsparend. Der Anästhesieverbrauch pro Maus betrug 156,47 ± 37,88 μL (Mittelwert ± SD, n = 17) eines vorverdünnten Ketamin/Xylazin-Cocktails (1:10 Ketamin, 1:50 Xylazin, in Kochsalzlösung; Stammlösungskonzentration, jeweils 100 mg/ml). Die Operation kann in relativ kurzer Zeit durchgeführt werden. Die Gesamtoperationszeit pro Maus betrug 53 ± 5,23 min (Mittelwert ± SD, n = 17). Mit geschultem Personal können mehrere Operationen gleichzeitig durchgeführt werden. In unserer Gruppe führte ein erfahrener Forscher die Operation durch, bis die Klemme aus dem Nierenstamm gelöst wurde, während ein zweiter vom Wundverschluss bis zur Genesung der Maus übernahm. Mit diesem Ansatz konnten wir eine hohe Anzahl von Operationen an einem einzigen Tag durchführen. In diesem Modell verwendeten wir den dorsolateralen Ansatz, der im Vergleich zum Mittellinienansatz16 zu weniger Traumata und reduziertem Flüssigkeits- und Wärmeverlust aus der Bauchhöhle führt.
Zuvor veröffentlichte Protokolle haben die Nieren-Pedikelklemmtechnik beschrieben, um eine akute Nierenschädigung bei Mäusen zu induzieren17,18,19. In diesen Studien wurde jedoch zusätzlich zur einseitigen IRI eine kontralaterale Nephrektomie mit ischämischen Zeiten von 15 bis 26 min durchgeführt. In diesem Protokoll induzierten wir eine einseitige Ischämie für 30 Minuten, während die kontralaterale Niere erhalten blieb. Dies führte zu einer Überlebensrate von 100%. Dieses Modell ist jedoch nicht geeignet, azotemische Nierenschäden zu induzieren, was zum Teil auf die kompensatorische Wirkung der nicht chirurgisch intervenierten kontralateralen Niere zurückzuführen ist. Eine Niere beim selben Tier unberührt zu lassen, bietet jedoch den Vorteil, längere Ischämiezeiten mit einer höheren Überlebensrate zu verwenden. Darüber hinaus kann die kontralaterale Niere verwendet werden, um mögliche Nebenwirkungen von Testmedikamenten oder Behandlungen, die während des experimentellen Verfahrens angewendet werden, zu beurteilen und Nieren-Nieren-Übersprecheffektezu untersuchen 20,21. Zum Beispiel war dieses Modell nützlich, um reaktive Sauerstoffspezies-induzierte Veränderungen auf zellulärer Ebene sowohl im IRI als auch in der kontralateralen, nicht chirurgisch intervenierten Niere11 zu zeigen.
Dieses Modell hat eine potenzielle Anwendung in Studien, die darauf abzielen, Marker für einseitige Nierenschäden, renale Crosstalk-Effekte, postrenale IRI-induzierte hämodynamische Veränderungen und potenzielle nephrotoxische Wirkungen von Arzneimittelkandidaten zur Verwendung in renaler IRI zu identifizieren und zu charakterisieren. Diese detaillierte Beschreibung der wichtigsten pathologischen Veränderungen dient als wertvolles Werkzeug, um den am besten geeigneten Zeitpunkt für die Untersuchung spezifischer zellulärer Prozesse auszuwählen, von Entzündungen und Nekrosen (4 h bis 2 Tage) bis hin zu Regeneration (4 Tage) und Fibrose (7 Tage und später).
Offenlegungen
Die Autoren erklären, dass es keine Interessenkonflikte in Bezug auf diesen Artikel gibt.
Danksagungen
Ein Teil der in diesem Artikel gezeigten Arbeit wurde vom Center of Integrative Mammalian Research der Ross University School of Veterinary Medicine (RUSVM), St. Kitts und Nevis, gegründet. Die finanzielle Unterstützung des Department of Veterinary Biomedical Sciences des Long Island University College of Veterinary Medicine wird sehr geschätzt.
Materialien
| Name | Company | Catalog Number | Comments |
| Atipamezole hydrochloride | Penn Veterinary Supply, Inc., PA, USA | PVS8700 | 5 mg/mL |
| Buprenorphine | Penn Veterinary Supply, Inc., PA, USA | PRMBURPEN22 | 0.3 mg/mL |
| Commercial euthanasia solution | various suppliers | na | e.g., Euthasol Virbac (sodium pentobarbital 390 mg/mL + sodium phenytoin 50 mg/mL) |
| Eye ointment Puralube | Dechra Veterinary Products, KS, USA | na | 3.5 g (1/8 oz) |
| Heating pad RightTempJr | Kent Scientific, CT, USA | RT-JR-20 | Consider the one with two temperature probes |
| Ketamine hydrochloride | Penn Veterinary Supply, Inc., PA, USA | VED1220 | 100 mg/ml |
| S&T Vascular clamp | Fine Science Tools, Inc., Germany | 00398-02 | Jaw dimensions: 5.5 x 1.5 mm; length: 11 mm |
| Sterile Disposable Towel Drapes | Kent Scientific, CT, USA | SURGI-5023-3 | Disposable, individualy packed |
| Surgical instruments (Graefe forceps, Halsted-Mosquito hemostat, scissors, etc) | Fine Science Tools, Inc., Germany | Various | Consider the extra fine straight scissor and the angled Graefe forceps |
| Vicryl suture | Ethicon US, LLC | J493G | Size 5-0 |
| Xylazine hydrochloride | Penn Veterinary Supply, Inc., PA, USA | VAM4821 | 100 mg/mL |
Referenzen
- Ray, S. C., Mason, J., O'Connor, P. M. Ischemic renal injury: can renal anatomy and associated vascular congestion explain why the medulla and not the cortex is where the trouble starts. Seminars in Nephrology. 39 (6), 520-529 (2019).
- Weight, S. C., Bell, P. R., Nicholson, M. L. Renal ischaemia--reperfusion injury. The British Journal of Surgery. 83 (2), 162-170 (1996).
- Ratliff, B. B., Abdulmahdi, W., Pawar, R., Wolin, M. S. Oxidant mechanisms in renal injury and disease. Antioxidants & Redox Signaling. 25 (3), 119-146 (2016).
- Schrier, R. W., Wang, W., Poole, B., Mitra, A. Acute renal failure: definitions, diagnosis, pathogenesis, and therapy. The Journal of Clinical Investigation. 114 (1), 5-14 (2004).
- Fernández, A. R., Sánchez-Tarjuelo, R., Cravedi, P., Ochando, J., López-Hoyos, M. Review: Ischemia reperfusion injury-a translational perspective in organ transplantation. International Journal of Molecular Sciences. 21 (22), 8549 (2020).
- Wu, C. -. L., et al. Tubular peroxiredoxin 3 as a predictor of renal recovery from acute tubular necrosis in patients with chronic kidney disease. Scientific Reports. 7 (1), 43589 (2017).
- Nishida, K., et al. Systemic and sustained thioredoxin analogue prevents acute kidney injury and its-associated distant organ damage in renal ischemia reperfusion injury mice. Scientific Reports. 10 (1), 20635 (2020).
- Mishra, J., et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet. 365 (9466), 1231-1238 (2005).
- Han, W. K., Bailly, V., Abichandani, R., Thadhani, R., Bonventre, J. V. Kidney injury molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury. Kidney International. 62 (1), 237-244 (2002).
- Coca, S. G. Kidney injury biomarkers with clinical utility: has Godot finally arrived. American Journal of Nephrology. 50 (5), 357-360 (2019).
- Godoy, J. R., et al. Segment-specific overexpression of redoxins after renal ischemia and reperfusion: protective roles of glutaredoxin 2, peroxiredoxin 3, and peroxiredoxin 6. Free Radical Biology & Medicine. 51 (2), 552-561 (2011).
- Wei, Q., Dong, Z. Mouse model of ischemic acute kidney injury: technical notes and tricks. American Journal of Physiology - Renal Physiology. 303 (11), 1487-1494 (2012).
- Gaut, J. P., Liapis, H. Acute kidney injury pathology and pathophysiology: a retrospective review. Clinical Kidney Journal. 14 (2), 526-536 (2021).
- Le Clef, N., Verhulst, A., D'Haese, P. C., Vervaet, B. A. Unilateral renal ischemia-reperfusion as a robust model for acute to chronic kidney injury in mice. PLoS One. 11 (3), 0152153 (2016).
- Pelkey, T. J., et al. Minimal physiologic temperature variations during renal ischemia alter functional and morphologic outcome. Journal of Vascular Surgery. 15 (4), 619-625 (1992).
- Kennedy, S. E., Erlich, J. H. Murine renal ischaemia-reperfusion injury. Nephrology. 13 (5), 390-396 (2008).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. Journal of Visualized Experiments: JoVE. (78), e50495 (2013).
- Hesketh, E. E., et al. Renal ischaemia reperfusion injury: a mouse model of injury and regeneration. Journal of Visualized Experiments: JoVE. (88), e51816 (2014).
- Wei, J., et al. New mouse model of chronic kidney disease transitioned from ischemic acute kidney injury. American Journal of Physiology. Renal Physiology. 317 (2), 286-295 (2019).
- Basile, D. P., Leonard, E. C., Tonade, D., Friedrich, J. L., Goenka, S. Distinct effects on long-term function of injured and contralateral kidneys following unilateral renal ischemia-reperfusion. American Journal of Physiology - Renal Physiology. 302 (5), 625-635 (2012).
- Polichnowski, A. J., et al. Pathophysiology of unilateral ischemia-reperfusion injury: importance of renal counterbalance and implications for the AKI-CKD transition. American Journal of Physiology. Renal Physiology. 318 (5), 1086-1099 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten