Method Article
Un modèle murin efficace de lésion unilatérale d’ischémie rénale-reperfusion
Dans cet article
Résumé
Les lésions d’ischémie-reperfusion rénale sont associées à une morbidité et une mortalité élevées chez les patients hospitalisés. Ici, nous présentons un modèle murin simple et efficace de lésion unilatérale d’ischémie rénale-reperfusion et fournissons un aperçu séquentiel des changements pathologiques représentatifs observés dans le rein.
Résumé
La lésion d’ischémie-reperfusion (IRI) est la principale cause d’insuffisance rénale aiguë et contribue de manière significative au retard de la fonction du greffon. Les modèles animaux sont les seules ressources disponibles qui imitent les complexités des dommages associés à l’IRI rencontrés in vivo. Cet article décrit un modèle murin efficace d’IRI rénal unilatéral qui fournit des données hautement reproductibles. L’ischémie est induite par l’occlusion du pédicule rénal droit pendant 30 min suivie d’une reperfusion. En plus de l’intervention chirurgicale, un aperçu séquentiel des changements physiologiques et histopathologiques attendus après l’IRI rénale sera fourni en comparant les données de sept temps de reperfusion différents (4 h, 8 h, 16 h, 1 jour, 2 jours, 4 jours et 7 jours). Les données critiques pour la planification des expériences à l’avance, telles que le temps chirurgical moyen, la consommation moyenne d’anesthésiques et les changements de poids corporel au fil du temps, seront partagées. Ce travail aidera les chercheurs à mettre en œuvre un modèle IRI rénal fiable et à sélectionner le temps de reperfusion approprié qui correspond à leurs objectifs d’investigation prévus.
Introduction
Les reins sont parmi les organes les plus perfusés du corps et sont extrêmement sensibles aux changements dans la perfusion sanguine1. Les lésions d’ischémie-reperfusion rénale (IRI) restent la principale cause d’insuffisance rénale aiguë 2,3 et sont associées à une morbidité élevée et à une mortalité élevée chez les patients hospitalisés4. Avec des options thérapeutiques limitées disponibles,4,5 l’IRI rénal fait actuellement l’objet de plusieurs efforts de recherche en biomédecine 6,7 visant le développement de nouvelles cibles thérapeutiques et la caractérisation de marqueurs précoces et sensibles des lésions rénales 8,9,10 . L’identification d’un modèle animal fiable, rapide et rentable est considérée comme essentielle pour répondre à ces besoins. Cet article présente un modèle murin simple et efficace de l’IRI rénal unilatéral. L’ischémie est induite par serrage du pédicule rénal droit pendant 30 min11,12. Une partie cruciale de ce modèle consiste à choisir le temps de reperfusion le plus approprié qui reproduira les événements pathologiques d’intérêt, tels que la nécrose tubulaire, l’infiltration de cellules inflammatoires polymorphonucléaires ou la fibrose. Par conséquent, les chercheurs reçoivent cet aperçu séquentiel des changements pathologiques représentatifs attendus dans le rein IRI.
Protocole
Le protocole suivant décrit une chirurgie de survie. Par conséquent, la pratique aseptique et chirurgicale la plus élevée est appliquée. Toutes les expériences sur les animaux ont été effectuées conformément aux lignes directrices de l’établissement et approuvées par le Comité institutionnel de soins et d’utilisation des animaux. Pour éliminer les différences entre les sexes et les souches dans les effets de l’IRI, seules des souris mâles C57BL6 ont été utilisées dans l’étude. Tous les animaux ont été appariés en âge et en poids pour produire des résultats comparables.
1. Préparation
REMARQUE : Une chronologie des différentes phases expérimentales et interventions est illustrée à la figure 1A.
- Nettoyez et désinfectez la table d’opération avant chaque intervention. Préparer et placer tous les matériaux requis (instruments stérilisés et cotons-tiges, gaze et rideaux stériles, anesthésiques pré-dilués, coussin chauffant, pince vasculaire stérilisée, solution saline stérile, antiseptiques et sutures cutanées) sur la table chirurgicale (voir le tableau des matériaux).
- Anesthésier des souris mâles C57BL6 (tranche d’âge de 11 à 13 semaines) par injection intrapéritonéale de kétamine/xylazine (100 mg/kg et 20 mg/kg de poids corporel, respectivement, préalablement dilués dans une solution saline stérile).
REMARQUE: Une manipulation qualifiée des animaux est essentielle pour minimiser le stress de l’animal, car les réponses au stress peuvent affecter négativement l’action des anesthésiques. - Après l’administration de kétamine/xylazine, raser la zone chirurgicale sur le flanc droit à l’aide d’une lame de rasoir et de savon.
REMARQUE: Le rasage de la peau améliore la cicatrisation des plaies ainsi que les résultats généraux des chirurgies de survie. - Désinfectez d’abord la peau dans la zone chirurgicale avec 70% d’alcool, puis avec une solution d’iode povidone à l’aide d’un coton-tige.
- Après la préparation de la peau, placez la souris sur une table chauffante en position de décubitus ventral et stabilisez la température corporelle à 37 ° C (surveillée par des sondes rectales et des capteurs de coussinets).
REMARQUE: Les reins sont plus facilement accessibles et exposés chirurgicalement lorsqu’ils sont placés dans un décubitus ventral plutôt que latéral. - Pendant que la température corporelle est stabilisée, appliquez une pommade pour les yeux sur les yeux de la souris.
REMARQUE: Les anesthésiques dissociatifs, tels que la kétamine, font que les yeux de l’animal restent ouverts pendant l’anesthésie.
2. Chirurgie
- Une fois les réflexes douloureux absents (pincement des orteils avec une pince à épiler), effectuer une incision chirurgicale dorso-latérale d’environ 1 cm sur le flanc droit à l’aide d’une lame de scalpel. Commencez l’incision derrière la dernière côte et continuez caudalement d’environ 1 cm parallèlement à la ligne médiane lombaire.
- Transectez la musculature abdominale à l’aide de ciseaux pour visualiser l’espace rétropéritonéal. Enlevez les petites quantités de sang produites lors de la section des muscles à l’aide de cotons-tiges stériles.
REMARQUE: Étant donné que l’approche dorso-latérale est utilisée, le rétropéritoine, et non la cavité péritonéale, est accessible avec cette procédure. - Poussez le rein droit hors de la cavité abdominale. Utilisez des pinces Graefe pour exposer le rein avec soin.
REMARQUE: Gardez toujours les pinces fermées pour éviter les blessures traumatiques au rein lorsqu’elles sont placées sur l’abdomen et utilisez-les uniquement pour pousser et guider soigneusement le rein vers l’incision chirurgicale et en sortir. - Exposez lentement le rein droit et identifiez le pédicule rénal. Retirez soigneusement le tissu adipeux autour du pédicule.
- Pour induire une ischémie, placez la pince vasculaire sur l’artère rénale et la veine présentes dans le pédicule rénal, en évitant de serrer l’uretère adjacent. Utilisez un hémostat Halsted-Mosquito pour manipuler la pince vasculaire.
REMARQUE: L’ischémie est confirmée par la visualisation d’un changement de couleur du rein du rouge-rose au violet foncé (Figure 1B). - Couvrez le rein serré avec de la gaze stérile imbibée de solution saline pour éviter la dessiccation et laissez-la pendant 30 min.
- Surveillez périodiquement la profondeur de l’anesthésie et l’humidité de la gaze pendant cette période.
REMARQUE: La dose d’induction de l’anesthésie est suffisante pour fournir une analgésie jusqu’à la fin de l’événement ischémique; par conséquent, aucune injection anesthésique supplémentaire n’est nécessaire. - Peu de temps avant la fin de la période d’ischémie, retirez la gaze et découvrez le rein. Tenez l’hémostat Halsted-Mosquito, prêt pour le retrait de la pince.
- À la minute 30, ouvrez la pince vasculaire avec l’hémostat et retirez-la du pédicule rénal pour permettre la reperfusion du rein.
REMARQUE: La reperfusion est confirmée par la visualisation d’un changement de couleur du rein du violet foncé au rouge-rose (Figure 1C). - Effectuez les mêmes procédures décrites ci-dessus pour les animaux simulés sans serrer le pédicule rénal.
- Après vérification du changement de couleur des reins, retournez le rein dans la cavité abdominale. Fermez les muscles abdominaux avec une suture résorbable 5-0 à l’aide d’un motif croisé.
REMARQUE: Une deuxième injection d’anesthésiques peut être nécessaire pour maintenir l’analgésie pendant la suture des muscles et de la peau. La moitié de la dose initiale s’est avérée efficace pour fournir une analgésie jusqu’à la fin de la chirurgie. - Fermez la peau avec une suture résorbable 5-0 à l’aide d’un motif de matelas horizontal. Nettoyez la plaie avec une solution d’iode de povidone à l’aide d’un coton-tige.
3. Récupération et post-chirurgie
REMARQUE: Comme le temps post-chirurgical est le temps réel de reperfusion, des soins post-chirurgicaux appropriés sont éthiquement obligatoires et scientifiquement pertinents. Les temps de reperfusion peuvent être sélectionnés selon les besoins du chercheur. Des temps de reperfusion de 4 h, 8 h, 16 h, 1 jour, 2 jours, 4 jours et 7 jours sont comparés pour obtenir un aperçu séquentiel des changements pathologiques induits par l’IRI rénale.
- Gardez la souris sur le coussin chauffant jusqu’à ce qu’elle commence à récupérer de l’anesthésie.
REMARQUE: Il est recommandé d’attendre que la souris commence à bouger ses pattes et tente de se déplacer. Dans les cas où des injections anesthésiques supplémentaires sont nécessaires pendant la chirurgie, le temps de récupération est plus long. L’atipamezole, un antagoniste des récepteurs alpha-2, peut être administré à une dose de 0,5 mg/kg de poids corporel par voie intrapéritonéale pour inverser les effets de la xylazine et raccourcir la phase de récupération. Pour la gestion de la douleur, la buprénorphine (0,1 mg/kg de poids corporel, par voie intrapéritonéale) est administrée avant l’opération et toutes les 6 heures pendant la phase de récupération et post-chirurgicale. L’utilisation d’anti-inflammatoires non stéroïdiens est déconseillée car plusieurs médicaments de cette famille induisent une néphrotoxicité et peuvent donc modifier les résultats. - Après la récupération de l’anesthésie, replacez la souris dans sa cage avec un accès libre à l’eau et à la nourriture.
REMARQUE: La purée de nourriture peut être fournie dans une boîte de Petri ainsi que du matériel pour se cacher et jouer (par exemple, des feuilles de papier, des tubes d’essuie-tout). - Surveillez la souris quotidiennement pour évaluer la cicatrisation des plaies, la consommation de nourriture et d’eau, le poids corporel et le comportement.
REMARQUE: L’état de cicatrisation des plaies a été évalué à l’aide de l’échelle suivante: 1, sec; 2, humide; 3, partiellement ouvert; 4, ouvert. La cicatrisation rapide des plaies a été documentée dans cette étude, avec plus de 90% des plaies sèches après le jour 2.
4. Euthanasie et prélèvement d’échantillons
- Euthanasier les souris avec du pentobarbital de sodium administré par voie intrapéritonéale à une dose deux fois supérieure à la dose anesthésique pour les souris (100 mg / kg).
- Prélever des échantillons de liquide et de tissus au besoin.
REMARQUE: Les deux reins, le sang total (pour le nombre de cellules sanguines), le sérum (pour la biochimie du sang), l’urine, le cœur et les poumons ont été recueillis. Quelques microlitres de sérum sont nécessaires pour l’analyse biochimique du sang (azote uréique sanguin (BUN), créatinine, électrolytes). Si nécessaire, 24 heures avant l’euthanasie, les souris peuvent être placées dans des cages métaboliques pour recueillir un volume d’urine plus élevé qui permet de déterminer les paramètres de la fonction rénale.
Résultats
Paramètres physiologiques
Les souris se sont remises de cette chirurgie unilatérale de l’IRI rénal sans incident; semblait actif et alerte; et a montré une alimentation, une consommation d’alcool et un comportement normaux le lendemain. Certaines souris peuvent avoir une perte de poids corporel post-IRI, bien qu’elle soit généralement inférieure à 10% du poids corporel initial (Figure 2). Des pertes de poids corporel plus importantes (˃10%) peuvent être préjudiciables, et ces animaux doivent être retirés de l’étude. Les souris opérées par simulacre n’ont pas montré de changements de poids corporel après la chirurgie (mesurés 24 heures après la chirurgie). La plupart des souris ont récupéré leur poids corporel initial entre les jours 4 et 7 après la chirurgie (voir le groupe IRI de 7 jours, figure 2). La fonction rénale peut être évaluée à l’aide de marqueurs traditionnels tels que l’azote uréique sanguin (BUN) et la créatinine. De plus, les taux d’électrolytes dans le sérum (sodium, potassium et chlorure) et une numération globulaire différentielle automatisée ont été inclus dans l’analyse.
Changements histopathologiques
L’évaluation des résultats histopathologiques a été effectuée à l’aide de sections entières du milieu sagittal du rein fixées à 4 % de paraformaldéhyde et incorporées dans la paraffine, ainsi que paroxyline/éosine (HE), d’acide périodique schiff et de taches trichromes de Masson. Les changements les plus évidents produits par ce modèle unilatéral d’IRI rénal peuvent être observés à la jonction cortico-médullaire, en particulier dans les tubules proximaux, les membres ascendants épais de l’anse de Henle et les tubules alambiqués distaux, ainsi que dans l’interstitium tubulaire (voir la légende pour la figure 3). Des images microscopiques montrant les lésions les plus caractéristiques après l’IRI dans le rein peuvent être vues à la figure 3. Une liste des résultats histopathologiques séquentiels est fournie dans le tableau 1.
Un système de notation des blessures tubulaires a été mis au point pour catégoriser les dommages au fil du temps (figure 4). Dans ce cas, cinq altérations définies ont été évaluées par trois évaluateurs différents : 1) l’atténuation épithéliale tubulaire; 2) perte de bordure de brosse; 3) nécrose tubulaire; 4) obstruction luminale; et 5) présence de coulée protéique. Une affectation de « 1 » indique que l’altération est présente, « 0 » qu’elle est absente.
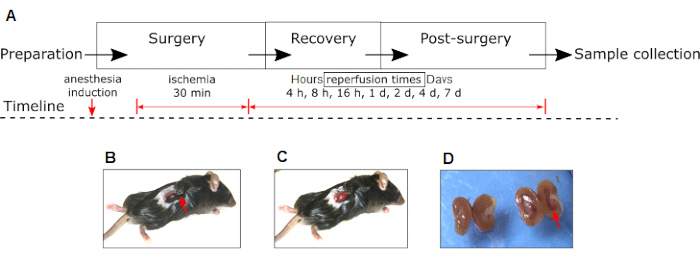
Figure 1 : Modèle expérimental d’IRI rénal chez la souris. (A) Les phases d’expériences et d’interventions (induction d’anesthésie, ischémie et reperfusion) sont montrées. Veuillez noter les changements dans la couleur du rein droit au rouge foncé pendant l’ischémie (B) au rose pendant la reperfusion (C). (D) Aspect macroscopique du rein droit IRI (flèche rouge) par rapport au rein controlatéral non IRI du même animal 24 heures après la chirurgie. La flèche rouge en (B) indique la position de la pince hémostatique. Abréviation : IRI = Ischémie-reperfusion lésion. Veuillez cliquer ici pour voir une version agrandie de cette figure.
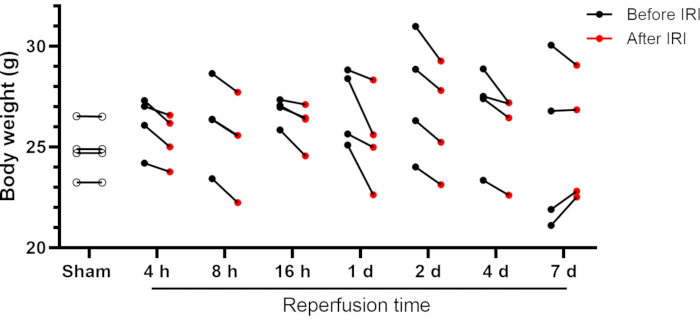
Figure 2 : Poids corporel des souris avant et après l’IRI rénal. Les données individuelles sont affichées. Abréviations : IRI = Lésion d’ischémie-reperfusion; h = heures; d = jours. Veuillez cliquer ici pour voir une version agrandie de cette figure.
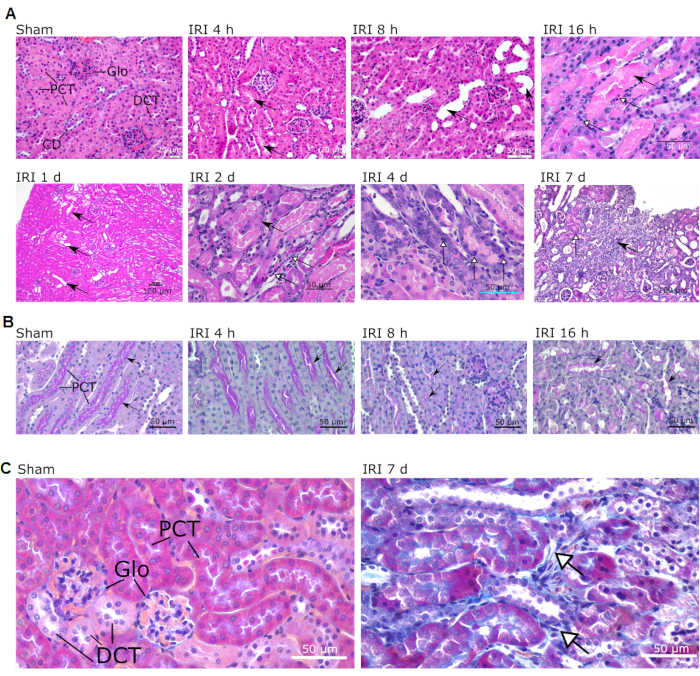
Figure 3 : Lésions microscopiques typiques observées dans le cortex et la jonction cortico-médullaire de souris opérées par IR. Des temps de reperfusion simulés et différents sont affichés (indiqués au-dessus de chaque image). (A) Les structures intactes sont représentées en simulacre (grossissement 40x; barre d’échelle = 20 μm). Les flèches dans IRI 4 h indiquent la présence de coulée protéique dans la lumière tubulaire (grossissement 40x; barre d’échelle = 20 μm). Les flèches dans IRI 8 h montrent une dilatation tubulaire (grossissement 40x; barre d’échelle = 50 μm). La flèche noire dans IRI 16 h montre la fonte tubulaire dans les segments médullaires; les flèches blanches montrent les zones de nécrose cellulaire (grossissement 40x; barre d’échelle = 50 μm). Les flèches noires dans IRI 1 d indiquent une dilatation tubulaire (grossissement 10x; barre d’échelle = 100 μm). La flèche noire dans IRI 2 d montre des noyaux cellulaires élargis; les pointes de flèches blanches montrent des zones d’infiltration de lymphocytes et de macrophages (grossissement de 40x; barre d’échelle = 50 μm). Les pointes de flèches blanches dans IRI 4 d indiquent des cellules tubulaires mitotiques (grossissement 40x; barre d’échelle = 50 μm). La flèche noire dans IRI 7 d montre une zone de fibrose focale; La pointe de flèche blanche montre une zone de régénération (grossissement 20x; barre d’échelle = 100 μm). (B) Coloration PAS montrant le cortex rénal de souris lors d’une reperfusion précoce (4 h, 8 h et 16 h). Notez l’atténuation progressive de la bordure du pinceau (flèches). Grossissements 40x; barres d’échelle = 50 μm (C) Coloration trichrome Masson de souris simulées et IRI 7 d montrant des zones de fibrose interstitielle (flèches blanches). Grossissement 40x; barres d’échelle = 50 μm. Abréviations : IRI = Lésion d’ischémie-reperfusion; Glo = glomérule; PCT = tubule alambiqué proximal; DCT = tubule alambiqué distal; CD = conduit collecteur; PAS = Schiff acide périodique; d = jour. Veuillez cliquer ici pour voir une version agrandie de cette figure.
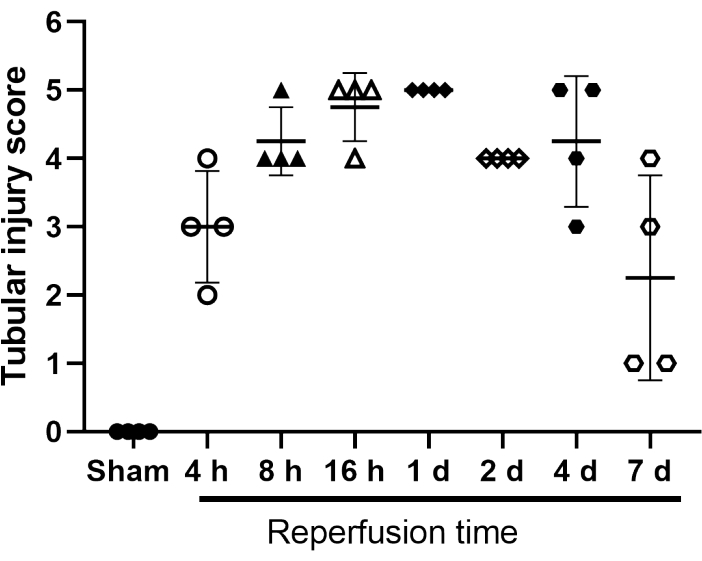
Figure 4 : Score de lésion tubulaire des souris simulées et opérées par l’IRI. Échelle du système de notation 1 à 5 pour l’atténuation épithéliale tubulaire; perte de bordure de brosse; nécrose tubulaire; obstruction luminale; et présence de coulée protéique. Une affectation de « 1 » indique que l’altération est présente, « 0 » qu’elle est absente. Les valeurs individuelles sont affichées. Les barres représentent la moyenne ± ET (n = 4). Abréviation : IRI = Ischémie-reperfusion lésion. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Temps après l’IRI | Changements pathologiques les plus importants |
| 4 h | Obstruction tubulaire |
| Protéine coulée dans la lumière | |
| 8 h | Dilatation tubulaire |
| Nécrose naissante | |
| Atténuation de l’épithélium | |
| 16 h | Nécrose cellulaire |
| Fonte tubulaire | |
| Infiltration de neutrophiles | |
| 1 jour | Nécrose |
| Dilatation tubulaire | |
| Infiltration de neutrophiles | |
| 2 jours | Dilatation tubulaire |
| Infiltration de lymphocytes et de macrophages | |
| Noyaux cellulaires élargis | |
| 4 jours | Activité mitotique proéminente dans les cellules tubules |
| 7 jours | Fibrose focale |
| Zones de régénération |
Tableau 1 : Changements pathologiques les plus importants au fil du temps. Diagnostiqué sur la base d’un examen microscopique de 4 à 6 animaux par groupe.
Discussion
Les modèles IRI rénaux de souris sont populaires dans la recherche biomédicale en raison de leurs coûts opérationnels relativement faibles et de la disponibilité de divers modèles transgéniques12. Le modèle unilatéral d’IRI rénal présenté ici imite les changements pathologiques caractéristiques observés dans l’IRI rénale humaine tels que la dilatation tubulaire, la nécrose et la fibrose13. Ces résultats sont basés sur des temps de reperfusion variables.
Les étapes critiques de ce protocole comprennent le maintien d’une température corporelle constante et le placement correct de la pince vasculaire dans le pédicule rénal. La température corporelle influence le métabolisme de l’animal14, modifiant les résultats expérimentaux à la fois aux niveaux physiologique et cellulaire15. Dans ce modèle, la température corporelle a été stabilisée avant la chirurgie à l’aide de sondes rectales et de capteurs de coussinets. En outre, une surveillance continue de la température corporelle pendant toute la procédure chirurgicale est fortement recommandée, en particulier avant de placer la pince vasculaire pour induire une ischémie.
L’exposition du rein et le bon placement de la pince vasculaire sont également essentiels au succès de l’expérience. Les dommages à la capsule rénale par une mauvaise manipulation de la pince pendant l’exposition du rein à travers l’incision chirurgicale entraîneront une hémorragie périrénale et une inflammation. La pince vasculaire doit être placée sur le pédicule rénal obstruant l’artère rénale et la veine rénale sans affecter l’uretère et les artères suprarénales. La dissection minutieuse du tissu adipeux entourant le hile rénal14,16 est essentielle pour cette étape.
Ce modèle est rentable et rapide. La consommation d’anesthésique par souris était de 156,47 ± 37,88 μL (moyenne ± ET, n = 17) d’un cocktail kétamine/xylazine prédilué (1:10 kétamine, 1:50 xylazine, dans une solution saline; concentration en solution mère, 100 mg/mL les deux). La chirurgie peut être effectuée dans une période relativement courte. Le temps total de chirurgie par souris était de 53 ± 5,23 min (moyenne ± SD, n = 17). Avec un personnel qualifié, plusieurs chirurgies peuvent être effectuées en même temps. Dans notre groupe, un chercheur expérimenté a effectué la chirurgie jusqu’à ce que la pince soit libérée du pédicule rénal, tandis qu’un deuxième a pris le relais de la fermeture de la plaie jusqu’à la récupération de la souris. Grâce à cette approche, nous avons pu effectuer un grand nombre de chirurgies en une seule journée. Dans ce modèle, nous avons utilisé l’approche dorsolatérale, qui se traduit par moins de traumatismes et une réduction de la perte de liquide et de chaleur de la cavité abdominale par rapport à l’approche médiane16.
Des protocoles publiés précédemment ont décrit la technique de serrage du pédicule rénal pour induire une lésion rénale aiguë chez la souris 17,18,19. Cependant, dans ces études, une néphrectomie controlatérale a été réalisée en plus de l’IRI unilatéral avec des temps ischémiques allant de 15 à 26 min. Dans ce protocole, nous avons induit une ischémie unilatérale pendant 30 min tout en préservant le rein controlatéral. Cela s’est traduit par un taux de survie de 100%. Cependant, ce modèle ne convient pas pour induire des lésions rénales azotémiques dues en partie à l’effet compensatoire exercé par le rein controlatéral non intervention chirurgicalement. Cependant, garder un rein non affecté chez le même animal offre l’avantage d’utiliser des temps d’ischémie plus longs avec un taux de survie plus élevé. En plus de cela, le rein controlatéral peut être utilisé pour évaluer les effets secondaires possibles des médicaments d’essai ou des traitements appliqués au cours de la procédure expérimentale et pour étudier les effets de la diaphonie rein-rein20,21. Par exemple, ce modèle a été utile pour montrer les altérations induites par les espèces réactives de l’oxygène au niveau cellulaire à la fois dans l’IRI et dans le rein11 controlatéral non intervention chirurgicalement.
Ce modèle a une application potentielle dans les études visant à identifier et à caractériser les marqueurs de lésions rénales unilatérales, les effets de diaphonie rénale, les changements hémodynamiques induits par l’IRI post-rénale et les effets néphrotoxiques potentiels des candidats médicaments à utiliser dans l’IRI rénale. Cette description détaillée des principaux changements pathologiques sert d’outil précieux pour sélectionner le moment le plus approprié pour étudier des processus cellulaires spécifiques, de l’inflammation et de la nécrose (4 h à 2 jours) à la régénération (4 jours) et à la fibrose (7 jours et plus tard).
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas de conflits d’intérêts concernant cet article.
Remerciements
Une partie du travail présenté dans cet article a été fondée par le Centre de recherche intégrative sur les mammifères de l’École de médecine vétérinaire de l’Université Ross (RUSVM), Saint-Kitts-et-Nevis. L’aide financière fournie par le Département des sciences biomédicales vétérinaires du Collège de médecine vétérinaire de l’Université de Long Island est grandement appréciée.
matériels
| Name | Company | Catalog Number | Comments |
| Atipamezole hydrochloride | Penn Veterinary Supply, Inc., PA, USA | PVS8700 | 5 mg/mL |
| Buprenorphine | Penn Veterinary Supply, Inc., PA, USA | PRMBURPEN22 | 0.3 mg/mL |
| Commercial euthanasia solution | various suppliers | na | e.g., Euthasol Virbac (sodium pentobarbital 390 mg/mL + sodium phenytoin 50 mg/mL) |
| Eye ointment Puralube | Dechra Veterinary Products, KS, USA | na | 3.5 g (1/8 oz) |
| Heating pad RightTempJr | Kent Scientific, CT, USA | RT-JR-20 | Consider the one with two temperature probes |
| Ketamine hydrochloride | Penn Veterinary Supply, Inc., PA, USA | VED1220 | 100 mg/ml |
| S&T Vascular clamp | Fine Science Tools, Inc., Germany | 00398-02 | Jaw dimensions: 5.5 x 1.5 mm; length: 11 mm |
| Sterile Disposable Towel Drapes | Kent Scientific, CT, USA | SURGI-5023-3 | Disposable, individualy packed |
| Surgical instruments (Graefe forceps, Halsted-Mosquito hemostat, scissors, etc) | Fine Science Tools, Inc., Germany | Various | Consider the extra fine straight scissor and the angled Graefe forceps |
| Vicryl suture | Ethicon US, LLC | J493G | Size 5-0 |
| Xylazine hydrochloride | Penn Veterinary Supply, Inc., PA, USA | VAM4821 | 100 mg/mL |
Références
- Ray, S. C., Mason, J., O'Connor, P. M. Ischemic renal injury: can renal anatomy and associated vascular congestion explain why the medulla and not the cortex is where the trouble starts. Seminars in Nephrology. 39 (6), 520-529 (2019).
- Weight, S. C., Bell, P. R., Nicholson, M. L. Renal ischaemia--reperfusion injury. The British Journal of Surgery. 83 (2), 162-170 (1996).
- Ratliff, B. B., Abdulmahdi, W., Pawar, R., Wolin, M. S. Oxidant mechanisms in renal injury and disease. Antioxidants & Redox Signaling. 25 (3), 119-146 (2016).
- Schrier, R. W., Wang, W., Poole, B., Mitra, A. Acute renal failure: definitions, diagnosis, pathogenesis, and therapy. The Journal of Clinical Investigation. 114 (1), 5-14 (2004).
- Fernández, A. R., Sánchez-Tarjuelo, R., Cravedi, P., Ochando, J., López-Hoyos, M. Review: Ischemia reperfusion injury-a translational perspective in organ transplantation. International Journal of Molecular Sciences. 21 (22), 8549 (2020).
- Wu, C. -. L., et al. Tubular peroxiredoxin 3 as a predictor of renal recovery from acute tubular necrosis in patients with chronic kidney disease. Scientific Reports. 7 (1), 43589 (2017).
- Nishida, K., et al. Systemic and sustained thioredoxin analogue prevents acute kidney injury and its-associated distant organ damage in renal ischemia reperfusion injury mice. Scientific Reports. 10 (1), 20635 (2020).
- Mishra, J., et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet. 365 (9466), 1231-1238 (2005).
- Han, W. K., Bailly, V., Abichandani, R., Thadhani, R., Bonventre, J. V. Kidney injury molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury. Kidney International. 62 (1), 237-244 (2002).
- Coca, S. G. Kidney injury biomarkers with clinical utility: has Godot finally arrived. American Journal of Nephrology. 50 (5), 357-360 (2019).
- Godoy, J. R., et al. Segment-specific overexpression of redoxins after renal ischemia and reperfusion: protective roles of glutaredoxin 2, peroxiredoxin 3, and peroxiredoxin 6. Free Radical Biology & Medicine. 51 (2), 552-561 (2011).
- Wei, Q., Dong, Z. Mouse model of ischemic acute kidney injury: technical notes and tricks. American Journal of Physiology - Renal Physiology. 303 (11), 1487-1494 (2012).
- Gaut, J. P., Liapis, H. Acute kidney injury pathology and pathophysiology: a retrospective review. Clinical Kidney Journal. 14 (2), 526-536 (2021).
- Le Clef, N., Verhulst, A., D'Haese, P. C., Vervaet, B. A. Unilateral renal ischemia-reperfusion as a robust model for acute to chronic kidney injury in mice. PLoS One. 11 (3), 0152153 (2016).
- Pelkey, T. J., et al. Minimal physiologic temperature variations during renal ischemia alter functional and morphologic outcome. Journal of Vascular Surgery. 15 (4), 619-625 (1992).
- Kennedy, S. E., Erlich, J. H. Murine renal ischaemia-reperfusion injury. Nephrology. 13 (5), 390-396 (2008).
- Skrypnyk, N. I., Harris, R. C., de Caestecker, M. P. Ischemia-reperfusion model of acute kidney injury and post injury fibrosis in mice. Journal of Visualized Experiments: JoVE. (78), e50495 (2013).
- Hesketh, E. E., et al. Renal ischaemia reperfusion injury: a mouse model of injury and regeneration. Journal of Visualized Experiments: JoVE. (88), e51816 (2014).
- Wei, J., et al. New mouse model of chronic kidney disease transitioned from ischemic acute kidney injury. American Journal of Physiology. Renal Physiology. 317 (2), 286-295 (2019).
- Basile, D. P., Leonard, E. C., Tonade, D., Friedrich, J. L., Goenka, S. Distinct effects on long-term function of injured and contralateral kidneys following unilateral renal ischemia-reperfusion. American Journal of Physiology - Renal Physiology. 302 (5), 625-635 (2012).
- Polichnowski, A. J., et al. Pathophysiology of unilateral ischemia-reperfusion injury: importance of renal counterbalance and implications for the AKI-CKD transition. American Journal of Physiology. Renal Physiology. 318 (5), 1086-1099 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon